摘要
背景
甜菜属甘蔗是我国主要的制糖作物之一,对盐碱地适应性强。本研究探讨了糖甜菜幼苗根系适应盐胁迫的碳氮代谢机制的改变。
结果
在300 mM Na处理1天(短期)和7天(长期)后,对甜菜幼苗根系的游离体、代谢组和转录组进行了评估+治疗。盐胁迫导致反应性氧物质(ROS)损伤和根部的离子毒性。有趣的是,在盐压力下,NA的增加+/ K.+比率相比在第7天的对照比较上在根部1天更低。的转录结果表明,大量的差异表达的基因(DEGS)以各种代谢途径中富集。共有1279名903度的视角分别被确定第1天和第7,和主要映射到基因和基因组(KEGG)途径的10京都百科全书。大部分基因参与碳代谢和氨基酸(AA)的生物合成。此外,代谢物组学分析表明,蔗糖代谢和三羧酸(TCA)循环响应于盐胁迫增加的活性。After 1 day of stress, the content of sucrose decreased, whereas the content of organic acids (OAs) such as L-malic acid and 2-oxoglutaric acid increased. After 7 days of salt stress, nitrogen-containing metabolites such as AAs, betaine, melatonin, and (S)-2-aminobutyric acid increased significantly. In addition, multiomic analysis revealed that the expression of the gene encoding xanthine dehydrogenase (XDH) was upregulated and that the expression of the gene encoding allantoinase (ALN) was significantly downregulated, resulting in a large accumulation of allantoin. Correlation analysis revealed that most genes were significantly related to only allantoin and xanthosine.
结论
我们的研究表明,在盐胁迫下糖甜菜植物的根部改变了碳和氮代谢。氮代谢在盐胁迫的晚期阶段起着重要作用。含有嘌呤代谢途径的丙二醇,可以是糖甜菜耐药性的关键调节剂。
背景
目前,全国20%的耕地和近50%的水浇地盐碱化[1那2].土壤盐渍化对农业生产构成巨大威胁,已成为全球性的复杂环境问题[3.].高盐浓度通常导致植物离子不平衡,浸润和氧化损伤,这可能导致萎缩和植物死亡[4.].因此,提高作物的耐盐性已成为一个重要的研究课题。
甜菜由于其优良的耐盐性,被用作研究植物耐盐机理的模范糖作物品种[5.那6.那7.那8.].与其他植物种类相比,甜菜可以更好地承受高盐胁迫和干旱胁迫[9.].植物通过积累渗透调节剂、选择性吸收盐离子、分配盐离子和增强抗氧化能力来应对盐胁迫[10.那11.].
目前,已知的是,植物的耐盐性机制涉及在植物组织中主要代谢产物,如糖,氨基酸(AAS),多元醇,有机酸(OAS)和激素[积累12.那13.].在甜菜中,甜菜碱等次生代谢产物具有保护细胞膜和增强抗氧化酶活性的作用;因此,这些代谢物可以促进细胞内活性氧(ROS)的清除,并在防止脂质过氧化中发挥积极作用[14.].甜菜含碳和/或含氮化合物可提高植株在不利生长条件下的整体适应性[15.那16.那17.].众所周知,氮和碳水化合物是限制作物生长的重要因素,但尚不知道当植物压力时,如何重新平衡这两个代谢过程。虽然已经有许多研究甜菜对盐胁迫的响应机制,但大多数这些研究都限于生态学水平或仅限于单一途径。盐胁迫下糖甜菜中发生的生理分子机制的知识。此外,关于代谢物反应与转录组对糖甜菜中的盐胁迫的关系的信息很少,特别是在根;大多数相关的研究都集中在植物的芽或叶子上。
转录组棉花分析(Gossypium.大豆(spp),甘氨酸最大(林)。稳定),紫花苜蓿(紫花苜蓿L.),大麦和其他植物物种揭示了与次级代谢物,激素合成,氮吸收,ROS间隙,细胞膜稳定性和盐胁迫下的信号转导途径有关的大量参数[18.那19.那20.那21.].然而,很少有研究研究了整个植物中碳和氮代谢的变化。一些研究表明,糖束叶中的TCA相关OAS的含量在盐胁迫下增加,脯氨酸,甘露醇和Putrescine帮助甜菜饲料适应盐胁迫[22.那23.].然而,甜菜怎么盐胁迫下以及是否该种调节碳氮代谢具有独特的耐盐性调控通路仍然未知。然而,所有的代谢变化是由基因控制的,因此有必要对基因表达的变化更多的研究。
根,直接受到盐胁迫的器官,充当碳水化合物的储藏库[24.那25.].因此,根的耐盐性与植物的生长密切相关。通过结合转录组学和代谢组学方法,我们阐明了上述的保护机制,以便更好地了解植物如何调节碳氮代谢以适应盐胁迫。本研究的目的是确定甜菜根确保碳代谢、氮代谢的平衡盐胁迫响应,确定途径重要的甜菜根适应盐胁迫和宽容,和识别关键基因和代谢产物参与了盐胁迫反应。因此,开展甜菜盐胁迫的生理研究,揭示甜菜耐盐机制具有重要的理论和实践价值。
结果
盐胁迫下甜菜的生理变化
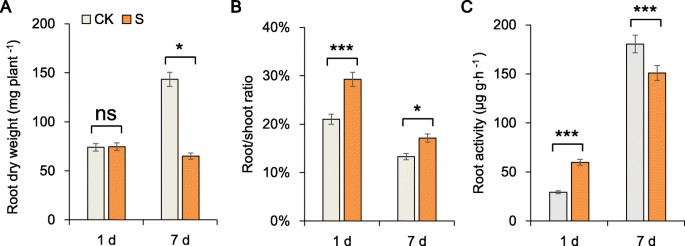
我们的初步试验表明,甜菜植株可以在最大盐浓度为300 mM (NaCl+Na)的溶液中完成营养生长期2所以4.).The root growth of sugar beet plants under salt stress was compared after 1 day and 7 days of the stress. The root biomass of sugar beet plants under salt stress was significantly (54.65%) lower than that in the plants under the control (CK) conditions (Fig.1a)。该结果表明,通过抑制的根生长反映,糖甜菜患有严重的盐胁迫。然而,在1天应激后,盐胁迫下植物的根系活性(Ra)大于CK条件下的植物中的植物的根活率为104.04%;通过琥珀酸脱氢酶在活细胞线粒体中的活性表明RA。通过下面介绍的苹果酸显着增加,验证了该关联。此外,在第1天和第7天的CK条件下,应力下的根/芽比率为8.26和3.83%(图。1B,C)。在本文中,所述糖用甜菜生长速度减慢,根代谢增加,三羧酸(TCA)循环的活性响应盐胁迫增加。
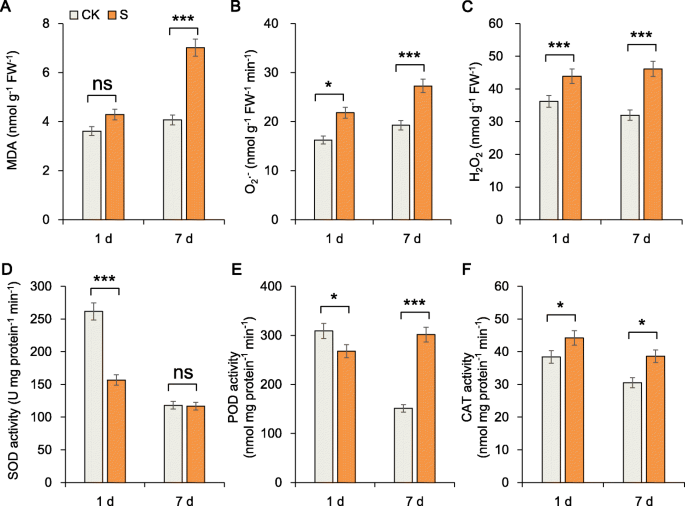
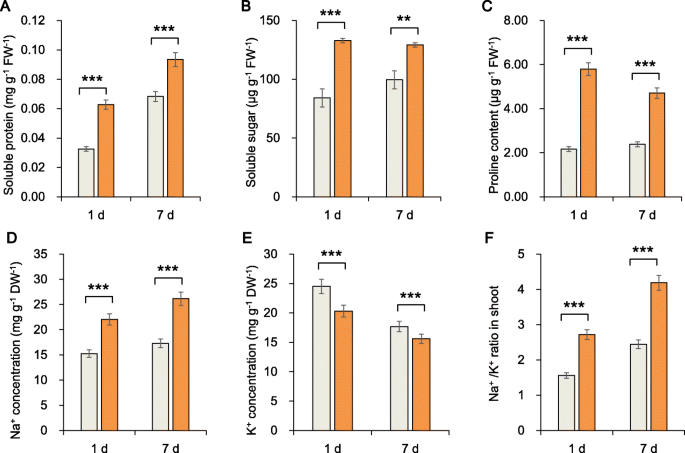
我们研究了甜菜根的ROS和氧化防御系统,发现根ROS含量随时间增加(图2A,B,C)。丙二醛(MDA)的内容,超氧阴离子(O2·-)和过氧化氢(H2O.2),盐胁迫7 d后显著高于胁迫1 d。但保护酶活性升高,第7天盐胁迫下植株过氧化物酶(POD)活性比对照高2倍。这一结果表明,POD可能在耐盐性中起关键作用,我们在分子水平上证实了这一点(图2)。2d, e, f)。此外,盐胁迫1和7 d后,可溶性蛋白质含量、可溶性糖含量和脯氨酸含量均显著增加(图3)。3.A,B,C)。
与ck植物中的植物相比,na+content in the roots of plants after 1 and 7 days increased significantly by 44.59 and 51.31%, and the K+含量分别显著下降17.14和11.60%。与各自对照相比,Na增加+/ K.+盐胁迫第7天的比例(71.17%)低于第1天的比例(74.59%)(图5)。3.d,e,f)。在这种高盐环境中,植物中的ROS和毒性离子水平仍然过高。大多数这些渗透调节物质都参与了应力反应;因此,我们认为重要的监管物质也参与糖甜菜根的耐盐性。因此,我们进行了代谢分析,其如下所述。
盐度驯化过程中甜菜代谢变化评估
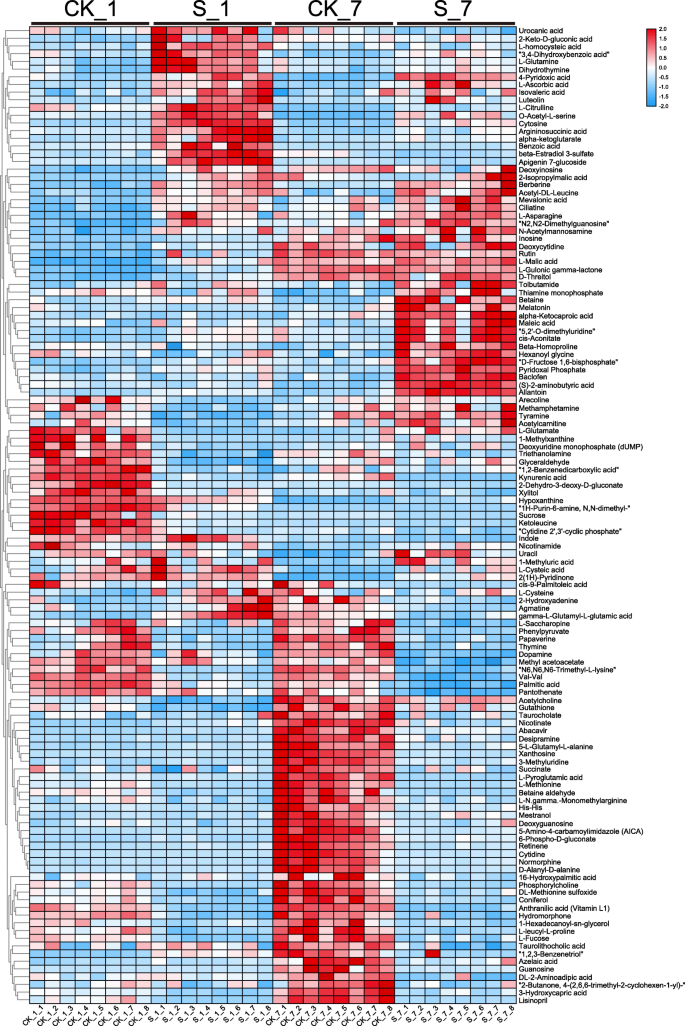
为了监测盐胁迫下甜菜的代谢适应过程,进行超级性能液相色谱 - 质谱(UPLC-MS)以鉴定差异表达的代谢物。总共127种差异表达的代谢物(24AAs,21 oAs,9胺,9个碳水化合物,11粒脂质,9个生物碱,7个核酸,4种维生素,2个辅助乳糖剂,2次糖醇,2个激素和28个其他化合物)可重复鉴定出来在CK条件和盐胁迫条件下的植物根部(表S1).
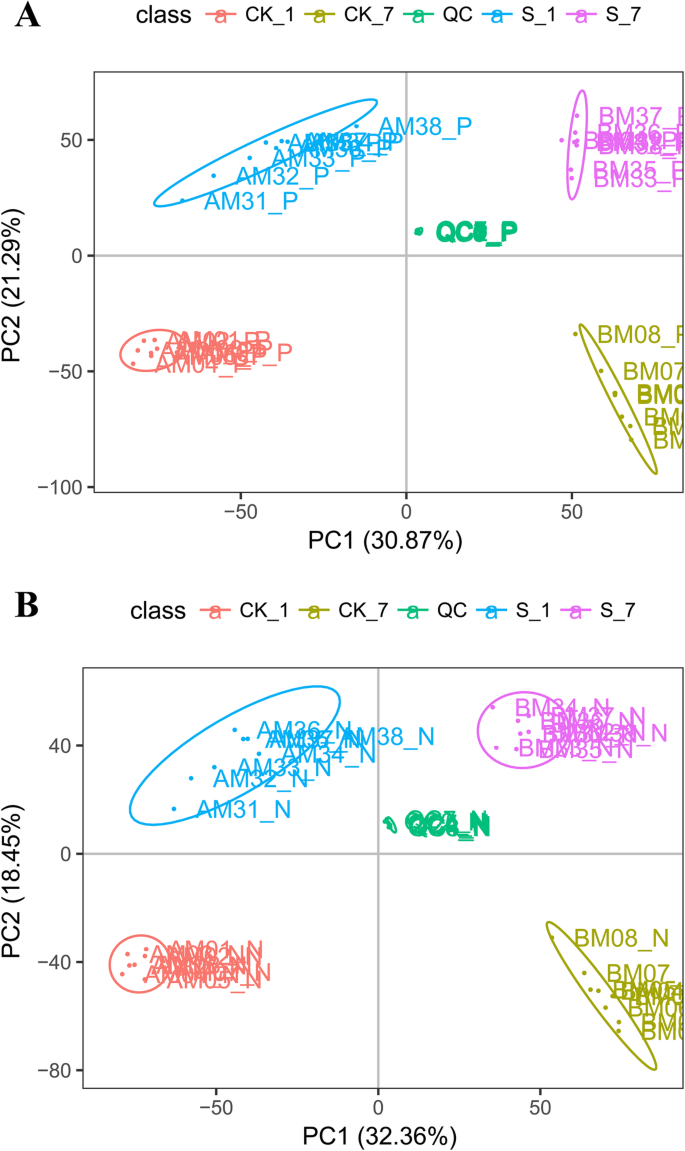
主成分(PC)分析表明,在正电喷雾电离(ESI)模式下,第一个PC (PC1)解释了各处理方向上测定的总代谢物变异的30.87%,而第二个PC (PC2)解释了总变异的21.29%。这部分是由于盐胁迫下的处理差异和时间差异造成的。在ESI阴性模式下也得到了类似的结果(图。4.).
在热图分析的基础上(图。5.)和表S中的数据2,我们推导出在暴露于盐胁迫后的初级代谢物的丰度受到显着影响1天(40次增加丰度,33次减少),7天(30增加,55分)。与CK条件下的那些相比,大多数盐胁迫条件下的AAS在第1天显着富集,包括L-谷氨酰胺和L-芦笋。类似地,大多数OAS,例如CIS-ACONITIET,苯甲酸L-苹果酸和α-酮戊二酸,在两天的盐胁迫下显着富集;然而,所有脂质的丰度在第7天减少。
与对照相比,盐胁迫下2-异丙基苹果酸的变化最为明显(第1天为27.4倍,第7天无显著差异)。仅在第7天,在盐胁迫条件下,l -瓜氨酸和褪黑素、(S)-2-氨基丁酸两种激素均显著高于对照。尿囊素含量(6.93倍)比甜菜碱含量(6.16倍)变化更大。
盐度胁迫下甜菜的转录分析
利用Illumina HiSeq 4000生成参考转录组甜菜属L.在盐胁迫的情况下。表格1显示48,862,905,51,492,828,51,606,390和53,096,544基于CK和盐胁迫的植物获得的总原始读数。除去低质量序列后,在随后的组装中保留了48,122,135,50,581,785,50,804,895,50,804,895和52,238,759个有效读数。GC百分比分别为42.00,42.50,42.17和42.33%,而Q20值率超过99.56%,测序误差率<1%。根据上述研究结果,这些测序数据具有大量高质量,保证序列组件的准确性,以及转录组的足够覆盖。在盐胁迫和CK条件之间的18个随机选择的基因的比较的基础上,定量实时PCR(QRT-PCR)结果表现出与RNA测序(RNA-SEQ)数据吻合良好(表S.3.).
DEGS的功能分析
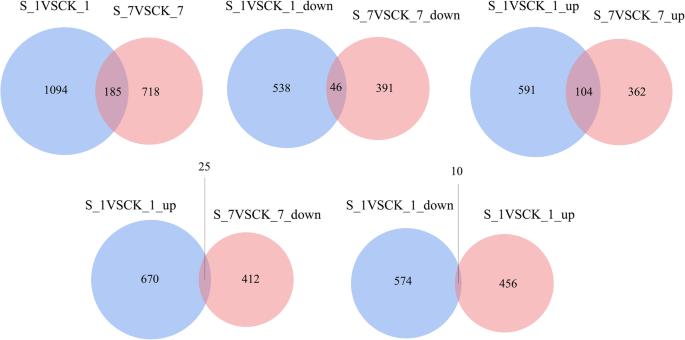
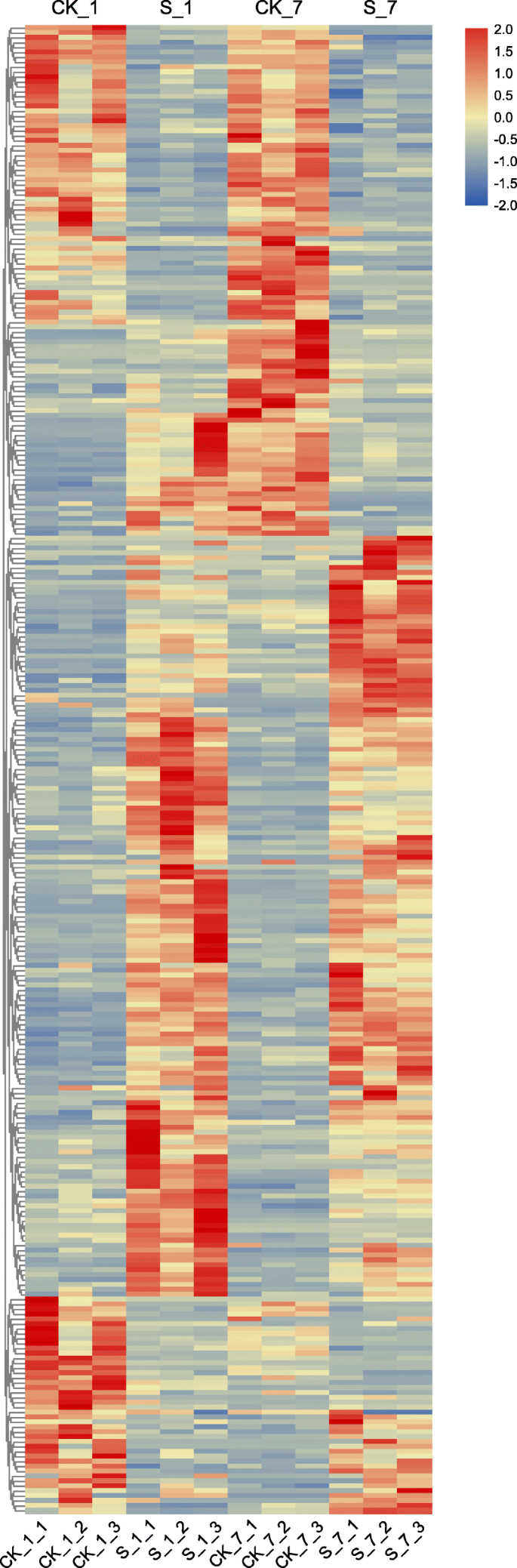
在甜菜胁迫1 d和7 d后,分别鉴定出1279和903个差异表达基因(图2)。6.),104首46个基因在根部的表达水平上调或两者在这两天盐胁迫下下调。然而,25度的视角的表达上调第一但随后下调,而在10度的视角首先下调和上调然后,表明糖用甜菜的对盐胁迫的转录反应在很大程度上是timespecific。随后,分层聚类分析进行用于获得在不同盐胁迫阶段那些共表达的转录物的全面的转录概况(图7.).聚类分析表明,盐胁迫显著影响了共表达转录本的转录谱。在这些共表达的转录本中,盐胁迫处理中上调基因的数量大于CK处理中下调基因的数量。此外,盐胁迫7 d后下调基因数量多于盐胁迫1 d后。
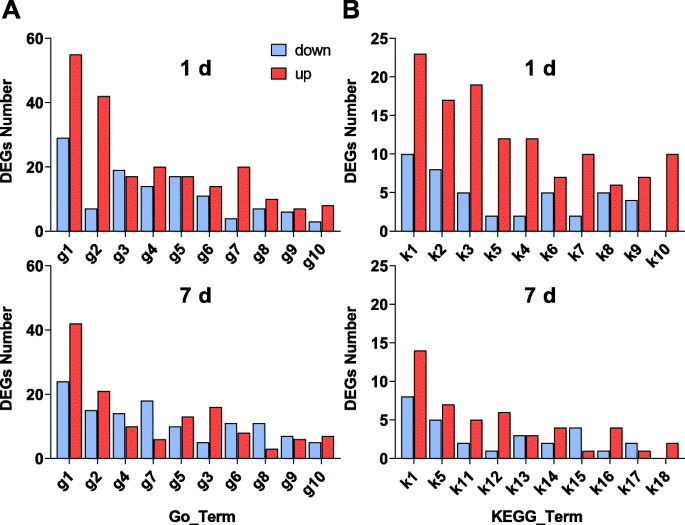
根据基因本体论(GO)分析(表S.4.),DEGS(P.值< 0.05)的氧化石墨烯在第1天(369、483和610)和第7天(289、46和420)分别具有3种功能:生物过程、细胞成分和分子功能。第1天,“氧化还原过程”(GO:0055114, 98个基因)、“代谢过程”(GO:0008152, 50个基因)和“跨膜运输”(GO:0055085, 37个基因)是生物过程本体中最丰富的三个GO术语。第7天,“氧化还原过程”(n= 78个基因),“代谢过程”(n= 43),以及“碳水化合物代谢过程”(GO:0005975,n= 27),占生物过程类别中富集程度最高的基因本体论(GO)前三名。在第1和第7天,“金属离子结合”(GO:0046872,n= 92),“氧化还原酶活性”(GO:0016491,n= 82),以及“水解酶活性”(GO:0016787,n = 57) represented the top three most significantly enriched GO terms in Molecular Function category.
所述DEGS被映射至来自所述生物过程类别(图10个的GO术语(在两个天)。8.a).在第1天,最丰富的deg被分类为与氧化还原过程(55个上调和29个下调基因)相关,其次是代谢过程(42个上调和7个下调基因)和跨膜运输(17个上调和19个下调基因)相关。只有141个上调基因在第7天富集,与盐胁迫1天相比减少了近0.5倍。此外,与代谢过程相关的基因表达在第1天急剧增加。此外,大多数deg在氧化还原或代谢过程中富集,且在氧化还原和代谢过程中上调的基因多于下调的基因。然而,在第7天,下调的DEGs比上调的DEGs对碳水化合物代谢过程的调节更丰富。这些结果表明,盐胁迫会严重影响植物的代谢和氧化还原过程。
A.来自生物过程类别的基因的前10个基因本体论(GO)术语的图,B.京都基因和基因组十大百科全书(KEGG)路径(S_1 vs CK_1, S_7 vs CK_7)的图。g1,氧化还原过程;g2,代谢过程;g3、跨膜运输;g4,转录调控,dna模板;g5、运输;g6、转录dna模板;g7:碳水化合物代谢过程;八国集团,蛋白质磷酸化;g9,氧化应激反应; g10, Proteolysis; k1, Phenylpropanoid biosynthesis; k2, Carbon metabolism; k3, Biosynthesis of amino acids; k5, Starch and sucrose metabolism; k4, Glycolysis/Gluconeogenesis; k6, Carbon fixation in photosynthetic organisms; k7, Cysteine and methionine metabolism; k8, beta-Alanine metabolism; k9, Glycine, serine and threonine metabolism; k10, Fatty acid metabolism; k11, alpha-Linolenic acid metabolism; k12, Arginine and proline metabolism; k13, Carotenoid biosynthesis; k14, Valine, leucine and isoleucine degradation; k15, Nitrogen metabolism; k16, Alanine, aspartate and glutamate metabolism; k17, Nicotinate and nicotinamide metabolism; k18, Tyrosine metabolism
我们进一步确定KEGG直向条款(P.value < 0.05) (Table S5.).总体上,273名78度的视角均位于28条13 KEGG通路上1天和7,分别。代谢途径包括生物合成苯丙(33个基因),碳代谢(25个基因),并在糖用甜菜氨基酸生物合成(24个基因),通过盐处理显着影响在第1天第7天,主要代谢途径显著受盐胁迫包括苯基丙烷合成(22个基因),淀粉和蔗糖代谢(12个基因)和α-亚麻酸代谢(8个基因)。
figure8.A显示了具有显着差异的前10个途径(P.值< 0.05)。与KEGG通路相关的基因数量在第7天低于第1天。在盐胁迫下,尤其是第1天,这些通路中上调的基因表达量多于下调的基因表达量。在盐胁迫下,与苯丙类生物合成相关的33个基因(23个上调,10个下调)在第1天受到影响,22个基因(14个上调,8个下调)在第7天受到影响。其次是糖代谢、淀粉和蔗糖代谢以及AA生物合成相关基因的变化,这些基因在盐胁迫的两个阶段都受到了影响。代谢类单基因的生物学功能包括盐胁迫下代谢过程的催化作用或为初级和次级代谢产物的生产产生能量。与KEGG通路相关的基因数量在第7天比第1天减少。
基因表达伴有盐度
基于包含大于2倍的变化和显著性的标准(P.值)大于0.05经由t检验确定,我们选择了高度DEGS(表S =6.).这些基因可以基于其在1天和7天后对盐处理的差异反应分为五种主要类型。I型(仅在第1天的高表达)包括12次,其表达在酸胁迫下的盐胁迫下的表达显着增加,但在第7天的第7天的表达没有显着差异,乙烯的表达 -响应性转录因子2(LOM104892796)在第1天中最大地增加(> 221倍),II型(仅在第7天的高表达)包括12次,其表达在根系中仅在第1天响应盐胁迫而在根中显着增加。在这些类型的II基因中,蛋白质P21样(LOM104892315)的表达最大地增加(96倍),乙烯响应转录因子4(LOM104900638)的表达在第7天增加> 45倍。
III型(在两个天1和7的高表达)包括104度的视角,其表达在根部显著增加响应于盐在两个第1天和第7。我们发现,三个共同的高度DEGS编码的胚胎发育晚期丰富(LEA)的蛋白质。有趣的是,三个基因在糖用甜菜幼苗中增强阳离子毒性和渗透胁迫耐受性相关联。我们还发现,扩展蛋白样B1是由三个基因和1天和7天,分别编码细胞色素两种基因控制。然而,32个基因缺乏功能注释。在总共有在该列表38的编码酶的基因,其中包括一个基因编码2- hydroxyflavanone脱水酶,一种基因编码一种阳离子POD,编码蛋白磷酸酶的两个基因,一个基因编码酰脲通透2,一个基因编码GDSL酯酶/脂肪酶(At5g55050),编码一种基因的α-1,4-葡聚糖 - 蛋白质合成酶和两个基因编码的蛋白磷酸酶.另外,一个基因被注释为精胺合酶。其他基因也被鉴定,包括1个编码多半乳糖醛酸酶的基因,1个编码生长素反应蛋白IAA29的基因,1个编码调节蛋白21的基因和1个编码氯化胆碱单加氧酶的基因。
IV型有25个deg,在盐胁迫第1天根系中表达量显著增加,但在第7天表达量下降,其中1个基因编码乙烯响应转录因子3,1个基因编码POD 11, 1个基因编码POD 20,一个基因编码GDSL酯酶/脂肪酶和一个基因编码BAG家族分子伴侣调节剂6。V型基因中有10个基因在盐胁迫下的表达量在第1天显著降低,但在第7天表达量增加,其中一个基因编码乙烯响应转录因子ERF107,另一个基因编码生长素结合蛋白ABP19a。
盐胁迫条件下基因表达和代谢变化的整合分析
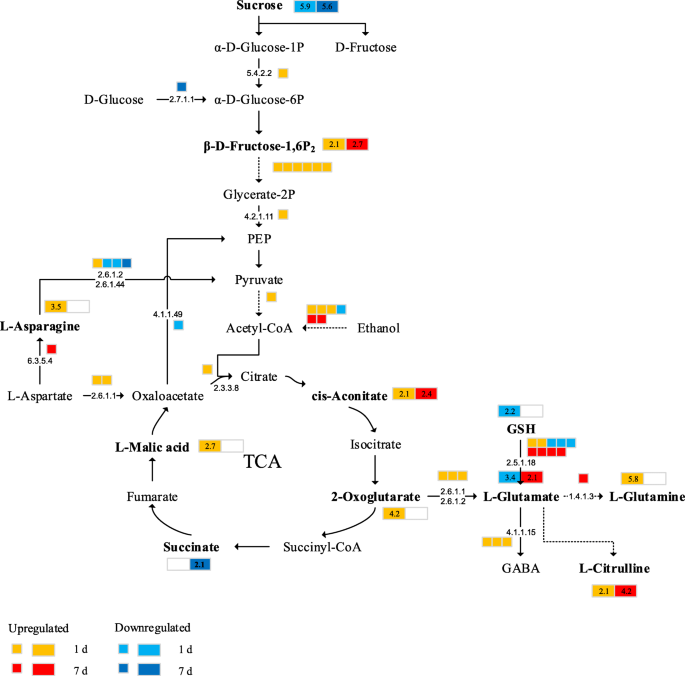
我们确定了主要基因表达与代谢产物水平的关系。表的年代7.列出这些代谢物,相关基因以及主要代谢途径。根据我们的结果,盐胁迫对这些途径产生了重大影响。在代谢概述中介绍了参与TCA循环,糖酵解,天冬氨酸家族和谷氨酸生物合成的那些主要途径。如图1所示。9.,在植物中,在植物中,在比较1天的植物中,将10个编码糖酵解酶[EC 5.4.2.2]和丙酮酸脱羧酶[Ec 4.1.1.1]的表达[eC.2.2.1.11]和丙酮酸脱羧酶[EC 4.1.1.1]。比较1天与CK条件下的植物。在TCA循环中,在应激第1天之后上调编码柠檬酸盐切割酶的基因的表达[EC 2.3.3.8]。此外,糖醇分解和蔗糖代谢途径变化,蔗糖含量降低,以及大量的OAS和AA,例如CIS-ACONITIET,L-苹果酸,琥珀酸盐,α-ketoglutarate,L-天冬酰胺和L-谷氨酰胺是生产。
这些糖酵解基因的表达的这些变化可以在1天盐胁迫后分别增加了CIS-仙偶氮剂,2-氧氟醚和L-苹果酸的含量,分别在2.1-,4.2-和2.7倍。与在CK条件下的植物中,盐胁迫条件下的植物中的顺穴含量增加2.4倍。编码天冬氨酸氨基转移酶的基因的表达[EC 2.6.1.2]和丙氨酸转氨酶[EC2.6.1.1]被上调,导致2-氧代摩托酸盐,在盐胁迫1天后产生L-谷氨酸,而L-谷氨酸和GSH的含量降低。同时,上调了编码谷氨酸脱羧酶的三种基因的表达[EC 4.1.1.15],L-谷氨酰胺和瓜氨酸的下游产物更丰富,导致应力下的谷氨酸短缺。糖酵解的调节和TCA循环表明,ATP丰富的变化可能发生在盐胁迫的早期阶段。这些ATP分子反过来为其他生理功能提供能量。
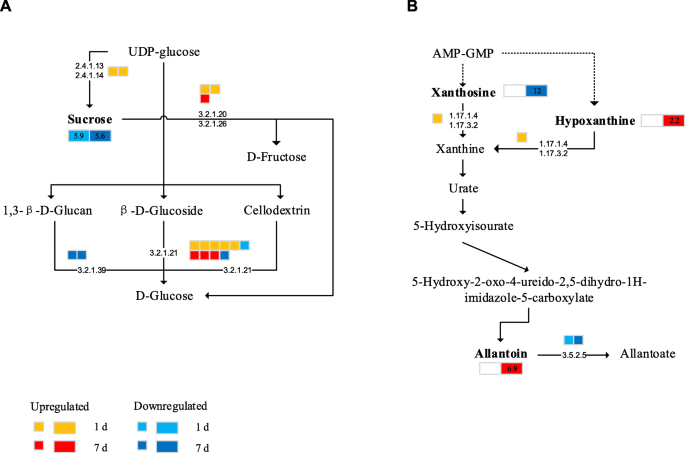
大多数与蔗糖代谢相关的基因在盐胁迫下表达上调(图。10.a),包括编码蔗糖合酶(SS [EC 2.4.1.13])的基因。然而,盐胁迫下植株的蔗糖含量低于对照。转化酶(INV [EC 3.2.1.26])基因和β -葡萄糖苷酶基因在盐胁迫下表达上调,这可能是导致可溶性糖增加的原因。这些关键基因表达的变化可能改变植物的蔗糖代谢。盐胁迫7天后,谷胱甘肽s -转移酶[EC 2.5.1.18]催化谷氨酸的产生,导致瓜氨酸的积累。有趣的是,参与嘌呤代谢途径的尿囊素酶(ALN)含量显著下调,导致尿囊素在第7天大量积累(图)。10.b).甜菜的尿素代谢首先是由一磷酸腺苷(AMP)和一磷酸鸟苷(GMP)通过脱胺产生黄嘌呤,然后是黄嘌呤脱氢酶(XDH [EC 1.17.1.4])水解黄嘌呤和次黄嘌呤。嘌呤黄嘌呤随后被XDH氧化成尿酸盐。尿酸酶(尿酸氧化酶,UO;EC 1.7.3.3)将尿酸转化为5-羟基异氰酸酯(5-HIU), 5-HIU通过2-氧-4-羟基-4-羧基-5-氰基脲-咪唑啉(OHCU)中间体代谢为尿液。ALN[。5.5.2.5]随后催化尿囊素分解为尿囊酸。在本研究中,编码XDH的基因表达增加,导致黄嘌呤分解形成尿酸盐。同时,ALN基因的表达下调,抑制了尿囊素的分解,尿囊素在胁迫第一天开始积累。这说明尿囊素的积累可能增加了甜菜对盐胁迫的适应性。
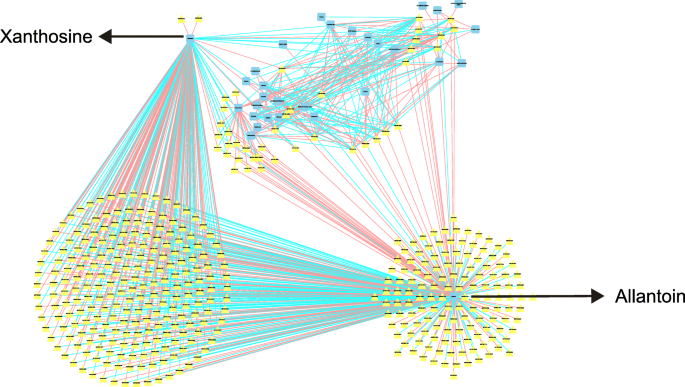
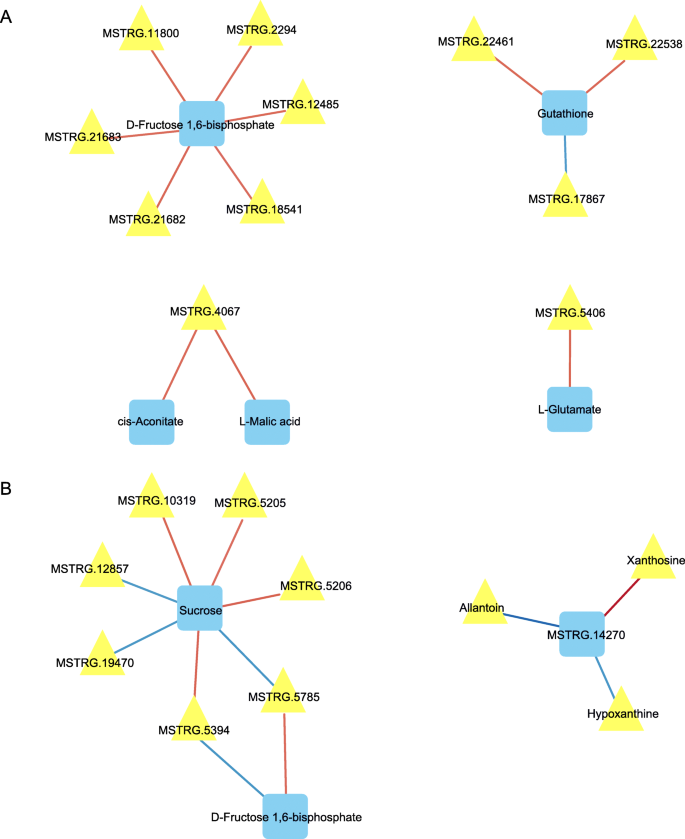
我们构建了相关基因和代谢物的网络图(如图)。11.和12.).我们首先分析了盐胁迫的第7天(R> 0.5)时第7天的所有代谢物和基因的相关性P.< 0.05)。结果表明,在嘌呤代谢途径中,大多数基因仅与黄嘌呤和尿囊素相关。随后,我们对每个途径中的基因和代谢物进行了相关性分析(r > 0.8,P.< 0.001)(图12.a和b)。结果表明,蔗糖和果糖-1,6-二磷酸的变化显著与几个基因相关,但相关的基因是早期和晚期阶段之间的不同。MSTRG.14270(丙二醇酶)是参与盐胁迫反应的主要基因;嘌呤代谢中该基因与黄嘌呤呈显著正相关,与尿囊素、次黄嘌呤呈显著负相关。
代谢途径和代谢物的第1天的主基因协会(A.)及第7天(B.).见图。11.有关更多详细信息
讨论
渗透胁迫、离子毒性与根系耐盐性
高盐浓度降低了环境的水势,导致渗透休克,过量的钠离子抑制细胞代谢过程并产生次级代谢物[26.].此外,大多数参与氧化还原过程的基因都大量表达。我们的研究结果还表明,在盐胁迫下,编码LEA (3) POD(2)蛋白的多个甜菜基因表达上调。LEA蛋白参与了脱水耐受性,它们通常因在种子发育过程中的后期积累以及作为渗透保护剂、膜稳定剂、抗氧化剂和伴侣保护植物免受非生物胁迫而闻名[27.那28.].有越来越多的证据表明,LEA蛋白在多种生物过程中的作用,包括植物生长和发育,形态和衰老[29.那30.那31.那32.].黄等人。[29.]报道了LEA蛋白可提高水稻NADPH氧化酶和抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)等抗氧化防御酶的表达和酶活性,缓解水稻氧化损伤。耐盐性强的甜菜品种具有较高的保护酶活性(如SOD和APX活性)[33.].
通常,与盐胁迫相关的离子毒性主要是由Na引起的+.na增加+盐胁迫期间浓度在植物中已得到证实[34.那35.].在本研究中,钠的积累+在盐胁迫早期,根系中钾含量显著增加,而钾含量则相反。在盐胁迫下,K+内容随时间和na增加+/ K.+比率增加。高浓度的na+会损害植物积累必需营养素的能力[36.],k时+是维持细胞膜和相关酶的稳定性和功能所必需的。保持足够的K+盐胁迫下的植物组织中的水平取决于选择性细胞k+和na+分布(37.].有趣的是,虽然钠的量+在幼糖甜菜根中增加,Na增加+/ K.+后期较CK降低,这可能是代谢物积累的原因。有研究表明,Agrostis植物根系对渗透压的代谢调节可以降低Na的含量+毒性和的关键在于改善这些物质的盐耐受性38.].此外,与野生型植物相比,转基因拟南芥盐胁迫下的植物增加了AA积累和降低的NA+/ K.+比(39.].甜菜的耐盐性是一个复杂的特性,它是由许多生理和代谢途径决定的,包括相容溶质含量的增加[22.].Lv等认为甜菜耐盐性最重要的因素可能是渗透调节[40].
本研究旨在揭示甜菜在盐胁迫下的自我保护机制。受盐胁迫后,植物在胁迫的早期和后期表现出明显不同的适应反应。根据甜菜对盐胁迫的形态和生理响应,我们进行了转录和代谢组学研究,发现在早期(1天)和长期(7天)盐胁迫下,甜菜碳氮代谢相关关键基因的表达和代谢物的积累发生了显著变化。
黄酮类化合物与盐胁迫相关
通过质谱分析,我们发现盐胁迫下黄酮类化合物显著增加。类黄酮是一种主要的植物次生代谢产物,包括强抗氧化剂[41那42例如l -抗坏血酸(Asc)、α -生育酚(维生素E)和芹菜素。众所周知,位于质膜、叶绿体、液泡和细胞核中的细胞内黄酮类化合物被氧化应激强烈诱导[43].类黄酮通路基因的表达与细胞内ROS的含量密切相关。事实上,我们的结果表明Asc的含量增加了3倍。在植物中,Asc作为主要的氧化还原缓冲液、酶的辅助因子、细胞分裂和生长的调节因子,并参与信号转导[44那45].Khan等。[46据报道,ASC及其各种功能在植物生长和发育中的性质对于细胞还原,抗氧化能力和对抗非生实压力的各种细胞机制的调节很重要。
芹菜素7-葡萄糖苷和木犀草素近年来也与应激有关。Mostafa Hojati的研究表明,甘菊(Matricaria Chamomilla.芹菜素-7-葡萄糖苷含量的变化与芹菜素-7-葡萄糖苷含量的变化有关[47].该研究还表明,叶黄素可以调节植物中可溶物质的积累来抵抗盐胁迫,与氮代谢有关。在该实验中,在应力的早期阶段积累的大量Apigenin 7-葡糖苷,而在应激后期积累的叶黄素,并且在CK条件下植物的植物含量为6倍。这表明糖甜菜产生的黄酮类代谢物可能首先响应渗透胁迫,然后响应离子胁迫。此外,KEGG注释分析显示,上调了与苯丙烷生物合成相关的大量基因的表达。一些研究表明,苯丙烷生物合成与黄酮和木质素合成有关,可以改善渗透效应水曲柳[48].Ma等人报道了关于荞麦的类似结论[49].因此,Asc、芹菜素-7-葡萄糖苷和木犀草素的积累可能参与了植物的盐反应。
aas与盐胁迫相关联
当植物经受盐胁迫时,它们可以抵抗或缓解小分子渗透调整物质的积累造成的损害[50].先前的研究表明,盐胁迫期间大麦的AA代谢提高,和小分子的AA的积累有助于通过提高渗透调节及通过维持细胞膜的稳定性,以提高耐盐性[51].在280 mmol/L NaCl处理下,耐盐品种T710MU的脯氨酸和游离氨基酸含量高于盐敏感品种S710 [52].本实验结果表明,在盐胁迫早期,甜菜AA代谢显著增强,导致谷氨酰胺、天冬酰胺、半胱氨酸、瓜氨酸和苯丙氨酸大量积累。天冬酰胺和半胱氨酸是蛋氨酸和谷胱甘肽合成的前体,它们可以清除细胞毒素,保护SH蛋白群免受氧化和ROS [53那54].同样,半胱氨酸是必需生物分子的代谢前体,如维生素、辅助因子、抗氧化剂和许多防御相关化合物[55].在本研究中,o -乙酰- l-丝氨酸含量也有一定程度的增加。半胱氨酸代谢的最后一步是由o -乙酰丝氨酸(硫醇)裂解酶(OASTL)催化,它将还原的硫与o -乙酰丝氨酸结合生成半胱氨酸;因此,半胱氨酸在盐胁迫中起着重要的作用。谷氨酸可用于生产瓜氨酸、脯氨酸和-氨基丁酸(GABA)。瓜氨酸据报道是一种有效的羟基自由基清除剂和有效的抗氧化剂,可保护DNA和代谢酶免受氧化损伤[56那57那58].非生物胁迫产生ROS,诱导烟草和葡萄中阴离子谷氨酸脱氢酶(GDH)的表达形成谷氨酸合成脯氨酸[59].这种关系可能是在应力开始时谷氨酸含量降低的原因。
支持盐胁迫下的细胞渗透电位增加的渗透物存在于许多化合物中,但它们的合成不同步:谷氨酰胺,天冬酰胺,半胱氨酸和苯丙氨酸在应激的发作时作用,而草酸盐,甜菜碱,祖非和瓜氨酸和瓜粉胺主要积聚在胁迫下紧张的晚期。其他兼容性溶质,如糖,似乎只在次要的角色上发挥作用。此外,这些相容化合物可用于储存氮气,并且植物可以在渗透压减少时使用氮气[60].
OAS与盐胁迫相关
盐胁迫开始时,根中的OAs(包括顺乌头酸、2-异丙基苹果酸、苯甲酸、α -酮戊二酸和l -苹果酸)增加,这与组织中的AAs变化一致。这种变化模式可能与阳离子/阴离子不平衡程度有关,阳离子/阴离子不平衡程度是决定植物OA含量的一个重要因素[61].对于根部吸收过多阳离子的植物,电荷平衡应该由更多的负电荷恢复,这些负电荷是由OA提供的,包括乌头酸、柠檬酸、苹果酸和丙二酸[62那63].因此,在根内检测到的OA水平可以抵消电荷不平衡[64];或者,它可能用作代谢活性的溶液来调节渗透压[65].我们的研究结果表明美洲国家组织对盐胁迫的第一天发挥了重要作用。类似于发生在本研究中,刘等人。[66]在干旱胁迫下分析了SheckGrass,发现了大量的AA和OA积聚。在盐胁迫下对荞麦的代谢分析也导致了相同的结论[49].这表明,植物可能首先重新排列OAs和AAs以应对盐胁迫[8.].
蔗糖代谢与盐耐受性相关
在植物中,糖作为细胞的代谢资源和结构成分,在各种胁迫条件下糖也进行渗透调节[67那68那69].在我们的研究中,盐胁迫导致可溶性糖含量的增加,这与Wang等人的研究结果一致。[22.].先前的一项研究表明,外源葡萄糖和蔗糖有助于小黑麦幼苗在盐胁迫下的生长[70].在本研究中,在应激早期糖甜菜根部的碳代谢显着增加,而蔗糖和脂质含量降低。蔗糖是植物代谢的碳和能量的主要来源。annunziata等。[17.研究表明,硬粒小麦根系在盐胁迫下经历了蔗糖和氮化合物的再平衡。SS [EC 2.4.1.13]和INV [EC 3.2.1.26]是蔗糖代谢的关键酶。在本研究中,SS基因在盐处理1天后表达上调,但在盐处理7天后无明显变化。然而,编码INV的基因在这两天都上调。d -果糖-1和6P2含量在盐胁迫下增加。这些结果表明,甜菜根促进蔗糖的分解成其他可溶性糖和提高盐胁迫下柠檬酸循环的活动,满足生存的能源需求的增长缓慢,和这一现象变得越来越明显的压力的增加持续时间(71].先前的研究表明,番茄耐盐能力的差异,可能与调节碳的分配和蔗糖代谢双方的能力[72].Mišić等的研究结果提供了强有力的证据,证明了INV在细胞内的表达Schenkia spicata以腐蚀的方式调节[73].然而,对海甜菜和栽培甜菜的转录组分析表明,在急性盐胁迫下,糖代谢、蛋白质加工、转录调控和信号转导是栽培甜菜独有的[8.];因此,不同的甜菜品种在不同的生育期可能需要不同的处理方法来缓解盐胁迫,也可能需要不同的盐胁迫原因。
尿囊素积累与耐盐
转录和新陈代谢的综合分析表明,祖非是一种非常重要的代谢物。在本研究中,盐应激结束时植物中的甜菜碱累积比CK植物在盐胁迫结束时。甜菜碱是一种含有众所周知的含氮化合物,可增强胁迫性,并稳定蛋白质和膜的季结构,免受干旱,高盐度和极端温度的不利影响[74].而在盐胁迫下,尿囊素的积累量是对照的6.9倍。尿囊素(5-尿囊内酯或5-尿囊内酯)是一种含杂环氮的化合物,是植物尿素代谢过程中的中间体。尿素化合物一般通过嘌呤分解代谢产生,在植物氮代谢中起重要作用[75].越来越多的研究报道了尿囊素在植物体内的积累是对各种胁迫条件的反应;尿囊素参与植物的胁迫反应,并提供对非生物胁迫因子的耐受性[76那77那78].干旱胁迫下鹰嘴豆类似的调查结果已经报道79].
这项研究的结果表明,编码XDH的基因的表达被上调。类似地,在其中从葡萄XDH基因在拟南芥中过表达的研究表明,尿囊素积累激活脱落酸(ABA)信号传导途径,有助于去除ROS并播放在盐胁迫应答中起重要作用[80].尿囊素不仅是一种可移动的富氮化合物,还通过减少氧化损伤来保护植物免受非生物胁迫[78].Watanabe等人。据报道,ALN函数的损失可能导致含有丙二醇的大量积累拟南芥,增加胁迫相关基因的表达,增强对干旱胁迫和渗透胁迫的耐受性,作者报道尿囊素的具体作用是通过ABA调控的[81].拟南芥植物的研究还表明,外源丙氨酸的应用增加了拟南芥幼苗的应力耐受性[77].在我们的研究中,相关分析表明,大多数盐胁迫下差异表达的基因进行了显著相关尿囊素,这表明尿囊素是可能比在盐胁迫下甜菜等代谢产物更为重要和有效。此外,该研究的结果涉及两种激素,即,褪黑激素和(S)的变化-2-氨基丁酸,其有可能以反映新的调节途径,并为随后的研究提供方向。
总之,我们推测糖甜菜可以响应盐胁迫,增强TCA循环,通过重构碳和氮代谢累积渗透调整物质来迅速地进行糖代谢。在渗透调节物质中,丙二醛可用于甜菜根部或作为在应力下储存氮的组分。祖非素基因可用作随后研究的关键基因。
结论
在这项研究中,通过转录组织和代谢组学方法分析了甜菜以短期和长期盐胁迫的适应机制。研究发现,甜菜甜菜通过调节碳和氮代谢,主要是涉及蔗糖代谢和嘌呤代谢途径的盐度。重要的是,祖非可能与糖甜菜到盐胁迫的适应性反应密切相关。我们的研究结果提供了甜菜盐耐腐蚀的见解,并为进一步提高植物胁迫阻力提供了有价值的基础。
方法
植物生长条件和胁迫处理
试验在东北农业大学植物生长室(23°C/18°C,昼/夜)进行。将德国KWS公司供应的KWS0143甜菜种子置于含有蛭石的花盆中,光周期为14 h/10 h,光强为450 μmol m- 2年代- 1相对湿度60±5%。幼苗出苗后,用半强度的霍格兰营养液每天浇灌一盆,连续浇水10天。然后将均匀的幼苗转移到单独的20 l塑料容器中(长度为100 cm;宽22厘米;高度15厘米),含半强度霍格兰营养液,并用气泵连续通气。试验设计为完全随机设计,设1个对照和1个盐处理,每个处理8个生物重复。每个处理的每个生物重复都在4个独立的容器中进行。盐处理(NaCl和Na2所以4.当第一对成熟叶完全开发时,在2:1米的比率开始。na的浓度+在3 d内由100 mM逐渐增加到300 mM。只添加营养液的处理作为空白CK。2 N HCl或2 N NaOH使营养液pH在7.0 ~ 7.2之间。营养液每2天更换一次。
每个处理分别设置8个、3个和3个生物重复进行代谢组分析、转录组分析和生理参数测定。分别于盐胁迫第1天和第7天取样。一半的样品浸泡在液氮中,然后在−80℃保存,用于提取总RNA进行转录组学和代谢组学分析。其余样品置于烘箱中,105℃干燥15 min, 80℃干燥2 d。每株的根/茎比计算为植株根干重与茎干重之比。
RA和无机离子含量分析
RA (μg- 1h- 1)根据三苯基四唑氯化物(TTC)方法测量[82].脱氢酶活性被认为是RA的指标。
干根样品(0.1 g)用HNO消化3./ HClO4.(5/1 v / v)直到解决方案变得清晰。NA.+和K.+通过原子吸收分光光度法(ICE 3500; Thermo Fisher Scientific,USA)测定内容物,并且无机离子含量以mg g表示- 1DW。
丙二醛、超氧自由基、H2O.2和脯氨酸含量
用硫代巴比妥酸(TBA)提取丙二醛,上清液在450、532和600 nm处的吸光度按Shi等的方法测定[83].
超氧化物阴离子(o2·-)根据刘和庞的方法确定含量[84].磷酸钾缓冲液(pH7.8)用于提取O.2·-通过在25℃下孵育20分钟的植物材料,加入17mM磺酰胺和7mMα-萘胺,并在25℃下孵育20分钟。测量530nm处的吸光度,o2·-含量通过标准曲线计算出随后。
H2O.2根据Velikova的方法确定含量[85].用0.1% (w/v)三氯乙酸提取根组织后,加入磷酸盐缓冲液和1 M KI。在黑暗中孵育1 h终止反应,测量390nm处的吸光度。随后,H2O.2内容通过标准曲线计算,h2O.2在nmol g中表达的内容- 1弗兰克-威廉姆斯- 1.
根据Bates的方法测定脯氨酸含量[86].Samples (0.5 g) were extracted with 3% (w/v) sulfated salicylic acid. Ninhydrin acid, glacial acetic acid, and the sample tissue were then mixed together and heated in a water bath at 100 °C for 1 h. The proline was extracted with toluene, the absorbance at 520 nm was measured, and the proline content was calculated via a standard curve, with the proline content expressed in μg g- 1弗兰克-威廉姆斯。
可溶性糖和蛋白质含量的测定
可溶性糖含量按Spiro [87].将一百微升的提取物加入到由1.08米H组成的溶液中2所以4.那1。09 mM thiourea and 2.1 mM anthrone with the final volume being 3 ml. The mixture was then heated at 100 °C for 10 min. A calibration curve for D-glucose was established as a standard. The total protein content was determined via Bradford method [88].
抗氧化酶的分析
通过Stewart和Bewley的方法测量SOD活性[89];酶活性以g为单位表示- 1(FW)。将一个单位的SOD活性定义为1ml反应混合物中1mg组织蛋白所需的酶量,以获得50%的SOD抑制率。通过根据傅的方法监测470nm的Guaiacol的形成来测定POD活性。90];酶活性是在愈创木酚的毫摩尔分钟表示- 1g- 1(FW)。CAT酶活性通过Aebi报道的系统计算[91].
代谢物分析和数据分析
收集并于冰上解冻样品;后,50%的甲醇溶液,用于提取代谢物。In brief, 120 μL of the 50% methanol solution cooled before hand was used to extract 20 μL sample under 1 min of vortexing, followed by 10 min of incubation under ambient temperature. Later, the mixture obtained was preserved under the temperature of − 20 °C. Afterwards, the mixture was centrifuged for 20 min at 4000 g to collect supernatants, which were later transferred to the new 96-well plates. The samples were stored at − 80 °C prior to LC-MS analysis.
所有样品按照机器操作程序,采用LC-MS系统进行分析。首先采用UPLC系统(SCIEX, UK)进行色谱分离。此外,采用ACQUITY UPLC BEH Amide色谱柱(100mm *2.1 mm, 1.7 μm, Waters, UK)进行反相分离。柱温保持在35℃,溶剂为A (25 mM nhh4.H.2O + 25mM乙酸铵)和溶剂B(IPA:ACN = 9:1 + 0.1%甲酸),其流速为0.4ml / min。梯度洗脱条件设定如下:0-0.5分钟,95%B;0.5-9.5分钟,95至65%B;9.5〜10.5分钟,65%〜40%B;10.5-12分钟,40%b;12-12.2分钟,40-95%b;和12.2-15分钟,95%b [92].每个样品的进样量为4 μl。
使用Triple ToF 5600加上高分辨率串联质谱仪(Sciex,UK)和在负离子模式下操作的Q-TOF检测基于柱洗脱的代谢物[92].离子源气体1和2均设置为60psi,帘气设置为30psi,界面加热器温度设置为650℃。正离子模式下离子喷雾的电压浮动为5000 V,负离子模式下离子喷雾的电压浮动为−4500v。此外,为了评估LC-MS系统在整个采集过程中的稳定性,一个用于质量控制的样品(基于所有样品汇集)以10个样品为间隔进行检测。
来自质谱仪的原始数据通过ProteOWizard MSCONVERT软件转换为可读的MZXML数据。通过XCMS软件进行峰提取,并且还进行峰提取QC。通过相机对提取的材料进行添加剂离子注释,然后通过Metax软件进行主要识别。使用内部标准数据库来使用质谱初级信息来识别和匹配质谱的次要信息。随后通过人代谢数据库(HMDB),KEGG数据库和其他数据库用代谢物用代谢物注释,以解释代谢物的物理化学性质和生物学功能。量化差分累积的代谢物,然后通过Metax软件筛选。
转录组RNA-seq过程
根据制造商的协议,通过TRK1001总RNA纯化试剂盒(LC Science,休斯顿,TX)提取总RNA [93].使用Bioanalyzer 2100和RNA 6000 Nano LabChip Kit (Agilent, CA, USA)测定总RNA量和纯度,RNA值> 7.0。定量总RNA后,将真核细胞mRNA附着在Oligo (dT)磁珠上进行富集。提取的mRNA通过片段缓冲液随机破碎成短片段,以片段mRNA为模板,利用六碱基随机引物(随机六聚体)、缓冲液中双链cDNA合成、dNTPs、RNaseH和DNA聚合酶I合成一条cDNA链[94].AMPure XP珠子被用来净化双链产品,T4 DNA聚合酶和克莱诺DNA聚合酶被用来修复附件粘性末端的DNA钝端,一个基地和连接器被添加到3 '端,AMPureXP珠子被用于片段选择,最终进行PCR扩增,增加最终测序文库。文库定量后,由Illumina HiSeq 4000仪器生成,测序读长为双端2*150 bp (PE150) [93];低质量的读取被删除。原始序列数据可在GEO系列登录号GSE114968下获得。进行基因差异表达和功能分析。不同基因表达水平的测定基于上述数据分析程序,使用HISAT软件将测序数据与NCBI (https://www.ncbi.nlm.nih.gov/genome/?term=Beta+vulgaris)甜菜参考基因组。转录本通过多次比对组合而成。最后,用R图形化显示Ballgown生成的数据结果。功能分析包括使用GOseq富集分析和KOBAS富集分析KEGG信号通路。通过StringTie和Ballgown计算所有转录本的表达水平。StringTie也被用来确定mRNA的表达水平,通过计算每千碱基的转录本每百万mapping reads (FPKM) [94].R package Ballgown根据log 2 (fold change) > 1或log 2 (fold change) <−1的标准选择差异表达的mrna和基因,在时差异有统计学意义P.< 0.05 (95].
实时荧光定量PCR验证盐反应基因
通过qRT-PCR定量18个随机选择的deg的表达,验证RNA-seq测定的表达水平。从RNA-seq中提取的总RNA逆转录为cDNA,用于验证mRNA表达的准确性。采用ABI StepOnePlus real-time PCR仪,结合SG Fast qPCR Master Mix Kit进行qRT-PCR。所用引物采用Primer Express 5.0设计。实时反应体系为SYBR Green qPCR Master Mix 10.0 μL,每条阳性引物0.4 μL (10 μM), ddH 7.2 μL2O.那和2。0 μL of cDNA. The amplification procedure consisted of 95 °C for 3 min; 45 cycles of 95 °C for 7 s; 57 °C for 10 s; 72 °C for 15 s; and then 72 °C for 10 min. The specificity of the primer pair was checked by sequencing the PCR product. The experiment was performed in triplicate, and the resulting melting curve was used to determine the specificity of the amplified fragment. Expression levels were calculated via the 2-ΔCt或2——ΔΔCt方法,采用Opticon Monitor Analysis Software 3.1工具对数据进行分析[96].所用引物见表S8..
统计分析
数据用3次或8次生物重复的平均值±标准差(SD)表示。代谢组学分析有8个重复,其他分析有3个重复。通过Ballgown包R 3.2.5 (R Core Team,维也纳,奥地利)计算统计学意义。t检验和方差分析均采用SPSS统计学22.0软件(IBM, Chicago, IL)进行。表格和图表使用Microsoft Excel 2013, GraphPad prism 8.3软件(San Diego, CA, USA)和R 3.2.2编写。差异P. < 0.05 and 0.01 were considered significant and highly significant, respectively.
可用性数据和材料
原始RNA-seq数据可在GEO系列登录号GSE114968 (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE114968).在本研究中使用和/或分析的数据集可在合理要求下从通讯作者处获得。
缩写
- 5 HIU:
-
5-hydroxyisourate
- AA:
-
氨基酸
- ALN:
-
丙二醇酶
- ASC:
-
L-抗坏血酸
- 度:
-
差异表达基因
- ESI:
-
电喷雾电离
- GABA:
-
4-aminobutyric酸
- 国民幸福指数:
-
谷氨酸脱氢酶
- H.2O.2:
-
过氧化氢
- 质:
-
液相色谱-光谱法
- 李:
-
胚胎晚期丰富
- MDA:
-
丙二醛
- O.2·-:
-
超氧化物阴离子
- 办公自动化:
-
有机酸
- OHCU:
-
2-氧代-4-羟基-4-羧基-5-ureido-咪唑啉
- PC:
-
主成分
- PC1:
-
第一主成分
- PC2:
-
第二主成分
- ROS:
-
活性氧
- 柠檬酸:
-
三羧酸循环
- 稍后通知:
-
硫代巴比土酸
- UPLC:
-
超高效液相色谱
- XDH:
-
黄嘌呤脱氢酶
参考资料
- 1。
粮农组织土地和植物营养管理服务。[http://www.fao.org/ag/agl/agll/spush].2009年访问。
- 2。
山口T,Blumwald E.开发耐盐作物:挑战和机遇。趋势植物SCI。2005; 1012:615-20。
- 3.
张志刚,张志刚,张志刚,等。盐生植物对盐胁迫的生理生态适应:光合作用、PS II光化学和抗氧化反馈——对气候变化适应能力的影响。植物生理生化学报。2013;463 - 468。
- 4。
(1)盐对红树生长、离子积累、光合作用和叶片解剖的影响。工业parviflora.树木。2004;182:167 - 74。
- 5.
杨L,康康,陈某,李海。盐胁迫诱导蛋白酶组和转录组变化糖甜菜单体添加线M14。J植物理性。2012; 169S1:839。
- 6.
Hossain MS,Elsayed Ai,Moore M,Dietz K-J。氧化还原与反应性氧物种网络在糖束中盐度耐受性的适应性。J Exp Bot。2017; 685:1283-98。
- 7.
Wedeking R, Mahlein AK, Steiner U, Oerke EC, Goldbach HE, Wimmer MA。幼甜菜的渗透调节(甜菜属),并通过代谢产物分析和红外热像仪评估其后续复水的影响。植物生态学报。2016;441:119-33。
- 8.
Skorupa M,Gołębiewskim,kurnik k,niedojadłoj,kęsyj,klamkowski k等。盐胁迫对盐休克 - 甜菜及其嗜睡症的案例。BMC植物BIOL。2019; 191:57。
- 9.
罗泽玛,张永强,李华,李洪波,卡施尼格,等。比较甜菜品种及其盐生祖先的耐盐性:驯化和育种程序的结果。AoB植物7,2016(2014-12-9)。2014; 7: plu083。
- 10.
盐胁迫对甜菜生长、无机离子和脯氨酸积累与渗透调节的影响。环境实验机器人2002;471:39-50。
- 11.
Zou C,Sang L,Gai Z,Wang Y,Li C.甜菜对碱性应激的形态和生理反应。糖科技。2017; 1:1-10。
- 12.
甜菜碱和脯氨酸在植物抗非生物胁迫中的作用。环境Exp Bot. 2007; 592:206-16。
- 13。
李鹤,臧BS,邓XW,王XP。海藻糖-6-磷酸合酶基因OSTP1的过表达增强了水稻中的非生物胁迫耐受性。Planta。2011; 2345:1007。
- 14。
Baque Ma,Elgirban A,Lee Ej,Paek Ky。蔗糖调节蒽醌,酚类,黄酮类生物合成和抗氧化酶在不定根悬浮培养中的抗氧化酶活性的增强诱导Morinda citrifolia(l)。植物生理学报。2012;342:405-15。
- 15.
适合LVD, Memelink J. ORCA3,植物初级和次级代谢茉莉酸响应的转录调控因子。科学。2000;2895477:295-7。
- 16.
曼苏尔MMF。含氮化合物与植物对盐胁迫的适应医学杂志。2000;434:491 - 500。
- 17.
Annunziata MG, Ciarmiello LF, Woodrow P, Maximova E, Fuggi A, Carillo P. Durum小麦根系适应盐度重塑细胞中氮代谢产物和蔗糖的含量。植物学报2016;7:2035。
- 18.
Postnikova oa,shao j,nemchinov lg。催化盐度应力响应苜蓿根转录组的分析。植物细胞生理。2013; 547:1041-55。
- 19.
粉丝XD,王杰克,杨n,董yy,刘l,王fw等。大豆叶片和盐酸叶片叶片的基因表达分析,盐碱碱和旱水胁迫下的含水量。基因。2013; 5122:392-402。
- 20.
Yao D,张X,Zhao X,Liu C,王C,张Z等。转录体分析显示棉花胁迫调节的生物过程和棉花根中的关键途径(陆地棉l .)。基因组学。2011;981:47-55。
- 21。
Bahieldin A, Atef A, Sabir JSM, Gadalla NO, Edris S, Alzohairy AM,等。野生大麦RNA-Seq分析(h . spontaneum盐胁迫条件下)的叶转录。C R生物学。2015; 3385:285-97。
- 22。
王Y,Stevanato P,俞L,赵H,孙X,孙楼等。在甜菜幼苗下不同水平盐胁迫的生理和代谢的变化。Ĵ厂水库。2017; 1306:1079年至1093年。
- 23。
侯塞因MS,Persicke男,ElSayed AI,卡里诺夫斯基Ĵ,迪茨KJ。在细胞和亚细胞水平的代谢谱揭示了与甜菜耐盐性相关的代谢产物。J Exp Bot。2017; 6821-22:5961-76。
- 24。
王志强,王志强,王志强,等。盐胁迫下黄瓜根系信号转导研究——以黄瓜(Cucumis sativus L. Environ Exp)为例
- 25。
唐妮HF,Adu Mo,Schmidt S,Otten W,Dupuy LX,White PJ等。通过成像和图像分析来定量根系和根际相互作用的挑战和机遇。植物细胞环境。2015; 387:1213-32。
- 26。
Gong B,Li X,Bloszies S,Wen D,Sun S,Wei M等。通过一氧化氮和多胺的相互作用的碱性碱性应力减轻涉及溶亚曲霉在溶氧化剂和生理策略。自由Radic Biol Med。2014; 716:36-48。
- 27。
Tunnacliffe A, Wise MJ。LEA蛋白的持续难题。《自然科学》杂志上。2007;9410:791 - 812。
- 28.
邵海波,梁志生,邵马。高等植物LEA蛋白的结构、功能、基因表达与调控。胶体表面B-Biointerfaces。453 - 4:131 2005; 5。
- 29.
黄L,张米,贾茹,赵X,黄X,ji e等。一种非典型晚期胚胎发生丰富的蛋白质Oslea5在ABA诱导的抗氧化防御中起着积极作用栽培稻L.植物细胞生理。2018; 595:916。
- 30.
Saha B, Mishra S, Awasthi JP, Sahoo L, Panda SK.转基因芥菜抗旱和耐盐性的增强[Brassica Juncea.(L.)Czern&的Coss。]过表达拟南芥组4胚胎发育晚期丰富基因(AtLEA4-1)。ENVIRON实验植物学。2016; 128:99-111。
- 31.
Campos F, Cuevas-Velazquez C, Fares MA, Reyes JL, Covarrubias AA。第1组LEA蛋白是一种古老的植物蛋白群,也存在于其他真核生物以及古菌和细菌域中。基因组学杂志。2013;28810:503-17。
- 32.
徐d,段X,王B,香B,何T,一个胚胎发育晚期丰富蛋白基因的吴R.表达HVA1,大麦赋予对转基因水稻水分亏缺和盐胁迫。植物理性。1996; 1101:249-57。
- 33.
王Y,Stevanato P,吕C,李R,耿G.比较生理与对比耐盐2个基因型甜菜蛋白质组学分析。JAgric Food Chem。2019; 6721:6056-73。
- 34.
植物的钠转运与耐盐性。《细胞生物学》2000;124:431-4。
- 35。
测试仪M,Davenport R. Na +耐受性和Na +在高等植物中的运输。Ann Bot。2003; 915:503-27。
- 36。
芒斯R,盐度耐性的测试仪M.机制。Annu Rev植物Biol。2008; 591:651-81。
- 37。
沃克DJ,米勒AJ。胞质娜的捐款单细胞测量+和K.+盐宽容。植物杂志。2003;1312:676 - 83。
- 38。
刘涛,庄亮,黄斌。根钠钙信号转导的代谢调节和基因表达对农草耐盐性的影响。植物生态学报。2019;42(1-2):219-32。
- 39.
金哟,康H,Ahn SJ。植物植物素合酶ATPCS2的过度表达增强了拟南芥的耐盐性。J植物理性。2019; 240:153011。
- 40.
吕X,陈S,汪Y.理解的进展对盐胁迫甜菜的生理和分子反应。前植物SCI。2019; 10:1431。
- 41.
张志强,张志强,张志强,等。植物中的类黄酮氧化:从生化特性到生理功能。植物科学进展。2007;121:29-36。
- 42.
Agati G,Azzarello E,Pollastri S,Tattini M.Flavonoids作为植物的抗氧化剂:位置和功能性意义。植物SCI。1963年; 2012:67-76。
- 43.
Hernándezi,伊雷格雷L,Breusegem Fv,Munnéboschs。与植物中的抗氧化剂有多相关?趋势植物SCI。2009; 143:125-32。
- 44.
Kerk NM,Feldman NJ。静态中心启动与维护的生化模型:对根业经组织的影响。发展。1995年; 1219:2825-33。
- 45。
Pignocchi C,Foyer Ch。Apoplastic抗坏血酸的代谢及其在细胞信号传导调节中的作用。CurrOp植物BIOL。2003; 64:379-89。
- 46。
Khan Ta,Mazid M,Mohammad F.植物诱导抗坏血酸潜力的综述。J Agrobiol。2011; 282:97-111。
- 47。
Hojati男,勒斯-Sanavy SAM,Ghanati楼帕纳西M.己唑醇诱导经受干旱胁迫母菊植物的抗氧化保护和芹菜素-7-葡糖苷的积累。J植物理性。2011; 168(8):782-91。
- 48。
陈晓霞,王华,李晓霞,马凯,詹玉英,曾峰。水曲柳4-香豆酸:辅酶a连接酶4 (4CL-like 1)的克隆和功能分析及其在非生物胁迫和细胞壁合成中的作用。BMC Plant Biol. 2019;191:231。
- 49。
马W,金JK,贾C,尹楼金HJ,阿克拉姆W,等人。比较转录和荞麦的代谢谱分析(Fagopyrum tataricum(L.)Gaertn。)在盐度胁迫下。代谢物。2019; 910:225。
- 50.
李敏,郭锐,焦艳,金霞,张华,石磊。基于幼苗根系代谢组学的大豆耐盐性比较。植物学报2017;
- 51.
维多多PJH,Newbigin E,测试仪男,Bacic A,Roessner U.代谢反应,大麦盐胁迫(大麦芽L.)品种,撒哈拉和限幅器,这在耐盐性不同。J Exp Bot。2009年,6014:4089-103。
- 52.
耿刚,吕春,李瑞,刘华,于林,等。盐敏感和耐盐基因型的转录组分析揭示了甜菜耐盐代谢途径。acta physica sinica, 2019;
- 53.
notor G, Mhamdi A, Chaouch S, Han Y, Neukermans J, Marquez-Garcia B, et al.;植物中的谷胱甘肽:综合综述。acta botanica yunnanica(云南植物研究),2012;
- 54.
Noctor G,Arisi ACM,Jouanin L,Kunert KJ,Rennenberg H,门厅CH。谷胱甘肽:生物合成,代谢和关系,在转基因植物研究抗逆性。J Exp Bot。1998; 49321:623-47。
- 55.
Romero LC,Gotor C. cysteineSoyostasis在植物免疫中起重要作用。新植物。1931; 2011:165-77。
- 56.
里曼多AM,帕金斯-维齐总理。西瓜皮中瓜氨酸含量的测定。J Chromatogr。2005;10781:196 - 200。
- 57.
Akashi K,Miyake C,Yokota A.瓜育酸盐,一种耐旱性野生西瓜叶中的一种新型相容溶质,是一种有效的羟基自由基清除剂。费用。2001; 5083:438-42。
- 58.
Dasgan HY,Kusvuran S,Abak K,Leport L,Larher女,甜瓜的营养生长(甜瓜)期间瓜氨酸的积累和盐耐受性之间Bouchereau A.的关系。植物土壤环境。2009; 552:51-7。
- 59。
Skopelitis DS, Paranychianakis NV, Paschalidis KA, Pliakonis ED, Delis ID, Yakoumakis DI等。非生物胁迫产生ROS,信号转导阴离子谷氨酸脱氢酶的表达,形成谷氨酸,促进烟草和葡萄脯氨酸的合成。植物细胞。1810;2006:2767 - 81。
- 60.
罗德D. A,汉森AD。季铵和高等植物叔锍化合物。Annu启植物生理学植物分子生物学。1993; 441:357-84。
- 61.
赵旭,王伟,张飞,邓军,李志,付斌。两种水稻基因型苗期耐盐性的比较代谢谱。《公共科学图书馆•综合》。2014;99:e108020。
- 62.
Chang K,Roberts JK。通过13C-NMR光谱法测定的K +离子吸收期间玉米根尖的细胞质苹果醛水平。Biochim Biophys Acta。1991; 10921:29-34。
- 63.
琼斯DL。根际有机酸的研究进展。植物与土壤。1998;2051:25-44。
- 64.
Zuther E,Koehl K,Kopka J.稻米育苗盐反应的比较代谢分析。在:抗旱耐盐作物分子育种进展.由Jenks MA,长谷川总理,Jain SM编辑。荷兰多德雷赫特:施普林格;2007.p . 285 - 315。
- 65.
杨超,郭伟,史丹。有机酸对耐碱盐生植物虎头草耐碱的生理作用。阿格龙j . 2010; 1024:1081-9。
- 66.
刘泰,陈mx,张y,zhu fy,刘yg,田y等。两种Switchgrass Ecotypes的比较代谢物分析揭示了干旱应激反应和Rhizosheath重量的差异。Planta。2019; 2504:1355-69。
- 67.
Fougèref,鲁尔迪尔,街道JG。盐胁迫对氨基酸,有机酸和碳水化合物组成的氨基酸,菌和苜蓿细胞溶胶(紫花苜蓿l .)。植物理性。1991; 964:1228-36。
- 68.
Kaplan F,Kopka J,Haskell DW,Zhao W,Schiller KC,Gatzke N等人。探索拟南芥的温度应激代谢物。植物理性。2004; 1364:4159-68。
- 69。
罗莎男,拉多C,Podazza G,Interdonato R,冈萨雷斯JA,希拉尔M等人。可溶性糖 - 代谢,传感和非生物胁迫:在植物的生活的复杂网络。植物信号Behav。2009; 45:388。
- 70。
王L,Li G,Wei S,Li L,Zuo S,Liu X等。外源葡萄糖和蔗糖对盐胁迫下小黑麦幼苗光合作用的影响。Speckynthetica。2019; 571:286-94。
- 71。
王勇,丛颖,王勇,郭震,岳军,邢震,等。基于相对和绝对定量(iTRAQ)等压标签的定量蛋白质组学分析鉴定早期盐度胁迫反应蛋白。acta physica sinica, 2019; 43(3):599。
- 72。
Balibrea ME,Dell'AmicoĴ,BolarínMC,佩雷斯 - Alfocea F.碳分区和在番茄植株盐度下生长蔗糖代谢。physiol植物。2000; 1104:503-11。
- 73。
D, Dragićević M, Šiler B, Nestorović Živković J, Maksimović V, Momčilović I,等。糖和酸性转化酶介导了申克草根培养物对盐胁迫的生理反应。植物生理学杂志,2012;
- 74.
坂本A,在植物甜菜碱合成村田N.基因工程:当前状态和增强抗逆性的影响。J Exp Bot。2000; 51342:81-8。
- 75.
Werner AK,Witte Cp。氮气动员的生物化学:嘌呤环分解代谢。趋势植物SCI。2011; 167:381-7。
- 76.
Nourimand M,Todd CD。丙二醇有助于镉处理的拟南芥根系的应力反应。植物理性生物化学。2017; 119:103-9。
- 77.
外源尿囊素增加拟南芥幼苗对NaCl胁迫的耐受性,并调节氧化应激反应基因的表达。植物生理学杂志,2018;421:421 - 426。
- 78.
陈志强,陈志强。拟南芥尿素代谢的研究进展。植物生理学杂志。2016;19:87 - 95。
- 79.
Khan N, Bano A, Rahman MA, Rathinasabapathi B, Babar MA。基于uplc - hrms的非靶向代谢分析揭示了鹰嘴豆(Cicer arietinum)代谢组在长期干旱胁迫后的变化。植物学报。2019;421:115-32。
- 80。
你,朱B,王F,韩H,Sun M,Zhu H等人。血管血管XANThine脱氢酶基因,VVXDH,增强了转基因拟南芥中的盐度耐受性。植物Biotechnol rep. 2017; 113:147-60。
- 81。
渡边S,松本男,Hakomori Y,高木H,岛田H,坂本A.嘌呤代谢物尿囊素增强的非生物胁迫通过脱落酸代谢的协同活化的耐受性。植物细胞环境。2014; 374:一〇二二年至1036年。
- 82.
Lindström A, Nyström c容器生长的苏格兰松,挪威云杉和美国黑松幼苗根系耐旱性的季节变化。Can J For Res. 1987; 178:787-93。
- 83.
施H,叶T,氢硫化物硫化氢供体的钠陈Z.外源应用增强的在狗牙根多种非生物胁迫耐受(Cynodon Dactylon.(l)。是。)。植物理性生物化学。2013; 712:226-34。
- 84.
刘芳,庞世杰。两种潮间带红藻(greloupia turuturu和Palmaria palmata)活性氧代谢的耐逆性和抗氧化酶活性。J Exp Mar Biol Ecol. 2010; 3822:82-7。
- 85.
Velikova V,Yordanov I,Edreva A.酸性雨处理豆植物中的氧化应激和一些抗氧化体系:外源多胺的保护作用。植物SCI。2000; 1511:59-66。
- 86.
Bates LS, Waldren RP, Teare ID。水分胁迫研究中游离脯氨酸的快速测定。植物与土壤。1973;391:205-7。
- 87.
斯皮罗RG。糖分析糖蛋白中。方法酶。1966; 8:3-26。
- 88.
一种利用蛋白质染料结合原理的快速和灵敏的微量蛋白质定量方法。学生物化学肛门。1976;72年代(1 - 2):248 - 54。
- 89.
Stewart Rr,Bewley JD。脂质过氧化与大豆轴加速老化相关的过氧化。植物理性。1980; 652:245-8。
- 90。
傅y,li f,xu t,cai s,chu w,qiu h等。生物累积,亚细胞和分子定位以及生理学和超微结构的损害Nymphoides peltata(GMEL。)O. Kuntze暴露于钇。环境科学污染粉丝。2014; 214:2935-42。
- 91。
Aebi H.在体外过氧化氢酶,Vol。105.纽约:学术;1984年。
- 92。
于灿,罗晓军,詹晓荣,郝娟,张玲,宋玉波,等。比较代谢组学揭示了两种濒危红豆杉(T. fuana和云南T.)。BMC Plant Biol. 2018;18:197。
- 93。
何庆林,魏晓燕,韩晓燕,周强,王华强,丁宁珍,等。妊娠期接触2,3 ',4,4 ' 5-五氯联苯对小鼠子代卵母细胞表观遗传印记和成熟的影响拱Toxicol。2019;939:2575 - 92。
- 94。
甘霖,蒋婷婷,易卫军,卢锐,徐福元,刘春明,等。基于代谢组学和转录组学的早期阴虚热证能量代谢相关潜在生物标志物研究Anat Rec Adv Integr Anat Evol Biol. 2020。https://doi.org/10.1002/ar.24355.
- 95。
Frazee Ac,Pertea G,jaffe Ae,Langmead B,Salzberg SL,韭菜JT。Ballgown桥接转录组合组件与表达分析之间的差距。NAT BIOTECHNOL。2015; 333:243-6。
- 96。
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据——ΔΔCT方法。方法。2001; 254:402-8。
致谢
我们感谢赵福新在写作上的帮助。我们也感谢盖志嘉和刘英的鼓励。
资金
国家自然科学基金项目(no . 31671622);中国农业科学研究体系项目(no . CARS-170201)。资助机构在研究的设计中没有任何作用;收集、分析和解释数据;或者在手稿的写作中。
作者信息
隶属关系
贡献
LL促成了实验设计,数据分析和稿件写作;CFL构思了这项研究,促成了实验设计,并修改了稿件;LL,BW,DL,PRW,ZYW和YBW执行了实验和数据分析;CLZ贡献了宝贵的讨论,所有作者均认批准了稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
竞争利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
盐胁迫不同阶段的原始代谢组学数据(n = 8).表S2。总结盐胁迫不同阶段代谢组学数据的变化。表S3。用于通过QRT-PCR验证测序(SEQ)数据的基因。表S4。从两个比较组(S_1VSCK_1和S_7VSCK_7)的DEGS术语。表S5。KEGG途径富集来自两个比较组(S_1vsCK_1和S_7vsCK_7)的DEGs。表S6。重要度的视角在盐胁迫下的根部检测(P.< 0.05)。FC (fold change)数为正表示表达式上调,FC为负表示表达式下调。表S7。与盐甜菜中的糖甜菜中代谢物相关的Degs的描述。FC (fold change)数为正表示表达式上调,FC为负表示表达式下调。表S8。QRT-PCR基因的引物列表。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于在这篇文章中提供的数据,除非在信用额度的数据另有说明。
关于这篇文章
引用这篇文章
刘,L.,王,B.,刘D.et al。转录组学和代谢组学分析揭示了甜菜根碳氮代谢的改变对盐胁迫的适应机制。BMC植物杂志20.138(2020)。https://doi.org/10.1186/s12870-020-02349-9
收到了:
接受:
发表:
关键字
- 甜菜属l
- 盐耐受性
- 多元分析
- 碳和氮代谢