摘要
背景
阴影包括低光强和不同的质量。然而,低的红光/远红光(R/Fr)比值是影响间作和密植植物生长的信号。因此,研究了遮荫条件下低R/Fr解耦对光合作用和CO的影响2.同化。在自然光照条件下(正常(N,阳光)、N + Fr、低(L) + Fr和L光)4个处理下,大豆植株在生长室内生长。
结果
低R/Fr显著提高了光系统II的总生物量、叶面积、淀粉和蔗糖含量、叶绿素含量、净光合速率和量子效率(P < 0.05). Proteomic analysis of soybean leaves under different treatments was performed to quantify the changes in photosynthesis and CO2.叶绿体中的同化作用。在7834蛋白量化,12显示> 1.3倍丰度的变化,其中1与卟啉和叶绿素代谢,2参与光系统I (PS)、4与PS二世有关,3蛋白质参与光合电子传递和2参与了淀粉和蔗糖代谢。这些蛋白质的动态变化表明,光合作用和CO2.与N处理相比,L处理通过上调成分蛋白水平维持同化。虽然低R/Fr增加了光合CO2.N + Fr和L + Fr处理大部分蛋白表达水平与N处理相比差异不显著。通过定量反转录聚合酶链反应发现基因表达也有类似的趋势,不包括蔗糖合酶的基因表达,这可能是因为光照环境是影响碳同化的因素之一。
结论
低R / FR比(高FR光)可以增加光合作用CO2.通过提高光系统的光合效率,在相同的光照强度下进行同化。
背景
在农业生产中,光是作物生长和发展的重要因素[1.].种内或种间植物相互遮荫经常影响作物的光截取[2.]尤其是间作密植系统,是提高资源利用率和产量的重要栽培方法[3.]植物可以感知到阴影,使它们能够适应并调整其表型和生理特征,以竞争有限的光资源[4.].阴影往往会导致在茎的伸长反应,叶柄和叶荫敏感的植物种类[5.].
植物阴影减少了光合作用辐射量(PAR)并改变光的光谱组成[6.,7.].植物通过光合色素选择性地吸收红色(R)波长。由于邻近植物的绿色叶子反射和传播,相对富集的远红色(FR)光谱相对富集[8.]。观察到周围环境中的R/Fr比率下降。阴影下的光强度和质量变化不同于弱光条件下的变化[9,10].使用黑色尼龙网或织物实现的低光条件不会改变光的光谱组成,特别是R / FR比[11,12].
光敏色素在感知R/Fr比值信号和通过基因表达和生理过程调控植物光形态建成中起着关键作用[1.]光敏色素有两种存在形式,即R光吸收Pr和Fr光吸收Pfr[1.,5.].在300-800 nm范围内,这两种形态的平衡随光谱组成的变化而动态变化[13].低R / FR比是阴影避免的重要信号因子[14].响应低R / FR比值包括增加茎伸长,降低的叶面积和分支,并且在叶绿素变化(叶绿素)的含量[8.,15,16].正常或低光条件下的低R / Fr比显着增加了大豆生物量(干重)与正常的R / Fr比(约1.2)[6.,9].
低的R/Fr比值表明Fr光谱在植物冠层中富集程度较高。植株叶片对Fr光的吸收较少(λ > 700 nm);因此,它对光合作用的量子产量贡献较小[17].然而,甄和范·埃尔塞尔[18]据报道,有效的光化学和光合作用需要Fr光。同样,遮荫处的Fr光高于弱光,从而增加净光合速率(PN)在相同的光强度条件下[11],导致全厂净同化增加[6.,9].典型地,较短波长是用来与较长的波长,以提高其光合效率,并且该整体现象称为艾默生增强效果[18].相反的效果,它是由光神父短光波长的量子产率的提高(例如,在低R / FR比值)在不同的光强的环境中,没有接收到相当大的关注。一些研究只是表明,光神父可以提高植物的光合作用和生物量[6.,18]因此,在将R/Fr比率与阴影分离的过程中,不同光强下的低R/Fr比率(Fr光富集)是否调节了光形态形成过程需要进一步分析。
光系统I和II(PS I和II,分别地)在串联操作以进行光合作用的初级光化学反应[18]这些过程涉及光吸收、能量和电子转移,由不同的相关蛋白质进行[11,19].蛋白质组学分析已被用于识别盐胁迫下植物光合蛋白的变化[20.],水赤字[21],低磷酸盐[22,叶绿素缺乏[23].我们之前研究了大豆光合蛋白的响应,通过使用对相对和绝对量化(ITRAQ)方法的同位素标记来调查了豆类光合蛋白对阴影条件的响应[11]然而,据我们所知,光照强度和R/Fr比值与遮荫条件下光合作用的蛋白质组学分析对于确定调节光系统相关蛋白的R/Fr比值非常重要,而光系统相关蛋白会影响光合作用和光合作用2.同化。
大豆(甘氨酸最大(L.)大豆 - )是蛋白质和油全球最重要的栽培作物之一[24,25],它通常用于旋转或与其他作物的互补,因为它可以固定大气氮[3.].然而,大豆经常遭受种内或种间相互遮荫[9].阴影增加了大豆,叶绿素含量,叶绿素植物的生物质,叶绿素含量和光合作用[2.,26].同样,我们之前通过使用ITRAQ定量蛋白质组学分析报告了光合蛋白对阴影和低光的反应,发现SHADE的FR光丰富PN通过与低光相比上调差异蛋白的基因表达水平[11].因此,低R/Fr可能是促进CO的信号2.通过增加光合能力的同化作用。因此,本研究旨在分析不同光强下大豆形态、碳水化合物和光合作用对低R/Fr的响应,并利用iTRAQ技术揭示不同光强下低R/Fr对大豆光合作用的影响。
结果
形态特征
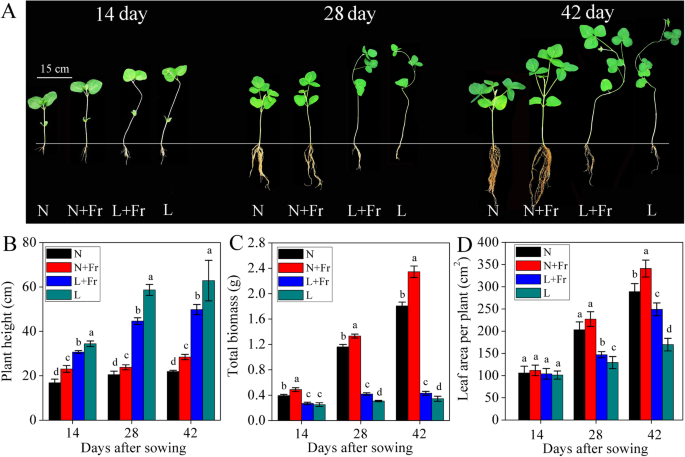
在正常光强和弱光强下,低R/Fr直接影响大豆的生长表型。1.一种)。在正常光强度下,N + FR处理中大豆的植物高度显着高于N处理中的植物高度。相比之下,与播种后42天的L治疗相比,L + FR处理中的植物高度降低了20.8%(图。1.b)。在播种14天后,在治疗中发现大豆植物的最高生物量值N + Fr和L + FR,即N和L.豆荚中的那些在常规光处理(N和N + FR)中始终产生最大的生物量对于低轻微处理的人(L和L + Fr)。在播种后42天,最大和最小总生物量为2.4和0.3g植物−1在N + Fr和L处理中。不同处理的生物量在播后14和28 d也有相似的变化趋势(图2)。1.c) 此外,在第14和28天,低R/Fr比率显著增加了单株叶面积 在正常光照和弱光照条件下播种后,不同处理的单株叶面积变化趋势与总生物量变化趋势一致(图。1.d) 。
叶绿体超微结构、蔗糖和淀粉含量的变化
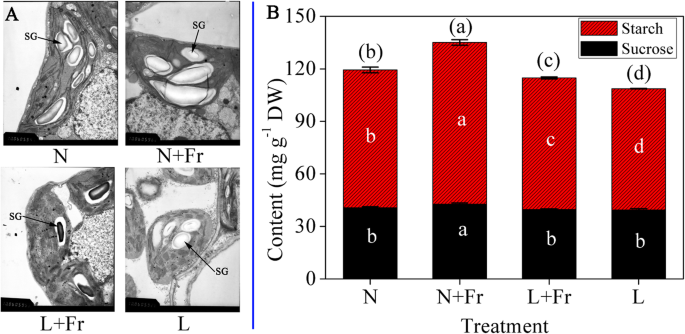
在不同光环境中生长时,叶绿体超微结构的变化不同,N和N + FR处理中的叶绿体大小大于L和L + FR处理中的叶绿体尺寸(图。2.a).淀粉粒度也呈现类似趋势。N + Fr和L + Fr处理的淀粉含量分别显著高于N和L处理。N + Fr处理淀粉含量最高为92.4 mg/g, L处理淀粉含量最低为69.2 mg/g。N + Fr处理的大豆蔗糖含量显著高于其他处理(图2)。2.b)。
PS II的叶绿素含量,光合作用和量子产量
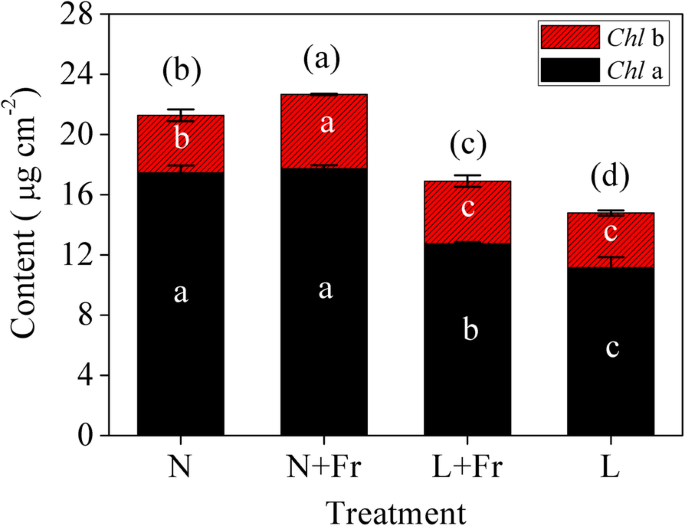
的背影A.的背影,B,且正常光条件下(N和N + Fr处理)总Chl显著低于弱光条件下(L和L + Fr处理)(图2)。3.).N + Fr和L + Fr处理(低R/Fr)的总Chl含量分别比N和L处理(正常R/Fr)显著提高6.5和14.3%。
4个处理PSII同化速率对光合光子通量密度(PPFD)和量子产量的光响应曲线如图所示。S1(数据引自我们以前的报告[9])。当PPFD高于200 μmol m时,4个处理的同化速率存在显著差异−2 s−1.光合速率的最大值(P最大限度)和光饱和点(LSP)在N + Fr处理中明显高于其他处理。P最大限度在N处理下的LSP分别比N + FR处理下的相应值低14.9和47.4%。相似地,P最大限度L组LSP较L + Fr组分别降低23.8和38.2%。的最小值P最大限度与其他处理相比,L处理出现LSP, CO为5.8 μmol2.M−2 s−1在318.2 μmol m−2 s−1, 分别。在该研究中,治疗中PSII的量子产量N和N + Fr在显着高于L和L + Fr处理中的含量。然而,与治疗L中的治疗相比,治疗L + FR增强了15.2%的PSII的量子产率。
大豆叶片蛋白质组学分析
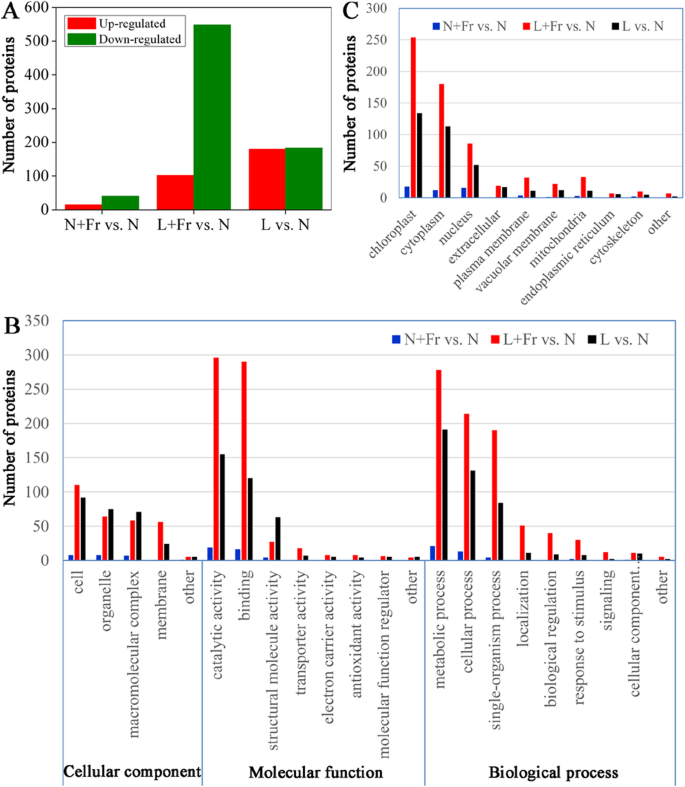
大豆叶的总蛋白质从不同的处理中提取,使用ITRAQ技术探索蛋白质谱。鉴定了总共9890个蛋白质基团,其中定量了7834个蛋白质(表S1).在>至少1.3-的基础上的fold change (P < 0.05), among the quantified proteins, we observed that 15 and 41 proteins were up-regulated and down-regulated, respectively in N + Fr vs. N; 102 and 548 were up-regulated and down-regulated, respectively under L + Fr vs. N, 180 and 183 proteins were up-regulated and down-regulated, respectively in L vs. N (Fig.4.一种)。
基于基因本体(Gene Ontology, GO)富集分析,将差异积累的蛋白分为生物过程蛋白、分子功能蛋白和细胞组分蛋白三大类(图1)。4.b) 生物过程和分子功能类别进一步分为三个子类别,分别代表细胞、代谢和单一生物体过程以及结合、催化和结构分子活性。亚细胞位置注释信息表明,在所有已鉴定的蛋白质中,ass相关叶绿体蛋白分别占L和N、L中独特蛋白的36.9%、39.1%和32.1% + Fr与N和N的对比 + 分别为Fr和N(图。4.C)。
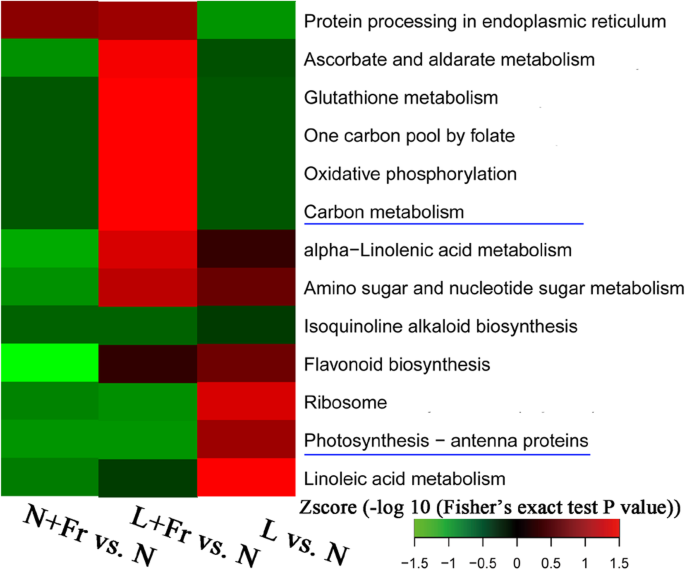
京都基因和基因组百科全书(KEGG) pathways visualized as heat map through a two-tailed Fisher’s exact test were used to identify the differences in protein abundance among L + Fr, N + Fr, N, and L treatments. Thirteen different functional categories were selected for analysis. As illustrated in Fig.5.,在功能类别中,C代谢和光合作用 - 天线蛋白与光合作用有关2.同化:参与光合作用的蛋白质 + Fr和L + 与N处理相比,Fr处理的蛋白质积累量下降,而L处理的蛋白质积累量上升。
大豆叶片光合作用同化反应的关键蛋白
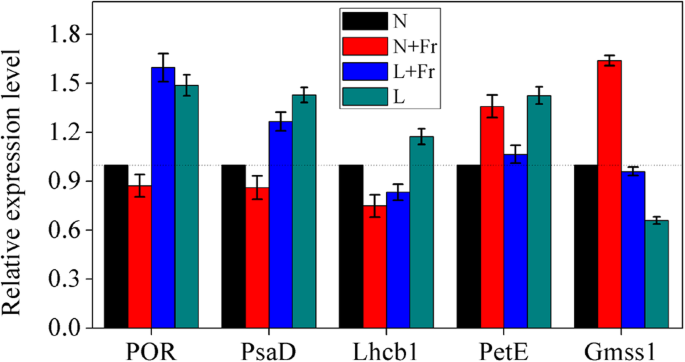
共有12个与光合作用有关的差异表达蛋白质2.氮胁迫下的同化作用通过iTRAQ分析检测 + Fr,L + 在这些差异表达的蛋白质中,一个与卟啉和叶绿素代谢有关,两个与PS I有关,四个与PS II有关,三个参与光合电子传递,两个参与光合作用淀粉和蔗糖代谢中的ved(表1.).的expression levels of nine proteins (i.e., Protochlorophyllide reductase [POR], Photosystem I subunit [PsaD], Chlorophyll a/b binding protein 1 [Lhcb 1], Lhcb 2, Lhcb 4, Lhcb 6, PetE, PetF, and Sus) were up-regulated under L treatment compared with N treatment. However, the expression levels of the two proteins (i.e., POR and Lhcb 1) in N + Fr treatment and two proteins (i.e., PsaH and PetH) in L + Fr treatment were down-regulated compared with those in N treatment.
实时定量聚合酶链反应(qRT-PCR)结果证实了差异表达蛋白
为了评估iTRAQ数据的有效性,我们根据RT-PCR分析的差异蛋白质分类,随机选择了6种基因产物,包括POR、PsaD、Lhcb 1、PetE和Sus基因表达水平(图。6.).QRT-PCR结果表明,在L处理下,与N处理相比,观察到POR,PSAD,LHCB 1和Pete的转录物水平显着增加。在L + FR处理下,POR,PSAD和PETE表达水平上调。相比之下,与N次处理下的那些相比,POR,PSAD和LHCB 1的表达水平下调了N + FR处理下。GMS1的变化与N + FR,L + FR和L处理中的POR不同。
讨论
在正常光照下,低R/Fr比显著增加大豆的茎伸长,而在低光照下则相反(图。1.a和b).在弱光条件下,光强相对于R/Fr比调节株高[9,27]然而,在相同的光照强度条件下,低R/Fr比率显著增加了大豆的总生物量和叶面积(图。1.C)。同样,天竺葵和氧化鲸树的全植物生物质随着额外的FR辐射(低R / FR比)增加(低R / FR比)增加[6.].
光合作用是物质积累的基础。低R/Fr比在正常或低光强条件下提高光合作用。类似于艾默生增强效应的相反[28,短波长的光合效率可以通过增加长波来提高。已经观察到,与直接影响光化学的PSll相比,PSll对较短波长的光作出反应,表现出兴奋[29].有趣的是,不同波长的光可以通过在退出PSL和PSLL中来补充彼此的效果[20.].此外,Fr减轻了PSI中电子流的受体侧限制,施加了供体侧限制,从而增加了氧化P700的比例。因此,P最大限度values in N + Fr and L + Fr treatments (high enrichment of Fr light) were significantly higher than those in N and L treatments, respectively. Although low light intensity significantly decreased the Chl content (ChlA.和B),在相同光照条件下,低R/Fr比显著增加单位面积Chl含量[16].叶面积、Chl含量和叶绿素含量的变化趋势PN与不同处理的总生物量一致(图。1.,3.,S1),从而指示低R / FR比值可以提高大豆中相同的光强度的光合能力。
在本研究中,在N + Fr和L + 在N和L处理下,Fr处理可以分别显著增加淀粉和蔗糖的含量。2.b).波长较短的光与远红光的互补负责在两个光系统之间建立激发平衡。这种激发平衡可能优化光化学和相对CO的速率2.同化[20.].不同处理的淀粉和蔗糖含量变化趋势相似PN、PSII的量子产量和总生物量(fig .;1.和2.) [9].此外,额外的Fr辐射对生菜和天竺葵光合作用和全植物净同化有促进作用[12,18].总之,这些结果提示FR光的高富集通过提高大豆叶片的光合能力可能有助于提高淀粉和蔗糖含量。
蛋白质组学是一种系统识别细胞或组织中表达的所有蛋白质的方法[30.].在这项研究中,我们主要专注于与光合作用相关的差异表达蛋白质(表1.)POR是调节叶绿素代谢的关键功能蛋白[29,31].与N处理相比,L处理下POR蛋白表达上调,而N + Fr处理下POR蛋白表达呈相反趋势(表1)1.).POR表达随着辐照下降而显着增加[32].我们之前的研究还发现,玉米遮荫或弱光可以提高POR蛋白的表达[11].qRT-PCR分析结果证实了POR对不同光强和质量的响应。6.).POR是光依赖性反应的阴性对照蛋白质,特别是对于光强度[33].虽然R/Fr比较低,但在相同光照条件下可提高单位叶面积Chl含量(图2)。3.), POR蛋白和基因表达呈相反趋势(表)1.;无花果。6.).该结果与单位有关(mg cm−2)的含量[11,34].
PS I的PsaD亚基是一种外周蛋白,为铁还蛋白提供对接位点,并与其他PS I亚基相互作用[35].PsaD对光环境高度敏感,高光强显著降低PsaD含量[36].同样,低光条件下PsaD蛋白和基因表达水平上调,因为PS II的高蛋白表达可以改善电子传递,从而增加了低光条件下PsaD蛋白的表达[11].低R/Fr比率(Fr光增强)可能逆转低光条件下PsaD蛋白的表达(表1)2.).这一发现与Fr光可以提高光化学和光合作用效率的结果相似[18].
捕光天线(LHCII)是与PS II相关的主要色素-蛋白质复合物,从而形成PS II-LHCII超复合物,其中几个LHCII围绕反应中心核心复合物[37].的LHCb的水平降低与用于LHCb的1,LHCb的2和4 LHCb的[A显著趋势光强度增加5.,6.,37].我们的结果与这些数据一致(见表)1.)类似地,蛋白质Lhcb 1和Lhcb 2的表达水平在过度辐射下降低[38].而L + Fr处理的Lhcb 1、Lhcb 2、Lhcb 4和Lhcb 6水平与N处理相比没有变化(R/Fr较低)。在Lhcb 1的基因表达中也发现了类似的结果(图。6.).这些结果表明,在较短的波长下,增加Fr光波长(低R/Fr比)可以提高光合效率。Ahmadova和Mamedov [39表明光子的低能量在光化学过程中起着重要的作用。
PetE是氧光合生物中参与循环和线性电子传递的低分子量蛋白质之一。它催化电子从膜结合的Cyt b6/f复合物转移到P700 [40].PetH是PetF的氧化还原伙伴蛋白,PetF是一种依赖光的电子转移蛋白[41].这些蛋白质对光环境高度敏感。弱光条件下可上调PetE和PetF的表达(表)1., 无花果。6.).PETE和PETF蛋白趋势的变化与低光条件下的LHCB 1,LHCB 2,LHCB 4和LHCB 6蛋白的变化类似。可能发生这种现象,因为与正常光线相比,通过在低光中的相对蛋白质增加的腭堆叠的程度改善了光捕获和电子传输(表1.) [42].然而,低R/Fr比率(N + Fr和L + 与正常R/Fr比率(正常光照)相比,Fr处理几乎不影响PetE和PetF的表达水平。这一结果与我们之前的研究结果相似[11].不同处理下PetH表达的变化与PetF表达的变化不同(表)1.),因为Peth是蛋白质 - 蛋白质相互作用反应的速率控制蛋白,因为Peth和Petf作为电子转移伴侣(冈田,2009)。这一发现可以解释为什么叶绿素A / B将蛋白质结合在低光中但是PN与其他处理相比减少(图。S1).
叶淀粉和蔗糖代谢进展也受轻环境的影响(图。2.) [43].SS表达水平在L和L + FR处理下显着上调(表1.).然而,在L和L + Fr处理下,Gmss1的基因表达呈现相反的趋势(图)。6.).同样,在弱光条件下,蔗糖水平首先下降,这是由于蔗糖合成酶(即SPS和SS-s)活性下降[44].这些结果可能与同一蛋白在不同处理下的基因和蛋白表达水平不同有关。
结论
这些结果表明,在相同的光照强度下,低R/Fr比(高Fr光浓度)可以提高光合CO2.通过提高光合能力的同化作用。
方法
植物材料及处理设计
以我国西南地区农业生产中与其他作物紧密种植或间作的主要大豆品种南豆12为试验材料。大豆种子由四川省南充农业科学研究所提供。所有大豆种子在30℃下用湿滤纸覆盖24 h。然后,将发芽的大豆种子放入间隔为10 cm的容器中培养。每个容器高15 cm,长40 cm,宽20 cm,容器内填满湿润的有机土壤。
实验分为两个部分。一个部分被用于形态学测量。包括发芽的种子容器直接放置在不同的环境光的治疗,并且每个治疗包括三个容器。
用于生理和蛋白质组分析的其他部分。各种光环境下在大豆生长周期之差是由正常的环境条件下生长的大豆避免,直到第一三叶叶子的全面发展。然后,植物只是第二三叶的外观后进行四种不同的光的治疗方法。Furthermore, after 15 days of treatments, all samples were collected at 10 am for the analysis of physiological parameters and differentially expressed proteins. Plants were grown in growth chamber with natural solar radiation, with the temperature maintained at 25 °Cin the day and 20 °C during the night. Additionally, the humidity was maintained at 60%, and plants were irrigated with nutrients solution (0.2% Hoagland’s solution) after every couple of days [45].
根据我们之前的了解,使用黑色尼龙纱布和远红(Fr) led [9],控制大豆遮篷中的PAR和红色遥远的红竞争。大豆冠层的FR光的强度为5.98±0.14μmol·m−2·年代−1在黑暗的条件下,在晴天中午测量大豆冠层的PAR和光谱辐照度,每个测量重复五次,使用以下四种处理(表)2.正常光,普通光加FR光,低光,低光加远红光。在三个不同的生长室中重复三次处理。使用Li-19Sa量子传感器(Li-Cor公司,Lincoln,NE,美国)和光纤光谱仪(AsvPE-2048;Avaves,荷兰)测量PAR和光谱辐照度。排在第10位 分别位于大豆冠层上方[7,9]。
形态特征
从土壤表面到大豆生长点的植株高度。在播后14 d,每14 d测定5株大豆幼苗的生物量和叶面积。使用平板扫描仪(CanoScan LiDE 200,佳能公司,日本)扫描叶片,叶面积(cm2.)由Image J 1.45 s测量。生物量样品在105°C下过度干燥0.5 h以停止组织的代谢过程,然后在80°C下干燥72 h至恒重[9].
叶绿体超微结构
正如杨等人之前发表的[11将二叶三叶的叶片(2mm × 2mm)置于4℃3%戊二醛中,1%四氧化锇处理。然后将大豆叶片固定片段脱水,分别用分级丙酮系列和Epon812包埋。半薄切片染色后用钻石刀切割。然后用醋酸盐和柠檬酸铅对样品进行染色,透射电镜观察;日本日立h - 600 - iv)。
蔗糖和淀粉的测定
将叶片样品在105℃下过滤0.5小时以停止组织的代谢过程,然后在80℃下干燥24小时至恒重。根据Lee等人的方法。(2020)有一些变化[45],通过均质化在5ml 80%(v / v)乙醇中,从0.5g干燥样品中萃取可溶性糖。在水浴中加热匀浆后,通过以3500g离心10分钟除去不溶性级分。沉淀物均质化并再次离心。合并上清液,然后用80%乙醇稀释至25ml。对水解的样品进行离心,仅收集少量(100μL)上清液并加入100ul 30%氢氧化钾溶液,然后沸腾,约10分钟。冷却溶液,加入蒽酮试剂。在40°再加热溶液15分钟后,使其冷却,并在620nm处检查吸光度。使用蔗糖的标准溶液计算量。通过加入2ml水,将剩余的材料被离心管用于淀粉萃取。然后,将管置于沸水浴中15分钟。 After cooling, 2 ml of 9.2 M perchloric acid (PCA) was added. After stirring for 15 min, the supernatants were collected after centrifuging the contents at 3500 g for 10 min. The residues were re-extracted two times with 2 ml of 4.6 M PCA. After centrifugation, the supernatants were combined, volumes were made to 50 ml with water. Starch was determined colorimetrically using the phenol-sulphuric acid method, as described by [46].
PSⅡ的光合作用、光合色素浓度和量子产率
正如Yang等人所描述的[2.],选择第二片三叶叶叶,使用Li-6400便携式光合作用系统(美国东北林肯市Li-COR公司)测量光合特性,环境温度25℃ °C和a CO2.Concentration of 400 μmol mol−1从九点到十一点。11个光强等级(0、20、50、100、150、200、400、600、800、1000和1200 μmol m−2 s−1)。在光响应曲线上,PPFD位于水平轴和PN在纵轴上(PN-PPFD曲线)。的P最大限度然后使用Yang等人提出的方法估计LSP。[11].使用CI Imager叶绿素荧光成像系统(technica Ltd., Colchester, UK)获得叶绿素荧光参数。每次测量前,我们将每个处理的大豆叶片置于黑暗条件下10分钟。光化照度(750 μmol m−2 s−1)打开,并在20秒时施加饱和脉冲 每隔15分钟休息一次 最小值。从这些值中,最大荧光(F'M)和稳态荧光(Fs)在轻微条件下确定。根据公式计算光系统II的量子效率(F'M-Fs)/F'M[9].
在那之后,四个15的叶盘 从每片叶子的中心获得毫米直径,然后切成3片 嗯。这些叶盘放在10个盒子里 在20℃下,在黑暗中添加80%丙酮ml 24摄氏度 h、 叶绿素含量是按照先前公布的程序测定的[34].每个处理准备3个重复。
蛋白质提取,消化和ITRAQ标签
处理2周后,用液氮研磨大豆植株的第二叶片。遵循Yang等人的方法[11[然后将粉末移至离心管。借助高强度超声波处理器(Scient),在冷条件下使用裂解缓冲液和1%蛋白酶抑制器鸡尾酒来破碎。剩余的是离心。使用15%TCA在-20℃下使用15%TCA,在冷下沉淀蛋白质。在4℃下离心后,处理蒸馏物,使用冷丙酮冲洗三次沉积物。然后通过将蛋白质溶解在缓冲液中来测定蛋白质浓度。在黑暗中,在室温下在室温下使用20mM IAA来进行蛋白质溶液的还原和烷基化45分钟。然后使用100mM TEAB用于稀释蛋白质样品。最后,为了消化蛋白质,使用胰蛋白酶与蛋白质的比例加入胰蛋白酶。用每个样品中的胰蛋白酶消化约100μg蛋白质以进行进一步实验。 For iTRAQ labeling, peptides were desalinized with the help of Strata X C18 SPE column (Phenomenex), vacuum-dried, replenished in 0.5 M TEAB, and then operated using 4-plex iTRAQ kit manual instructions.
HPLC分馏和LC串联质谱(MS / MS)分析
如前所述[11[高pH反相HPLC通过使用Agilent 300延伸C18柱将样品分成级分。通过真空离心脱水后,将肽溶解在0.1%甲酸中并加载到反相分析柱上(赞美薄膜RSLC,Thermo Scientific)。Easy-NLC 1000 UPLC系统用于以350nl / min的恒定柱流速进行梯度洗脱。然后使用orbitrap Fusion TM Tribrid TM质谱仪(Thermo Fishific)分析所得肽。
数据库搜索和分析
使用整合的Andromeda搜索引擎(v.1.5.2.8) MaxQuant处理MS/MS数据。采用iTRAQ 8-plex进行量化,选取MaxQuant中所有其他参数的默认值,如Yang等[11].为了确定下调或上调的蛋白表达,我们使用0.77倍或1.3倍截断与aP分别为< 0.05。GO注释用于注释蛋白质[23].差异积累的蛋白质也被分配到KEGG数据库[47,48].
qRT-PCR验证
通过qRT-PCR方法验证了蛋白质组学的可靠性。按照Yuan等的方法进行RNA分离[49]在我们的研究中,以β-微管蛋白基因作为参考对照。在CFX96系统机器(美国Bio-Rad)上进行RT-PCR。表中列出了使用的引物S2.
统计分析
使用基于计算机的程序SPSS(16.0版)使用单向ANOVA计算意义(16.0版)。数据作为平均值±标准偏差为三个重复。统计显着性得到了认可P< 0.05。
可用性数据和材料
本研究中使用和分析的数据集可从通讯作者处获得。
缩写
- chl:
-
叶绿素
- 去:
-
基因本体论
- iTRAQ:
-
等压标签用于相对和绝对量化
- 记:
-
京都基因和基因组百科全书
- LSP:
-
光饱和点
- PN:
-
净光合作用速率
- P最大限度:
-
光合速率最大值
- qRT PCR:
-
实时定量聚合酶链反应
- R / Fr:
-
红/远红比
- 票面价值:
-
光合有效辐射
- POR:
-
原叶绿素还原酶
- PPFD:
-
光合光子通量密度
- PS I:
-
光系统I
- 注2:
-
拍照II
参考文献
- 1.
袁海英,王志强,王志强。栽培扁豆和野生透镜体种质对红远比和光合有效辐射差异的开花和生长响应植物学报。2017;8:386。
- 2.
杨飞,廖丹,吴旭,高锐,范勇,马瑞莎,王旭,永涛,刘伟,刘金金fcr:玉米-大豆间作系统地上、地下互作对作物产量的影响。2017、203(完成):16-23。
- 3.
冯艳,王旭,廖冬,陆峰,高锐,刘伟,永涛,吴旭,杜军,姜丽佳:玉米-大豆连作模式对产量的影响[J] .作物学报,2015,38(1):97 - 101。
- 4.
Gelderen KV,康C,Paalman R,Keuskamp DH,Hayes S,Pierik RJPC:拍摄中的远红光检测通过HY5转录因子调节横向根部开发。2018:TPC.00771.02017。
- 5.
Ballaré CL, Pierik RJPC,环境:避荫综合征:多重信号和生态后果2017,40。
- 6。
公园Y,朗克尔ESJE,植物学E:41-49:远红辐射通过增加叶片扩展和全株净同化2017年,136促进苗的成长。
- 7。
冯Y,山H,高R,刘W,勇T,王X,吴X,杨WJFCR:大豆幼苗在继电器带状间作相对于系统的光量和红色的增长:远红比率到2014年,155(155):245-253。
- 8。
王志强,王志强,王志强,等:植物对遮荫环境的适应性研究进展[j] .应用生态学报,2012,30(5):537 - 541。
- 9.
杨飞,范勇,吴旭,程艳,刘强,冯丽,陈杰,王志强,王旭东,杨飞:生长素与赤霉素比值对大豆生长和物质分配的影响。
- 10。
李涛,刘丽娜,姜春东,刘玉军,史丽锦:互遮荫对大田高粱光合调节的影响[j] .作物学报,2014,137(8):31-38。
- 11.
冯y,feng l,liu q,吴x,粉丝,拉扎ma,cheng y,chen j,wang x,yong tje等遮荫条件下光强与红远红比互作对大豆叶片光合作用的影响2018,150。
- 12.
植物学报,2018,36(4):592 - 598。
- 13.
Demotes-Mainard S, Péron T, Corot A, Bertheloot J, Gourrierec JL, Pelleschi-Travier S, Crespel L, Morel P, Huché-Thélier L, Boumaza RJE等:植物对红色和远红灯,2015,309的园艺应用的应用。
- 14.
史密斯H,。%J Nature:植物植物和光信号感知 - 一种新兴合成。2000,407(6804):585-591。
- 15.
Wherley BG,Gardner DS,Metzger JDJCS:高杂草光致光学,受光谱组成和光强度2005,45(2):562-568的变化影响。
- 16.
Razzak Ma,Ranade Ss,Strandå,García-gil MRJPC,环境:苏格兰松树幼苗的差异响应,可变强度和r和Fr光的比例2017,40(8):1332。
- 17。
McCree Kjjam:作物植物中光合作用的动作谱,吸收率和量子产量。1971,9(71):191-216。
- 18。
Zhen S,Iersel MWVJJOPP:有效的光化学和光合作用需要远红光。2017,209:115-122。
- 19。
两种光化学系统在光合作用中的作用与鉴定。1962、64(2):243 - 260。
- 20。
王磊,梁伟,邢军,谭飞,陈艳,黄磊,程超,陈文杰:盐胁迫下红树秋茄叶绿体蛋白质组动态变化研究(英文)[J] .浙江农业学报,2013,12(11):5124-5136。
- 21。
邓旭,刘艳,徐旭,刘东,朱刚,闫欣,王智,闫玉飞:水分亏缺条件下小麦旗叶与发育籽粒蛋白质组比较研究2018,9。
- 22。
张克,刘H,宋j,吴W,李克,张吉布布:由于增强无机磷酸盐回收2016,16(1):129,揭示玉米突变体中低磷酸盐耐受性和增强的光合作用揭示了低磷酸盐耐受性和增强的光合作用。
- 23.
王磊,曹H,陈聪,岳聪,郝X,杨Y,王晓乔:叶绿素缺乏茶树品种的互补转录组学和蛋白质组学分析揭示了多种代谢途径的变化2016,130:160–169。
- 24.
吴玉山,杨F,龚W,艾哈迈德S,范Y,吴晓玲,勇T,刘伟,舒克,刘JJJoIA:不同大豆基因型在套作系统中的遮荫适应性响应和产量分析2017,16(6):1331-1340。
- 25.
Tacarindua CRP,Shiraiwa T,Homma K,Kumagai E,Sameshima RJFCR:在温度梯度腔室2013,154:74-81的温度梯度腔室中种植温度提高的影响和大豆产量的影响。
- 26.
龚武,蒋聪,吴勇,陈华,刘伟,杨文杰:大豆的两种策略:容忍与回避(甘氨酸最大)幼苗以反应间作的阴影。2015,53(2):259-268。
- 27.
高默斯CMM, Visser EJW, Onge KR, St, Voesenek LACJ, Ronald PJTiPS:遮荫:当长高不是一个选项时2013,18(2):65-71。
- 28.
李志强。小球藻光合作用量子产量与光波长度的关系[j] ., 1943, 30(3): 165-178。
- 29。
周H,Yu Z,YE ZJSH:在开发过程中使用ITRAQ蛋白质组学技术与桃皮类有关的关键蛋白质。2018,239:123-132。
- 30.
叶绿体蛋白质组学:潜力与挑战。2004年,55(400):1213 - 1220。
- 31。
Heyes DJ, Hunter CNJTiBS:使酶催化轻松工作:原叶绿素氧化还原酶。2005年,30(11):642 - 649。
- 32。
Bennett J, Schwender JR, Shaw EK, Tempel N, Ledbetter MC, Williams RSJBeBA:玉米叶片未能适应低光照。原叶绿素还原酶在调节5种叶绿素结合蛋白水平中的作用1987,892(1):118-129。
- 33。
Forreiter C,Van Cleve B,Schmidt A,Apel KJP:Anuiosperms 1991,183(1):126-132中的NADPH-蛋白氯化物氧化酶的一般光依赖性阴性控制的证据。
- 34。
叶色素含量与光谱反射率之间的关系在不同的物种、叶结构和发育阶段。2002、81(2):337 - 354。
- 35.
光系统I的PsaD亚基(基本结构域突变降低膜中PsaD水平)。1997、115(4):1699 - 1705。
- 36.
Nama S,Madireddi SK,Devadasu Er,Subramanyam Rjjop,B-Biology P:高光诱导的组织,蛋白质概况和光合机械的功能变化,在Chlamydomonas Reinhardtii 2015,152:367-376。
- 37.
高光诱导水稻光合机制的组织结构、蛋白质结构和功能的变化衣藻reinhardtii.2015、152 B (Pt): 367 - 376。
- 38.
光系统II (LHCII)主要光吸收复合物结构的三聚体亚基(trieric subunits)水平的变化及其异构体(isoforms), 2012, 50(1): 8-14。
- 39.
远红光下光系统II中酪氨酸自由基的形成。2018、136(1):93 - 106。
- 40.
在Δ petE突变体中,psi依赖的循环电子流能力的限制降低了聚胞球菌PCC 7942细胞对铁胁迫的适应能力☆.2012,1817(8):1277-1284。
- 41。
Okada KJB,通信BR:PetH在与光系统II的超分子复合物的组成部分PetH和光依赖性电子转移蛋白PetF之间的相互作用中控制速率。2009,389(2):394–398。
- 42。
辛师九,鑫W,惠源G,Lei S,WAH很快CJPP:叶子解剖结构的系统调节,光合性能和高粱高耐光性2011,155(3):1416-1424。
- 43。
Gupta Ak,Kaur Njjob:糖信号和基因表达与植物中非生物胁迫下的碳水化合物代谢相关。2005,30(5):761-776。
- 44。
杨L,陈军,孙X,李江,陈N:在叶和甜瓜果实蔗糖和半乳糖,蔗糖低聚糖代谢的抑制(Cucumis Melo.在弱光胁迫下。Sci Hortic-Amsterdam。2019; 244:343-51。
- 45。
李H,李BR,伊斯兰山,拉VH,公园SH,Bae DW,金TH。激素和糖反应的品种差异表明,再生早期脱落酸反应的蔗糖韧皮部负荷是种子产量的重要决定因素芸苔属植物显著.Environ Exp Bot。2020; 169:103917。
- 46。
陈志强,陈志强,陈志强,等:比色法测定糖及相关物质的研究进展[j]。
- 47.
Kanehisa M, Sato Y, Kawashima M, Furumichi M, Tanabe MJNAR: KEGG作为基因和蛋白质注释的参考资源2016,44(数据库期):D457-D462。
- 48.
袁S,张ZW,郑C,赵ZY,王Y,冯利,牛GQ,王CQ,王JH,冯H,等.拟南芥隐色素1在开花的氮调节中的作用.美国自然科学杂志.2016;113(27):7661-6。
- 49.
Hoagland博士,Arnon DIJCaesc:在没有土壤的情况下种植植物的水培方法。1950、347(5406):357 - 359。
致谢
我们感谢京杰邓邓邓邓邓邓 - Biolab(杭州310018,中国),有限公司赋予差异表达蛋白质分析的建议。
资金
国家自然科学基金资助项目(No. 31571615);CARS-04-PS19)。资助机构为这项研究提供了资金支持,包括实验实施、抽样和数据分析。
作者信息
隶属关系
贡献
FY、QL、YC进行实验;LF、XWu和YF做了一些实验;FY、MAR、XW、TY、WL、JL、JB、KS、WY构思原始研究方案;FY和WY对实验进行了设计,对实验数据进行了分析,并撰写了论文。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
道德认可和参与同意
不适用。
同意出版
不适用。
竞争利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
Springer Nature在公布的地图和机构附属机构的管辖权主张方面保持中立。
补充信息
附加文件1:图S1。
不同处理下大豆叶片净光合速率(A)、光饱和点(B)和PSII (C)的光响应曲线N、N + Fr、L + Fr、L分别表示正常光(正常PAR和正常R/Fr比)、正常光加远红光(正常PAR和低R/Fr比)、低光加远红光(低PAR和低R/Fr比)、低光(低PAR和正常R/Fr比)。P最大限度LSP表示最大光合速率和光饱和点。数据以三次重复的平均值±标准差表示。其次是不同字母的手段显着不同P= 0.05。
附加文件2:表S1
.差异表达了独特蛋白质的统计数据。
附加文件3:表S2
.用于表征的引物清单甘氨酸最大基因。
权限
开放获取本文根据知识共享署名4.0国际许可证获得许可,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者适当的信任和来源,提供到知识共享许可证的链接,并说明是否进行了更改。本文中的图像或其他第三方材料包括在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包括在文章的知识共享许可证和法定法规不允许我们的预期用途或超出允许用途,您需要直接获得版权持有人的许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
杨,F.,刘,Q.,程,Y。等等。低红/远红比值作为信号,通过增加光合能力促进大豆幼苗的碳同化。BMC植物杂志20,148(2020)。https://doi.org/10.1186/s12870-020-02352-0
已收到:
认可的:
出版:
关键词
- 轻质质量
- 间作
- 大豆
- 遮荫
- 光合作用
- 一氧化碳2.同化