- 研究文章
- 开放获取
- 发布:
八倍体草莓'圆波普叶中的水杨酸 - 灌注反应响应诱导抵抗podosphaera aphanis.通过增加原花青素的积累和致病相关基因的上调
BMC植物生物学体积20., 文章编号:149(2020.)
摘要
背景
podosphaera aphanis.,一种主要的生物养真菌病原体,导致草莓的显着产量损失。中国是世界上最大的草莓生产国,选择耐粉状耐用品种。但是,阻力机制反对P. Aphanis.在八倍体草莓中仍不清楚。
结果
为了了解抗病抗性的可能机制,我们接种了草莓叶P. Aphanis.,并在两组草莓叶片中检测候选基因的表达谱和生化表型。从ddH中获得的unigenes2O-和SA-Preatered叶片分别导致总共48,020和45,896个基因。Kegg富集表明,苯丙醇化生物合成和植物激素信号转导途径富集至明显的程度。DEG分析表明,与SA信号通路相关的关键TFS基因可能在草莓中发挥重要作用 -P. Aphanis.交互。特别是,Fawrky70.,FaJAZ1和Famyc2样,参与调节SA和JA信号通路的拮抗作用,导致SA响应基因的表达增加(特别是PR1,PR2,PR3,PR5),与ja应答基因表达下降(FaJAR1,FaAOS,FaLOX2).此外,通过激活MBW复合物并抑制粉状霉菌生长,SA预处理诱导PA的积累。
结论
本研究描述了对调节模型中的原花青素(PAS),病因相关(PR)基因,SA和转录因子的作用P. Aphanis.,它恰逢早期的防御激活,导致PAS和PR蛋白的积累。
背景
植物已经进化了免疫系统,以防御各种致病微生物,这依赖于通过病原体相关的分子模式触发和效应引发的免疫识别潜在的效应症[1]:防御机制包括氧化破裂、细胞壁增强、致病相关蛋白(PR)的产生和渗透部位的快速超敏反应(HR) [2].粉状霉菌(PM)是大多数植物的广泛真菌疾病,由Ascomycet引起[3.],这是强烈的生物养殖真菌,可形成营养素的吸收。超过400个PM物种殖民占近10,000个子植物物种[4],包括单子叶植物和双子叶植物[5].之前的植物PM研究专注于参与信号途径和次生代谢物的主要抗性基因,特别是在经济上重要的作物,如番茄,大麦,苹果和小麦以及参考物种中拟南芥[6].因此,研究分子抗性机制对提高经济作物的品质和产量具有重要意义。
新的证据表明,植物激素,特别是水杨酸(SA)、茉莉酸(JA)和乙烯(ET)信号通路调节植物对各种病原体的防御[7].在生物营养病原体攻击时,内源性SA的积累诱导多种PR基因的表达,增强抗性。SA-和JA/ et介导的防御途径通常是相互拮抗的[8].当SA水平升高时,NPR1低聚体解离成单体,进入细胞核并与TGA转录因子(TFs)相互作用[9[TGA - 相互作用的戊二酮480(GRX480),其调节SA / JA拮抗作用[10].WRKY70也是致病相关蛋白(PR1)表达所必需的,是SA/JA拮抗的关键调控因子[11].在拟南芥, sa介导的防御对生物营养体起着至关重要的作用,而JA/ET则防御坏死营养体[12].参与SA-JA串扰的同源基因包括NPR1、WRKY70、GRX480、MYC2和JAZs [13].SA/JA途径拮抗作用与其他植物激素(如ET和赤霉酸)相互作用,调节生物营养和坏死营养之间的平衡。
八倍体草莓(Fragaria×ananassa.)是一个常年的植物属于蔷薇科[14].草莓在中国广泛种植,是无性繁殖。podosphaera aphanis.是草莓的一种生物营养真菌病[15],造成相当大的生产损失,并被认为是最具破坏性的疾病之一。由于日本品种(尤其是Benihoppe衍生的新品种)的大规模推广和冬季温室适宜的环境条件,白粉病在我国已成为严重病害[16].尽管八薄草莓的总基因组序列信息可用[17,它的防御机制P. Aphanis.在分子水平仍然澄清。转录组分析表明,与次生代谢,信号转导,信号转导和抗病性的差异表达基因(DEGS)上调,并在早期防御中发挥了至关重要的作用P. Aphanis.[18].此外,对二倍体草莓的候选基因进行了功能鉴定,为研究草莓抗病性提供了依据P. Aphanis.,包括FvHsfB1a[19],FvMLO[20.], 和FVWRKY42[21].八薄草莓中PPMLO1赋予抗性的反义表达P. Aphanis.,表明基于mlo的抗性机制在草莓中起作用[22].异位表达AtNPR1二倍体草莓表现出增强的抗性P. Aphanis.,表明NPR1赋予广谱疾病抗性[23].过度的AtELP3和AtELP4在二倍体中,草莓具有增强的抗病性P. Aphanis.,建议elp.基因可能产生抗PM的能力[24].我们对抵抗抵抗的理解的最新进展P. Aphanis.已经揭示了它是多基因和数量遗传的[25].尽管有这些努力,但很少的研究专注于八倍体草莓的分子抗性机制。大多数研究专注于应用研究,特别是在实践中使用的农药。对疾病控制的密集使用可能对环境和人类健康有害[26].因此,研究八倍体草莓的抗病机制是近年来研究的热点P. Aphanis..
在这项研究中,我们首先研究了分类的荧光参数和萌发百分比以确定感染时间。接下来,我们在两组的不同感染阶段分析了叶片的转录组(DDH2O-treated和SA-treated)。KEGG结果表明,DEGs主要参与苯丙素、类黄酮的生物合成和激素信号转导。此外,我们还检测了总黄酮含量(TFC)、PAs和SA含量的动态变化规律。进一步分析系统发育树和保守序列,找出高度同源的蛋白,通过转录水平比较分析这些关键基因之间的相关性。我们的研究结果为草莓八倍体对草莓的防御机制提供了深入的分子水平P. Aphanis..SA、PAs、TFC和信号分子也是SA诱导抗性的潜在调控化合物P. Aphanis..本研究是第一个表征抵抗的抵抗机制P. Aphanis.在八倍薄纸草莓中。
结果
叶动力学响应P. Aphanis.
在温室环境中测定了接种后荧光参数和形态的变化P. Aphanis..10月自然日光照仅8 ~ 9 h/d。实验期间,白天温度约18-28°C,夜间7-14°C,相对湿度约39-58°C,夜间91-95°C(图)S1).Dodgson et al.,(2007) 97-100%的相对湿度是酵素萌发的最适温度,15-25℃是酵素萌发的最适温度,20℃是酵素产孢的最适温度[27].因此,温室内的温度和湿度适宜p . aphianis发芽。
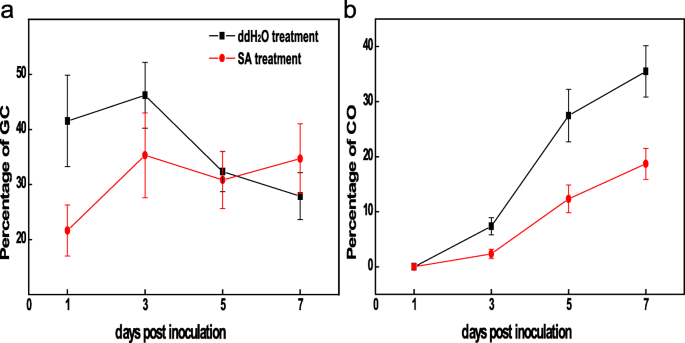
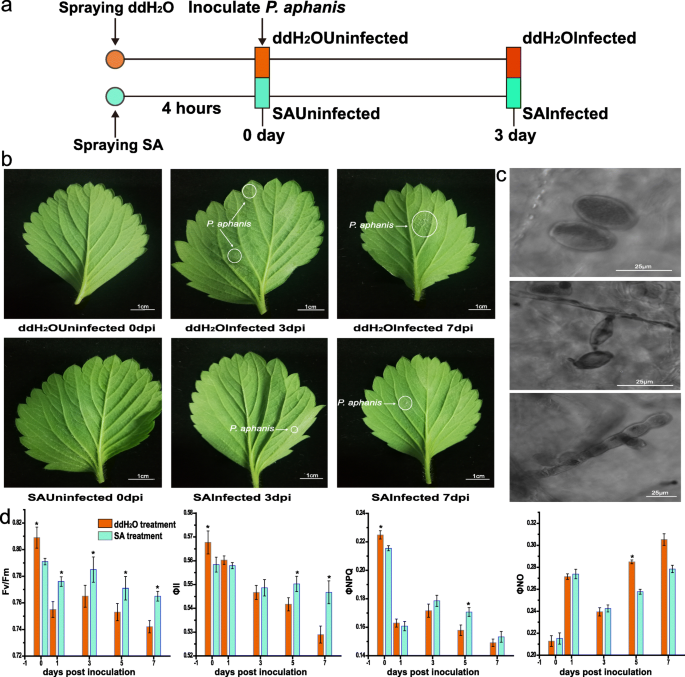
响应叶片阻力P. Aphanis.,分生孢子萌发率P. Aphanis.在整个实验期间进行记录(图3)。1).在两组中,在3 dpi的叶子上开始出现在叶子上的视觉症状(白菌丝体菌丝体),两组之间观察到明显的差异(DDH中存在较大的疾病区域2O处理比SA处理好)。而在ddH中,广泛的定植发生在叶片上2O组在7dpi时,SA组仅观察到少量限制性定植(图。2b).的发展阶段P. Aphanis.也使用显微镜观察(图。2C)。
用水杨酸(SA)预处理减少了殖民化面积p . aphains在草莓的叶子里。一个实验轮廓。年轻的草莓叶被喷洒用蒸馏水和sa。4小时后,接种来自每组的植物子集p . aphains.分别在0 dpi和3 dpi时采集10株植株的叶片P. Aphanis.接种。b进展的摄影记录P. Aphanis.用ddH处理草莓叶的感染2在接种后的不同时间点(0,3和7 dpi),o或sa。酒吧= 1厘米。cP. Aphanis.在不同的时间点的草莓叶上的分析萌发。d草莓叶片对侵染反应的时间历程P. Aphanis..叶绿素荧光参数的变化Fv/ F米,φ.2,φ.NPQ,φ.不在接种P. Aphanis..在接种后(DPI)的0,1,3,5和7天拍摄测量。Fv/ F米在初始暴露于饱和光脉冲之后,确定了20分钟的黑暗适应的叶子。所有值表示为平均值±标准误差;N = 3 forFv/ F米,φ.2,φ.NPQ,φ.不测量
为进一步确定最佳采样时间,两组感染的叶绿素荧光参数P. Aphanis.被发现(图。2d)。Fv/ F米是光合作用初始部分的状态,并反映了应力下的植物程度。φ.PSII为实际PSII效率,反映当前光合机制的实际光能转换效率。φ.NPQ为通过调节光保护机制以热量的形式散失的能量,若该值较高,说明植物具有较高的光保护能力。φ.不是热和荧光能量的被动耗散,表明在过度光线下的自我保护能力丢失。两组均跌幅下降Fv/ F米比率在1dpi时增加,在3dpi时增加,随后持续下降Fv/ F米值从3到7 dpi。的Fv/ F米SA组的比值高于ddH组2o组从1到7 dpi,并在相应的时间点吻合视觉症状(图。2d)。φ.PSII在实验过程中表现出不断下降;φ.PSII和φ.NPQSA组高于ddH2o组从3到7 dpi。与此相反Fv/ F米,φ.PSII,φ.NPQ,φ.不在DDH.2在5 ~ 7 dpi范围内,O组高于SA组。较低的Fv/ F米值通常与较高相同φ.NPQ值,表示降低PS光化学效率的耗散过程。Fv/ F米ddH值较低2oinfected比在sainfected中,表明造成的光系统II损坏p . aphains在3 dpi。而在值上无显著性差异φ.不在两种处理之间预期5 dpi(图。2d)感染P. Aphanis.,减少Fv/ F米,φ.PSII,φ.NPQ在第3天检测到,这与明显症状的出现一致。因此,这些分化表型(3 dpi)被用于转录组分析。
草莓叶片转录组的变化P. Aphanis.
确定草莓在响应P. Aphanis.,在12个样品上进行RNA测序(RNA-SEQ)分析(DDH2OINFETED,DDH2ouncatech,SAINFECTED和SALOFETECT,每处理三重复)(图。2一种)。总共获得了大约6亿根的原始读数,清洁读数被映射到f . ananassa_Camarosa基因组(表S1).用DEGs的FPKM值计算ddH的fold changes2OInfected / ddH2oouncted和sainfected / saunfreated。原理分析(PCA)显示PC1和PC2可以解释总转录表达水平方差的64.40%,其中PC1根据基因型解释了总检测变化的50.96%,而PC2根据治疗分离样品,并解释了12%方差(图S2).对于来自SainFected和Sauninfed基因型的样品,PC2对PC2具有更大的分离,表明SA预处理期间的转录分化较强。
在两组中,ddH草莓叶片中分别表达了48,020个转录本和45,896个转录本基因2OInfected / ddH2在未受感染和sainfated / saufated的叶片中,共有43,103个基因在ddH中表达2OInfected / ddH2oounifected叶子,2770个基因仅在DDH中表达2oounifacted叶片和2147个基因仅在DDH中表达2OInfected树叶。而sainfated / saunifated有41,939个共同表达的基因,1755个基因仅在saunifated叶片中表达,2202个基因在sainfated叶片中表达(图)S3.a).根据p-adjust < 0.05和|log2FC|≥1,ddH共检测到4417和3754个DEGs2OInfected / ddH2分别为未分化和sainfated / saufated叶片。如图所示S2与2110在DDH中,在SainFected / Saunfected叶片中上调AB,2224个基因的抑制2OInfected / ddH2未受影响(log2FC≥1为上调)。相比之下,ddH中更多的基因是下调基因2OInfected / ddH2未受影响(2088)相比于受sainfconnected / saunfconnected叶片(1530)(下调时log2FC≤−1)。然而,通常有921个基因在两个时间点表达。ddH中有1476个基因表达上调2o治疗,上调1565个基因在SA治疗中,DDH中的1801个基因下降2o治疗,在SA治疗中下调1268个基因)在这两个组中都很明显,表明对响应的次数P. Aphanis.(图这种差别很大。S3.d)。基于桦树聚类,在草莓期间,以可区分的表达模式识别了总共20种表达型材集群 -P. Aphanis.DDH中的互动2o和sa治疗(图S3.e).白粉病感染导致两种ddH转录本的快速上调或下调2o治疗(簇1,4,6,3和5)和SA处理(簇1,4,6,2,3和5),表明涉及真菌反应的转录物。Cluster7,Cluster8,Cluster9和Cluster10显示了两种治疗的不规则变化。一般来说,结果表明DDH中的次数2o与SA治疗相比,延迟治疗。
20个富集的氧化石墨烯项主要分为生物过程和分子功能(图)S4ab)。在ddH2O-治疗组,大多数基因参与氧化还原过程,金属离子结合,阳离子结合和氧化还原酶活性。相反,只有单生物代谢过程,氧化还原过程和氧化还原酶活性与SA治疗组有关。Kegg浓缩分析显示了一些相同的途径,例如苯丙醇丙烷生物合成,苯丙氨酸代谢和黄酮类生物合成(图S4光盘)。两组下的富集途径是植物激素信号转导(图S5),说明SA和JA信号通路主要参与了应答P. Aphanis..我们得出结论,苯丙醇丙烷和黄酮类生物合成的基因和参与激素信号转导的TFS在草莓防御激素中发挥着重要作用P. Aphanis..
黄酮类生物合成途径参与抵抗P. Aphanis.
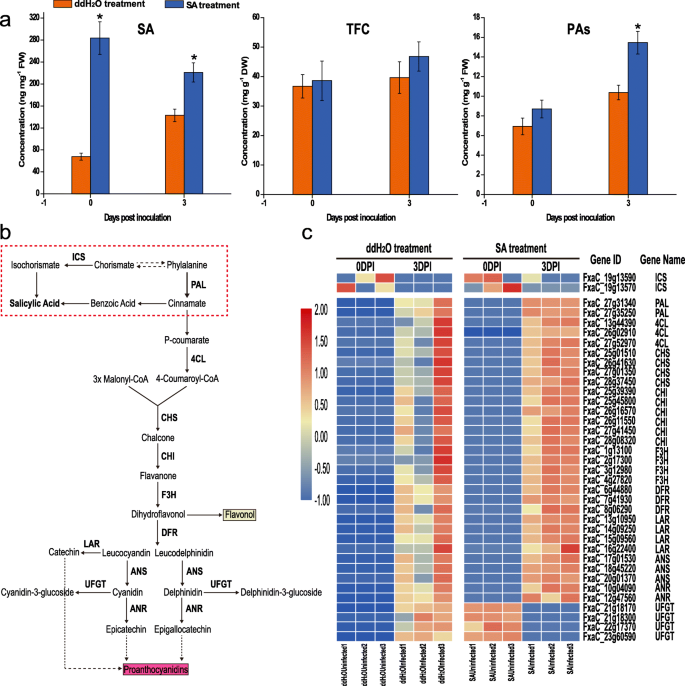
确定外源性SA是否能触发PA积累p . aphains测定TFC和PA代谢物(图。3.一种)。SA治疗组中的SA浓度显着高于DDH中的浓度2o治疗组在两个感染点。两组间TFC含量无显著差异,但sa处理组TFC含量高于ddH处理组2O-治疗组。此外,PA水平在SainFected中显着高于DDH2oinfected。为了进一步阐明SA-触发PAS积累的调节机制,研究了与苯丙醇丙烷和黄酮途径相关的DEG的调节(图。3.c). RNA-Seq显示参与类黄酮通路的关键基因表达上调。4-香豆酸-辅酶a连接酶2 (4CL)编码基因、查尔酮合酶(CHS)编码基因、查尔酮异构酶(CHI)编码基因、黄酮3-水解酶(F3H)编码基因、二氢黄酮醇还原酶(DFR)编码基因、亮色花青素还原酶(LAR)编码基因、花青素合酶(ANS)编码基因的转录水平,和花青素还原酶(ANR)编码基因在3dpi时均高于0 dpi时。此外,这些基因在sa处理组的表达水平也高于ddH处理组2O-treated组(表S4).与ddH中udp -葡萄糖:花青素:类黄酮糖基转移酶(UFGT)编码基因表达增加相比2OINFECTECT,UFGT在SAINFected中的表达明显下调,表明SA可以抑制UFGT产生更多PAS。总体而言,我们建议PAS在提高抵抗抵抗力方面的潜在作用P. Aphanis..因此,我们建议TFC和PAS是防御的潜在重要的抗真菌化合物P. Aphanis..
MBW配合物参与了PA的生物合成p . aphains
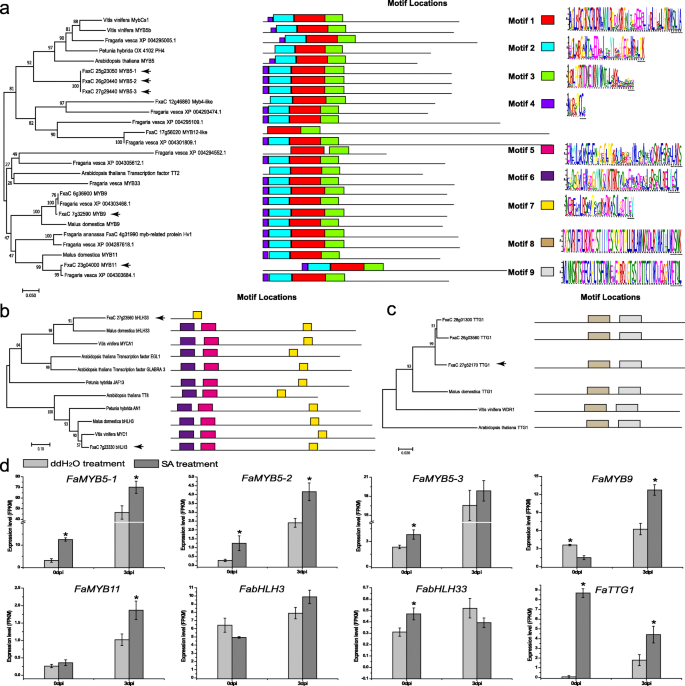
前人研究表明FaMYB9/FaMYB11、FabHLH3和fatg1在草莓果实发育过程中相互作用调节PA合成[28].系统发育分析表明Famyb5-1,Famyb5-2,Famyb5-3最相似atmyb5..R2R3-MYB MOTIF分析显示,图案1和基序2是R2保守结构域,而基序3是R3保守结构域(图。4a).另外,另外两款R2R3-MYB,FaMYB9和Famyb11.是同源物mdmyb9.和mdmyb11..有趣的是,系统发育分析显示,除了这些蛋白外,这些蛋白在长度上与它们的同源物相似Fabhlh33(FxaC_27g23560)。Motif分析还显示,FabHLH33缺失了Motif 5 (bHLH结构域)和Motif 6 (ACT-like二聚体结构域),这两个结构域与MdbHLH33和VvMYCA1的关系比与AtEGL1/AtEGL3的关系更密切(图)。4b).此外,FabHLH3类似于VvMYC1、MdbHLH、PhAN1和AtTT8。FaTTG1与MdTTG1高度相似,所有鉴定的蛋白都有两个WD40结构域(motif 8和motif 9)(图8)。4C)。
关键基因的表达模式分析(FaMYB9,Famyb11.,Fabhlh3.,Fabhlh33,FaMYB5在进行编码MBW复合物以了解两种处理中TFC和PAS的差异(图。4d).的表达模式FaMYB5,FaMYB9,Famyb11.,Fabhlh3.和FaTGG1与ddH2OInfected(无花果。4d),其与同一点中的PAS累积模式有关(图。2一种)。反过来,Fabhlh3.在两组下两点显示出显着的表达水平,尽管SA治疗在3dpi的情况下,与0 dpi的抑制相比,其在3 dpi的水平增加。显着差异Fabhlh33在0 dpi处观察到SA处理之间的差异,在3dpi处SA处理进一步降低了其水平。在…的情况下Fattg1.,在沉淀中观察到高表达。
SA的生物合成和信号通路有助于增强抗性
SA的生物合成有两个不同的途径;苯丙氨酸途径和ICS1途径,近95%的SA都是从这些途径产生的[29].ISC1途径包括两个步骤:先由ICS1催化异构体转化为异异构体,再由一种未知酶将异异构体转化为SA [30.].对于系统发育分析,鉴定了草莓的高度同源蛋白质(图S5a-e)。在该研究中,在两组中编码ICS1的基因在两组中下调(图。3.d和图S6),两种PAL基因表达明显上调。此外,表达分析显示Faics2.表达非常低,但高表达FaPAL.通常,这些结果表明,草莓的SA生物合成可能主要来自PAL途径。此外,EDS1和PAD4在感染部位的SA积累的上游作用,而EDS1 / PAD4复合物的表达可以通过外源SA增加[31].与0 dpi相比,FAPAD4.两组在3dpi时均表达上调(图S5e).无明显变化FaEDS1ddH2OInfected和ddH2而SA诱导的表达较强FaEDS1在SA治疗组的两种感染点,表明P. Aphanis.可能会抑制EDS1抑制SA生物合成。有趣的是,没有显着差异FAPAD4.观察到两组之间,表明EDS1可能在介导草莓中的AS积累方面的作用。
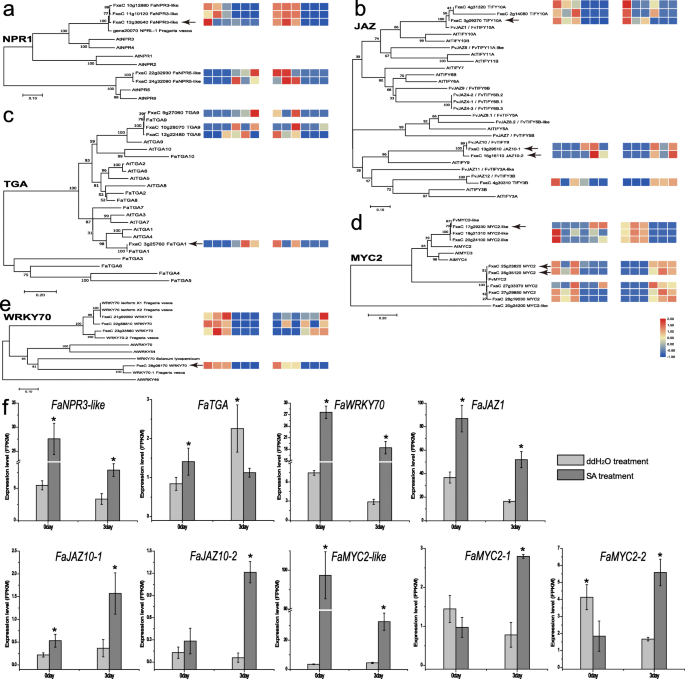
在转录重编程与草莓抗性相关的转录物轮廓p . aphains而SA含量的积累表明,SA生物合成基因和TFs参与SA信号转导,发挥着关键作用。本研究从系统发育分析和表达模式两方面对其进行进一步的描述,旨在剖析其在植物中的功能作用p . aphains草莓的响应。在这两种治疗中都有deg,如NPR、TGA、WRKY、MYC2和JAZ,它们参与信号转导(图)S5).正如预期的那样,随着SA和JA途径在两组中激活,需要大规模转录重编程,尤其是转录因子。为了进一步确定在防御反应调节中对这些DEG的可能作用,使用这些含量的蛋白质序列,未加速的系统发育树被修改以显示F.Ananssna与F.Ananssna之间的进化关系答:芥(无花果。5).
识别假定的度草莓叶片中JA基因的生物合成P. Aphanis..草莓NPR之间存在的系统发育关系(一个), JAZ (b),TGA(c),myc2(d)和wrky70(e)本研究中使用的蛋白质(黑色箭头)与其最近的同源物。分支的数字表示后验概率和基于1000次重复的bootstrap百分比。使用每处理三种生物样品的平均值[LOG10(FPKM + 1)]产生热线,代表叶中含量的相对转录物表达水平。彩色条表示表达值,作为增加强度梯度(蓝色,低表达;红色,高表达)。f相对表达的变化Fanpr3就像,FaTGA,FaJAZ1,FaJAZ10,似乎和FaMYC20 dpi和3 dpi的基因。与对照进行归一化处理,对应于3个生物重复的平均值±S.E.p< 0.05)。在,拟南芥,所有蛋白质资料可于Uniprot资料库(https://www.uniprot.org/).NPR,病因相关基因的非富表达;jaz,斋月zim-domain;TGA,TGACG主导结合因子;WRKY,W盒(5' - (t)TGAC [CT] -3')主题结合因子;MYC2,核局部基本螺旋环 - 螺旋型转录因子
致病相关基因1 (NPR1)的非表达子是sa依赖信号通路的正调控因子,介导TGA因子与致病相关基因PR-1中as-1基序的结合。FaNRP3-like在系统到底是更近的fvnprl-1,哪个更相似ATNPR3 / ATNPR4.比AtNPR1.fvnprl-1可能与拟南芥NPR3 / NPR4类似的功能作为SA介导的防御的负调节器[32].如图所示。5,强烈的感应Fanpr3就像在SA治疗4 h后,两组均迅速下降,提示Fanpr3就像(类似于fvnprl-1)是一种抑制因子,可迅速平衡过量SA引起的影响。因此,Fanpr3就像可能是SA介导的防御途径的负调节剂。作为NPR1的重要共同激活因子,FaTGA在DDH之间显示了对比表达曲线2OInfected / ddH2本研究中的ouoninfected和sainfected / sauninfffected(图。5).FaTGA与FaTGA1具有高度相似性,FaTGA1可能与FaNPR1相互作用,在应对白粉病中发挥关键作用[33].此外,FaTGA与AtTGA也表现出密切的进化关系,AtTGA通过调控SA的生物合成SARD1.[29].因此,FaTGA1可能是SA生物合成和SA介导防御的正调控因子。显然,与负调控ja应答基因相比,WRKY70是正向介导sa依赖基因中NPR1和COI1的下游调控因子[30.].虽然上调趋势Fawrky70.(类似于SlWRKY70和Atwrky70.)在两组中观察到表达,转录水平Fawrky70.sa组显著高于ddH2o治疗(图。5),表明sa mediatesFawrky70.积累,与之前的研究一致[31,34].因为Atwrky70是JA响应基因的负调节因子,我们假设Fawrky70 orthologs也可能是SA响应基因的正调节因子。
参与JA依赖防御途径的舞台
众所周知,JA-SA串扰会导致细曲工厂对不同病原体的防御[35].jaz(jasmonate-zim结构域)蛋白是调节各种生物过程的关键转录压缩机。作为JA响应中的钥匙压缩机,当JA-ILE水平低时,JAZ与MYC2结合,导致JA响应基因的抑制[36].JA信号通路可以在草莓果实发展的早期触发PAS生物合成,尤其是FaMYC2,FaJAZ1和FAJAZ8.1.,是ja应答基因,与JA-Ile生物合成的激活相关[37].虽然FaJAZ1(类似于FvJAZ1)在两组的感染期间显示了减少模式,这是一个明显的表达FaJAZ1观察到SA诱导(图。5),根据sa处理后的叶片对活性氧的响应p . aphains,说明外源SA可在感染早期诱导JA生物合成基因的表达,导致pa的积累,从而对真菌进行防御。相比之下,表示FAJAZ10-1和FAJAZ10-2在两个组中展示了从0到3 DPI的类似增量模式。进化关系表明Famyc2样有最高的认同FvMYC2-like,Famyc2-1和Famyc2-2被密切聚集在一起FVMYC2.[37].Famyc2-1和Famyc2-2在感染过程中sa的表达增加,与观察到的方式相似FAJAZ10-1和FAJAZ10-2(无花果。5).统称,观察到显着更大的表达水平FaJAZ1和Famyc2样在sa治疗中比在ddH中更有效2O-treatment。此外,观察到较高的相对表达水平Famyc2样和FaJAZ1在烟草中。JA生物合成中涉及的关键酶的基因的表达模式如FaJAR,FaAOS,FaLOX2还分析了(图S6).在0 dpi下,SA处理的叶片表现出这些基因的更高转录物水平,从1至3 dpi降低FaLOX2(图S6).有趣的是,的表达FaLOX2桑拿浴组高于ddH组2ouoninfected;但是,在3 dpi下,没有显着差异FaLOX2观察到两组之间。表达式FaAOS和FaJAR1在所有时间点都显示出类似的模式。此外,这些基因与之前研究的基因高度同源[38,39].携带涉及JA Biosynthesis的关键基因,遵循相同的下调模式,这与SA和JA途径之间的拮抗关系一致。总体,JAZ1,JAZ10-2,MYC2-like,MYC2-1,MYC2-2及其他与ja信号有关的基因(FaLOX2,FaAOS,FaJAR)在期间下调P. Aphanis.与SA诱导更高表达相比感染。
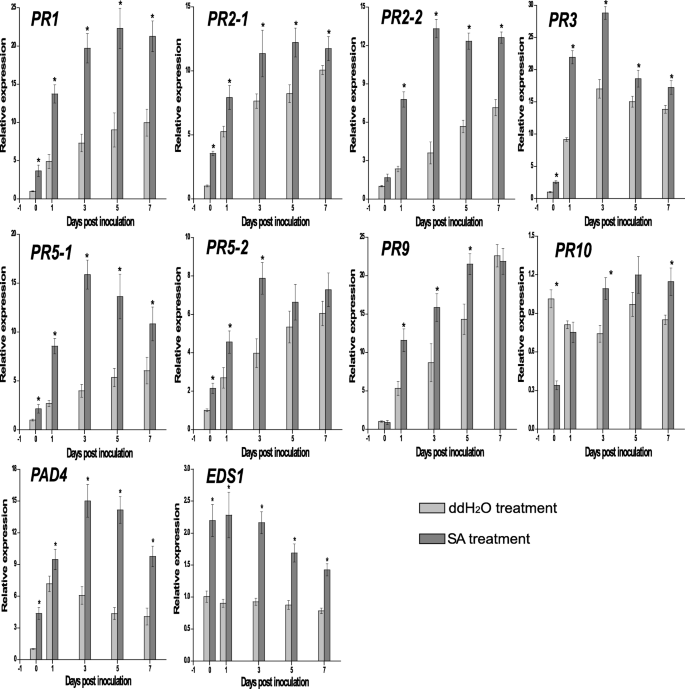
病原相关抗性基因的表达模式
为了研究sa诱导的抗性中涉及的防御反应,主要的转录变化(log2倍变化> 3)响应P. Aphanis.监测SainFected和Sauninfect之间的感染(表S5),包括表达PR1,PR2(endo-1,3-葡聚糖酶),PR3(逐胰酶),PR5(甲磺汀样蛋白),PR9(植物过氧化物酶),和PR10.的表达模式PR.通过RT-qPCR进一步检测两组基因。6).这9个PR基因在SA处理下草莓叶片中的表达与RNA-Seq的表达趋势相似。SA有直接的影响FaPR1,FaPR2,FaPR3,FaPR5,FaPR10,与DDH相比,SA治疗组中表达显着差异所证明2O-治疗组。而且,在实验期间,所有人的表达PR.基因持续5天。回应P. Aphanis.,SA治疗表现出显着更高的表达FaPR1,FaPR2-1,FaPR2-2,FaPR3,FaPR5-1,PR5-2表达式比ddH中的表达式要多2o治疗。在此之前,这些基因也是显着的UREGOWD(1 dpi)P. Aphanis.感染(肉眼可见白色菌丝,3dpi)。这些结果表明FaPR1,FaPR2-1,FaPR2-2,FaPR3,FaPR5-1,PR5-2可能会争夺直接防御P. Aphanis..
讨论
SA称为O-羟基苯甲酸,是一种简单的酚类化合物,已被证明通过植物防御反应的活化诱导抗性。它也是众所周知的外源SA保护小麦对粉末状霉菌。关于BTH的昂贵成本,SA诱导草莓防御反应p . aphains是本研究的另一种选择。虽然比较转录组数据提供了深入了解二倍体草莓防御P. Aphanis.,八倍薄膜草莓中的分子机制仍然不太了解。在这里,我们使用了DDH20治疗和SA治疗的植物,响应于p . aphains利用比较转录组方法鉴定可能参与防御的关键成分。
两种草莓不同的表型
在本研究中,Fv/ F米减少ddH2OInfected较sainfinfected更为显著,这清楚地反映出未经SA预处理的病原菌感染对PSII功能的抑制更为严重,说明SA可以减轻对PSII的损伤p . aphains提高PSII原有光能转换效率。此外,在φ.2在ddH之间2OINFECTED和SAINFECTED是obersved,而SA治疗与DDH相比表现出更高的价值2O处理5 ~ 7dpi时,SA可减轻leaves。此外,φ.NPQ说明SA可提高草莓叶片的非辐射耗散能力。因此,Fv/ F米和φ.NPQ可以用作生物标志物。此外,Sainfacty展示了DDH的较小的感染区域2OINFECTED,表明外源SA可以增强抵抗力p . aphains并减轻疾病过程,而不抑制粉末状霉菌的蔓延。在两组中鉴定的KEGG途径,Flavanol生物合成途径是最富集的,表明基因调节黄烷醇代谢物的重要性响应P. Aphanis..以往的研究表明,与次级代谢、信号转导、转录因子和抗病相关的基因在防御中发挥重要作用P. Aphanis.[18].
SA生物合成基因可能有助于抵抗P. Aphanis.
在拟南芥, SA生物合成的主要途径是ICS1途径[34],这也依赖于基因,例如EDS1和PAD4。该途径触发早期植物防御和HR独立于PAD4,之后招募PAD4通过SA的累积来提高植物防御。在DDH.2o治疗FAICS1,而在SA处理中未检测到该基因的变化(图。3.c).此外,显著上调FaPAL在两组中观察(图。3.c),建议草莓可能主要通过PAL途径综合SA。在草莓中,FAPAD4和EDS1可以形成一个复杂的来规范防御系统。没有什么不同FAPAD4.在两组中观察(图S6f)我们得出结论,Faeds1可能是草莓天生免疫的重要调解员。更高的抵抗力P. Aphanis.也观察了sainfated (fig .;1ab和2b)。在DDH中,SA水平保持稳定2o根据成绩单积累的略微变化治疗FaPAL,FaEDS1,FAPAD4.,这表明P. Aphanis.可以抑制这些关键基因来感染成功。在整个实验期间,对于这三种基因,与SA-生物合成基因相比,两种治疗中观察到转录物水平的稳定降低,表明SA途径可能在防御方面发挥至关重要的作用p . aphains.综上所述,这些结果表明草莓激活了防御系统p . aphains通过SA生物合成。
在SA引发叶片中增加PAS可能会限制P. Aphanis.
最近有报道称,黄酮类化合物在抗真菌的化学防御中被诱导[35,36].在本研究中,我们发现PA水平和TFC在SA处理中增加(图。3.一种)。SA增加了PA积累cistus heterophyllus在葡萄藤里[40].在这种情况下,RNA-Seq数据显示,SA处理后,参与PA合成的基因显著转录上调(图)。3.特别是c)。FaUFGTs在SA治疗中下调(图。3.c),说明SA可以诱导并增加PAs的积累。MBW复合物(MYB-bHLH-WD40)通过直接激活参与类黄酮生物合成途径后期步骤的基因来调控PAs的生物合成[41].众所周知,来自不同组织(水果、叶子和茎)的PAs的功能是保护病原体、昆虫和食草动物[40].为了扩大我们对mbw介导的草莓叶片PAs积累的认识,我们用草莓果实中MYB成员蛋白进行了系统发育分析(图2)。4).系统发育分析表明FaMYB9,Famyb11.,Fabhlh3.,Fattg1.可能是参与PA生物合成的MBW复合物形成的功能成分(图。4abc)。的增加FaMYB9,Famyb11.,Fabhlh3.,Fattg1.在SA处理中观察到表达水平,这与较高的PAs含量相符(图。3.a)和关键结构基因的表达水平(图。3.c).特别是在草莓叶片中,SA处理下,3 dpi的pa浓度相对较高(图3)。1AC)。这些转录修饰与MBW复合物一致地显示了调节PA生物合成[28].我们的结果支持这样一种情况,即FabHLH3可能与PAs的生物合成更相关,与FaMYB9和FaMYB11结合,形成一个三角复合物(FaMYB9/FaMYB11, FabHLH3和fatg1),导致PAs含量上调p . aphains在草莓叶。在草莓果实中,FamyB5可以与FamyB1互动以调节MBW复合物[28,41].在三种情况下FaMYB5基因,在sainfect中表达上调,提示SA信号通路与FaMYB5表达式。有趣的是,SA可以诱导PAs的积累,表明调控PAs积累的机制可能依赖于SA-或ja信号通路。的可能性FaMYB5可能促进草莓叶片中PAs的生物合成。因此,FaMYB5可能在草莓叶片对P. Aphanis..值得注意的是,PAS是抗真菌代谢物P. Aphanis..
参与SA信号通路的DEGs可导致防御P. Aphanis.
已知SA介导的途径升高了对生物侵蚀的抗性。NPR1是SA信号转导的关键正调节因子,与TGA物理相互作用,其参与SA依赖性激活PR1,导致基因防御系统的转录调节[9,42].Fanpr3就像在系统到底是更近的fvnprl-1(无花果。5a),可能是sa信号通路的抑制因子。此外,FaTGA(类似于FATGA1.和AtTGA1)可能是SA生物合成和SA信号通路的正稳压因子。Wrky基因家族介导植物防御措施对抗各种病原体[43].WRKY70是参与SA-和ja依赖应答之间平衡的重要分子[44].WRKY70通过增加EDS1的表达来肯定调节SA介导的信号传导拟南芥[11].强烈的表达Fawrky70.(类似于SlWRKY70和Atwrky70.)通过SA治疗诱导,暗示Fawrky70.在SA信号通道中发挥重要作用。此外,对抗明显的抵抗力p . aphains(图。1 b和2)结合强烈的诱导Fawrky70.(无花果。5)提示SA-JA信号串音介导的下游反应调控因子,参与正向调控p . aphains.SA结果在快速诱导中的应用Fanpr3就像,可以删除过量的SA。作为NPR1,NPR3和NPR4在SA信号通路中是调节剂[45和JA信号通路[46].然而,外源性SA诱导了强烈的FaPR1(无花果。6).它清楚,NPR1与TGA相互作用,这是必要的PR1.在我们的研究中,未鉴定出NPR1同源物。
DEGs参与JA的生物合成和信号通路的响应P. Aphanis.感染
新兴的证据表明了许多植物中的Sa-Ja拮抗作用[27,47,48].SA水平需要对病原体进行防御,然后减少JA-生物合成基因的表达模式,表明草莓活化SA信号通路并抑制JA信号通路。Jaz在镇压JA响应方面发挥着至关重要的作用,其中Myc2的功能被jaz压制[49].FaJAZ两组均表现为0 ~ 3 dpi的减少,并伴有显著的表达水平FaJAZ提示p . aphinas可能会抑制表达水平FaJAZ.MYC2是JA信号通路中JAZ的直接靶点[50].FAJAZ10-1和FaJAZ1-2表现出类似的上调模式FaMYC2,而FaJAZ1(无花果。4b)和Famyc2样(无花果。4d)表现出强烈的诱导,这是JA响应基因,并且与外源SA引起的JA生物合成基因的激活有关,表明SA治疗的叶子在早期阶段升高了JA生物合成,这与Meja-invive一致草莓水果中的花青素积累[39].此外,SA水平期间p . aphains感染与草莓叶中PA的积累相关,表明外源SA可以诱导PA的积累来防御P. Aphanis..因此,SA途径可以用JA拮抗作用于草莓留下的PAS积累p . aphains.
诱导SA引起的P. Aphanis.攻击,或SA的外源应用可以促进更强的反应P. Aphanis.[33].确实,在转录本表达上没有显著差异FaJAR1,FaLOX2,FaAOS观察到两组的3DPI / 0DPI之间(图S6).而且,FaJAR1,FaLOX2,FaAOS外源SA 4小时后的水平高于DDH2O预处理。本研究数据表明,草莓暴露于SA足以诱导JA生物合成基因的早期增强,这与外源SA可以诱导JA生物合成,导致PAs的积累有关。综上所述,这些结果也支持SA的应用能够激活SA信号通路并覆盖JA信号通路的观点。支持这一概念的是FAPAD4.和FaEDS1在' Camarosa '中JA处理后,转录本确实增加了[51].
与国防相关的蛋白质有助于增强抗性P. Aphanis.
根据电阻性能测定的结果(图。1),发现九次编码通过转录组数据(LOG2折叠变化> 3)鉴定的PR蛋白与增加的抗性相连P. Aphanis.包括PR1、PR2、PR3、PR5、PR9、PR10。相比之下,ddH2o处理组,这9个PR基因特异性抵抗P. Aphanis.或在SA治疗组中以较高水平表达(图。5,表S4).特别是,PR1,PR2-1,PR2-2,PR3,PR5-1,PR5-2与ddH相比,SA处理组表达量更高2O治疗前后,特别是在出现明显白色症状前的1 dpi显著上调(图2)。2b)突出显示这些PR基因是SA信号在抵抗力的后果P. Aphanis..因此,它可能是PR1,PR2,PR3和PR5也可能是抗真菌代谢物P. Aphanis..
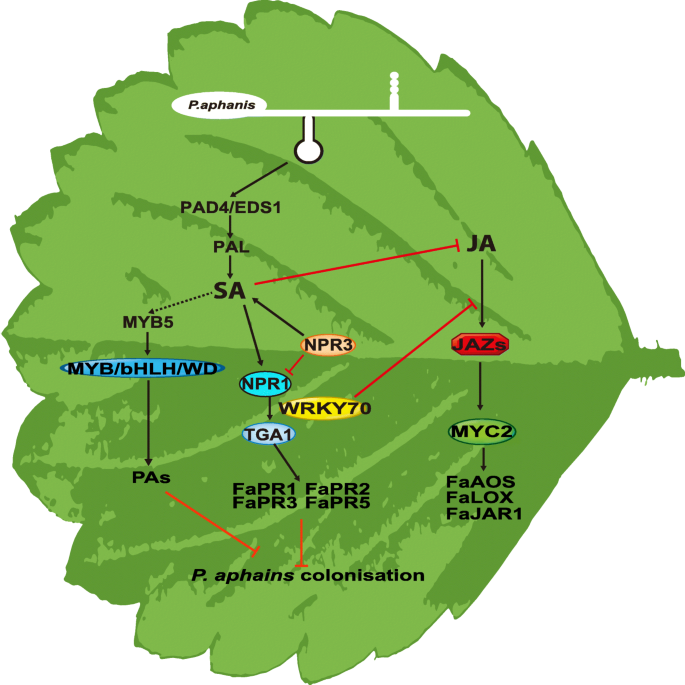
结论
我们确定了八薄草莓响应中的不同候选基因P. Aphanis.与二倍体草莓的PR基因和TFS研究中鉴定的那些相比 -P. Aphanis.交互。类似于拟南芥二元模型中的SA-JA串扰模型拟南芥[52,防御反应的综合模式P. Aphanis.(图。7).我们提出以下结论:(i)P. Aphanis.诱导草莓基因表达和代谢产物产生的剧烈变化;(ii) SA诱导草莓抗性增强,提供了SA诱导抗性的约束P. Aphanis.;(3)与拟南芥,草莓的SA生物合成途径可能主要来自PAL途径;(iv)外源SA的应用可以通过激活MBW复合物来诱导PAS的积累;(v)在抵抗抵抗期间观察到PR基因的上调P. Aphanis.特别是PR1,PR2-1,PR2-2,PR3,PR5-1,PR5-2;(VI)涉及植物激素信号传导途径的几个TFS有助于抵抗P. Aphanis..比较转录组分析使我们能够揭示与SA信号相关的新电阻机制,然后进行显着抵抗P. Aphanis..本研究为进一步探索抗虫分子机制奠定了基础P. Aphanis.在草莓中,并通过基因工程提供改善草莓品种的新策略。
方法
植物材料
草莓幼苗(Fragaria×ananassa.“Benihoppe”由北京市农林科学院国家草莓种质资源库提供。这些实验植物在盆栽中生根,在直径为5厘米的花盆中植入1:1:1的泥炭:蛭石:珍珠岩混合物,然后在2018年9月15日移植到一个温室中,在直径为20厘米的花盆中植入1:1:1的泥炭:蛭石:珍珠岩混合物。在北京林业大学塑料温室进行了接种试验。试验期间的生长条件如图所示S1.没有施用杀菌剂,根据农业实践加入肥料。
P. Aphanis.接种和SA治疗
P. Aphanis.一个月后,即2018年10月15日进行接种。草莓叶被感染了P. Aphanis.通过从受感染的草莓叶中轻轻敲击。植物接种的年轻健康植物P. Aphanis.更换受感染的老植物接种试验采用从草莓白粉病叶片上部轻轻摇落,定位于14日龄完全伸长的幼叶的近轴表皮。孢子数约为每厘米200-300个孢子2.所有实验组在上述生长条件下均置于温室中。将80株植物分为两个亚群,每个亚群40株:ddH2o处理组和sa处理组。接种前四小时用P. Aphanis.,用水喷洒一组,同时使用雾化器将另一组用外源SA(2mM)喷洒到上部完全叶上,直至其耗尽。针对每次感染时间对三种重复进行采样。在每种植物中随机10上幼叶,在0,1,3,5和7dpi和7dpi和RNA中取样。所有收集的叶子都接种了p . aphains接种面积为全叶面积的16.73 ~ 25.37%。样品浸泡在液氮中,保存在−80℃,待进一步分析。这项研究评估了四种条件:水处理和不接种(ddH)2OUninfected);SA治疗而不接种(桑葚感染);3 dpi (ddH2oinfected);并在3 dpi(sainfected)接种的Sa治疗。
TFC和PAS确定
采用植物总酚检测试剂盒(A142-1-1,南京建城生物工程研究所,中国南京),采用比色法测定总黄酮含量。简单地说,在样品中加入亚硝酸钠,然后再加入氯化铝。最后,向混合物中加入氢氧化钠。2 h后,以10000 rpm离心10 min, 502 nm读取上清液的吸光度,并与芦丁标准品进行比较。类黄酮含量表示为mg g−1DW(干重)。
根据植物原花青素检测试剂盒(A144-1-1,南京建城生物工程研究所,中国南京)测定原花青素含量(PAs)。显色溶液、香兰素溶液:盐酸溶液= 1:1,即食。简单地说,在样品中加入甲醇。搅拌20 min后,3000rpm离心20 min,加入显色液上清。在500 nm处测定溶液的吸光度,并与芦丁标准品进行比较。PAs含量表示为mg / g−1弗兰克-威廉姆斯(鲜重)。
内源性游离SA的提取
根据Pan等人所描述的标准方案分析植物激素[28].使用50 mg叶片的3个重复样品,采用液相色谱-质谱(Waters Crop。,Milforf, MA) analyses of SA were performed by the Testing and Analysis Center of Beijing Forestry University, Beijing, China.
荧光参数的测定
采用成像- pam叶绿素荧光仪(Walz, Effeltrich, Germany)测定受感染草莓叶片的光合参数[32].用20分钟的黑暗处理制备小植物。使用成像PAM,叶绿素荧光计,暗治疗荧光收率,F0,最大荧光产量为F米被确定。华尔兹软件使用了这个公式Fv/ F米= (F米-F0/F米计算最大psii量子产量。目前的荧光收率,Ft以及最大的光适应荧光,F米的,在400 μmol m .光化照射下−2 s−1计算有效PSII量子产率[Y (II) = (F米的- - - - - -Ft/F米的].NPQ被确定为商(F米-F米的/F米.使用下式获得PSII量子场Y(NO)的非调节能量耗散:Y(NO)= 1 /(NPQ + 1 + QL(F米/F01))。根据动力学记录,Walz软件使用感兴趣的区域,这些区域是从相应的周围受感染的叶子中随机选择的。对于每个处理,使用3个植物并取平均值。
光学显微镜
光学显微镜分析P. Aphanis.[33[在0,1,3,5,7 DPI的感染叶中随机切除的叶片(直径)上进行。通过在酒精含甜菜蛋白毒素蓝色(10mL乙醇,10mL酚,10mL水,10mL乳酸和10毫克乳酸和10mg台盼蓝)中煮沸2分钟的叶片染色2分钟。在室温下以氯水合物(2.5g溶解在1mL水中)的氯水合物(2.5g)清除染色片。清除叶在50%甘油中的盖玻片下安装并使用Leica DM2500观察。P. Aphanis.采用共聚焦激光扫描显微镜(海德堡工程公司,德国)进行检测。
转录组分析
识别草莓中的关键途径 -P. Aphanis.交互作用,12个样本(ddH2ouoninfected,ddh.2oinfected,sauninfected和sainfected;每次治疗三次重复)用于RNA-SEQ分析(表S1).使用TruSeqTM RNA样品制备试剂盒(Illumina, San Diego, CA, USA)提取总RNA,并制备RNA- seq转录组文库。参考基因组注释(fragaria_x_ananass_camarosa_genome_v1.0 .0.a1)的序列组装对序列reads进行比对,该注释可在Rosaceae基因组数据库(GDR,ftp://ftp.bioinfo.wsu.edu/species/Fragaria_x_ananassa/).为了识别两个不同的样品之间DEGS(差异表达的基因),每个转录物的表达水平根据片段每千碱基百万(FPKM)法计算。RSEM(http://deweylab.biostat.wisc.edu/rsem/)用来量化基因丰度。R统计软件包DESeq2 (http://bioconductor.org/packages/stats/bioc/DESeq2/)用于差异表达分析。
系统发育树和蛋白质基序分析
来自草莓的基因id如表所示S2和S3..利用ClustalW(开度= 10,延伸度= 0.2)对两种植物(草莓和拟南芥)基因的全部预测氨基酸序列进行了比对。用邻域连接法进行系统发育重建,用bootstrap法进行1000个重复的系统发育测试。使用MEGA version 7.0软件进行比对和系统发育分析。比例尺表示分支长度,对应于每个氨基酸位置的取代数。MEME程序(http://meme.nbcr.net/meme3/mme.html)用于预测所有蛋白质的基序,该蛋白质通过Motiffinder进一步注释(https://www.genome.jp/tools/motif/).
RT-qPCR验证RNA-Seq数据
选择来自RNA-SEQ分析的十个转录组基因并通过RT-QPCR验证。使用底漆5.0设计引物(表S6).十个选定的关键同源物是PR1(FXAC_7G01820),PR2(FxaC_9g22040和FxaC_21g36890),PR3(fxac_3g11800.),PR5(FxaC_21g46690和FxaC_24g22200),PR9(FXAC_12G01950),PR10(fxac_14g19400.),PAD4.(Fxa_C2g34100),EDS1(Fxa_C17g21160).使用EASYspin和植物RNA Mini Kit (Aidlab, Beijing, China)从每个样品中分离叶片总RNA。随后,用RNase-free DNase处理总RNA (2 μg),去除基因组DNA。按照说明书(CWBIO, Jiangsu, China),用GoScript Reverse Transcription Kit合成cDNA。采用Applied Biosystem公司7500 real-time PCR系统,在20 μl反应中进行RT-qPCR。用2−ΔΔCt方法(53]和正常化使用两个FaACTIN基因作为内部控制。用三个生物学重复进行反应。
统计分析
通过完全随机设计(三种复制)进行实验。数据表示为平均值±SD(n = 3), and analysed using ANOVA by the SPSS 17.0 (SPSS Inc., USA). The level of significance difference was established atP < 0.05. For RNA-seq,P- 使用Q值调整值,Q值<0.005和| log2(折叠)| ≥ 1 were set as the threshold for significantly differential expression. PCA were made with ggplot2. Differences were analysed using a one-way analysis of variance with Fisher’s least significant difference test. P-value ≤0.05 were considered statistically significant. All analyses were performed using Origin 8.0 software (OriginLab Corp.,https://www.originlab.com/).
可用性数据和材料
所有支持本研究结果的数据均包含在本文或其补充信息文件中。本文报道的原始序列数据已保存在Genome sequence Archive [47在大数据中心[48[cn],中国科学院北京基因组研究所(BIG),登录号为CRA001964,公开地址为https://bigd.big.ac.cn/gsa..
缩写
- BTH:
-
苯并噻唑.
- DEG:
-
差异表达基因
- FPKM:
-
每百万千兆比赛每千碱基
- Fv/ F米:
-
光合效率
- 走:
-
基因本体论
- 人力资源:
-
过敏的反应
- KEGG:
-
Kyoto基因和基因组的百科全书
- φ.NPQ:
-
Nonphotochemical淬火
- PCA:
-
主成分分析
- 公关:
-
Pathogensis-related基因
- RT-QPCR:
-
实时定量聚合酶链反应
- RNA-Seq:
-
RNA-sequencing
- ROS:
-
活性氧
- 山:
-
水杨酸
- 交通:
-
总黄酮含量
- TFS:
-
转录因子
- φ.PSII:
-
实际PSII效率
- φ.不:
-
量子产量的未测量能量耗散
参考文献
- 1.
Jones JD, Dangl JL。植物的免疫系统。大自然。2006;444(7117):323。
- 2.
Chisholm ST, Coaker G, Day B, Staskawicz BJ。宿主-微生物的相互作用:塑造植物免疫反应的进化。细胞。2006;124(4):803 - 14所示。
- 3.
陈志强,陈志强,陈志强,等。白粉病真菌的分类研究。见:白粉病:综合论述;2002.13-55页。
- 4.
Takamatsu S.分子系统发育揭示了粉末状霉菌的表型演变(白粉菌目,子囊菌类).植物病理学杂志。2013;79(4):218-26。
- 5.
Glawe哒。白粉病:回顾世界上最熟悉(但鲜为人知)的植物病原体。植物病理学杂志2008;46:27-51。
- 6.
Kuhn H,Kwaaitaal M,Kusch S,Acevedo-Garcia J,Wuh,Panstruga R. Biotrophy最佳:新发现和未解决的拟南芥 - 白粉病霉菌疫苗疾病。拟南芥书。2016年; 14:E0184美国植物生物学家学会。
- 7.
Robert-Seilaniantz A, Grant M, Jones JD。植物疾病和防御中的激素串扰:不仅仅是茉莉酸-水杨酸拮抗。植物病理学杂志2011;49:317-43。
- 8.
Spoel SH, Koornneef A, Claessens SM, Korzelius JP, Van Pelt JA, Mueller MJ, Buchala AJ, Métraux J-P, Brown R, Kazan K. NPR1 modulates cross-talk between salicylate-and jasmonate-dependent defense pathways through a novel function in the cytosol. Plant Cell. 2003;15(3):760–70.
- 9.
在拟南芥中,水杨酸和NPR1诱导反式激活TGA因子募集到一个防御基因启动子。植物细胞。2003;15(8):1846 - 58。
- 10.
关键词:拟南芥,茉莉酸/乙烯诱导的防御通路,戊二醛互作蛋白,ALWL基序摩尔。2012;5(4):831 - 40。
- 11.
wang J, wang J, wang J, ET al . WRKY70转录因子在植物防御中的表达。植物细胞。2004;16(2):319 - 31所示。
- 12.
Spoel Sh,Dong X.在植物免疫应答期间使激素串扰感。细胞宿主微生物。2008; 3(6):348-51。
- 13.
Thaler JS,Humphrey Pt,Whiteman NK。斋甲酸和水杨酸盐信号串扰的演变。趋势植物SCI。2012; 17(5):260-70。
- 14.
Folta KM, Gardiner SE。蔷薇科的遗传学和基因组学,第6卷。纽约:施普林格;2009.p . 411 - 506。
- 15.
Ainsworth GC。Ainsworth&Bisby的真菌词典。瓦莱特福德:Cabi;2008年。
- 16.
张Y,王G,东俊,钟C,张L,张H.中国草莓育种进展。载体:VIII国际草莓研讨会1156;2016. p。7-12。
- 17.
Edger PP, Poorten TJ, VanBuren R, Hardigan MA, Colle M, McKain MR, Smith RD, Teresi SJ, Nelson AD, Wai CM草莓八倍体基因组的起源与进化。51 Nat麝猫。2019;(3):541。
- 18.
Jambagi S, Dunwell JM。感染后差异表达基因的全局转录组分析及鉴定Fragaria Vesca.白粉病(Podosphaera aphanis)。转录组学:开放获取。2015;3(1)。
- 19.
胡艳,韩艳,魏伟,李艳,张凯,高艳,赵飞,冯军。二倍体草莓草莓热激转录因子的鉴定、分离和表达分析。植物科学学报2015;6:736。
- 20。
Jambagi S, Dunwell JM。Fragaria vesca与白粉病互作MLO基因的鉴定与表达分析(podosphaera aphanis.).植物生物学进展,2017;1(1):40-54。
- 21。
魏伟,崔明宇,胡勇,高凯,谢永刚,蒋勇,冯建勇。来自二倍体林地草莓(Fragaria vesca)的WRKY转录因子FvWRKY42的异位表达增强了拟南芥对白粉病的抗性,提高了对渗透胁迫的抗性,并增加了脱落酸的敏感性。植物科学。2018;275:60 - 74。
- 22。
吉万D,Roalson EH,主D,Dhingra A.反义表达桃霉菌抵抗基因座O(PpMlo1)基因赋予瘢痕疙瘩的粉末状霉菌的交叉物种抗性。转基因Res。2013; 22(6):1119-31。
- 23。
Silva KJP,Brunings A,Peres Na,Mou Z,Folta Km。拟南芥NPR1基因在草莓中赋予广谱疾病抗性。转基因Res。2015; 24(4):693-704。
- 24。
Silva KJP,Brunings Am,Pereira Ja,Peres Na,Folta Km,Mou Z. rapidopsisELP3 / ELO3和ELP4 / ELO1基因增强Fragaria VESCA L.BMC植物Biol中的抗病性。2017; 17(1):230。
- 25。
草莓抗白粉病QTL的鉴定。acta photonica sinica, 2018;131(9): 1995-2007。
- 26。
Pertot I,Zasso R,Amsalem L,Baldessari M,Angeli G,Elad Y.在高隧道生长系统中融合了生物控制在草莓粉状霉菌控制策略中。作物科。2008; 27(3-5):622-31。
- 27。
Dodgson JLA。Podosphaera Aphanis的流行病学和可持续控制(草莓白粉病);2007年。
- 28.
Schaart Jg,Dubos C,Romero de la Fuente I,Van Houwelingen Am,De Vos Rc,Jonker Hh,Xu W,Retaboul JM,Lepiniec L,Bovy AG。草莓(F Ragaria×Ananassa)果实中Pryhocyanidin生物合成的MyB-BHLH-WD40调节综合体的鉴定与表征。新植物。2013; 197(2):454-67。
- 29.
孙涛,张强,丁平,Jetter R,张颖。TGACG-BINDING FACTOR 1 (TGA1)和TGA4通过调节系统性获得性抗性缺陷1 (SARD1)和CALMODULIN-BINDING PROTEIN 60g (CBP60g)的表达调控水杨酸和吡果酸的生物合成。新植醇。2017;217(1):344。
- 30.
Li J. WRKY70转录因子:茉莉酸介导和水杨酸介导信号在植物防御中的融合节点。植物细胞。2004;16(2):319 - 31所示。
- 31.
阿米亚人HS,Eulgem T,Kaloshian I. Slwrky70是Mi-1介导的蚜虫和番茄内膜的抗性所必需的。Planta。2012; 235.2:299-309。
- 32.
林杰S,Jui-yu L,Nai-Chun L,Chia-Lin C.鉴定了涉及水杨酸介导的防御途径的阴性调节的草莓NPR样基因。Plos一个。2018; 13(10):E0205790。
- 33.
关键词:草莓,八倍体,TGA基因,抗蚜能力植物生物技术代表2019;14:1-13。
- 34.
陈C,陈Z.两种病原体和水杨酸诱导基因的分离与表征编码烟草中的粘性DNA结合蛋白的基因。植物mol biol。2000; 42(2):387-96。
- 35.
魏建军,陈志强,李志强,李志强。茉莉酸盐和水杨酸盐防御信号通路相互干扰对植物挥发性物质释放和寄主选择行为的影响。[J] .机器人。2014;65(12):3289-98 .]
- 36.
Chini A,Gimenez-ibanez S,Goossens A,Solano R.延期信号中的冗余和特异性。CurrOp植物BIOL。2016; 33:147-56。
- 37.
Garrido-Bigotes A,Figueroa Ne,Figueroa PM,Figueroa Cr。草莓中的Jasmonate信号通路:在果实开发和成熟过程中的基因组鉴定,分子表征和jazs和mycs的表达。Plos一个。2018; 13(5):E0197118。
- 38.
Preuss A,Augustin C,Hoffmann T,Fiogeroa Cr,Valpuesta V,Sevilla JF,Schwab W.功能性茉莉酸羧基甲基转移酶的表达与草莓果实发育负相关。J植物理性。2014; 171(15):1315-24。
- 39.
草莓果实发育和成熟过程中茉莉酸代谢及其与脱落酸的关系植物营养学报。2018;37:110-3。
- 40.
原花青素——类黄酮研究的最终前沿?新植醇。2005;165(1):9-28。
- 41。
Aharoni A, Vos CHRD, Wein M, Sun Z, O’connell AP.草莓FaMYB1转录因子抑制转基因烟草花青素和黄酮醇的积累。植物j . 2001; 28(3): 319 - 32。
- 42。
Despres C.拟南芥NPR1抗病蛋白是一种新型辅助因子,其将DNA结合活性的氧化还原调节赋予碱性结构域/亮氨酸拉链转录因子TGA1。植物细胞。2003; 15(9):2181-91。
- 43。
Pandey SP,SOMSSICH IE。Wrky转录因子在植物免疫中的作用。植物理性。2009; 150(4):1648-55。
- 44。
Li J,Brader G,Kariola T,Tapio Palva E. Wrky70调制植物防御中信号通路的选择。工厂J. 2006; 46(3):477-91。
- 45。
张y,cheng yt,qu n,zhao q,bi d,李x。两种NPR1副病毒患者拟南芥防御反应的负调节。工厂J. 2006; 48(5):647-56。
- 46。
Liu L, Sonbol F-M, Huot B, Gu Y, Withers J, Mwimba M, Yao J, He SY, Dong X.茉莉酸受体通过非规范通路激活茉莉酸信号通路促进效应触发免疫。Nat Commun。2016;7:13099。
- 47。
王勇,宋飞,朱军,张胜,杨勇,陈涛,唐波,董磊,丁宁,张强。GSA:基因组序列归档。基因组学、蛋白质组学和生物信息学。2017;15(1):14-8。
- 48。
张智,赵伟,肖军,鲍勇,何松,张刚,李勇,赵刚,陈锐,高勇,张超。2020年国家基因组数据中心数据库资源。核酸Res. 2020;48(D1): D24-33。
- 49。
Melotto M, Mecey C,妞妞Y,钟HS, Katsir L,姚明J,曾庆红W,薄B, Staswick P,浏览J .关键作用两个带正电氨基酸雅主题的拟南芥JAZ蛋白质调停coronatine-and jasmonoyl isoleucine-dependent交互与COI1盒蛋白质。植物j . 2008; 55(6): 979 - 88。
- 50。
翟强,闫丽,谭东,陈锐,孙军,高丽,董明强,王颖,李超。MYC2转录因子磷酸化偶联蛋白水解在茉莉酸信号介导的植物免疫中的作用。公共科学图书馆麝猫。2013;9 (4):e1003422。
- 51。
Amil-Ruiz F, Garrido-Gala J, Gadea J, Blanco-Portales R, Muñoz-Mérida A, Trelles O, de Los Santos B, Arroyo FT, Aguado-Puig A, Romero F, Mercado JÁ, Pliego-Alfaro F, Muñoz-Blanco J, Caballero JL。草莓炭疽菌相互作用中SA-和ja -防御通路的部分激活植物学报2016;7:1036。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4945649/.
- 52。
Spoel Sh,Dong X.植物如何实现免疫力?防御没有专门的免疫细胞。NAT Rev Immunol。2012; 12(2):89。
- 53.
利用实时荧光定量PCR技术对相关基因表达数据进行分析2-△△CT.方法。方法。2001;25(4):402 - 8。
致谢
我们非常感谢坤施,为她的植物传播和技术援助提供帮助。我们还感谢上海Majorbio Bio-Pharmy Technology Co.,Ltd。提供I-Sanger平台(http://www.i-sanger.com/)用于数字基因表达谱分析的结果分析。
资金
国家自然科学基金项目(no . 31870571)。
作者信息
隶属关系
贡献
JF概念化了这项工作并设计了实验。JF和MZ进行了表达分析,并对数据进行了分析。JF和KNY撰写了初稿。JF和CXZ编辑了手稿。所有作者都已阅读并批准了最终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者声明没有利益冲突。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1
:图S1.试验期间温室温度(红色)、湿度(绿色)。从2018年10月15日至10月22日,每2小时收集一次数据。
附加文件2
:图S2.草莓中不同表达转录物的原理分析(PCA) -P. Aphanis.交互。PC1根据基因型分离样品,解释50.96%的方差。PC2根据植物暴露于植物的不同感染时间分离样品P. Aphanis.殖民化并解释了差异的13.44%。橙色,紫色,绿色和蓝色代表DDH2ouoninfected,ddh.2OInfected, SAUninfected, and saininfected
附加文件3.
:图S3.在ddH度2o处理和sa处理的叶子。(a)两组在3dpi时,DEGs的数量升高或下调。(b)由RNA-Seq分析的deg生成的比较感染阶段基因表达折叠变化的热图。热图颜色代表基于所提供的颜色键标的基因表达的fold-change水平;红色=表达上调,蓝色=表达下调,白色=表达无变化。(c) ddH之间deg数的维恩图2o处理组和sa处理组。(d)维恩图显示了两组中上调和下调基因的交叉比较。(e) ddH中DEGs的聚类分析2o处理组和sa处理组基于BIRCH方法。
附加文件4.
:图S4.(a) ddH中丰富的基因本体论(GO)生物学过程2OInfected / ddH2OUninfected。(b) sainfated /SAUninfected中的富集基因本体论(GO)生物学过程。y轴表示富集GO过程(误发现率< 0.05)。x轴表示每个氧化石墨烯过程中注释的基因总数。红色和蓝色部分分别代表下调和上调基因。(c) ddH的KEGG富集途径(前20)2OInfected vs ddH2OUninfected。(d) sainfated与SAUninfected的KEGG富集途径(前20位)。富度是指富集程度。点的颜色和大小分别表示q值和基因数的范围。
附加文件5.
:图S5.ddH中deg的分层聚类热图2OInfected / ddH2ouoninfected和sainfected / sauninfected。(a)DDH之间植物激素信号传导中涉及的DEG的聚类分析2OInfected / ddH2ouon(b)植物激素信号在船群/桑林的植物激素信号中的群体分析。差异在蓝色(下调)和红色(上调)中突出显示。
附加文件6.
:图S6.草莓病叶片中SA和JA生物合成相关基因的初步鉴定P. Aphanis..本研究使用的草莓PAL + ICS (a)、EDS1 + PAD4 (b)、JAR1 (c)、AOS1 (d)和LOX (e)蛋白(黑色箭头)与它们最接近的同源物之间存在系统发育关系。分支的数字表示后验概率和基于1000次重复的bootstrap百分比。(f)相对表达的变化FaPAL,Faics2.,FaEDS1,FAPAD4.,FaJAR,FaAOS和FaLOX0 dpi和3 dpi的基因。与对照进行归一化处理,对应于3个生物重复的平均值±S.E.p< 0.05)。朋友,苯丙氨酸ammonia-lyase;ICS, isochorismate合成酶;EDS2,疾病易感性增强2;PAD4:植物抗毒素缺乏4;JAR1, ja -氨基酸合成酶1;AOS:氧化烯合成酶;液态氧,脂氧合酶。
附加文件7.
:表S1.RNA-Seq读取和读取映射。表S2.3DPI−/Control-的差异表达基因(|log2FC| > 1)。表S3.在SainFected / SanninFected(| LOG2FC |> 1)中的差异表达基因。表S4。在SainFected / Sanninfected之间涉及类黄酮途径的显着参与。表S5.在sainfected / sanninffected中有显着的参数(log2折叠变化> 3)。表S6.引物序列和衍生自RT-QPCR分析的参数。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
冯军,张敏,杨侃。等等。八倍体草莓'圆波普叶中的水杨酸 - 灌注反应响应诱导抵抗podosphaera aphanis.通过增强的原花青素积累和促进病因相关基因的上调。BMC植物杂志20,149(2020)。https://doi.org/10.1186/s12870-020-02353-z
收到了:
接受:
发表:
关键词
- 水杨酸
- 八薄草莓
- podosphaera aphanis.
- 原花青素
- PR.基因