- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
大麦条纹花叶病毒的表达系统揭示了小麦C2H2锌指蛋白TaZFP1B作为耐旱性的关键调控因子gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba144gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
干旱胁迫是限制全球小麦生产的主要因素之一。提高耐旱性对农业可持续发展至关重要。虽然与抗旱性相关的各种形态、生理和生化反应已被记录在案,但提高作物抗旱性所需的分子机制和调控基因还有待进一步研究。我们使用基于大麦条纹花叶病毒(BSMV)系统的一个新的4组分版本(用于过表达)和一个3组分版本(用于低表达)对小麦中c2h2型锌指蛋白TaZFP1B进行功能表征。这些表达系统避免了生产转基因植物系的需要,并大大加快了功能基因的表征。gydF4y2Ba
结果gydF4y2Ba
我们展示了过度表达gydF4y2BaTaZFP1BgydF4y2Ba在充足的水分条件下刺激植物生长并上调不同的氧化应激反应基因。过度表达的植物gydF4y2BaTaZFP1BgydF4y2Ba在植物生命周期的关键时期更耐旱。此外,RNA-Seq分析显示植物过度表达gydF4y2BaTaZFP1BgydF4y2Ba重新编程它们的转录组,导致生理和物理上的改变,帮助小麦在干旱胁迫下生长和生存。相比之下,植物转化为低表达gydF4y2BaTaZFP1BgydF4y2Ba对干旱的耐受性显著降低,生长受到负面影响。gydF4y2Ba
结论gydF4y2Ba
该研究清楚地表明,这两个版本的BSMV系统可以用于作物基因的快速有效的功能表征。在过度表达的植物中转录组重编程的程度gydF4y2BaTaZFP1BgydF4y2Ba说明编码的转录因子是小麦抗旱性的关键调控因子。gydF4y2Ba
背景gydF4y2Ba
面包小麦(gydF4y2Ba小麦gydF4y2BaL.)是世界上最重要的作物之一,全球需求正在增加。据估计,在2005年至2050年期间,谷物产量至少需要增加50% [gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].然而,由于有限的土地资源和各种非生物和生物压力的影响,实现这一目标是不确定的。干旱胁迫是限制全球作物产量的主要环境胁迫之一[gydF4y2Ba3.gydF4y2Ba],而随着全球气候变化,干旱出现的频率预计会增加[gydF4y2Ba4gydF4y2Ba].为了提高作物产量,我们必须进一步了解作物对各种非生物胁迫的响应和耐受机制的遗传和分子机制。gydF4y2Ba
大多数基因组研究都集中在植物模型或具有二倍体基因组的作物上。gydF4y2Ba拟南芥gydF4y2Ba而且gydF4y2Ba栽培稻gydF4y2Ba) [gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].这些研究为植物中与各种非生物胁迫相关的不同生物过程提供了有价值的见解。虽然模型和作物之间共享许多保守通路,但在进化过程中,同源基因之间有时会出现不同的功能[gydF4y2Ba7gydF4y2Ba].这限制了从模式物种到作物的功能表征结果的直接转化,并表明在作物植物(如小麦)中鉴定功能基因同源体需要进行种特异性研究。小麦是一种六倍体生物,起源于祖先基因组之间的杂交事件。这些事件提供了遗传多样性和可塑性[gydF4y2Ba8gydF4y2Ba]这是这种作物在不同生态条件下成功生长的关键[gydF4y2Ba9gydF4y2Ba].栽培小麦或祖先小麦的多样性基因库为识别胁迫相关基因提供了很好的机会,并提高了我们对基因网络的认识,这些基因网络可能有助于提高小麦在不同非生物胁迫条件下的性能。gydF4y2Ba
植物作为固着生物,需要进化出不同的策略来应对和适应环境的变化。暴露于非生物胁迫诱导生理和代谢反应,这些反应是通过涉及大量分子和应激反应基因的复杂信号转导网络介导的[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].干旱胁迫是由土壤水分亏缺引起的渗透胁迫引起的。此外,抑制COgydF4y2Ba2gydF4y2Ba干旱期间的固定导致叶绿体中的电子传递链和光系统活性紊乱,导致ROS产生和积累增加[gydF4y2Ba14gydF4y2Ba],这可能对植物有害。在进化过程中,植物在形态、生理和生化水平上适应了动态响应,使它们能够在快速变化的环境条件下生存。与耐受性状相关的适应性反应包括叶表面角质层蜡的生物合成、渗透调节能力的提高和细胞壁弹性的增加以维持组织膨胀[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba]通过木葡聚糖内转糖酶/水解酶(XTH)、纤维素合成酶、果胶酯酶、膨胀素、可溶性碳水化合物和脯氨酸和甜菜碱等渗透保护剂的合成和积累[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].这些形态或生理反应的表现包括从感知压力到大量增加生存机会的基因表达的过程。越来越多的证据表明,胁迫信号的转导和植物的反应是由钙和几种钙的活化介导的gydF4y2Ba2 +gydF4y2Ba传感器(gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba,一项研究表明,过表达Calmodulin 1 (CaM1)基因正调控NADPH氧化酶RbohF,导致ABA触发的ROS生成和气孔关闭[gydF4y2Ba21gydF4y2Ba].gydF4y2Ba
ABA是干旱诱导的关键信号,调节最终导致适应和耐受胁迫的生理反应。ABA在叶片中的积累直接调控气孔运动[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba]并减少水分流失,从而避免干旱[gydF4y2Ba24gydF4y2Ba].一项对野生小麦的研究证实了ABA敏感性与耐旱性之间的关系gydF4y2Ba山羊草属tauschiigydF4y2Ba其中耐旱品种gydF4y2Ba答:tauschiigydF4y2Ba表现出明显高于干旱敏感系的ABA敏感性,并倾向于积累更多的胁迫响应基因转录本[gydF4y2Ba23gydF4y2Ba].这表明ABA敏感性是由ABA感知/信号通路中不同基因的表达所调控的。在使用转基因系的研究中,过表达的基因涉及ABA信号,如天冬氨酸蛋白酶gydF4y2BaASPG1gydF4y2Ba, nadp -苹果酸酶或E3泛素连接酶增强了对干旱胁迫的耐受性[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].在另一项研究中,通过反义调节或受体样激酶1 (RPK1)突变导致的功能丧失gydF4y2Ba拟南芥gydF4y2BaABA敏感性降低,气孔关闭和几种胁迫诱导基因的表达,如lea样蛋白,过氧化物酶,RD26, dnaj样蛋白,细胞色素P450和SOD [gydF4y2Ba28gydF4y2Ba].SnRK2蛋白激酶亚家族的酶是植物对ABA反应的主要调节因子,通过直接磷酸化各种下游靶点,包括转录因子、NADPH氧化酶RbohF、lea样蛋白、DREB(脱水响应元件结合蛋白)、慢阴离子通道(SLAC)相关基因和抗氧化酶基因[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].这些研究表明,小麦的耐旱性是由一个复杂的基因调控网络控制的,对这个网络的了解仍然很少。gydF4y2Ba
转录因子是调节特定基因组表达的最重要的调节蛋白[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].它们在植物对非生物胁迫的反应中起着主要作用,它们将胁迫诱导的信号转化为细胞反应。干旱胁迫基因表达上调受干旱响应元件结合蛋白/C-repeat结合因子(DREB/CBF)、碱性亮氨酸拉链(bZIP)、成髓细胞癌基因(MYB)、gydF4y2BaNgydF4y2Ba点,gydF4y2Ba一个gydF4y2BaTAF1/2和gydF4y2BaCgydF4y2BaUC (NAC)、核因子Y (NF-Y)、锌指蛋白(ZFP)和含有高度保守的氨基酸序列WRKYGQK (WRKY)的蛋白[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba通过依赖aba或不依赖aba的途径。对胁迫诱导转录因子的功能分析可以为复杂的调控基因网络及其在非生物胁迫中的参与提供更多信息。在大豆中,dreb1型转录因子的过表达研究表明,它们诱导了许多属于脱氢酶/LEA家族的靶基因、伴侣基因和参与解毒和次级代谢产物合成的酶[gydF4y2Ba42gydF4y2Ba].几种WRKY转录因子被认为是不同植物胁迫反应和衰老的调节因子[gydF4y2Ba43gydF4y2Ba].过度的gydF4y2BaGmWRKY27gydF4y2Ba降低ROS水平,提高转基因大豆植株的耐盐性和耐旱性[gydF4y2Ba44gydF4y2Ba].在转基因水稻植株中,过表达gydF4y2BaOsWRKY89gydF4y2Ba导致生长迟缓,增加蜡在叶片表面的沉积,以及紫外线B耐受[gydF4y2Ba45gydF4y2Ba].另一种水稻转录因子OsMYB2,通过刺激可溶性糖和脯氨酸的积累,赋予水稻对多种胁迫的耐受性,如盐度、寒冷和干旱[gydF4y2Ba46gydF4y2Ba],而过度表达gydF4y2Ba拟南芥MYB96gydF4y2Ba角质层积蜡增强抗旱性[gydF4y2Ba47gydF4y2Ba].同样,水稻SERF1转录因子已被证明可以调节与耐盐性相关的不同基因的表达,包括三个Cys2/ his2型(C2H2)锌指蛋白(gydF4y2BaZfp179, zfp182, zfp252)gydF4y2Ba(施密特等人,2013)。这些C2H2 ZFP转录因子在水稻中过表达被证明可以增加对盐和/或干旱的耐受性[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].更多的研究表明,C2H2 ZFP转录因子参与了植物对干旱、寒冷、盐、强光和氧化应激的响应和耐受性gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba]和米[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba].遗传分析显示,ZAT10和ZAT12是C2H2 ZFPs家族中两个被广泛研究的成员gydF4y2Ba拟南芥gydF4y2Ba,是ros清除酶基因表达所必需的[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba].这些结果表明,C2H2 ZFPs可能在非生物胁迫下调控ROS信号通路中发挥重要作用。在小麦中,至少有53个C2H2分子gydF4y2BaTaZFPgydF4y2Ba亚科(C12i)已鉴定[gydF4y2Ba60gydF4y2Ba].后一项研究显示,37gydF4y2BaTaZFPgydF4y2Ba干旱胁迫和至少一种其他非生物胁迫使成员上调。然而,这种机制gydF4y2BaTaZFPgydF4y2Ba小麦亚科协调胁迫反应的研究还很少。在这37名成员中,gydF4y2BaTaZFP1BgydF4y2Ba(gydF4y2BaTaZFP1gydF4y2Ba在所有胁迫条件下(强光、洪水、干旱、HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba),并与Al耐受性有关[gydF4y2Ba61gydF4y2Ba].这表明该基因可以调控胁迫诱导基因的表达,并可能在小麦各种含氧化胁迫成分的非生物胁迫中发挥重要作用。另一种小麦gydF4y2BaZFPgydF4y2Ba基因命名gydF4y2BaTaZFP1gydF4y2Ba最近被证明可以提高烟草的耐盐性[gydF4y2Ba62gydF4y2Ba].然而,这个TaZFP1有8个C2H2结构域(相比之下,TaZFP1B中有2个C2H2结构域),并且与TaZFP1B或我们之前确定的任何其他TaZFP亚家族成员没有显著的同源性[gydF4y2Ba60gydF4y2Ba].gydF4y2Ba
在这里,我们重点研究了C2H2锌指转录因子TaZFP1B在小麦干旱胁迫下的功能特征,利用一个新的四组分BSMV过表达系统和一个特征良好的三组分BSMV基因下调系统[gydF4y2Ba63gydF4y2Ba].我们的研究结果表明,TaZFP1B通过刺激清除ROS系统和上调许多基因来提高对干旱胁迫的耐受性,这些基因在使用不同植物的转基因研究中被证明可以提高干旱和ROS耐受性[gydF4y2Ba64gydF4y2Ba].有证据表明,TaZFP1B是小麦耐旱性的关键调控因子。gydF4y2Ba
结果gydF4y2Ba
TaZFP1BgydF4y2Ba表达水平与抗旱性增加呈正相关gydF4y2Ba
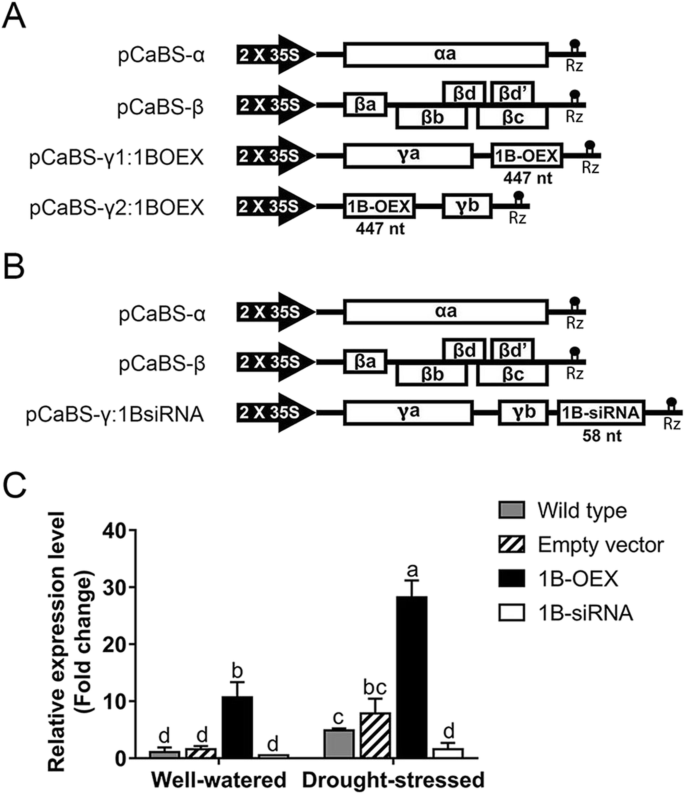
为了研究TaZFP1B对干旱胁迫耐受性的影响,利用大麦条纹花叶病毒的三组分或四组分体系,产生了低组分或高组分的小麦植株gydF4y2BaTaZFP1BgydF4y2Ba分别表达水平(图;gydF4y2Ba1gydF4y2Ba这些转化子被命名为空载体(无cDNA插入),1B-OEX (gydF4y2BaTaZFP1BgydF4y2Ba过表达)和1B-siRNA (gydF4y2BaTaZFP1BgydF4y2Ba沉默)。确认新的BSMV病毒介导过表达(VOX)系统可以用于修饰gydF4y2BaTaZFP1BgydF4y2Ba通过qRT-PCR对该转录本进行分析(图;gydF4y2Ba1gydF4y2Bac).正如预期的那样gydF4y2BaTaZFP1BgydF4y2Ba在水分充足的条件下,1B-OEX植株的转录水平比野生型植株高出约12倍。和预期的一样,gydF4y2BaTaZFP1BgydF4y2Ba在水分充足的植物中,1B-siRNA在植物中的表达较低,这证实了一种有效的靶向gydF4y2BaTaZFP1BgydF4y2Ba由siRNA转录。通过分析最接近的表达谱来验证siRNA的特异性gydF4y2BaTaZFPgydF4y2Ba亲戚(gydF4y2BaTaZFP1AgydF4y2Ba,gydF4y2Ba1 dgydF4y2Ba,gydF4y2Ba2 bgydF4y2Ba,gydF4y2Ba二维gydF4y2Ba,gydF4y2Ba3 bgydF4y2Ba而且gydF4y2Ba3 dgydF4y2Ba)(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。该分析表明1B-siRNA也影响同源拷贝的表达gydF4y2BaTaZFP1AgydF4y2Ba(来自A基因组)但没有靶向gydF4y2BaTaZFP2gydF4y2Ba或gydF4y2BaTaZFP3gydF4y2Ba成绩单(gydF4y2Ba60gydF4y2Ba].请注意,gydF4y2BaTaZFP2AgydF4y2Ba而且gydF4y2BaTaZFP3AgydF4y2Ba在小麦中尚未发现。经过7天的干旱处理后gydF4y2BaTaZFP1BgydF4y2Ba野生型植物的转录水平比浇水充足的植物上调约5倍。在干旱胁迫下的空载体植物中也观察到类似的结果。另一方面,干旱诱导的上调gydF4y2BaTaZFP1BgydF4y2Ba在1B-OEX植物中,这一上调幅度比野生型植物在干旱胁迫后观察到的上调幅度高约6倍。然后,我们试图确定是否增加表达gydF4y2BaTaZFP1BgydF4y2Ba引起表型变化(图;gydF4y2Ba2gydF4y2Ba).有趣的是,过度表达gydF4y2BaTaZFP1BgydF4y2Ba在充足的水条件下改善植物生长(图;gydF4y2Ba2gydF4y2Baa).在1B-OEX植物中,与其他三种植物(野生型、空载体和1B-siRNA)相比,其生长速度更为强劲。另一方面,沉默gydF4y2BaTaZFP1BgydF4y2Ba造成轻微的肿胀损失。14天的干旱胁迫显著地削弱了四种植物类型的膨胀,但1B-OEX植物的影响不那么严重(图2)。gydF4y2Ba2gydF4y2Bab).补水7 d后,1B-OEX植株恢复较其他植株快(图2)。gydF4y2Ba2gydF4y2Bac).空载体与野生型植物之间没有明显的表型差异,说明水分充足和干旱条件下的表型依赖于gydF4y2BaTaZFP1BgydF4y2Ba表达水平,而不是用于感染的病毒成分。为了验证干旱对种子产量的影响,在植物到达孕穗期后,水分被保留10天(图2)。gydF4y2Ba2gydF4y2Bad).我们的结果表明,干旱胁迫显著降低了所有植物的穗长、每穗总粒重、每穗粒数和平均粒重(10粒)。有趣的是,与野生型和空载体植物相比,1B-OEX植物的每穗粒重较高,而1B-siRNA植物的每穗粒重较低(表2)gydF4y2Ba1gydF4y2Ba).再一次,gydF4y2BaTaZFP1gydF4y2Ba表达水平可能解释了所获得的结果,因为空载体和野生型植物之间的数据相似,它们显示出相似的表达水平gydF4y2BaTaZFP1BgydF4y2Ba表达式。gydF4y2Ba
用于修改的矢量示意图表示形式gydF4y2BaTaZFP1BgydF4y2Ba小麦中的表达。gydF4y2Ba一个gydF4y2Ba用于过表达的四分量BSMV系统的向量。gydF4y2BabgydF4y2Ba用于消声的三分量BSMV系统的矢量。gydF4y2BacgydF4y2Ba量化的gydF4y2BaTaZFP1BgydF4y2Ba小麦中的转录本。野生型,未感染的Atlas 66植物;空载体,Atlas 66植物感染四种基本(“空”)质粒:pCaBS-α, pCaBS-β, pCaBS-γ1:00和pCaBS-γ2:00;1B-OEX, Atlas 66植物被(中描述的四种质粒感染gydF4y2Ba一个gydF4y2Ba);1B-siRNA, Atlas 66植物感染的三种质粒(gydF4y2BabgydF4y2Ba).数值为4个生物重复的平均值±标准差。不同字母表示样本间差异有统计学意义(gydF4y2BaPgydF4y2BaTukey 's检验< 0.05)gydF4y2Ba
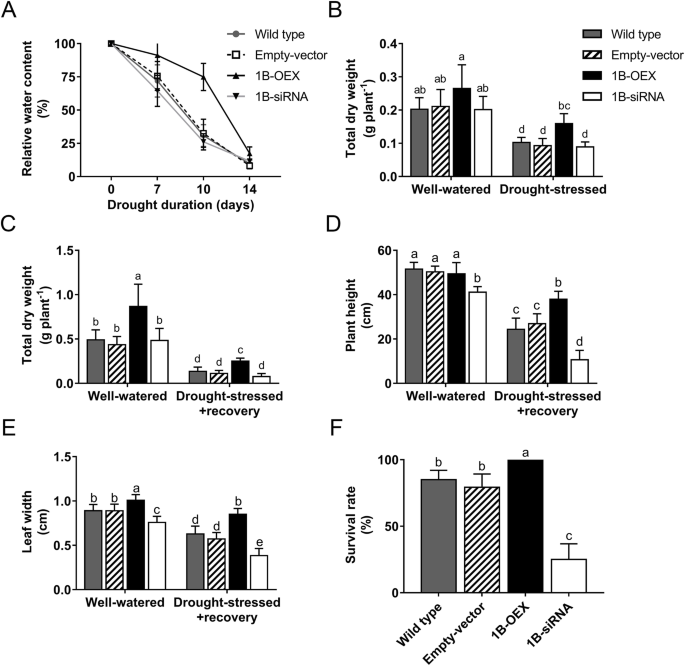
TaZFP1B增强了小麦植株对干旱胁迫的耐受性。不同类型的小麦植物(见图。gydF4y2Ba1gydF4y2Ba)种植14天,然后再浇水7天(gydF4y2Ba一个gydF4y2Ba)或因干旱而缺水14天(gydF4y2BabgydF4y2Ba).为了恢复,对照植物和干旱胁迫植物每天浇水,持续7天(共生长35天)(gydF4y2BacgydF4y2Ba).野生型,空载体,1B-OEX和1B-siRNA植物的照片(cv。Dakosta)在孕穗期受干旱胁迫10天,然后生长至成熟(gydF4y2BadgydF4y2Ba)gydF4y2Ba
研究了干旱胁迫对其他生长参数的影响。相对含水量(relative water content, RWC)是反映水体状况的重要指标。对植物进行干旱胁迫14 d,并在不同时间点测定RWC。结果如图。gydF4y2Ba3.gydF4y2Baa表明,与1B-OEX植物相比,野生型、空载体和1B-siRNA植物的RWC下降较快。干旱胁迫10 d后,1B-OEX植株的RWC显著高于其他植株。结果如图。gydF4y2Ba3.gydF4y2BaB表明,在水分充足的条件下,4种植物的干重积累无显著差异。然而,与浇水充足的植物相比,植物在干旱胁迫下暴露14天会导致干重减少,尽管这种减少在1B-OEX植物中明显较少。在水分充足的条件下,1B-OEX植株生长35 d后,干重高于其他植株,干旱胁迫14 d和恢复7 d后也是如此(图2)。gydF4y2Ba3.gydF4y2Bac).尽管1B-OEX植株的性能优越,但与在最佳条件下继续生长的1B-OEX水分充足的植株相比,干旱胁迫+恢复植株的干重显著降低(图。gydF4y2Ba3.gydF4y2Bac).与浇水充足的植物相比,所有植物在干旱胁迫和恢复后的株高都显著降低。然而,在水分充足条件下或干旱胁迫和恢复后,1B-siRNA植物的株高低于其他三种类型的植物(图2)。gydF4y2Ba3.gydF4y2Bad).干旱胁迫和恢复后,1B-OEX植株最高,1B-siRNA植株最矮。在水分充足的条件下,1B-OEX植株也长出了更宽的叶片,而1B-siRNA植株则相反(图2)。gydF4y2Ba3.gydF4y2Bae).在干旱胁迫和恢复后,所有植物的叶宽都比水分充足的植物减小。然而,1B-OEX植物的叶子最宽,而1B-siRNA植物的叶子最窄。经过干旱胁迫和恢复后,所有1B-OEX植株都存活了下来,而1B-siRNA的存活率仅为25%,而野生型和空载体植物的存活率为80-85%(图2)。gydF4y2Ba3.gydF4y2Baf).此外,叶绿素荧光成像显示,10天干旱胁迫降低了野生型和空载体植物叶片中的叶绿素含量,在1B-siRNA植物中降幅更大(附加文件)gydF4y2Ba2gydF4y2Ba:图S2)。相比之下,即使在干旱14天后,1B-OEX植物的叶绿素荧光仍然很高。这些结果表明TaZFP1B参与了胁迫下叶绿素的稳定。gydF4y2Ba
TaZFP1BgydF4y2Ba过表达可以改善植物的生理参数。植物按照图中描述的方式生长和处理。gydF4y2Ba2gydF4y2Ba.测量以下生理参数:gydF4y2Ba一个gydF4y2Ba相对含水量;gydF4y2BabgydF4y2Ba水分充足和干旱胁迫植物的总干重;gydF4y2BacgydF4y2Ba水分充足的植物和干旱胁迫恢复后的总干重;gydF4y2BadgydF4y2Ba株高;gydF4y2BaegydF4y2Ba第二叶宽;而且gydF4y2BafgydF4y2Ba干旱处理和恢复后的存活率。数值为4个生物重复的平均值±标准差。不同字母表示样本间差异有统计学意义(gydF4y2BaPgydF4y2BaTukey 's检验< 0.05)gydF4y2Ba
TaZFP1B提高了对干旱诱导氧化应激的耐受性gydF4y2Ba
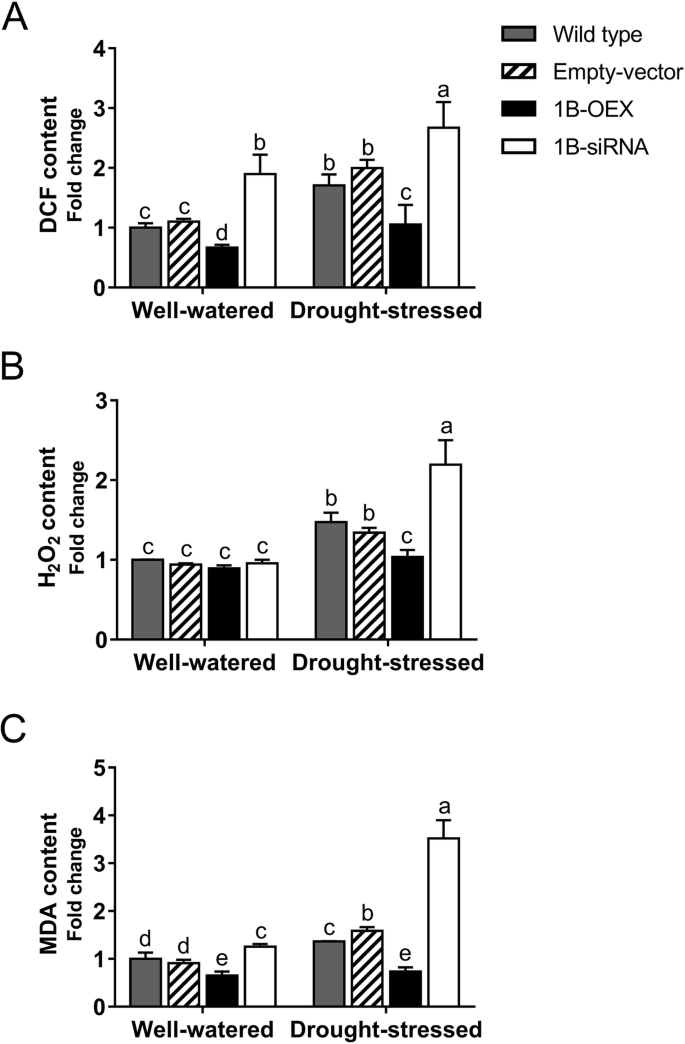
通过分析2 ',7 ' -二氯荧光素(DCF)的积累来研究TaZFP1B对ROS积累的影响(图。gydF4y2Ba4gydF4y2Baa).水分充足的野生型和空载体植物的DCF水平相似,而1B-OEX和1B-siRNA植物的DCF水平分别较低和较高。与水分充足的植株相比,7天干旱胁迫导致野生型和空载体植株DCF的显著积累。在1B-siRNA植物中,DCF水平较高,而在1B-OEX植物中则明显较低。gydF4y2Ba
TaZFP1B减少干旱胁迫下ROS的积累。植物按照图中描述的方式生长和处理。gydF4y2Ba2gydF4y2Ba除干旱胁迫7 d外。制备可溶性提取物,并测定DCF (gydF4y2Ba一个gydF4y2Ba), HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba(gydF4y2BabgydF4y2Ba)和丙二醛(gydF4y2BacgydF4y2Ba),以及蛋白质含量,结果表示为相对于水分充足的野生型植物的折叠变化。数值为4个生物重复的平均值±标准差。不同字母表示样本间差异有统计学意义(gydF4y2BaPgydF4y2BaTukey 's检验< 0.05)gydF4y2Ba
由于HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba是干旱胁迫下产生的主要ROS物种中最稳定的[gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba],也检查了其在叶组织中的产生(图。gydF4y2Ba4gydF4y2Bab). H无明显变化gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba不同水分充足的植物之间的内容。干旱胁迫7 d后,HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在野生型和空载体植物中,HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在1B-siRNA植物中观察到。相反,H含量无显著增加gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在1B-OEX植物中。gydF4y2Ba
各种自由基的积累导致脂质过氧化,脂质过氧化本身会导致丙二醛(MDA)等副产物的形成[gydF4y2Ba67gydF4y2Ba].通过测定叶片组织中丙二醛的含量来评估脂质的氧化损伤。如图所示。gydF4y2Ba4gydF4y2Bac,水分充足的1B-OEX植株MDA积累减少,1B-siRNA植株MDA积累增加。在干旱胁迫后,野生型和空载体植物中MDA水平升高,在1B-siRNA植物中更是如此。相比之下,过度表达gydF4y2BaTaZFP1BgydF4y2Ba阻止干旱诱导的MDA积累。gydF4y2Ba
活性氧清除系统的基因表达及活性gydF4y2Ba
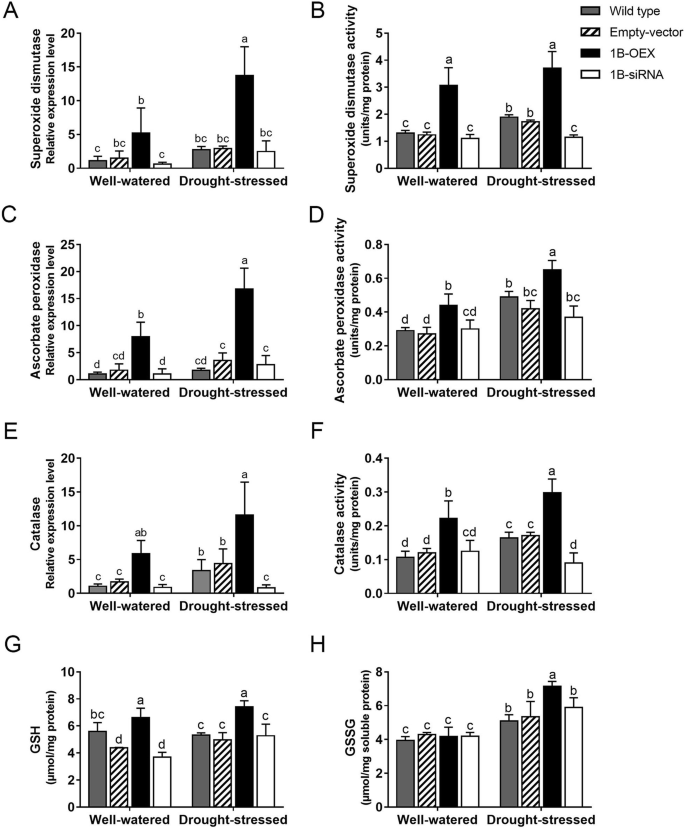
在应激条件下,维持细胞内ROS稳态需要抗氧化酶和化合物的存在[gydF4y2Ba11gydF4y2Ba].植物清除ros的主要酶有超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)和过氧化氢酶(CAT)。为了研究TaZFP1B是否需要清除ROS,我们选择了RNA-Seq数据中表达增加的SOD (TRIAE_CS42_2BL_TGACv1_131439_AA0427700)、APX (TRIAE_CS42_U_TGACv1_642188_AA2112960.5)和CAT (TRIAE_CS42_7DL_TGACv1_602975_AA1973160.1)基因进行qRT-PCR分析(图。gydF4y2Ba5gydF4y2BaA, c和e)。还测定了SOD、APX和CAT的酶活性(图。gydF4y2Ba5gydF4y2BaB d和f)。在水分充足的条件下,显著上调gydF4y2Ba草皮gydF4y2Ba在1B-OEX植物中观察到SOD的表达和总活性,而在其他三种植物中无显著差异(图2)。gydF4y2Ba5gydF4y2Baa和b). 7 d干旱胁迫上调gydF4y2Ba草皮gydF4y2BaRNA表达和SOD活性在野生型和空载体植物中表现较弱,但在1B-OEX植物中表现较强。干旱胁迫不诱导1B-siRNA植物SOD活性,表明TaZFP1B是干旱胁迫的必要条件gydF4y2Ba草皮gydF4y2Ba老年病。另外两种抗氧化酶(APX和CAT)也观察到了类似的结果。gydF4y2Ba5gydF4y2BaC到f)。gydF4y2Ba
TaZFP1B增强ROS清除系统的基因表达和活性。植物按照图中描述的方式生长和处理。gydF4y2Ba2gydF4y2Ba除干旱胁迫7 d外。表达水平gydF4y2Ba草皮gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),gydF4y2BaAPX型gydF4y2Ba(gydF4y2BacgydF4y2Ba),gydF4y2Ba猫gydF4y2Ba(gydF4y2BaegydF4y2Ba)用qPCR法测定,结果以相对于水分充足的野生型植物的折叠变化表示。这些基因对应的酶活性也进行了测定(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba而且gydF4y2BafgydF4y2Ba).还测定了还原性和氧化性谷胱甘肽(GSH和GSSG)的含量(gydF4y2BaggydF4y2Ba而且gydF4y2BahgydF4y2Ba).数值为4个生物重复的平均值±标准差。不同字母表示样本间差异有统计学意义(gydF4y2BaPgydF4y2BaTukey 's检验< 0.05)gydF4y2Ba
据报道,非酶促抗氧化剂如还原性谷胱甘肽(GSH)在氧化应激管理中发挥着重要作用[gydF4y2Ba68gydF4y2Ba].我们通过测定叶片组织中的还原性谷胱甘肽(GSH)和氧化性谷胱甘肽(GSSG)来测定总谷胱甘肽含量。如图所示。gydF4y2Ba5gydF4y2Bag,在水分充足的条件下,与野生型、空载体和1B-siRNA植物相比,1B-OEX植物中GSH的含量更高。干旱胁迫7 d后,野生型、空载体和1B-siRNA植株中谷胱甘肽含量相似,而1B-OEX植株中谷胱甘肽含量较高。在对照条件下,四种植物类型的GSSG水平相似。干旱胁迫导致四种植物的GSSG显著积累,其中1B-OEX植物的GSSG积累最高(图2)。gydF4y2Ba5gydF4y2Bah).这些结果表明TaZFP1B提高了抗氧化能力。gydF4y2Ba
水分充足条件下转录组的改变gydF4y2Ba
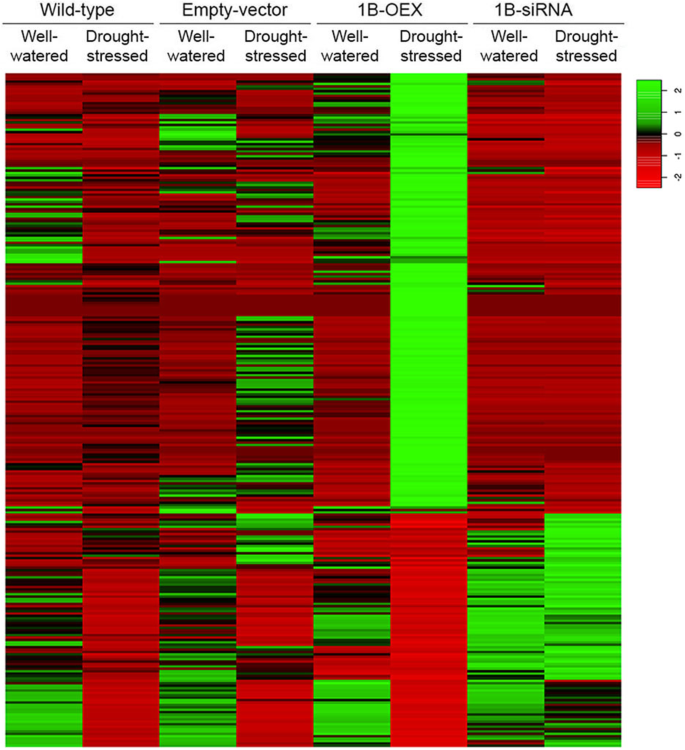
为了更好地了解TaZFP1B在分子水平上的功能,我们对8个mRNA-Seq文库进行了测序,以分析转录谱。来决定如何gydF4y2BaTaZFP1BgydF4y2Ba转录水平影响基因表达,在水分充足或干旱条件下,将1B-OEX和1B-siRNA植物的mRNA谱与野生型植物的mRNA谱进行比较。通过生成不同类型植物之间差异调控转录本的热图,可以可视化全局表达模式(图2)。gydF4y2Ba6gydF4y2Ba).我们发现,在1B-OEX水分充足的植物中,27个转录本上调了至少5倍gydF4y2Ba2gydF4y2Ba).这些上调的基因编码的蛋白质涉及转录、钙结合、应激反应、氧化还原、细胞壁和膜结构、运输、细胞周期和碳水化合物代谢。其中一些蛋白质与非生物应激反应有关。gydF4y2Ba
显示差异基因表达的热图。植物按照图中描述的方式生长和处理。gydF4y2Ba2gydF4y2Ba除干旱胁迫7天外,制备RNA-Seq文库并测序。利用log2转换TPM表达式值的Spearman相关系数生成层次聚类。颜色刻度表示表达水平(红色,低表达;绿色,高表情)。干旱胁迫下1B-OEX植株中至少上调5倍的187个基因见表gydF4y2Ba4gydF4y2Ba.干旱胁迫下TaZFP1B过表达下调至少2倍的96个基因见表gydF4y2Ba5gydF4y2Ba
虽然基因表达的5倍诱导为基因受TaZFP1B调控提供了信心,但在1B-OEX植物中上调1 - 5倍的基因仍可能在胁迫耐受性中发挥重要作用。例如,编码已知在ROS清除中的作用的酶的基因(附加文件gydF4y2Ba3.gydF4y2Ba:表S1)特别令人感兴趣:SOD增加2.5倍,APX增加2.1倍,CAT增加1.8倍。的过度表达gydF4y2BaTaZFP1BgydF4y2Ba也下调了11个转录本至少2倍(表gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
干旱胁迫下转录组的改变gydF4y2Ba
来识别分子途径gydF4y2BaTaZFP1BgydF4y2Ba在干旱胁迫下,比较了1B-OEX与野生型植物的转录水平。我们的分析揭示了过度表达gydF4y2BaTaZFP1BgydF4y2Ba与其他三种类型的植物相比,在干旱胁迫下改变了许多新基因的表达(图2)。gydF4y2Ba6gydF4y2Ba).我们发现187个转录本上调了至少5倍(表gydF4y2Ba4gydF4y2Ba)在干旱处理的1B-OEX植物中,与野生型植物相比。其中包括编码参与转录、信号转导、应激反应、氧化还原过程、细胞壁和膜结构、细胞周期、转运、蛋白质翻译后修饰、碳水化合物、脂肪酸和氮代谢以及其他代谢的蛋白质的基因。有趣的是与ROS相关的基因数据。编码刺激ROS产生的酶的基因,如NADPH氧化酶(#143)和半乳糖氧化酶(#149),与编码ROS清除酶的基因,如过氧化物酶(#137,#141,#142)和硫氧还蛋白(#153)同时上调。许多已知的在应激反应和耐受性中起作用的基因也被上调(表gydF4y2Ba4gydF4y2Ba):基因编码脱氢酶(#91,#95,#100,#114),冷反应蛋白COR14a(#69),葡聚糖内-1,3- β -葡萄糖苷酶(#182),重复结构域蛋白(#92,#102,# 125-127),nadp依赖的苹果酶(#183),E3泛素蛋白连接酶(#178,#179),富含甘氨酸或羟脯氨酸的蛋白(#113,#159)和参与程序性细胞死亡的基因(#148,#160,#164,#165)。此外,TaZFP1B上调了一些编码与细胞壁修饰有关的酶的基因,如木葡聚糖内转葡萄糖苷酶/水解酶(#154)和果胶酯酶(#155),以及编码与细胞壁重塑相关的其他蛋白质的基因,如扩张素(#156),拉霉素(#157)和WAX2(#158)。一些参与碳水化合物和脂肪酸代谢的基因也被上调(# 182-195)。另一方面,与野生型植物相比,干旱处理的1B-OEX植物中有96个转录本下调了至少2倍(表2)gydF4y2Ba5gydF4y2Ba).其中许多基因参与光合作用代谢(# 244-264)。综上所述,这些观察结果强调了TaZFP1B在干旱胁迫下转录调节的作用,表明TaZFP1B是胁迫相关基因的关键调节因子,这些基因在干旱胁迫和氧化应激耐受性中至关重要。gydF4y2Ba
讨论gydF4y2Ba
新的BSMV表达系统可用于小麦功能基因的鉴定gydF4y2Ba
众所周知,小麦的功能表征比在模型系统中更难实现gydF4y2Ba拟南芥gydF4y2Ba.此外,在异种系统中描述作物基因的特性带来了许多无法轻易回答的问题,而且数据解释并不总是能翻译到作物物种上。在这项研究中,我们证明了BSMV系统可以简单、快速和有效地直接对小麦这一重要的作物物种进行基因表征。利用我们为VOX开发的4组分BSMV系统和现有的针对VIGS的3组分BSMV系统,我们在这里证明TaZFP1B转录因子是小麦抗氧化和干旱胁迫所必需的。gydF4y2Ba
干旱是限制全球作物生长和产量的主要非生物因素。提高作物的耐旱性是农业可持续性的一个重要考虑因素,特别是因为预计气候变化将加剧干旱期的发生和严重程度。从以前的研究中,我们确定了c2h2型锌指成员gydF4y2BaTaZFP1BgydF4y2Ba(以前叫gydF4y2BaTaZFP2gydF4y2Ba)是受各种非生物胁迫(铝、强光、缺氧、HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba还有干旱)[gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba].我们目前的研究表明过度表达gydF4y2BaTaZFP1BgydF4y2Ba与CBFs等其他干旱相关转录因子相比,在正常生长条件下不会导致生长减少[gydF4y2Ba69gydF4y2Ba,gydF4y2Ba70gydF4y2Ba].植物overexpressinggydF4y2BaTaZFP1BgydF4y2Ba植物抗旱能力强而表达不足gydF4y2BaTaZFP1BgydF4y2Ba更敏感。与野生型植物相比,1B-OEX植株的相对含水量、干物质产量、茎长、叶宽、成活率和穗粒产量等表型参数均有改善。这种对生长的积极影响可能是通过植物磺因子受体介导的(#78),因为过度表达gydF4y2BaAtPSKR1gydF4y2Ba促进拟南芥的生长[gydF4y2Ba71gydF4y2Ba].gydF4y2Ba
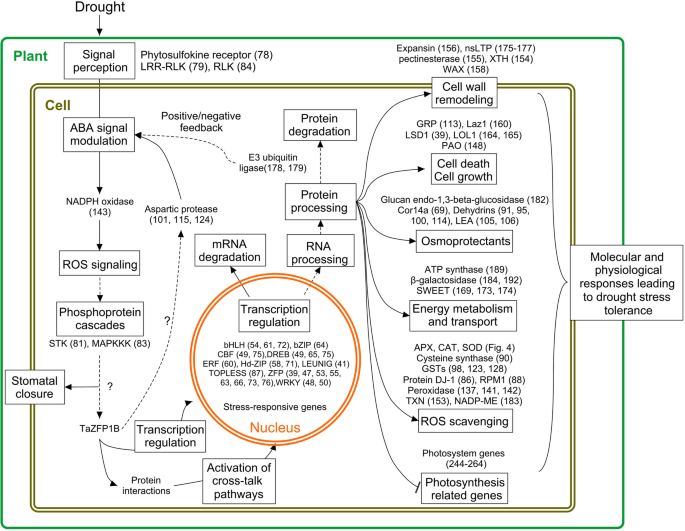
在本研究中进行的转录组分析实验表明,TaZFP1B调节应激反应和耐受性的转录本集合。大多数是应激反应基因,参与信号、转录、氧化还原过程、细胞壁和膜结构、转运、细胞周期和碳水化合物代谢。一些基因的强烈上调之前并没有与干旱或氧化应激耐受性相关,在此不再讨论。然而,它们的强烈上调表明,进一步描述这些基因可能是有兴趣的。我们的分析显示,与野生型相比,1B-OEX植物在应对干旱胁迫时,188个基因上调了至少5倍。在这一点上,很难确定在这项研究中确定的基因是否真的是转基因研究中已经证明了其抗胁迫功能的基因的直系同源。然而,它们可以发挥类似的作用,并解释1B-OEX植物抗旱性的提高[gydF4y2Ba72gydF4y2Ba].一个总结基因表达变化及其与耐旱性潜在关系的模型如图所示。gydF4y2Ba7gydF4y2Ba支持讨论。gydF4y2Ba
1B-OEX植物的主要变化及其与耐旱性相关的信号通路实线表示单步反应,虚线表示多步反应。ABA,脱落酸;APX,抗坏血酸过氧化物酶;bHLH,基本螺旋-环-螺旋,;bZIP,基本亮氨酸拉链;猫,过氧化氢酶;CBF,核心结合因子;COR,冷调节基因;DJ-1,蛋白脱糖酶DJ-1, DREB,脱水响应元件结合; ERF, ethylene response factor; GST, glutathione S-transferase; GRP, glycine-rich protein; Hd-ZIP, homeodomain-leucine zipper; HSP, heat shock proteins; Laz1, Lazarus 1; LEA, late embryogenesis abundant; LRR-RLK, leucine-rich repeats receptor-like kinase; LOL1, lsd one like 1; LSD1, lesion simulating disease 1; MAPKKK, mitogen-activated protein kinase kinase kinase; NADP-ME, NADP-dependent malic enzyme; nsLTP, non-specific lipid transfer protein; PAO, polyamine oxidase; SOD, superoxide dismutase; STK, serine/threonine kinase; ROS, reactive oxygen species; RUBISCO, ribulose bisphosphate carboxylase/oxygenase; TXN, thioredoxin protein; WAX; WRKY, transcription factor containing a highly conserved WRKY domain; and XTH, xyloglucan endotransglucosylase/hydrolase and ZFP, zinc finger protein;. Numbers refer to the corresponding genes in Tables2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba而且gydF4y2Ba5gydF4y2Ba
信号感知和调制gydF4y2Ba
干旱引发植物激素ABA的产生,ABA反过来诱导环境适应所需的应激相关基因的表达。因此,aba相关反应与干旱反应有着错综复杂的关系。富亮氨酸重复受体样激酶(LRR-RLKs)(#79)属于受体样激酶(RLKs)的大亚家族,是环境刺激的重要介质(图。gydF4y2Ba7gydF4y2Ba).有人提出LRR-RLKs可能参与了对干旱和ABA感知的早期反应[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba73gydF4y2Ba].由于其在发育和应激反应中的作用,LRR-RLKs是非生物抗应激的新的潜在靶点[gydF4y2Ba74gydF4y2Ba].在拟南芥中,抑制LRR-RLK RPK1下调了许多ABA诱导基因,导致ABA敏感性降低和气孔关闭[gydF4y2Ba28gydF4y2Ba].这表明RLKs在ABA信号转导通路中起着重要的调节作用。此外,已知作为转录抑制因子的LEUNIG和topless相关蛋白(#41,#87)在1B-OEX植物中被干旱诱导[gydF4y2Ba75gydF4y2Ba].这表明,与耐旱性负相关的基因的转录抑制可能是一种需要进一步研究的机制。gydF4y2Ba
早期研究表明ABA通过激活NADPH氧化酶诱导ROS的产生[gydF4y2Ba25gydF4y2Ba].NADPH氧化酶表达增加(#143和附加文件gydF4y2Ba4gydF4y2Ba:图S3A)在1B-OEX植物中可能参与ABA信号的调节。ROS如超氧自由基和过氧化氢被认为是ABA信号传递的必要分子,而在干旱胁迫下,过量积累可能是非常有毒的。因此,调节ROS信号转导和ROS解毒的调控机制是协调对ABA的反应所必需的。ROS作为细胞内信号触发对干旱胁迫的反应[gydF4y2Ba76gydF4y2Ba,gydF4y2Ba77gydF4y2Ba].它们通过激活蛋白激酶和磷酸酶诱导磷酸化和去磷酸化事件[gydF4y2Ba78gydF4y2Ba].在本研究中,一些蛋白激酶和磷酸酶通过过表达上调了2到5倍gydF4y2BaTaZFP1BgydF4y2Ba(附加文件gydF4y2Ba3.gydF4y2Ba:表S1)。磷酸蛋白级联在介导非生物胁迫反应和耐受性方面起着重要的调节作用。丝氨酸/苏氨酸激酶(#81)和MAP激酶(#83)能够磷酸化广泛的底物,并与许多不同的应激反应有关[gydF4y2Ba79gydF4y2Ba].我们之前的生物信息学分析已经确定了TaZFP1B氨基酸序列中不同激酶的几个假定磷酸化位点[gydF4y2Ba60gydF4y2Ba].这表明在干旱胁迫下,磷酸化可能是完全激活TaZFP1B所必需的。gydF4y2Ba7gydF4y2Ba).此外,有研究报道,拟南芥中的C2H2锌指蛋白ZAT10和ZAT6以及水稻中的ZFP36需要激酶激活才能对胁迫耐受性进行正向调控[gydF4y2Ba57gydF4y2Ba,gydF4y2Ba80gydF4y2Ba,gydF4y2Ba81gydF4y2Ba].gydF4y2Ba
为了控制胁迫下ROS的积累水平,植物会激活抗氧化功能相关基因的表达和应激蛋白的产生。在gydF4y2Ba拟南芥gydF4y2Ba,过度表达gydF4y2BaASPG1gydF4y2Ba天冬氨酸蛋白酶降低HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba解毒酶(SOD和CAT)的平行激活,对ABA的敏感性增强,抗旱性提高[gydF4y2Ba24gydF4y2Ba].据此,我们的研究显示,在水分充足的条件(#6)和干旱胁迫(#101,#115)下,1B-OEX小麦中编码天冬氨酸蛋白酶的基因被TaZFP1B强烈上调gydF4y2Ba4gydF4y2Ba:图S3B), #124)。这一结果表明,天冬氨酸蛋白酶可能通过调控ABA敏感性在提高小麦抗旱性和ROS解毒机制中发挥重要作用(图2)。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
此外,1B-OEX植株ROS积累较低,这与SOD、APX和CAT编码基因上调,SOD、APX和CAT活性显著升高有关。的过度表达gydF4y2BaTaZFP1BgydF4y2Ba增加编码锚蛋白重复序列的基因表达(#25)。研究表明,AKR2A蛋白在拟南芥中作为APX3的伴侣蛋白[gydF4y2Ba82gydF4y2Ba],为观察到的APX活性增加提供了额外的支持。蛋白质DJ-1同源物D(#86)的诱导可能有助于1B-OEX植物的整体氧化应激耐受性,因为过表达AtDJ-1A的拟南芥植物对各种非生物胁迫的耐受性增强,可能是通过与sod相互作用[gydF4y2Ba83gydF4y2Ba].这表明,在小麦中观察到的耐旱性的增强也可能是由与sod的相互作用介导的,进一步将干旱和氧化应激联系起来。RPM1的增加(#88)也有助于氧化应激的改善,通过观察表明,当AtRPM1在拟南芥中过表达时,SOD和CAT活性增加[gydF4y2Ba84gydF4y2Ba].TaZFP1B OEX还能增加GSH和GSSG含量,GSH和GSSG是植物ROS解毒的重要代谢产物。半胱氨酸合成酶(#90)的增加可能为GSH的合成贡献了更多的Cys [gydF4y2Ba85gydF4y2Ba].总之,这些结果表明过度表达gydF4y2BaTaZFP1BgydF4y2Ba与野生型小麦相比,触发更大的维持ROS稳态的能力,提高耐旱性和生产力。gydF4y2Ba
越来越多的研究报告了泛素蛋白连接酶(E3s)的关键作用(#178和#179和附加文件)gydF4y2Ba4gydF4y2Ba:图S3C)在植物发育过程中的作用,包括对非生物胁迫的响应[gydF4y2Ba86gydF4y2Ba].水稻U-box E3连接酶OsPUB15经HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba干旱胁迫对植物的耐受性有重要影响。其过表达促进转基因植物在干旱胁迫下的生长[gydF4y2Ba87gydF4y2Ba].相比之下,过度表达gydF4y2BaAtPUB19gydF4y2BaABA信号负调控,抗旱性降低[gydF4y2Ba88gydF4y2Ba].基于这些研究,我们假设TaZFP1B的功能可能涉及下游E3连接酶(图2)。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
转录因子之间或与其他蛋白质复合物之间的物理相互作用已成为重要机制,允许不同途径之间的交叉对话,从而增强对环境条件的适应性[gydF4y2Ba89gydF4y2Ba].这表明在1B-OEX植物中被上调的转录因子成员可能参与了特定的或共享的通路。转录因子作为许多胁迫响应基因的调控因子,是干旱处理1B-OEX植物中差异表达的最大基因群之一。根据基因注释,属于大家族的转录因子被强烈上调:bHLH(#54, #61, #72和#77),bZIP (#64), CBF/DREB(#49和#75),ERF (#60), HD-ZIP(#58和#71),WRKY(#48和#50)和ZFP(#39, #47, #53, #55, #63, #66, #73和#76)。这些转录因子可以诱导与不同激素信号通路相关的额外基因的表达,这些信号通路包括脱落酸(#101,#115,#124,#134和#185),茉莉酸(#89和#107),生长素(#104,#118和#136),赤霉素酸(GA)(#151),油菜素类固醇(BR)(#117)和乙烯(#60)[gydF4y2Ba38gydF4y2Ba].已知每个家族中的许多转录因子都能增强干旱、盐、寒冷和渗透胁迫的耐受性[gydF4y2Ba90gydF4y2Ba,gydF4y2Ba91gydF4y2Ba并参与调节应激反应。综上所述,这些观察结果表明TaZFP1B可能是参与干旱胁迫响应的复杂网络的分子中介。gydF4y2Ba
ROS清除和能量供应gydF4y2Ba
过度的gydF4y2BaTaZFP1BgydF4y2Ba导致大量编码抗应激蛋白的基因上调。过度的gydF4y2BaTaZFP1BgydF4y2Ba导致ROS积累降低,并强烈诱导ROS清除酶活性(SOD、APX和CAT)。我们还发现nadp -苹果酸酶(#183和附加文件gydF4y2Ba4gydF4y2Ba:图S3D)在1B-OEX植物中强烈上调。这种酶参与COgydF4y2Ba2gydF4y2Ba在植物中的固定。此外,在C3植物中,它被认为参与了NADH向NADPH的转化,从而改善了细胞的抗氧化防御[gydF4y2Ba92gydF4y2Ba].在烟草中,nadp -苹果酸酶与干旱胁迫适应有关[gydF4y2Ba93gydF4y2Ba].其过表达导致气孔导度降低,从而提高水分利用效率[gydF4y2Ba94gydF4y2Ba].这可能有助于在干旱胁迫下维持生长。在我们的研究中还发现了其他参与ROS清除的基因。不同种类的谷胱甘肽s -转移酶(GSTs)在1B-OEX植物中上调(#12,#98 #123,#128,和附加文件gydF4y2Ba4gydF4y2Ba:图S3E和S3F)已知可促进异种生物的解毒,并参与对包括氧化应激在内的各种非生物应激的响应[gydF4y2Ba95gydF4y2Ba,gydF4y2Ba96gydF4y2Ba].一些theta, phy和tau gst已被证明具有谷胱甘肽过氧化物酶活性,以减少脂肪酸的有机氢过氧化物,防止氧化损伤[gydF4y2Ba97gydF4y2Ba].gydF4y2Ba
延缓叶片衰老曾被认为是提高干旱耐受性的一种策略[gydF4y2Ba98gydF4y2Ba].减缓光合作用是通过下调光合机制的组成部分来限制ROS产生和传播的主要策略之一[gydF4y2Ba99gydF4y2Ba].我们发现许多参与光合作用代谢的基因在1B-OEX植物中下调,相反,在干旱胁迫下1B-siRNA植物中过表达(表2)gydF4y2Ba5gydF4y2Ba).这些基因包括RUBISCO活化酶、RUBISCO小链和其他几种叶绿体蛋白(# 244-264)。有趣的是,与野生型和1B-siRNA植物相比,1B-OEX植物中这些基因的下调与维持高叶绿素含量和延缓衰老有关(图2)。gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba2gydF4y2Ba:图S2)。在保持叶绿素含量的同时解耦光合作用可能有助于植物在胁迫期间生存下来,同时使其在胁迫后更快地恢复。gydF4y2Ba
在缺水期间,能源供应严重受限。ATP合成酶是电子传递过程中参与ATP合成的关键酶。增加ATP合成酶(#189)的表达可以提高植物的耐旱性gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2BaOne hundred.gydF4y2Ba].在缺水条件下,植物的能量分配策略对于增加生存至关重要,因此,编码双向糖转运蛋白SWEET(#169, #173和#174)的基因的上调可能有助于在适当的区室中分配能量,以支持胁迫耐受机制[gydF4y2Ba101gydF4y2Ba].有趣的是,先前在拟南芥中观察到光合作用活性降低,同时β-半乳糖苷酶活性增加(#184)。半乳糖苷酶活性可能参与细胞壁多糖的分解代谢网络,在光合产物产量较低时产生所需的糖作为能量来源[gydF4y2Ba102gydF4y2Ba].gydF4y2Ba
渗透防护和结构加固gydF4y2Ba
渗透调节是植物适应干旱胁迫的重要机制之一。在我们的研究中,我们发现CBF/DREB编码基因(#49,#65和#75)在干旱胁迫下1B-OEX植物中表达上调。DREB蛋白在植物胁迫信号、非生物和生物胁迫耐受性中的重要性已被报道[gydF4y2Ba103gydF4y2Ba].CBF/DREB蛋白的过表达增强了下游靶基因的表达,包括Cor14a(#69),脱氢蛋白(#91,#95,#100和#114)和胚胎发生晚期丰富蛋白(#105,#106),这些蛋白被认为可以保护大分子不因脱水而聚集[gydF4y2Ba104gydF4y2Ba,gydF4y2Ba105gydF4y2Ba,gydF4y2Ba106gydF4y2Ba].gydF4y2Ba
额外的基因编码蛋白质参与细胞结构,延伸和维持,和细胞壁或膜代谢,如木葡聚糖内转葡萄糖酶/水解酶(#154和附加文件gydF4y2Ba4gydF4y2Ba:图S3G), WAX(#158),果胶酯酶(#155)和膨胀素(#156)也上调gydF4y2BaTaZFP1BgydF4y2Ba干旱胁迫下的过表达。这些蛋白质在控制细胞壁的延展性和可塑性方面起着重要作用,这两个特性是应对含水量逐渐减少所必需的。后者会对植物细胞结构造成相当大的机械应力,因此增加细胞壁的弹性和纤维素合成有助于维持细胞完整性和细胞在脱水时的膨胀[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba107gydF4y2Ba,gydF4y2Ba108gydF4y2Ba].此外,在干旱胁迫和复水过程中,还观察到复活植物细胞壁多糖和蛋白质的变化[gydF4y2Ba109gydF4y2Ba].水分的流失主要是通过气孔的蒸腾作用发生的,但有研究报道,在干旱条件下,叶片表面表皮蜡的合成有助于减少水分的流失[gydF4y2Ba110gydF4y2Ba,gydF4y2Ba111gydF4y2Ba].WAX(#158)和非特异性脂质转移蛋白基因(# 172,# 175-177和附加文件gydF4y2Ba4gydF4y2Ba:图S3H)分别促进蜡的合成和参与角质层蜡的沉积[gydF4y2Ba110gydF4y2Ba,gydF4y2Ba112gydF4y2Ba].因此,这些结果表明TaZFP1B调节应激反应基因,这些基因已知能够增强对干旱胁迫的适应能力。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
应激下的程序性细胞死亡和生长gydF4y2Ba
泛素也参与程序性细胞死亡(PCD)的调控[gydF4y2Ba113gydF4y2Ba].非生物胁迫诱导的PCD对于确保植物的生存具有相当大的意义,因为它是一个高度调控的过程,有助于清除不需要的和受损的细胞,从而维持组织和生物过程的稳态。细胞死亡是植物生长发育的组成部分,也是植物对非生物胁迫反应的一部分[gydF4y2Ba114gydF4y2Ba,gydF4y2Ba115gydF4y2Ba].在这项研究中,调节PCD和自噬的基因,如多胺氧化酶(#148),gydF4y2BaLaz1gydF4y2Ba(#160), LOL1(#164, #165)和LSD1(#39)在1B-OEX植株中表达上调[gydF4y2Ba116gydF4y2Ba,gydF4y2Ba117gydF4y2Ba,gydF4y2Ba118gydF4y2Ba,gydF4y2Ba119gydF4y2Ba].有趣的是,LOL1(#164和#165)和LSD1(#39)对PCD具有拮抗作用。在gydF4y2Ba拟南芥gydF4y2Ba,过度表达gydF4y2BaLOL1gydF4y2Ba增强病原体驱动的超敏反应和氧化应激诱导的细胞死亡[gydF4y2Ba118gydF4y2Ba),而gydF4y2BaLSD1gydF4y2Ba编码PCD的负调控因子[gydF4y2Ba119gydF4y2Ba].进一步的研究也报道了LSD1通过调节PSII最大效率、水分利用、细胞壁结构和组成以及HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba浓度。这说明LSD1可能参与调节光合作用、蒸腾作用、细胞信号稳态、植物生物量产生和种子产量[gydF4y2Ba120gydF4y2Ba,gydF4y2Ba121gydF4y2Ba].同样,新出现的证据表明,富含甘氨酸的蛋白质(GRPs)(#113)参与植物细胞生长和干旱胁迫的调节[gydF4y2Ba122gydF4y2Ba].过度的gydF4y2Ba拟南芥gydF4y2Ba水稻中富含甘氨酸的rna结合蛋白AtGRP2或AtGRP7可提高干旱胁迫下的产量[gydF4y2Ba123gydF4y2Ba],而AtGRP5促进细胞伸长[gydF4y2Ba124gydF4y2Ba].这些发现表明,在干旱胁迫适应过程中,细胞生长和细胞死亡需要一个微妙的平衡。gydF4y2Ba
结论gydF4y2Ba
综上所述,通过对TaZFP1B在生理和分子水平上的功能表征,可以更好地理解该转录因子在小麦中的重要性及其在干旱胁迫响应和耐受性中的作用。新型VOX和VIGS系统的使用允许快速的功能基因表征,而不需要生成转基因植物系,这在六倍体小麦中是一个漫长的过程。本文提供的数据表明,TaZFP1B是一个关键的转录因子,通过激活多条信号通路或通过胁迫反应通路之间的串扰,协调多种分子机制,涉及与胁迫耐受相关的基因的调控。抗干旱和氧化应激能力的增强gydF4y2BaTaZFP1BgydF4y2Ba提示该转录因子可作为选育抗旱小麦的标志,在气候变化条件下提高产量。另外,启动子区域的基因编辑方法增强其表达是在正常生长和干旱条件下提高小麦作物生产力的有趣可能性。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
的gydF4y2Ba小麦gydF4y2Ba简历。Atlas 66冬小麦品种由Carver及其同事[gydF4y2Ba125gydF4y2Ba并在我们的温室设施中种植。选择该品种进行功能鉴定gydF4y2BaTaZFP1BgydF4y2Ba(GenBank登录号MN577972),因为该基因是从该品种的先前研究中鉴定出来的,并显示出对不同的非生物胁迫有反应[gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba].此外,为避免冬季品种春化所必需的步骤,商品化春小麦gydF4y2Bat . aestivumgydF4y2Ba简历。Dakosta (gydF4y2Bahttps://www.inspection.gc.ca/english/plaveg/pbrpov/cropreport/whe/app00009711e.shtmlgydF4y2Ba)从La Coop Fédérée (saint - hyac在,Québec加拿大)购买,用于分析开机期间的耐旱性。gydF4y2Bat . aestivumgydF4y2Ba而且gydF4y2Ba烟草benthamianagydF4y2Ba在22°C、14 h光周期、100 μmol m的受控条件下的生长室中生长gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba辐照度(荧光灯和白炽灯),70%的相对湿度。种子被播种在黑土、泥炭苔藓和珍珠岩(2:1:1的比例)的混合物中,花盆每天浇水,连续14天。如图和表中的图例所示,在不同的时期内,通过扣留水来引发干旱压力。为确定干旱胁迫对种子产量的影响,当旗叶鞘内的发育头明显增大时(孕穗期Z45),水分被截留10天。对照样品每天浇水。组织取样在一天的同一时间进行,以避免昼夜周期的影响。gydF4y2Ba
结构为gydF4y2BaTaZFP1BgydF4y2Ba沉默和过度表达gydF4y2Ba
采用之前开发的四分量BSMV系统gydF4y2BaTaZFP1BgydF4y2Ba病毒介导过表达[gydF4y2Ba63gydF4y2Ba].与三组分系统相比,这个改进的系统基于四种不同的质粒(pCaBS-α, pCaBS-β, pCaBS-γ1和pCaBS-γ2),其中编码γ RNA的DNA被分裂成两部分,以允许克隆更大的cDNA片段或通过克隆两个质粒中的基因来增加表达:pCaBS-γ1和pCaBS-γ2。要获得gydF4y2BaTaZFP1BgydF4y2Ba从小麦根尖中提取总RNA (cv;Atlas 66)暴露于铝中,使用SensiFAST™cDNA Synthesis Kit (Bioline)将mrna逆转录为cDNAgydF4y2BaTaZFP1BgydF4y2Ba使用Q5高保真DNA聚合酶(New England Biolabs) pcr扩增cDNA。这gydF4y2BaTaZFP1BgydF4y2Ba利用引物1B-OEX_LIC1和1B-OEX_LIC2将编码序列克隆到pCaBS-γ1和pCaBS-γ2载体上gydF4y2Ba5gydF4y2Ba:表S2)。所得到的质粒与pCaBS-α和pCaBS-β载体一起使用以最大化gydF4y2BaTaZFP1BgydF4y2Ba超表达(无花果。gydF4y2Ba1gydF4y2BaA)因为与转基因植物研究中通常使用的强启动子相比,该系统的表达水平是适度的。gydF4y2Ba
三组分BSMV系统用于病毒诱导的基因沉默(VIGS)gydF4y2BaTaZFP1BgydF4y2Ba在小麦中[gydF4y2Ba126gydF4y2Ba].该系统使用三种不同的质粒(pcass -α, pcass -β, pcass -γ),分别携带编码BSMV菌株ND18的三种基因组rna (RNAα, RNAβ, RNAγ)的DNA序列。siRNA对抗gydF4y2BaTaZFP1BgydF4y2Ba采用GenScript siRNA靶标查找器(gydF4y2Bahttps://www.genscript.com/tools/sirna-target-findergydF4y2Ba).所选的义-环-反义DNA序列(AAGAGTATTGCGGATCTGAAGgydF4y2BattgatatccggydF4y2BaCTTCAGATCCGCAATACTCtttttttt)用于生成siRNA嵌合结构。以确保这个siRNA是特异性的gydF4y2BaTaZFP1BgydF4y2Ba, BLAST分析针对NCBI和EnsemblPlant数据库(第36版)的小麦基因组进行。唯一可检测到的靶标是同一转录因子家族的密切成员。siRNA片段被扩增(见附加文件)gydF4y2Ba5gydF4y2Ba引物见表S2),并通过连接不依赖克隆(LIC)亚克隆到pCaBS-γ中。所得的pCaBS-γ:1B-siRNA载体与pCaBS-α和pCaBS-β一起用于沉默gydF4y2BaTaZFP1BgydF4y2Ba小麦(图;gydF4y2Ba1gydF4y2Bab)。gydF4y2Ba
Agroinfiltration的gydF4y2Ba烟草benthamianagydF4y2Ba病毒接种在小麦中gydF4y2Ba
病毒提取物用于过表达或沉默gydF4y2BaTaZFP1BgydF4y2Ba小麦是在gydF4y2BaNgydF4y2Ba.gydF4y2BabenthamianagydF4y2Ba.质粒(pCaBS-α, pCaBS-β, pCaBS-γ:gydF4y2BaTaZFP1BgydF4y2Ba-siRNA沉默;pCaBS-α、pCaBS-β、pCaBS-γ1:gydF4y2BaTaZFP1BgydF4y2Ba和pCaBS -γ2:gydF4y2BaTaZFP1BgydF4y2Ba对于过表达),分别转化为gydF4y2Ba根癌土壤杆菌gydF4y2Ba电穿孔菌株EHA105。单菌落在含利福平(25 μg/ml)和卡那霉素(50 μg/ml)的LB中28℃培养过夜。用含有相同抗生素的LB (10 mm2 -(N-morpholino)乙磺酸(MES) pH 5.2和20 μM乙酰丁香酮)1:100稀释,28℃培养12 h。细菌细胞以2200 g和等量的三种或四种制成颗粒gydF4y2Ba农杆菌属gydF4y2Ba文化(ODgydF4y2Ba600gydF4y2Ba= 0.700)混合,在28°C的浸润缓冲液(10 mM MES, pH 5.2, 10 mM MgCl)中孵育3-5小时gydF4y2Ba2gydF4y2Ba及0.1 mM乙酰丁香酮),如上文所述[gydF4y2Ba126gydF4y2Ba].Agroinfiltration的gydF4y2Ban benthamianagydF4y2Ba叶片和含有病毒提取物的匀浆的制备如前所述[gydF4y2Ba63gydF4y2Ba,gydF4y2Ba127gydF4y2Ba].这些提取物是在小容量和存储在- 20°C以后使用。作为BSMV感染的对照,空载体(pcass -γ1:00和pcass -γ2:00)与pcass -α, pcass -β载体一起使用。如前所述,在小麦种子吸吸期间,用病毒提取物接种小麦种子3天[gydF4y2Ba63gydF4y2Ba,gydF4y2Ba127gydF4y2Ba].以每盆10粒的密度播种。gydF4y2Ba
本研究使用了四种不同类型的植物:野生型,用不含BSMV载体转化的植物gydF4y2BaTaZFP1BgydF4y2Ba空载体cDNA,植物过表达gydF4y2BaTaZFP1BgydF4y2Ba(1B-OEX)和欠表达植物gydF4y2BaTaZFP1BgydF4y2Ba(1 b-sirna)。gydF4y2Ba
生长参数的确定gydF4y2Ba
根据每个实验的描述,植物在不同的时间收获。在70°C干燥3 d前后,对整株植物(根和嫩枝)分别称重,并评估以下生长参数:干重、株高、由干重计算的茎根比、第二叶宽和相对含水量(RWC)。RWC的测量方法如前所述[gydF4y2Ba128gydF4y2Ba].存活率的计算来自于截留水分和再浇水后能够再生的小麦植株。通过在孕穗期施加干旱胁迫,研究了干旱胁迫对Dakosta春小麦籽粒产量(数量和重量)的影响。gydF4y2Ba
叶绿素发光成像gydF4y2Ba
叶绿素发光使用体内成像系统成像,该系统包括一个防光柜和一个电荷耦合器件(CCD)相机(NightOWL II LB983, Berthold Technologies),曝光时间为0.6 s。使用IndiGO软件(Berthold)进行图像分析。gydF4y2Ba
RNA分离,RNA- seq文库制备,测序和分析gydF4y2Ba
野生型和bsmv感染植物的总RNA样本(cv。Atlas 66)从3株21日生、水分充足的小麦植株(对照)和3株14日生、干旱胁迫7天(共21天生长)的第二叶上收获。组织在液氮中快速冷冻,并根据制造商的说明使用RNeasy Plant Mini试剂盒(QIAGEN)提取总RNA。RNA样本用柱上无RNA脱氧核糖核酸酶(QIAGEN)处理以去除任何污染的基因组DNA。随OD变化的RNA样品质量gydF4y2Ba260gydF4y2Ba/ ODgydF4y2Ba280gydF4y2Ba电泳检测值大于2.0。RNA完整性数(RIN)值的测定,RNA文库的制备和测序在Novogene (California, USA)进行。在Illumina NovaSeq平台的RNA-Seq文库上进行配对端(2 × 150 b)测序,并分析由Novogene提供的原始数据。分别分析配对末端序列的每次读取,然后比较每百万值的转录本,以排除不一致的结果(超过5倍的差异)。使用FastQC对原始数据质量进行验证[gydF4y2Ba129gydF4y2Ba].使用Trimmomatic(版本0.36.3)修剪适配器(TruSeq3对已结束)[gydF4y2Ba130gydF4y2Ba].对读取数据进行全局过滤,以保留基本质量超过Q30的读取数据。RNA-Seq数据被清洗以去除适配器、低读取质量和伪序列。转录组分析使用Galaxy管道进行gydF4y2Bahttps://usegalaxy.orggydF4y2Ba[gydF4y2Ba131gydF4y2Ba].序列工件是使用Galaxy平台上可用的fastx工具包删除的。RNA-Seq数据集之间的相似性使用plotCorrelation进行评估[gydF4y2Ba132gydF4y2Ba].生成基于Spearman相关方法的热图绘制类型,以可视化成对端测序两端的库和读之间的相关性。为了量化转录本的表达,在准映射模式下使用Salmon (version 0.8.2) [gydF4y2Ba133gydF4y2Ba].克麦尺寸设置为31。小麦转录组数据(数据库版本90.3)从Ensembl Plants (gydF4y2Baftp://ftp.ensemblgenomes.org/pub/plants/release-37/fasta/triticum_aestivum/cdna/gydF4y2Ba),并作为参考转录组进行转录定量[gydF4y2Ba134gydF4y2Ba].Salmon在RNA-Seq数据上生成的转录本的百万分之转录本值用于计算剪接率。通过应用特征选择来排除零或低计数的基因(附加文件gydF4y2Ba3.gydF4y2Ba:表S1和附加文件gydF4y2Ba6gydF4y2Ba:表S3)。为了进行分析,我们选择了在充足水分条件下或干旱胁迫下,1B-OEX植物中比野生型植物过表达5倍或更多的基因。在空载体和1B-OEX RNA-Seq数据中表达相似的基因被排除。我们还选择了一些特别感兴趣的基因,如在RNA-Seq数据中过表达不到5倍的ROS解毒酶。在本例中,通过qRT-PCR定量其表达水平。热图仪计划(gydF4y2Bahttp://www.heatmapper.ca/expression/gydF4y2Ba)绘制表达数据的热图。转录本的注释是基于Ensembl Plants上提供的小麦注释基因组转录本(版本37)(gydF4y2Baftp://ftp.ensemblgenomes.org/pub/plants/release-37/fasta/triticum_aestivum/gydF4y2Ba)或通过BLAST检索NCBI核苷酸集合(nr/nt)。转录组组装使用Trinity [gydF4y2Ba135gydF4y2Ba]以确定小麦cv基因的真实序列。阿特拉斯66年。RNA-Seq数据存放在NCBI基因表达Omnibus (GEO),登录号为GSE136683。gydF4y2Ba
定量RT-PCR分析gydF4y2Ba
从小麦第二叶中提取总RNA,用于实时定量聚合酶链反应(qRT-PCR)分析。阿特拉斯66)植物如上所述。总RNA (0.5 μg)用SensiFAST™cDNA Synthesis Kit (Bioline)在总体积20 μl中反转录。实时定量RT-PCR在CFX96 Touch™Thermal Cycler (Bio-Rad)上进行,使用Luna®Universal qPCR Master Mix (New England Biolabs)。为了定量同源基因的特异性转录本,引物在附加文件中gydF4y2Ba5gydF4y2Ba:表S2是根据cv的RNA-Seq数据检索的序列设计的。阿特拉斯66年。对于每个基因,参考基因序列从Ensembl Plants数据库中检索,并与Trinity生成的组装转录组进行比对。根据最小e值确定感兴趣序列。扩增过程如下:95°C下5 min, 95°C下15 s, 58°C下30 s,循环35次。目的基因转录水平与18S rRNA水平进行归一化。RNA转录本的折叠变化用2gydF4y2Ba——ΔΔCtgydF4y2Ba方法(gydF4y2Ba136gydF4y2Ba].gydF4y2Ba
活性氧的检测gydF4y2Ba
每个叶子样本(0.1 g)在液氮中研磨,粉末与1 mL 10 mM Tris-HCl混合在微管中,pH为7.2,然后在12000下离心gydF4y2BaggydF4y2Ba在4°C下放置20分钟。将上清液转移到新鲜微管中,用于测定总ROS和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba检测。使用荧光染料2 ',7 ' -二氯二氢荧光素二乙酸酯(DCFDA)检测总ROS, DCFDA由细胞酯酶去乙酰化,得到一种化合物,该化合物可被ROS氧化为2 ',7 ' -二氯荧光素(DCF) [gydF4y2Ba137gydF4y2Ba].DCF荧光用微孔板阅读器测量,激发波长和发射波长分别为495 nm和529 nm。在室温下用过氧化氢酶(300单位/mL)处理10分钟后,通过其他测量从实验值中减去非特异性背景。校正后的荧光值以相对荧光单位/mg蛋白提取物表示。过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)使用过氧化氢荧光检测试剂盒(Arbor Assays, USA)进行,激发波长和发射波长分别为570 nm和590 nm。HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba浓度由标准曲线计算,以μmol/g鲜重表示。DCF和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba数据归一化到相应的水分充足的野生型植物。gydF4y2Ba
脂质过氧化检测gydF4y2Ba
利用硫代巴比妥酸反应物质(TBARS)测定丙二醛(MDA)含量来估计叶片组织中脂质的氧化损伤。每个叶子样本(0.5 g)在含有0.5% (w/v)三氯乙酸(TCA)的砂浆中研磨,匀浆在12000下离心gydF4y2BaggydF4y2Ba20分钟。将上清液转移到玻璃管中,与含有40% TCA和1% (w/v)硫代巴比妥酸(TBA)的溶液混合。混合物在沸水中孵育30分钟,将管子移到冰浴中停止反应。然后将混合物与1-丁醇混合,并大力涡旋10 s,然后通过离心(4000gydF4y2BaggydF4y2Ba室温下,5分钟)。上面的相小心地转移到一个新的管和吸光度值读取在532 nm和600 nm。后一个值代表非特异性吸收,并被减去。根据MDA标准曲线(Cayman Chemical, USA)计算样品中MDA- tba复合物的含量为MDA当量。MDA数据归一化到相应的水分充足的野生型植物。gydF4y2Ba
抗氧化成分的测定:酶和代谢物gydF4y2Ba
超氧化物歧化酶(SOD;EC 1.15.1.1)通过抑制硝基蓝四氮唑(NBT)的光化学还原,如前所述[gydF4y2Ba138gydF4y2Ba].每个叶片样品(0.5 g)用液氮研磨,悬浮在1.5 mL均质缓冲液中:50 mM磷酸钠(pH 7.8)、1 mM乙二胺四乙酸(EDTA)和2% (w/v)聚乙烯聚吡啶烷酮(PVPP)。匀浆在12000度下离心gydF4y2BaggydF4y2Ba在4℃下静置30分钟,上清液立即用于SOD测定。3.0 mL检测培养基含有50 mM磷酸钠(pH 7.8)、0.66 mM EDTA、10 mM l -蛋氨酸、33 μM硝基蓝四氮唑(NBT)和3.3 μM核黄素。将试管置于600 μmol m的光照下进行反应gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)在25°C下放置10分钟。在560 nm处测定NBT的还原。SOD的一个酶单位被定义为对NBT光还原产生50%抑制的蛋白质量。结果以单位/毫克可溶性蛋白表示。gydF4y2Ba
抗坏血酸过氧化物酶总活性(APX;EC 1.11.1.11)通过A降低测定gydF4y2Ba290gydF4y2Ba在25℃下加热2分钟[gydF4y2Ba139gydF4y2Ba].每个叶片样品(0.5 g)用液氮研磨,悬浮在1.5 mL含有50 mM磷酸钠(pH 7.0)、2% (w/v) PVPP、0.1 mM EDTA和2 mM抗坏血酸盐的均质缓冲液中。匀浆在12000度下离心gydF4y2BaggydF4y2Ba在4°C下放置30分钟。反应混合物(1ml)含有50mm磷酸钠,0.1 mM EDTA, 0.5 mM抗坏血酸盐和0.5 mM HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在22℃下测定反应速率(抗坏血酸氧化/min)。用于计算的抗坏血酸(ε)的摩尔消光系数为2.8 mMgydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba.结果以每mg可溶性蛋白的APX (μmol抗坏血酸)单位表示。gydF4y2Ba
过氧化氢酶活性(CAT;EC 1.11.1.6)通过测定HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在25℃下,在240 nm处加热2分钟[gydF4y2Ba140gydF4y2Ba].每个叶片样品(0.5 g)用液氮研磨,悬浮在1.5 mL均质缓冲液中,其中含有50 mM Tris-HCl (pH 7.8)、0.1 mM EDTA、0.2% (v/v) Triton X-100、1 mM苯基甲基磺酰氟(PMSF)和2 mM二硫苏糖醇(DTT)。匀浆在12000度下离心gydF4y2BaggydF4y2Ba在4℃下静置30分钟,上清液用于CAT检测。反应混合物含有50mm磷酸钠(pH 7.0)和0.1% HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba反应速率(μmol HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba消耗量/分钟)在22°C下测量。H的摩尔消光系数gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba(ε)为39.4 mMgydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba.结果以CAT (μmol H)为单位计算gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)每毫克可溶性蛋白质。gydF4y2Ba
为了测定谷胱甘肽,将每个叶片组织(0.1 g)在液氮中研磨,并将粉末置于含有1ml 10 mM Tris-HCl的微管中,pH为7.2,并在12000下离心gydF4y2BaggydF4y2Ba在4°C下放置20分钟。上清液转移到新鲜的微管中。根据制造商的方案,使用谷胱甘肽(GSH)荧光检测试剂盒(Arbor Assays, USA)测定还原性谷胱甘肽(GSH)和氧化性谷胱甘肽(GSSG)水平。建立谷胱甘肽标准曲线,测定样品中游离谷胱甘肽和总谷胱甘肽的浓度。结果以μmol / mg可溶性蛋白表示。gydF4y2Ba
蛋白定量gydF4y2Ba
使用Bio-Rad蛋白质测定染色试剂(Bio-Rad,加拿大)对蛋白质进行定量。用酶标仪在595 nm处读取吸光度,用牛血清白蛋白(BSA)制备的标准曲线测定蛋白质浓度。gydF4y2Ba
RNA-Seq数据的统计分析和验证gydF4y2Ba
除RNA-Seq外,所有实验均独立重复至少4次,所示值均为均数±标准差(SD)。均数比较采用单向方差分析(ANOVA)进行。使用Tukey的事后检验分析平均值之间的差异gydF4y2BapgydF4y2Ba值< 0.05。使用InStat 3.0进行统计分析。通过成对相关分析文库之间的关系,并生成热图验证各处理成对末端测序两端之间的相关性(附加文件gydF4y2Ba7gydF4y2Ba:图S4)。热图揭示了野生型和空载体处理之间的密切关系,表明BSMV感染本身并没有引起基因表达的重大变化。分析表明,水分充足和干旱文库的相关性较低,表明在施加干旱胁迫时,小麦转录组谱发生了深刻的变化。此外,无论是比较水分充足的植物还是干旱处理的植物,1B-OEX和1B-siRNA文库之间的相关性都是最低的,这表明基因表达谱存在显著差异。这表明有几个基因是受基因表达调控的gydF4y2BaTaZFP1BgydF4y2Ba在1B-siRNA植物中可能以相反的方式调控。为了对RNA-Seq结果进行qRT-PCR验证,从RNA-Seq数据中的差异调控转录本列表中随机选择干旱胁迫1B-OEX中上调的16个基因,并使用特定引物分析干旱胁迫1B-OEX与野生型植物之间的表达水平(附加文件)gydF4y2Ba5gydF4y2Ba:表S2)。通过比较日志生成散点图gydF4y2Ba2gydF4y2Ba褶皱变化(OEX干旱/野生型干旱)。结果表明,qPCR得到的表达模式与RNA-Seq数据之间的相关性(gydF4y2BaRgydF4y2Ba2gydF4y2Ba= 0.6374,gydF4y2BapgydF4y2Ba> 0.01)(附加文件gydF4y2Ba8gydF4y2Ba:图S5)与qPCR和微阵列数据之间的观察结果相似。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在当前研究中生成和/或分析的RNA-Seq数据集可在GEO存储库中获得,登录号为GSE136683,gydF4y2Bahttps://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE136683gydF4y2Ba.的gydF4y2BaTaZFP1BgydF4y2Ba该序列可在GenBank获得,登录号为MN577972 (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/nuccore/MN577972gydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- APX型:gydF4y2Ba
-
抗坏血酸盐过氧化物酶gydF4y2Ba
- ATP:gydF4y2Ba
-
三磷酸腺苷gydF4y2Ba
- bHLH:gydF4y2Ba
-
基本的螺旋-环-螺旋蛋白gydF4y2Ba
- BSA:gydF4y2Ba
-
牛血清白蛋白gydF4y2Ba
- BSMV:gydF4y2Ba
-
大麦条纹花叶病毒gydF4y2Ba
- bZIP:gydF4y2Ba
-
亮氨酸拉链gydF4y2Ba
- CaM1:gydF4y2Ba
-
钙调蛋白1gydF4y2Ba
- 猫:gydF4y2Ba
-
过氧化氢酶gydF4y2Ba
- CBF:gydF4y2Ba
-
c -重复序列结合因子gydF4y2Ba
- 贴现:gydF4y2Ba
-
2 ', 7 '二氯荧光素gydF4y2Ba
- 含有DREB:gydF4y2Ba
-
干旱反应元件结合蛋白gydF4y2Ba
- 德勤:gydF4y2Ba
-
二硫苏糖醇gydF4y2Ba
- EDTA:gydF4y2Ba
-
乙二胺四乙酸gydF4y2Ba
- 小块土地:gydF4y2Ba
-
乙烯响应因子gydF4y2Ba
- GRP:gydF4y2Ba
-
Glycine-rich蛋白质gydF4y2Ba
- 谷胱甘肽:gydF4y2Ba
-
减少谷胱甘肽gydF4y2Ba
- GSSG:gydF4y2Ba
-
氧化谷胱甘肽gydF4y2Ba
- 销售税:gydF4y2Ba
-
谷胱甘肽S-transferasegydF4y2Ba
- HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba:gydF4y2Ba
-
过氧化氢gydF4y2Ba
- HD-ZIP:gydF4y2Ba
-
同源结构域亮氨酸拉链转录因子gydF4y2Ba
- 是:gydF4y2Ba
-
茉莉酸gydF4y2Ba
- 有没有1:gydF4y2Ba
-
拉撒路1gydF4y2Ba
- 李:gydF4y2Ba
-
晚期胚胎发生丰富gydF4y2Ba
- LOL1:gydF4y2Ba
-
Lsd是1gydF4y2Ba
- LRR-RLK:gydF4y2Ba
-
富含亮氨酸重复受体样激酶gydF4y2Ba
- MDA:gydF4y2Ba
-
丙二醛gydF4y2Ba
- MYB:gydF4y2Ba
-
成髓细胞瘤癌基因gydF4y2Ba
- 南京:gydF4y2Ba
-
NgydF4y2Ba点,gydF4y2Ba一个gydF4y2BaTAF1/2和gydF4y2BaCgydF4y2Ba加州大学gydF4y2Ba
- NADPH:gydF4y2Ba
-
还原烟酰胺腺嘌呤二核苷酸磷酸gydF4y2Ba
- 电视台:gydF4y2Ba
-
氮蓝四唑gydF4y2Ba
- NF-Y:gydF4y2Ba
-
核因子YgydF4y2Ba
- 纤毛运动:gydF4y2Ba
-
程序性细胞死亡gydF4y2Ba
- PMSF:gydF4y2Ba
-
Phenylmethylsulphonyl氟化gydF4y2Ba
- PVPP:gydF4y2Ba
-
PolyvinylpolypyrrolidonegydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- RPK 1:gydF4y2Ba
-
受体样激酶1gydF4y2Ba
- 二磷酸核酮糖羧化酶:gydF4y2Ba
-
核酮糖1 5 5-bisphosphate,羧化酶/加氧酶gydF4y2Ba
- RWC:gydF4y2Ba
-
相对含水量gydF4y2Ba
- 线性:gydF4y2Ba
-
慢负离子通道gydF4y2Ba
- SOD:gydF4y2Ba
-
超氧化物歧化酶gydF4y2Ba
- 甜:gydF4y2Ba
-
糖最终将成为出口运输工具gydF4y2Ba
- 稍后通知:gydF4y2Ba
-
硫代巴比土酸gydF4y2Ba
- TBARS:gydF4y2Ba
-
硫代巴比妥酸反应性物质gydF4y2Ba
- 柠檬酸:gydF4y2Ba
-
三氯乙酸gydF4y2Ba
- 中收取:gydF4y2Ba
-
病毒引起的基因沉默gydF4y2Ba
- VOX:gydF4y2Ba
-
Virus-mediated过度gydF4y2Ba
- WRKY:gydF4y2Ba
-
含有高度保守的氨基酸序列WRKYGQK的蛋白质gydF4y2Ba
- XTH:gydF4y2Ba
-
Xyloglucan endotransglucosylase /水解酶gydF4y2Ba
- ZFP:gydF4y2Ba
-
锌指蛋白gydF4y2Ba
参考文献gydF4y2Ba
粮农组织。2050年的全球农业。罗马:粮农组织;2009.gydF4y2Ba
Valin H, Sands RD, van der Mensbrugghe D, Nelson GC, Ahammad H, Blanc E, Bodirsky B, Fujimori S, Hasegawa T, Havlik P,等。粮食需求的未来:理解全球经济模型的差异。农业经济,2014;45(1):51-67。gydF4y2Ba
法鲁克M,侯赛因M,瓦希德A,西迪基KHM。植物的干旱胁迫:综述。见:植物对干旱胁迫的反应。柏林,海德堡:施普林格柏林海德堡;2012.1-33页。gydF4y2Ba
Vicente-Serrano SM, Beguería S, Camarero JJ。干旱在气候变化中的严重程度。见:干旱和缺水手册:CRC出版社;博卡拉顿,美国,2017年。p . 279 - 303。gydF4y2Ba
朱镕基JK。植物的非生物胁迫信号及其响应。细胞。2016;167(2):313 - 24。gydF4y2Ba
Jeandroz S, Lamotte O.编辑:植物对生物和非生物胁迫的反应:从细胞信号的教训。中国植物科学,2017;8:1772。gydF4y2Ba
张志刚,张志刚,张志刚。水稻和小麦中同源NAC转录因子的分化功能。中国生物医学工程学报,2012;29(4):344 - 344。gydF4y2Ba
费尔德曼M,利维AA。小麦异源多倍体化引起的基因组进化。遗传学。2012;192(3):763 - 74。gydF4y2Ba
杜晓峰,李志刚,李志刚。基因组可塑性是多倍体小麦驯化成功的关键因素。科学。2007;316(5833):1862 - 6。gydF4y2Ba
后基因组时代植物非生物胁迫响应的研究:过去、现在和未来。植物学报,2010;36(6):344 - 344。gydF4y2Ba
米特勒R, Vanderauwera S, Gollery M, Van Breusegem F.植物活性氧基因网络。植物科学进展,2004;9(10):490-8。gydF4y2Ba
Takahashi S, Seki M, Ishida J, Satou M, Sakurai T, Narusaka M, Kamiya A, Nakajima M, Enju A, Akiyama kgydF4y2Ba拟南芥gydF4y2Ba细胞培养使用全长cDNA芯片。植物分子生物学,2004;56(1):29-55。gydF4y2Ba
Batista R, Fonseca C, Planchon S, Negrao S, Renaut J, Oliveira MM.环境胁迫是转基因和非转基因植物转录组和蛋白质组变化的主要原因。科学通报2017;7(1):10624。gydF4y2Ba
干旱胁迫和活性氧:产生,清除和信号。植物信号行为学。2008;3(3):156-65。gydF4y2Ba
摩根JM。高等植物的渗透调节与水分胁迫。植物科学进展。1984;35(1):299-319。gydF4y2Ba
Lamaoui M, Jemo M, Datla R, Bekkaoui F.作物高温干旱胁迫及其缓解方法。前沿化学。2018;6:26。gydF4y2Ba
李丽娟,李丽娟,李丽娟。非生物胁迫对细胞壁代谢的影响。植物(巴塞尔)。2015; 4(1): 112 - 66。gydF4y2Ba
张志刚,张志刚,张志刚,等。干旱胁迫对植物代谢和基因表达的影响。植物学报。2013;32(1):21-32。gydF4y2Ba
Ijaz R, Ejaz J,高松,刘涛,Imtiaz M,叶忠,王涛。番茄膜联蛋白基因AnnSp2过表达通过调节ABA合成和清除ROS增强耐干旱和耐盐性。科学通报2017;7(1):12087。gydF4y2Ba
Abdeen A, Schnell J, Miki B.转录组分析表明,抗旱转基因植物过表达转录因子ABF3没有非预期效应。BMC基因组学,2010;11:69。gydF4y2Ba
戴超,李勇,李智智,南恒,郭建民。钙调素1调控拟南芥衰老和ABA反应。植物科学学报,2018;gydF4y2Ba
威尔金森S, Kudoyarova GR, Veselov DS, Arkhipova TN, Davies WJ。植物激素相互作用:作物育种和管理的创新目标。中国科学(d辑:自然科学),2012;gydF4y2Ba
库桥Y, Terashima A, Takumi S.小麦d基因组前驱体和合成六倍体脱水耐受性、ABA敏感性的变异及其相关基因表达模式。中华分子生物学杂志,2009;10(6):2733-51。gydF4y2Ba
姚旭,熊伟,叶涛,吴勇。天冬氨酸蛋白酶的过表达gydF4y2BaASPG1gydF4y2Ba基因赋予抗旱能力gydF4y2Ba拟南芥gydF4y2Ba.中国机械工程学报,2012;29(7):339 - 344。gydF4y2Ba
郭JM,莫里IC,裴ZM,莱昂哈特N,托雷斯MA,腾格尔JL,布鲁姆RE,博德S,琼斯JD,施罗德JI。NADPH氧化酶gydF4y2BaAtrbohDgydF4y2Ba而且gydF4y2BaAtrbohFgydF4y2Ba基因在ros依赖性ABA信号通路中的作用gydF4y2Ba拟南芥gydF4y2Ba.中国生物医学工程学报。2003;22(11):2623-33。gydF4y2Ba
Arias CL, Pavlovic T, Torcolese G, Badia MB, Gismondi M, Maurino VG, Andreo CS, Drincovich MF, Gerrard Wheeler MC, Saigo MgydF4y2Ba拟南芥gydF4y2Ba.中国植物科学,2018;9:1637。gydF4y2Ba
杨玲,吴玲,常伟,李忠,苗明,李勇,杨娟,刘忠,谭娟。玉米E3泛素连接酶基因的过表达gydF4y2BaZmAIRP4gydF4y2Ba增强植物抗旱能力gydF4y2Ba拟南芥gydF4y2Ba.植物物理与生物化学。2018;123:34-42。gydF4y2Ba
Osakabe Y, Maruyama K, Seki M, Satou M, Shinozaki K, Yamaguchi-Shinozaki K.富含亮氨酸重复受体样激酶1是拟南芥脱落酸早期信号的关键膜结合调控因子。植物学报。2005;17(4):1105-19。gydF4y2Ba
Kulik A, Wawer I, Krzywinska E, Bucholc M, Dobrowolska G. SnRK2蛋白激酶——植物对非生物胁迫响应的关键调控因子。组学。2011; 15(12): 859 - 72。gydF4y2Ba
娄东,王华,梁刚,于东。水稻OsSAPK2对干旱胁迫的敏感性和耐受性。植物科学进展(英文版);gydF4y2Ba
Dey A, Samanta MK, Gayen S, Maiti MK.蔗糖非发酵1相关激酶2基因SAPK9通过调节细胞渗透势、气孔关闭和胁迫响应基因表达来提高水稻的耐旱性和产量。中国生物医学工程学报。2016;16(1):158。gydF4y2Ba
中岛,伊藤,山口-筱崎,等。植物转录调控网络对非生物胁迫的响应gydF4y2Ba拟南芥gydF4y2Ba和草。植物科学进展。2009;49(1):88-95。gydF4y2Ba
Ciftci-Yilmaz S, Mittler R.植物锌指网络。细胞生物学与生物工程学报,2008;26(6):344 - 344。gydF4y2Ba
杨晓明,张晓明,张晓明,等。活性氧信号通路与非生物应激的关系。中国生物医学工程学报。2008;33(3):481-9。gydF4y2Ba
A.植物c2h2型锌指转录因子在胁迫响应中的参与。植物科学进展(英文版);gydF4y2Ba
杨松,万杰,黄艳。缩小目标:向成功的耐旱作物基因工程迈进。植物学报。2010;3(3):469-90。gydF4y2Ba
Ambawat S, Sharma P, Yadav NR, Yadav RC。MYB转录因子基因作为植物反应的调节因子:综述。植物学报。2013;19(3):307-21。gydF4y2Ba
乔茜,王志刚,王志刚,王志刚。植物转录因子对干旱胁迫响应的研究进展。前沿植物科学,2016;7:1029。gydF4y2Ba
杨晓明,杨晓明,杨晓明。干旱和寒冷胁迫下植物基因表达的调控网络。植物学报。2003;6(5):410-7。gydF4y2Ba
MYB结构域转录因子在植物基因组非生物胁迫中的作用及胁迫反应的表观遗传控制。植物信号行为研究。2016;11(1):e1117723。gydF4y2Ba
刘旭,王涛,Bartholomew E, Black K,董明,张勇,杨松,蔡勇,薛松,翁勇,等。黄瓜果棘发育过程中NAC转录因子及其表达的综合分析(gydF4y2BaCucumis巨大成功gydF4y2Bal .)。Hortic res 2018;5(1):31。gydF4y2Ba
Kidokoro S, Watanabe K, Ohori T, Moriwaki T, Maruyama K, Mizoi J. Myint Phyu sin Htwe N, Fujita Y, Sekita S, Shinozaki K:大豆dreb1 / cbf型转录因子在热、干旱和冷胁迫响应基因表达中的作用中国植物学报,2015;26(3):344 - 344。gydF4y2Ba
蒋娟,马珊珊,叶娜,姜敏,曹娟,张娟。WRKY转录因子在植物逆境响应中的作用。中国生物医学工程学报,2017;29(2):344 - 344。gydF4y2Ba
王峰,陈宏伟,李广涛,魏伟,李伟,张伟科,马波,毕永德,赖玉春,刘小林,等。GmWRKY27与GmMYB174相互作用,降低GmNAC29的表达,提高大豆植株的抗逆性。中国植物学报,2015;36(2):344 - 344。gydF4y2Ba
王辉,郝娟,陈霞,郝珍,王霞,楼艳,彭艳,郭震。水稻WRKY89基因的过表达增强了水稻抗紫外线B的能力和抗病性。植物化学学报,2007;26(6):799-815。gydF4y2Ba
杨安,戴X,张文辉。r2r3型MYB基因OsMYB2与水稻耐盐、耐冷和耐脱水有关。中国机械工程学报,2012;29(7):344 - 344。gydF4y2Ba
李珊珊,金浩,金瑞杰,徐mc .过度表达gydF4y2Ba拟南芥gydF4y2BaMYB96具有抗旱性gydF4y2Ba亚麻荠漂白亚麻纤维卷gydF4y2Ba通过角质层蜡积累。植物细胞学报2014;33(9):1535-46。gydF4y2Ba
孙世杰,郭淑琴,杨霞,包玉梅,唐海军,孙华,黄娟,张海辉。新型Cys2/ his2型锌指蛋白参与水稻耐盐性的功能分析。应用物理学报,2010;26(10):2807-18。gydF4y2Ba
Schmidt R, Mieulet D, Hubberten HM, Obata T, Hoefgen R, Fernie AR, Fisahn J, San Segundo B, Guiderdoni E, Schippers JH,等。盐反应性ERF1在水稻盐胁迫初始反应中调控活性氧依赖信号。植物学报。2013;25(6):2115-31。gydF4y2Ba
坂本H,丸山K,佐久间Y, Meshi T,岩渊M,筱崎K,山口-筱崎K。gydF4y2Ba拟南芥gydF4y2BaCys2/ his2型锌指蛋白在干旱、寒冷和高盐度胁迫条件下发挥转录抑制因子的作用。植物科学进展。2004;36(1):344 - 344。gydF4y2Ba
杨晓明,张晓明,张晓明,等。拟南芥锌指蛋白Zat12在活性氧和非生物胁迫信号传导中的作用。植物科学进展。2005;39(2):344 - 344。gydF4y2Ba
Mittler R, Kim Y, Song L, Coutu J, Coutu A, Ciftci-Yilmaz S, Lee H, Stevenson B,朱建科。Zat10的功能增益和功能缺失突变增强了植物对非生物胁迫的耐受性。中国科学(d辑),2006;gydF4y2Ba
Ciftci-Yilmaz S, Morsy MR, Song L, Coutu A, Krizek BA, Lewis MW, Warren D, Cushman J, Connolly EL, Mittler R. Cys2/ his2型锌指蛋白Zat7的ear基序在小鼠的防御反应中起关键作用gydF4y2Ba拟南芥gydF4y2Ba盐度胁迫。中国生物化学杂志,2007;28(12):9260-8。gydF4y2Ba
石辉,王霞,叶涛,陈峰,邓娟,杨萍,张勇,陈震gydF4y2Ba拟南芥gydF4y2Ba6通过激活水杨酸相关基因和c-repeat结合因子基因调节拟南芥的生物和非生物胁迫反应。中国生物医学工程学报,2014;29(3):344 - 344。gydF4y2Ba
徐德强,黄娟,郭淑琪,杨旭,包玉明,唐海军,张海生。tfiiia型锌指蛋白基因ZFP252的过表达增强了水稻的耐旱耐盐性(gydF4y2Ba栽培稻gydF4y2Bal .)。中国农业科学,2008;29(7):344 - 344。gydF4y2Ba
张慧,倪琳,刘颖,王艳,张安,谭敏,蒋敏。c2h2型锌指蛋白ZFP182参与水稻脱落酸诱导的抗氧化防御。中国生物工程学报,2012;29(7):457 - 457。gydF4y2Ba
张华,刘颖,温峰,姚东,王玲,郭娟,倪玲,张安,谭敏,蒋敏。水稻c2h2型锌指蛋白ZFP36是水稻抗氧化防御和抗氧化胁迫的关键分子。中国科学(d辑),2014;26(3):344 - 344。gydF4y2Ba
Davletova S, Rizhsky L, Liang H, Z Shengqiang, Oliver DJ, Coutu J, Shulaev V, Schlauch K, Mittler R.胞质抗坏血酸过氧化物酶1是拟南芥活性氧基因网络的核心成分。植物学报。2005;17(1):268-81。gydF4y2Ba
李志强,李志强,李志强,等。锌指蛋白Zat12在氧化应激过程中对抗坏血酸过氧化物酶1表达的影响gydF4y2Ba拟南芥gydF4y2Ba.中国生物医学工程学报,2004;29(4):344 - 344。gydF4y2Ba
张志刚,张志刚。六倍体小麦C1-2i锌指蛋白的全基因组鉴定及其对非生物胁迫的响应。中国生物医学工程学报。2016;29(2):873-90。gydF4y2Ba
胡德华,李志强,李志强。近等基因小麦C2H2锌指与铝耐受性的关系。土壤学报。2012;36(1):1 - 6。gydF4y2Ba
赵太阳B, Y,年代,杨米,小k . TaZFP1 t . aestivum乙炔type-ZFP基因,调节植物盐胁迫耐受性,通过调节不同stress-defensive生理过程。植物物理与生物化学。2019;136:127-42。gydF4y2Ba
Cheuk A, Houde M.一种新的大麦条纹花叶病毒允许大蛋白过表达快速功能分析。中国生物医学工程学报,2018;36(3):344 - 344。gydF4y2Ba
黄B:植物抗旱性的激素调节机制。见:植物的干旱耐受性,第1卷。编辑:Hossain MA, Wani SH, Bhattacharjee S, Burritt DJ, Tran L-SP, 1。瑞士:施普林格国际出版;2016:45-75。gydF4y2Ba
notor G, Veljovic-Jovanovic S, Driscoll S, Novitskaya L, Foyer CH: C3植物叶片的干旱和氧化负荷:光呼吸的主要作用?Ann Bot. 2002;89规格号:841-850。gydF4y2Ba
Foyer CH, Shigeoka S.了解氧化应激和抗氧化功能以增强光合作用。中国生物医学工程学报,2011;29(1):344 - 344。gydF4y2Ba
Ayala A, Munoz MF, Arguelles S.脂质过氧化:丙二醛和4-羟基-2-壬烯醛的产生、代谢和信号机制。《氧化医学杂志》2014;2014:360438。gydF4y2Ba
植物细胞氧化还原稳态与活性氧的研究。In: Gupta DK, Palma JM, Corpas FJ,编辑。氧化还原状态作为植物细胞应激反应的中心调节器。湛:施普林格国际出版;2016.25 - 50页。gydF4y2Ba
吉尔莫SJ,福勒SG,托马斯how MF。gydF4y2Ba拟南芥gydF4y2Ba转录激活因子CBF1、CBF2和CBF3具有匹配的功能活性。植物分子生物学杂志,2004;54(5):767-81。gydF4y2Ba
库宾,达哈尔KP,萨维奇LV,辛格J,博德R,伊万诺夫AG,赫里V,胡纳NP。CBFs作为叶绿体氧化还原、光敏色素和植物激素信号的整合因子在冷驯化中的作用。中华分子化学杂志,2013;14(6):12729-63。gydF4y2Ba
松林Y, Ogawa M, Kihara H, Niwa M, Sakagami Y.拟南芥植物硫素受体基因的破坏和过表达影响细胞寿命和生长潜力。植物科学进展。2006;42(1):45-53。gydF4y2Ba
Gabaldón T, Koonin EV。基因矫形学的功能和进化意义。中国农业科学。2013;14(5):360-6。gydF4y2Ba
Marshall A, Aalen RB, Audenaert D, Beeckman T, Broadley MR, Butenko MA, Cano-Delgado AI, de Vries S, Dresselhaus T, Felix G,等。应对干旱胁迫:受体样激酶提出了新的方法。植物学报。2012;24(6):2262-78。gydF4y2Ba
Dievart A, Perin C, Hirsch J, Bettembourg M, Lanau N, Artus F, Bureau C, Noel N, Droc G, Peyramard M,等。水稻中富含亮氨酸重复受体样激酶基因突变等位基因的表型分析揭示了耐胁迫谷物的新潜在靶点。植物科学进展(英文版);gydF4y2Ba
郭伟,郭文杰。拟南芥TOPLESS互作组基因抑制的研究进展。中国生物医学工程学报,2012;29(1):344 - 344。gydF4y2Ba
巴克斯特A,米特勒R,铃木N. ROS在植物胁迫信号传递中的关键作用。中国机械工程学报,2014;26(5):529 - 529。gydF4y2Ba
齐军,宋正大,王波,周娟,Kangasjärvi J,朱建科,龚忠。植物对干旱胁迫和病原侵袭的响应中ROS信号通路和气孔运动。中国生物医学工程学报,2018;29(4):344 - 344。gydF4y2Ba
刘勇,何超。植物氧化还原信号及其MAP激酶通路的调控研究进展。氧化还原生物学。2017;11:192-204。gydF4y2Ba
李志强,李志强,李志强,等。非生物胁迫下植物丝裂原活化蛋白激酶信号通路的研究。植物信号行为学。2011;6(2):196-203。gydF4y2Ba
阮小春,金士俊,李凯,金柯,刘小敏,韩海杰,黄明明,李文文,洪继昌,文永华,等。c2h2型锌指转录因子(ZAT10)的鉴定gydF4y2Ba拟南芥gydF4y2Ba作为MAP激酶的底物。植物细胞学报,2012;31(4):737-45。gydF4y2Ba
刘小敏,阮小春,金柯,韩海杰,刘杰,李k,金mc,尹金杰,郑伟。锌指转录调节因子ZAT6被MPK6磷酸化调控gydF4y2Ba拟南芥gydF4y2Ba盐胁迫和渗透胁迫下种子萌发。中国生物工程学报,2013;43(3):344 - 344。gydF4y2Ba
沈刚,Kuppu S, Venkataramani S,王娟,闫娟,邱霞,张慧。Ankyrin重复蛋白2A是拟南芥过氧化物酶体膜结合抗坏血酸过氧化物酶3的重要分子伴侣。植物学报。2010;22(3):811-31。gydF4y2Ba
徐小明,林华,Maple J, Bjorkblom B, Alves G, Larsen JP, Moller SG。拟南芥DJ-1a蛋白通过胞质SOD活化提供胁迫保护。中国生物医学工程学报(英文版),2010;gydF4y2Ba
李铮,黄娟,王铮,孟F,张松,吴霞,张铮,高铮。拟南芥核苷酸结合和富亮氨酸重复序列基因RPS2和RPM1(D505V)的过表达使水稻具有广谱抗病性。前沿植物学报2019;10:417。gydF4y2Ba
刘志军,刘志军。半胱氨酸代谢的分子生物学、生物化学和细胞生理学研究gydF4y2Ba拟南芥gydF4y2Ba.拟南芥书刊。2011;9:e0154。gydF4y2Ba
舒科,杨伟。E3泛素连接酶:植物发育和非生物胁迫响应中的泛在角色。中国生物医学工程学报,2017;29(4):344 - 344。gydF4y2Ba
Park JJ, Yi J, Yoon J, Cho LH, Ping J, Jeong HJ, Cho SK, Kim WT, An G. OsPUB15在幼苗建立过程中降低细胞氧化应激的作用。植物学报,2011;26(2):344 - 344。gydF4y2Ba
刘玉春,吴玉林,黄晓华,孙娟,谢强。U-box E3泛素连接酶AtPUB19对水稻脱落酸和干旱应答具有负向调控作用gydF4y2Ba拟南芥gydF4y2Ba.植物学报。2011;4(6):938-46。gydF4y2Ba
Bemer M, van Dijk ADJ, Immink RGH, Angenent GC。跨家族转录因子相互作用:基因调控的另一层。植物科学进展,2017;22(1):66-80。gydF4y2Ba
杨晓明,李志强,张晓明,等。植物转录因子与非生物胁迫信号通路的关系。生物工程学报。2010;54(2):201-12。gydF4y2Ba
李文杰,李志强,李志强,等。植物转录因子在植物抗非生物胁迫中的作用。在植物的非生物胁迫反应-生理,生化和遗传的角度。InTech里耶卡:的哲理;2011.p . 269 - 96。gydF4y2Ba
Häusler RE, Hirsch HJ, Kreuzaler F, Peterhänsel C. c4循环酶在转基因C3植物中的过表达:提高C3光合作用的生物技术方法。中国机械工程学报,2002;29(3):344 - 344。gydF4y2Ba
Doubnerova Hyskova V, Miedzinska L, Dobra J, Vankova R, Ryslava H.磷酸烯醇丙酮酸羧化酶,nadp -苹果酸酶,丙酮酸,磷酸二激酶参与驯化gydF4y2Ba烟草gydF4y2BaL.干旱胁迫。中国植物科学,2014;26(5):529 - 529。gydF4y2Ba
陈晓明,陈晓明,陈晓明,等。玉米nadp -苹果酶表达对烟草气孔功能的影响。中国机械工程学报,2002;29(3):344 - 344。gydF4y2Ba
康明斯I, Dixon DP, fretagg - pohl S, Skipsey M, Edwards R.植物谷胱甘肽转移酶在异种生物解毒中的多重作用。Drug Metab Rev. 2011;43(2): 266-80。gydF4y2Ba
谷胱甘肽S转移酶在植物抗非生物胁迫中的作用,包括砷解毒。前沿植物科学,2018;9(751):751。gydF4y2Ba
狄克逊DP, Lapthorn A,爱德华兹R.植物谷胱甘肽转移酶。基因组生物学,2002;3(3):REVIEWS3004。gydF4y2Ba
里弗罗RM, Kojima M, Gepstein A, Sakakibara H, Mittler R, Gepstein S, Blumwald E.开花植物叶片延迟衰老诱导极端耐旱性。中国科学院学报(自然科学版),2007;26(4):366 - 366。gydF4y2Ba
他们JM。被子植物复活植物耐干燥机理研究。In:植物耐干燥性;2007.51 - 90页。gydF4y2Ba
张晓霞,刘珊珊,高野,等。线粒体ATP合成酶小亚基基因的过表达(gydF4y2BaAtMtATP6gydF4y2Ba)对几种非生物胁迫具有耐受性gydF4y2Ba酿酒酵母gydF4y2Ba而且gydF4y2Ba拟南芥gydF4y2Ba.生物技术通报,2008;30(7):1289-94。gydF4y2Ba
膜转运蛋白与抗旱性——一个复杂的问题。植物科学进展(英文版);gydF4y2Ba
潘迪,刘志刚,刘志刚。植物叶片光合作用的减少与β -半乳糖苷酶活性的增加有关gydF4y2Ba拟南芥gydF4y2Ba:水分胁迫对酶活性的调节。原生质。2017;254(4):1651 - 9。gydF4y2Ba
杨晓明,李志强,李志强,等。DREB转录因子在植物抗非生物和生物胁迫中的作用。植物细胞学报,2006;25(12):1263-74。gydF4y2Ba
Sakuma Y, Maruyama K, Osakabe Y, Qin F, Seki M, Shinozaki K,山口-Shinozaki KgydF4y2Ba拟南芥gydF4y2Ba转录因子DREB2A参与干旱响应基因的表达。植物学报。2006;18(5):1292-309。gydF4y2Ba
Gilmour SJ, Sebolt AM, Salazar MP, Everard JD, Thomashow MF。过度表达gydF4y2Ba拟南芥gydF4y2BaCBF3转录激活因子模拟与冷驯化相关的多种生化变化。植物科学进展。2000;29(4):344 - 344。gydF4y2Ba
张志刚,张志刚。dreb在植物非生物胁迫响应调控中的作用。中国机械工程学报,2011;26(2):344 - 344。gydF4y2Ba
桑树EST编码悔恨蛋白(MiREM)参与非生物胁迫的分子和功能特征。植物细胞学报,2013;32(11):1729-41。gydF4y2Ba
赵瑞敏,李峰,方勇,高强,王伟。扩增素调控的细胞伸长与小麦抗旱性有关。原生质。2011;248(2):313 - 23所示。gydF4y2Ba
王晓明,张志刚,张志刚,张志刚。复活植物耐干燥的分子机制研究。中国生物医学工程学报(自然科学版),2012;gydF4y2Ba
陈x, Goodwin SM, Boroff VL,刘x, Jenks MA。的克隆和特性gydF4y2BaWAX2gydF4y2Ba基因的gydF4y2Ba拟南芥gydF4y2Ba参与角质层膜和WAX生产。植物学报。2003;15(5):1170-85。gydF4y2Ba
Jager K, Fabian A, Eitel G, Szabo L, Deak C, Barnabas B, Papp I.循环水分胁迫下不同耐受力面包小麦品种的形态生理差异。中国植物科学,2014;29(4):457 - 457。gydF4y2Ba
潘艳,李娟,焦琳,李超,朱东,于娟gydF4y2BaSetaria italicagydF4y2Ba脂质转移蛋白基因在非生物胁迫下起着关键作用。前沿植物科学2016;7(1752):1752。gydF4y2Ba
陈玉生,邱小斌。泛素在细胞死亡和生存的十字路口。中华癌症杂志,2013;32(12):640-7。gydF4y2Ba
Love AJ, Milner JJ, Sadanandom A.时间就是一切:植物细胞死亡的调控重叠。植物科学进展,2008;13(11):589-95。gydF4y2Ba
罗杰斯HJ。植物细胞死亡与器官发育中国生物医学工程学报,2005;gydF4y2Ba
多胺氧化酶是烟草培养细胞氧化破裂诱导程序性细胞死亡的关键因素之一。植物科学进展。2006;42(1):1 - 6。gydF4y2Ba
Malinovsky FG, Brodersen P, Fiil BK, McKinney LV, Thorgrimsen S, Beck M, Nielsen HB, Pietra S, Zipfel C, Robatzek S,等。Lazarus1是一种DUF300蛋白,有助于程序性细胞死亡gydF4y2Ba拟南芥gydF4y2BaAcd11和超敏反应。公共科学学报,2010;5(9):e12586。gydF4y2Ba
Epple P, Mack AA, Morris VR, Dangl JL。氧化应激诱导细胞死亡的拮抗控制gydF4y2Ba拟南芥gydF4y2Ba通过两种相关的植物特异性锌指蛋白。中国科学(d辑),2003;21(3):344 - 344。gydF4y2Ba
Dietrich RA, Richberg MH, Schmidt R, Dean C, Dangl JL。一种新的锌指蛋白编码gydF4y2Ba拟南芥LSD1gydF4y2Ba基因是植物细胞死亡的负调控因子。细胞。1997;88(5):685 - 94。gydF4y2Ba
Wituszynska W, Slesak I, Vanderauwera S, Szechynska-Hebda M, Kornas A, Van Der Kelen K, Muhlenbock P, Karpinska B, Mackowski S, Van Breusegem F,等。病变模拟疾病1、增强的疾病易感性1和植物抗毒素缺乏4有条件地调节细胞信号稳态、光合作用、水分利用效率和种子产量gydF4y2Ba拟南芥gydF4y2Ba.中国生物医学工程学报,2013;29(4):379 - 379。gydF4y2Ba
Szechynska-Hebda M, Czarnocka W, Hebda M, Bernacki MJ, Karpinski S. PAD4, LSD1和EDS1调节耐旱性,植物生物量生产和细胞壁特性。植物细胞学报,2016;35(3):527-39。gydF4y2Ba
植物中富含甘氨酸的蛋白质在胁迫反应中:一个新兴的,仍然有前景的故事。植物科学学报,2018;9:342。gydF4y2Ba
杨德华,郭庆杰,金明凯,朴世杰,杨金基,姜华gydF4y2Ba拟南芥gydF4y2Ba富含甘氨酸rna结合蛋白AtGRP2或AtGRP7可提高水稻产量(gydF4y2Ba栽培稻gydF4y2Ba)在干旱胁迫条件下。植物科学通报2014;214:106-12。gydF4y2Ba
Mangeon A, Magioli C, menees - salgueiro AD, Cardeal V, de Oliveira C, Galvao VC, Margis R, Engler G, sacheto - martins G. AtGRP5,一种液泡定位的富含甘氨酸的蛋白质,参与细胞延伸。足底。2009;230(2):253 - 65。gydF4y2Ba
卡佛B,惠特莫尔W,史密斯E, Bona L. 4个耐铝冬小麦种质的登记和2个易感近等值系。作物科学1993;33(5):1113-4。gydF4y2Ba
袁超,李超,闫琳,刘震,韩超,于军,李东。大麦条纹花叶病毒在单子叶和双子叶病毒诱导基因沉默的高通量载体。公共科学学报,2011;6(10):e26468。gydF4y2Ba
张志刚,张志刚,张志刚,等。一种利用大麦条纹花叶病毒快速高效表达基因的方法。植物科学进展。2017;13(1):24。gydF4y2Ba
肖芳华,薛国平。水分亏缺条件下大麦幼苗胚胎发生晚期丰富蛋白基因启动子活性分析。植物细胞学报2001;20(7):667-73。gydF4y2Ba
Andrews S: FastQC:高通量序列数据的质量控制工具。2010.可在http://www.bioinformatics.babraham.ac.uk/projects/fastqc/上获得。gydF4y2Ba
Bolger AM, Lohse M, Usadel B. Trimmomatic:一种用于Illumina序列数据的灵活修剪器。生物信息学。2014;30(15):2114 - 20。gydF4y2Ba
Goecks J, Nekrutenko A, Taylor J, Galaxy T. Galaxy:支持生命科学中可访问的、可复制的和透明的计算研究的综合方法。中国生物医学工程学报。2010;11(8):R86。gydF4y2Ba
Ramirez F, Ryan DP, Gruning B, Bhardwaj V, Kilpert F, Richter AS, Heyne S, Dundar F. Manke T: deepTools2:用于深度测序数据分析的下一代web服务器。核酸研究,2016;44(W1): W160-5。gydF4y2Ba
Patro R, Duggal G, Love MI, Irizarry RA, Kingsford C. Salmon提供了快速和偏见意识的转录表达量化。光子学报。2017;14(4):417-9。gydF4y2Ba
Clavijo BJ, Venturini L, Schudoma C, Accinelli GG, Kaithakottil G, Wright J, Borrill P, Kettleborough G, Heavens D, Chapman H,等。一种改良的异源六倍体小麦基因组的组装和注释鉴定了完整的农艺基因家族,并为染色体易位提供了基因组证据。中国生物工程学报,2017;27(5):885-96。gydF4y2Ba
Haas BJ, Papanicolaou A, Yassour M, Grabherr M, Blood PD, Bowden J, Couger MB, Eccles D, Li B, Lieber M,等。利用三位一体平台从RNA-seq中重建转录本序列,用于参考生成和分析。网络学报。2013;26(8):1494-512。gydF4y2Ba
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25(4):402 - 8。gydF4y2Ba
植物中活性氧(ROS)、脂质过氧化和电解质泄漏的测定和检测。方法Mol生物学,2010;639:292-8。gydF4y2Ba
超氧化物歧化酶:改进的测定方法和适用于丙烯酰胺凝胶的测定方法。生物化学。1971;44(1):276-87。gydF4y2Ba
菠菜叶绿体中过氧化氢被抗坏血酸特异性过氧化物酶清除。植物物理学报。1981;22(5):867-80。gydF4y2Ba
过氧化氢酶。上榜者:编辑Bergmeyer HU。酶促分析方法。第2版:学术出版社,剑桥,美国;1974.p . 673 - 84。gydF4y2Ba
致谢gydF4y2Ba
作者感谢李大伟(中国农业大学农业生物技术国家重点实验室)提供的pCaBS-α、pCaBS-β和pCaBS-γ载体。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了加拿大自然科学与工程研究委员会的资助(RGPIN-2017-05256)gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
AC进行实验;AC和MH设计实验,解释数据并撰写手稿;FO对数据进行了解释,并对手稿进行了修改。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
沉默的gydF4y2BaTaZFP1BgydF4y2Ba影响最接近的相对表达gydF4y2BaTaZFP1BgydF4y2Ba不相关的亲戚(联系)。不同类型的小麦植物(见图。gydF4y2Ba1gydF4y2Ba)培养14天,然后再进行7天的充足灌溉或7天的干旱胁迫,用qRT-PCR检测表达水平。数据为4个生物重复的平均表达±SD。不同字母表示样本间差异有统计学意义(gydF4y2BaPgydF4y2BaTukey 's检验< 0.05)。gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
小麦叶片叶绿素自发荧光研究不同类型的小麦植物(见图。gydF4y2Ba1gydF4y2Ba)种植14天,然后再浇水10天或14天(面板上的顶部叶子),或者通过闭水10天或14天(面板上的底部叶子)来抵御干旱。使用NightOWL II成像柜捕获荧光。gydF4y2Ba
附加文件3:表S1。gydF4y2Ba
TaZFP1B过表达上调的基因列表。gydF4y2Ba
附加文件4:图S3。gydF4y2Ba
RNA-Seq数据的qRT-PCR验证。不同类型的小麦植物(见图。gydF4y2Ba1gydF4y2Ba)种植14天,然后再浇水7天,或者缺水7天。表达水平相对于水分充足的野生型组。数字参照表中对应的基因gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba而且gydF4y2Ba5gydF4y2Ba.数据为4个生物重复的平均表达±SD。不同字母表示样本间差异有统计学意义(gydF4y2BaPgydF4y2BaTukey 's检验< 0.05)。gydF4y2Ba
附加文件5:表S2。gydF4y2Ba
TaZFP1B过表达下调的基因列表。gydF4y2Ba
附加文件6:表S3。gydF4y2Ba
本研究中使用的引物。gydF4y2Ba
附加文件7:图S4gydF4y2Ba
RNA-seq文库之间的相关性热图。不同类型的小麦植物(见图。gydF4y2Ba1gydF4y2Ba)种植14天,然后再浇水7天,或者缺水7天。制备RNA-Seq文库,进行配对端测序。从配对端测序中产生的每个读数都被单独分析。利用Spearman相关系数进行分层聚类。颜色刻度表示相关性的程度。gydF4y2Ba
附加文件8:图S5。gydF4y2Ba
RNA-seq与qRT-PCR数据之间的Pearson相关性。表达率(干旱处理野生型/干旱处理1B-OEX)的qRT-PCR log2值(y轴)由表达率(干旱处理野生型/干旱处理1B-OEX)的RNA-seq log2值(x轴)绘制。用于计算相关性的基因列在补充表中gydF4y2Ba1gydF4y2Ba.所有qRT-PCR数据均来自3个生物重复。——表示95%置信区间。计算出的相关值(gydF4y2BaRgydF4y2Ba2gydF4y2Ba)与回归线一起显示。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Cheuk, A., Ouellet, F. & Houde, M.大麦条纹花叶病毒表达系统揭示了小麦C2H2锌指蛋白TaZFP1B作为耐旱性的关键调节因子。gydF4y2BaBMC植物生物学gydF4y2Ba20.gydF4y2Ba144(2020)。https://doi.org/10.1186/s12870-020-02355-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02355-xgydF4y2Ba
关键字gydF4y2Ba
- 大麦条纹花叶病毒gydF4y2Ba
- C2H2锌指蛋白gydF4y2Ba
- 干旱gydF4y2Ba
- 功能描述gydF4y2Ba
- 基因超表达gydF4y2Ba
- 植物转化gydF4y2Ba
- RNA-SeqgydF4y2Ba
- 核gydF4y2Ba
- 转录组gydF4y2Ba
- 小麦gydF4y2Ba