摘要
背景
常见的野豌豆(野豌豆属漂白亚麻纤维卷L.)是一种重要的自花授粉的一年生草料豆科植物,在干旱易发地区作为牲畜和人类食用的蛋白质来源很有意义。而干旱胁迫对黄豆科植物的生长发育和产量有不利影响。植物在地表和地下之间进化出共同或不同的代谢途径,以应对干旱胁迫。野豌豆地上组织和地下组织对干旱胁迫的协调响应目前尚不清楚。
结果
结果显示,12份样本共鉴定出30427个全长转录本,平均长度为2278.89 bp。然后通过Illumina-Seq分析上述12个样本的整体转录谱。在叶片和根中分别鉴定出3464和3062个差异表达基因。基因本体(GO)富集分析发现脱氢蛋白基因和Δ1-吡咯啉-5-羧酸合成酶被诱导用于脯氨酸的生物合成和保水。京都基因与基因组百科(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析结果表明,DEGs在激素信号转导、淀粉和蔗糖代谢、精氨酸和脯氨酸代谢中显著富集,并鉴定出多个干旱响应候选基因。脱落酸(ABA);AREB/ABF-SnRK2通路)调控AMY3和BAM1活性,诱导叶片淀粉降解,增加根系碳输出,这可能与干旱胁迫反应有关。在共诱导转录因子(TFs)中,AREB/ABF、bHLH、MYB、WRKY和AP2/ERF具有不同的表达模式,可能是叶片与根系在干旱胁迫下相互作用的关键。在转基因酵母中,过表达四种转录因子增加了酵母对渗透胁迫的耐受性。
结论
在叶和根中发现的多管齐下的方法拓宽了我们对普通野豌豆抗旱协调机制的理解,并进一步提供了通过基因工程提高抗旱性的靶点。
背景
植物经常遇到不利的生长条件,如干旱、盐碱和极端温度。这些胁迫会减少植物生长和作物产量,并在决定植物物种的地理分布方面发挥重要作用[1,2,3.].在这些环境因素中,干旱是影响植物生产力和生存的最严重的非生物胁迫之一[4,5].在干旱条件下,植物启动各种复杂的信号网络,以适应和生存在缺水时期,并演化出三种主要的复杂策略来应对干旱条件:(i)逃避胁迫,(ii)避免胁迫和(iii)耐受胁迫[6].干旱逃逸发生在严重干旱缩短的生长季节,通过对改变植物分子机制的环境线索的响应。相反,抗旱是通过一系列的形态和生理变化来提高植物的水分利用效率和减少蒸腾作用。抗旱性通过产生稳定蛋白质的分子和渗透调节来抵抗脱水[7,8].这些植物适应策略包括形态学、生化、生理和分子变化,其基础是许多基因的表达改变,其中可能包括胁迫信号转导相关基因、功能蛋白和转录因子(tf)的上调[9,10].
参与抗旱性的重要基因一般分为两类:调节基因和功能基因[2,10].功能基因编码重要的代谢蛋白和酶,直接在保护细胞免受应激作用中起作用,调控基因编码大量的调控蛋白,包括蛋白磷酸酶、激酶和tf,主要在同步非生物应激反应中的基因表达和信号转导中发挥重要作用[11,12].特别值得注意的是,植物基因组中高达10%的基因是tf,它们可以通过ABA依赖/独立途径被激活,并通过调节下游的胁迫响应基因在植物的耐旱性中发挥特别关键的作用[5,13].
代谢同化协调是植物适应干旱胁迫机制的关键因素。在植物中,大部分水分从土壤中蒸发,以换取CO2这使得水资源的可用性成为增长和生产力的主要限制因素。尽管地上的叶子和地下的根有不同的发育轨迹,植物也进化出高度协调的生物过程,通过微调叶片的能量生产来适应干旱条件,以响应根系中水分和营养的可用性[3.,14].考虑到地上组织和地下组织之间生物过程的复杂性,在植物全转录组水平上了解与抗旱性有关的常见和特殊的胁迫相关基因表达谱和分子网络是非常必要的。利用下一代RNA测序(NGS)技术,在许多非模式植物物种中发现了许多干旱响应基因,包括松果体halepensis[15),藜藜麦(Willd。)16),而Ammopiptanthus mongolicus[17,但这些研究主要集中在单个组织或整个植物,除了李属mahaleb,Arundo donax,镜头culinaris,碧桃,利用NGS识别干旱胁迫下叶与根的协调响应机制[18,19,20.,21,22].这些研究表明,激素信号转导在植物对干旱胁迫的响应中起着重要作用。与NGS方法相比,最近开发的太平洋生物科学公司(PacBio)全长测序可以产生更长的读取长度和高度准确和无偏序序列,使其在没有参考基因组的物种的基因组、转录组和表观遗传学研究中更有效地解决未解决的问题[23,24].然而,据我们所知,利用这种新的全基因组测序方法对植物干旱响应基因进行全基因组转录组学研究尚未见报道。
常见的野豌豆(野豌豆属漂白亚麻纤维卷L.)是一种重要的自花授粉的一年生草料豆科植物,在干旱易发地区作为一种投入最少的优质动物饲料很有价值[25,26].由于其成本低、营养价值高和广泛的环境适应性,野豆科植物不仅被用作牲畜饲料的蛋白质来源,还被用于人类消费[27,28].相比诉narbonensis而且诉摘要,在缺水条件下,野豌豆的生长受影响最大[29].因此,系统认识其对干旱响应的分子机制,对提高野豆科植物的质量和生态分布具有重要意义。此前,Zhu等人(2019)对干旱胁迫下的普通黄豆科植物整体进行了重新转录分析,发现干旱响应基因主要参与植物激素信号转导、糖酵解/糖异生和苯丙烷类生物合成[30.].然而,由于NGS的测序结果大多不能代表全长cDNA序列,且作者只关注普通野豆科植物整体对干旱胁迫的响应,因此,利用全长测序方法系统地阐明和比较野豆科植物地上组织和地下组织对干旱响应的分子机制还有待进一步研究。在本研究中,我们首次使用PacBio全长测序方法生成了普通野豆科植物的转录组。进一步系统地鉴定和分析了叶片和根系在干旱胁迫下的差异表达基因及其共同和不同的分子机制。这些结果将加深我们对干旱胁迫响应的分子协同机制的认识,同时也将加速发现和改良普通野豌豆的抗旱性相关基因。
结果
Illumina-Seq和映射
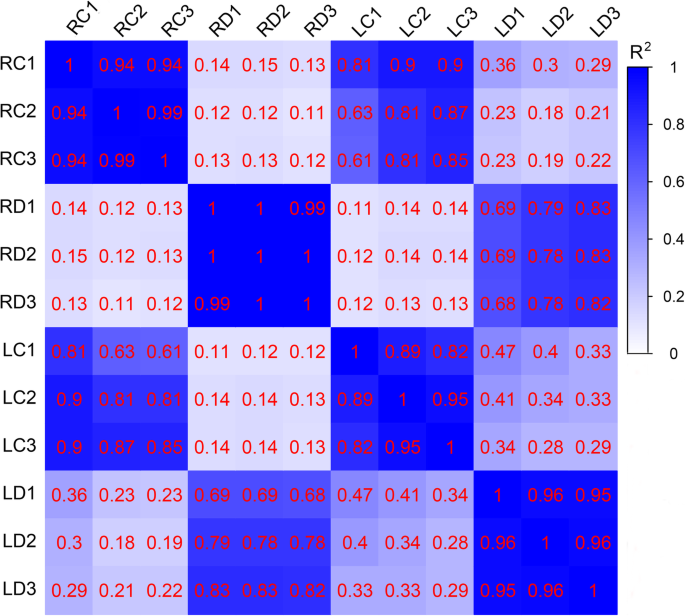
由于地上的叶子是第一个感知水分流失的组织,而地下的根是第一个暴露于干旱的器官,它们遵循不同的生物过程来应对干旱胁迫。在本研究中,我们收集了对照和干旱条件下的叶和根组织,并进行了转录组分析,以获得普通野豌豆在缺水条件下的反应概况。在我们的初步实验中,我们发现高浓度的聚乙二醇会严重抑制普通野豌豆幼苗的生长,因此,本研究使用中等浓度(20%的聚乙二醇)进行转录组分析(附加文件)8:图S1)。从浸水24 h的根和叶(RD1、RD2、RD3、LD1、LD2和LD3)和对照条件(RC1、RC2、RC3、LC1、LC2和LC3)中制备12个cDNA文库,用于Illumina测序。在过滤掉Q30百分比大于90.35%的低质量读取后,总共产生了3.1877亿个对端读取。其中,根和叶的清洁reads分别为160.27和1.585亿个。clean read的平均GC含量为43.07%1).Pearson相关系数显示,3个重复的相关值均在0.82 ~ 1之间,呈正相关关系,测序结果可用于进一步研究(图1)。1).
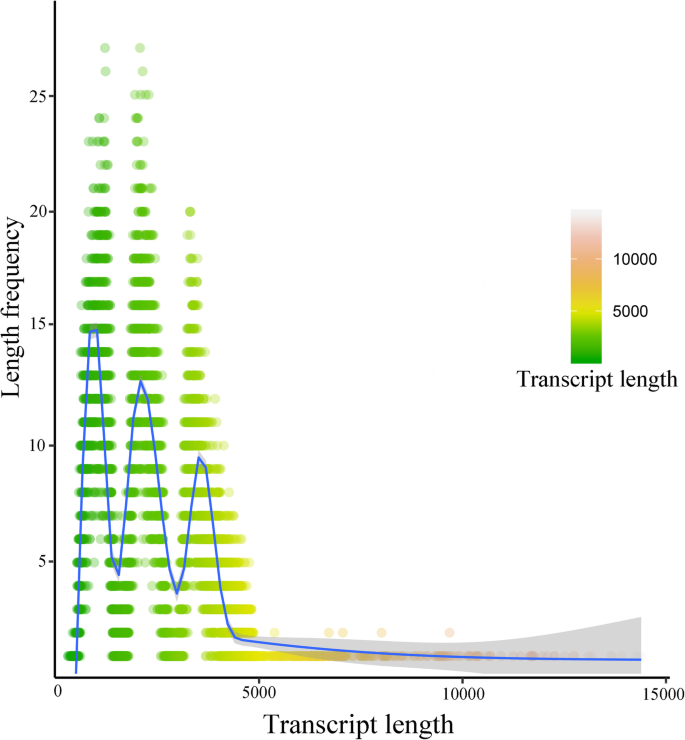
从12个样本中提取相同的rna作为一个样本,并进行SMRT测序,以生成一个信息丰富的参考转录组数据库。将这些序列与NGS序列相结合,以提高正确子读的质量和数量。最后,在所有12个样本中共鉴定出30,427个转录本。然后通过Bowtie2软件将干净的读取映射到完整的转录本上。总的来说,每个库的平均、唯一和多映射比率分别为77.57、27.89和72.11%1).这些30427个转录本的长度范围为304 ~ 14390 bp,平均长度为2278.89 bp, N50长度为4604 bp(图4)。2).小说转录本的平均长度为1682.75 bp,比注释转录本短。
公共数据库中的文字注释和分类
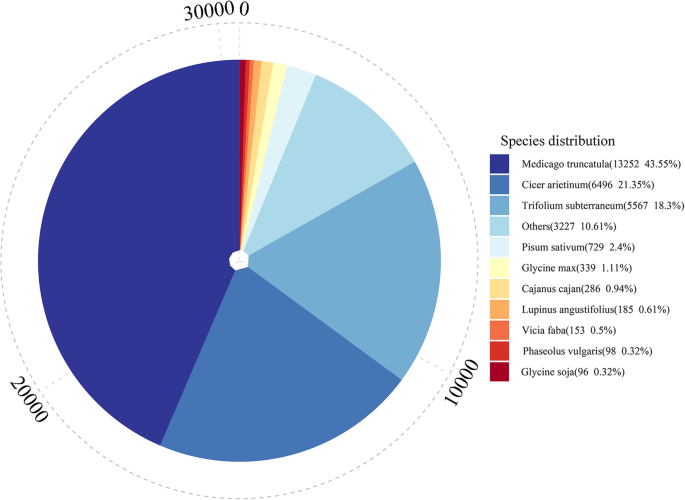
为了预测转录本的功能注释,将所有转录本序列与Nr、KOG、COG、Pfam、Swiss-Prot、eggNOG、GO和KEGG等8个公共数据库进行比对。结果如表所示2.在这8个数据库中共成功注释了29,898份转录本。有注释的转录本数量在10220 (33.59%,COG) ~ 29824 (98.01%, Nr)之间,在所有数据库和未在数据库中注释的转录本数量分别为8107(26.64%)和528(1.74%)。与其他物种相比,Medicago truncatula与普通野豆科植物的匹配最多(13252株,43.55%),其次为中投arietinum(6496年21.35%)三叶草subterraneum(5567 18.30%)(图。3.).
叶和根中潜在的DEGs分析
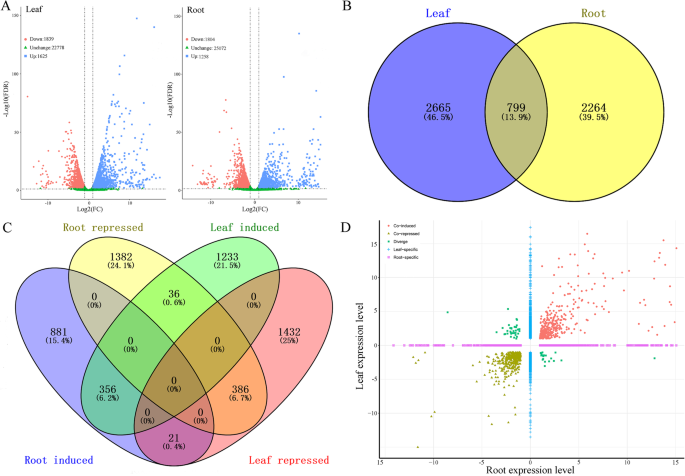
为了进一步了解普通野豆科植物对干旱胁迫响应的转录组学特征,对对照和干旱胁迫条件下叶和根组织中的基因进行了比较。与对照相比,在干旱条件下,叶片和根系中分别鉴定出3464和3062个DEGs。其中,1625和1258个DEGs在叶片和根系中分别表达上调,1839和1804个DEGs在干旱胁迫下叶片和根系中分别表达下调(图4)。4a).这些结果表明叶片对干旱胁迫比根系更敏感。其中2665个(46.5%)和2264个(39.5%)deg分别是叶片和根特异性的(图5)。4b).值得注意的是,共有799个(13.9%)基因在两种组织中差异表达;799个基因中,共诱导基因356个(6.2%),共抑制基因386个(6.7%),反表达基因57个(1%)。4c和d)。DEGs的绝对值表明,在干旱条件下,在两种组织中,共抑制的DEGs比共诱导的DEGs高表达的基因要少(图1)。4d)分析了528个新型转录本对干旱胁迫响应的基因表达谱。分析结果显示,在干旱胁迫下,叶片和根系中分别有40个和30个显著差异表达的转录本。在叶片中,26个转录本上调,14个转录本下调,392个正常表达,96个未检测到。在根中,16个转录本上调,14个下调,441个正常表达,57个未检测到1:表S1)。对于平均表达变化,两种组织中检测到的所有转录本都显示出非常相似的水平,但在干旱条件下,叶片中的转录本比根中的表达更高9:图S2A)。对于新的转录本,它们的表达模式更有可能在两种组织中上调(附加文件9:图开通)。
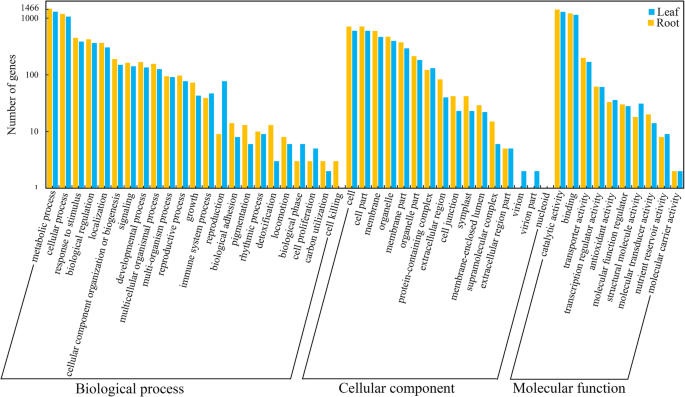
为了进一步了解普通紫薇植物的叶片和根系在干旱胁迫下是否发生了类似的响应机制,利用GO数据库对DEG函数进行了分类。共49个官能团分为三类。在生物过程(BP)类中,叶片的代谢过程(1594:上调42.8%)和根(1423:上调41.7%)最多,其次是叶片的细胞过程(1273:上调41.7%)和根(1151:上调42.5%),叶片的单生物过程(1074:上调45.2%)和根(943:上调42.5%),叶片对刺激的响应(446:上调50.2%)和根(385:上调40.5%)。叶片中参与“对刺激的反应”的表达上调的DEGs多于根,提示这些DEGs可能在干旱感知和响应中发挥重要作用。在细胞成分(CC)类中,叶片“细胞”(714:上调54.6%)和根(598:上调53.8%)、叶片“细胞部分”(714:上调50.2%)和根(599:上调53.9%)、叶片“膜”(596:上调32.4%)和根(469:上调41.2%)相关的DEGs最为丰富。在分子功能(MF)组中,排在前三位的GO项中,叶片的“催化活性”(1410:上调41.4%)和根(1286:上调40.0%)、叶片的“结合”(1207:上调45.4%)和根(1142:上调38.3%)、叶片的“转运体活性”(200:上调37.5%)和根(173:上调37.6%)的富集程度高于其他项(图5)。5).在3464个DEGs中,有2293个(66.2%)在GO数据库中被成功注释;然而,69个deg与8个公共数据库中的任何基因都不匹配,在两个组织中只检测到一个转录本。其余的deg是组织特异性的,这可能表明具有组织特异性功能的新转录本的存在。
基因表达的验证
为了进一步证实我们的RNA-Seq数据的可靠性,我们从叶和根中随机选择了10个候选deg进行qRT-PCR验证。如附加文件所示10:图S3,这些DEGs在叶和根中的表达水平与FPKM值显著相关。其中5个基因在干旱处理后表达上调,3个基因表达下调,2个基因表达相反。在我们的研究中,线性回归分析显示了较高的正相关系数(R2= 0.81),说明我们的转录数据中这些DEGs的表达与qRT-PCR结果基本一致(附文件11:图S4)。
去富集分析
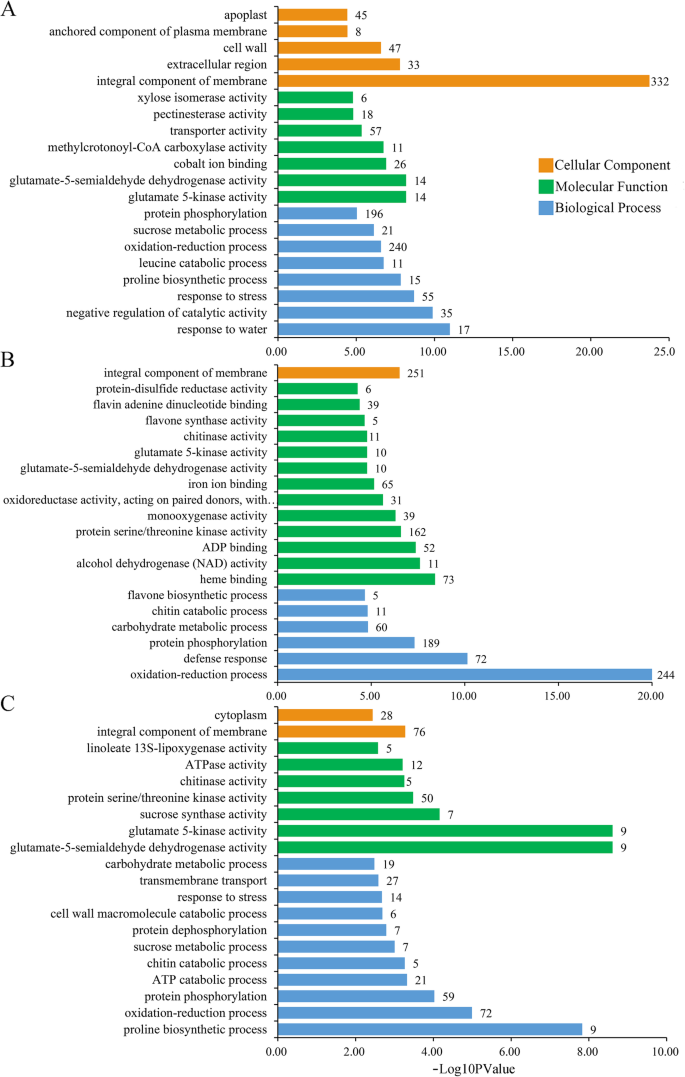
植物的叶和根遵循不同的发育轨迹,为了适应波动的环境,它们的生物过程在全植物水平上高度协调。为了研究干旱胁迫下调控整个植物相互作用和协调的分子机制,我们对两个组织间共享的叶、根和deg进行了GO富集(前20)分析。氧化石墨烯富集表明,干旱胁迫显著影响了野豌豆叶片中8个BP、7个MF和5个CC类别(图1)。6a).同样,13个MF类、6个BP类和1个CC代谢类在普通紫薇科植物根系中受到影响(图1)。6b)根系中MF类项的deg含量高于叶片。此外,11个bp, 7个mf和2个CC类别在两种组织中显著富集(图。6c).“膜的整体成分”是叶片中最显著的富集类别,其次是“催化活性负调控”和“对水分的响应”。植物脱氢酶基因的表达和积累与抗非生物胁迫能力呈一致的正相关。值得注意的是,所有17个富集在“对水的反应”类别的基因都被上调,并在Nr数据库中注释为“脱氢蛋白”(附加文件12:图S5A)。其中14例显著上调(Log2FC > 6),而在对照条件下几乎检测不到它们的表达。根中最显著富集的deg是“氧化还原过程”,其次是“防御反应”和“蛋白质磷酸化”(附加文件12: Fig.S5B)。在244个“氧化还原过程”类富集的DEGs中,有172个基因在根中特异性表达,其中68个基因表达上调,104个基因表达下调2:表S2)。值得注意的是,在两种组织中均检测到72个DEGs,其中30个表达上调,36个表达下调,6个在叶和根中反表达。在主要的MF类中,氧化还原酶活性也较高。结果表明,与氧化/还原活性相关的DEGs可能在干旱胁迫响应中发挥重要作用。“防御反应”是最丰富的20个GO词汇中第二丰富的词汇。有趣的是,在两种组织中都检测到18个DEGs,其中1个在叶和根中表达上调,8个表达下调,9个在叶和根中相反表达,说明这些相反表达的基因可能在普通野豆科植物的地上和地下组织中对干旱胁迫的响应中发挥不同的作用3.:表S3)。此外,我们分析的两个组织中有799个DEGs,在排名前20的GO术语中,“谷氨酸-5-半醛脱氢酶活性”术语最为显著,其次是“谷氨酸5-激酶活性”、“脯氨酸生物合成过程”和“氧化还原过程”(附文件)12:图S5C)。在“响应胁迫”途径富集的14个DEGs中,10个在两种组织中表达上调,3个表达下调,1个相反表达,在叶片中表达上调,在根系中表达下调。“脯氨酸生物合成过程”是BP类中最丰富的术语。总共9个Δ1-吡咯啉-5-羧酸合成酶(P5CSs)在此期间富集,且均表达上调。
KEGG富集分析
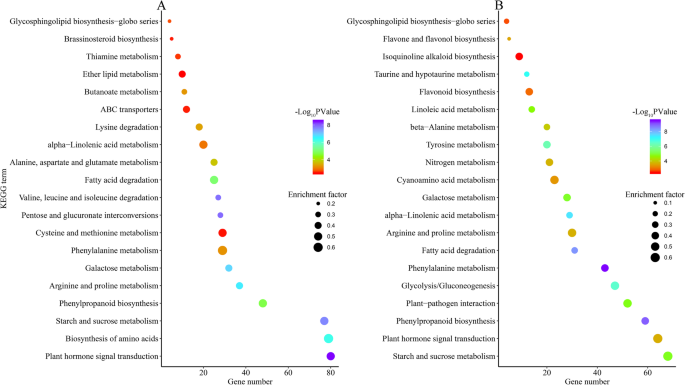
为了研究干旱胁迫下DEGs的复杂生物学行为,进行了KEGG途径富集分析。共有1424个干旱响应的deg被分配到叶片和根的113个KEGG通路上4:表S4)。筛选叶和根的前20条潜在通路,作为最强烈的响应活动(图5)。7).从KEGG富集分析来看,“植物激素信号转导”、“氨基酸生物合成”、“淀粉与蔗糖代谢”、“苯丙烷类生物合成”、“精氨酸与脯氨酸代谢”是叶片中最活跃的生理活动,而“植物激素信号转导”、“淀粉与蔗糖代谢”、“苯丙烷类生物合成”、“植物-病原相互作用”、“糖酵解/糖异生”、“苯丙氨酸代谢”是根中最活跃的活动。“植物激素信号转导”、“淀粉和蔗糖代谢”和“苯丙烷生物合成”是两种组织对干旱反应最丰富的途径。两种组织中共有9条通路和11条不同的通路,其中一半以上被归为“代谢”相关通路。
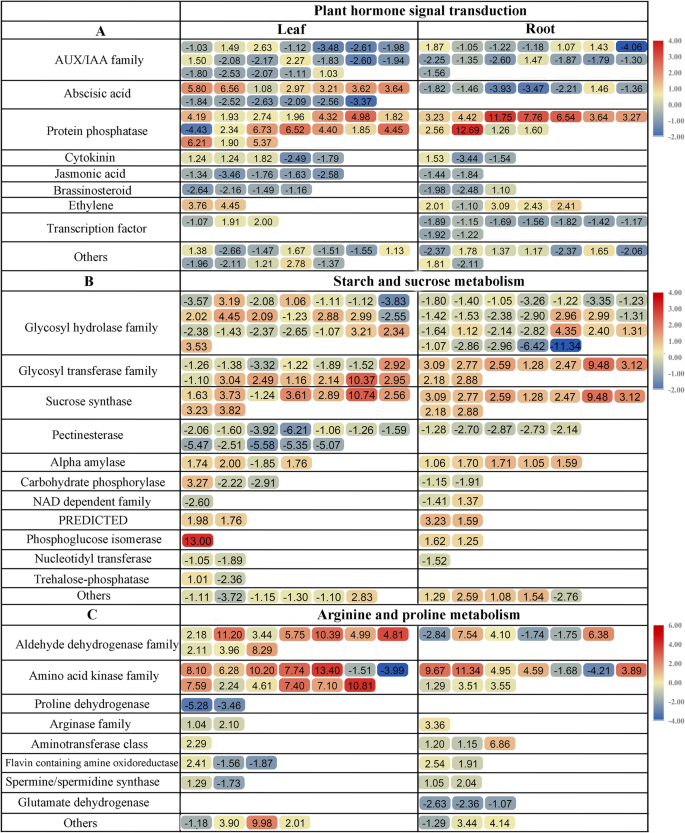
我们进一步比较了叶片和根之间三条富集的KEGG通路:“植物激素信号转导”(ko04075)、“精氨酸和脯氨酸代谢”(ko00330)和“淀粉和蔗糖代谢”(ko00500)。几个激素相关基因的鉴定表明,普通的野豌豆可能使用大量的信号介质来对抗干旱胁迫。干旱处理后,叶片和根系中的ABA、生长素、磷酸酶、细胞分裂素(CK)、油菜素内酯(BR)、乙烯(ET)、赤霉素(GA)和茉莉酸(JA)信号通路等植物激素信号相关的DEGs均上调或下调。如图所示。8A和附加文件5:表S5a,在植物激素信号转导途径中,叶片或根系中大部分基因参与ABA、生长素和磷酸酶途径;所有磷酸酶相关基因在根中表达上调,而大部分在叶中表达下调。大部分ABA代谢相关基因在两种组织中均表达下调。有趣的是,参与植物激素代谢的转录因子仅在根中被发现,且全部下调。如图所示。8B和附加文件5:表S5b,在植物“淀粉和蔗糖代谢”途径中,叶片或根系中大部分基因参与糖基水解酶家族;近一半的基因在叶片中表达上调,80.76%的基因在根中表达下调。糖基转移酶家族基因在根中全部上调,其中一半在叶中上调。蔗糖合酶基因在叶片中特异富集,且大部分基因表达上调。在本研究中,“精氨酸和脯氨酸代谢”途径是基因中冗余度最高的,其中大量基因在干旱条件下表达上调(图1)。8C和附加文件5:表S5c)。许多氨基酸激酶家族和醛脱氢酶(ALDH)家族基因在叶和根中均有显著表达。叶片中表达上调的DEGs高于根中表达的DEGs。所有ALDHs均在叶片中表达上调,且叶片中的转录物丰度远大于根系。相比之下,脯氨酸脱氢酶(PDH)和精胺/亚精胺合成酶相关基因分别在叶片和根中表达。
TFs对干旱胁迫响应的鉴定
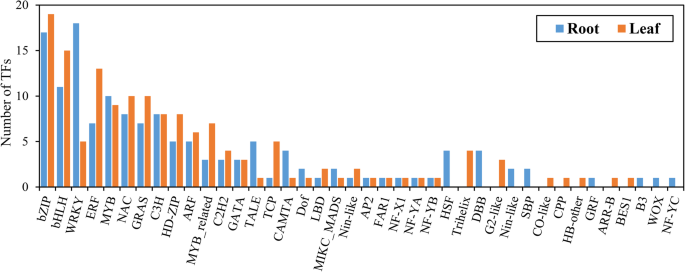
转录因子在调节植物在恶劣环境条件下生存的胁迫反应中起着至关重要的作用。在我们的转录组数据中,共有149和133个DEGs被鉴定为转录因子,分别在叶和根中被分为32和33个科(图5)。9).常见的野豌豆叶和根中最具代表性的转录因子家族是bZIP、bHLH、WRKY、ERF、MYB和NAC,这些转录因子被称为胁迫相关转录因子,在介导植物干旱胁迫反应中的作用已被广泛研究。叶片中WRKY转录本的数量是根中WRKY转录本的近4倍,而叶片中erf转录本的数量是根中的近2倍。共有38个共同反应的deg被鉴定为tf,它们属于17个科(图。10).在这些TF中,最丰富的TF家族是bHLH(5)和NAC(5),其次是bHLH(4)、ERF(4)和C3H(4)。在叶和根中分别鉴定出111和95个特异反应的tf;如HSF、Trihelix、G2-like、CO-like、CPP、ARR-B和BES1等基因在叶片中均有特异性表达,表明其抗旱性存在组织特异性机制。
酵母中候选tf的功能验证
迄今为止,利用转基因技术提高植物抗旱性的研究已经开展了许多工作,并通过遗传转化方法取得了一些有前景的结果。我们用pYES2载体在酵母菌INVSc1中异源过表达4个标记为ATNAC3 (F01.PB8282)、ERF107 (F01.PB3413)、ANAC019 (F01.PB9565)和ATMYB59 (F01.PB10800)的DEGs,以研究它们在酵母暴露于30% PEG和5 M NaCl时的可能作用(图1)。11).在非应激条件下,pYES2和4种TF转基因酵母细胞的存活率没有差异。在30% PEG和5 M NaCl中培养36 h后,转化系均成活良好,而对照系受到抑制,尤其是在盐胁迫下。这些结果与同源基因的表达模式一致拟南芥,这也是由脱水应激引起的拟南芥[31,32,33].在四种tf中,过表达ANAC019的菌株比过表达其他tf的菌株在盐胁迫下存活更好,说明ANAC019蛋白可能赋予酵母细胞脱水耐性。由于目前对普通野豆科植物基因功能的认识有限,这些结果将为后续研究野豆科植物功能基因的特性提供候选资源。
讨论
PacBio Iso-Seq从普通的野豌豆中获得高质量的转录本
单分子测序具有更长的阅读长度和更高的一致性准确性,可以生成全长转录本和接近参考质量的基因组组装,基因组注释和转录组表征的准确性大大提高,特别是对于没有参考基因组的物种[23,24]。在本研究中,共产生了30 427份全文转录本;这比之前报道的普通野豌豆转录组数据要长得多,如772 bp [25, 1124 bp [30.]和921.55 bp [34].在这些全文转录本中,注释的比例高于以往关于普通野豌豆的研究中所确认的比例(66.10%和83.48%)[25,30.].其余未注释的转录本(528)可能代表了一个普通的野豌豆特有的新基因库,这将为未来的实验提供一个良好的起点,包括初步的功能表征和研究它们在普通野豌豆干旱胁迫响应中的潜在作用。
干旱胁迫相关DEGs的表征
混合测序策略已经建立,以使用更精确的NGS短读和PacBio全长转录本结合使用,可以获得比单独使用测序更高质量的转录本。由于干旱胁迫下普通紫薇植物地上组织和地下组织的代谢和生物学过程尚不清楚,我们利用Illumina HiSeq X Ten平台进一步研究了干旱条件下普通紫薇植物叶片和根系中DEGs的表达规律。与根相比,叶片中鉴定出的DEGs更多。这表明,在根中,大多数基因的表达谱比在叶中更稳定,但在根中检测到的DEGs数量比在叶中要少。共有799个DEGs在两种组织中差异表达,只有57个DEGs在两种组织中表达相反,这表明野豌豆地上组织和地下组织可能通过相似的生物学过程高度协调,优化全株对干旱胁迫的适应;此外,在干旱胁迫下,植物仍有明显的发育轨迹,这与研究结果一致李属mahaleb而且碧桃在干旱胁迫下[18,20.].
野豆科植物干旱转录应答的功能分类
GO注释后,DEGs被标记为BP、MF和CC类中的49个官能团。此外,我们还进行了GO富集,以确定最主要的优势项,我们的结果与前人的研究一致,表明不同植物物种对干旱胁迫的响应具有保守功能[20.,35].结果表明,“对水的反应”是叶片中富集最多的术语,共有17个DEGs(均注释为脱氢蛋白)富集,且均上调;其中3个在根中也有上调。脱氢蛋白,也被称为胚胎发育晚期丰富蛋白(LEA),是研究得最好的LEA蛋白组[36].存在了五李属却草原在一种或几种处理下,叶片表达上调,尤其是PEG处理下。当在烟草中过度表达时,有四种草原增强烟草对寒冷和干旱胁迫的耐受性[37].近年来,许多研究表明,脱氢蛋白基因和其他保护机制,如活性氧(ROS)的dismutation,协同提高植物对各种胁迫的耐受性[38,39,40].BP类中,“脯氨酸生物合成过程”富集程度最高。共有9个P5CSs在“脯氨酸生物合成过程”术语中富集,且全部上调。作为一个关键基因,P5CS1在干旱胁迫下,脯氨酸在生物合成中发挥重要作用。在大麦中,从41个变异中鉴定出13个独特的单倍型HvP5CS1, 2个单倍型和5个多态性与耐旱性相关性状显著相关[41].dehydrin和P5CS本研究中发现的基因可能是进一步研究普通野豆科植物干旱相关基因的重要候选基因。
普通野豆科植物对干旱胁迫响应的一般信号通路
在不利的环境下,植物进化出精确的机制,可以从区分胁迫信号中受益。激素在植物适应不利环境条件的过程中起着至关重要的作用,如生长素、ABA、CK、BR、ET、GA、JA、水杨酸(SA)和独角内酯[42,43].其中,ABA、ET、JA和SA已被证实在调节植物对非生物胁迫的反应中发挥主要作用[42,44].在渗透条件下,已知ABA可以刺激气孔关闭,通过调节应激反应基因来维持水分平衡[45].因此,由于本研究中高度富集的DEGs, ABA途径可以被认为是普通野豌豆抗旱性最重要的途径。
先前的研究表明PYR/PYL/RCAR具有类似于ABA负调控因子抑制A组蛋白磷酸酶2C (Group APP2Cs)以依赖于aba的方式。例如,A族pp2c蛋白HAB1作为ABA信号的负调控因子拟南芥[46,47].的ABA-receptorPYL5通过抑制A族激活ABA信号PP2CS和提高抗旱性拟南芥[48].此前的一项研究评估了14种转基因作物的抗旱性拟南芥-overexpressing所有供试和显示,PYL9可通过抑制磷酸酶活性提高抗旱性[49].一个PYL4 A194T突变体揭示了一个重要的作用PYL4/PP2C的相互作用在ABA信号,显示气孔导度下降和改善水分利用拟南芥[50].枝A的研究PP2CS在苔藓里Physcomitrella金属盘发现A组PP2C对陆生植物ABA响应和抗旱性的调控具有保守效应,说明aPP2C对促进陆生植物的进化起关键作用[51,52].此外,A组PP2C基因识别拟南芥水稻、玉米、番茄、紫花苜蓿和黄瓜对ABA信号和非生物胁迫的响应是高度诱导的,表明A组PP2C在陆生植物中高度保守[53].在我们的研究中,17例(16例上调,1例下调)和11例(全部上调)A组PP2C分别在叶和根中检测到DEGs。其中PP2C (ABI,在叶和根中发现的不敏感基因全部上调。值得注意的是,11PP2C根中检出的deg为also且在两种组织中均上调表达,表明ABA信号传递过程高度协调,优化了全株对干旱胁迫的适应。相比之下,是四和五所有供试在叶和根中发现的PYRABACTIN抗性基因(注释为PYR1-LIKE)均被下调,其中两个基因在两个组织中共同诱导。蔗糖非发酵1相关蛋白激酶(SnRKs)基因家族在植物逆境胁迫反应和代谢反应的联系中起着至关重要的作用;其中,SnRK2家族是渗透应激激活蛋白激酶[3.].十个九拟南芥snrk2可通过渗透胁迫激活;其中,SnRK2.7和SnRK2.8在干旱响应基因调控中发挥重要作用[54,55].AREB/ABF-SnRK2通路通过abre介导的转录在ABA/胁迫信号中发挥作用,协同调节与植物脱水胁迫反应相关的靶基因[56].在本研究中,在叶和根中分别鉴定出6个和3个常见的野豌豆SnRK DEGs,其中2个在两种组织中都被下调。一种常见的野豌豆SnRK2 DEG在两种组织中都被下调,而两种SnRK2 DEG在叶和根中被特异性上调。这些SnRKs可能是一种信号转导因子,并在干旱胁迫下磷酸化整个普通野豆科植物的胁迫响应基因。以上结果表明,在干旱胁迫下,豇豆snrk2在ABA- pyl释放相关的ABA信号转导通路中发挥重要作用,并显著诱导pp2c结合和抑制调控下游因子。这种复杂的依赖于aba的反应和这些基因对干旱胁迫的反应能力使它们成为普通野豌豆进一步功能分析的理想对象。
淀粉和蔗糖代谢可以维持膨压和叶片含水量,这取决于编码淀粉降解酶的基因,然后在干旱胁迫下改变蔗糖和氨基酸含量[35,57,58].已知α/β-淀粉酶和蔗糖合酶活性与干旱条件下植物碳代谢的改变有关[59].在我们的研究中,9个叶片特异性转录本被注释为“蔗糖合成酶”,其中8个被上调。α-淀粉酶在叶片中有3个转录本上调,1个转录本下调,5个转录本上调α-淀粉酶在根中鉴定。其中,三种共诱导转录本在两种组织中均上调。三种和两种常见的野豌豆转录本被鉴定为β-淀粉酶分别存在于叶和根中,属于糖基水解酶家族14。在叶片中发现的转录本上调率高于根。结果表明,野豆科植物的抗旱性与碳代谢有关;植物通过稳定淀粉和葡萄糖储存的能量来缓解干旱胁迫。
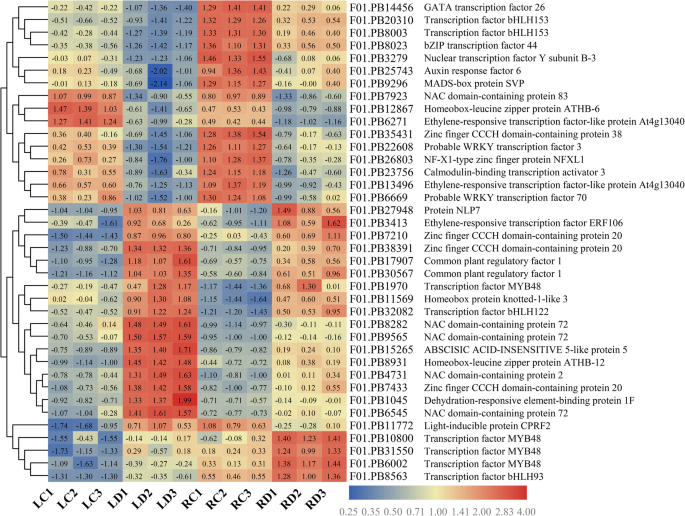
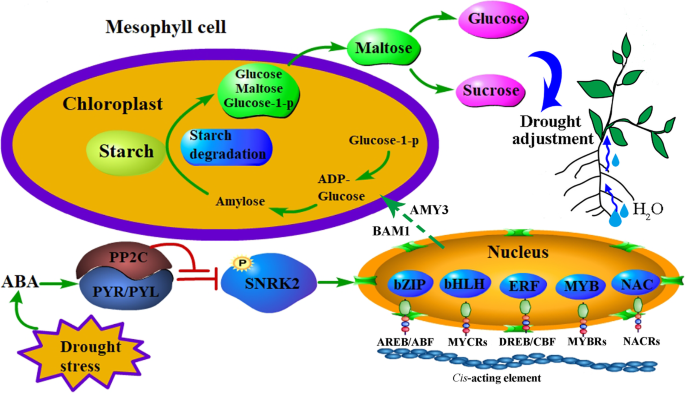
在拟南芥,的glucuronokinaseatglcak突变体表现出对ABA过敏,水分流失增加,根系发育减少,耐旱性降低[60].此前的一项研究表明,糖的积累主要是由于己糖含量的增加,通过降低己糖激酶基因的表达,从而提高蔗糖水平,在aba依赖的AREB/ABF-SnRK2信号通路的最高表达[61].近年来的研究表明,叶片中淀粉的调控由β-AMYLASE1 (BAM1)和α-AMYLASE3 (AMY3)通过AREB/ABF-SnRK2激酶信号通路对渗透胁迫耐受性很重要,并表明该机制很可能在不同的植物物种中保守[58,62].在这里,我们确定了一种常见的野豌豆AMY3在两种组织和两种常见的野豆科植物中都表达上调的基因BAM1叶片基因上调。我们推测,ABA (AREB/ABF-SnRK2通路)通过调节AMY3和BAM1的活性,诱导叶片淀粉降解,增加向根系的碳输出,从而在干旱胁迫响应中促进渗透液积累和根系生长,以获取水分和养分(图1)。12).
与“植物激素信号转导”和“淀粉和蔗糖代谢”途径相比,“精氨酸和脯氨酸代谢”是普通紫薇叶和根中富集的第三重要途径。最近的一些研究也表明,精氨酸、脯氨酸和胺可以调节细胞渗透调节,稳定蛋白质和酶,防止缺水条件下的细胞膜损伤,表明在植物的耐旱性中氨基酸的代谢、积累和周转呈正相关[18,63,64,65].在烟草中,表达三种PDH从弱脱水(1天)到强脱水(6天),叶片和根系中脯氨酸降解的关键酶基因持续受到抑制,导致脱水条件下植物的脯氨酸浓度比对照条件高5-10倍[66].在这项研究中,PDH-注释基因在叶片中特异性表达,且均表达下调,表明在叶片中起显著作用PDH野豌豆游离脯氨酸含量调控基因的研究。在植物中,许多ALDH家庭成员对许多非生物的压力有反应,例如小麦traeALDH7B1-5A转基因基因增强了抗旱性拟南芥、玉米ALDH22A1不同的非生物胁迫和转基因植物过表达诱导了基因的表达ALDH22A1提高烟草对各种非生物胁迫的耐受力[67,68].在常见的野豌豆中,氨基酸激酶家族和ALDH家族基因在两种组织和所有组织中显著富集aldh在叶片中被上调。蛋白质发明后,精氨酸和脯氨酸代谢途径加强和/或改善胁迫诱导的蛋白质崩溃,在干旱条件下,普通野豌豆特定氨基酸的含量显著增加。
转录因子在干旱胁迫下的作用
转录因子作为许多胁迫响应基因的主要调控因子,是增强对干旱等非生物胁迫耐受性的潜在基因组候选者,因为它们在使植物抵御不利环境中的作用[12,69].现在已经确定的是,包括bZIP(主要是AREB/ABF)、AP2/ERF、NAC、bHLH、WRKY和MYB在内的几个TF家族是参与各种非生物胁迫的关键调节因子[5,70,71,72].在AREB/ABF亚家族基因中拟南芥在非生物胁迫诱导下,4个AREB/ABF转录因子(ABF1、ABF3、AREB1/ABF2和AREB2/ABF4)在营养组织中表达;除ABF1外,其余的tf均受到渗透和ABA胁迫(如脱水)的显著诱导,ABF2也可能参与葡萄糖信号传递[56,73,74].这些转录因子的过表达表明,在干旱胁迫下,3个AREB/ABFs作为ABA信号的主转录因子拟南芥植物(74,75].在这项研究中,两种常见的野豌豆转录本被注释为“—ABF2基因对干旱胁迫的响应,其中一个基因在两种组织中均表达上调,而另一个基因仅在叶片中显著上调,从而证实了它们与干旱胁迫的相关性。bHLH122在抗渗透胁迫中起正向调节作用拟南芥并通过抑制CYP707A3转录本增加细胞ABA水平[76].三种常见的vetch转录本注释为“bHLH122”,其中“F01”。PB32082在两种组织中均表达上调,而F01。PB9425”和“F01。PB13415 "在叶片中分别表达上调和下调。F01成绩单”。PB6002”,注释为“MYB48,在两种组织中均表达上调。此前,玉米的过表达ZmMYB48转基因基因显著提高抗旱性拟南芥植物;干旱胁迫下,胁迫/ABA响应基因表达量和ABA含量均增加[77].在本研究中,在根和叶中分别检测到18和5个WRKY转录本,并且在根中检测到的转录本均被抑制。先前的一项研究表明,温和的渗透条件会迅速阻止地上的嫩枝生长,而根系则会继续伸长。78].另外,当表达的时候WRKY75基因被抑制,侧根和根毛显著增加,负调控根的生长[79].根系中WRKY转录物的下调可能会影响侧根和根毛的形成,增加根的总表面积,这些变化可以提高普通野豌豆在缺水土壤中的生长能力。然而,常见的ERF转录本在叶中表达多于在根中表达;其中4个在两种组织中均显著表达,9个和3个分别在叶和根中特异性表达。近年来的研究表明,ERF蛋白家族可以提高多种植物的耐旱性。OsERF48作为积极的调节因子,有助于水稻的根系生长和抗旱性[80].DREB1/ cbf型蛋白属于(AP2/ERF)型转运因子家族,参与调控大豆和大豆中干旱、热、冷胁迫响应基因的表达拟南芥[81].DREB1A可通过调节大豆的气体交换和生产性状来提高大豆的抗旱性[82].四种共反应基因中上调和下调基因的数量小块土地其中1个转录本注释为DREB1F (F01。PB1045)在两种组织中均上调。值得注意的是,将近70%小块土地家族成员在叶子中表达上调,这表明小块土地在普通的野豌豆叶子中,基因可能对干旱更加敏感。此外,锌指转录因子家族是另一个重要的TF,在植物对干旱胁迫的响应中发挥重要作用[83,84,85].过度的OsC3H47增强水稻的耐旱性,降低水稻对ABA的敏感性[85].烟草植物overexpressingl TaNF-YB3;通过调节aba相关信号通路,表现出更好的耐旱性[86].这些TF家族成员在干旱胁迫后在普通的野豌豆叶片和根系中表现出诱导表达谱。综上所述,特异性或共同响应性TF的不同表达模式表明,它们在两种常见的野豆科植物组织中以aba依赖的方式参与干旱响应,表明TF家族成员在调节叶片和根系信号转导中发挥着重要作用,并可能在多个步骤参与相声。
结论
本研究首次对干旱胁迫下普通紫薇科植物叶片和根系的整体转录调控进行了综合研究和比较分析。这些序列被组装成30427个全长转录本,平均长度为2278.89 bp。在叶和根中分别鉴定出3464和3062个DEGs。在干旱胁迫下,叶片和根系组织间分子网络的级联中发现了DEGs之间的串扰和发散。激素信号转导、淀粉和蔗糖代谢、精氨酸和脯氨酸代谢是广泛富集的途径。AREB/ABF-SnRK2通路相关基因可能通过调控AMY3和BAM1活性,诱导叶片淀粉降解,增加根系碳输出,增强抗旱性。此外,在酵母中进行的外源表达实验表明,4个转录因子可作为提高渗透胁迫耐受性的候选基因。总的来说,叶片和根系中干旱响应转录本的存量增加了我们对普通野豌豆在缺水条件下的地上和地下生物学特性的了解。
方法
应力处理和样品采集
普通野豌豆品种“兰健1号”的健康种子由兰州大学(甘肃兰州)提供。首先用1.0% (v/v)次氯酸钠表面杀菌5分钟,用蒸馏水洗涤6次,然后在20°C下发芽4天。然后将20颗均匀发芽的种子分别播种于60孔板中,用1/2 MS(半强度Murashige and Skoog)溶液(pH = 5.8)水培培养。随后将幼苗移栽到20℃、16 h/8 h(明暗)、180 μmol m的温室中−2年代−1光合活性辐射和80%的湿度,1/2 MS溶液每2天更换一次。为优化PEG浓度,将4日龄幼苗移栽到含有不同浓度PEG(0、10、15、20、25、30和35%)的1/2 MS溶液中7 d。测定了幼苗的地上长、地下长和鲜重。进行了5次生物重复。
播种后在1/2 MS溶液中生长7 d,选取生长均匀、生长强劲的四叶期健康秧苗10株,平均分为两组:一组转入对照花盆,另一组转入含等量PEG (20% (m/V), pH = 5.8)溶液和半强度培养基溶液的花盆进行抗旱处理。为了减少昼夜节律的影响,对照和干旱处理的每个样品的叶和根平行生长,24 h后收获,立即在液氮中冷冻,并在−80°C保存。每个样本来自4个不同的幼苗,每个时间点收集3个生物重复。
RNA的分离与评估
共使用12个样本[2个组织(叶和根)× 2个处理(对照和20% PEG/24 h) × 3个生物复制]进行转录组分析。使用RNeasy Plus Mini Kit (Agilent Technologies, CA, USA)提取总RNA。随后,在1%琼脂糖凝胶上评估RNA污染和降解情况。RNA完整性使用RNA Nano 6000检测试剂盒和安捷伦2100生物分析仪进行评估。对于PacBio亚型测序(Iso-Seq) (Pacific Bioscience, Menlo Park, USA),从每个样本池中提取等量RNA完整性数≥7.0和28S/18S比值≥1.0的总RNA。对于Illumina测序(Illumina, San Diego, USA),我们准备了一个包含12个节间RNA样本的索引文库,并使用Illumina HiSeq X Ten平台进行测序。
PacBio Iso-Seq文库构建、测序和数据分析
测序库按照官方协议进行了如下修改。使用SMARTer™PCR cDNA合成试剂盒(Clontech, CA, USA)从4 μg混合总RNA中合成全长cDNA。PCR扩增后,使用BluePippin Size Selection System (Sage Science, Beverly, MA, USA)选择产品尺寸,生成3个文库,每个样本长度分别对应1-2、2-3和3-6 kb的片段。将扩增的cDNA产物按照Iso-Seq协议构建SMRTbell模板文库[87,88].使用Qubit2.0和Agilent 2100分别确定定量准确性和文库大小;只有当文库大小满足预期标准时才进行测序。最后,共7个SMRT细胞在PacBio RSII平台上进行测序。
使用带有默认参数的ToFu管道,将原始数据处理为错误校正的insert (roi)读取。接下来,通过在roi中搜索polyA尾信号和5 '和3 ' cDNA引物,确定非全长(nFL)和全长非嵌合(FL)转录本。采用迭代聚类误差校正(ICE)方法获得一致性异构体,并利用Quiver对来自ICE的FL一致性序列进行抛光。此外,我们从用nFL修正的原始共识解读中获得精练的共识解读,并生成校正后准确率超过99%的FL转录本,以供进一步研究。使用高质量的Iso-Seq FL转录本,使用CH-HIT(标识为> 0.99)去除冗余以获得转录本。
Illumina转录组文库的制备、测序和数据分析
用DNase I (TaKaRa, Dalian, China)处理后,用磁性寡聚珠从总RNA中纯化出mRNA。根据制造商的协议,使用Illumina公司(NEB, USA)的NEBNext UltraTM RNA文库准备试剂盒生成测序文库。利用Illumina HiSeq X Ten对cDNA文库进行了100 bp的对端测序,每个样本获得了超过6gb的干净数据。
fastq格式的原始数据首先使用内部Perl脚本进行处理。在这一步中,通过去除三种读,即包含适配器的读、低质量的读和未知碱基大于10%的读,得到干净的数据。同时,利用Q30参数和GC含量来评价这些清洁数据的质量。
与全长转录本的比较和基因表达水平的量化
用Long-Read de Bruijn图误差校正(LoRDEC)工具(−t 5 -b 200 -e 0.4 -s 3 k-mers 21和25)与NGS数据进行了同源序列校正。然后,使用Bowtie2将干净的数据映射回组装好的转录组数据库,根据映射结果获取每个转录本的阅读计数。转录本表达水平通过RSEM软件包进行鉴定,并通过每个样本的千碱基片段/转录本/百万映射转录本(FPKM)方法计算[89].通过设置错误发现率阈值(FDR) < 0.01和日志值来确定差异表达基因(DEGs)2(Group1/Group2)≥1,对处理样品和对照样品进行两两比较。
转录本的功能注释和DEG分析
转录本通过BLASTX搜索公共数据库进行注释,包括国家生物技术信息中心(NCBI)的非冗余蛋白质数据库(Nr),蛋白质家族(Pfam),蛋白质的正交基团簇(KOG/COG/eggNOG), Swiss-Prot, GO和KEGG。利用GOseq R包和KOBAS (P-value< 0.05),分别为[90,91].利用deg从PlantTFDB数据库(http://planttfdb.cbi.pku.edu.cn/).
存在分析
qRT-PCR使用CFX96 Touch™实时PCR检测系统(Bio-Rad, USA)和SYBR®Green进行,并使用CFX Manager软件(Bio-Rad)进行分析。PCR程序如下:95°C 3 min, 95°C 10 s, 55°C 30 s, 39个循环。具体引物使用Primer3设计,如附加文件所示6:表S6,其特异性通过对常见的野豆科植物转录本的BLAST检索得到确认。作为一个内部标准,常见的野豌豆肌动蛋白基因(Unigene 68614)计算相对折叠表达量Ct方法。
转基因酵母表达载体的构建及耐胁迫试验
用PCR引物对从常见的野豌豆叶和根中分离出4个转录因子的完整编码序列,见附加文件7: S7表。然后,将这些tf的PCR产物插入酵母表达pYES2载体(Invitrogen, Carlsbad, USA)。随后,通过醋酸锂法将表达载体和空pYES2对照质粒导入INVSc1酵母菌株(Invitrogen, USA) [92].然后将转化菌选择在无尿嘧啶的SC培养基上,添加2% (w/v)葡萄糖,30°C培养36 h。渗透耐受性评价按照前面描述的方法进行[93,94].
数据和材料的可用性
Illumina HiSeq X Ten生产的12个样品的测序原始数据可以通过链接访问NCBI序列阅读档案(SRA)数据库https://www.ncbi.nlm.nih.gov/Traces/study/?acc=PRJNA554306,登录号为SRR9674916-SRR9674930,生物项目登录号为PRJNA554306。
缩写
- 度:
-
差异表达基因
- TFs:
-
转录因子
- 阿坝:
-
脱落酸
- 门店:
-
下一代RNA序列
- PacBio:
-
太平洋生物科学
- Nfl:
-
Non-full-length
- FL:
-
全身non-chimeric
- 冰:
-
误差校正的迭代聚类
- LoRDEC:
-
Long-Read de Bruijn图错误校正
- FPKM:
-
每千碱基的片段每百万映射的转录本
- 罗斯福:
-
错误发现率
- 英国石油公司:
-
生物过程
- 答:
-
细胞组件
- MF:
-
分子功能
- KEGG:
-
京都基因和基因组百科全书
- 走:
-
基因本体论
- CK:
-
细胞分裂素
- BR:
-
Brassinosteroid
- 等:
-
乙烯
- 遗传算法:
-
赤霉素
- 是:
-
茉莉酸
- ALDH:
-
醛脱氢酶
- PDH:
-
脯氨酸脱氢酶
- ROS:
-
活性氧
- A组PP2C史:
-
A组蛋白磷酸酶2C型
- SnRKs:
-
蔗糖非发酵相关蛋白激酶
参考文献
- 1.
杨建平,张建平。干旱、盐和温度胁迫诱导的代谢重排和调节网络。中国科学(d辑:自然科学版)2012;
- 2.
王晓燕,王晓燕,王晓燕,等。作物耐非生物胁迫与产量稳定性的遗传机制。Nat Rev Genet 2015;16:237。
- 3.
朱镕基j - k。植物的非生物胁迫信号与响应。细胞。2016;167(2):313 - 24。
- 4.
膜转运蛋白与抗旱性——一个复杂的问题。植物科学通报,2014;5:687。
- 5.
Joshi R, Wani SH, Singh B, Bohra A, Dar ZA, Lone AA, Pareek A, Singla-Pareek SL.干旱胁迫下转录因子与植物响应的研究进展。植物科学进展2016;7:1029。
- 6.
Sourour A, Afef O, Mounir R, Mongi BY。植物对水分亏缺胁迫的形态、生理、生化和分子响应研究进展。国际工程科学2017;6:1-4。
- 7.
Kooyers新泽西。自然草本植物种群抗旱和抗旱能力的演化。植物科学。2015;234:155 - 62。
- 8.
植物非生物胁迫耐受性的解剖与建模。植物学报,2010;13(2):206-12。
- 9.
方勇,熊林。干旱反应的一般机理及其在植物抗旱性改良中的应用。细胞分子生命科学,2015;72(4):673-89。
- 10.
王晓东,王晓东。了解植物抗旱性增强的调控网络和工程。植物生物学杂志,2006;9(2):189-95。
- 11.
李松,向勇,程铮,余旭,阮明,李伟,明鹏。木薯幼苗对干旱和寒冷胁迫响应机制的全局基因表达分析。植物科学进展2017;8:1259。
- 12.
王红,王红,邵红,唐旭。转基因技术利用转录因子提高植物非生物胁迫耐受性的研究进展。植物学报(自然科学版)2016;7(248):67。
- 13.
Iuchi S, Kobayashi M, Taji T, Naramoto M, Seki M, Kato T, Tabata S, Kakubari Y, Yamaguchi-Shinozaki K, Shinozaki K. 9-基因调控抗旱性的研究独联体-环氧类胡萝卜素双加氧酶是植物脱落酸生物合成的关键酶基于“增大化现实”技术abidopsis。植物j . 2010; 27:325-33。
- 14.
Khan N, Nazar R, Iqbal N, Anjum N.植物激素与植物抗非生物胁迫能力。德国海德堡:施普林格;2012.
- 15.
周静,周静,周静,周静。干旱胁迫下青海松(Pinus halepensis)转录组分析。38树杂志。2017;(3):423 - 41。
- 16.
莫拉莱斯A, Zurita-Silva A, Maldonado J, Silva H.智利藜麦的转录应答(藜藜麦在缺水条件下,揭示了aba独立的表达模式。前面。植物科学。2017;8:216。
- 17.
高峰,王娟,魏松,李铮,王楠,李红,冯军,李红,周勇,张峰Ammopiptanthus mongolicus用RNA-Seq技术检测叶子。《公共科学图书馆•综合》。2015;10 (4):e0124382。
- 18.
冯燕,梁超,李斌,万婷,刘涛,蔡勇。抗旱性树种基因的差异表达谱及表达途径李属mahaleb根和叶对干旱胁迫的反应。Sci Hortic。2017;226:75 - 84。
- 19.
Fu Y, Poli M, Sablok G, Wang B, Liang Y, La Porta N, Velikova V, Loreto F, Li M, Varotto cArundo donaxL. ungene -based RNA-seq。Biotechnol生物燃料。2016;9(1):54。
- 20.
Ksouri N, Jiménez S, Wells CE, Contreras-Moreira B, Gogorcena Y.根和叶的转录应答碧桃进行RNA测序。植物学报2016;7:1715。
- 21.
梁超,王伟,王杰,马杰,李超,周芳,张松,余宇,张磊,李伟,等。向日葵差异表达基因的鉴定(向日葵)叶片和根系在干旱胁迫下的RNA测序。机器人钉。2017;58(1):42。
- 22.
Morgil H, Tardu M, Cevahir G, Kavakli İH。干旱敏感扁豆(镜头culinaris)根和叶处于短期和长期水分亏缺状态。功能整合基因组。2019;19:715。
- 23.
Chien JT, Pakala SB, Geraldo JA, Lapp SA, Humphrey JC, Barnwell JW, Kissinger JC, Galinski MR.利用单分子实时PacBio技术生成高质量的疟原虫涂层基因组组装和注释。基因组Announc。2016;4:e00883-16。
- 24.
PacBio测序及其应用。中国生物工程学报,2015;13(5):278-89。
- 25.
董瑞,董东,罗东,周强,柴晓,张俊,谢伟,刘伟,董艳,王艳。转录组分析发现野豌豆荚果腹缝中存在荚果破碎相关基因(野豌豆属漂白亚麻纤维卷l .)。植物科学进展2017;8:649。
- 26.
黄勇,高旭,南智,张铮。野豆科植物的潜在价值(野豌豆属漂白亚麻纤维卷L.)作为动物饲料:综述。中国生物医学工程学报,2017;29(5):369 - 369。
- 27.
下注CD. Do Prado Cordoba L, Ribeiro LS, Schnitzler E. common vetch (野豌豆属漂白亚麻纤维卷)作为一种新的淀粉源:酸水解后的热、流变和结构性能。食品生物物理学。2016;11(3):275 - 82。
- 28.
董锐,贾胡夫明,董德东,王yr,刘忠平。537份普通野豌豆种质资源种子性状的形态变异特征(野豌豆属漂白亚麻纤维卷L.)使用数字图像分析。《新热情农业学报》2016;59(4):422-35。
- 29.
Haffani S, Mezni M, Slama I, Ksontini M, Chaïbi w三种紫薇科植物在缺水条件下的生长、水分关系和脯氨酸含量。牧草学报,2014;69(2):323-33。
- 30.
朱颖,刘强,徐伟,张军,王旭,聂刚,姚亮,王红,林晨。普通紫薇植物抗旱性相关基因的重新组装与发现。国际分子科学杂志2019;20(2):328。
- 31.
丁勇,刘宁,Virlouvet L, Riethoven J-J, Fromm M, Avramova Z.拟南芥脱水胁迫记忆基因的四种不同类型。植物生物学杂志,2013;13(1):229。
- 32.
法萨尼E, DalCorso G, Costa A, Zenoni S, Furini A拟南芥转录因子MYB59调节植物生长和胁迫反应中的钙信号。植物分子生物学杂志2019;99(6):517-34。
- 33.
Sukiran NL, Ma JC, Ma H, Su z。ANAC019在干旱胁迫下恢复生殖发育是必需的拟南芥.植物分子生物学杂志2019;99(1):161-74。
- 34.
瑞辉,张旭,辛华丽,郑丽,沈卓野豌豆属漂白亚麻纤维卷L.品种对镉胁迫的不同响应揭示了金属转运蛋白在镉耐受性中的重要作用。土壤植物。2018;423(1):241 - 55。
- 35.
潘亮,张旭,王杰,马旭,周明,黄亮,聂刚,王平,杨铮,李娟。干旱相关基因在调控水稻代谢过程和抗氧化防御中的转录谱分析多花黑麦草.植物科学进展2016;7:519。
- 36.
刘宏,于超,李宏,欧阳斌,王涛,张杰,王旭,叶铮ShDHN一种脱氢酶基因可以增强番茄对多种非生物胁迫的耐受性。植物科学。2015;231:198 - 211。
- 37.
包峰,杜丹,安岩,杨伟,王杰,程涛,张强李属却已烟草中的脱氢酶基因增强了对寒冷和干旱的耐受性。植物科学,2017;8:151。
- 38.
Halder T, Agarwal T, Ray S.小说的分离、克隆和刻画高粱dehydrin(SbDhn2)的蛋白质。原生质。2016;253(6):1475 - 88。
- 39.
Halder T, Upadhyaya G, Basak C, Das A, Chakraborty C, Ray S.在转基因烟草植株中,脱氢酶对氧化胁迫具有保护作用。植物科学,2018;9:136。
- 40.
徐海霞,李晓燕,徐cj,陈建伟。枇杷脱氢酶基因的过表达EjDHN1促进转基因烟草的耐寒性。植物生理学报,2018;65(1):69-77。
- 41.
夏勇,李锐,白刚,Siddique KHM, Varshney RK, Baum M,闫刚,郭鹏HvP5CS1它们与大麦耐旱性相关性状的关系(大麦芽l .)。Sci Rep-UK。2017; 7(1): 7870。
- 42.
王晓燕,王晓燕,王晓燕,等。植物激素对胁迫反应的调节作用。植物生物学杂志,2016;16(1):86。
- 43.
王晓燕,王晓燕,王晓燕。植物激素在植物抗非生物胁迫中的作用。作物j . 2016; 4(3): 162 - 76。
- 44.
巴里R,琼斯JDG。植物激素在植物防御反应中的作用。植物分子生物学,2009;69(4):473-88。
- 45.
Vishwakarma K, Upadhyay N, Kumar N, Yadav G, Singh J, Mishra RK, Kumar V, Verma R, Upadhyay RG, Pandey M,等。脱落酸信号与植物抗非生物胁迫的研究进展与展望。植物科学,2017;8:161。
- 46.
Nishimura N, Sarkeshik A, Nito K, Park S- y, Wang A, Carvalho PC, Lee S, cadell DF, Cutler SR, Chory J,等。PYR/PYL/RCAR家族成员是体内主要的ABI1蛋白磷酸酶2c相互作用蛋白拟南芥.植物j . 2010; 61(2): 290 - 9。
- 47.
Okamoto M, Peterson FC, Defries A, Park S-Y, Endo A, Nambara E, Volkman BF, Cutler SR.激活ABA二聚体受体可诱导保护细胞关闭,ABA调节基因表达和抗旱性。美国国家科学院。2013; 110(29): 12132。
- 48.
Santiago J, Rodrigues A, Saez A, Rubio S, Antoni R, Dupeux F, Park S- y, Márquez JA, Cutler SR, Rodriguez PL.脱落酸受体PYL5通过抑制枝A pp2c对抗旱性的调控。植物j . 2009; 60(4): 575 - 88。
- 49.
ABA受体PYL9促进抗旱性和叶片衰老。美国国家科学院。2016年,113(7):1949。
- 50.
Pizzio GA, Rodriguez L, Antoni R, Gonzalez-Guzman M, Yunta C, Merilo E, Kollist H, Albert A, Rodriguez PLPYL4 A194T该突变揭示了PYR1-LIKE4/蛋白磷酸酶2CA相互作用在脱落酸信号通路和植物抗旱性中的关键作用。植物杂志。2013;163(1):441。
- 51.
Komatsu K, Nishikawa Y, Ohtsuka T, Taji T, Quatrano RS, Tanaka S, Sakata Y. abi1相关蛋白磷酸酶2C的功能分析揭示了脱落酸信号的进化保守调控拟南芥和苔藓Physcomitrella金属盘.植物分子生物学,2009;70(3):327-40。
- 52.
小松K,铃木N,久村M,西川Y,中谷M,大田禾H,竹泽D,关木M,田中M,田次T,等。a族pp2c在陆生植物中进化为内在耐干性的关键调控因子。Nat Commun。2013;4:2219。
- 53.
辛格A,潘迪A,斯里瓦斯塔瓦AK, Tran L-SP,潘迪GK。植物蛋白磷酸酶2C:从基因组多样性到功能多样性及其在胁迫管理中的重要性。生物技术。2016;36(6):1023-35。
- 54.
布德索克M, Barbier-Brygoo H. Laurière CJJoBC。9种蔗糖非发酵相关蛋白激酶2在高渗透和盐胁迫下的鉴定拟南芥.中国生物化学杂志2004;279(40):41758-66。
- 55.
Mizoguchi M, Umezawa T, Nakashima K, Kidokoro S, Takasaki H, Fujita Y, Yamaguchi-Shinozaki K, Shinozaki K两个密切相关的II亚类SnRK2蛋白激酶协同调控干旱诱导基因的表达。植物细胞学报2010;51(5):842-7。
- 56.
藤田杨,田吉田,山口- shinozaki。植物渗透胁迫下AREB/ABF-SnRK2通路在abre介导转录中的关键作用。杂志。2013;147(1):15 -。
- 57.
Adams HD, Germino MJ, Breshears DD, baron - gafford GA,瓜迪奥拉-克拉蒙特M,邹CB, Huxman TE。非结构叶片碳水化合物动态松果体鸡蛋果在干旱导致的树木死亡过程中,揭示了碳代谢在死亡机制中的作用。新植醇。2013;197(4):1142 - 51。
- 58.
Thalmann M, Pazmino D, Seung D, Horrer D, Nigro A, Meier T, Kölling K, Pfeifhofer HW, Zeeman SC, Santelia D.脱落酸对叶片淀粉降解的调控对植物的渗透胁迫耐受性很重要。植物细胞。2016;28(8):1860。
- 59.
淀粉作为非生物胁迫下植物适应性的决定因素。新植醇。2017;214(3):943 - 51。
- 60.
葡萄糖醛酸激酶基因拟南芥,AtGlcAK,通过调节糖代谢参与耐旱性。植物分子生物学杂志,2017;35(2):298-311。
- 61.
La VH, Lee B-R, Islam MT, Park S-H, Lee H, Bae D-W, Kim T-H。从脱落酸到水杨酸介导的蔗糖积累的拮抗转移有助于小麦的耐旱性芸苔属植物显著.environment Exp Bot. 2019; 162:38-47。
- 62.
解析短暂淀粉储存在植物发育和渗透胁迫反应中的作用。迪斯:阿尔玛;2016.
- 63.
Ashraf MA, Iqbal M, Rasheed R, Hussain I, Perveen S, Mahmood S.第16章:脯氨酸动态代谢:在缺水环境中的重要性和调节。在:植物代谢产物及其在环境胁迫下的调节。剑桥:学术出版社;2018.323 - 36页。
- 64.
Pál M, Tajti J, Szalai G, Peeva V, Végh B, Janda T.渗透胁迫下小麦叶片中多胺、脱落酸和脯氨酸的相互作用。Sci Rep-UK。2018; 8(1): 12839。
- 65.
辛格M,库马尔J,辛格S,辛格副总裁,普拉萨德SM。渗透保护剂在提高植物耐盐性和耐旱性中的作用环境科学与技术,2015;14(3):407-26。
- 66.
Dobrá J, Vanková R, Havlová M, Burman AJ, Libus J, Štorchová h烟草叶片和根系在干旱胁迫和随后恢复过程中脯氨酸代谢相关基因的表达存在差异。植物生理学报,2011;32(4):369 - 369。
- 67.
陈J,李魏B, G,风扇R,钟Y,王X,张X。TraeALDH7B1-5A该基因编码小麦中的醛脱氢酶7,提高了小麦的耐旱性拟南芥.足底.2015, 242(1): 137 - 51。
- 68.
黄伟,马鑫,王强,高原,薛赟,牛霞,于刚,刘赟。过表达胁迫响应基因对烟草植株抗逆性的显著改善醛脱氢酶玉米(Zea mays)的基因。植物分子生物学,2008;68(4):451。
- 69.
Franco-Zorrilla JM, López-Vidriero I, Carrasco JL, Godoy M, Vera P, Solano R.植物转录因子的dna结合特异性及其定义靶基因的潜力。美国国家科学院。2014, 111(6): 2367。
- 70.
Butt HI,杨铮,龚强,陈娥,王曦,赵刚,葛曦,张曦,李芳。GaMYB85,一个R2R3 MYB基因在转基因拟南芥在耐旱方面起着重要作用。植物生物学杂志,2017;17(1):142。
- 71.
Castilhos G, Lazzarotto F, Spagnolo-Fonini L, Bodanese-Zanettini MH, Margis-Pinheiro M.基本螺旋-环-螺旋转录因子在干旱适应中的可能作用。植物科学。2014;223:1-7。
- 72.
陈健,Nolan T,叶辉,张明,童辉,辛萍,褚娟,褚超,李铮,尹永军。WRKY46、WRKY54和WRKY70转录因子参与油菜素调控的植物生长和干旱响应。植物细胞。2017;29(6):1425。
- 73.
金晟,姜继义,赵德毅,朴智华,金淑珍。ABF2是abre结合bZIP因子,是葡萄糖信号的重要组成部分,其过表达影响多重应激的耐受性。植物j . 2004; 40(1): 75 - 87。
- 74.
杨文华,杨文华,杨文华,等。植物对渗透胁迫的aba依赖性和aba非依赖性信号转导。植物生物学杂志2014;21:133-9。
- 75.
Furihata T, Maruyama K, Fujita Y, Umezawa T, Yoshida R, Shinozaki K, Yamaguchi-Shinozaki K.脱落酸依赖的多位点磷酸化调节转录激活子AREB1的活性。美国国家科学院。2006, 103(6): 1988。
- 76.
刘伟,太宏,李硕,高伟,赵敏,谢超,李伟。bHLH122对抗旱和抗渗透胁迫有重要意义拟南芥和抑制ABA分解代谢。新植醇。2014;201(4):1192 - 204。
- 77.
王勇,王强,刘明,柏晨,王旭,马强,程斌,蔡锐。一株玉米的过表达MYB48转基因拟南芥植物的抗旱性基因。植物生物学杂志,2017;60(6):612-21。
- 78.
Payton P, Kottapalli KR, Kebede H, Mahan JR, Wright RJ, Allen RD.棉花叶片和根系组织干旱胁迫转录组的研究。Biotechnol。2011;33(4):821 - 8。
- 79.
Devaiah BN, Karthikeyan AS, Raghothama KG。WRKY75转录因子是一种磷酸盐获取和根发育的调节因子拟南芥.植物杂志。2007;143(4):1789。
- 80.
郑浩,郑普杰,朴世华,Redillas MCFR, Kim YS, Suh J-W, Kim J-K。过度的OsERF48导致的监管OsCML16这是一种钙调素类蛋白基因,可以增强根系生长和耐旱性。植物学报,2017;15(10):1295-308。
- 81.
Kidokoro S, Watanabe K, Ohori T, Moriwaki T,丸山K, Mizoi J, Myint Phyu Sin Htwe N,藤田Y, Sekita S, Shinozaki K,等。大豆DREB1/ cbf型转录因子在热、干旱和冷胁迫响应基因表达中起作用。植物j . 2015; 81(3): 505 - 18。
- 82.
Rakocevic M, Müller M, Matsunaga FT, Neumaier N, Farias JRB, Nepomuceno AL, fug反- pagliarini R.温室干旱胁迫下DREB1A大豆植株的日向日运动有助于气体交换和生产响应。植物j . 2018; 96(4): 801 - 14所示。
- 83.
马杰,李明艳,王芳,唐杰,熊爱生。大白菜Dof家族转录因子及其对非生物胁迫响应的全基因组分析。BMC基因组学。2015;16(1):33。
- 84.
王凯,丁勇,蔡春,陈铮,朱晨。C2H2锌指蛋白在植物非生物胁迫应答中的作用。杂志。2019;(4)165:690 - 700。
- 85.
王伟,刘斌,徐敏,Jamil M,王刚。ABA诱导CCCH串联锌指蛋白OsC3H47降低ABA敏感性,提高抗旱性栽培稻.Biochem Bioph Res Co. 2015;464(1): 33-7。
- 86.
杨M,赵Y,年代,Du X,顾J,肖k .小麦核转录因子基因Y (NF-Y) B亚TaNF-YB3; l带来至关重要的抗旱ABA-associated调制的信号通路。植物组织与器官学报,2017;28(1):1 - 5。
- 87.
罗东,周强,吴勇,柴晓,刘伟,王勇,杨强,王铮,刘卓。渗透和离子胁迫组分对栽培紫花苜蓿根系耐盐性的全转录本测序和转录组比较分析(紫花苜蓿l .)。植物生物学杂志2019;19(1):32。
- 88.
晁强,高志峰,张东,赵秉国,董凤青,付春霞,刘丽娟,王秉春。的发展动态杨树阻止转录组。植物学报,2019;17(1):206-19。
- 89.
杜威CN。RSEM:从有或没有参考基因组的RNA-Seq数据中精确的转录物定量。BMC生物信息学。2011;12:323。
- 90.
谢超,毛旭,黄娟,丁勇,吴娟,董升,孔亮,高刚,李春燕,魏磊。富集途径与疾病注释与识别的web服务器KOBAS 2.0。核酸学报,2011;39(suppl_2): W316-22。
- 91.
Young MD, Wakefield MJ, Smyth GK, Oshlack A. RNA-seq的基因本体论分析:考虑选择偏差。基因组医学杂志。2010;11 (2):R14。
- 92.
河井S,桥本W,村田k酿酒酵母和其他真菌。生物工程缺陷。2010;1(6):395 - 403。
- 93.
李曦,张东,李辉,王燕,张燕,木A。EsDREB2B在沙漠豆科植物Eremosparton songoricum中发现了一种新的dreb2型截断转录因子,增强了酵母和转基因烟草对多种非生物胁迫的耐受性。植物生物学杂志,2014;14(1):44。
- 94.
魏鑫,金鑫,Ndayambaza B,闵鑫,张铮,王赟,刘伟。干旱胁迫下普通野豌豆水通道蛋白基因家族的转录组全特征及功能鉴定。DNA细胞生物学2019;38(4):374-84。
确认
感谢聂斌提供常见品种“兰健1号”种子,感谢兰州大学罗东、周强、张政社对实验和稿件的宝贵帮助和建议。
资金
本研究得到国家基础研究计划(973)项目(No. 2014CB138704)、中央高校基本科研业务费专项资金(lzujbky-2020-18)、国家自然科学基金(31502000)和兰州大学大型仪器设备开放共享专项资金的支持。
作者信息
从属关系
贡献
W L, Y W, X M构思和设计了研究。X M, W L, X L进行实验,参与数据分析,撰写论文。X M、Y W、W L和B N对论文的修改提出了有价值的建议。所有作者阅读并批准了该手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1表S1。
小说转录本的表达谱。
附加文件2表S2。
氧化还原过程类表达谱丰富了Pfam、Swissprot和nr数据库中的转录本及其注释。
附加文件3表S3。
防御反应类表达谱丰富了Pfam、Swissprot和nr数据库中的转录本及其注释。
附加文件4表S4。
KEGG富集的结果是普通的野豌豆叶子。
附加文件5表S5。
在干旱胁迫下,DEGs参与“植物激素信号转导”、“淀粉和蔗糖代谢”和“精氨酸和脯氨酸代谢”通路(表S1a-c)。
附加文件6表S6。
本研究使用的qRT-PCR引物。
附加文件7表S7。
本研究中用于酵母分析的引物。
附加文件8图S1。
普通野豌豆幼苗抗聚乙二醇胁迫特性的研究。在不同PEG浓度(0、10、15、20、25、30和35%)条件下培养7 d,测定野豌豆地上长度(A)、地下长度(B)和鲜重(C)。
附加文件9图S2。
散点图表示在干旱胁迫下,两种组织中所有检测到的转录本(A)和新转录本(B)的表达变化。
附加文件10图S3。
采用qRT-PCR方法对10个RNA-Seq鉴定的基因在对照植株和干旱胁迫植株的叶片和根系中的表达谱进行了验证。灰色条表示RT-qPCR测定的相对表达量(左y轴),橙色线表示转录本的表达量(右y轴)。
附加文件11图S4。
表达式(log .)的验证2-fold变化)的RNA-Seq基因,通过qRT-PCR。结果绘制了在干旱胁迫下,普通野豌豆基因表达上调或下调的图谱。线性趋势线和R2显示值。
附加文件12如图S5所示。
叶片、根系中“对水的响应”(A)、“对胁迫的响应”(B)和“脯氨酸生物合成过程”(C)中富集的DEGs的表达谱以及两组织间共享的DEGs的表达谱。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Min, X., Lin, X., NDAYAMBAZA, B。et al。植物叶片和根系响应干旱胁迫的协调机制野豌豆属漂白亚麻纤维卷lBMC植物杂志20.165(2020)。https://doi.org/10.1186/s12870-020-02358-8
收到了:
接受:
发表:
关键字
- 常见的野豌豆
- 完整的成绩单
- 干旱胁迫
- 叶和根