- 研究文章
- 开放访问
- 发表:
Pitaya的分子表征及表达分析(Hylocereus polyrhizus.)生命值LRR基因对Neoscytalidium Dimidiatum.感染
BMC植物生物学体积20., 文章编号:160(2020.)
抽象的
背景
溃疡病引起的Neoscytalidium Dimidiatum.是一种毁灭性的疾病,导致皮托阿行业的重大损失。然而,植物中的抗性蛋白质对病原体感染起到至关重要的作用。在抗性蛋白质中,富含亮氨酸的重复(LRR)蛋白是在植物生长,发育和生物和非生物和非生物应激反应中起着至关重要的作用,特别是在疾病防御中起着至关重要的作用。
结果
在本研究中,转录组学分析鉴定了总共272个LRR基因,其中233个具有编码序列(CDS),在植物皮托亚(Hylocereus polyrhizus.)对真菌的反应Neoscytalidium Dimidiatum.感染。通过系统发育分析,将这些基因分为不同的亚群。对LRR基因进行分子表征、功能注释和表达分析。此外,4个LRR基因(CL445。Contig4_All、Unigene28_All CL28。采用定量逆转录PCR (quantitative reverse transcription PCR, qRT-PCR)对不同火龙果(Hylocereus polyrhizus.和Hylocereus undatus.),在不同的筏组织中,并用水杨酸(SA)处理后,茉莉酸甲酯(MEJA)和脱落酸(ABA)激素。鉴定了信号传导途径中的相关蛋白质功能和作用。
结论
本研究提供了全面的概述生命值在筏的转录水平下的LRR家族基因响应于N. Demidiatum.感染,了解鳕鱼溃疡病的分子机制将有助于,为进一步研究奠定了巨大的基础。
背景
植物在生长和发育过程中遭受各种生物和非生物胁迫,并且最重要的压力之一是由病原体引起的疾病。一旦受到病原体的攻击,植物通过细胞表面受体感知和识别病原体/微生物相关的分子模式(PAMPS / MAMPS)并触发免疫应答,其称为PAMP或MAMP触发的免疫(PTI / MTI)[1].在病原微生物,鞭毛蛋白(FLG22),伸长因子TU(EF-TU),肽聚糖(PGN)和脂多糖(PGN)和脂多糖(LPS)用几丁质,来自oomycetes的真菌和β-葡聚糖的壳聚糖是典型的纸板[2].一旦受病原体攻击,植物首先通过位于细胞表面的植物模式识别受体(PRRS)激活防御。表面局部受体激酶(RKS),尤其是TM-LRR是最着名的PRR蛋白。一种RKS是表面局部受体,另一个是受体样蛋白质。这些蛋白质可以通过各种配体结合的外胚层检测保守的纸浆,以激活植物PTI / MTI [3.].与PRR-RKS相比,PRR-RLPS蛋白质具有相同的整个结构,但缺乏细胞内激酶结构域。
在植物中,有两种跨膜受体样激酶(PRR-RLK)是众所周知的。一种PRR-RKS是受体样丝氨酸/苏氨酸激酶,另一个是受体组氨酸激酶。rlks是一种大家庭,具有细胞外结构域,跨膜结构域和细胞内激酶结构域(通常)4].rlks是少量富含亮氨酸的重复(lrr),赖氨酸基序受体激酶(lyk)和Catharanthus Roseus.RLK1-like (CrRLK1L)根据其n端胞外结构域和富含亮氨酸重复受体样激酶(LRR-RLKs)得到了最好的研究[5].RLKs定位于细胞表面,可以识别微生物来源的不同配体。例如,flg22和EF-Tu elf18分别被属于LRR-RLKs的鞭毛蛋白敏感2 (FLS2)和延伸因子Tu受体(EFR)检测到。几丁质激发子受体激酶(CERK1)通过同源二聚和磷酸化介导几丁质诱导信号[6].LysM-RK赖氨酸基序受体激酶5 (LYK5)结合真菌几丁质与CERK1形成几丁质诱导复合物诱导拟南芥植物免疫[7].
并非所有激酶都具有细胞外或跨膜结构域,例如受体样细胞质蛋白激酶(RLCK)。但这些激酶在细胞内定位中也具有类似于RLK的催化结构域[4].Botrytis诱导的激酶1(Bik1),一种定义为丝氨酸/苏氨酸激酶与FLS2和Brassino类固醇(Br)不敏感的1相关激酶1(Bak1)相互敏感的血浆膜 - 局部化Rlck,以引发植物免疫应答对细菌鞭毛蛋白[8].另一种命名为BR信号激酶1 (BSK1)的RLCK作为油菜素内酯受体BR不敏感1 (BRI1)的底物,与PAMP受体FLS2发生物理关联,并正调控PTI [9].这些结果表明,PRRs包括受体激酶(receptor kinase, RKs)、类受体蛋白(receptor- likeproteins, RLPs)及其相互作用的激酶或蛋白在植物PTI过程中的防御中发挥着重要作用。
如果PAMP触发的免疫反应相当大,则会激活细胞内免疫。植物中的抗性(R)直接或间接识别病原体效应器并激活效应触发的细胞内免疫(ETI)。在植物中,具有富含亮氨酸的重复(LRR)r蛋白的r蛋白,共有氨基酸(AA)序列基序LXXLXLXN / CXL(X表示任何AA)[10.].大多数lrr为免疫受体,主要参与植物生长发育、植物与病原菌相互作用的ETI过程和胁迫防御[11.].在ETI过程中,植物细胞内免疫受体感知分泌的毒力效应。在那些免疫受体中,核苷酸结合位点亮氨酸重复受体(NBS-LRS)占大部分[3.].的NBS-LRR型蛋白被分类到收费/白介素受体(TIR)-NBS-LRR(TNL)和卷曲螺旋(CC)-NBS-LRR(CNL),并且这些是大多数电阻(R)在应答的蛋白对病原体感染植物[12.,13.].
LRR家族基因主要编码富亮氨酸重复序列(LRR)保守结构域的蛋白,包括富亮氨酸重复序列受体/受体样激酶(LRR- rks /RLKs)亚家族、富亮氨酸重复序列受体/受体样蛋白(LRR- rps /LRR- rlps)亚家族、F-box/LRR-repeat蛋白(FBXL)亚家族和核苷酸结合位点富亮氨酸重复(NBS-LRR)亚家族通常参与植物免疫。在结构方面,LRR基因的主要特征是其20 - 30aa结构域和包含2-42个LRR的跨膜结构域[14.].此前的研究表明,LRR结构域为蛋白质相互作用提供了一个通用的结构框架,并允许蛋白质作为与病原体识别和防御激活相关的分子开关[15.,16.].
典型的LRR-RLK含有N-末端细胞外受体结构域,单通过跨膜结构域和C末端细胞内激酶结构域。N-末端结构域感知信号,单通域锚定膜内的蛋白质,C-末端激酶结构域通过自磷酸化转换下游的信号[17.].在拟南芥, LRR跨膜受体激酶FLS2是一种模式识别受体,决定鞭毛蛋白22 (flg22)感知的特异性[18.].一种Capsicum Annuum.(Pepper)LRR蛋白(Ca据报道,LRR1)通过与两种发病机制相关的蛋白质相互作用来调节植物细胞死亡和防御(CaPR10和CaPR4B)和过敏诱导反应1蛋白(CaHIR1) [19.].另一个C. annuum.质膜LRR蛋白(CaLRR51)响应细菌而作为阳性调节剂Ralstonia solanacearum.感染 [20.].
在LRR- rlk家族中,LRR受体样丝氨酸/苏氨酸蛋白激酶(LRR- stk)亚家族是最大的亚家族。这些分子在病原体识别信号、随后植物防御机制的激活和发育控制中发挥着重要作用[21.].BRI1和BAK1是BR信令中涉及的一对RLK,其调节植物生长,发展和应力响应[22.,23.].BAK1也是一种LRR-STK,通过与BRI1在体内和体外相互作用,发挥信号调节作用拟南芥[22.].与LRR-RLKs相比,LRR-RPs缺乏启动植物下游信号转导的细胞质激酶域[24.].
FBX1亚家族在动物和植物中广泛存在,并且在保守的F箱结构域的N-末端存在大约40-50AA [25].据报道,F箱蛋白是SKP1-CULLIN-F箱蛋白(SCF)泛素连接酶复合物的基质识别亚基[26].基因组分析表明,F型箱基因对大豆和豆类的盐胁迫,重金属和干旱响应Medicago truncatula[27,28].类似于称为Toll /白细胞介素-1受体(TIR1)的植物蛋白信令F型盒蛋白4(AFB4)在植物生长,发育和先天免疫中起着枢轴作用,如组合所示生理,分子和遗传方法[29].Angot的一个有趣的研究研究出版社.(2006)表明,七型III型分泌系统(T3S)含量含有LRR结构域和F盒结构域的效应促进几种宿主植物中的疾病。作者表示,这可能是因为他们劫持他们的宿主SCF型E3泛素连接酶,以干扰宿主遍在蛋白/蛋白酶体途径以促进疾病[30.].
在哺乳动物中,据报道FBX12与P85β亚基的池相互作用,通过利用蛋白酶体降解过程来控制磷脂酰肌醇-3-激酶(PI3K)信号传导级联[26].免疫沉淀和串联质谱(IP-MS)分析表明,叉头箱M1(FoxM1)转录因子与胃癌中的FBXL2蛋白相互作用[31].同时,Chen等人发现FBXL2泛素化Aurora B抑制肿瘤发生[32].此外,Tosto等人的一项研究表明,FBXL7过表达与阿尔茨海默病有关,该研究将阿尔茨海默病样转基因小鼠与野生型同卵鼠进行了比较[33].这些结果表明,FBXL蛋白质不仅参与植物的生长,发育和疾病也是哺乳动物。
在植物中,NBS-LRR亚家族可以直接与病原体衍生的效果,作为受体和间接感测效应介导的其他宿主蛋白的修饰[34].NBS作为分子开关,是NB-ARC (APAF-1、抗性蛋白和CED-4共享的核苷酸结合适配器)结构域的一部分[35].活化植物NBS-LRRS引发一系列免疫应答,例如过敏反应(HR),其终止于感染细胞的死亡[36].植物中nbs - lrr主要有两大类:螺旋基序(CC)-NBS-LRR (CNL)亚家族和TIR-NBS-LRR (TNL)亚家族[37].CC- nbs - lrr亚家族具有一个n端CC结构域,而TIR- nbs - lrr亚家族具有TIR结构域[38].小麦CC-NBS-LRR(助教RCR1)被报道对真菌病原体的防御反应有积极的贡献Rhizoctonia cerealis.通过维持反应性氧(ROS)同性恋[39].另一种CC-NBS-LRR蛋白PM21在小麦中被证明赋予粉状霉菌抗性[40].在植物中尼古利亚娜·宾夕法尼亚州,新真菌的过度表达plasmoparaviticola.- 诱导的TiR-NBS-LRR基因(弗吉尼亚州RGA1)增强抗病性和耐旱耐盐性[41].大豆TIR-NBS-LRR R型基因GmKR3的过表达提高了大豆对几种花叶病毒的抗性[42].与其他LRR基因类似,NBS-LRR基因在植物疾病防御信号中起重要作用。
火龙果(Hylocereus polyrhizus.和Hylocereus undatus.)是一种重要的热带-亚热带果树,分布于中美洲、东亚和东南亚。由真菌引起的溃疡病Neoscytalidium Dimidiatum.是筏业最具破坏性和经济上重要的疾病之一[43,44].目前,由于缺乏关于火龙果基因组的报道,采用高通量方法研究生物和非生物胁迫响应基因是经济和有效的。
命名的真菌Neoscytalidium Dimidiatum.导致帕提亚的溃疡病被隔绝,并在我们以前在海南省的工作中确定了[44].转录组宽的高通量RNA测序(RNA-SEQ)关于与...相关的抗性基因的表达谱Neoscytalidium Dimidiatum.随后在正常和病变的茎组织中进行防御[45].在这里,我们分析并研究了筏(Hylocereus polyrhizus.)LRR受体样(生命值LRR)家族抗性基因的响应N. Demidiatum.感染基于先前RNA测序数据的细节。转录组学,分子特征,以及有关火龙果LRR亚科后表达结果N. Demidiatum.尚未报道感染。本研究概述了托养遗址的LRR基因的亚科分类,为未来的功能研究提供了基础。在未来的研究中,在帕提亚的每个LRR亚家族的进化历史和功能仍然被理解。
结果
脱皮鉴定与系统发育分析生命值LRR转录基因
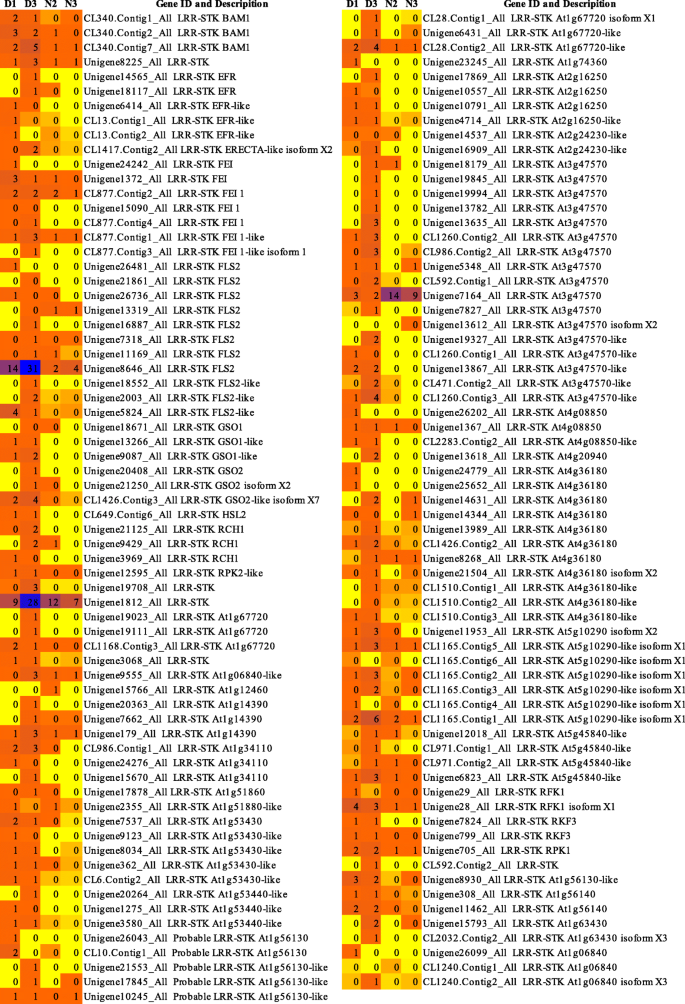
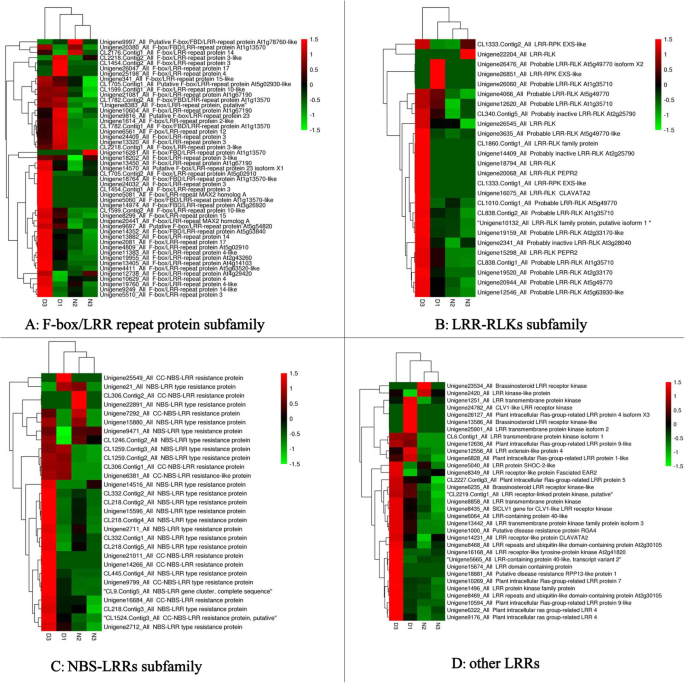
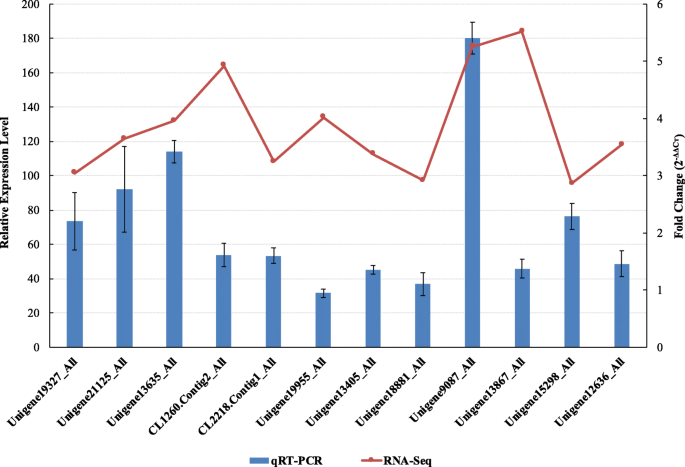
我们通过RNA-seq获得了火龙果溃疡病诱导的Hiseq差异表达数据,在我们之前的研究中有详细报道[45].在这项研究中,共272岁生命值LRR转录组基因是根据以往的从头转录组分析确定的。热图分析表明,患病火龙果组织中大部分LRR基因表达上调。其中12个基因(Unigene19327_All、Unigene21125_All、Unigene13635_All、CL1260)。Contig2_All CL2218。在log2FoldChange (D/N)≥1.0 (FDR≤0.001)的基础上,Contig1_All、Unigene19955_All、Unigene13405_All、Unigene18881_All、Unigene9087_All、Unigene13867_All、Unigene15298_All和Unigene12636_All均显著上调(补充材料)1).272年生命值LRR转录基因进行BLAST分析(补充材料1)涉及六种蛋白质数据库(NR / NT,Swissprot,Kegg,Cog,Interpro和Go)。基于爆炸分析,这些基因被注释为属于LRR-STK亚家族(135),FBXL亚家族(49),NBS-LRR亚家族(29),LRR-RLK亚家族(26),植物细胞内RAS组相关LRR(皮肤)亚家族(8),LRR跨膜蛋白激酶亚家族(5),芸苔类固醇LRR受体激酶亚类(3),以及其他LRR基因(17)(表1).272的热图生命值D1,D3,N2和N3样品中的LRR基因表达水平在图1和2中示出。1和2.虽然LRR-STK基因属于LRR-RLK亚家族,但为了区别于常见的LRR-RLK基因,我们构建了单独的热图。
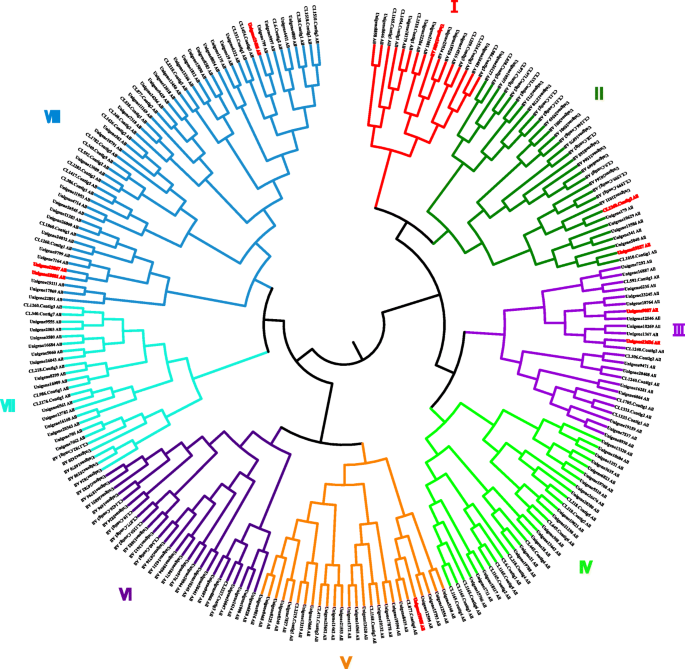
在272中生命值利用A质粒编辑器(ApE)软件进行碱基序列分析(http://jorgensen.biology.utah.edu/wayned/ape/).相反,一些生命值LRR基因有多个CDS。33生命值选择具有CDSS> 1.0 kB的LRR基因用于基因注释和基因结构分析,而四个生命值选择具有最长CDS的LRR基因进行进一步的表达分析(在不同的真菌感染阶段,在不同的筏组织中以及植物激素治疗后)。233的AA序列和分子量生命值远程雷达基因with CDSs varied greatly, from 30 aa/3.382 kDa to 1138 aa/128.777 kDa (Supplementary Material2).233的AA序列生命值使用Mega 6.0使用LRR基因用于系统发育分析[46], 9个CDSs显著上调的基因用红色标记(图。3.).系统发育分析表明,233geS可以分为八个亚壳(图。3.和表格1).这表明这些基因具有一定程度的AA级相似性,表明进化关系。然而,基础和AA序列进化结果并不一致(表1),由于密码子的简并性。
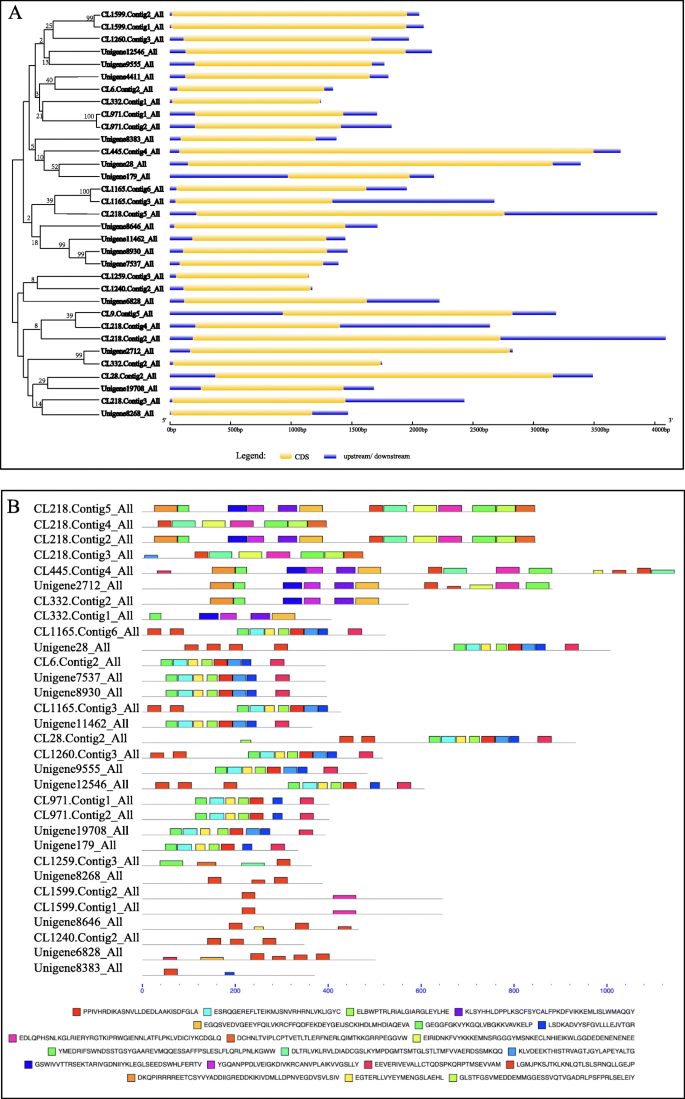
33生命值LRR转录基因与CDSS> 1.0 KB
难以进一步研究所有LRR基因,因为其中很多。因此,我们选择具有CDSS> 1.0kB的基因,用于基因结构分析和保守的基序分析(图。4)作进一步研究。CDSs > 1.0 kb的33个基因的详细信息见表2.所有33生命值LRR转录基因有上下游序列。CL1599。Contig2_All CL1599.Contig1_All;CL971。Contig1_All CL971.Contig2_All;CL1165。Contig6_All CL1165.Contig3_All;Unigene11462_All, Unigene8930_All和Unigene7537_All;Unigene2712_All和CL332。Contig2_All有99-100%的相似性,表明每一组2 - 3个基因具有密切的进化关系。
qRT-PCR验证12个LRR差异表达基因(DEGs)
PossionDis分析结果显示,在272个LRR基因中,有12个基因表达显著上调(|log2FoldChange (D/N)|≥1.0,FDR≤0.001)。在这12个基因中,有7个基因(Unigene15298_All、Unigene21125_All、Unigene13635_All、CL1260。Contig2_All、Unigene13867_All、Unigene19327_All和Unigene9087_All被注释为属于LRR-STK亚家族,三个(CL2218。Contig1_All、Unigene19955_All和Unigene13405_All)属于FBXL亚家族,1个(Unigene18881_All)属于抗病基因,1个(Unigene12636_All)属于PIRL亚家族。
为了验证RNA-SEQ结果,进行QRT-PCR测定。12个基因(不是Unigene19955_All)的QRT-PCR表达水平趋势与RNA-SEQ结果一致(图。5).此外,12个基因中有3个(Unigene15298_All、Unigene21125_All和CL2218.Contig1_All)没有CDS,其余9个基因aa的数量在35 ~ 290之间(Supplementary Material)2).
四种表达概况生命值LRR基因在不同阶段N. Demidiatum.不同火龙果种的感染情况
四个生命值远程雷达(CL445基因。Contig4_All、Unigene28_All CL28。选择Contig2_All和Unigene2712_All作为后续的表达分析,因为它们有4个最长的CDSs (Supplementary Material)2).保守的域分析表明C1445.contig4_all和Unigene2712_All是NBS-LRR型抗性蛋白,而Unigene28_All和Cl28.contig2_All是可能的LRR-STK(图。6).这四个基因有3-9个LRR基序(图)。6).此外,CL445.contig4_all和Unigene2712_all属于Rx-CC_like系列(“马铃薯病毒X抗性蛋白质和类似蛋白质的”卷曲线圈结构域“)和NB-Crom系列。Unigene28_all和Cl28.contig2_all具有关于STKC_IRAK系列的特定命中(“丝氨酸/苏氨酸激酶,白细胞介素-1受体相关激酶和相关STK”的“催化结构域,和相关STK”)和普通的LRR-RLK(PLN00113超家族)。cl28.contig2_all具有特定的malitIn样域;Malectin是一种新的内质网碳水化合物结合蛋白和蛋白质N-糖基化的早期步骤的候选者参与者[47].
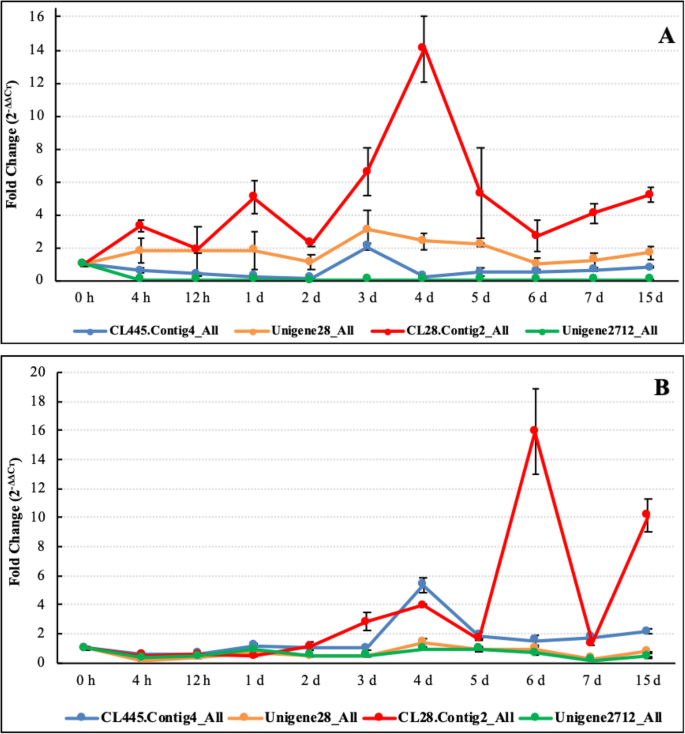
皮托耶茎在3天后呈现明显的症状N. Demidiatum.第15天感染和腐烂(图。7).然而,与红肉状斗鱼相比(图。7a),白肉状斗叶属(图。7B)具有很强的抵抗力。由于火龙果茎上有一层坚硬的蜡保护层,四个LRR基因在红肉火龙果和白肉火龙果中分别在感染3~4 d和4~6 d后表达量最高。表达结果(图。8a)建议,在红色肉体pitaya(Hylocereus polyrhizus.),compared with control level (0 h), CL445.Contig4_All expression first decreased and then suddenly increased on day 3, then decreased, and finally exhibited an increasing trend but remained lower than the control level. Unigene28_All and CL28.Contig2_All expression levels were increased afterN. Demidiatum.Unigene28_All在第3天达到峰值,CL28则在第3天达到峰值。Contig2_All在第4天达到峰值。与其他3个基因相比,Unigene2712_All的表达始终低于对照水平。这些结果表明,这4个基因参与了火龙果对真菌感染的应答,其中CL28基因的应答最为明显。Contig2_All,第4天显著上调。与其他3个基因相比,Unigene2712_All可能在植物-病原互作中起负调控作用。在白色果肉的火龙果(Hylocereus undatus.),基因表达有相似趋势。但在白肉火龙果中,基因的侵染时间较红肉火龙果晚1天。8四。b)生命值LRR基因表达文件的结果与两种火龙果的感染症状一致(图2)。7).
四种表达概况生命值LRR转录基因在不同阶段和不同的筏剂种类N. Demidiatum.感染。(一个):生命值LRR Genesexpression曲线在红肉体筏(Hylocereus polyrhizus.)感染N. Demidiatum.;(b):生命值白肉火龙果LRR基因表达谱(Hylocereus undatus.)感染N. Demidiatum..X轴代表不同的阶段N. Demidiatum.y轴表示折痕变化(2-ΔΔcт)。注释:CL445。Contig4_All和Unigene2712_All: nbc - lrr;Unigene28_All CL28。Contig2_All: LRRSTK。远程雷达:富亮氨酸重复;国家统计局:nucleotide-binding网站;STK:丝氨酸/ threonine-protein激酶
四个组织特异性表达轮廓生命值远程雷达基因
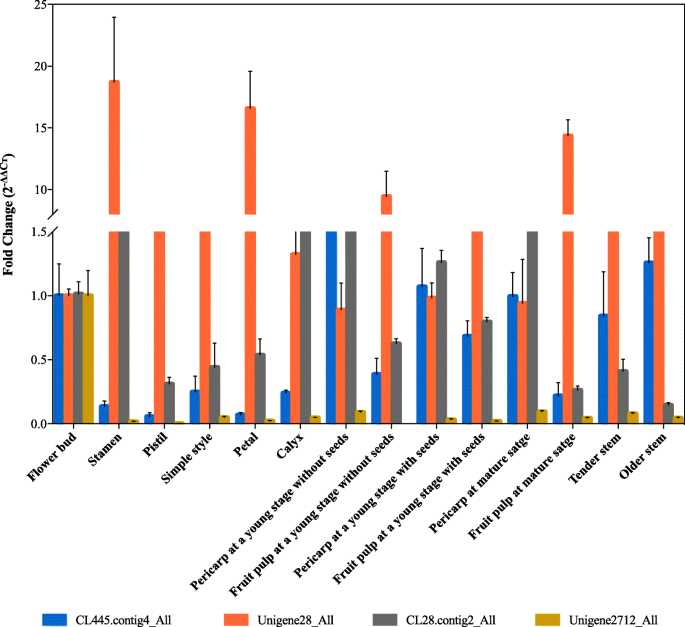
特异性基因(也称为豪华基因)是产品在特定细胞类型中具有特异性功能的基因。调查这四个生命值我们选择的LRR基因在特定的细胞中具有特定的功能,通过qRT-PCR获得了14个火龙果组织的组织特异性表达谱。9).CL445.Contig4_All主要表达于年轻绿色水果的果皮;Unigene28_All主要表达于雄蕊,花瓣,都和一个年轻的绿色水果和红色果实的果肉;CL28.Contig2_All两个年轻绿色水果和红色水果的果皮是显著表达,Unigene2712_All主要表达在花蕾。这些结果表明,Unigene28_All是显著上调和火龙果花和果实生长发育可能起关键作用。
四个人的表情简介生命值LRR基因对SA、ABA和MeJA处理的响应
在植物中,激素响应广泛的生物和非生物胁迫信号网络中发挥重要作用。SA,ABA,茉莉酮酸酯(JAS),和乙烯在植物疾病至关重要公知的角色和害虫抗性[48].更好地了解四个生命值LRR基因对植物病理学相互作用途径的激素调节的反应,通过QRT-PCR评估这些基因的表达模式,响应SA,ABA和MEJA治疗(图。10.).所有四种基因都会在某种程度上响应三个激素。在ABA治疗2小时后,Unigene28_ALL表达显着改变。cl28.contig2_all突出显示在SA治疗的48小时内。UNIGENE2712_ALL由ABA显着下调,但通过SA显着上调,在24小时达到峰值。结果表明,Unigene28_All和Cl28.contig2_all可以在激素介导的抗病抗响应中发挥枢转作用。
讨论
在本研究中,我们确定了De Novo转录组组装分析中Pitaya中的272个LRR基因,其中233种具有CDSS。这些基因中的大多数属于LRR-RLK,NBS-LRR或FBXL亚壳,并且在LRR-RLK亚家族内,LRR-STK亚家族具有最多的基因。注释和保守域分析结果表明,LRR基因具有典型的LXXLXLXNXL结构域,其中大部分都参与了植物疾病。尽管具有明显的进化起源,但大多数动物和植物需要具有LRR结构域的细胞表面或细胞内免疫受体,以检测病原体和触发防御响应[49].在哺乳动物中,LRR激酶在疾病中发挥关键作用,特别是帕金森氏病和克罗恩病[50,51].在植物中,这些LRR中的大多数是抗性蛋白质,并且可以与病原体衍生的效果直接相关,或间接感测效应介导的其他宿主蛋白的修饰[52].不同种类的细胞表面免疫LRR受体具有启动抗性的重要特征。本研究发现的LRR基因可能在火龙果免疫应答中发挥重要作用。系统发育分析表明,碱基与aa序列结果不一致(见表1)1)由于密码子的退化性。另外,具有类似碱序列的基因不一定具有类似的功能。
除了三个大LRR亚科,我们还发现8个PIRL基因,五个LRR跨膜蛋白激酶基因,三个油菜素内酯相关LRR受体激酶基因,和其他17个LRR基因,如基因CLAVATA(CLV)样LRR受体激酶中,LRR蛋白SHOC -2-等,并且LRR受体样蛋白扁EAR2(图2).pls是一类植物特有的LRR蛋白,参与发育细胞信号传导和基因调控答:芥, PIRL1和PIRL9具有冗余的作用,在花粉发育早期的关键转换点是必不可少的[53].
大多数LRR-RLK是跨膜激酶和磷酸盐丝氨酸/苏氨酸残基(也称为LRR-STK),大多数LRR-RLKS是识别细胞外配体,其导致细胞内激酶结构域的激活和随后的下游信号传导途径的转导[54].我们鉴定的五种LRR跨膜蛋白激酶基因可以属于LRR-RLKS亚家族。
据报道,LRR-RLK基因BAK1 / SERK3参与芸苔类固醇信号,是PAMP触发免疫的主要调节剂答:芥和N. Benthamiana.[55].本研究中的三种芸苔类固醇LRR受体激酶基因可能在芸苔类固醇信号通路中发挥关键作用,以响应于N. Demidiatum.火龙果的感染。
有报道称,CLV1是一个由含有lrr的胞外结构域(可能具有受体功能)和胞质STK结构域(通过跨膜结构域连接)组成的RLK;它被认为在分生组织的维持和花的发育中起着重要的作用[54,56].与CLV1相比,CLV2在结构上类似但具有非常短的预测细胞质尾部[57].CLV3是一种干细胞特异性蛋白,可激活拟南芥Clavata干细胞信号通路[58].这些报道表明CLV蛋白主要参与植物的生长发育。
选择了四个基因(CL445.Contig4_All,Unigene28_All,CL28.Contig2_All和Unigene2712_All)(因为它们具有四个最长CDS),以进行进一步的表达分析。其中,Cl445.contig4_all和Unigene2712_All是NBS-LRR抗性蛋白,而Unigene28_All和Cl28.contig2_All是可能的LRR受体样STK基因(图。6).CL28。第4天,Contig2_All显著上调N. Demidiatum.感染,而Unigene2712_ALL在所有感染阶段都显着下调。然而,基因表达的时间达到白皮筏的峰值后1天,而不是红肉筏(图。8b)。这两个基因可能在植物疾病反应中起阳性或负面作用。Unigene28_all在第3天显着表达N. Demidiatum.感染,基于组织特异性表达谱,在雄蕊,花瓣和果实浆中也显着表达了幼苗和红色果实。这些结果表明,Unigene28_all不仅参与筏花和果实生长和发展,还参与抗病抵抗反应。此外,在红皮筏的感染后3〜4天达到3〜4天的表达水平,而白肉质筏中的4〜6天表示,它可能在不同的斗酵母物种之间表现出不同的抗性。
植物激素包括SA,JAS,ABA,芸苔类固醇,乙烯和养羊酸,充当触发和介导植物免疫应答的信号[59].在植物中,SA是一种次级代谢物,在激活植物对病原体的抗性中起着重要的信号分子作用[60,61].研究表明,SA在感染叶和未感染叶中的积累增加,介导了系统获得性抗性(SAR) [62].SA的积累可与致病相关蛋白基因表达的增加平行[61].例如,BAK1过表达导致SA的积累和细胞死亡控制基因的放松[63].
JAs,包括茉莉酸和MeJA衍生物,已被证明能有效提高植物的耐受性[64].据报道,JAs是葡萄过敏反应细胞死亡的关键信号化合物,并在对细菌flg22的应答中积累血管卢比斯[65].
与SA和JAS类似,ABA(含有15个碳原子的弱酸)是重要的应激激素,并且参与生理过程[66].ABA参与胚胎发生、种子萌发、花过渡等过程[67,68].
然而,植物生长,发育和压力反应需要涉及复杂信号网络串扰的多种植物激素[69].在这项研究中,Pitaya茎被Sa,Meja和Aba治疗。尽管所有四种基因对三种激素作出反应,但在SA处理后48小时内表达达到峰值,并且Unigene28_All在2小时时清楚地调节Unigene28_All。激素治疗结果表明,LRR家族基因的表达由植物激素调节。LRR家族抗性基因和激素相关基因可能形成跨网络以调节植物病。将所有表达结果一起服用,我们选择了这两个基因进行进一步的功能研究。随后分析UNIGENE28_ALL和CL28.ContoG2_ALL中的保守功能基序,表明这两种基因均具有典型的LXXLXLXNXL结构域,STKC-IRAK的STRVGTIGYMAPE或SSVAXGTL / VYSVAXGTL / VYLDLDPE保守位点(X表示任何AA)(图。11.).这些域或保守位点可能在蛋白质功能和信号传导的重要作用。然而,在某些情况下,LRR蛋白质需要功能的另一个助手或合作伙伴的蛋白质,所以一个完整的功能研究(包括筛选相互作用的蛋白质)关于Unigene28_All和CL28.Contog2_All正在紧张进行,其结果将在未来公布。
溃疡病引起的N. Demidiatum.是火龙果主要产地最严重的病害之一[44].的N. Demidiatum.是一种真菌,对其宿主火龙果具有很强的特异性感染。目前,由于火龙果基因转化体系存在非常困难的技术瓶颈,很难像模式植物一样通过转基因方法来研究火龙果的基因功能。真菌也不能感染模式植物拟南芥我们的探索性测试,烟草和番茄。因此,识别具有真正深度实验的基因是非常努力的工作。目前,在脱皮诱导的筏中的转录组织,分子表征和LRR基因的表达分析没有报道N. Demidiatum.感染。从表达式配置文件中,我们可以识别生命值LRR基因响应火龙果溃疡病初步的。这些结果提供了在这一刻相对较差研究的病害系统重要的研究资料,提供对火龙果LRR亚家族的进一步功能研究的框架,并有助于在高等植物中更好地理解,LRR基因的复杂性。
结论
由真菌引起的溃疡病N. Demidiatum.是因为它在其主机火龙果迅速蔓延,特异性强感染的最重要的疾病之一。溃疡病的发生不仅对单产显著威胁,而且还会影响火龙果的质量。目前,它是挖掘抗性基因,并解释他们的职能的一项重要工作。本研究主要分析了生命值通过生物信息学分析和表达曲线在不同斗酵母组织中,红斑地粘土的不同感染阶段(Hylocereus polyrhizus.)及白肉火龙果(Hylocereus undatus.)和植物激素治疗生命值LRR家族抗性基因。本研究的结果提供了全面的概述生命值在筏的转录水平下的LRR家族基因响应于N. Demidiatum.为进一步深入的功能研究提供了基础。
方法
植物材料和生长条件
火龙果正常组织(N1、N2、N3)和病变组织(D1、D2、D3)Hylocereus polyrhizus.)来自海南省海南省莱德县的RNA-SEQ的茎已在种植园的自然条件下长约5年。正常(n)组是健康植物,而疾病(d)组被感染的患病植物N. Demidiatum.真菌。脱皮茎和果实感染N. Demidiatum.真菌最初出现小黄斑,随后迅速蔓延,最终几乎所有茎干都会腐烂。采用深圳华大基因科技有限公司的Illumina HiSeq系统进行从头转录组组装和RNA-Seq。采用主成分分析(PCA)和相关性分析评价样品的重复性。经过分析,N1和D2样品由于重复性差而被放弃。因此,以4个样品(N2、N3、D1、D3)进行生物信息学分析和后续实验。rna测序数据和图谱在NCBI基因表达综合数据库中的登录号为GSE119976。另外,火龙果茎的组织为N. Demidiatum.在海南大学的种植园中收集了真菌感染,激素治疗和组织特异性表达与用于RNA-SEQ的人的种植园。在每个条件下使用五种筏植物并显示出类似的症状。所有五种筏植物都合并在一起用于QRT-PCR实验。
序列组装和RNA-Seq生物信息学分析
Clean data用于生物信息学分析,它是通过对已测序的原始数据进行过滤获得的[45].采用三位一体对端组装法鉴定火龙果生命值LRR家族基因[70].TEGR基因指数聚类工具用于通过聚类组装的清洁读取和消除冗余来获取未成熟子[71.].这些unigenes被爆炸到公共蛋白质数据库以注释和分析。包括。期望最大化(RSEM)软件(版本:v1.2.12;参数:默认值;http://deweylab.biostat.wisc.edu/RSEM),获得FPKM表达量。unigenes FPKM的计算方法为Li B [72.].调整后的上调或下调的unigenesP-value≤0.05,fold change |(log2FC)≥1|用NOIseq和PossionDis方法定义为差异表达基因(DEGs)。
脱皮鉴定与系统发育分析生命值LRR转录基因
将组装好的ungene blast到nr、GO、KEGG、COG、InterPro和SwissProt数据库中,选择注释到LRR家族基因的ungene进行下一步分析。所有的表达水平生命值使用免费在线数据分析平台OmicShare工具(http://www.omicshare.com/tools/图。1和2).此后,使用编码序列(CDSS)的所有233 LRR基因的序列基于1000个引导复制和使用Mega 6.0软件的邻接(NJ)方法构建系统发育树[46].
33种植物的基因结构和系统发育分析生命值LRR转录基因与CDSs> 1.0 kb
有33个生命值LRR转录基因与CDSS> 1.0 kB。使用免费的在线平台基因结构显示服务器(GSDS V2.0,)进行这些基因的基因结构分析http://gsds.cbi.pku.edu.cn)通过上传基因的CDS和装配序列。基于CDS的氨基酸序列,对MEME程序进行了保守的基序分析。基于1000个引导复制和使用Mega 6.0软件的邻接(NJ)方法进行系统发育分析[46].
通过定量逆转录(QRT)-PCR验证12个显着上调的差异表达的LRR基因(DEGS)
为了验证上调或下调基因的可靠性和一致性,我们选择基于PossionDis分析的12个差异表达LRR基因进行qRT-PCR检测。采用改进的十六烷基三甲基溴化铵(CTAB)法提取N2、N3、D1、D3火龙果样品总RNA [73.].在用DNASE I(Thermo Fisher Scientific,USA)处理后,根据制造商的方案(Takara,Japan)进行RNA的第一链CDNA合成RNA。然后,将N 2和N 3 cDNA模板平衡混合在一起以获得总N样品,与D1和D3相同,得到总D样品。根据制造商的Chamq™UniversalSybr®QPCR主混音试剂盒(Q711-02 / 03,北京,中国),使用20μL反应系统进行QRT-PCR测定。十二点明显上调生命值采用7500 Applied Biosystems公司的qRT-PCR系统(Life Tech, 81 Wyman Street, Waltham, MA, 02454, USA)对LRR家族基因进行qRT-PCR检测。结果表明,火龙果的泛素基因(UBQ.)是数据规范化的一个很好的内部参考[74.].12个生命值LRR家族基因和UBQ.使用Primer Premier 6软件(www.plemierbiosoft.com.).qRT-PCR条件参照既往研究[45].Delta-Delta周期阈值(2-ΔΔct)方法在三次技术重复的基础上输出数据分析。
四种表达概况生命值LRR基因在不同阶段的转录N. Demidiatum.不同火龙果种的感染情况
在全部LRR基因中,有4个生命值LRR转录基因(CL445.Contig4_all,Unigene 28_All,Cl28.Contig2_All和Unigene 2712_All)被选择用于进一步表达研究,因为它们具有四个最长的CDS。红肉体pitaya(Hylocereus polyrhizus.)“金都一号”和白肉火龙果(Hylocereus undatus.)“越南Bairou”柔软的茎被使用N. Demidiatum.感染。5个健康的个体斗植物用作从海南大学的种植园收集的对照。另外5个健康的个体斗植物被用来感染。受感染的实验如下进行:N. Demidiatum.在将马铃薯右旋糖琼脂培养基中生长7-10天后,收集菌丝。在接种之前,使用75%乙醇灭菌茎两次。用400x显微镜放大倍数(奥林巴斯公司,日本),用400x显微镜放大(Olympus Corporation),催化菌丝20-40分钟。通过将分枝悬浮液喷射到脱皮茎上来进行接种。喷洒后,用蒸馏水包裹在吸水性羊毛中以保持水分。然后将植物置于28℃的照射培养箱中,在16/8H光/暗循环下在28℃下置于15天。在0h,4小时,12小时,1天,2天,3天,4天,5天,6天,7天和15天后,收集Pitaya干组织N. Demidiatum.感染。将总RNA反转转录成cDNA,并且CDNA用于QRT-PCR(如前步骤)。使用Primer Premier 6.0软件设计了四种LRR基因的QRT-PCR引物(www.plemierbiosoft.com.).四种基因的引物细节介绍了否定的信息1,2,3.,4.
四个人的表情简介生命值Pitaya不同组织中的LRR基因
研究了以下14个健康的筏组织:(1)花芽,(2)雄蕊,(3)雌蕊,(4)简单款式,(5)花瓣,(6)Calyx,(7-12)Pericarp和果实纸浆年轻的绿色,成熟的绿色和红色水果,(13)嫩茎,(14)较旧的茎被收集在海南省筏植物园。提取14个组织的总RNA,反转转录成cDNA,并用于QRT-PCR以获得四种选定基因的表达谱。
四个响应生命值LRR基因与水杨酸(SA)、茉莉酸甲酯(MeJA)和脱落酸(ABA)处理相关
在用5mM SA溶液(pH5.7),1mM Meja溶液和100μMaba溶液处理之前,使用75%乙醇在种植酸盐中收集健康的Pitaya茎并使用75%乙醇灭菌两次。这三种解决方案全部加入0.01%SILWET-77(代码:DE0025,北京生物群生物科技有限公司,中国),以减少水的表面张力。在0小时,0.5小时,1小时,2小时,4小时,12小时,24小时和48小时后收集干部组织。如前一步骤中进行RNA提取和QRT-PCR测定。
可用性数据和材料
通过NCBI网站获得的rna测序数据和谱图在GEO数据库中的登录号为GSE119976。https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse119976.).在当前研究期间生成和分析的数据集可从合理请求的Geo网站或相应作者获得。
缩写
- LRRS:
-
富含亮氨酸的重复基因
- LRR-RLKs:
-
富含亮氨酸的重复受体样激酶
- NBS-LRRs:
-
核苷酸结合位点富含亮氨酸重复序列
- LRR-STKs:
-
富含亮氨酸的重复类受体丝氨酸/苏氨酸蛋白激酶
- Bri1:
-
芸苔类固醇不敏感1
- BAK1:
-
Bri1相关受体激酶1
- NB-ARC:
-
APAF-1抗性蛋白共享的核苷酸结合衔接子,CED-4结构域
- CC-NBS-LRR:
-
卷绕式线圈基序核苷酸结合位点亮氨酸重复
- SA:
-
水杨酸
- JA:
-
酸盐
- Meja:
-
茉莉酸甲酯
- 阿巴:
-
脱盐酸
- SAR:
-
系统获得的阻力
- 公关:
-
病程相关蛋白
参考
- 1。
Thomma BP,Nurnberger T,Jooosten MH。PAMP和效果:模糊的PTI-ETI二分法。植物细胞。2011; 23(1):4-15。
- 2。
Newman Ma,Sundelin T,Nielsen JT,ERBS G. MAMP(微生物相关分子图案)引发植物的免疫力。前植物SCI。2013; 4:139。
- 3.
植物模式识别受体。趋势Immunol。2014;35(7):345 - 51。
- 4.
Jurca我,Bottka年代,视野中时a描述家庭的拟南芥受体细胞质激酶(RLCK类VI)。植物细胞众议员2008;27(4):739 - 48。
- 5.
植物天然免疫的受体样激酶复合物。植物科学学报2012;3:209。
- 6.
刘T,刘Z,宋C,胡Y,韩Z,她Ĵ,范楼王阶,金C,张J,等。甲壳素诱导二聚化激活植物的免疫受体。科学。2012; 336(6085):1160-4。
- 7。
Cao Y,Liang Y,Tanaka K,Nguyen CT,Jedrzejczak RP,Joachimiak A,Stacey G.激酶Lyk5是拟南芥中的一个主要的几丁质受体,形成含有相关激酶Cerk1的甲壳素诱导的络合物。Elife。2014; 3。
- 8。
Lin W, Li B, Lu D, Chen S, Zhu N, He P, Shan L. protein kinase complex BAK1/BIK1酪氨酸磷酸化介导拟南芥先天免疫。中国科学(d辑:地球科学)2014;
- 9。
Shi H,Shen Q,Qi Y,Yan H,Nie H,Chen Y,Zhao T,Katagiri F,Tang D.Br-Signaling Kinase1与鞭毛素感应2物理相关,并调节拟南芥的植物先天免疫力。植物细胞。2013; 25(3):1143-57。
- 10。
富含亮氨酸重复序列的蛋白质。中国生物医学工程学报。1995;5(3):409-16。
- 11.
对紫杉醇假单胞菌效应体HopA1的抗性受TIR-NBS-LRR蛋白RPS6调控,SRFR1突变增强。植物杂志。2009;150(4):1723 - 32。
- 12.
van der biezen ea,琼斯jd。植物抗病蛋白和基因对基因概念。趋势Biochem SCI。1998年; 23(12):454-6。
- 13.
Sekhwal Mk,Li P,Lam I,Wang X,Cloutier S,你FM。植物中疾病性基因类似物(RGA)。int j mol sci。2015; 16(8):19248-90。
- 14.
宋D,李克,宋F,郑Z。OSBiserk1的分子表征及表达分析,在水稻中抗病反应期间编码富氨氨酸富抗受体样激酶的基因。Mol Biol rep.2008; 35(2):275-83。
- 15.
Bella J,Hindle Kl,Mcewan Pa,Lovell SC。富含亮氨酸的重复结构。细胞mol寿命。2008; 65(15):2307-33。
- 16.
威廉姆斯SJ,YIN L,Foley G,Casey LW,Outram MA,爱立信DJ,Lu J,Boden M,Dist IB,神户B.从葡萄NLR蛋白RPV1中的TIR结构域的结构和功能。前植物SCI。2016; 7:1850。
- 17.
郭晓霞,何凯,杨华,袁涛,林华,李建军。拟南芥富含亮氨酸重复受体样蛋白激酶基因的克隆与序列分析。BMC基因组学。2010;11:19。
- 18。
Chinchilla D,Bauer Z,Regenass M,Boller T,Felix G.拟南芥受体激酶FLS2结合FLG22并确定鞭毛素感知的特异性。植物细胞。2006; 18(2):465-76。
- 19。
辣椒富亮氨酸重复序列蛋白在植物细胞死亡和免疫中的功能及其与致病相关蛋白和超敏诱导蛋白的相互作用。足底。2017;246(3):351 - 64。
- 20。
程伟,肖志,蔡华,王超,胡勇,郑勇,沈磊,杨胜,刘铮,等。一种新的富含亮氨酸重复蛋白CaLRR51在辣椒对茄科Ralstonia侵染的响应中起正调控作用。植物学报。2017;18(8):1089-100。
- 21。
afzal aj,木头aj,lightfoot da。植物受体样丝氨酸苏氨酸激酶:信号传导和植物防御中的作用。Mol植物微生物相互作用。2008; 21(5):507-17。
- 22。
李家,文士,租赁ka,doke jt,税收jt,walker jc。BAK1,拟南芥LRR受体样蛋白激酶与BRI1相互作用并调节芸苔类固醇信号传导。细胞。2002; 110(2):213-22。
- 23。
Li J. BRI1/BAK1受体激酶对介导油菜素内酯信号转导。细胞。2002;110(2):203 - 12所示。
- 24。
免疫受体AtRLP23及其配体nlp20和辅助受体AtSOBIR1和AtBAK1的结构和功能分析。acta botanica sinica, 2019;32(8): 1038-46。
- 25.
崔HR,张ZR,吕W,徐JN,王XY。全基因组表征和在海棠斯蒂卡基因组F-box蛋白编码基因的分析。Mol Genet基因组学。2015; 290(4):1435至1446年。
- 26.
Kuchay S,Duan SS,Schenkein E,Peschiaroli A,Saraf A,Florens L,Washburn MP,Pagano M.FBXL2和PTPL1介导的P110-FaiVβ调节亚基的降解控制PI(3)K信号级联。NAT细胞BIOL。2013; 15(5):472。
- 27.
贾强,肖志新,王福林,孙松,梁凯杰,Lam HM:大豆F-Box基因家族对盐胁迫响应的全基因组分析。中华医学杂志。2017;18(4):818-34。
- 28.
宋建斌,王应祥,李海波,李博文,周志胜,高胜,杨志明。短梗苜蓿F-box家族基因是响应盐、重精神和干旱胁迫的关键基因。功能整合基因组学。2015;15(4):495-507。
- 29.
Hu Z,Keceli Ma,Piisila M,Li J,Survila M,Heino P,Brader G,Palva et,Li J. F-Box蛋白AFB4在植物生长,开发和先天免疫中起着至关重要的作用。细胞res。2012; 22(4):777-81。
- 30.
茄科Ralstonia solanacearum (Ralstonia solanacearum)需要含有F-box样结构域的III型效应体来促进几种寄主植物的病害。中国科学(d辑:地球科学)2006;103(39):14620-5。
- 31.
李lq,潘d,陈h,张l,谢wj。F-Box蛋白FBXL2通过泛素介导的Forkhead盒M1的降解抑制胃癌增殖。费用。2016; 590(4):445-52。
- 32。
Chen BB,Glasser Jr,Coon Ta,Mallampalli RK。SKP-CULLIN-F BOX E3连接酶组分FBXL2 ubiquitinate Aurora B抑制肿瘤发生。细胞死亡者。2013; 4:E759。
- 33。
Tosto G,Fu H,Vardarajan BN,Lee JH,Cheng R,Reyes-Dumeyer D,Lantigua R,Medrano M,Jimenez-Velazquez Iz,Elkind Ms,等。F-Box / LRR重复蛋白7是与阿尔茨海默病相关的遗传相关。ANN CLIN TRACKEN TOIL NEUROL。2015; 2(8):810-20。
- 34。
一种植物NLR复合物通过与另一种NLR的自身免疫风险变异的异构体关联而激活。咕咕叫医学杂志。2017;27(8):1148 - 60。
- 35。
Takken Fl,Albrecht M,Tameling Wi。抗性蛋白质:植物防御分子交换机。CurrOp植物BIOL。2006; 9(4):383-90。
- 36。
Bentham A,Burdett H,Anderson Pa,Williams SJ,神户B. Animal NLRS为植物NLR功能提供了结构洞察力。Ann Bot。2017; 119(5):827-702。
- 37.
结构相似的NLR蛋白在植物中的功能多样化。植物科学。2018;269:85 - 93。
- 38.
赵Y,翁Q,宋Ĵ,马H,袁Ĵ,董Z,在谷子NBS-LRR编码抗性基因的刘Y.生物信息学分析。生化遗传学。2016; 54(3):232-48。
- 39.
Zhu X,Lu C,Du L,Ye X,Liu X,Coulles A,Zhang Z.麦芽菌Nb-LRR基因Tarcr1是对坏养殖真菌病原体Rhizoctonia casia的宿主防御反应所必需的。植物Biotechnol J. 2017; 15(6):674-87。
- 40。
邢林,胡鹏,刘军,Witek K,周胜,徐建军,周伟,高磊,黄震,张锐,等。毛萼藻Pm21编码一个CC-NBS-LRR蛋白,具有抗小麦白粉病的能力。摩尔。2018;11(6):874 - 8。
- 41.
Li X,张Y,YIN L,Lu J.过表达病原体诱导的葡萄曲线TIR-NB-LRR基因VARGA1增强了尼古利亚纳·斯坦姆亚洲疾病抗病和干旱和耐盐性和耐药性。原生质。2017; 254(2):957-69。
- 42.
杨旭,何华,王敏,郭鹏,王勇,庞军,董勇,冯旭,王胜,等。转基因大豆中GmKR3基因的过表达可使大豆抗多种病毒。acta botanica sinica(云南植物学报),2019;49(1):93 - 97。
- 43.
庄MF,倪HF,杨族,舒SL,赖斯,江益。台湾Neoscytalidium Dimidiatum的Pitaya(Hylocereus Undatus和H. polyrhizus)的首发腐败溃疡病的第一报告。植物DIS。2012; 96(6):906。
- 44。
徐敏,彭勇,齐昭,颜智,杨林,何明东,李庆新,刘春林,阮永忠,魏淑生,等。引起火龙果溃疡病的新竹孢子虫的鉴定。植物学报。2018;47(5):547-53。
- 45。
徐敏,刘春林,罗静,齐志,严志,付勇,魏绍生,唐华。二半茎火龙果溃疡病的转录组新生分析。BMC基因组学,2019;20(1):10。
- 46。
Tamura K,SteCher G,Peterson D,Filipski A,Kumar S. Mega6:分子进化遗传学分析6.0版。mol Biol Evol。2013; 30(12):2725-9。
- 47。
Schallus T, Jaeckh C, Feher K, Palma AS, Liu Y, Simpson JC, Mackeen M, Stier G, Gibson TJ, Feizi T,等。麦芽素:一种新的内质网碳水化合物结合蛋白,是蛋白质n -糖基化早期阶段的一个候选角色。中国生物医学工程学报。2008;19(8):3404-14。
- 48。
罗伯特 - Seilaniantz A,纳瓦罗L,巴里R,琼斯JD。病理激素失衡。CurrOp植物BIOL。2007; 10(4):372-9。
- 49.
植物先天免疫中富含亮氨酸重复结构域:丰富的可能性。细胞Microbiol。2009;11(2):191 - 8。
- 50。
康UB,玛托贾。富含亮氨酸的重复激酶2和帕金森病。蛋白质组学。2017; 17:1-2。
- 51。
Hugot JP,Chamaillard M,Zouali H,Lesage S,Cezard JP,Belaiche J,Almer S,Tysk C,O'Morain CA,Gassull M等人。NOD2幼亮的重复变体与克罗恩病的敏感性的关系。自然。2001; 411(6837):599-603。
- 52。
Dangl JL,琼斯JD。植物病原体和综合防御反应,感染。自然。2001; 411(6839):826-33。
- 53.
Forsthoefel NR,道TP,弗农DM。PIRL1和PIRL9,编码新的植物特有的家族富含亮氨酸重复蛋白的成员,是孢子分化成花粉是必不可少的。Planta。2010; 232(5):1101至1114年。
- 54.
鸟居骨。植物中富含亮氨酸重复受体激酶的结构、功能和信号转导途径。Int Rev Cytol. 2004; 234:1-46。
- 55.
Chaparro-Garcia A,Wilkinson Rc,Gimenez-Ibanez S,Findlay K,Coffey MD,Zipfel C,Rathjen JP,Kamouns,Schornack S.基底抗性的受体样激酶Serk3 / Bak1是基础抗性的植物植物植物植物尼加罗尼亚州宾夕法尼亚州的infestans。Plos一个。2011; 6(1):E16608。
- 56。
Clark Se,玛雅·梅耶托斯em运行MP。Clavata1,拟南芥的分型和花卉发育调节因子。发展。1993; 119(2):397-418。
- 57。
郑志强,陈志强,陈志强。拟南芥CLAVATA2基因编码一个稳定CLAVATA1受体样激酶所需的受体样蛋白。植物细胞。1999;11(10):1925 - 34。
- 58。
Rojo E,Sharma VK,Kovaleva V,Raikhel NV,Fletcher JC。CLV3本地化为细胞外空间,在那里它激活拟南芥Clavata干细胞信号通路。植物细胞。2002; 14(5):969-77。
- 59。
刘文,刘j,triplett l,lech je,wang gl。对细菌和真菌病原体的大米先天免疫的新洞察。Annu Rev phytopathol。2014; 52:213-41。
- 60。
李茜,权茜。SA信号如何连接Flg22响应?植物信号学报。2014;9(11):e972806。
- 61。
C,MOU Z.水杨酸及其在植物免疫中的功能。J Intent Plant Biol。2011; 53(6):412-28。
- 62。
Aarts N, Metz M, Holub E, Staskawicz BJ, Daniels MJ, Parker JE。抗病基因对EDS1和NDR1的不同需求决定了拟南芥中至少有两条R基因介导的信号通路。中国科学(d辑:地球科学)1998;95(17):10306-11。
- 63。
Kim Sy,Shang Y,Joo Sh,Kim Sk,Nam Kh。BAK1的过度表达导致水杨酸积累和细胞死亡对照基因的放松管制。Biochem Biophys Res Communce。2017; 484(4):781-6。
- 64。
Ahmad P,Rasools,Gul A,Sheikh Sa,Akram Na,Ashraf M,Kazi Am,Gucel S. Jasonates:压力耐受性的多功能作用。前植物SCI。2016; 7:813。
- 65.
张X,徐男,竹林Y,神谷浩Y,黎曼男,尼克P.茉莉由PAMP flg22诱导而不是诱导细胞死亡的诱导的Harpin在葡萄沙地葡萄。原生质。2017; 254(1):271-83。
- 66.
董T,Park Y,Hwang I. Asscisic acid:生物合成,灭活,同性恋和信号传导。散文生物化学。2015; 58:29-48。
- 67.
李y,王c,刘x,宋j,李h,sui z,张m,方s,chu j,xin m等。Up-Chrencateys通过促进细胞膨胀促进细胞膨胀有助于种子萌发杂种优势。J Exp Bot。2016; 67(9):2889-900。
- 68。
杨W,张W,王X. ABA信号的翻译后控制:蛋白质磷酸化和泛素化的作用。植物Biotechnol J. 2017; 15(1):4-14。
- 69。
宁阳,刘伟,王光良。作物的免疫平衡与产量。植物学报,2017;22(12):1069-79。
- 70.
Grabherr Mg,Haas Bj,Yassour M,Levin JZ,Thompson Da,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q等。来自RNA-SEQ数据的全长转录组件没有参考基因组。NAT BIOTECHNOL。2011; 29(7):644-52。
- 71.
ertea g,huang x,梁f,安东尼克斯库v,苏丹娜r,karamycheva s,lee y,white j,cheung f,parvizi b等。TIGR基因指数聚类工具(TGICL):用于快速群集大型EST数据集的软件系统。生物信息学。2003; 19(5):651-2。
- 72。
李斌,杜威出版社。RSEM:从有或没有参考基因组的RNA-Seq数据中准确的转录本定量。BMC生物信息学。2011;12:323。
- 73。
白色ej,venter m,hiten nf,汉堡jt。改性的十六烷基二甲基溴化物方法改善了鲁棒性和多功能性:植物RNA提取的基准。Biotechnol J. 2008; 3(11):1424-8。
- 74。
冯霞,郭丽,金涛。火龙果家政基因actin和UBQ的克隆与序列分析。贵州农业科学,2013;41(9):4。
确认
感谢海南大学邓永川教授为我们提供的实验帮助。
资金
这项工作得到了海南大学世界第一级学科的支持(RZZX201904),中国农业和农村农村资源保护项目(18190033-1。Pitaya的种质保护),作物科学研究生创新海南大学热带农业与林业学院项目(ZWCX2018007)。该资助者在研究的设计,集合,分析和解释方面没有作用,以及编写手稿。
作者信息
隶属关系
贡献
TH*构思了这项研究并参与了所有实验的设计。HJQ*参与了实验设计,并在研究过程中提供了很好的思路,包括手稿的撰写。XM进行qRT-PCR分析,统计分析,撰写稿件。LCL进行RNA提取、qRT-PCR验证和统计分析。FY、LZW、GPY进行了生物信息学研究。XR, CY, WSS参与了实验的数据分析和讨论。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
从海南省莱昂乡村田园果园获得权限,用于本研究中使用的采样和实验。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1提议信息1:
所有272个基因的信息。
附加文件2 Supplenmentary信息2:
233个LRR相关基因CDS最长的序列特征。
附加文件3提议信息3:
用于在稿件的基因引物。
补充信息4:
各数据库的序列均为LRR家族基因。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
徐敏,刘春林。傅,Y。等等。Pitaya的分子表征及表达分析(Hylocereus polyrhizus.)生命值LRR基因对Neoscytalidium Dimidiatum.感染。BMC植物杂志20,160(2020)。https://doi.org/10.1186/s12870-020-02368-6
已收到:
接受:
发表:
关键词
- 火龙果
- 溃疡病
- Neoscytalidium Dimidiatum.
- 转录组
- 富含亮氨酸 - 重复基因
- 表达分析
- 中存在