- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
盐生大豆的盐适应性(gydF4y2Ba甘氨酸大豆gydF4y2Ba)涉及光系统协调gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba155gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
甘氨酸大豆gydF4y2Ba黄豆是一种盐生大豆,原产于黄河三角洲盐碱地。光系统I (PSI)的性能以及光系统II (PSII)与PSI之间的相互作用尚不清楚gydF4y2Ba甘氨酸大豆gydF4y2Ba在盐胁迫下。本研究旨在探讨植物的盐适应性gydF4y2Ba甘氨酸大豆gydF4y2Ba在光系统协调方面。gydF4y2Ba
结果gydF4y2Ba
盆栽gydF4y2Ba甘氨酸大豆gydF4y2Ba与栽培大豆一起暴露在300 mM NaCl中9天,gydF4y2Ba大豆gydF4y2Ba,作为对照。盐胁迫下PSII的最大光化学效率(Fv/Fm)和PSI (gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba)显著降低,而PSI和PSII反应中心蛋白的损失gydF4y2Ba大豆gydF4y2Ba,较早的下降表明PSI脆弱性较大gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba在820 nm调制反射瞬态中比Fv/Fm和降低PSI氧化。相反,PSI稳定性定义为gydF4y2Ba甘氨酸大豆gydF4y2Ba,因为gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba和PSI反应中心蛋白丰度不受盐胁迫的影响。叶片叶绿体超微结构和脂质过氧化均未受影响gydF4y2Ba甘氨酸大豆gydF4y2Ba在盐胁迫下。抑制PSII受体侧的电子流有助于通过限制电子流到PSI来保护PSI,这似乎是一种积极的反应gydF4y2Ba甘氨酸大豆gydF4y2Ba由于盐胁迫后恢复迅速。相反,PSI稳定性有助于防止PSII光抑制,因为PSI失活的模拟反馈抑制导致盐胁迫下Fv/Fm大幅下降。相反,PSI失活通过抑制PSII受体侧提高PSII激发压力,并加速PSII光抑制gydF4y2Ba大豆gydF4y2Ba的正相关和负相关gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba其效率是电子分别超过初级醌和PSII激发压力。gydF4y2Ba
结论gydF4y2Ba
因此,依赖于PSI稳定性和PSII受体侧快速反应的光系统协调有助于防御盐诱导的光合器官氧化应激gydF4y2Ba甘氨酸大豆gydF4y2Ba.光系统相互作用应被认为是盐生大豆的盐适应机制之一。gydF4y2Ba
背景gydF4y2Ba
在世界范围内土地退化的背景下,为未来不断增长的人口提供足够的食物是一个巨大的挑战。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].土壤盐渍化是土地退化的一种主要形式,对可持续农业生产构成严重威胁。灌溉农田常因灌溉施肥不合理而出现二次盐碱化,而一次盐碱化的盐碱地大面积分布在沿海和内陆干旱区[gydF4y2Ba1gydF4y2Ba].与单一土壤改良相比,生物盐农业已被提出作为管理盐碱地的一种环境友好的方法[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].盐生作物是重要的种质资源,除直接在盐碱地种植外,还可通过传统杂交或基因转化培育耐盐新基因型。但是,最好事先弄清盐生植物适应盐胁迫的生理机制。gydF4y2Ba
盐胁迫通过诱导渗透胁迫和离子毒性扰乱植物代谢,抑制植物生长,作为盐诱导的次生胁迫,常对生物大分子产生氧化损伤[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].相应地,植物也进化出了一些防御机制,如根钠gydF4y2Ba+gydF4y2Ba排除,渗透压合成和抗氧化诱导。这些防御机制通常在盐生植物中更为有效,此外,盐生植物为了在盐碱地生存,还存在着一些特殊的防御行为,如腺体分泌盐和盐在液泡中积累作为渗透剂[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].植物的生存和生长在很大程度上取决于光合作用。光合作用对盐胁迫非常敏感,光合能力似乎是区分植物耐盐性的一个可行标准[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].总的来说,气孔对光合作用的限制最初是由盐诱导的渗透胁迫引起的,抑制暗酶过程可进一步降低COgydF4y2Ba2gydF4y2Ba固定(gydF4y2Ba17gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].因此,叶绿体中的激发压力可能升高,从而引起光系统光抑制,产生过多的ROS [gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].目前,盐生植物的研究主要集中在盐诱导光系统II (PSII)光抑制方面,而盐生植物一般具有较高的PSII光化学容量和COgydF4y2Ba2gydF4y2Ba盐胁迫下糖系植物的同化速率[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].但盐生植物中包括反应中心、给体和受体电子载体的PSII组分在盐胁迫下是否具有均匀的响应尚不清楚。gydF4y2Ba
迄今为止,人们对盐胁迫下光系统I (PSI)的研究还非常有限,更不用说PSII和PSI之间的相互作用了[gydF4y2Ba16gydF4y2Ba].在我们最近的研究中,PSI被证明是盐胁迫下某些糖植作物的关键光抑制位点[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].与PSII不同,PSI很难修复受损。gydF4y2Ba22gydF4y2Ba].PSI光抑制可通过反馈抑制电子传递增强PSII激发压力,加重PSII光抑制[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].因此,在对非生物胁迫适应性较弱的敏感植物品种或品种中发现了PSI失活[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].相反,PSII光抑制限制电子向PSI的捐赠,可以通过在PSI受体侧的meler反应减少ROS的产生来防止PSI光抑制[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].因此,PSII和PSI的协同在保护整个光合系统中起着重要作用。盐生植物除了具有较强的离子毒性和渗透胁迫防御能力外,还能有效耗散叶绿体中的激发能,清除ROS,保护PSII免受氧化损伤,盐生植物在盐胁迫下PSII的光抑制作用很少报道[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].值得注意的是,PSII的稳定性增加了盐生植物PSI氧化损伤的可能性,特别是在长期重度盐胁迫下,CO含量大幅下降gydF4y2Ba2gydF4y2Ba同化。迄今为止,盐生植物在盐胁迫下PSII和PSI的协同作用尚未见报道,盐生植物是否通过PSII的灵活响应来保护PSI免受光抑制尚不清楚。gydF4y2Ba
野生大豆是提高栽培大豆环境适应性的宝贵种质资源。gydF4y2Ba甘氨酸cyrtolobagydF4y2Ba是一种原产于澳大利亚海滩盐碱地的野生大豆品种,一系列研究表明它在抑制钠gydF4y2Ba+gydF4y2Ba聚积、光合活性、抗氧化活性、绕PSI循环电子流和激发能量耗散[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].在中国,盐生大豆gydF4y2Ba甘氨酸大豆gydF4y2Ba,生长于黄河三角洲沿海盐碱地,与gydF4y2Ba甘氨酸cyrtolobagydF4y2Ba,gydF4y2Ba甘氨酸大豆gydF4y2Ba在盐胁迫下还能有效延缓有毒离子的积累,保持较高的光合活性[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba].在最近的一项研究中,我们系统地说明了耐盐性gydF4y2Ba甘氨酸大豆gydF4y2Ba从根系离子通量、抗氧化系统、渗透调节和光合作用等方面[gydF4y2Ba14gydF4y2Ba].然而,光合作用分析主要集中在盐生大豆在盐胁迫下的气体交换特性,PSII耐盐性仅由PSII最大光化学效率(Fv/Fm)无明显变化来定义。Fv/Fm不能反映PSII组分的异质行为[gydF4y2Ba39gydF4y2Ba],且盐生大豆在盐胁迫下PSI的表现以及PSII与PSI之间的协调性尚不清楚。本研究重视光合系统性能和光合电子传递,旨在深入揭示植物的盐适应性gydF4y2Ba甘氨酸大豆gydF4y2Ba通过阐明光系统的协调。本研究对大豆耐盐性的研究具有重要意义,并可为大豆种质资源的改良提供参考。gydF4y2Ba
结果gydF4y2Ba
气体交换、电子传递速率和PSII激发压力gydF4y2Ba
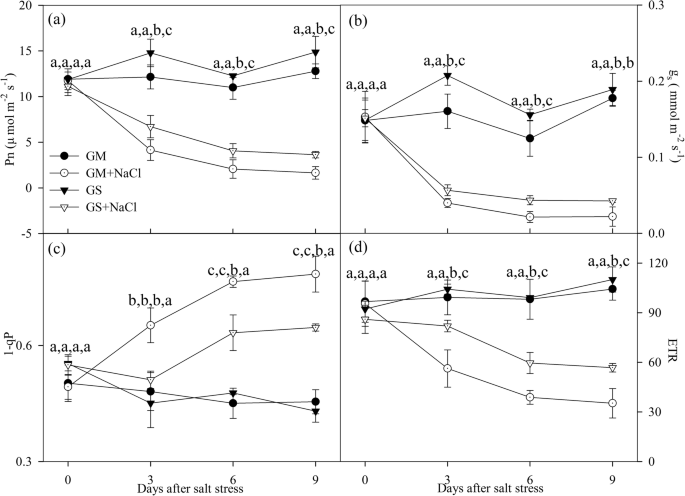
光合速率(Pn)、气孔导度(ggydF4y2Ba年代gydF4y2Ba)和PSII电子传递速率(ETR)显著降低gydF4y2Ba甘氨酸大豆gydF4y2Ba而且gydF4y2Ba大豆gydF4y2Ba在盐胁迫下,盐浓度下降幅度更大gydF4y2Ba大豆gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Baa, b, d).盐胁迫下PSII激发压力(1-qP)显著提高35.6%gydF4y2Ba大豆gydF4y2Ba第3天,第9天增幅达到72.5%(图;gydF4y2Ba1gydF4y2Bac).盐胁迫6 d后,1-qP显著增加gydF4y2Ba甘氨酸大豆gydF4y2Ba,第9天增加50.3%(图;gydF4y2Ba1gydF4y2Bac)。gydF4y2Ba
光合速率(Pn,gydF4y2Ba一个gydF4y2Ba),气孔导度(ggydF4y2Ba年代gydF4y2Ba,gydF4y2BabgydF4y2Ba), PSII激发压力(1-qP,gydF4y2BacgydF4y2Ba)和PSII电子传递速率(ETR,gydF4y2BadgydF4y2Ba)gydF4y2Ba大豆gydF4y2Ba(GM,圈)和gydF4y2Ba甘氨酸大豆gydF4y2Ba(GS,三角形)暴露在0(封闭符号)和300 mM(开放符号)NaCl下。图中数据为5次重复的平均值(±SD)。不同字母表示GS、GM、GS + NaCl和GM + NaCl的差异显著gydF4y2BaPgydF4y2Ba< 0.05gydF4y2Ba
促使叶绿素gydF4y2Ba一个gydF4y2Ba荧光(PF), 820 nm调制反射瞬态(MR)和延迟叶绿素gydF4y2Ba一个gydF4y2Ba荧光(DF)gydF4y2Ba
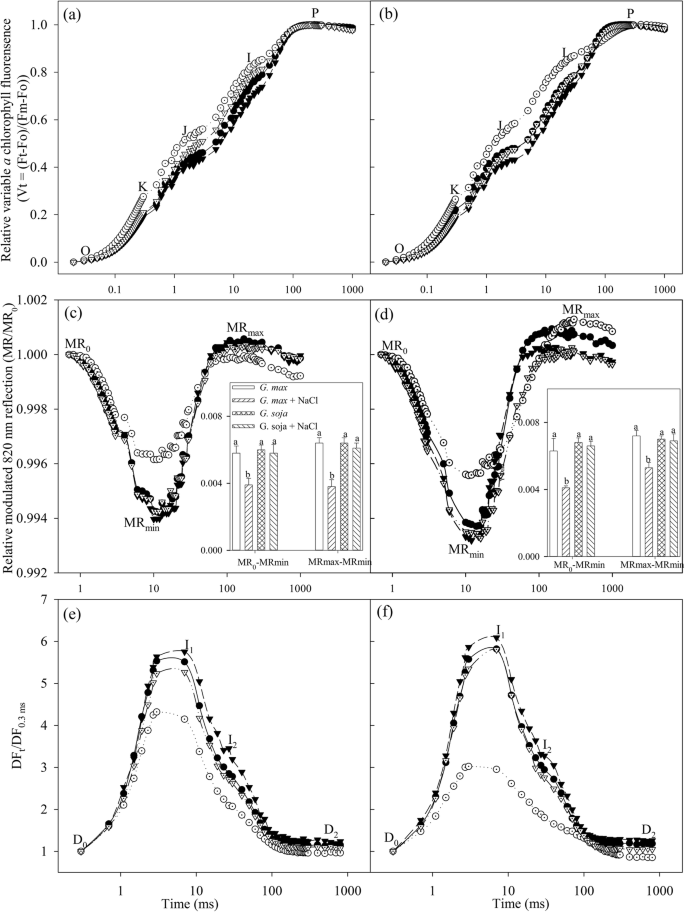
若还原醌(QgydF4y2Ba一个gydF4y2Ba)和质体醌(PQ)被抑制,J和I阶会出现[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].盐胁迫3 d后,J和I步长明显升高gydF4y2Ba大豆gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Baa),在盐胁迫的第9天,J台阶和I台阶的升高幅度增大(图2)。gydF4y2Ba2gydF4y2Bab),说明PQ在Q之外发生了PSII侧的再氧化和电子转移gydF4y2Ba一个gydF4y2Ba被抑制了。K阶跃通常发生在300 μs左右,这是由于PSII供体侧OEC的损伤[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].盐胁迫3 d后,PSII供体侧受损gydF4y2Ba大豆gydF4y2Ba根据K阶跃的出现(图;gydF4y2Ba2gydF4y2Baa).相对而言,盐胁迫导致J和I阶跃升高较小,而K阶跃没有变化gydF4y2Ba甘氨酸大豆gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Baa、b)。gydF4y2Ba
瞬时叶绿素a荧光gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,调制820 nm反射gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,和延迟叶绿素a荧光gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba在gydF4y2Ba大豆gydF4y2Ba(圆圈)和gydF4y2Ba甘氨酸大豆gydF4y2Ba(三角形)暴露在0(封闭符号)和300 mM(开放符号)NaCl下3天(左面板)和9天(右面板)。O, K, J, I和P表示叶绿素的具体步骤gydF4y2Ba一个gydF4y2Ba荧光瞬态。先生gydF4y2Ba0gydF4y2Ba为红光照明开始时820 nm调制反射值(0.7 ms,第一次可靠的MR测量)。先生gydF4y2Ba0gydF4y2Ba-MRmin和MRmax-MRmin分别为PSI氧化和再还原振幅。MR数据gydF4y2Ba0gydF4y2Ba-MRmin和MRmax-MRmin表示5个重复的平均值(±SD),误差条上不同字母表示在gydF4y2BaPgydF4y2Ba< 0.05。I1, I2, D2是否表示延迟叶绿素的起始点,第一个(7 ms)和第二个(50 ms)最大峰值和最小点gydF4y2Ba一个gydF4y2Ba荧光曲线。DFgydF4y2Ba0.3毫秒gydF4y2Ba是初始微秒延迟荧光信号在0.3 ms。信号在对数时间尺度上绘制,每条曲线是5次重复的平均值gydF4y2Ba
MR信号由MR/MR表示gydF4y2Ba0gydF4y2Ba比率,其中MRgydF4y2Ba0gydF4y2Ba是光化照明开始时的值(0.7 ms)。随着MR/MR的降低,PSI氧化开始gydF4y2Ba0gydF4y2Ba先生gydF4y2Ba0gydF4y2Ba到MR瞬态的最小值(MRmin),随后MR/MR增加gydF4y2Ba0gydF4y2Ba达到最大值(MRmax)表示PSI再次降低。MR瞬态变化显著,MR显著降低gydF4y2Ba0gydF4y2Ba-MRmin和MRmax-MRmin ingydF4y2Ba大豆gydF4y2Ba盐胁迫下(图;gydF4y2Ba2gydF4y2Bac, d),表明PSI氧化和再还原都受到了负面影响。相反,盐胁迫不抑制PSI的氧化和再还原gydF4y2Ba甘氨酸大豆gydF4y2Ba, MR未见明显变化gydF4y2Ba0gydF4y2Ba-MRmin, MRmax-MRmin和MR瞬态(图;gydF4y2Ba2gydF4y2Bac, d).盐胁迫下,DF瞬态进入gydF4y2Bag·马克斯gydF4y2Ba显著抑郁,IgydF4y2Ba1gydF4y2Ba和我gydF4y2Ba2gydF4y2Ba高峰,但我gydF4y2Ba1gydF4y2Ba和我gydF4y2Ba2gydF4y2Ba峰略有下降gydF4y2Ba甘氨酸大豆gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Bae、f)。gydF4y2Ba
免疫印迹分析,PSII性能及最大光化学容量gydF4y2Ba
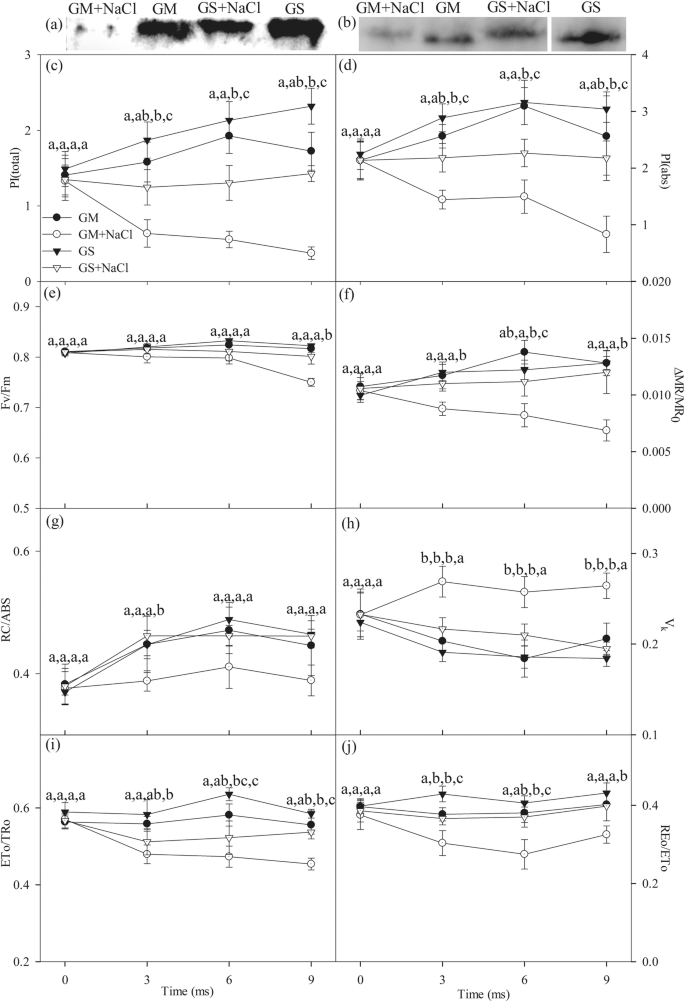
盐胁迫9 d后,PSI反应中心蛋白(PsaA)和PSII反应中心蛋白(PsbA)丰度明显下降gydF4y2Ba大豆gydF4y2Ba而不是gydF4y2Ba甘氨酸大豆gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Baa, b).盐胁迫显著降低了总性能指标(PIgydF4y2Ba总计gydF4y2Ba)和PSII性能指标(PI .gydF4y2Ba腹肌gydF4y2Ba)gydF4y2Ba大豆gydF4y2Ba而且gydF4y2Ba甘氨酸大豆gydF4y2Ba,年的下降幅度更大gydF4y2Ba大豆gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Bac, d).同样地,盐胁迫也导致电子超过Q的概率更大的降低gydF4y2Ba一个gydF4y2Ba(ETo/TRo)和从体系间电子载体到还原PSI端电子受体(REo/ETo)中的gydF4y2Ba大豆gydF4y2Ba比gydF4y2Ba甘氨酸大豆gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Bai, j). PSI的最大光化学容量显著降低(gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba)已在gydF4y2Ba大豆gydF4y2Ba而不是gydF4y2Ba甘氨酸大豆gydF4y2Ba盐胁迫下,盐致Q降低gydF4y2Ba一个gydF4y2Ba还观察到每PSII天线叶绿素(RC/ABS)的还原反应中心gydF4y2Ba大豆gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Baf, g).符合K阶跃升高(图;gydF4y2Ba2gydF4y2Baa, b),盐诱导可变荧光强度在K阶显著增加(VgydF4y2BakgydF4y2Ba)亦在gydF4y2Ba大豆gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Bah).当盐胁迫延长至9 d时,Fv/Fm显著降低gydF4y2Ba大豆gydF4y2Ba,但Fv/Fm降低不显著gydF4y2Ba甘氨酸大豆gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Bae)。gydF4y2Ba
免疫印迹法分析PSI (PsaA)、gydF4y2Ba一个gydF4y2Ba)和PSII (PsbA,gydF4y2BabgydF4y2Ba)的叶子gydF4y2Ba大豆gydF4y2Ba(通用汽车)和gydF4y2Ba甘氨酸大豆gydF4y2Ba300mm NaCl胁迫9天后(GS)。总性能指标(PIgydF4y2Ba总计gydF4y2Ba,gydF4y2BacgydF4y2Ba), PSII性能指标(PI .gydF4y2Ba腹肌gydF4y2Ba,gydF4y2BadgydF4y2Ba), PSII的最大光化学效率(Fv/Fm,gydF4y2BaegydF4y2Ba)及PSI (gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba,gydF4y2BafgydF4y2Ba),每PSII天线叶绿素醌还原反应中心(RC/ABS,gydF4y2BaggydF4y2Ba), K阶荧光强度变化(VgydF4y2BakgydF4y2Ba,gydF4y2BahgydF4y2Ba),电子移动到伯醌以外的概率(ETo/TRo,gydF4y2Ba我gydF4y2Ba)和系统间电子载体的电子被转移到PSI受体端电子受体(REo/ETo,gydF4y2BajgydF4y2Ba)的叶子gydF4y2Ba大豆gydF4y2Ba(圆圈)和gydF4y2Ba甘氨酸大豆gydF4y2Ba(三角形)暴露在0(封闭符号)和300 mM(开放符号)NaCl下。图中数据为5次重复的平均值(±SD)。不同字母表示GS、GM、GS + NaCl和GM + NaCl的差异显著gydF4y2BaPgydF4y2Ba< 0.05。印迹信号从附加文件中的全长印迹图像中裁剪gydF4y2Ba2gydF4y2Ba:图S2和附加文件gydF4y2Ba3.gydF4y2Ba:图S3gydF4y2Ba
光系统性能的恢复gydF4y2Ba
盐胁迫停止后第1天,PIgydF4y2Ba总计gydF4y2BaπgydF4y2Ba腹肌gydF4y2Ba、ETo/TRo和REo/ETogydF4y2Ba甘氨酸大豆gydF4y2Ba迅速恢复到正常水平gydF4y2Ba甘氨酸大豆gydF4y2Ba不经盐处理,说明植物光系统耐盐性高gydF4y2Ba甘氨酸大豆gydF4y2Ba(表gydF4y2Ba1gydF4y2Ba).可能是由于对光系统的不可逆损伤,这些参数没有显示恢复gydF4y2Ba大豆gydF4y2Ba尽管盐胁迫停止(表gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
PSI和PSII之间的协调gydF4y2Ba
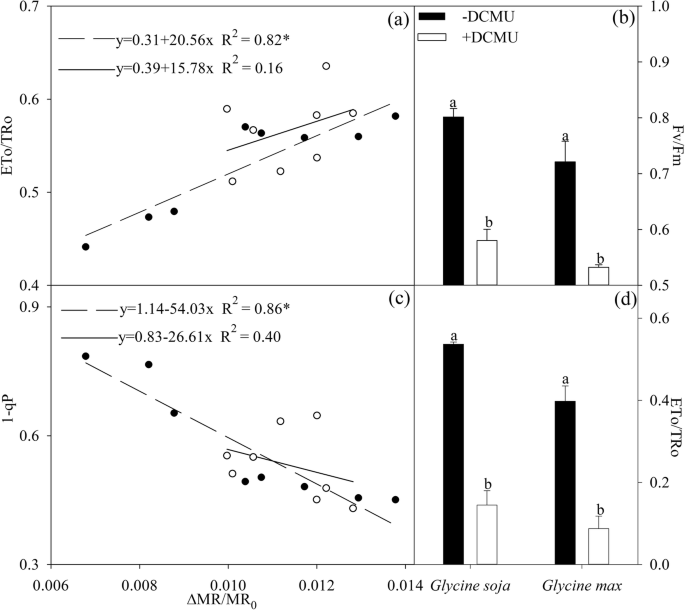
△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba与ETo/TRo呈显著正相关gydF4y2Ba大豆gydF4y2Ba在盐胁迫下,二者呈显著负相关gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba和1-qP(图;gydF4y2Ba4gydF4y2Baa, c).但是,的相关性很低gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba与ETo/TRo和1-qPgydF4y2Ba甘氨酸大豆gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Baa, c). DCMU(阻断Q电子传递的抑制剂)的应用gydF4y2Ba一个gydF4y2Ba−gydF4y2Ba要问gydF4y2BaBgydF4y2Ba−gydF4y2Ba,对Fv/Fm和ETo/TRo的影响更大gydF4y2Ba大豆gydF4y2Ba而且gydF4y2Ba甘氨酸大豆gydF4y2Ba在盐胁迫9天后(图;gydF4y2Ba4gydF4y2Bab, d)。gydF4y2Ba
PSII最大光化学效率的回归分析(gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba),电子有可能移动到伯醌(ETo/TRo,gydF4y2Ba一个gydF4y2Ba)和PSII激发压力(1-qP,gydF4y2BacgydF4y2Ba)gydF4y2Ba大豆gydF4y2Ba(封闭符号)和gydF4y2Ba甘氨酸大豆gydF4y2Ba(开放的符号)。*表示相关性在gydF4y2BaPgydF4y2Ba< 0.01。PSII的最大光化学效率(Fv/Fm,gydF4y2BabgydF4y2Ba)及贸易主任/临时贸易主任(gydF4y2BadgydF4y2Ba)gydF4y2Ba大豆gydF4y2Ba而且gydF4y2Ba甘氨酸大豆gydF4y2Ba3-(3,4-二氯苯基)-1,1-二甲基羰基-amid (DCMU)在300 mM NaCl盐胁迫9天后。在试剂处理中,300 mM NaCl盐胁迫6 d后的叶片在0或70 μM DCMU中黑暗浸泡3 h。Fv/Fm数据(gydF4y2BabgydF4y2Ba)及贸易主任/临时贸易主任(gydF4y2BadgydF4y2Ba)表示5个重复的平均值(±SD),误差柱上不同字母表示DCMU处理与对照组在gydF4y2BaPgydF4y2Ba< 0.05gydF4y2Ba
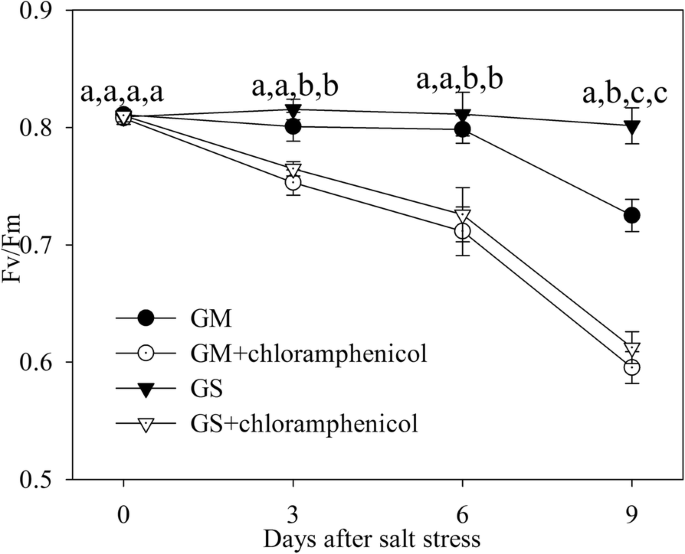
存在氯霉素的Fv/FmgydF4y2Ba
使用D1蛋白从头合成的抑制剂氯霉素来阐明D1蛋白从头合成的差异是否是导致PSII光抑制不平等的原因gydF4y2Ba大豆gydF4y2Ba而且gydF4y2Ba甘氨酸大豆gydF4y2Ba.由于氯霉素的施用,Fv/Fm较大,年下降到相近水平gydF4y2Ba大豆gydF4y2Ba而且gydF4y2Ba甘氨酸大豆gydF4y2Ba盐胁迫(图;gydF4y2Ba5gydF4y2Ba),表明盐胁迫对PSII的负面影响主要是通过阻碍D1蛋白修复来实现的。gydF4y2Ba
脂质过氧化和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba内容gydF4y2Ba
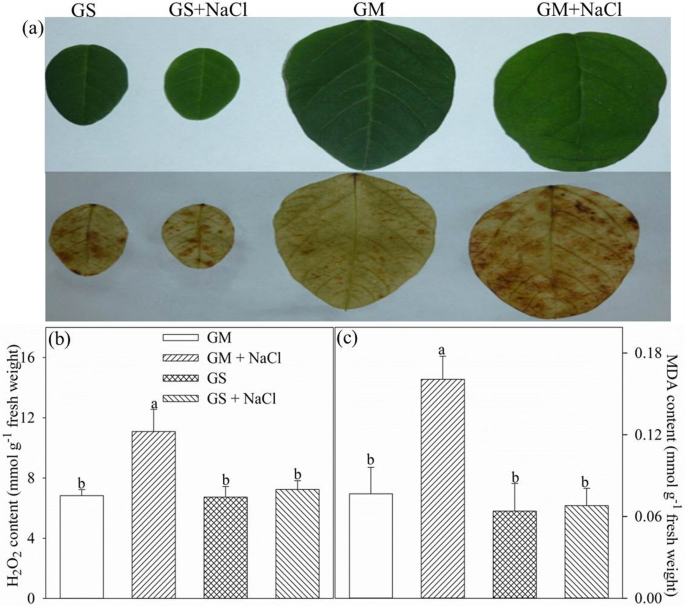
丙二醛(Malondialdehyde, MDA)含量反映了植物组织脂质过氧化的水平。盐胁迫9 d后,MDA和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba叶片中含量显著增加gydF4y2Ba大豆gydF4y2Ba相比之下,叶子没有明显的变化gydF4y2Ba甘氨酸大豆gydF4y2Ba3,3-二氨基联苯胺组织化学染色也显示HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba内容在叶子gydF4y2Ba大豆gydF4y2Ba而不是gydF4y2Ba甘氨酸大豆gydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
组织化学检测HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),丙二醛(MDA,gydF4y2BabgydF4y2Ba)和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba(cgydF4y2Ba)gydF4y2Ba叶中的含量gydF4y2Ba大豆gydF4y2Ba(通用汽车)和gydF4y2Ba甘氨酸大豆gydF4y2Ba300mm NaCl胁迫9天后(GS)。图中数据为5个重复的平均值(±SD),误差柱上不同字母表示盐处理与对照在gydF4y2BaPgydF4y2Ba< 0.05gydF4y2Ba
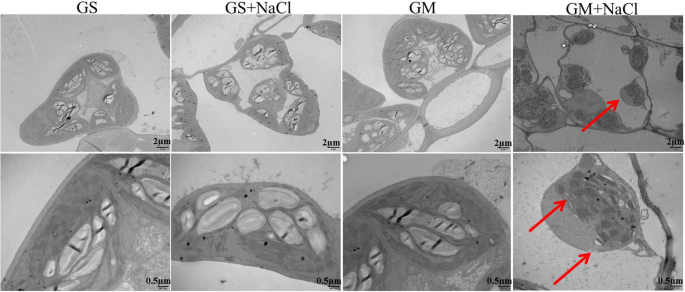
叶片叶绿体的超微结构gydF4y2Ba
盐胁迫9 d后,叶肉细胞和叶绿体超微结构无明显变化gydF4y2Ba甘氨酸大豆gydF4y2Ba,说明其耐盐性高(图;gydF4y2Ba7gydF4y2Ba).然而,随着叶绿体中淀粉颗粒的大量减少,叶绿体有脱离细胞壁的趋势gydF4y2Ba大豆gydF4y2Ba在盐胁迫下,除了叶绿体包膜崩解外,类囊体也被检测到膨胀和松弛(图2)。gydF4y2Ba7gydF4y2Ba).叶绿体超微结构的损伤与盐诱导的光系统性能的严重下降相一致gydF4y2Ba大豆gydF4y2Ba.gydF4y2Ba
讨论gydF4y2Ba
与我们之前的研究一样[gydF4y2Ba14gydF4y2Ba],气孔关闭导致Pn显著降低gydF4y2Ba大豆gydF4y2Ba而且gydF4y2Ba甘氨酸大豆gydF4y2Ba在严重的盐胁迫下(图;gydF4y2Ba1gydF4y2Baa, b) CO的大萧条gydF4y2Ba2gydF4y2Ba同化通过对光合电子传递的反馈抑制,增加了ROS产生的可能性,对光合器官构成了很大的威胁。事实上,脂质过氧化和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba浓度证实了盐诱导的叶片氧化应激gydF4y2Ba大豆gydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Ba).在环境胁迫下,光系统的光抑制通常与叶片脂质过氧化的升高同时发生,值得注意的是,在盐胁迫下,ROS的产生与PSI和PSII光化学能力呈负相关已得到证实[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].因此,不变的脂质过氧化和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba浓度表明,盐诱导的氧化应激对光系统的危害较小gydF4y2Ba甘氨酸大豆gydF4y2Ba比gydF4y2Ba大豆gydF4y2Ba.gydF4y2Ba
一致地,盐诱导的PSII和PSI光抑制在gydF4y2Ba大豆gydF4y2Ba而不是gydF4y2Ba甘氨酸大豆gydF4y2Ba根据Fv/Fm和的变化gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba, PI下降较小gydF4y2Ba总计gydF4y2Ba证实了植物光合装置的良好性能gydF4y2Ba甘氨酸大豆gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Bac, e, f)。特别是盐诱导的叶绿体和类囊体超微结构的破坏,证实了盐对紫花苜蓿光系统性能的严重抑制gydF4y2Ba大豆gydF4y2Ba(无花果。gydF4y2Ba7gydF4y2Ba).PSI的脆弱性通常存在于敏感的植物中,由于其对整个光合装置的威胁,似乎是识别植物对非生物胁迫耐受性的可行标准[gydF4y2Ba28gydF4y2Ba].在本研究中,PSI稳定性定义为gydF4y2Ba甘氨酸大豆gydF4y2Ba在盐胁迫下由于不明显的变化gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba和PsaA丰度(图;gydF4y2Ba3.gydF4y2Baa, f).相比之下,在gydF4y2Ba大豆gydF4y2Ba,表现为盐诱导的减少gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba在PSII发生光抑制前的第3天(图;gydF4y2Ba3.gydF4y2Bae, f).因此,盐生大豆的高盐适应性应包括PSI稳定性。πgydF4y2Ba腹肌gydF4y2Ba综合反映PSII表现,比Fv/Fm更敏感[gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].盐胁迫3天后,PSII表现不仅在gydF4y2Ba大豆gydF4y2Ba但是在gydF4y2Ba甘氨酸大豆gydF4y2Ba, PI的死亡率较低gydF4y2Ba腹肌gydF4y2Ba的PSII稳定性更高gydF4y2Ba甘氨酸大豆gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Bad).盐胁迫下PSII给体侧和受体侧均开始受损,PSII活性反应中心数量下降gydF4y2Ba大豆gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Bag, i, j), PSII反应中心随后因Fv/Fm和PsbA丰度降低而受损(图。gydF4y2Ba3.gydF4y2Bab, e)。相比之下,盐胁迫只影响PSII受体侧gydF4y2Ba甘氨酸大豆gydF4y2Ba,影响比在轻gydF4y2Ba大豆gydF4y2Ba由于ETo/TRo降低较小,J阶跃升高较小(图;gydF4y2Ba2gydF4y2BaA b和gydF4y2Ba3.gydF4y2Bai).与前人研究相似,盐生大豆PSII在盐胁迫下的稳定性得到了验证[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba24gydF4y2Ba],但本研究揭示了PSII受体侧的快速反应。延迟叶绿素gydF4y2Ba一个gydF4y2Ba微秒区荧光主要与Z有关gydF4y2Ba+gydF4y2Ba问gydF4y2Ba一个gydF4y2Ba−gydF4y2BaPS II状态[gydF4y2Ba47gydF4y2Ba].I的出现gydF4y2Ba1gydF4y2BaDF瞬变峰主要是由S的积累引起的gydF4y2Ba3.gydF4y2BaZgydF4y2Ba+gydF4y2BaP680QgydF4y2Ba一个gydF4y2Ba−gydF4y2Ba状态,该状态与PSII给体侧和受体侧的活性反应中心和电子转移能力有关[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].在盐胁迫下,I大幅度下降gydF4y2Ba1gydF4y2Ba证实了PSII组分的损伤,包括反应中心、给体侧和受体侧gydF4y2Ba大豆gydF4y2Ba,而I略有下降gydF4y2Ba1gydF4y2Ba是否与PSII受体侧电子传递的轻度抑制相一致gydF4y2Ba甘氨酸大豆gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Bae, f).总体而言,盐生大豆在盐胁迫下PSI的稳定性和PSII受体侧的快速响应。gydF4y2Ba
根据先前的研究,盐胁迫刺激抗氧化酶达到较高水平gydF4y2Ba甘氨酸大豆gydF4y2Ba比gydF4y2Ba大豆gydF4y2Ba[gydF4y2Ba14gydF4y2Ba].光系统协同除具有较强的抗氧化保护作用外,在对抗光系统光抑制方面也起着重要作用gydF4y2Ba甘氨酸大豆gydF4y2Ba暴露在严重的盐胁迫下。PSI光抑制源于PSI受体侧meler反应产生的ROS氧化铁硫蛋白,PSII的电子流对PSI光抑制至关重要[gydF4y2Ba22gydF4y2Ba].盐诱导CO大幅度下降gydF4y2Ba2gydF4y2Ba同化后,PSII受体侧受限电子流迅速响应到PSI中gydF4y2Ba甘氨酸大豆gydF4y2Ba并且可以通过减少ROS的产生来帮助防止PSI的抑制(图。gydF4y2Ba1gydF4y2Bad).应用DCMU的实验模拟了PSI光抑制对PSII受体侧电子传递的抑制,结果表明PSI光抑制加速了PSII光抑制(图。gydF4y2Ba4gydF4y2Bab, d). PSI活性与PSII激发压力和PSII受体侧电子输运无关gydF4y2Ba甘氨酸大豆gydF4y2Ba的相关分析gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba与1-qP和ETo/TRo(图;gydF4y2Ba4gydF4y2Baa, c).因此,PSI的稳定性有助于通过缓解对电子输运的反馈抑制来防止PSII光抑制的发生gydF4y2Ba甘氨酸大豆gydF4y2Ba在盐胁迫下。相反,PSI脆弱性提高了PSII激发压力gydF4y2Ba大豆gydF4y2Ba盐胁迫下通过诱导PSII受体侧过度还原,两者呈正相关gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba与ETo/TRo呈负相关gydF4y2Ba△gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba和1-qP(图。gydF4y2Ba1gydF4y2Bac和gydF4y2Ba4gydF4y2Baa, c),并最终导致PSII光抑制(图。gydF4y2Ba3.gydF4y2Bae).盐诱导PSII光抑制的差异gydF4y2Ba大豆gydF4y2Ba而且gydF4y2Ba甘氨酸大豆gydF4y2Ba由于氯霉素的存在,Fv/Fm降低到相同的水平(图2)。gydF4y2Ba5gydF4y2Ba).MR瞬态中PSI再还原幅度的下降与PSII失活一致gydF4y2Ba大豆gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Bac, d),因为PSI再还原过程主要依赖于PSII的电子捐赠。尽管PSII失活极大地限制了电子流向PSI,但PSI在MR瞬态中的氧化幅度仍然被抑制(图2)。gydF4y2Ba2gydF4y2Bac, d),验证PSI比PSII的损伤更大。我gydF4y2Ba2gydF4y2BaDF瞬变中的相位与PQ池完全还原前PSII反应中心的电子从还原醌转移到质体醌(PQ)的时间延长有关[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].与I阶跃升高和REo/ETo降低相一致的是,IgydF4y2Ba2gydF4y2Ba也表明PQ的再氧化被抑制,因为对PSI的损伤更大(图。gydF4y2Ba2gydF4y2Bae, f).因此,被动PSII光抑制不能有效防御PSI在体内的氧化损伤gydF4y2Ba大豆gydF4y2Ba在盐胁迫下。然而,盐胁迫也提高了I阶跃,导致REo/ETo和I降低gydF4y2Ba2gydF4y2Ba在gydF4y2Ba甘氨酸大豆gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2BaA b e f和gydF4y2Ba3.gydF4y2Baj), PQ再氧化下降与PSI活性不变似乎是矛盾的。PQ位于细胞色素b6f复合体(cyt b6f)中,通过该复合体,PSII到PSI的电子传递被桥接,可溶性PSI主受体Ferredoxin与cyt b6f的基质位点结合,触发PSI循环电子流[gydF4y2Ba50gydF4y2Ba].PSI循环电子流是植物在非生物胁迫下的重要光保护途径,它减少了对PSI的电子捐赠和ATP的产生,以修复光损伤的PSII [gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].我们推测PQ再氧化的下降是由于cyt b6f与Fd结合增强,促进PSI循环电子流入gydF4y2Ba甘氨酸大豆gydF4y2Ba在盐胁迫下,对超过Q的电子传递产生反馈抑制gydF4y2Ba一个gydF4y2Ba在PSII受体侧。这一推论应在今后的研究中通过探索光系统配位与PSI循环电子流的关系来建立。但是,至少,盐胁迫后ETo/TRo和REo/ETo的快速恢复,支持了PSII和PSI之间限制电子传递的正响应gydF4y2Ba甘氨酸大豆gydF4y2Ba保护光合装置(表gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
结论gydF4y2Ba
综上所述,光合系统协调依赖于PSI的稳定性和PSII受体侧的快速反应,有助于防御盐诱导的光合器官氧化应激gydF4y2Ba甘氨酸大豆gydF4y2Ba.本研究可加深对盐生植物耐盐机理的认识。gydF4y2Ba
方法gydF4y2Ba
植物材料及处理gydF4y2Ba
甘氨酸大豆gydF4y2Ba是一种盐生大豆,原产于中国黄河三角洲沿海盐碱地gydF4y2Ba甘氨酸大豆gydF4y2Ba均采自中国科学院黄河三角洲滨海湿地生态实验站(N37°45′,E118°58′)附近的野生植物。采集的种子经徐华凌教授鉴定,保存在东营农业科学院。本研究中对植物的实验研究,包括植物材料的收集,没有违反任何指导方针或当地法律。采集和使用这种野生大豆不需要特殊许可和伦理批准。gydF4y2Ba大豆gydF4y2Ba大豆是中国主要的栽培大豆,其种子gydF4y2Ba大豆gydF4y2Ba以玉豆8号和中作90052 - 76为亲本进行有性杂交。的种子gydF4y2Ba大豆gydF4y2Ba由山东省农业科学院提供。的种子gydF4y2Ba甘氨酸大豆gydF4y2Ba而且gydF4y2Ba大豆gydF4y2Ba在附加文件中显示gydF4y2Ba1gydF4y2Ba:图S1,种子标本分别保存在东营农业科学院和山东省农业科学院,无凭证编号。gydF4y2Ba
种子萌发和苗木培养的方案在我们之前的研究中已经报道过[gydF4y2Ba14gydF4y2Ba].2017年7月7日,种子发芽了gydF4y2Ba大豆gydF4y2Ba在蒸馏水中浸泡8小时后,将gydF4y2Ba甘氨酸大豆gydF4y2Ba在浓硫酸中浸泡10分钟,去除种子上的硬壳。将种子转移到培养皿中,放置在两张滤纸之间,在25°C的黑暗中发芽,并喷洒Hoagland营养液(pH 5.7)以保持滤纸湿润。Hoagland营养液含有四水合硝酸钙(945mg L)gydF4y2Ba−1gydF4y2Ba), EDTA二钠(37 mg LgydF4y2Ba−1gydF4y2Ba)、硝酸钾(506毫克LgydF4y2Ba−1gydF4y2Ba),七水硫酸亚铁(28mg LgydF4y2Ba−1gydF4y2Ba)、硝酸铵(80 mg LgydF4y2Ba−1gydF4y2Ba)、硼酸(6.2 mg LgydF4y2Ba−1gydF4y2Ba)、碘化钾(0.83 mg LgydF4y2Ba−1gydF4y2Ba),硫酸锰(22 mg LgydF4y2Ba−1gydF4y2Ba),磷酸二氢钾(136毫克LgydF4y2Ba−1gydF4y2Ba),硫酸锌(8.6 mg LgydF4y2Ba−1gydF4y2Ba),硫酸镁(493毫克LgydF4y2Ba−1gydF4y2Ba),钼酸钠(0.25 mg LgydF4y2Ba−1gydF4y2Ba),硫酸铜(0.025 mg LgydF4y2Ba−1gydF4y2Ba)和氯化钴(0.025 mg LgydF4y2Ba−1gydF4y2Ba).种子萌发后,用我们先前研究中报道的相同方法进行培养[gydF4y2Ba14gydF4y2Ba].1个月后,在pH为5.7的Hoagland营养液中加入NaCl进行盐处理。Hoagland营养液(pH, 5.7)的NaCl浓度每天逐渐升高50 mM,达到最终处理浓度(300 mM NaCl)。选取最新完全展开的叶片进行生理生化参数测定。在盐胁迫9 d后,用Hoagland营养液完全浸出培养基中的NaCl,以检测光系统性能的恢复,因为每个罐底都有一个用于浸盐的小孔。gydF4y2Ba
气体交换和调制叶绿素荧光的测量gydF4y2Ba
通过使用配备荧光叶室(6400-40 LCF, Li-Cor)的开放式光合系统(LI-6400XTR, Li-Cor, Lincoln, NE, USA)同时检测气体交换和调制叶绿素荧光参数。温度和COgydF4y2Ba2gydF4y2Ba浓度分别设置在25℃和400 μmol molgydF4y2Ba−1gydF4y2Ba在试管里。Pn和ggydF4y2Ba年代gydF4y2Ba同时被记录。根据先前的研究,还记录了调制的叶绿素荧光,用于计算ETR和1-qP [gydF4y2Ba25gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].gydF4y2Ba
瞬时叶绿素荧光、调制820 nm反射和延迟叶绿素荧光瞬态的测量gydF4y2Ba
使用多功能植物效率分析仪(MPEA, Hansatech, UK),在前1 s的红光照明下同时记录PF、DF和MR瞬态,在随后10 s的远红光照明下仍然检测到MR信号。连续光照下PSI反应中心的氧化还原状态可以通过监测820 nm反射来检测[gydF4y2Ba40gydF4y2Ba].Δ先生/先生gydF4y2Ba0gydF4y2Ba, Fv/Fm, VgydF4y2BakgydF4y2Ba, RC/ABS, ETo/TRo, REo/ETo, PIgydF4y2Ba腹肌gydF4y2Ba和πgydF4y2Ba总计gydF4y2Ba均根据以往研究计算[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba].gydF4y2Ba
光合作用电子传递的所有氧化还原反应都是可逆的,PSII反应中心的反向电子转移和电荷重组导致重新活化的叶绿素延迟荧光发射[gydF4y2Ba47gydF4y2Ba].DF信号以暗间隔记录,以排除光下PF干扰[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba57gydF4y2Ba].本研究在关闭光化光后20 μs采集微秒域DF信号,构建DF瞬态。gydF4y2Ba
MDA和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba含量及组织化学检测gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba
采用硫代巴比妥酸反应法测定丙二醛含量以指示脂质过氧化程度[gydF4y2Ba58gydF4y2Ba].叶片组织(0.5 g)在液氮下研磨,用5 mL 0.1% TCA均质。匀浆以10000倍离心gydF4y2BaggydF4y2Ba4℃加热10 min,收集上清液测定MDA和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba内容(gydF4y2Ba25gydF4y2Ba].用0.1 mg ml真空浸润叶片gydF4y2Ba−1gydF4y2Ba3,3 -二氨基联苯胺在50mm三乙酸溶液(pH, 3.8)中,在室温黑暗中孵育24小时。然后,将叶片浸泡在煮沸的乙醇(80%)中10分钟脱色,并拍照[gydF4y2Ba59gydF4y2Ba].gydF4y2Ba
类囊体膜的分离和western blotgydF4y2Ba
与Yan等人的方法一样。[gydF4y2Ba28gydF4y2Ba],通过蛋白提取、SDS-PAGE凝胶、蛋白转移到聚偏氟乙烯膜、特异性抗体孵育和化学发光信号检测等步骤对PsbA和PsaA进行western blot检测。gydF4y2Ba
叶绿体超微结构观察gydF4y2Ba
类似于Oustric等人。[gydF4y2Ba60gydF4y2Ba],叶片小片(1毫米gydF4y2Ba2gydF4y2Ba),在100 mM磷酸盐缓冲液(pH 7.2)中加入2.5%戊二醛,室温下固定2小时,并用相同的缓冲液清洗。样品在100 mM磷酸盐缓冲液(pH值7.2)中浸泡在1%的渗透酸中,室温下固定4小时,通过分级乙醇系列(50-100%)干燥,并嵌入Spurr的环氧树脂中。用超微切片仪(Leica ultracut R, Germany)获得70 nm的超微切片,用醋酸铀酰和磷酸铅染色后,透射电镜(JEM-1230, Japan)检测叶绿体超微结构。gydF4y2Ba
统计分析gydF4y2Ba
对所有数据采用SPSS 16.0 (SPSS Inc., Chicago, IL, USA)进行单因素方差分析。所示值为五个重复植株的测量平均值,平均值的比较是通过LSD检验确定的。差被认为是显著的在gydF4y2BaPgydF4y2Ba< 0.05。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- Cyt b6f:gydF4y2Ba
-
细胞色素b6f复合物gydF4y2Ba
- 环氧乙烷/有望:gydF4y2Ba
-
一个电子超越初级醌的概率gydF4y2Ba
- ETR:gydF4y2Ba
-
PSII电子输运速率gydF4y2Ba
- 阵线/ Fm:gydF4y2Ba
-
PSII的最大量子产额gydF4y2Ba
- ggydF4y2Ba年代gydF4y2Ba:gydF4y2Ba
-
气孔导度gydF4y2Ba
- MDA:gydF4y2Ba
-
丙二醛gydF4y2Ba
- Pn:gydF4y2Ba
-
光合速率gydF4y2Ba
- πgydF4y2Ba腹肌gydF4y2Ba:gydF4y2Ba
-
PSII性能指标gydF4y2Ba
- πgydF4y2Ba总计gydF4y2Ba:gydF4y2Ba
-
总绩效指标gydF4y2Ba
- PSI:gydF4y2Ba
-
光系统IgydF4y2Ba
- PSII:gydF4y2Ba
-
光系统IIgydF4y2Ba
- RC / ABS:gydF4y2Ba
-
每个PSII天线叶绿素的醌还原反应中心gydF4y2Ba
- PQ:gydF4y2Ba
-
质体醌gydF4y2Ba
- REo /表示:gydF4y2Ba
-
系统间电子载体中的电子被转移到PSI受体侧的末端电子受体的概率gydF4y2Ba
- 问gydF4y2Ba一个gydF4y2Ba:gydF4y2Ba
-
主要醌gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- VgydF4y2BakgydF4y2Ba:gydF4y2Ba
-
K阶荧光强度变化gydF4y2Ba
- △gydF4y2Ba先生/先生gydF4y2Ba0gydF4y2Ba:gydF4y2Ba
-
PSI的最大光化学容量gydF4y2Ba
- ΦPSII:gydF4y2Ba
-
PSII的实际光化学效率gydF4y2Ba
- 1-qP:gydF4y2Ba
-
PSII激发压力gydF4y2Ba
参考文献gydF4y2Ba
Nikalje GC, Srivastava AK, Pandey GK, Suprasanna P.生物盐水农业中的盐生植物:机制、利用和附加值。土地科学进展,2017;gydF4y2Ba
Fedoroff NV, Battisti DS, Beachy RN, Cooper PJM, Fischhoff DA, Hodges CN,可耐福VC, Lobell D, Mazur BJ, Molden D, Reynolds MP, Ronald PC, Rosegrant MW, Sanchez PA, Vonshak A, Zhu JK。从根本上重新思考21世纪的农业。科学。2010;327:833-4。gydF4y2Ba
Panta S, Flowers T, Lane P, Doyle R, Haros G, Shabala S.盐生植物农业:成功的故事。环境科学学报。2014;37(3):344 - 344。gydF4y2Ba
Rozema J, Flowers T.盐碱化世界的生态作物。科学。2008;322:1478 - 80。gydF4y2Ba
文图拉Y, Eshel A, Pasternak D, Sagi M.盐生菌农业的发展:过去和现在。安博。2015;115:529-40。gydF4y2Ba
杨晓明,王晓明,王晓明,等。活性氧和抗氧化机制在植物抗非生物胁迫中的作用。植物化学学报,2010;gydF4y2Ba
侯赛因女士,迪茨KJ。盐胁迫下氧化还原调节机制、活性氧和氧化还原稳态的调节。前沿植物科学,2016;7:548。gydF4y2Ba
杨晓明,杨晓明,陈晓明,等。盐生植物耐盐胁迫下ROS稳态的研究进展。中国科学(d辑),2014;gydF4y2Ba
陈敏,杨震,刘娟,朱涛,魏旭,范宏,王波。盐排除剂在含盐条件下的适应机理及其应用。中国生物化学杂志,2018;gydF4y2Ba
Shabala S, Bose J, Hedrich R.盐膀胱:它们重要吗?植物科学进展(英文版);gydF4y2Ba
宋杰,王波。利用真盐植物了解耐盐性,发展咸化农业:gydF4y2Ba碱蓬莎莎gydF4y2Ba作为一个有前途的模式。安·博。2015;115:541-53。gydF4y2Ba
植物耐盐性与NagydF4y2Ba+gydF4y2Ba传感和传输。2018; 6:215-25。gydF4y2Ba
6个基因型橄榄盐胁迫效应的生理比较分析。Hortscience。2014;49:901-4。gydF4y2Ba
陈鹏,闫凯,邵华,赵松。野生大豆耐盐生理机制研究(gydF4y2Ba甘氨酸大豆gydF4y2Ba)来自中国黄河三角洲:光合作用、渗透调节、离子通量和抗氧化能力。科学通报。2013;8:e83227。gydF4y2Ba
Kalaji HM, Govindjee, Bosa K, Koscielniak J, Golaszewska KZ。盐胁迫对两个叙利亚大麦地方品种光系统II效率和CO2同化的影响环境科学学报,2011;gydF4y2Ba
Stepien P, Johnson GN。拟南芥和盐生芥光合作用对盐胁迫的比较:质体末端氧化酶作为替代电子sink的作用。植物学报。2009;49:1154 - 65。gydF4y2Ba
闫凯,邵海波,邵春春,陈鹏,赵世杰,Brestic M,陈小波。盐渍土壤植物的生理适应机制及其对海岸带盐渍农业可持续发展的意义植物学报。2013;35:2867-78。gydF4y2Ba
闫凯,吴超,张玲,陈霞。四倍体和同源二倍体金银花光合作用和光抑制的对比(gydF4y2Ba金银花粳稻gydF4y2Ba大拇指)在盐胁迫下。植物科学进展(英文版);gydF4y2Ba
杨晓明,杨晓明,杨晓明。不同盐胁迫敏感性橄榄品种光合特性的限制。植物细胞环境,2003;26:595-601。gydF4y2Ba
杨晓华,梁震,文小刚,陆楚明。甜菜碱生物合成的基因工程导致转基因烟草植物光合作用对盐胁迫的耐受性增加。植物分子生物学杂志,2008;66:73-86。gydF4y2Ba
高桥,村田。环境胁迫如何加速光抑制?植物科学进展,2008;13:178-82。gydF4y2Ba
张志强,张志强,等。光系统的光抑制作用。中国生物医学工程学报,2011;gydF4y2Ba
杨勇,闫长青,曹伯波,徐海霞,陈建平,姜达。野生大豆的一些抗盐的光合反应被转移到杂交后代中gydF4y2Ba甘氨酸cyrtolobagydF4y2BaACC547。化学工程学报。2007;29(2):658 - 69。gydF4y2Ba
薛震,赵松,高宏,孙松。野生大豆的耐盐性(gydF4y2Ba甘氨酸大豆gydF4y2Ba摘要。调查。ZYD 03262)在NaCl胁迫下主要由Na决定gydF4y2Ba+gydF4y2Ba在工厂的分布。植物学报。2013;36:61-70。gydF4y2Ba
闫凯,边涛,何伟,韩刚,吕敏,郭敏,陆敏。根脱落酸对菊芋防光吸作用的贡献(gydF4y2Ba向日葵Helianthus tuberosusgydF4y2Bal)在盐胁迫下。中国生物化学杂志,2018;gydF4y2Ba
闫凯,赵松,刘智,陈霞。盐预处理可缓解甜高粱盐致光抑制。植物物理学报。2015;27:19 19 - 29。gydF4y2Ba
张志生,杨超,高勇,张丽兰,范晓磊,刘俊杰。PSI对ROS的敏感性较高,导致黄瓜幼叶光系统耐冷性较低。b型生物。2014; 137:127-34。gydF4y2Ba
闫凯,赵珊珊,崔明,韩刚,温平。洋蓟光合作用与光系统I的脆弱性(gydF4y2Ba向日葵Helianthus tuberosusgydF4y2Bal)暴露于内涝。植物物理与生物化学。2018;125:239-46gydF4y2Ba
闫凯,陈鹏,邵洪波,邵春春,赵世杰,Brestic M.热胁迫下甜高粱光合电子传递过程的解剖。科学通报。2013;8:e62100。gydF4y2Ba
闫凯,陈鹏,邵海波,赵世杰。生物能源作物洋蓟光合电子传递链的研究gydF4y2Ba向日葵Helianthus tuberosusgydF4y2Bal)在热胁迫下进行可持续栽培。作物学报。2013;50:809-15。gydF4y2Ba
Zivcak M, Brestic M, Kalaji HM, Govindjee。日光下和荫凉下大麦叶片的光合作用对强光的响应:荫凉叶中较低的PSII连通性是否与防止过量光照有关?Photosynth res 2014; 119:339-54。gydF4y2Ba
张志生,贾玉军,高勇,张丽玲,李海清,孟QW。黄瓜低温光抑制后PSI恢复的特性(gydF4y2BaCucumis巨大成功gydF4y2Bal .)树叶。足底。2011;234:883-9。gydF4y2Ba
张志生,金丽琴,李宜涛,Tikkanen M,李秋明,艾晓珍,高海燕。紫外线b辐射(UV-B)缓解寒光诱导的PSI光抑制并加速CO的恢复gydF4y2Ba2gydF4y2Ba黄瓜的同化作用(gydF4y2BaCucumis巨大成功gydF4y2Bal .)树叶。科学通报2016;6:34455。gydF4y2Ba
陆凯喜,丁文文,朱硕,姜达。盐诱导之间的差异gydF4y2Ba甘氨酸cyrtolobagydF4y2Ba而且gydF4y2Bag·马克斯gydF4y2Ba抗氧化能力和KgydF4y2Ba+gydF4y2Ba与钠gydF4y2Ba+gydF4y2Ba选择性积累。Crop J. 2016; 4:129-38。gydF4y2Ba
陆kx,杨勇,何勇,姜达。大豆耐盐性与光系统I周围循环电子流的诱导及态跃迁有关。Photosynthetica。2008;46:10-6。gydF4y2Ba
杨勇,姜达,徐海霞,闫长青,郝锐。野生大豆适应盐胁迫需要光系统I周围的循环电子流gydF4y2Ba甘氨酸cyrtolobagydF4y2BaACC547。生物植物。2006;50:586-90。gydF4y2Ba
魏鹏,车斌,沈亮,崔勇,吴松,程超,刘峰,李文伟,于斌,林宏敏。氯通道基因的鉴定与功能表征gydF4y2BaGsCLC-c2gydF4y2Ba野生大豆。BMC植物生物学2019;19:121。gydF4y2Ba
张晓康,周庆华,曹建辉,于宝军。不同的cl - /盐耐受性和nacl诱导的组织和细胞离子通量的变化gydF4y2Ba大豆gydF4y2Ba,gydF4y2Ba甘氨酸大豆gydF4y2Ba以及他们的杂交幼苗。中国农业科学(英文版);2011;gydF4y2Ba
李敏,程丽丽,高勇,蒋道昌,彭涛。大豆PSII的异质性行为(gydF4y2Ba大豆gydF4y2Ba)叶片在不同高温处理下PSII光化学效率相同。中国植物学报。2009;26(2):366 - 366。gydF4y2Ba
李志强,李志强,李志强。豌豆叶片中与叶绿素a荧光上升(OJIP)平行的820nm透射信号的表征植物学报,2003;30:785-96。gydF4y2Ba
张志刚,张志刚,张志刚。甲基紫ologen和二溴百里醌对豌豆叶片的处理揭示了光系统I在Chl a荧光上升OJIP中的作用。生物化学学报2005;1706:250-61。gydF4y2Ba
王志刚,王志刚,王志刚。大麦品种的差异热敏感指数(gydF4y2Ba大麦芽gydF4y2Bal)用叶绿素a荧光OKJIP监测。植物物理与生物化学,2016;gydF4y2Ba
乌卡鲁姆A,戈尔采夫V,斯特拉瑟RJ。通过同时测量瞬时荧光、延迟荧光和820 nm调制反射的动力学,探讨了温度对豌豆植株的影响。PLoS One, 2013;8:10。gydF4y2Ba
Oukarroum A, Bussotti F, Goltsev V, Kalaji HM。光系统I和II的活性氧生成与光化学的相关性gydF4y2Ba浮萍属gibbagydF4y2BaL.盐胁迫下的植物。环境科学学报。2015;39(2):344 - 344。gydF4y2Ba
Zivcak M, Brestic M, Olsovska K, Slamka P.性能指数作为水分胁迫的敏感指标gydF4y2Ba小麦gydF4y2Ba中国环境科学。2008;29(4):349 - 349。gydF4y2Ba
Zivcak M, Olsovska K, Slamka P, Galambosova J, Rataj V, Shao HS, Brestic M.叶绿素荧光性能指标对缺氮对小麦光合功能的影响。植物土壤环境学报。2014;60:210-5。gydF4y2Ba
戈尔采夫五世,扎哈里耶娃一世,切尔涅夫P,斯特拉瑟RJ。光合作用中的延迟荧光。Photosynth res 2009; 101:217-32。gydF4y2Ba
高军,李鹏,马峰,高采采。植物叶片膨大过程的光合特性gydF4y2Ba马吕斯micromalusgydF4y2Ba采用叶绿素a荧光探针,调制820nm反射。b型生物。2014; 137:144-50。gydF4y2Ba
Kalaji HM, Goltsev V, Bosa K, Allakhverdiev SI, Strasser RJ, Govindjee。植物发光的实验体内测量:大卫沃克的视角。Photosynth Res. 2012; 114:69-96。gydF4y2Ba
乔利奥P,乔利奥A. C3植物的循环电子流。生物化学学报。2006;17:362 - 8。gydF4y2Ba
吴欣,舒松,王勇,袁锐,郭松。外源腐胺通过与循环电子流的协同作用缓解盐胁迫对黄瓜光抑制的影响。光子学报,2019;29(3):344 - 344。gydF4y2Ba
孙勇,耿强,杜勇,杨霞,翟华。热胁迫下葡萄叶片光系统I循环电子流的诱导。植物科学学报,2017;26(2):344 - 344。gydF4y2Ba
黄伟,杨玉军,张树生,刘涛。光系统I周围循环电子流促进ATP合成可能有助于光系统II在弱光下的快速修复。植物科学,2018;9:239。gydF4y2Ba
杨晓强,张秋生,张东,冯建新,赵伟,刘志,谭勇。海水高温和光照对鳗草光合电子传递的相互作用(gydF4y2Ba目前gydF4y2Bal .)。植物物理与生物化学。2018;132:453-64。gydF4y2Ba
Maxwell K, Johnson GN。叶绿素荧光-一个实用指南。中国科学(d辑),2000;gydF4y2Ba
闫凯,韩刚,任超,赵松,吴霞,边涛。赤霉病侵染通过诱导苹果幼苗叶片萎蔫降低光系统性能。中国植物科学,2018;9:479。gydF4y2Ba
王志刚,王志刚,王志刚,王志刚,等。复活植物哈戟草干燥和复水过程中荧光和820nm反射变化的体内同步记录。生物化学学报。2010;1797:122。gydF4y2Ba
闫凯,赵松,边玲,陈霞。盐胁迫促进金银花叶片酚类物质的积累(gydF4y2Ba金银花粳稻gydF4y2Ba没有氧化应激的诱导。植物化学学报。2017;12:326 - 326。gydF4y2Ba
张志刚,魏永德,张志刚。HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在植物。HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba白粉病与大麦互作过程中乳突的积累及过敏反应。植物学报,1997;11:1187-94。gydF4y2Ba
Oustric J, Quilichini Y, Morillon R, Herbette S, Luro F, Giannettini J, Berti L, Santini J.长期营养缺乏对四倍体柑橘幼苗超微结构、生理生化水平的影响小于二倍体幼苗。植物物理与生物化学。2019;135:372-84。gydF4y2Ba
确认gydF4y2Ba
我们感谢徐华凌教授为我们提供gydF4y2Ba甘氨酸大豆gydF4y2Ba种子。gydF4y2Ba
资金gydF4y2Ba
本研究由国家重点研发计划(2019YFD1002702)、国家自然科学基金(41201292)、山东省自然科学基金(ZR2017QC005)、烟台市科技创新发展计划(2020MSGY065)、中国科学院重点部署项目(KFZD-SW-113)、作物生物学国家重点实验室开放基金共同资助。山东农业大学(2016KF07)、山东省重点研发计划(2017CXGC0316)。资助者没有参与实验设计、数据收集和分析、手稿准备和发表决定。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
KY设计实验,进行实验和数据分析,撰写和修改稿件。WH和LB参与了实验。ZZ参与实验并帮助修改手稿。XT和MA参与数据分析。LL帮助完善了语言。GH提出了一些关键性的建议并审阅了手稿。所有作者都已阅读了手稿,并批准了最终版本的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1gydF4y2Ba
.gydF4y2Ba甘氨酸大豆gydF4y2Ba而且gydF4y2Ba大豆gydF4y2Ba种子,瞬发叶绿素gydF4y2Ba一个gydF4y2Ba荧光的gydF4y2Ba甘氨酸大豆gydF4y2Ba而且gydF4y2Ba大豆gydF4y2Ba盐处理前,和生长gydF4y2Ba甘氨酸大豆gydF4y2Ba而且gydF4y2Ba大豆gydF4y2Ba在一个人工气候室里。gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
PSII (PsbA)蛋白反应中心蛋白的western blot原始图像gydF4y2Ba大豆gydF4y2Ba(通用汽车)和gydF4y2Ba甘氨酸大豆gydF4y2Ba盐胁迫下(GS)。红色箭头表示图中使用的裁剪信号。gydF4y2Ba3.gydF4y2Bab。gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
蛋白中PSI (PsaA)反应中心蛋白的western blot原始图像gydF4y2Ba大豆gydF4y2Ba(通用汽车)和gydF4y2Ba甘氨酸大豆gydF4y2Ba盐胁迫下(GS)。红色箭头表示图中使用的裁剪信号。gydF4y2Ba3.gydF4y2Ba一个。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
燕,K,何,W,边,L。gydF4y2Baet al。gydF4y2Ba盐生大豆的盐适应性(gydF4y2Ba甘氨酸大豆gydF4y2Ba)涉及光系统协调。gydF4y2BaBMC植物生物学gydF4y2Ba20.gydF4y2Ba155(2020)。https://doi.org/10.1186/s12870-020-02371-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02371-xgydF4y2Ba
关键字gydF4y2Ba
- 叶绿素荧光gydF4y2Ba
- 叶绿体超微结构gydF4y2Ba
- 调制820 nm反射gydF4y2Ba
- 氧化应激gydF4y2Ba
- 光抑制gydF4y2Ba