摘要
背景
凝乳结构是决定菜花凝乳形态的重要特征之一。然而,目前还缺乏分子水平上对这一复杂性状的遗传机制的研究。基因/ qtl负责形态差异之间的今天的豆腐和紧豆腐花椰菜还没有很好地揭示。
结果
在此,我们利用一个普通的紧凝亲本和两个松凝亲本,分别培育了两个双单倍体(DH)群体,分别包括122和79个系。对于每个群体,我们将凝乳结构概念分解为四个参数(基径、茎长、茎角和凝乳固体度),并在两种环境中收集每个参数对应的表型数据。采用Kosambi函数和复合区间映射算法构建连锁图谱,分析与凝乳结构参数相关的qtl。共检测到20个QTL,最小奇似然值(LOD)在2.61 ~ 8.38之间,每个QTL解释的表型方差百分比(PVE)在7.69 ~ 25.10%之间。其中,控制茎秆长度的qtl (qSL。C6-1,卡片。C6–2) and two QTLs controlling curd solidity (qCS.C6–1 and qCS.C6–2) were steadily expressed in both environments. Further, qSL.C6–1, qSL.C6–2, qCS.C6–1 and qCS.C6–4 fell into the same chromosomal region of the reference genome, indicating that these loci are involved in pleiotropic effects or are tightly linked.
结论
目前的研究确定了一系列与凝乳结构参数相关的qtl,这些qtl可能对目前中国广泛种植的松凝菜花的形成有本质的贡献。这些结果可能为深入解读凝乳发育的分子机制和标记辅助选择菜花育种中的凝乳形态铺平了道路。
背景
花椰菜(甘蓝变葡萄孢L.)原产于欧洲沿海地区,是世界上重要的蔬菜作物。凝乳作为花椰菜特有的商品器官,具有丰富的形态变异,已在分子遗传水平上得到了广泛的研究[1].例如,特定的凝乳表型被揭示为由BoCAL基因(2,3.],BoAP1花椰菜凝乳与花椰菜头表型差异的基因决定[4,5],而或编码质体相关蛋白的基因可产生富含β-胡萝卜素的橘凝乳[6].最近,一项基于174份随机选择的花椰菜基因库的全基因组关联研究确定了凝乳相关性状的24个显著关联[7].
花椰菜凝乳最重要的特性之一是坚固性,这主要取决于它的内部结构。紧实型凝乳具有短梗、大梗角和高固形性,而松散型凝乳则相反(附加文件)1:图S1)。基于这些结构上的差异,菜花品种被分为紧凝型和松凝型[8,9].此外,这两种凝乳的健康促进成分及抗氧化能力亦有所不同[10].世界上大部分地区都种植传统的凝乳菜花,而凝乳菜花则主要在中国种植[11].目前中国主要种植的花椰菜,其特点是其长而绿的茎,这在传统的紧凑型菜花中是罕见的,而且其独特的食用品质在中国烹饪中很受欢迎,如炒、烤或热锅[10].据我们所知,花椰菜在中国各地都有种植,已成为重要的蔬菜品种。此外,这种独特的类型已被引入到其他一些东亚/东南亚国家,如越南、泰国和印度,并逐渐被接受。因此,凝乳结构具有植物形态和经济效益的双重重要性[8,9].
虽然凝乳在成熟后会从外围变得松散,但凝乳的中心始终是紧密的,即使在植株抽苔和开花时也是如此。不同品种的凝乳结构存在显著差异。当凝乳刚刚生长出来时,这些差异就已经可以区分了(附加文件1:图S1)。在以往的研究中,凝乳固形度显示出显著的选择效应,并在对紧密亲本和松散亲本的后代进行遗传分析时,认为凝乳固形度受多基因因子数量的支配[12].这一概念已在紧凑和松散品种之间揭示的遗传背景差异中得到部分验证[13].也有人假设,松凝菜花源自初级菜花种质资源,通过对有利于中国烹饪习惯的凝乳特性的严格选择,引入中国[13].然而,人工选择凝乳特征的证据,特别是凝乳结构,基本上促成了今天的松凝花椰菜的形成,是缺乏的。迄今为止,与凝乳结构相关的基因/ qtl还没有很好地揭示。
近年来,基于致密和松散凝乳菜花亲本的DH群体构建了包含2741个SNPs的高密度遗传图谱[11].在本研究中,我们结合另一个DH群体,应用该遗传图谱和群体对菜花凝乳结构qtl进行了分析,旨在更好地理解凝乳发育。
结果
凝乳结构相关参数的表型变异
ID群体的疏松亲本‘DL3203-61’在两种环境下均比致密亲本‘IL4305’(平均BD = 16.58 cm,平均SL = 7.39 cm,平均SA = 0.85,平均CS = 2.88)表现出更大的基径(平均BD = 19.48 cm)、更长的茎秆(平均SL = 9.00 cm)、更小的茎秆角(平均SA = 0.97)和更低的凝乳固结度(平均CS = 1.12)。同样,IZ群体的雄性松凝亲本ZN198的平均BD值为20.92 cm,平均SL值为9.24 cm,平均SA值为0.93,平均CS值为1.75。t检验显示,紧凑型和松散型亲本在所有实验环境中各参数均有显著差异(附加文件)2:表S1)。
表型数据表明,本研究采用的4个参数能有效反映松散凝乳和紧凑凝乳之间凝乳结构的差异。在各种群的DH系中,所有参数均基本呈正态分布。部分DH系在相应亲本外出现值,表明存在基因间相互作用。
两个群体在不同种植季节的凝乳性状均有明显的表型变异。8月播种的亲本和DH系的BD和SL值小于7月播种的亲本和DH系,SA和CS值变化不明显(附加文件)2:表S1),说明种植季节对凝乳大小的影响大于对凝乳质地的影响。SL、SA和CS的广义遗传力范围为0.72至0.98,但对于BD,每个群体的广义遗传力分别仅为0.25和0.30(附加文件)2:表S1)。BD遗传力的遗传力较低,说明该性状受环境因素的影响程度较其他性状大。同一种群中同一参数在不同种植季节间的相关系数为0.79 ~ 0.94 (P< 0.001)。
“ID”群体遗传图谱构建
在' il4305 '和' DL3203-61 '之间共有199个标记存在多态性,多态性比例为8.5%。经连锁分析,173个标记(77个SSRs和96个srap)被分配到9个连锁组(LGs)上。1).根据SSRs的序列,将每个LG固定在参考基因组的同源染色体上(http://brassicadb.org/brad/index.php),并被指定相应的编号(C1-C9)。遗传图谱全长608.3 cM,平均标记间隔3.5 cM。单个LG长度在41.6 ~ 100.7 cM之间,标记量在6 ~ 36个之间。这张图,以下称为“ID图”,用于进行qtl的ID填充扫描。
卡方检验显示,在链接图上的173个标记中,有56个(32.4%)不符合ID群体中预期的1:1等位基因频率(P≤0.05)。这些畸变标记大多集中在C2、C8和C9连锁群的特定区段(附加文件)3.:表S2)。在ID群体中,位于C8和C9位点的标记显示母本(IL4305)基因型比例较高,而位于C2位点的标记显示父本(DL3203-61)基因型比例较高。
QTL定位
在ID居群中,共发现了12个与4个参数相关的qtl。LOD值在2.63 ~ 8.38之间,PVE值在7.69 ~ 25.10%之间1).其中,1个与秸秆长度有关的QTL (qSL.C6-1)和2个与凝乳固形性有关的QTL (qCS. c6 - 1)。C6-1和qCS.C6-2)在两种环境下均可检测到。此外,置信区间qCS。C6-1和qSL。C6-1部分重叠(表1),与SL与CS的高度相关相吻合。值得注意的是,卡片。C6-1 qSA。C6-1, qc。C6-1, qc。C6-1, qc。C6-1位于相同的6号染色体上。
对于IZ群体,在两种环境中共鉴定出8个qtl。LOD值在3.49 ~ 6.99之间,PVE在11.6 ~ 25.06%之间2).其中,一个控制茎长的QTL (qSL.C6-2)稳定存在于两个环境试验的指示数据中。qBD。C1,卡片。C1和qCS。C1在1号染色体上的间隔几乎相同,说明这3个qtl可能是一个多效性位点。同样,卡片。C6-2和qCS。C6-4在6号染色体上也处于相同的区间。
通过ID图与参考基因组比较,将SSR标记FITO276、Na12E01a、FITO032、Ol12E03、FITO333、FITO301定位在6号染色体上。qSL的位点。C6-2和qCS。C6-4定位于6号染色体23992639 ~ 33263090 bp的区间。值得注意的是qSL的位点。C6-2和qCS。IZ图中的C6-4局限于6号染色体30,128,973-34,650,103 bp之间(图2)。2).这些数据表明,来自不同人群的这两个位点可能指向染色体6上的同一个位点/基因芸苔属植物oleracea物种。
讨论
花椰菜的膨大凝乳被认为是受复杂的遗传控制[14].在这里,我们使用了两个DH群体来解剖负责凝乳结构的qtl。与以往的研究一致[12,13],结果表明凝乳结构具有明显的遗传力,提示前期通过遗传改良茎秆长度、茎秆角度来调节凝乳形态的可行性。
同样有趣的是,有几个qtl控制茎长(qSL。C6-1, qSL.C6-2)和凝乳固体度(qCS. 2)。C6-1, qc。C6–4) are probably involved in pleiotropic effects. Similar pleiotropic QTLs were widely found in different species [15,16,17,18].在花椰菜中,也报道了控制早熟性和凝乳大小的qtl的共定位,并被认为是人工选择的结果,以使这两个不同来源的农艺性状重叠[19].然而,秆长、秆角和凝乳固体度似乎是导致凝乳致密性和疏松性差异的主要因素,这三个参数之间也有很强的相关性,在以前的研究中也发现了[20.].因此,本研究中qtl的共定位更有可能指向在松凝菜花驯化改良过程中相关性状的共驯化。本研究中使用的两个群体都采用了同一母本,即来自福建精实菜花品种“神农80”的紧凑自交系“IL4305”。在这两个不同的亲本之间,“ZN198”,一个来自于松凝乳品种“青农65”的DH系,被定义为“典型的松凝乳”。DL3203-61 ',来自欧洲品种' Amazing '的DH后代,代表另一种松凝乳类型,称为'半松凝乳'。在检测到的20个qtl中,qSL。C6-1, qc。C6-1,卡片。C6-2和qCS。C6-4位点位于参考基因组的相似区域,说明该位点广泛存在于不同产地的菜花中,主要通过调控菜花茎长来调控凝乳的固形性。从自然进化的角度来看,松散的凝乳有利于植物开花和结子[12].然而,人工选择往往选择致密凝乳作为储存和运输的需要。因此,豆腐花椰菜的出现可以看作是一种进化倒退。无论如何,凝乳结构qtl的密集分布表明,花椰菜基因组的第6染色体在凝乳固形性驯化中发挥了重要作用。
凝乳的形成是花椰菜生命周期中一个关键而敏感的阶段。凝乳的结构在一定程度上受温度、光照和土壤肥力等环境因素的影响[21].已有研究表明,某些品种的凝乳结构在不同种植季节之间的变化比不同种植年份之间的变化更为明显[22].在本研究中,我们收集了每个测绘群体不同种植季节的表型数据,而不是多年的数据,这被普遍认为是QTL检测可靠性的重要保证。两个DH群体的表型数据显示,7月1日播期推迟至8月1日播期后,凝乳大小(BD和SL)普遍变小,凝乳形状(SA和CS)无明显变化趋势。这可能是由于8月1日播种比7月1日播种在凝乳生长发育期的温度较低,日照时间较短。在两个种群中,有4个qtl (qSL. qtl。C6-1,卡片。C6-2, qc。C6-1和qCS.C6-2)在两个种植季节均可检出,可靠性高。符合qSL的共同本地化。C6-1,卡片。C6-2和qCS。C6-1,我们假设位于这些区域的标记将为标记辅助选择(MAS)在改善凝乳形态,特别是茎长方面提供可靠和强大的工具,无论育种目标是松散凝乳还是致密凝乳。
凝乳结构具有复杂复合的特点。它还包含一系列其他参数,这些参数会影响凝乳的形态,甚至凝乳的重量。例如,一些育种者试图选择一级梗长而粗,次一级梗细、短而多的凝乳,以改善花椰菜的外观、产量、耐储运性。因此,将凝乳结构概念分解为更详细、更可测量的参数,需要更深入的研究。对这些因素的深入研究不仅将为研究凝乳形成的分子机制提供新的见解,而且将为花椰菜育种中凝乳的改良提供有力的工具。
结论
通过使用不同的参数反映凝乳形态的差异,我们证明了凝乳结构在不同群体中是遗传的。共检测到20个qtl, LOD值为2.61 ~ 8.38,PVE值为7.69 ~ 25.10%。在第6号染色体上发现了一个区间,显示了负责茎长和凝乳硬度的qtl的广泛共定位,这表明它在中国广泛种植的现代松凝花菜的分化中起着重要作用。这些结果不仅为人工选择多样化导致不同凝乳结构(紧凑/松散)的不同需求提供了新的见解,而且可能为深入破译凝乳发育的分子机制铺平了道路。该标记对花椰菜凝乳形态的标记辅助选择(MAS)育种具有重要意义。
方法
植物材料和生长条件
本研究使用了两个DH群体。其中一个包括79个DH系(' IZ '群体),由' IL4305 ' × ' ZN198 '杂交发展而来,如Zhao等人所述[11],另包括122个DH系(ID居群),由' IL4305 ' × ' DL3203-61 '组合小孢子培养而成。“IL4305”是由“神农80”培育的具有极致密凝乳的高级自交系,而“ZN198”和“DL3203-61”分别是由“青农65”和“Amazing”培育的具有不同类型凝乳的DH系。3.).“神农80”、“青农65”和“神奇”种子购自温州神路种子有限公司。田间试验在两个不同的种植季节进行(“IZ”在2016年7月和8月播种;海宁县(HN, 30°320 N, 120°410E) 2013年7月和8月播种。每个试验按随机区组设计设2个重复。每行12株,行距50 cm,行距65 cm。
表现型
根据我们以往文献中对紧凝乳与松凝乳表型差异的分析[8],设计了一系列表征凝乳结构的参数,包括基础直径(BD)、凝乳杆长(SL)、凝乳杆角(SA)和凝乳固体度(CS)。BD为沿三个随机方向测量的基径平均值;SL为四个最低分支的平均长度,SA为SL与BD之比(图2)。4).CS由纹理分析仪TA测量的GR指数来分配。TX Plus(稳定微系统,英国),如赵等人所述。[8].SA值越高,茎角越小,CS值越高,凝乳越坚实。对于每次加入,分别采集6个具有代表性的凝乳样本,并在它们可见后20天进行测量。一般来说,在这个种植季节,凝乳会在20天后变得商业化成熟。对6种凝乳的参数数据进行了平均。采用SAS v9.3软件对各参数进行广义遗传力分析。
DNA提取和基因分型
对于ID群体,使用DNeasy植物DNA miniprep试剂盒(Qiagen, Hilden, Germany)收集幼叶,并从20天的幼苗幼叶中提取基因组DNA。使用ND-1000分光光度计(NanoDrop, Wilmington, DE, USA)检测DNA浓度和质量,并在1.0%琼脂糖凝胶上用标准lambda DNA进行电泳。SSR引物共903条[23,24,25](附加文件4:表S3)和144对SRAP引物组合(附加文件5:表S4)分别检测亲本间及子代DH系间的基因型多态性。按照Zhao等人描述的程序进行PCR反应。[13]用于SSR和Mei等。[26]。扩增片段在8%非变性聚丙烯酰胺凝胶中分离,银染色检测[27].
对于IZ群体,根据遗传图谱上的2741个snp,收集亲本和DH系的基因型[11].
QTL定位
JoinMap 4.0的Kosambi函数[28]进行连锁分析,并基于ID群体的多态性标记构建遗传图谱。LOD设置为3.0,最大重组率设置为0.4。
WinQTLCart 2.5 [29]对ID和IZ群体各表型参数进行复合区间映射。统计模型的绘制函数为Kosambi,距离类型为Position,步长为2 cM。LOD的阈值由500个排列确定P= 0.05。QTL的命名原则是在性状缩写前加“q”,缩写后加连锁群号。如果在同一连锁群上有两个或两个以上一个性状的qtl,这些qtl用以下阿拉伯数字区分。例如,“qSL”。C2 - 2”为C2连锁群中第二个控制茎长QTL。
数据和材料的可用性
支持本文结论的数据集包含在这篇发表的文章及其补充信息文件中。“IZ”图中用于QTL分析的测序数据可在另一篇论文中获得(doi:https://doi.org/10.3389/fpls.2016.00334).本研究中产生的所有植物材料均可根据合理要求从作者处获得(Zhenqing Zhao,zhaozq@zaas.ac.cn;Honghui顾,guhh2199@163.com).
缩写
- DH:
-
双单倍体
- 通过:
-
每个QTL解释的表型方差的百分比
- LOD:
-
奇的最小似然
参考文献
- 1.
帕尔默芸苔属植物oleracea以品种特异性方式表达的基因可能编码一种新的植物跨膜受体。植物细胞生理学杂志,2001;42(4):404-13。
- 2.
杜克洛DV, Bjorkman T.分生组织特征基因在凝乳增殖和花起始过程中的表达芸苔属植物oleracea.中国机械工程学报,2008;29(2):344 - 344。
- 3.
杨晓明,王晓明,王晓明,等。拟南芥花椰菜表型的分子生物学基础。科学。1995;267(5197):522 - 5。
- 4.
Kop E P, Teakle GR, Mcclenaghan ER, Lynn JR, King GJ。花椰菜和花椰菜苞片性状的遗传分析。植物科学2003;164(5): 0 - 808。
- 5.
史密斯LB,金GJ。的分布Bocal-a等位基因的芸苔属植物oleracea与菜花凝乳发育和驯化的遗传模型一致。Mol Breed. 2000;6(6): 603-13。
- 6.
卢s, Eck JV, Zhou X, Lopez AB, O'Halloran DM, Cosman KM,等。这种花椰菜或基因编码一种DNAJ半胱氨酸丰富结构域蛋白,该蛋白介导高水平的β-胡萝卜素积累。植物学报。2006;18(12):3594-605。
- 7.
王晓明,王晓明,王晓明,等。花椰菜凝乳相关性状的遗传预测及关联定位。G3:基因,基因组。遗传学。2018;8:707-18。
- 8.
赵忠,顾辉,王娟,盛鑫,余辉。菜花凝乳固体度定量评价方法的发展与比较。中国食品工程学报,2013;19:477 - 82。
- 9.
顾华,赵忠,盛旭,余辉,王杰。松凝花椰菜小孢子培养双单倍体高产研究(芸苔属植物oleraceavar。葡萄孢属).Euphytica。2014;195(3):467 - 75。
- 10.
顾红,王洁,赵忠,盛霞,于红,黄伟。豆腐花椰菜小花的外观、健康成分及抗氧化性能的研究。国际食品杂志,2015;18:392-402。
- 11.
赵忠,顾辉,盛旭,余辉,王杰,黄玲,等。利用特定位点扩增片段测序发现花椰菜全基因组单核苷酸多态性和构建高密度遗传图谱。前沿植物科学,2016;7:393。
- 12.
Nieuwhof M, Garretsen F.花椰菜凝乳的坚固性。Euphytica。1961;10(3):301 - 6。
- 13.
赵忠,顾辉,盛旭,余辉,王洁,赵洁,等。微卫星标记揭示了松凝菜花及其相关品种的遗传多样性和亲缘关系。科学通报。2014;166:105-10。
- 14.
苏珊M,维维安F.花同源基因表达定义发育停滞阶段芸苔属植物oleraceaL.var。葡萄孢属而且italica.足底。1997;201:179 - 88。
- 15.
李国强,李国强,李国强,李国强。两个海侵偏析充足的六倍体RIL群体籽粒锌、铁含量的QTL定位植物科学进展(英文版);
- 16.
李峰,谢娟,朱霞,王霞,赵艳,马霞。水稻生育期与产量性状相关的遗传基础(栽培稻l。)。植物科学前沿,2018;9: 650。
- 17.
王洁,敦旭,石娟,王霞,刘刚,王慧芸苔属植物显著L在两种不同的氮条件下。中国植物科学,2017;8:1709。
- 18.
赵翁雪W,邢Y, X, Y,唐W,王L,等。自然变异ghd7是水稻抽穗期和产量潜力的重要调控因子。中国科学。2008;40(6):761-7。
- 19.
TH Lan, AH Paterson。雕刻凝乳的数量性状位点的比较图谱芸苔属植物oleracea.遗传学。2000;155(4):1927。
- 20.
赵忠,顾辉,盛旭,余辉,王娟,曹娟。利用SSR标记和生长出试验检测松凝菜花杂种的遗传纯度。中国科学(d辑),2012;
- 21.
中晚期花椰菜园艺性状的世代平均分析(芸苔属植物oleraceal . var。葡萄孢属)在喜马拉雅山西部的亚温带条件下。植物育种,2018;137(1):97-108。
- 22.
沙尔玛,辛格PK, Chable V, Tripathi SK.杂交花椰菜的研究进展。新种子。2005;6(2-3):151-93。
- 23.
inigez - luy FL, Voort AV, Osborn TC。开发了一套基于快速循环基因组序列的SSR标记芸苔属植物oleraceal基因型。应用理论与实践。2008;17(6):977-85。
- 24.
罗维AJ,莫尔CL,特里克M,爱德华兹KJ。用于标记和制图应用的微型卫星的高效大规模开发芸苔属植物作物物种。应用理论。2004;108(6):1103-12。
- 25.
Piquemal J, Cinquin E, Couton F, Rondeau C, Seignoret E, Doucet I,等。建造油菜(芸苔属植物显著l) SSR标记的遗传图谱。理论应用,2005;111(8):1514-23。
- 26.
梅娟,丁勇,陆凯,魏东,刘勇,乔迪斯,等。鉴定涉及抗性的基因组区域菌核病sclerotiorum从野生芸苔属植物oleracea.应用理论与实践。2013;26(2):549 - 556。
- 27.
聚丙烯酰胺凝胶中DNA的快速敏感银染色。生物化学。1991;196(1):80-3。
- 28.
Van O. JW: JoinMapW 4.0,用于计算实验群体遗传连锁图谱的软件。荷兰:Kyazma B. V,瓦赫宁根;2006.
- 29.
王珊,Basten CJ,曾志斌。Windows QTL制图器2.5。罗利:北卡罗莱纳州立大学统计系;2006.http://statgen.ncsu.edu/qtlcart/WQTLCart.htm.
确认
不适用。
资金
中华人民共和国科技部重点研发计划项目(2017YFD0101805);政府间国际科技创新合作重点项目(2017YFE0114500);国家自然科学基金(31501768);浙江省科学技术厅农业发展重点项目(2016C02051-5);浙江省农业科学院学科建设(A1)和欧盟地平线2020研究创新计划资助协议No. 774244。资助者在研究设计、数据收集、数据分析、数据解释、手稿写作或发表决定中没有任何作用。
作者信息
从属关系
贡献
ZZ和HG构思并进行实验并撰写手稿;XS, HY, JW和YS参与数据收集和分析。所有作者都对最终稿进行了评论、阅读和批准。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
紧凝乳(左)和松凝乳(右)在不同凝乳发育阶段的剖面。
附加文件2:表S1。
DH群体中各参数的表型表现。
附加文件3:表S2。
在DH群体中,等位基因频率的连锁群区域偏离1:1的比例。
附加文件4:表S3。
用于' ID '连锁图谱构建的SSR启动子。
附加文件5:表S4。
SRAP正向和反向引物序列。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
赵,ZQ。,Sheng, XG., Yu, HF.et al。菜花凝乳结构相关qtl的鉴定。BMC植物生物学20.177(2020)。https://doi.org/10.1186/s12870-020-02377-5
收到了:
接受:
发表:
关键字
- 菜花
- 凝乳体系结构
- 连锁分析
- 遗传图谱
- QTL定位


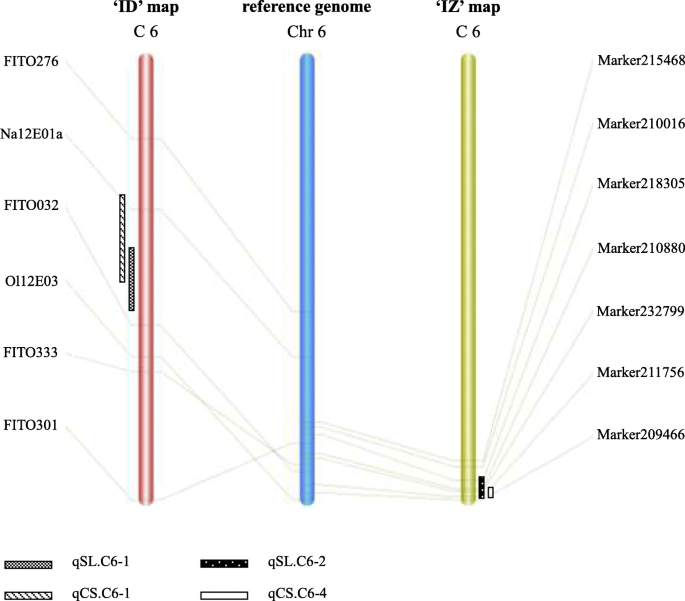
 符号,不同阴影表示对应QTL的置信区间
符号,不同阴影表示对应QTL的置信区间
