摘要
背景
丝裂原活化蛋白激酶(MAPKs)作为MAPKKK-MAPKK-MAPK级联反应的一部分,作为响应各种环境信号的细胞内信号转导途径,在植物发育过程中发挥着重要作用。然而,很少有MAPKK在葡萄藤中的功能特征。
结果
在本研究中,在葡萄品种“黑皮诺”中鉴定了5个MAPKK (MKK)成员,克隆命名为VvMKK1-VvMKK5。系统发育分析根据其保守基序和基因结构的相似性将其分为4个亚科拟南芥MAPKK成员。qRT-PCR结果显示,VvMKK1、VvMKK2、VvMKK4和VvMKK5在成熟叶片、幼叶片和根中表达量上调,而在叶柄中表达量较低。孢子接种葡萄叶片后,VvMKK2、VvMKK3和VvMKK5基因差异上调Erisyphe necator或用水杨酸(SA)、乙烯(ETH)、氢氧化钠(H2O2,或者暴露在干旱环境下,这表明这些基因可能参与了多种信号通路。VvMKK2和VvMKK4基因在转基因中过表达拟南芥与野生型植物相比,野生型植物在胁迫条件下产生的种子萌发率和存活率显著提高,幼苗生长状况也更好。中VvMKK2过表达拟南芥提高了对盐和干旱胁迫的耐受性,而过表达VvMKK4只提高了盐胁迫的耐受性。
结论
本研究的结果为了解MAPKKK-MAPKK-MAPK基因在葡萄转录水平上的相互作用和功能提供了依据,并为葡萄干旱和盐胁迫的候选基因的鉴定提供了依据。
背景
植物作为固着生物,已经发展出信号机制来调节细胞代谢,使其适应环境变化和应激刺激。事实上,植物已经进化出了不同的信号网络,它们在感知压力和传递压力信号方面发挥作用,从而引发基因表达的变化[1].丝裂原活化蛋白激酶(MAPK)信号级联作为一种常见的信号转导模块,将外部刺激转化为细胞反应,并参与多种生物过程[2].经典的MAPK信号级联由三种特定丝氨酸/苏氨酸蛋白激酶的线性级联组成:MAPK、MAPK激酶(MAPKK/ map2k /MKK)和MAPK激酶激酶(MAPKKK/ map3k /MEKK)。相当多的MAPKKK-MAPKK-MAPK基因已经在拟南芥和其他植物[3.].它们都通过磷酸化作用作为上游和下游的调控因子[3.,4].MAPKs在T- x - y基序中的苏氨酸和酪氨酸残基上磷酸化,并被其特定的MAPKKs激活,这些MAPKKs自身磷酸化于位于S/T- xxxxx -S/T基序中的两个丝氨酸/苏氨酸残基上,并被上游MAPKKKs激活[5,6,7,8].激活后,MAPK可通过转录因子或转录机制组件的磷酸化调控下游基因的表达[4,9].大量研究证明,MAPK级联发挥重要作用在不同细胞的转导过程植物细胞暴露于各种非生物和生物压力,包括干旱、盐度、温度和压力(高、低),以及病原体的攻击,和植物激素反应(2,10,11,12,13,14].MAPK级联也负责调节大麦等谷类作物的种子休眠[15].
随着全基因组序列的增加和分析,许多MAPK级联的成员已经在多种植物物种中被鉴定出来。MAPKK基因家族是MAPK级联的重要组成部分之一。例如:拟南芥基因组包含80个MAPKKs、10个MAPKKs和20个MAPKs [11];大米含有75个MAPKKs, 8个MAPKKs和17个MAPKs [16,17];番茄含有89个MAPKKs, 6个MAPKKs和16个MAPKs [18,19].这些物种中MAPKKs的数量接近MAPKs的一半,远低于MAPKKKs的数量。这些数据表明MAPKKs在整合来自多个MAPKKs的信号和将信号输入到不同的MAPKs中发挥着重要作用。MAPKKs可能作为分岔点,并可能参与多个MAPK级联反应,这些级联反应在响应各种应力时被激活[1,11].几种MAPKKs已经在不同的植物物种中被鉴定出来,包括拟南芥MKK1和MKK2-5,烟草NtMEK1-2,苜蓿SIMKK,番茄LeMEK1,玉米ZmMEK1和ZmMKK3-4 [20.].的拟南芥MKK1/MKK2-MPK4/MPK6级联反应此前已被证明在植物对盐和冷胁迫以及病原体攻击的反应中发挥了不可或缺的作用[21,22,23,24,25].拟南芥MKK3参与病原菌感染诱导的信号级联[26].拟南芥MKK4/MKK5-MPK3/MPK6级联在生物胁迫调控中发挥重要作用[27,28].AtMKK6直接调控细胞分裂和有丝分裂[29].NtMEK2激活烟草中sa诱导的蛋白激酶(SIPK)和创伤诱导的蛋白激酶(WIPK),诱导细胞死亡[30.].SIMKK介导紫花苜蓿中盐和诱导信号[31].ZmMKK4具有耐盐和耐冷性拟南芥,而ZmMKK4和ZmMKK3通过清除活性氧正介导了转基因烟草的渗透胁迫[32].
小道消息(葡萄是世界上有价值和广泛种植的水果作物之一。虽然MAPK级联参与多种防御和胁迫信号的转导,但MAPK级联在葡萄对生物和非生物胁迫反应中的作用尚未阐明。在我们之前的研究中,我们鉴定了葡萄中MAPK和MAPKKK基因家族,并分析了它们在不同器官和不同胁迫条件下的表达[7,33].最近,使用诉酿酒用葡萄基因组(http://genomes.cribi.unipd.it/grape/) [34],已鉴定出葡萄MAPKK基因家族成员,并进行系统发育分析,但未提供其表达和功能的实验证据[3.].此外,MAPKK基因家族成员在生物和非生物胁迫反应中的表达或功能分析尚未见报道。本研究通过同源性搜索,在葡萄基因组中鉴定出5个MAPKK基因,并通过聚合酶链反应(PCR)克隆了5个MAPKK基因。并与已知的MAPKK基因进行系统发育关系、保守基序和基因结构比较拟南芥。随后,我们分析了MAPKK各基因在葡萄不同组织中的表达水平,以及在不同激素和生物和非生物胁迫下的表达水平。最后,我们鉴定出两个可能参与调控生物和非生物胁迫反应的MAPKK基因,并通过转基因过表达研究对这两个基因的功能作用进行了更详细的分析拟南芥.我们的研究结果为MAPK级联蛋白在植物逆境反应中的作用提供了新的信息。
结果
VvMKK家族基因的分子特征
通过对葡萄藤基因组序列的研究,我们可以确定葡萄藤中MAPKK基因家族成员。在葡萄基因组中共鉴定到5个MAPKK基因,命名为VvMKK1-VvMKK5。因为没有标准的命名协议,为以前识别的MAPKKs拟南芥,这些基因是根据它们在葡萄藤染色体上从上到下的坐标顺序命名的。已鉴定的VvMKK基因的命名、登录数、染色体定位、氨基酸数、基因长度、分子量、等电点(PI)列于表中1.VvMKK基因位于四条染色体上。VvMKK2和VvMKK3位于第11号染色体,VvMKK1、VvMKK4和VvMKK5分别位于第9、14和17号染色体。的orf VvMKK基因编码多肽从314 (VvMKK5)到518 (VvMKK4)氨基酸,从1169个基点(VvMKK5)到6879个基点(VvMKK2)长,分子质量预测从34.94 KDa (VvMKK5) 57.48 KDa (VvMKK4),用等电点值从5.56π(VvMKK4) 9.50π(VvMKK1)(表1).
通过RT-PCR从“黑皮诺”(Pinot noir, PN40024)植物中获得所有VvMKK基因的全长cDNA克隆,以确认全基因组序列的结果,并进一步对编码蛋白的性质进行分类(附加文件)1:表S1)。克隆结果显示,VvMKK4与全基因组序列具有99.94%的相似性,VvMKK1、VvMKK2、VvMKK3和VvMKK5与全基因组序列具有100%的相似性2:图S1)。
所有克隆的葡萄MAPKK基因的翻译蛋白中都存在保守基序拟南芥进行了分析。给出了分析的示意图表示(附加文件)3.:图S2)。所有5个VvMKK基因的预测多肽均具有MAPKKs的3个典型基序结构,并包含共识序列S/T- xxxxxx -S/T。
对5个VvMKK基因进行系统发育分析,将其分为4个亚群,与中亚群相对应拟南芥(附加文件4:图S3)。A组为VvMKK2和VvMKK3,共3个AtMKKs; B组为VvMKK4,共1个并行成员AtMKK3。将VvMKK1置于C组,VvMKK5置于D组拟南芥MAPKK序列(附加文件4:图S3)。MAPKK基因的外显子/内含子排列也可以根据它们的系统发育关系分为四个亚群(附加文件)4:图S3)。尽管在特定的外显子长度上存在一些差异,但MAPKKs的外显子结构模式似乎是很保守的。例如,A组中的VvMKK2和VvMKK3位于同一染色体上,具有高度的相似性和相同数量的内含子(7个内含子)4:图S3)。的拟南芥C组和D组的MAPKK基因不包含内含子,尽管在C组的VvMKK1基因进化过程中似乎获得了一些内含子(附加文件)4:图S3)。在葡萄中共鉴定到5个MAPKK基因。
VvMKK基因表达
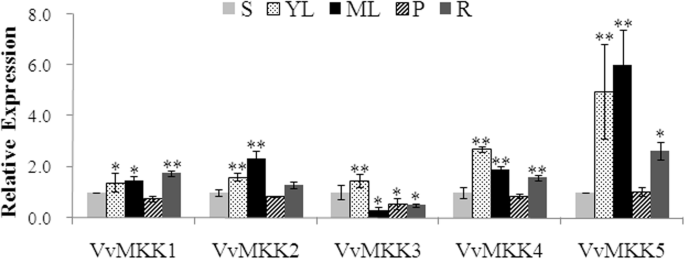
MAPKK基因在葡萄5个不同组织和器官中的表达水平结果表明,VvMKK2相对于其他组织类型在幼嫩叶片和根中表达量较高,而其密切相关的姐妹基因VvMKK3在这些组织中的表达量较低(图2)。1).VvMKK1、VvMKK4和VvMKK5在嫩、成熟叶片和根中表达量最高,在其他组织类型中表达量也最高(图2)。1).总体而言,VvMKK基因在叶片组织中的表达量相对高于叶柄。
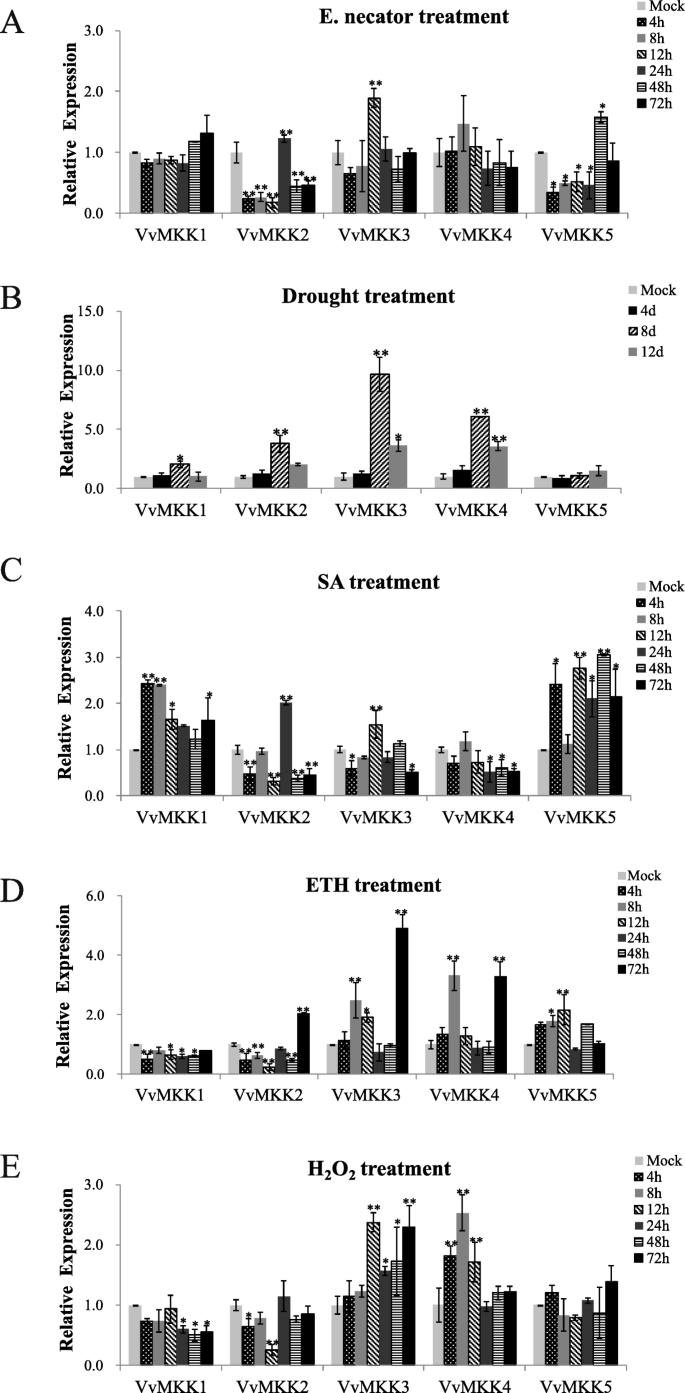
VvMKK3对接种白粉病叶片反应最快,接种后12 h表达量明显上调,之后表达量逐渐下降(图2)。2a)。相比之下,VvMKK2和VvMKK5分别在接种后24 h和48 h表达量最高(图2)。2一个)。
生物和非生物胁迫下葡萄叶片VvMKK基因表达的qRT-PCR分析一个:大肠necator(白粉病)感染;b:干旱处理;c水杨酸(SA)治疗;d:乙醇(ETH)处理;e过氧化氢(H2O2)治疗(有关治疗的详情见[7])。相对折叠差是通过与模拟(未经处理)组织的标准化相对表达水平进行比较来确定的,该水平的值为“1”。
4个VvMKK基因(VvMKK1 - VvMKK4)在葡萄叶片中表现出相似且显著的表达变化。2b).它们的表达量增加,在干旱处理开始后的第8天达到顶峰,之后表达量下降。值得注意的是,VvMKK3和VvMKK4在干旱处理中表达量增加了5倍(图2)。2b).在对SA的反应方面,相对于未处理的对照(mock), VvMKK1和VvMKK5的表达增加幅度最大,而VvMKK4的表达下调,VvMKK2和VvMKK3的表达仅轻微增加(1倍)(图)。2c). VvMKK基因对ETH和H的集体反应2O2(图相类似。2在这些处理中,相对于未处理的对照,VvMKK3和VvMKK4基因显著上调,而ETH下调VvMKK1和VvMKK5显著上调,但不受H影响2O2(无花果。2d和e)。
VvMKK2基因在转基因植物中的过表达拟南芥增强非生物的耐受力
转基因拟南芥研究过表达VvMKK2的品系对非生物胁迫耐受性的影响。根据卡那霉素抗性共筛选出11个独立的转基因品系,并通过GUS检测进一步证实(数据未显示)。我们利用3个VvMKK2纯合子株系(OE2, OE8和OE9),通过GUS染色检测它们在叶片中表达了强烈的VvMKK2,并将它们的反应与野生型(WT)、非转化植株进行了比较。
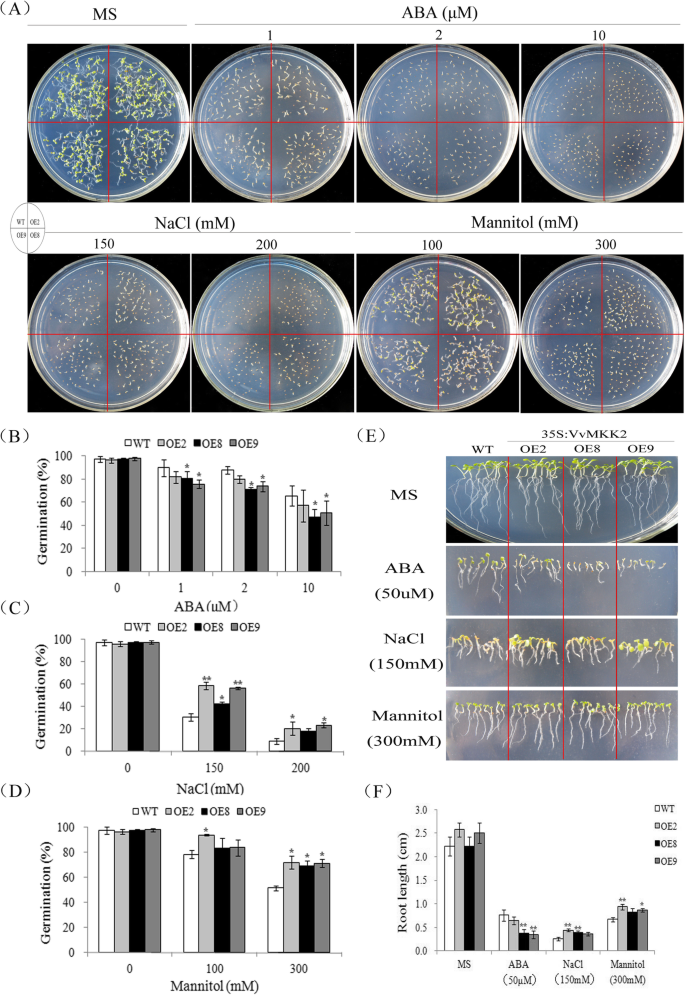
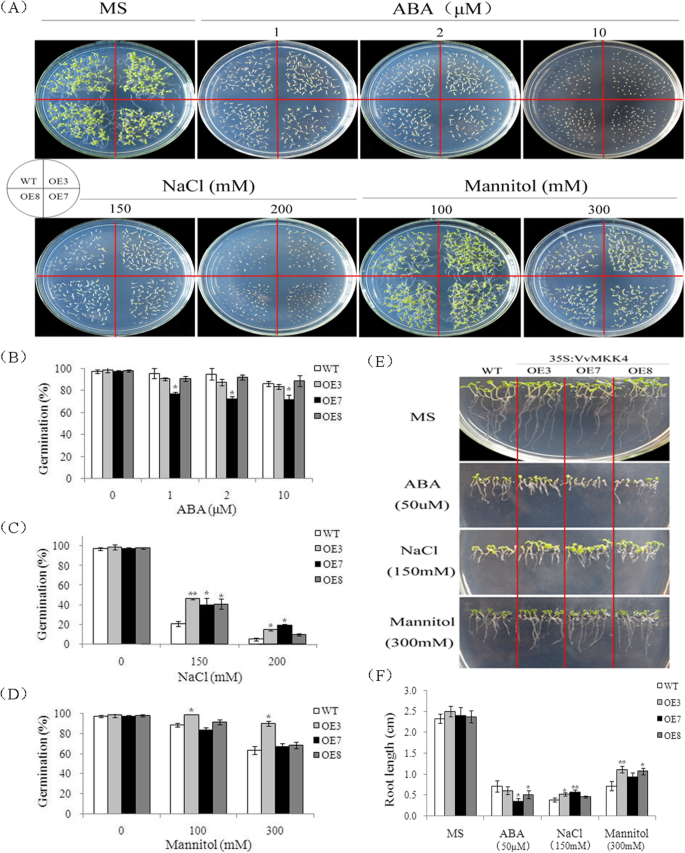
WT和vvmkk2过表达转基因(OE2、OE8和OE9品系)种子在添加不同浓度ABA、NaCl和甘露醇的1/2 MS琼脂培养基上萌发(图2)。3.).如图所示。3.a, WT和转基因植株在正常、非胁迫条件下生长没有明显的形态差异(图。3.a).野生型和转基因种子在添加不同浓度ABA的正常1/2 MS培养基上萌发率均受到抑制,且随着ABA浓度的增加,野生型和转基因种子的萌发率无显著差异(图2)。3.a和b)。
当转基因和野生型拟南芥在150 mM NaCl处理下,WT种子的发芽率约为40%,过表达VvMKK2的转基因种子的发芽率约为60%。在200 mM NaCl处理下,WT和转基因种子的发芽率分别下降到10和20%。这些结果表明,过表达VvMKK2增强了种子对盐诱导的萌发抑制的耐受性(图。3.在含有100 mM甘露醇的培养基上,野生型与过表达VvMKK2的转基因种子的萌发无显著差异。值得注意的是,在300 mM甘露醇下,转基因和野生型种子的萌发率分别约为70%和~ 50%(图2)。3.a和d)。
进一步研究了ABA、NaCl和甘露醇对转基因和野生型植株根系生长的影响。在生长培养基中不添加任何改良剂时,根长没有显著差异。当生长培养基中添加50 μM ABA时,转基因植株的根生长受到的抑制程度大于野生型植株。3.然而,在相同条件下,转基因植株的根明显长于野生植株,而转基因植株的子叶也更大(图2)。3.当暴露于300 mM甘露醇时,WT幼苗的根系生长受到严重抑制,而转基因植株的根系生长仅受到轻微影响(图2)。3.e和f)。
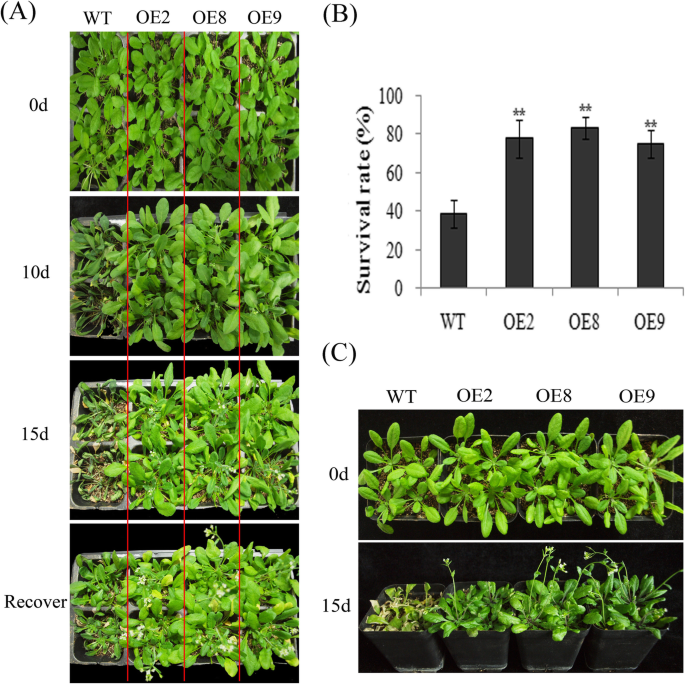
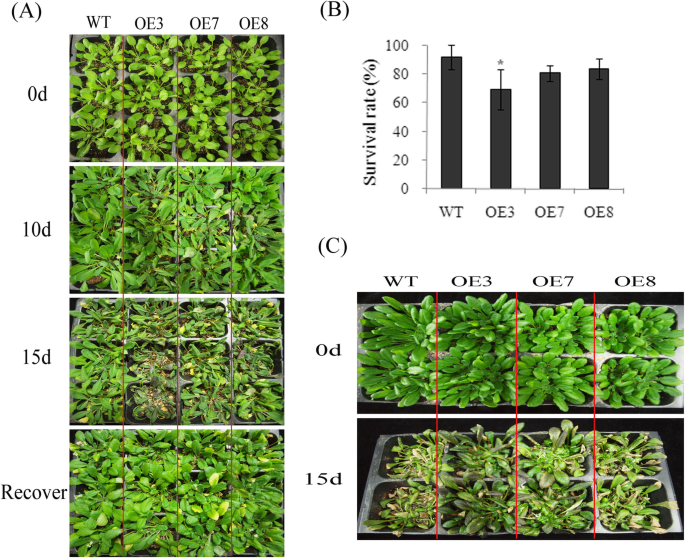
WT和转基因植株分别失水20 d,再复水2 d,以评估VvMKK2过表达对抗旱性的影响。结果表明,未浇水20 d后,WT植株的叶片萎蔫现象比转基因植株更明显。过表达VvMKK2的转基因植株在重新浇水后也比野生型植株恢复生长更快(图2)。4a).再浇水3天后,转基因株系的存活率为80%,而WT株系的存活率仅为40%。4b).这些结果表明,过表达VvMKK2增强了水稻的抗旱性拟南芥。
在同一盆栽中,用150mm NaCl溶液灌溉WT和转基因植株15 d,以确定是否在营养生长过程中也通过过表达VvMKK2而增加了萌发和根系生长的耐盐性。与非胁迫条件相比,WT和转基因植株在盐胁迫条件下均表现出严重的生长抑制,但转基因植株表现出较弱的抑制(图2)。4c).此外,大多数转基因植株甚至在高盐度条件下存活,部分植株开花,而WT植株的叶片随着时间的推移会枯萎、卷曲甚至死亡(图2)。4c).这些数据表明,过表达VvMKK2提高了转基因植株的耐盐性拟南芥植物在种子萌发和营养生长过程中。
VvMKK4在转基因植物中的过表达拟南芥增强耐盐性
VvMKK4被转化为拟南芥研究VvMKK4过表达对植物抗多种胁迫能力的影响。通过卡那霉素抗性筛选共获得9个独立的转基因株系,并通过GUS检测证实。利用叶片中GUS基因高表达的3个VvMKK4纯合子株系(OE3、OE7和OE8)进行抗逆性试验。
研究了野生型和3个独立的转基因株系(OE3, OE7和OE8)的种子在不同非生物胁迫下的发芽率。5).结果表明,在添加50 μM ABA的MS培养基上,WT和转基因株系的萌发率没有显著差异。5在添加150 mM NaCl的MS培养基上,转基因种子的发芽率为40%,而WT种子的发芽率为20%。5转基因种子在200 mM NaCl下的萌发率为20%,而WT种子在200 mM NaCl下的萌发率仅为5%。5在添加了300 mM甘露醇的MS培养基上,WT和转基因种子的发芽率差异不显著,除OE3转基因株系外(图3)。5a和d)。
在野生型和转基因植株上,研究了ABA、NaCl和甘露醇处理对根长的影响。在没有任何修饰的正常MS培养基上生长的转基因和WT植株的根长没有显著差异(图2)。5相比之下,在MS培养基中添加50 μM ABA时,转基因植株的根长比WT植株短(图2)。5与转VvMKK2转基因植株一样,转VvMKK4转基因植株的根长更长拟南芥在添加了150 mM NaCl的MS培养基上生长的WT植株(图2)。5e和f)。在盐胁迫下生长的转基因植株子叶也较大。在含有300 mM甘露醇的MS培养基上生长的WT幼苗中,所有过表达VvMKK4的转基因株系的植株根长。5e和f)。
中VvMKK4过表达的性能拟南芥对干旱和盐碱条件下的植物也进行了评价。WT和转基因植株先断水20 d,再复水2 d,模拟干旱胁迫和恢复。在保留水分20 d后,WT和转基因株系的叶片都表现出萎蔫,然而,萎蔫的程度在转基因植株中并不像WT植株中那样广泛(图2)。6a).恢复浇水后,转基因和野生型植株大部分恢复生长,两种植株(转基因和野生型)的存活率无显著差异,均表现为80%的存活率(图2)。6a和b)。还检测了转基因和WT植物对高盐度的耐受性(图2)。6c). WT和转基因植物的生长均显著降低;然而,WT植株受到的影响更大,在盐胁迫下表现出更高水平的萎蔫和褪绿(图2)。6c)。
讨论
VvMKK基因的鉴定、鉴定和分离
MAPKKK-MAPKK-MAPK信号级联在调控发育过程和环境信号转导中发挥重要作用[4,14].通过对其全基因组序列的分析,已经在许多植物中发现了MAPK信号转导相关基因。这包括MAPKK家族基因,这已经被系统地研究拟南芥[11)、大米(35,番茄18)、玉米(8),苹果(36],单子叶草本植物,Brachypodium distachyon[37和其他人。之前的一项研究拟南芥结果表明,来自同一亚群或分支的MAPKK蛋白倾向于聚在一起,除AtMKK10分支外,大多数MAPKK基因一般聚在分辨率较好的分支中。VvMKK基因/蛋白的系统发育分类也得到了保守基序分析的支持(附加文件)3.:图S2)和基因结构(附加文件4:图S3)。与其他已对齐的MAPKs类似,VvMKKs具有标志性motif VGTxxYMSPER、植物特异性磷酸化靶位点motif−S/TxxxxxS/T-和活性位点motif内保守的天冬氨酸和赖氨酸残基(−D (L/I/V) K-)的一致序列。保守基序分析表明,所有的VvMKK蛋白都具有保守性特征,并且每个亚家族都有类似于其他植物的保守基序拟南芥.有趣的是,A亚群、C亚群和D亚群的MAPKKs编码相对较短的蛋白,而B亚群的AtMKK3和VvMKK4具有一个不同寻常的结构特征,即在扩展的C端区域有一个核运输因子(NTF)结构域。据报道,这种嵌合排列在光合真核生物谱系中有很长的进化史[38].基因结构分析表明,同一亚群的MAPKK基因成员具有相似的外显子-内含子结构。尽管在特定的外显子长度上有一些适度的差异,MAPKKs(包括VvMKKs)的外显子结构模式似乎是很保守的。例如,位于同一染色体上的A组的VvMKK2和VvMKK3的相似性最高,都有7个内含子(附加文件)4:图S3)。拟南芥C组和D组的MAPKK基因没有内含子,而C组的VvMKK1基因在进化过程中似乎出现了内含子的一些增益(附加文件)4:图S3)。总的来说,保守基序和基因结构分析表明,同一亚群中的MAPKK基因具有相似的保守基序和外显子-内含子结构,说明同一亚群中的MAPKKs相互之间关系密切。
发现葡萄中MAPKK的数量和大小相对较小,在已鉴定MAPKK基因的植物物种中,葡萄中MAPKK基因的数量最少(附加文件)5:表S2)。虽然葡萄的基因组实际上可能比其他植物物种含有更少的MAPKK基因,但也有可能在已发表的含有缺口的葡萄基因组的部分中存在更多的MAPKK [39].
VvMKK在不同应激条件下的表达
基因在特定组织中的高水平表达,相对于其他组织,通常表明该基因起功能作用[40].在目前的研究中,大多数VvMKK基因在叶片组织中的表达高于其他任何组织/器官(图。1).特异性VvMKK基因的高表达可能与其在相应器官发育中的作用有关,或者表明该蛋白感知和转译细胞信号的位点。VvMKK2的不同表达式模式相比,其关系密切,复制基因姐姐,VvMKK3,表明尽管重复基因氨基酸序列高度的相似性,不能推断,他们应该也有一个类似的功能或参与相同的信号通路。事实上,VvMKK2和VvMKK3表达的器官特异性是不同的,可能是基于它们的功能而不是序列相似性[37].还需要进一步的研究来确定葡萄中各种MAPKK家族基因的功能。
对一个基因家族进行调查是识别参与特定生物过程的候选基因或特定启动子的有效策略[41].越来越多的证据表明MAPKK蛋白参与了植物对各种生物和非生物胁迫的响应[38].在目前的葡萄藤研究中,几个VvMKKs被几个测试的胁迫相关处理激活,并表现出不同的表达模式(图。2).已知MAPKK参与了植物细胞中一个精细的信号转导级联网络,因此特定的VvMKK基因参与了对不同胁迫刺激的响应很可能。因此,不同的MAPKK基因可能参与调控不同的发育过程或胁迫。聚类分析也显示了具有相似调节功能的不同植物物种的基因,但基因分类与功能之间是否存在相关性尚待确定[42].A组和B组的MAPKK基因主要参与植物的非生物胁迫反应拟南芥.例如,AtMKK1与干旱信号有关[43],有报道称AtMKK2在非生物胁迫耐受性中发挥作用[25].本研究构建的系统发育树确定VvMKK2属于A组,A组还包含AtMKK1、AtMKK2和AtMKK6。进一步分析表明,VvMKK2在白粉病、干旱、SA和ETH处理中表达上调,特别是在干旱处理中。这一发现与之前的研究几乎相同[22].AtMKK3和VvMKK4属于B亚家族,VvMKK4与非生物胁迫(如盐胁迫)反应以及植物生长发育有关。本研究还表明VvMKK4可以被干旱、ETH和H诱导2O2.根据已进行的实验,VvMKK2和VvMKK4基因在几个胁迫相关处理中表达一致且显著增加,尤其是在干旱处理中。因此,我们选择了它们进行进一步的过表达研究拟南芥.
VvMKK2和VvMKK4在转基因植物中的过表达拟南芥增强了抗压能力,
VvMKK2、VvMKK4在大肠杆菌中转化过表达拟南芥以进一步确定它们在应激反应中的作用。拟南芥由于葡萄藤转化的固有困难,选择了转化目标。结果表明,过表达VvMKK2和VvMKK4提高了转基因植株的抗逆性拟南芥结果表明,受各种胁迫处理后,植物的发芽率、根长和存活率显著降低。3.,4,5和6).ABA是种子萌发和幼苗早期发育过程中植物反应的重要调节因子[44].结果表明,在WT中测量的参数与过表达之间没有显著差异拟南芥在正常MS培养基中添加50 μM ABA时,转基因植株和野生植株的种子萌发均受到抑制,但转基因植株的抑制程度高于野生植株。进一步的实验表明,过表达基因对不同的非生物胁迫具有耐受性。过表达vvmkk2的植株对盐和干旱胁迫的耐受性增强,而过表达vvmkk4的植株对盐胁迫的耐受性增强。这些结果与前人关于MAPKK基因对盐胁迫耐受性影响的研究一致[45].这些转基因植物对不同胁迫的耐受性差异,可能反映了每个VvMKK蛋白对下游基因调控的特异性。需要进一步的生理学和遗传学实验来验证和进一步阐明这些基因的功能。
可能的MAPKKs模块和MAPKs涉及到葡萄藤的相互作用
植物MAPKs通过与上游和下游的蛋白质组分相互作用,以级联的方式调控各种生理反应已有充分的文献记载[46].到目前为止,我们已经在葡萄柚中识别出12个VvMAPKs, 5个VvMKKs和45个vvmapkks [7,33研究表明,MAPKKK-MAPKK-MAPK基因的成对互作与葡萄耐胁迫的机制有关,尚需进一步研究。众所周知,AtMKK1/AtMKK2-AtMAPK4模块负调控免疫拟南芥[23].VvMKK2是假定的拟南芥AtMKK1和AtMKK2,在本研究中,在白粉病、干旱、SA、ETH处理中,特别是在干旱处理中,AtMKK1和AtMKK2的表达上调,因此,其在抗盐和干旱胁迫中的作用得到了异位验证拟南芥.与AtMPK4密切相关的VvMAPK9也在白粉病、干旱、SA、ETH处理中表达上调[7].因此,VvMKK2和VvMPK9可能形成了一个功能性的MAPK级联,表明VvMKK2 - VvMPK9的相互作用可能参与了盐和干旱胁迫以及对病原体的防御。进一步综合分析VvMKKs和VvMAPKs之间的蛋白-蛋白相互作用,有助于建立MAPK级联及其信号网络。
结论
在本研究中,我们从葡萄中鉴定了5个MAPKK基因,这些基因不均匀地分布在4条染色体上,并被分为4个分支,这些分支与葡萄藤的MAPKK基因完全相同拟南芥MAPKK基因。基因表达分析表明,大部分基因在不同组织中表达,并响应白粉病、干旱、SA、ETH胁迫。中VvMKK2过表达拟南芥提高了对盐和干旱胁迫的耐受性,而过表达VvMKK4只提高了盐胁迫的耐受性。葡萄耐胁迫的机制以及MAPKKK-MAPKK-MAPK基因的成对互作有待进一步研究。研究结果可为葡萄品种的非生物抗逆性育种提供依据,也可为调控这些基因的表达提供依据。
方法
植物材料、生长条件和胁迫处理
PN40024 (诉酿酒用葡萄在1/ 2ms培养基上,添加0.3 mg/L 3-吲哚丁酸(IBA, Sigma, USA),光周期16/8 h (100 μmol m .)−2年代−1),在25°C的生长室。研究了VvMKK基因在生物(白粉病)和非生物(干旱)胁迫条件下以及激素和化学处理(SA、ETH和H2O2)也采用qRT-qPCR进行研究,如前所述[7,33].在离体(组织培养)植物中,分析了5种组织类型的组织特异性表达。茎,成熟叶(第6节和第7节);幼叶(第1节和第2节)、叶柄和根分别收获,在液氮中冷冻,在−80°C下保存,直到它们被用于后续分析。
的种子拟南芥采用75%乙醇(v/v, 1 ml)浸泡5 min, 5% NaClO (v/v, 1 ml)浸泡20 min对转基因植株进行表面消毒。种子用无菌蒸馏水漂洗3-5次,然后在1/2 MS含3% (w/v)蔗糖的凝固培养基上。先在4°C的黑暗中培养2天,然后放置,在16/8 h的光/暗循环和80% RH下保持在22±1°C。然后我们移植拟南芥将完整的子叶放在装有灭菌基质(蛭石:营养土壤:珍珠岩= 9:3:1)的花盆上,每个花盆装4棵幼苗,用保鲜膜覆盖。当幼苗长到2-4片叶子时,取下保鲜膜,正常培养,直到胁迫处理。
PN40024植物由法国INRA的Anne-Françoise Adam-Blondon博士好心提供。的拟南芥种子取自南京农业大学果树生物技术实验室(中国江苏省南京市)。我们声明植物材料的收集符合机构,国家或国际准则。
葡萄MAPKK基因的鉴定、克隆和分析
为了鉴定葡萄中MAPKK基因家族的成员,拟南芥MAPKK蛋白序列[47]从TAIR10 (http://www.arabidopsis.org/)数据库用作查询查询葡萄蛋白质组数据库(12xv1) (http://genomes.cribi.unipd.it/grape/) [34]及NCBI数据库(http://www.ncbi.nlm.nih.gov/基于隐马尔可夫模型的搜索(HMMER:http://hmmer.wustl.edu/).模因(Motif Elicitation的多重期望最大化)(http://meme.nbcr.net/meme/cgi-bin/meme.cgi)对葡萄藤MAPKK基因家族的候选蛋白进行预测分析。随后对每个检索到的序列进行保守的MAPKK特征motif序列检测。MAPKK基因模型只有在显示双特异性蛋白激酶的一致序列时才被接受,包括保守motif (- D (L/I/V) K-)、植物特异性磷酸化靶位点motif (- S/TxxxxxS/T-)和签名motif (VGTxxYMSPER) [11].
采用RT-PCR结合cDNA末端快速扩增(RACE)方法获得葡萄MAPKK基因全长克隆。根据预测的MAPKK基因序列设计基因特异性引物。列出了用于扩增orf和3 '非翻译区域序列的引物对(附加文件)6:表S3和其他文件7:表S4)。所用的PCR方案如前所述[7].在确认获得的全长序列的准确性后,利用ClustalW程序将预测的VvMKKs序列与克隆的VvMKK编码序列进行核苷酸水平的多序列比对。MAPKKs的系统发育树和外显子/内含子结构拟南芥葡萄藤的构造如前所述[7,33].
RNA提取及qRT-PCR表达分析
从收集的样本中提取总RNA,方法修改自前面描述的方法[48].使用1 μg总RNA和PrimeScritpt RT reagent Kit (TaKaRa,日本)按照制造商说明进行第一链cDNA合成。如前所述进行逆转录-定量PCR (qRT-PCR) [7,33].用于MKK基因qRT-PCR分析的基因特异性引物使用Beacon Designer 7.0软件(Premier Biosoft International, USA)设计,针对每个基因的3 ' UTR,设计生成约200 bp的产物(附加文件)8:表S5)。选择葡萄肌动蛋白基因作为内对照,对每个反应中存在的cDNA总量进行归一化。目的基因的相对表达量用2——ΔΔCt方法,其中ΔΔCt = (Ct目标基因- - - - - - Ct肌动蛋白)治疗——(Ct目标基因- - - - - - Ct肌动蛋白)控制[7].每个样本包含三个生物学重复,分析代表了三个独立实验的结果。
的变换拟南芥
通过PCR扩增MAPKK基因(VvMKK2和VvMKK4)的全长cDNA,引物包括BamH我和囊我限制网站在他们各自的5 ' -end(附加文件9:表S6)。pcr生成的片段在pCAMBIA1301二元载体中与GUS报告基因融合。插入的基因置于花椰菜花叶病毒35S (CaMV 35S)启动子。序列确定后,将该构造引入根癌土壤杆菌应变EHA105。拟南芥植物(Col-0生态型)采用浸花法转化[49].在含50 mg/L卡那霉素的1/2 MS培养基上筛选出转基因苗,并通过PCR进行验证。用两周大的幼苗进行GUS组织化学染色,如前所述[50].转基因T3后代拟南芥用于抗逆性试验。
种子萌发试验和根生长的测量
Surface-sterilized种子的T3转基因和野生型(WT)植物放置在1/2 MS盘子补充各种浓度的甘露醇(100毫米,300毫米)或ABA(1μM 2μM 10μM),或生理盐水(100毫米,200毫米),其中甘露醇是用来模拟水分胁迫体外培养(51].将种子在4℃黑暗下孵育3天,再置于光照下。发芽的种子数以种子总数的百分比表示。对15天的发芽率进行评分,并对植株进行拍照。每个处理使用三个重复板。
根生长试验中,转基因和WT种子置于1/2 MS琼脂板上发芽。种子发芽2天后,将每个株系的幼苗小心地转移到一个新的1/2 MS琼脂平板上,添加或不添加50 μM ABA、300 mM甘露醇或150 mM NaCl。将平板垂直放置在机架上,在生长7天后测量每个幼苗的根长。这个实验至少重复了三次。
野生型和转基因植物的抗逆性评价
在干旱处理中,转基因和野生型植物种子在1/ 2ms培养基上萌发生长2周,然后移栽到塑料盆中,定期浇水生长5周。干旱处理是由不浇水开始的。为了评估存活情况,在塑料花盆中生长的植物不浇水20 d,然后再浇水3 d,评估存活情况并拍照。存活率计算为存活株数/实验株总数× 100。表现出> 50%绿色组织的植株被认为已经存活。
对于耐盐性测试,拟南芥按上述方法培养幼苗。先不浇水,然后用300 mM NaCl溶液从罐底开始灌水15 d,观察植株外观的变化。干旱和盐的测定进行了3个重复。
统计分析
采用方差分析(ANOVA)评估各处理的统计显著性,并采用Fisher 's LSD检验在显著性水平下确定转基因和野生型植株处理方法的显著差异P< 0.05和P< 0.01。所有统计分析均使用SAS软件(8.0版,美国NC SAS Institution)进行。照片使用Photoshop CS5(微软和Adobe,美国)制作。
数据和材料的可用性
支持这篇文章中描述的结论的数据集包括在手稿和它的附加文件中。其他数据可根据相应作者的合理要求提供。将克隆的5个VvMKK基因的序列提交到NCBI数据库https://www.ncbi.nlm.nih.gov/nuccore,加入号分别为MT154080、MT154081、MT154082、MT154083和MT154084。
缩写
- AA:
-
氨基酸
- 阿坝:
-
脱落酸
- 爆炸:
-
基本的局部对齐搜索工具
- 英国石油公司:
-
碱基对
- CaMV35S:
-
花椰菜花叶病毒35S启动子
- 互补脱氧核糖核酸:
-
互补脱氧核糖核酸
- 大肠杆菌:
-
大肠杆菌
- ERK激酶:
-
增殖蛋白激酶
- 乙:
-
2-氯乙基膦酸
- H2O2:
-
过氧化氢
- MAPK:
-
增殖蛋白激酶
- MAPKK:
-
丝裂原活化蛋白激酶
- MAPKKK:
-
丝裂原活化蛋白激酶激酶
- MAPKKKK:
-
丝裂原活化蛋白激酶激酶激酶激酶
- 图3 K:
-
丝裂原活化蛋白激酶激酶/MAPKKK
- 图4 K:
-
丝裂原活化蛋白激酶激酶激酶/MAPKKKK
- MEK:
-
丝裂原活化蛋白激酶激酶/MAPKK
- MEKK:
-
丝裂原活化蛋白激酶激酶/MAPKKK
- MKK:
-
丝裂原活化蛋白激酶激酶/MAPKK
- MPK:
-
增殖蛋白激酶/ MAPK
- 女士:
-
Murashige和Skoog中号
- 兆瓦:
-
分子量
- OE:
-
过表达
- 下午:
-
白粉病
- PI:
-
等电点
- 种族:
-
cDNA末端快速扩增
- 山:
-
水杨酸
- SIMK:
-
Salt-stress-inducible MAPK
- SIMKK:
-
Salt-stress-inducible MAPKK
- SIPK:
-
SA-induced蛋白激酶
- 他们:
-
Threonine-glutamic acid-tyrosine
- 3’UTR:
-
3′翻译区
- WIPK:
-
Wound-induced蛋白激酶
- WT:
-
野生型
参考文献
- 1.
Kumar K, Rao KP, Sharma P, Sinha AK。非生物胁迫对水稻丝裂原活化蛋白激酶激酶(MKK)的差异调控。植物生理学与生物化学。2008;46(10):891-7。
- 2.
张晓霞,徐旭,于宇,陈超,王军,蔡超,郭伟。棉花MKK和MAPK家族成员的整合分析。Sci众议员2016;6:29781。
- 3.
葡萄丝裂原活化蛋白激酶级联反应的研究。植物科学学报2015;6:556。
- 4.
王志强,王志强,王志强,等。植物MAP激酶信号转导的研究进展。植物学报。2002;5(5):415-24。
- 5.
丝裂原活化蛋白激酶:从酵母到人类的三激酶模块的保存。杂志启;1999 79(1):143 - 80。
- 6.
植物丝裂原活化蛋白激酶信号转导。植物学报2010;61:621-49。
- 7.
Wang G, Lovato A, Liang YH, Wang M, Chen F, Tornielli GB, Polverari A, Pezzotti M, Cheng zzm。MAPK基因家族在葡萄中的分离和表达分析。中国葡萄酒业。2014;2(20):255-62。
- 8.
孔晓霞,潘军,张东,姜胜,蔡刚,王磊,李丹。玉米丝裂原活化蛋白激酶基因家族及其MKK-MAPK互作网络的鉴定。生物化学学报。2013;441(4):964-9。
- 9.
拟南芥MAPKs:一个涉及多个生物学过程的复杂信号网络。j . 2008; 413(2): 217 - 26所示。
- 10.
王刚,王涛,贾振华,宣建平,潘大东,郭志荣,张建勇。猕猴桃MAPK基因家族的全基因组生物信息学分析(猕猴桃对).中华医学杂志。2018;19(9)。https://doi.org/10.3390/ijms19092510.
- 11.
Ichimura K, Shinozaki K, Tena G, Sheen J, Henry Y, Champion A, Kreis M, Zhang SQ, Hirt H, Wilson C, et al. .植物丝裂原活化蛋白激酶级联:一个新的命名。植物科学进展,2002;7(7):301-8。
- 12.
张森,王志强。MAPK在植物防御信号中的级联作用。植物科学进展,2001;6(11):520-27。
- 13.
金春英,刘玉华,杨华,福岛海,Gassmann W, Hildebrand D, Sharp RE,张爽。胁迫应答型丝裂原活化蛋白激酶级联反应诱导植物乙烯生物合成。植物细胞。2003;15(11):2707 - 18。
- 14.
植物防御中的MAPK级联信号网络。植物学报。2009;12(4):421-26。
- 15.
Adhikari L, Razar RM, Paudel D, Ding R, Missaoui AM。多年生草本牧草季节性休眠的观察。acta botanica yunnanica(云南植物研究);2017;
- 16.
Rao KP, Richa T, Kumar K, Raghuram B, Sinha AK。硅分析显示水稻中有75个丝裂原活化蛋白激酶激酶激酶基因家族成员。DNA研究》2010;17(3):139 - 53。
- 17.
水稻MAP激酶基因家族与稻瘟病菌侵染的分子分析。植物与微生物的相互作用。2006;19(5):530-40。
- 18.
关键词:MAPKK, MAPKKK基因家族,番茄,发育,胁迫反应,转录分析《公共科学图书馆•综合》。2014;9 (7):e103032。
- 19.
关键词:CRISPR/Cas9,单位点或多位点编辑,基因工程,基因工程引用本文:园艺杂志2019;者。
- 20.
张涛,刘永强,杨涛,张丽,徐胜,薛磊,安磊。植物MAPK级联信号的收敛。植物生理生化学报。2006;44(5-6):274-83。
- 21.
在拟南芥中,MKK2信号通路介导了冷和盐胁迫信号的传递。摩尔细胞。2004;15(1):141 - 52。
- 22.
高敏,刘建军,毕德华,张志强,程飞,陈树华,张玉玲。MKK1、MKK1/MKK2和MPK4共同作用于丝裂原活化蛋白激酶级联调控植物天然免疫。细胞研究》2008;18(12):1190 - 8。
- 23.
邱金龙,周龙,Yun BW, Nielsen HB, filil BK, Petersen K, Mackinlay J, Loake GJ, Mundy J, Morris PC。拟南芥丝裂原活化蛋白激酶MKK1和MKK2在MEKK1、MPK4和MKS1介导的防御信号传导中具有重叠的功能。植物杂志。2008;148(1):212 - 22所示。
- 24.
关键词:AtMEK1,拟南芥,丝裂原激活蛋白激酶,活性突变体,胁迫反应植物j . 2002; 29(5): 637 - 47。
- 25.
MAP激酶MKK2激酶对拟南芥抗病能力的影响。植物与微生物学报。2007;20(5):589-96。
- 26.
有丝裂原激活蛋白激酶MKK3-MPK6级联是拟南芥茉莉酸信号转导途径的重要组成部分。植物细胞。2007;19(3):805 - 18。
- 27.
关键词:拟南芥,天然免疫,MAP激酶,信号转导自然。2002;415(6875):977 - 83。
- 28.
Wang H ., Ngwenyama N ., Liu Y ., Walker JC ., Zhang S. .植物细胞。2007;19(1):63 - 73。
- 29.
HINKEL kinesin、ANP MAPKKKs和MKK6/ANQ MAPKK可磷酸化并激活MPK4 MAPK,构成拟南芥胞质分裂所需的途径。植物生理学报。2010;51(10):1766-76。
- 30.
杨启元,刘勇,张松。丝裂原活化蛋白激酶途径的激活与烟草抗病有关。中国科学院院刊2001;98(2):741-6。
- 31.
胁迫诱导的丝裂原活化蛋白激酶信号通路在两种不同的丝裂原活化蛋白激酶激酶水平上的收敛和发散。植物细胞。2002;14(3):703 - 11所示。
- 32.
王俊杰,刘绍平,彭志鹏,陆国栋。番茄丝裂原活化蛋白激酶基因家族的全基因组分析。基因。2012;499(1):108 - 20。
- 33.
王刚,Lovato A, Polverari A,王敏,梁永红,马永春,程志明。葡萄(Vitis vinifera)有丝裂原活化蛋白激酶激酶激酶基因家族的全基因组鉴定与分析BMC Plant Biol. 2014;14:219。
- 34.
Grimplet J, Van Hemert J, Carbonell-Bejerano P, Diaz-Riquelme J, Dickerson J, Fennell A, Pezzotti M, Martinez-Zapater JM。葡萄全基因组基因预测的比较分析,预测基因序列的功能注释、分类与整合。BMC Res Notes. 2012;5:213。
- 35.
Lee SK, Kim BG, Kwon TR, Jeong MJ, Park SR, Lee JW, Byun MO, Kwon HB, Matthews BF, Hong CB,等。丝裂原活化蛋白激酶基因OsMAPK33的过表达增强了水稻对盐胁迫的敏感性。J Biosci。2011;36(1):139 - 51。
- 36.
张树华,徐瑞君,罗旭,江志强,舒华。家蝇MAPK和MAPKK基因家族的全基因组鉴定和表达分析。基因。2013;531(2):377 - 87。
- 37.
陈磊,胡伟,谭胜,王敏,马震,周胜,邓欣,张勇,黄超,杨刚,等。二轴草MAPK和MAPKK基因家族的全基因组鉴定与分析。《公共科学图书馆•综合》。2012;7 (10):e46744。
- 38.
Hamel LP, Nicole MC, Sritubtim S, morrency MJ, Ellis M, Ehlting J, Beaudoin N, Barbazuk B, Klessig D, Lee J,等。古老的信号:植物MAPK和MAPKK基因家族的比较基因组学。植物科学进展。2006;11(4):192-8。
- 39.
王宁,郑勇,辛辉,方磊,李胜。葡萄NAC结构域转录因子基因家族的综合分析。植物学报2012;32(1):61-75。
- 40.
王辉,王伟,张鹏,詹杰,黄伟。葡萄花青素合成酶(ANS)的表达及亚细胞定位。原生质。2011;248(2):267 - 79。
- 41.
陈志强,陈志强,陈志强,等。葡萄白粉病易感基因候选基因的鉴定。植物生态学报。2008;35(12):1255-66。
- 42.
牛春春,魏伟,周启勇,田昂,郝玉军,张文凯,马波,林强,张志斌,张建军,等。小麦WRKY基因TaWRKY2和TaWRKY19调控转基因拟南芥的非生物胁迫耐受性。植物学报。2012;35(6):1156-70。
- 43.
等。拟南芥MAP激酶激酶MKK1参与对细菌激发子鞭毛蛋白的防御反应。植物j . 2006; 48(4): 485 - 98。
- 44.
陈志强,陈志强。种子和幼苗脱落酸信号转导的研究进展。植物细胞。2002;14(增刊):S15-45。
- 45.
MAPK在植物抗病信号传递中的作用。植物病理学杂志。2013;51:245-66。
- 46.
姜敏,文芳,曹建军,李鹏,佘建军,楚志刚。短叶藻丝裂原激活蛋白激酶级联调控网络的全基因组研究。BMC基因组学。2015;16:228。
- 47.
HMMER网络服务器:交互式序列相似性搜索。核酸学报2011;39(Web服务器版):W29-37。
- 48.
一种从白骨壤叶片中分离总RNA的改进方法。中国科学(d辑:地球科学)2008;63(1-2):124-6。
- 49.
农杆菌介导的拟南芥转化的一种简化方法。植物j . 1998; 16(6): 735 - 43。
- 50.
在植物中,Dof蛋白NtBBF1的DNA结合位点对rolB癌基因的组织特异性表达和生长素调控至关重要。植物细胞。1999;11(3):323 - 34。
- 51.
关键词:烟草,GhMKK5,抗病性,hr样细胞死亡,耐盐耐旱性中国生物医学工程学报。2012;63(10):3935-51。
确认
我们非常感谢USDA-ARS(美国农业部,农业研究服务)的Michael Wisniewski教授对手稿的阅读和评论。
资金
基金资助:中央高校基本科研业务费专项资金(no . KYZ201843);江苏省自然科学基金面上项目(no . BK20171328);作物遗传与种质创新国家重点实验室开放基金项目(no . ZW201813)。资助机构没有参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
从属关系
贡献
ZMC和GW构思并设计了实验。GW进行了实验。GW分析了这些数据。YHL和JYZ提供试剂/材料/分析工具。GW和ZMC撰写了论文。所有作者都通过了稿件的定稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1
:表S1。克隆的VvMKK基因的核酸序列。
附加文件2
:图S1。将每个克隆的VvMKK基因的核酸序列与葡萄藤全基因组序列数据库中预测基因的相应序列进行比对。序列同源性用黑色突出,差异用灰色突出。
附加文件3
:图S2。葡萄MAPKK基因的氨基酸序列比对及结构域分析拟南芥.使用ClustalW程序进行对齐。红框为保守签名motif,绿框为植物MAPKK特异性motif -T/SXXXXXS/T-,活性位点- d (I/L/V) K- motif以蓝色突出显示。
附加文件4
:图S3。葡萄藤MAPKK基因的系统发育关系及内含子/外显子结构示意图拟南芥.采用MEGA5.0软件,采用neighbor-joining (NJ)方法构建系统发育树(左图)。在每个分支上都显示了1000个重复的引导值。右边的字母A-D表示不同的mapkk组。右图显示MAPKK基因的外显子/内含子结构。绿框表示外显子,单线表示内含子。utr由两端的蓝色粗线表示。0、1、2代表不同的内含子相。基因模型按比例绘制,如图底部所示。
附加文件5
:表S2。不同植物中MAPKK基因家族成员的数量。
附加文件6
:表S3。引物序列用于克隆葡萄MAPKK基因。
附加文件7
:表S4。引物序列用于葡萄MAPKK基因的3 ' RACE。
附加文件8
:表S5。葡萄MAPKK基因的引物序列进行定量RT-PCR。
附加文件9
:表S6。引物序列用于将VvMKK2和VvMKK4基因插入转化载体。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
王国栋,梁勇。张,客户至上。et al。克隆,分子和功能表征的过度表达拟南芥来自葡萄的MAPKK基因葡萄).BMC植物杂志20.194(2020)。https://doi.org/10.1186/s12870-020-02378-4
收到了:
接受:
发表:
关键字
- 小道消息
- 丝裂原活化蛋白激酶激酶
- 表达分析
- 盐和干旱胁迫
- 转基因植物