抽象的
背景
颗粒结合的淀粉合酶I(GBSSI)酶负责淀粉糖的合成,因此,其在各种淀粉作物中具有蜡质淀粉表型的个体的不存在。先前与木薯中蜡淀粉表型相关的突变点的验证,以及GBSSI基因中的替代突变等位基因,可以允许发育分子辅助选择以使蜡质淀粉突变渗入木薯育种群体中。
结果
先前已识别出蜡质Cassava等位基因,与几个SNP相关联。特定的SNP(内含子11)用于开发用于筛选木薯种质中的杂合子类型的捕获标志物。虽然分子偏析对应于3:1的预期隔离(主要基因存在淀粉糖的存在),但含有与蜡质突变相关的SNP的纯合子未显示出蜡质表型。为了鉴定更多标记,我们从89种基因型测序GBSS基因,其中一些与携带已知的蜡质等位基因的线分离的一些。结果,鉴定了GBSSI基因中的17个突变,其中仅在外显子6(MEWXEX6-DEL-C)中的缺失与蜡质表型相关。通过判别分析主要成分分析(DAPC)的突变点的评价也没有完全区分蜡质个体。因此,我们开发了Kombetity等位基因特异性PCR(KASP)标记,其允许在WX和WX等位基因之间进行歧视。结果表明,在分析的种质中,杂种杂合物的杂合体缺失。因此,删除MEWXEX6-DEL-C不应用于辅助选择在与蜡质淀粉的原始来源不同的遗传背景中。此外,与具有高遗传多样性的锯齿板相比,该研究中鉴定的替代SNP与蜡质表型无关。
结论
虽然GBSSI基因在木薯中可以出现多个突变,但只有外显子6 (MeWxEx6-del-C)的缺失与AM206-5原始源的蜡质表型相关。
背景
淀粉广泛用于多种商业目的。它不仅提供了超过80%的人饮食中的卡路里[1[它还具有许多工业应用,例如胶水和粘合剂。它基本上由两种类型的聚合物组成:直链淀粉(基本上α1,4-聚葡聚糖,线性)和淀粉素(α1,4-聚葡聚糖和α-1,6-聚葡聚糖,支链)[2],其比例和安排赋予了定义淀粉商业优势的特性,并且是繁殖计划的重点。主要商业来源淀粉是玉米,木薯,米饭,小麦和土豆。玉米后,木薯是全球淀粉的第二个最重要的来源。这些物种中的每一个的功能和特异性定义其工业应用[3.,4,5,6].
淀粉颗粒的基本单元,由葡萄糖分子的许多短链组成。相反,淀粉糖是较长链的较小分子[7].来自不同作物的淀粉通常由20-30%直链淀粉和70-80%支链淀粉组成[1].具有低或不含直链淀粉的淀粉,称为蜡质类型,是重要的,因为它们呈现较低的替代和逆行,通常是透明的并且具有更粘弹性的凝胶形式[8].逆转是一种过程,其中破坏的直链淀粉和淀粉蛋白链(通常在水存在下加热)可以逐渐重新缔合成不同的有序结构。随着时间的推移,这种重组可以释放保留在结构(速度)内的水,对来自这种类型的淀粉的食物的感官品质和储存时间产生了不利影响,主要是因为它改变了食物的质地和营养特性[9].蜡质木薯淀粉不仅与来自其他作物的蜡状淀粉相比,较低的促蛋白酶[10],突变不改变淀粉蛋白的结构[11].由于脂质和蛋白质含量低,木薯淀粉口感中性,这使它在食品工业中比谷类淀粉具有竞争优势[12].
虽然可以对淀粉进行化学和物理修饰来改变其功能性能以满足特定的市场需求,但对这些修改有一定的局限性。此外,无论类型如何,对淀粉的改变始终与更高的工业成本相关联。要考虑的另一个方面是消费者越来越苛刻的产品更加自然,最少的工业加工。因此,对天然分化的淀粉有一种日益增长的市场。育种计划可以促进遗传变异的发现,进一步纳入商业品种中的这些特征,蜡质淀粉是这些特殊性状之一。
从遗传观点来看,清楚地了解淀粉生物合成中的基因允许鉴定携带突变的种质的探讨,而无需慢性表型方法。在与淀粉合成有关的酶中,GBSSI(颗粒结合的淀粉合酶I)是与直链淀粉伸长率有关的合成酶。许多物种的蜡质突变体表现出这种酶的缺乏活性[7,13,14].来自不同分子机制的几个等位基因形式已被确定为负责蜡样表型。玉米蜡质基因的编码区为3718 bp,由14个外显子组成,范围为64 ~ 392个碱基对(bp), 13个内含子,范围为81 ~ 139 bp [15].根据FAN等人。[16] 这WX.-D7等位基因在第7外显子与内含子的交界处有一个30 bp的缺失,产生一个保留第7内含子的异常转录本,该转录本引入一个不成熟的终止密码子,使GBSSI失活。在水稻中,在GBSSI基因的外显子6和10中发现了两个snp,它们与直链淀粉含量和糊状特性有关[17].在位于Exon1 / Intron1的SNP之间也观察到强烈的相关性,并在水稻淀粉中的粘贴性质之间进行粘贴[18].在普通六倍体小麦(Triticum Aestivum.L.),每个基因组A、B和D都有一个蜡质蛋白,其各自的基因座编码器(Wx-A1、Wx-B1和Wx-D1)有文献报道的几个突变。在另一项研究中,在Wx-A1的空等位基因中插入一个SNP和缺失一个核苷酸,可诱导突变点前约55个核苷酸的过早终止密码子小麦属植物dicoccoides一个.和T. Dicoccum.S [19].最近,通过插入转座子并随之而来的这种物种中的功能丧失,其特征在于,这一物种的损失20.].最近在玉米中发现了两个新的突变,与转换元件相关联,其中466-BP回析膜插入外显子6中,116bp的转换重复元素插入外显子7 [21].
在木薯,对蜡质表型的遗传控制甚至其对这种特征的多样性开采的研究相对较近。通过转基因技术通过GBSSI基因表达的修饰诱导Cassava中的第一个蜡质克隆[22,23],后来由赵等人撰写[24].然后,通过[综述天然突变25]在国际热带农业中心(CIAIR)的一系列自我授粉中,这证明了来自基因型AM206-5的蜡质基因的隐性性质。最近,CRISPR-CAS9技术用于木薯,以介导两种基因的靶向诱变,所述两种基因涉及淀粉生物合成(GBSSI和靶向淀粉 - PTST1),导致蜡质克隆或克隆具有还原的直链淀粉含量[26].
Aiemnaka等。[27]所执行的GBSSI基因的分子表征从AM206-5源和鉴定潜在的功能的突变分离后代。作者发现外显子6与创建一个提前终止密码子的单个碱基排阻(胞嘧啶)的插入缺失;一个两碱基变体在外显子11(GC和AT);和内含子11的取代(C至G)。在此基础上最后的突变,作者开发出了SNAP(单核苷酸扩增多态性)标记,其信息将允许饲养者直接自花授粉,并通过分子标记回交协助,以减少对育种计划所需的成本和时间的目的.在此背景下,本工作的目的是如下:i)以验证其是否与先前从AM206-5在拉丁美洲木薯种质的蜡状淀粉的原始源相关联的突变(SNP和INDEL);和ii)确定的替代等位基因在GBSSI基因在蜡质和非蜡质种质可能在分子辅助选择(MAS),用于这种性状有用的面板。
结果
用捕获标记筛选Cassava种质
先前为内含子11开发的捕获引物[27]用于筛选来自四个国家的1529个木薯加入。电泳凝胶的轮廓分析基于引物MEWXI11-G和MEWXI11-C扩增的片段的存在或不存在,这表明存在杂合子个体,而只有两种等位基因中只有一个的扩增表明存在丙克(MEWXI11-G - GG基因型)或非蜡状(MEWXI11-C,CC基因型)表型的纯合体。根据分子分析,鉴定出评价的木薯种质中没有一种具有隐性等位性条件(GG)。这结果是预期的,因为1529种基因分型脱离中没有蜡状淀粉表型。然而,评估的个体中的206种被鉴定为杂合子(CG),因为它们具有引物Mewxi11-C和Mewxi11-g的等位基因。
基因型和S的形态学评价1具有SNAP标记的群体
二十八个从总(206)杂种质自花授粉在现场与产生S的目的1蜡质基因的分离群体。从该总(28),三种杂合容附加(BGM0061,BGM0935和BGM0438)产生了187株植物(分别为61,101和25),用于评估等位基因和蜡质表型的分子偏析。S的等位基因偏析结果1用引物MEWXI11-C和MEWXI11-G分析的后代,在后部的预期比例(1:2:1)中没有显着偏差1-BGM0061,S.1-BGM0935和S1-BGM0438,根据χ2测试(表1).因此,即使在这三个子代中有少量的个体,也可以观察到位于GBSSI基因第11内含子3197 bp处的C和G等位基因的孟德尔分离,这是一个隐性性状的预期(补充Fig. S .1).然而,尽管在后代的预期发生了分子偏析1- BGM0061,S1- BGM0935和S1- BGM0438,评价所有28个S的蜡质表型1基于2%碘试验的领域的后代未识别任何蜡质表型的个体。因此,该结果表明,当遗传背景与原始来源完全不同时,GBSSI基因的3197BP位置在3197bp位置的突变在GBSSI基因的3197bp位置是合适的分子标记。当遗传背景与原始来源完全不同时,用于分子辅助选择蜡质个体突变(AM206-5)。
基因测序鉴定GBSSI的新遗传变异
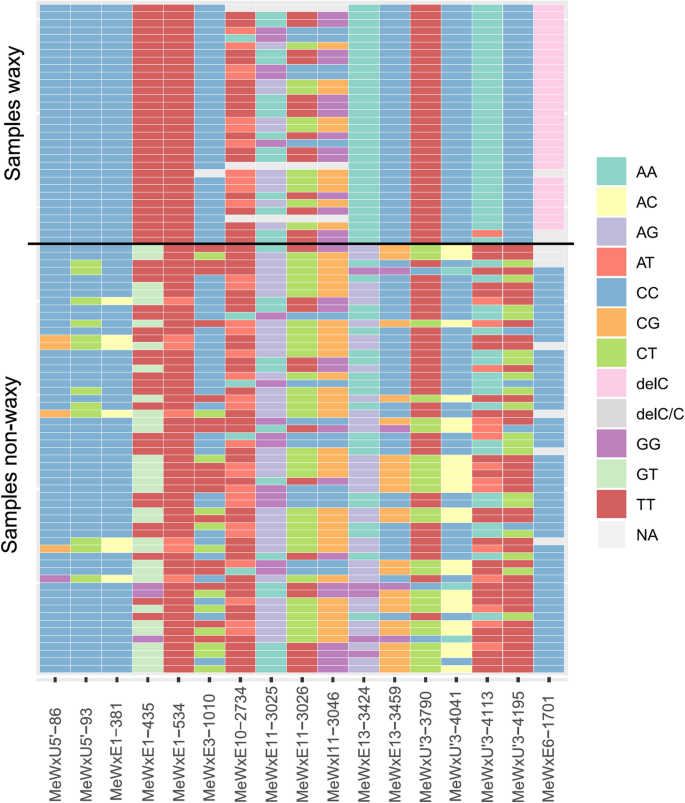
为了鉴定与蜡质淀粉相关的新的等位基因变体,完成GBSSI基因测序在89个木薯基因型中进行。在序列的对准修剪之后,在GBSSI基因中鉴定16个SNP,以及一种缺失,表明评估的89种木薯癌中的基因型差异,其中包括蜡质(AM206-5衍生的群体)和非蜡质基因型(种质库) (无花果。1).6个SNPs在非翻译区(utr), 1个在非编码区,9个在编码区。然而,在GBSSI基因中发现的等位变异并不能识别出任何能够精确区分蜡质和非蜡质个体的SNP(图。2).仅缺失先前由AIEMNAKA等人鉴定的核苷酸胞嘧啶(MEWXEX6-DEL-C)。[27]只存在于含蜡植物中。因此,在GBSSI基因中鉴定的SNPs不能单独确定导致木薯蜡样表型发展的停止密码子或遗传密码阅读中的错误。
基于GBSSI基因的等位基因变异的蜡质和非蜡质基因型的主要成分(DAPC)的判别分析
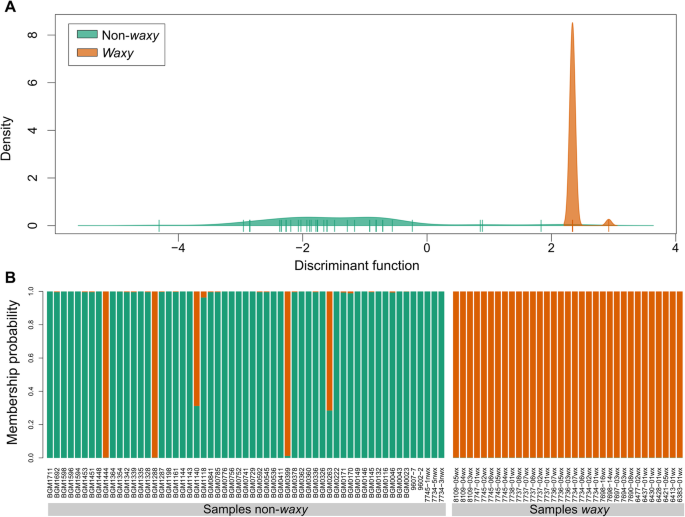
另外,进行DAPC以确定基于在GBSSI基因和淀粉类型中发现的一组SNP组聚类不同个体的判别功能。仅使用12个SNP,这些SNP显示出蜡质和非蜡质个体之间的最小变化。外显子10(位置2734bp)和外显子11(位置3025,3026和3046bp)的SNP是具有蜡状表型的个体中最分散的(图。2),并从联合分析中退出。MeWxEx6-del-C缺失(位置1701 bp)也被从分析中删除,因为主要目的是确定其他突变如何共同区分蜡质表型,以增加在巴西木薯种质中识别蜡质等位基因个体的可能性。
判别函数密度和隶属分配的重叠表明,SNP的组合不能进行100%精度的蜡状和非蜡质个体(图。3.).虽然分类模型表现出良好的精度,有没有完整的歧视(100%)非蜡质根据其成员分配,个人(BGM1444,BGM1288,BGM0399,BGM1140和BGM0263)(图。3.).
的年代NPs that contributed most to the discriminant function are located in the 3’UTR at 4041 and 4195 bp, and exon 13 at 3459 bp. Since the non-waxy individuals BGM1444, BGM1288 and BGM0399 shared these same SNPs with the waxy individuals, the waxy phenotype discrimination could not be performed accurately. The non-waxy individuals BGM1140 and BGM0263 shared the SNPs with small contributions (≤ 0.01) to discriminate the phenotype, located in the 5’UTR at 86 and 93 pb, as well as exon 1 at 381 and 534 bp and exon 3 at 1010 bp. The clone BGM1140 also shared the SNP of 3’UTR region (4195 bp) with waxy individuals.
通过KASP种质资源库的基因型分析
在GBSSI基因的完全测序之后,我们还鉴定了在1701bp(以下称为MEWXEX6-DEL-C)的出口6中的缺失,以前由AIEMNAKA等人描述。[27].考虑到仅在GBSSI基因的1701bp位置缺失胞嘧啶,能够将蜡与非蜡状表型区分开(图。2),下一步是对这种缺失进行大规模的基因分型。因此,采用KASP(竞争性等位基因特异性PCR)技术初步分析目的片段的扩增情况。在之前的基因分型中,SNAP引物MeWxI11-G和MeWxI11-C在3 '端富集了3个核苷酸,使11号内含子上的SNP发生差异扩增。Aiemnaka等人报道的其他突变也使用了相同的策略[27],没有成功[数据未示出]。与此相反,KASP技术可以通过使用引物,通过荧光标记的差异检测仅一种碱基差28].
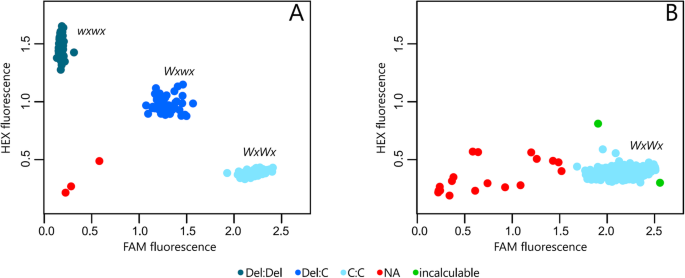
HEX荧光法检测蜡质纯合子(WXWX.), FAM荧光检测非蜡质纯合子(WXWX.),而杂合子则通过中间荧光(WXWX.).在通过KASP的MEWXEX6-DEL-C删除的第一次分析中,我们使用了一组94种附加,并且只有2017wx-02-17和7934-1基因型没有产生一致的荧光检测信号或未放大(图.4),而基因型2017wx-01-02和2017wx-02-19并没有出现预期的等位基因。因此,该最初的分析中识别所述蜡质和非蜡质表现型产生了96%的成功率。然后将1529个种质进行基因分型的方法的验证,并在此阶段有仅18种基因型(S1-1662-65,BGM-0052,BGM-0056,BGM-0314,BGM-0336,BGM-1037,BGM-1415,BGM-1598,BGM-1698,BGM-1716,BGM-1756,BGM-2245,BGM-2252,BGM-2257,BGM-2278,BGM-0150,BGM-0856,BRASILEIRA),对此我们不能识别与蜡质表现型(图相关联的等位基因。4).因此,KASP可以精确识别98%的个体。
这些分析的主要结果如下:1)在所评价的种质中,GBSSI基因1701 bp位点C等位基因缺失,缺乏木薯杂合种质;(ii)木薯基因型等位基因条件鉴定的高特异性。因此,这个点突变可以准确地鉴定任何木薯种质的蜡质基因的等位条件(图。4).
讨论
利用SNAP标记对木薯种质资源进行初步评价的主要目的是鉴定与糯性表型相关的等位基因的存在,一旦糯性表型在隐性条件下表达出来,指导种质资源的自花授粉。因此,我们使用了与Aiemnaka等人之前描述的蜡样突变相关的引物[27]在原始源AM205-6。然而,评估28号时的MeWxI11-G / C的引物用于与从拉丁美洲种质蜡质表型的个体的识别低效证实1从鉴定为具有对于g自花授粉衍生家庭等位基因与蜡质性状相关。报道引物未查明糯表型,由于S1具有G / g基因型的个体根据该领域的碘试验具有高淀粉糖含量。因此,可以推测先前由AIEMNAKA等人鉴定的SNP。[27[位置3197bp的C-g)可用于仅在衍生自AM205-6源的分离群体中的分子标记辅助选择,并且不可能验证其用于不同的遗传背景。
基于在蜡质和非蜡质个体中进行的完整GBSSI基因测序,Aiemnaka等人描述的所有突变[27[包括在外显子6(MEWXE6-DEL-C)中的一个吲哚,外显子11(MEWXE11-3025和3026)中的两个SNP,以及内含子11(MEWXI11-3046)中的一种取代。In addition, 13 other SNPs in the GBSSI gene were also found (MeWxU’5–86 and 93; MeWxE1–381,435, 543; MeWxE10–2734; MeWxE13–3424, 3459; MeWxU’3–3790, 4041, 4113, 4195). However, out of the 16 SNPs identified in the GBSSI gene, none of them were individually able to distinguish waxy and non-waxy phenotypes.
GBSSI基因测序使用了90份来自拉丁美洲不同来源的木薯材料,这些材料代表了该作物的巨大遗传多样性。这种高度的多样性对于识别蜡质和非蜡质基因型中常见的SNPs至关重要。因此,这些数据是一致的,可以作为进一步研究木薯与蜡质淀粉的关系的基础。类似的结果也在印度东北部的印度水稻品种中得到了报道,在那里,GBSSI基因突变之前与直链淀粉含量有关,并没有区分蜡样表型[29].五个品种由作者评估糯米,二没有突变,和非蜡质中,一个突变发生在一个品种。Choudhury等。[29[还研究了负责稻米中的Acculus颜色的OSC1基因座,并且他们发现归因于无色特征的OSC1基因中的10bp缺失,在21个品种中没有检测到这种表型。此外,含有着色组织的九种水稻品种之一提出了缺失。因此,被认为是与水稻中的蜡质淀粉和组织颜色相关的突变并不一定对应于不同遗传背景中的预期表型。
只有删除MEWXE6-DELC(第1701 BP)的删除件仅包括来自AM206-05原始来源的蜡质个体,因此能够在这些人群中表征蜡质表型。此删除在外显子8(位置2069bp)的早产TGA停止密码子可防止完全合成GBSSI酶[27].GBSS与颗粒结合,很可能是在支链淀粉形成的颗粒基质中合成直链淀粉。因此,突变体产生的直链淀粉较少或不产生直链淀粉,表明在这一功能上没有其他合成酶可以替代它[30.].
用于筛选MEWXE6-DEL-C缺失的KASP基因分型显示出高精度的蜡质和非蜡质分类[98%]。实际上,其他作者报告了KASP技术的高度灵活性和高精度,用于高性能基因分型[28].该KASP基因型允许的纯合和杂种质之间有明显的区别在训练群体,证明其巨大潜力的分子辅助选择。在这个意义上说,我们的工作是木薯育种的重要进展,因为它证实了基因分型KASP由标记MeWxEx6-DEL-C常规检测糯表型,使用从AM206-05源等位基因时。在未来,高通量筛选(HTS)与木薯几个重要的功能性标记物将是可能的,如已在其它作物如小麦,用于从不同的农艺性状超过38个多态性进行了分析与KASP的情况下技术[31].KASP基因分型测定的速度高于凝胶基PCR标记的45倍。
不同物种的分析支持蜡质表型与GBSSI酶的缺失/缺乏有关的感知,与基因的部分和完全缺失,SNP的存在和转换元素有时导致停止密码子[17,18,19,20.,21,32,33].在木薯中,表征这种表型遗传的GBSSI基因中发现了第一个自然隐性突变[27].However, this causal mutation determined by the deletion of a cytokine in exon 6 at position 1701 bp was not identified in the cassava germplasm analyzed here, so it will not be possible to explore the use of this mutation to generate segregating populations for the waxy gene in backgrounds other than the original source AM206–05 [34].然而,需要注意的是在整个进化过程中,不同的突变位点已经被描述为负责其他淀粉品种糯表型是很重要的。因此,因果突变的其他点可以在拉丁美洲的整个木薯种质基于基因测序GBSSI木薯被发现。事实上,未发表的研究结果表明有造成这些表型糯木薯至少两个不同的突变(塞瓦略斯,个人通信)。在玉米,与糯已经淀粉几个突变报道,包括插入和大小不等的缺失以及转座子和SNP [15].最近的突变包括RF2基因的转置[35.],在外显子7和10中删除[16]和外显子6和7中的转座因子[21鉴定为GBSSI基因中的功能突变,与玉米中的蜡状表型相关。
另一个重要方面是定量测定直链淀粉含量的个体表型,这可以识别不同直链淀粉含量的不同等位基因模式。根据Dobo等人[36.外显子1 (G/T多态性)、外显子6 (A/C多态性)和外显子10 (C/T多态性)表现出5种不同的等位基因模式:TCC、TAC、GCC、GAC和GAT。等位基因形式TAC和TCC存在于低直链淀粉品种中,GCC存在于中等直链淀粉品种中,GAT和GAC存在于高直链淀粉品种中。
通常,淀粉合成是复杂的并且来自几种酶的协调作用及其同种型[13].一个例子是靶向淀粉(PTST)的蛋白质拟南芥蒂利亚纳(L.),与直链淀粉合成有关。该蛋白质对靶向和GBSSI运输作用[37.,38.,因此直链淀粉的合成尚未完全阐明。无PTST因子的突变体A. Thaliana.不要产生直链淀粉,因为通常与淀粉结合的GBSS蛋白不能在不存在PTST的情况下结合。最近,证明了CRISPR-CAS9的应用,通过靶向诱变产生具有改性淀粉的木薯克隆PTST1.基因。这些克隆木薯在与野生型相比,表现出较低的直链淀粉含量,显示出PTST还参与淀粉中直链木薯块根[合成26].因此,可以说,除了在基因水平直接突变,其他基因组区域可能有助于解释糯表型,因此可选择。
在PTST基因(Manes.02G075700)已经描述的并且被映射木薯染色体2上不同的功能的突变,以及位于1号染色体的其他GBSSI同种型的识别(Manes.01G055700)39.,这可能会为更好地理解拉丁美洲种质中蜡质基因表达的分子基础带来新的贡献。考虑到GBSSI基因是已知的唯一负责直链淀粉合成的合成酶,而PTST蛋白负责GBSSI的靶向,对这类基因(包括启动子区域)进行完整的(配对端)测序,在木薯种质中寻找蜡质表型的等位基因将是第一步。被评估基因的所有核苷酸多样性将允许广泛的硅评估潜在突变点钝化直链淀粉生产。这些信息与测序结果相联系,将指导杂合子自花授粉。对于已经获得的种群,先对分离进行分子评估,然后使用碘测试进行实地评估,将确定有希望的个体。最后,利用已验证的标记在新的蜡质基因型来源中进行不同遗传背景的KASP评价,重申这些突变在选择潜在的木薯蜡质育种亲本方面的潜力。
结论
以前报道的GBSSI相关的SNP和本作中的那些在除了AM206-5源以外的遗传背景中的分子标记辅助选择不用。只有外显子6(MEWXEX6-DEL-C)的删除能够完全区分非蜡质和蜡质基因型。虽然评估的种质没有与原始AM206-5来源相关的等位基因,但我们的结果有助于建立使用分子辅助选择的实际模型,以便与Cassava中与蜡状表型相关的等位基因变异一起使用目标用所需等位基因优化特定基因型的基因分型及早期鉴定。
方法
木薯种质资源AM206-5蜡质表型相关的单核苷酸扩增多态性[SNAP]标记筛选
分析了巴西农业研究公司Embrapa Mandioca e Fruticultura巴西木薯种质库(巴西农业研究公司- Embrapa木薯和水果)的1529份来自巴西、哥伦比亚、委内瑞拉和乌干达不同生态系统的木薯种质库(补充-表S1).DNA提取按CTAB(十六烷基三甲基溴化铵)方案进行[40].验证提取的DNA的质量和数量,溴化乙酰乙锭(1.0mg。−1)用于染色的DNA在1%(W / V)琼脂糖凝胶(Invitrogen,USA),并用肉眼与各种浓度的λDNA(Invitrogen,美国)的比较。
Aiemnaka等人发现的突变位于外显子6(在92核苷酸处缺失1 bp)和外显子11 SNP (GC到at) [27]即使经过多次PCR调整,不优化。因此,仅使用单核苷酸扩增多态性(SNAP)进行木薯种质(地方品种和改良品种)的基因分型引物MeWxI11-G和MeWxI11-C开发由Aiemnaka等。[27,位于蜡质基因(GBSSI)的第11内含子上。聚合酶链反应(PCR)在最终体积为15 μL,含10 ng DNA, PCR缓冲液1x, 1.5 mM氯化镁中进行2(4G,巴西),0.2毫米的DNTP(Promega,USA),每种底漆(综合DNA Technologies,USA)的0.2um,1 U of Taq DNA聚合酶(Promega,USA)。扩增程序由94℃的循环组成2分钟;30°C的30次循环30秒;在56℃下的退火步骤30s和72℃,1分钟;使用Veriti®96-Well Model ThermoCcycler(Applied Biosystems,USA)进行72°C的最终延伸5分钟。为了开发扩增产物,2%(w / v)1000琼脂糖凝胶(Invitrogen,USA)含有1.0mg。L.−1使用溴化乙锭并在TBE 0.5x缓冲液中电泳(45mM Tris-硼酸盐,1mM EDTA)。凝胶上的产品在UV光中可视化并用凝胶逻辑212 Pro PhotoDichumentator(Carestream分子成像,USA)记录。
评价S.1后代使用SNAP标记
预先用杂合形式的Intron 11(Mewxi11-G-相关的Mewxi11-G-相关)的1197bp的G等位基因先前鉴定了二十八种基因型。27]对用蜡质表型产生纯合体的产生自我施肥。根据2014年8月至11月的开花的选择的木薯类化合物是BGM0061,BGM0131,BGM0132,BGM0222,BGM0463,BGM0505,BGM0726,BGM055,203,BGM0741,BGM0941,BGM0935,BGM0941,BGM0962,BGM1023,BGM0962,BGM1023,BGM1041,BGM1120,BGM1143,BGM1148,BGM1253,BGM1284,BGM1288,BGM1335,BGM1378,BGM1383,BGM1413和BGM1819。
为了进行木薯粉的自我授粉,在用布袋(20×15cm)的早晨开口之前覆盖了接受的女性花,以保护它们免受花粉污染。早上收集相同基因型的雄花,并置于预先标记的大盖瓶中。在早上和傍晚,通过对女性花的耻辱的接触来进行自我授粉,以确保人工授粉。然后,授粉花覆盖着voile [浅棉布]直到自然裂开后收集种子。
将28份自花授粉的种子在温室中播种,30天后移栽到田间。这些植物在种植10个月后被收获并进行评估。的年代1使用2%碘试验(2g Ki和0.2g I2在蒸馏水中的2%碘试验(2g Ki和0.2g I2)中评价每个家族的植物,施用于所有基因型的根部的横截面[25].长直链淀粉链具有高能力与溶液中的碘结合,这给出含有碘时含有淀粉糖的淀粉的蓝色。相反,碘蛋白素具有低碘结合能力,因此,红棕色污渍是仅含有该聚合物的淀粉的特征[7].
S的评价后,1本领域的家庭,属于家庭S1-BGM0061(60个体),S1-BGM0463(24个样品)和S1-BGM0935(101样品)的185个基因型是基因分型,如前所述,用捕获标记进行基因分型。S中GBSSI基因的分子偏析1基于引物MEWXI11-G和MEWXI11-C的个体进行了评估2测试\({\ sum} _ {i = 1} ^ n \ frac {{\ left [{f} _o- {f} _e \ light]} ^ 2} {f_e} \), 在哪里fo和fe是表型观察到的和预期的频率。
GBSSI基因测序
已于89个木薯基因型进行完整的GBSSI基因测序。这个总的,54份材料被认为纯合使用引物MeWxI11-G和MeWxI11-C(非蜡质表现型)(CC)或杂合(CG),和35个基因型分离从AM206-5衍生群体。后者的,3为纯合子(CC)或杂合(CG)(非蜡质表现型),和32为纯合子(GG)基因型(蜡状表型)(表2).如前所述进行基因组DNA的提取和定量。
为了完全扩增基因,使用来自木薯基因组V6.1的GBSSI基因(Manes.02G001000)的参考序列来开发五个引物[39.]保存于Phytozome v12.1数据库[41.] (桌子3.).Primer3计划[42.]设计引物,引物大小在800 ~ 1100 bp之间;退火温度在60℃以上;G / C比例在40%以上。引物被分配到每个序列重叠,以确保基因完全覆盖。
为了优化引物,我们测试了不同的退火温度(58 ~ 64℃)、氯化镁浓度(1、1.5和2 mM)和不同的PCR扩增循环次数。优化PCR反应是在最后一卷50μl包含10 ng的DNA, 1 x PCR缓冲,1.5/2.0毫米MgCl 2(美国表达载体),0.2毫米核苷酸(美国Promega),每个引物2毫米(集成DNA技术,美国),和1 U的Taq高保真DNA聚合酶(美国表达载体)。扩增程序通过在95°C下1 min的初始变性循环进行优化;然后在95°C下30/35个循环15 s,在62°C下15 s和72°C下30 s;在Veriti®96井热循环器(美国应用生物系统公司)中,在72°C下进行最终延伸7分钟。
用Exosap-IT(Affymetrix,USA)纯化电泳产物,在两个方向上使用Bigdye®终结器V3.1循环测序(Applied Biosystems,USA)进行测序,并用ABI Prism 3730 XL分析仪(Applied Biosystems,USA)分析。分配色谱图并用phred [43.,44.],与参考序列的频率对齐,借助Newsnp v3.0.1程序识别SNP [45.].通过与木薯基因组v6.1的GBSSI基因(Manes.02G001000)进行比对,确定编码区和非编码区[39.].
主成分的判别分析
基于GBSSI全基因测序所鉴定的等位变异进行主成分判别分析(dacc)。采用ddac,保留了前10个主成分和一个判别函数的数据的90%以上的变异。分析是使用adegenet.包(46.]软件R v3.5 [47.].
删除Mewxex6-Del-C的木薯种质的基因型评价
基因类等位基因特异性PCR(KASP)技术[28]为了筛选删除Mewxex6-Del-C,由Intertek Agritech进行。KASP基因分型优化在两个阶段进行。在第一步中,使用了一组具有已知等位基因条件的个体,即31个纯合的蜡质基因(WXWX.);31个杂合子个体(WXWX.)和32个非蜡质个体(WXWX.)4).使用SNPViewer2 V4.0.0程序检测到等位基因特异性荧光(六角形和FAM)。和群集使用R v.3.5来可视化[47.].优化和MeWxEx6-DEL-C标记的验证,1529个木薯种质基因分型后进行。
数据和材料的可用性
在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。
缩写
- GBSSI:
-
颗粒状淀粉合酶I(GBSSI)
DAPC.
判别主成分分析
- KASP:
-
Kompetitive等位基因特异性PCR
- SNP:
-
单核苷酸多态性
- mewxi11-g / c:
-
内含子11单核苷酸多态性表现为G/C碱基替换
- MeWxEx6-del-C:
-
在外显子6的核苷酸92处缺失1-BP缺失,在GBBSI基因上产生过早的止锁密码子
- 马斯:
-
分子辅助选择
- 折断:
-
单核苷酸扩增多态性标记
- UTR:
-
未经翻译的地区
参考文献
- 1.
Keeling PL, Myers AM。淀粉合成的生物化学和遗传学。食品科学技术。2010;1:271-303。https://doi.org/10.1146/annurev.food.102308.124214.
- 2.
陈志强,王志强,王志强,等。淀粉的分子结构及其对淀粉颗粒结构的影响[j]。淀粉/斯达克。2010; 62:389 - 420。https://doi.org/10.1002/star.201000013.
- 3.
唐明杰。淀粉的形态和功能。食物Hydrocoll。2009;23:1527-34。https://doi.org/10.1016/j.foodhyd.2008.09.016.
- 4.
块茎和根茎淀粉的组成、分子结构和理化性质:综述。Carbohydr石油。2001;45:253 - 67。https://doi.org/10.1016/s0144-8617(00)00260-5.
- 5。
辛格n,singh j,kaur l,sodhi ns,gill bs。不同植物来源的淀粉的形态学,热性和流变性质。食品化学。2003; 81:219-31。https://doi.org/10.1016/s0308-8146(02)00416-8.
- 6。
王克,亨利·克,吉尔伯特rg。淀粉生物合成,结构和性能之间的因果关系。Springer SCI Rev. 2014; 2:15-33。https://doi.org/10.1007/s40362-014-0016-0.
- 7。
Denyer K, Johnson P, Zeeman S, Smith AM。直链淀粉合成的控制。acta botanica sinica . 2001; 58(4): 489 - 494。https://doi.org/10.1078/0176-1617-00360.
- 8。
Šárkae,dvoğáčekv.蜡质淀粉的新加工和应用(审查)。J Food Eng。2017; 206:77-87。https://doi.org/10.1016/j.jfoodeng.2017.03.006.
- 9。
王S,利C,谷轮L,牛Q,王S.淀粉回生:全面审查。Crome Rev Food Sci Food Saf。2015; 14:568-85。https://doi.org/10.1111/1541-4337.12143.
- 10。
Sánchezt,dufour d,Moreno ix,Ceallos H.蜡状和棕榈淀粉的粘贴和凝胶稳定性与热,化学和机械应力下的新型蜡质木薯淀粉中的蜡质和正常淀粉的比较。JAgric Food Chem。2010; 58:5093-9。https://doi.org/10.1021/jf1001606.
- 11.
Rolland-SabatéA,SánchezT,BuléonA,Colonna P,Jaillais B,Ceallos H,Dufour D.与其他商业来源相比,具有低和高淀粉糖含量的新型木薯淀粉的结构表征。食品Hydrocoll。2012; 27:161-74。
- 12.
Waterschoot J, Gomand SV, Fierens E, Delcour JA。玉米、木薯、小麦、马铃薯和水稻淀粉的生产、结构、理化和功能特性。淀粉/斯达克。2015; 67:14-29。https://doi.org/10.1002/star.201300238.
- 13.
Tetlow IJ,Morell Mk,Emes MJ。了解高等植物中淀粉代谢调控的最新发展。J Exp Bot。2004; 55:2131-45。https://doi.org/10.1093/jxb/erh248.
- 14。
Zeeman Sc,Kossmann J,Smith Am。2010.淀粉:植物中的新陈代谢,演化和生物技术改性。Annu Rev植物Biol。2010; 61:209-34。https://doi.org/10.1146/annurev-arplant-042809-112301..
- 15.
黄伯强,田茂林,张建军,黄永波。玉米蜡质位点及其突变体类型玉米L. AGRIC中国科学。2010; 9:1-10。https://doi.org/10.1016/s1671-2927(09)60061-4.
- 16。
范L,宝Ĵ,王Y,姚军,桂Y,胡W,朱Ĵ,曾男,李源,在玉米淀粉途径徐Y.后驯化选育。Plos一个。2009; 4:e7612。https://doi.org/10.1371/journal.pone.0007612.
- 17。
Larkin Pd,Park Wd。蜡质基因单核苷酸多态性与水稻中淀粉特性的关联(奥雅萨苜蓿L.)。mol品种。2003; 12:335-9。https://doi.org/10.1023/b:molb.0000006797.51786.92..
- 18。
Kharabian-Masouleh A,Waters Dle,Reinke Rf,Ward R,Henry RJ。淀粉生物合成基因中的SNP与水稻的营养和功能性质相关。SCI批准。2012; 2:557。https://doi.org/10.1038/srep00557..
- 19。
Saito M,Nakamura T. eMMER小麦中鉴定的双点突变产生无效WX-A1等位基因。Al Appl Genet。2005; 110:276-82。https://doi.org/10.1007/S00122-004-1830-6.
- 20。
张立,陈开,罗米,张x,邓米,马茹,齐p,王j,陈g,刘y,pu z,李文,兰x,魏y,郑y,江Q.转座插入导致在中国小麦地体中的WX-B1N沉默。Al Appl Genet。2015; 130:1331。https://doi.org/10.1007/S00122-017-2901-9..
- 21。
小阳W,Dan C,Yuqing L,Weihua L,Xinming Y,Xiuquan L,Juan D,Lihui L.中国两种新的蜡质突变的分子特性。mol品种。2017年。https://doi.org/10.1007/s11032-016-0612-6.
- 22。
Raemakers K, Schreuder M, Suurs L, Furrer-Verhorst H, Vincken J-P, de Vetten N, Jacobsen E, Visser RGF。通过反义抑制颗粒结合淀粉合酶改进木薯淀粉I. Mol . Breed, 2005; 16:163-72https://doi.org/10.1007/s11032-005-7874-8.
- 23.
Koehorst-van Putten HJJ, Wolters AM, Pereira-Bertram IM, van den Berg HH, van der Krol AR, Visser RG。木薯块根特异性启动子的克隆与特性研究(木薯耐Crantz)。Planta。2012; 236:1955至1965年。https://doi.org/10.1007/s00425-012-1796-6.
- 24.
赵松松,杜福尔,Sánchez T,张鹏。不同淀粉生物和理化特性的蜡质木薯的开发。Biotechnol Bioeng。2011;108:1925-35。https://doi.org/10.1002/bit.23120.
- 25.
Ceballos H, Sánchez T, Morante N, Fregene M, Dufour D, Smith AM, Denyer K, Pérez JC, Calle F, Mestres C.木薯无直链淀粉突变体的发现(木薯耐Crantz)。JAgric Food Chem。2007; 55:7469-76。https://doi.org/10.1021/JF070633Y..
- 26。
公牛SE,升d,Chanez C,梅塔d,九怨Ĵ,Truernit E,等人。GBSS的加速易地繁育 - 和PTST1 -edited改性淀粉木薯。SCI ADV。2018; 4:eaat6086。https://doi.org/10.1126/sciadv.aat6086..
- 27。
Aiemnaka P,Wongkaew A,Chanthaworn J,Nagashima Sk,Boonma S,Authapun J,Jenweerawat S,Kongsila P,Kittipadakul P,Nakasathien S,Sreewongchai T,Wannarat W,Vichukit V,López-Lavalle实验室,CEBallos H,Rojanaridpiched C,彭甘泰C.木薯中自发蜡淀粉突变的分子表征。农作物科学。2012; 52:2121-30。https://doi.org/10.2135/cropsci2012.01.0058.
- 28。
基于竞争等位基因特异性PCR (KASP)的单核苷酸多态性基因分型技术及其在作物改良中的应用。摩尔品种。2014;33:1-14。https://doi.org/10.1007/S11032-013-9917-X..
- 29。
关键词:水稻,OsC1,驯化相关基因,遗传多样性,表型BMC麝猫。2014;15:71。https://doi.org/10.1186/1471-2156-15-71.
- 30。
Pfister B,Zeeman Sc。植物细胞中淀粉的形成。细胞mol寿命。2016; 73:2781-807。https://doi.org/10.1007/s00018-016-2250-x.
- 31。
Rasheed A,Wen W,Gao F,Zhai S,Jin H,Liu J,Guo Q,Zhang Y,Dreisigacker S,夏X,Z Z。Kasp测定的基因kasp测定基因的基因在面包小麦中的关键经济特征。Al Appl Genet。2016; 129:1843-60。https://doi.org/10.1007/s00122-016-2743-x.
- 32。
Monari Am,Simeone MC,Urbano M,Margiotta B,Lafiandra D.在面包和硬质小麦中发现的新蜡状突变体的分子表征。Al Appl Genet。2005; 110:1481-9。https://doi.org/10.1007/S00122-0055-1983-Y..
- 33。
易X,江泽民,胡w,zha y,bie t,gao d,liu d,wu r,cheng x,cheng s,zhang y。用于选择突变的wx-d1d的异教等位基因特异性PCR标记的开发小麦育种等位基因。植物品种。2017; 136:460-6。https://doi.org/10.1111/pbr.12504.
- 34。
莫伦特N,塞巴洛斯H,桑切斯T,罗兰-SabatéA,卡勒女,赫氏C,吉尔伯特O,中的不含直链淀粉木薯和它们的结构的分析和技术 - 功能性质的新的自发源杜氏D.发现。食品Hydrocoll。2016; 56:383-95。https://doi.org/10.1016/j.foodhyd.2015.12.025.
- 35.
刘九,荣T,李W.蜡状玉米颗粒结合淀粉合成酶基因的突变基因座和腺体选择标志。mol品种。2007; 20:93-102。https://doi.org/10.1007/S11032-006-9074-6.
- 36.
多博男,艾尔N,沃克G,公园WD。多态性基因GBSS影响美国直链淀粉含量和欧洲的稻种。Ĵ谷物科学。2010; 52:450-6。https://doi.org/10.1016/j.jcs.2010.07.010.
- 37.
Seung D,Boudet J,Monroe J,Schreier TB,David Lc,Abt M,Lu K,Zanella M,Zeeman Sc。靶向淀粉淀粉颗粒的蛋白质的同源物拟南芥树叶。植物细胞。2017; 29:1657 LP-1677。https://doi.org/10.1105/tpc.17.00222.
- 38。
Seung D,Soyk S,Coiro M,Maier Ba,Eicke S,Zeeman Sc。靶向淀粉的蛋白质是将颗粒结合的淀粉合酶定位为淀粉颗粒和正常直链淀粉合成拟南芥.Plos Biol。2015; 13:E1002080。https://doi.org/10.1371/journal.pbio.1002080.
- 39。
Bredeson JV,Lyons JB,Prochnik Se,Wu Ga,Ha Cm,Edsinger-Gonzales E,Grimwood J,Schmutz J,Rabbi Iy,Eyesi C,Nauluvula P,Lebot V,Ndunguru J,Mkamilo G,Bart Rs,Setter TL,Gladow Rm,Kulakow P,Ferguson Me,Rounsley S,Rokhsar DS。测序野生和培养的木薯和相关物种揭示了广泛的间隙杂交和遗传多样性。NAT BIOTECHNOL。2016; 34:562-70。https://doi.org/10.1038/nbt.3535.
- 40。
Doyle J, Doyle J.从新鲜组织中提取植物DNA。焦点。1990;12:13-5。
- 41。
Goodstein DM,Shu S,Howson R,Neupane R,Hayes Rd,Fazo J,Mitros T,Dirks W,Hellsten U,Putnam N,Rokhsar DS。植物血统:绿色植物基因组学的比较平台。核酸RES。2012; 40:1178-86。https://doi.org/10.1093/nar/gkr944.
- 42。
Untergasser A,Cutcutache I,Koressaar T,Ye J,Faircloth BC,Remm M,Rozen SG。primer3 - 新功能和接口。核酸RES。2012; 40:E115。https://doi.org/10.1093/nar/gks596.
- 43。
尤因B,绿P.碱基调用的用Phred自动测序痕迹。第二类错误的概率。Genome Res。1998; 8:186-94。https://doi.org/10.1101/gr.8.3.186.
- 44。
Ewing B, Hillier L, Wendl MC, Green P.使用Phred的自动音序器追踪的基础呼叫。我准确的评估。基因组研究》1998;8:175 - 85。https://doi.org/10.1101/gr.8.3.175.
- 45。
Weckx S,Del-Favero J,Rademakers R,Claes L,Crurs M,De Jonghe P,Van Broeckhoven C,De Rijk P. NovoSnp,一种用于序列变异发现的新型计算工具。Genome Res。2005; 15:436-42。https://doi.org/10.1101/gr2754005.
- 46。
Jombart T,Ahmed I. Adegenet 1.3-1:用于分析基因组SNP数据的新工具。生物信息学。2011; 27:3070-1。https://doi.org/10.1093/bioinformatics/btr521.
- 47.
r核心团队。R:统计计算的语言和环境。维也纳:统计计算基金会;2018. ISBN 3-900051-07-0,URL。http://www.r-project.org..
致谢
我想感谢实验室Andresa Priscila德索萨拉莫斯,雷蒙多·佩雷拉·达席尔瓦和Vandeson罗德里格斯德索萨,对他们的帮助的技术人员为我提供了支持,需要开发研究。
资金
我们感谢的CNPq(Conselho国立DesenvolvimentoCientíficoËTecnológico)的研究生产力奖学金(E.J.O.)和披肩(Coordenação德Aperfeiçoamento德Pessoal德NIVEL高级)的博士生奖学金(C.D.C.)。这些资助机构不得不在研究和收集,分析和解释数据的设计,并以书面的稿子没有任何作用。
作者信息
隶属关系
贡献
CDC,MBS,HC和EJO,构思,设计和分析了实验的数据。CDC,GAFO和PPS涉及GBBSI克隆,KASP分析和写作;EJO参与了外地和实验室评估和CATIA的论文的监督。所有作者都读过并批准了稿件。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有利益冲突。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
Do Carmo,C.D.,Sousa,M.B.E.,Dos Santos Silva,P.P.等等。木薯蜡样表型相关突变点的鉴定与验证。BMC植物BIOL.20,164(2020)。https://doi.org/10.1186/s12870-020-02379-3
已收到:
接受:
发表:
关键词
- 蜡质淀粉
- 筛选
- 测序
- KASP
- 配种