摘要
背景
保养红薯(番薯甘薯(l)蓝)生长和产量,蔗糖必须从叶片运输到根。蔗糖转运体或载体(SUTs或suc)运输蔗糖,参与植物生长和对非生物胁迫的反应。然而,SUTs在甘薯抗非生物胁迫中的作用机制尚不清楚。
结果
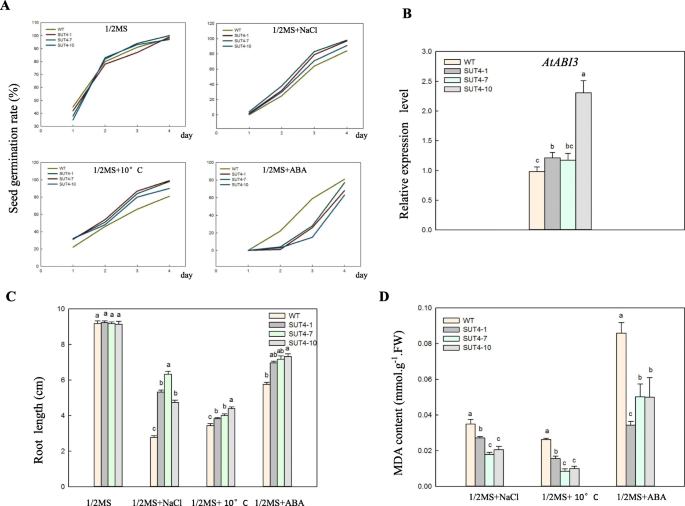
在本研究中,我们克隆了一本小说IbSUT4基因;由该基因编码的蛋白质定位于液泡体和质膜。对植物生长有促进作用IbSUT4转基因拟南芥线条,用增加的表达AtFT它是植物开花时间的调节因子。表达的IbSUT4在拟南芥与野生型(WT)植物相比,根系中蔗糖含量较高,叶片中蔗糖含量较低,从而提高了幼苗生长期间的抗胁迫能力。并系统分析了其作用机制IbSUT4对非生物压力的反应。结果表明,ABRE-motif定位于IbSUT4启动子区,ABA信号通路基因(即—ABF2,ABF4,SnRK2.2,SnRK2.3,而且PYL8 / RCAR3的表达ABI1被抑制。
结论
我们的数据提供了证据IbSUT4它不仅参与植物的生长,而且通过abf依赖的ABA信号通路在植物的胁迫耐受中起重要的正向调节作用。
背景
在高等植物中,光同化物主要以蔗糖的形式从源器官运输到库器官。蔗糖的合成、储存、运输和利用是细胞活性、器官和组织发育以及作物产量的一些主要决定因素[1].蔗糖转运是由多种蛋白质介导的,其中蔗糖转运蛋白或载体(称为SUTs或suc)介导蔗糖跨膜运动。
植物SUTs属于主要辅助超家族(major facilitator superfamily, MFS),是具有12个跨膜区域的完整膜蛋白[2].假设SUTs为H+-蔗糖转运蛋白参与细胞质子偶联蔗糖摄取,并可能在外质体途径中发挥两种主要功能:将蔗糖装载到源叶的韧皮部中,并将蔗糖卸载到库器官的细胞中,如贮藏根、块茎、果实和发育组织[3.].在植物中已经鉴定和鉴定了几种SUTs。如Riesmeier等(1992)首次克隆了菠菜SUT cDNA,并验证了其在酵母中的转运功能[4].随后,SUTs的拟南芥据报道。Sauer和Stolz(1994)使用了菠菜SUTcDNA作为探针进行筛选拟南芥cDNA文库,分离SUT1而且SUT2[5].的AtSUC对S进行了分析,发现由三个不同的亚家族组成。编码的低底物特异性蛋白AtSUC2在收集韧皮部高度表达,参与韧皮部负载和运输韧皮部泄漏蔗糖的回收[6,7].在没有蔗糖的情况下AtSUC2突变苗比野生型(WT)苗小[8].与其他suc相比,AtSUC9对蔗糖有超高的亲和力。植物与AtSUC9突变对低蔗糖水平敏感,在短日照条件下有早开花表型,这表明AtSUC9与花香诱导有关[9].相比之下AtSUC9,AtSUC4,属于su4支系,具有低蔗糖亲和力,是唯一的拟南芥SUC已知定位于液泡体,从液泡中释放蔗糖[10].除了拟南芥在美国,其他植物中的suc也被研究过。抑制StSUT4,主要表达在块茎、沉底叶和花等沉底器官中,导致提早开花,增加块茎产量,降低对远红光的敏感性,这可能是由于光照期结束时叶片蔗糖输出增加[11].rnai抑制的转基因杨树PtaSUT4增加叶茎生物量比,提高源叶和茎中的蔗糖含量,改变碳水化合物活性酶[12].总之,这些研究表明SUTs参与了源器官和库器官的碳水化合物分配。
SUTs还参与了植物对各种非生物应激源的反应;环境因素影响源汇关系、碳分配和植物生长[1].功能丧失突变AtSUC2而且AtSUC4导致对干旱、盐和冷胁迫过敏,而种子萌发和幼苗生长过程中ABA处理导致笋部蔗糖含量高而根部蔗糖含量低[13].相对于WT杨树植物,在那些沉默SUT4,严重干旱条件导致水分吸收速率降低和枯萎延迟[14].最近对全球公开的基因表达数据进行了分析,以评估SUT基因对不同环境刺激的响应调节[15].结果表明,SUTs对非生物胁迫有响应,但胁迫对蔗糖分布的影响及其分子机制尚不清楚。
ABA是一种广谱植物激素,在非生物胁迫中参与调控气孔开放、生长发育和协调各种胁迫信号转导途径[16,17].迄今为止,包括ABA受体在内的几种ABA通路基因已被鉴定出,这些基因负责植物对非生物胁迫的耐受性PYL8 / RCAR3以及调节因子SNF1 (SNF1活化蛋白激酶)和PP2C (2C蛋白磷酸酶)[18,19,20.,21].此外,有报道称ABA与植物的糖反应途径有关[22].Jia et al.(2015)发现低蔗糖水平诱导AtSUC9,通过ABA通路ABA诱导基因积累ABA,增强非生物抗逆性[23].
甘薯是一种双子叶作物,有地下贮藏器官。它的产量与光合产物的运输和分布密切相关。甘薯SUT基因IbSUT1而且IbSUT2之前被分离出来,免疫定位研究发现IbSUT2定位于SE-CCs(筛元伴细胞)[24,25].然而,甘薯SUTs的特征和功能以及它们介导蔗糖转运以支持下沉器官在环境刺激下的生长和发育的机制尚不清楚。在此,我们报道了一个新的甘薯SUT基因的双膜定位。IbSUT4,并通过abf依赖的ABA信号通路参与非生物应激反应。
结果
IbSUT4编码一种保守的SUT蛋白,与茄属植物StSUT4
为了研究甘薯SUTs的功能,我们克隆了一个基因(基因库:MN233360)并将其命名IbSUT4.使用简并引物SpSUT4-F和SpSUT4-R扩增预期的463 bp EST片段(图S1A)。根据扩增得到的3 '和5 ' cDNA EST序列,以及3 '和5 '末端的长度,设计了特异性引物IbSUT4得到(图S1B)。将序列拼接生成引物,得到全长1623 bp的序列,最大开放阅读距离(ORF)为1512 bp。
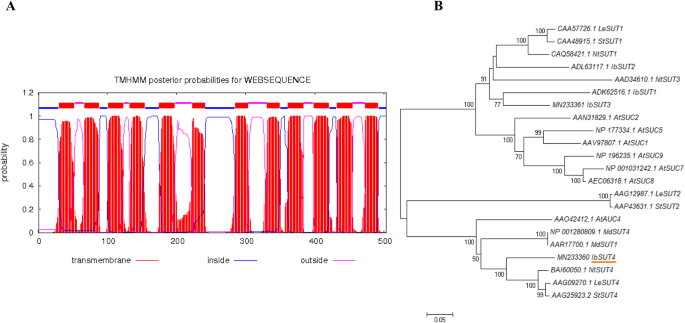
定量反转录PCR (qRT-PCR)结果表明IbSUT4在整个植物中表达量非常高,在汇器官中表达量相对较高(图S1C)。蛋白质预测软件显示,IbSUT4蛋白长502个氨基酸,包含1个MFS结构域和12个跨膜区域,是MFS家族的典型特征(图2)。1a). MFS家族作为膜转运蛋白,其基本功能是协助跨膜转运[26].
为了探讨IbSUT4蛋白与其他植物SUTs的关系,对其氨基酸序列进行了系统发育分析。BlastP和系统发育分析表明,该蛋白编码于IbSUT4属于MFS家族。此外,IbSUT4属于演化支IV,与StSUT4而且AtSUT4,两者都参与了非生物应激反应(图。1b).这表明IbSUT4也可能在对非生物胁迫的反应中发挥重要作用。
IbSUT4局限于鼓膜和质膜
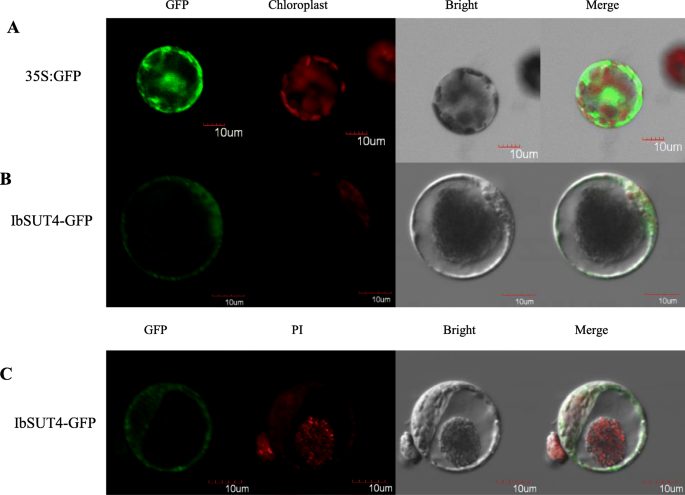
基于亚细胞定位StSUT4[11,27,我们预测到IbSUT4也可能局限于液泡体和质膜。我们构建了一个c端平移融合的GFPIbSUT4在花椰菜花叶病毒35S启动子(CaMV35S:IbSUT4-GFP)的控制下。融合蛋白的GFP信号在烟草原生质体中沿膜分布不均匀(图2)。2).GFP的不规则和圆形分布表明IbSUT4可能与烟草原生质体的液泡膜有关。
来测试IbSUT4我们用碘化丙啶(PI)对细胞核进行染色。细胞核被染成红色,细胞核周围检测到GFP信号(图。2).这些结果表明IbSUT4局限于鼓膜和质膜。
IbSUT4编码一个功能性蔗糖转运蛋白
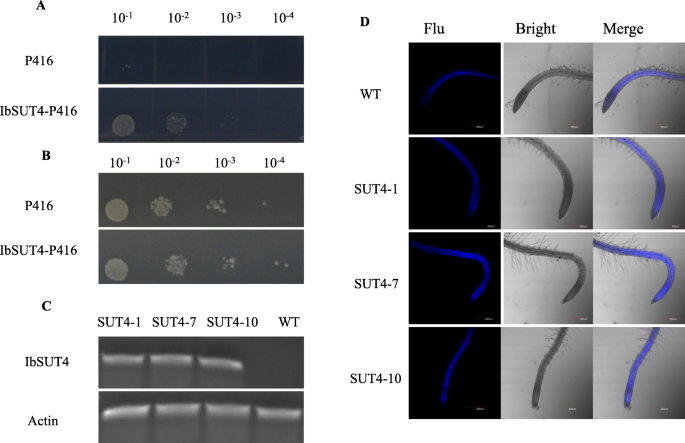
为了验证甘薯SUT的蔗糖吸收活性,我们将酵母溶液稀释并涂覆在平板上。在含2%蔗糖为唯一碳源的培养基上,SUSY7/ura3与IbSUT4生长得比用空p416GPD载体转化的酵母更好(图4)。3.a).但在含2%葡萄糖为唯一碳源的培养基上,SUSY7/ura3与IbSUT4空p416GPD矢量无差异(图。3.b).的表达式IbSUT4允许酵母在蔗糖上生长,说明IbSUT4编码一个功能SUT。
IbSUT4功能分析。一个,b的表达IbSUT4在以蔗糖或葡萄糖为唯一碳源的SUSY7/ura3酵母菌株中。30℃孵育3 d后观察。A.用空P416载体转化的SUSY7/ura3酵母IbSUT4在P416载体中,用2%的蔗糖培养。B.用空P416载体转化的SUSY7/ura3酵母IbSUT4在P416载体中,用2%的葡萄糖培养。c,dIbSUT4显示蔗糖摄取活性拟南芥.C. RT-PCR分析IbSUT4在WT和三个转基因株系(SUT41,SUT47,SUT4-10)。D. 7日龄苗对荧光橙黄素的吸收。一个,b,c印迹/凝胶从附加文件裁剪2,图s .2,3。比例尺= 300 μm
观察…的活动IbSUT4在体内,表达载体35S:IbSUT4被构造和引入拟南芥,得到6个纯合子转基因株系,均耐潮霉素。转录水平的半定量rt - pcrIbSUT4在转基因株系中显示IbSUT4上调了拟南芥(无花果。3.c).我们选择SUT41,SUT47,SUT4-10用于进一步分析。我们使用esculin(6,7 -二羟基香豆素- β- d -葡萄糖苷),蔗糖的荧光类似物,来观察其转录活性拟南芥.WT和3个转基因株系在1/ 2ms培养基上培养7天。然后,将植株在含有1mm麦青素的1/ 2ms液体溶液中孵育90分钟,观察蓝色荧光信号强度。转基因植株根部的信号强度拟南芥显著强于WT,表明在根中,叶青素在细胞内的吸收和积累(图;3.d).为了提高结果的准确性和可靠性,在图像J中对荧光强度进行了量化,结果再次确认了之前的观测结果(图S2),这意味着IbSUT4显示出蔗糖摄取活性,且这种活性在IbSUT4 -表达。
表达的IbSUT4结果花期早于拟南芥
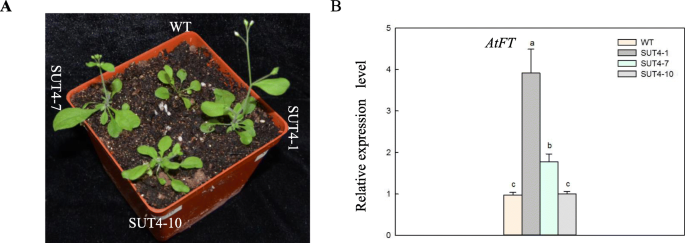
在光照16小时/暗8小时(长昼,LD)条件下生长13天后,我们评估了开花植物的数量(表S .)2),并发现IbSUT4 -表达拟南芥与野生型植物相比,开花更早,叶子更大。4a).我们还量化了开花标记基因的表达,AtFT.的开花位点t(英国《金融时报》)基因是通过光周期途径决定植物开花时间的关键位点。的英国《金融时报》基因在植物器官的营养生长和形态发生中也起调控作用[28].的表达式AtFT野生型和三种转基因之间存在显著差异拟南芥行(无花果。4B),表明IbSUT4表达诱导提早开花。这些结果表明IbSUT4参与植物生长。
表达的IbSUT4提高种子萌发时对ABA的敏感性,增加幼苗生长时的抗逆性
的可能功能IbSUT4对甘薯进行低温、甘露醇、高盐等非生物胁迫和ABA处理。qRT-PCR结果提示IbSUT4响应多种应激源(图S3),基于这些结果,我们选择高盐、低温和ABA胁迫进行研究IbSUT4表达拟南芥.
在对照条件下,野生型和转基因品系的种子发芽率无显著差异。在低温和高盐胁迫条件下,萌发率也相近。有趣的是,1 μM ABA处理显著抑制了转基因株系的发芽率。5a).为了进一步研究这一现象,我们分析了AtABI3qRT-PCR检测基因。ABA和GA激素在休眠和萌发中起重要作用[29,30.], ABA响应因子AtABI3对种子萌发具有负调控作用,高表达时可抑制种子萌发[31].AtABI3在1 μM ABA胁迫下,转基因株系的表达量显著高于野生型株系(图2)。5B),暗示过度表达IbSUT4提高了种子萌发过程中对外源ABA的敏感性。
通过测定根系长度,进一步研究了非生物胁迫对幼苗生长的影响。在对照条件下,WT和转基因株系之间的根系生长没有显著差异,但在非生物胁迫下,转基因幼苗的根系更长。5c).定量分析表明,转基因幼苗根系产生的丙二醛(MDA)较少(图2)。5d).这些结果提示过度表达IbSUT4可提高植物对非生物胁迫的抗性。
表达的IbSUT4在盐、低温和外源ABA处理下,蔗糖在茎和根中的分布发生变化拟南芥
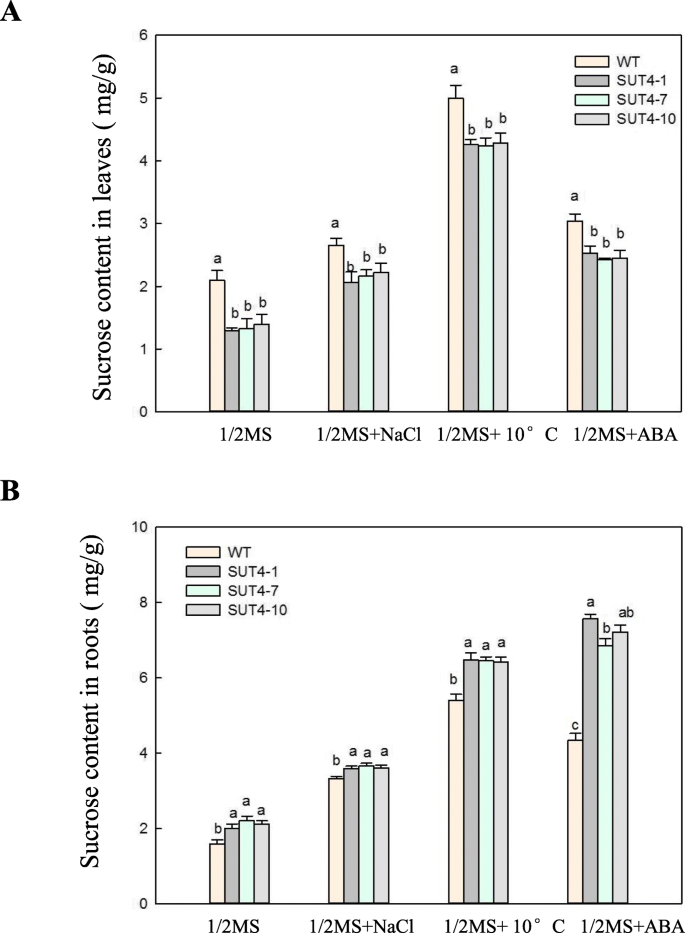
之前的研究表明AtSUC4突变体在胁迫下表现出茎和根中蔗糖分布的改变[13].因此,我们测定了胁迫条件下WT和转基因株系的蔗糖含量。转基因株系的根系比叶片表现出更多的蔗糖积累。6),暗示IbSUT4是蔗糖在胁迫条件下分配到根部所必需的。有趣的是,在各种胁迫条件下,野生型和转基因根系的蔗糖含量均高于对照,表明根系中蔗糖的积累可能对植物的抗逆性有重要作用。这些结果表明,在胁迫条件下,蔗糖在转基因株系中的分布发生了改变,这可能是转基因植物在胁迫条件下生长更好的原因。
表达的IbSUT4诱导ABA信号通路基因的表达
为了探索植物胁迫响应的分子机制,我们获得了847 bp的启动子IbSUT4通过基因组行走。使用植物CARE软件进行的分析揭示了几种应激和激素反应元素,包括MYB、LTR、ABRE和AuxRR-core(表S . 1)3.).ABRE响应元素也在IbSUT4启动子区域。abre结合转录因子在ABA信号通路中起重要作用[32,33],所以我们推测过度表达IbSUT4细胞系通过ABA信号对压力做出反应。
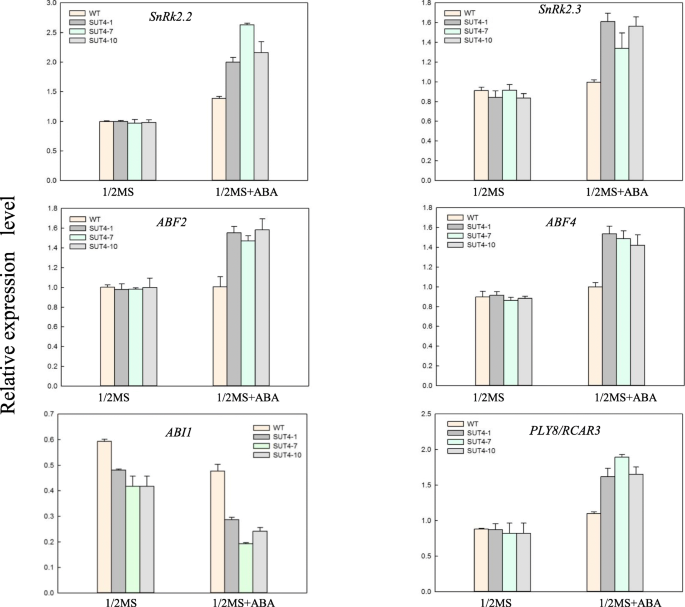
通过定量ABA信号通路基因的表达,我们进一步验证了植物通过abf依赖的ABA通路对胁迫的反应—ABF2,ABF4,SnRK2.2,SnRK2.3,PYL8 / RCAR3而且ABI1中存在。在缺乏ABA的情况下,表达SnRK2.2,SnRK2.3,—ABF2,ABF4,而且PYL8 / RCAR3WT和三个转基因株系之间没有明显差异.在40 μM ABA处理6 h后,转基因株系中大部分基因的表达量均高于野生型株系ABI1(无花果。7),是ABA信号的负调节因子。这些发现提示过度表达IbSUT4通过激活ABA受体和正调控因子,抑制负调控因子,增强ABA反应。
讨论
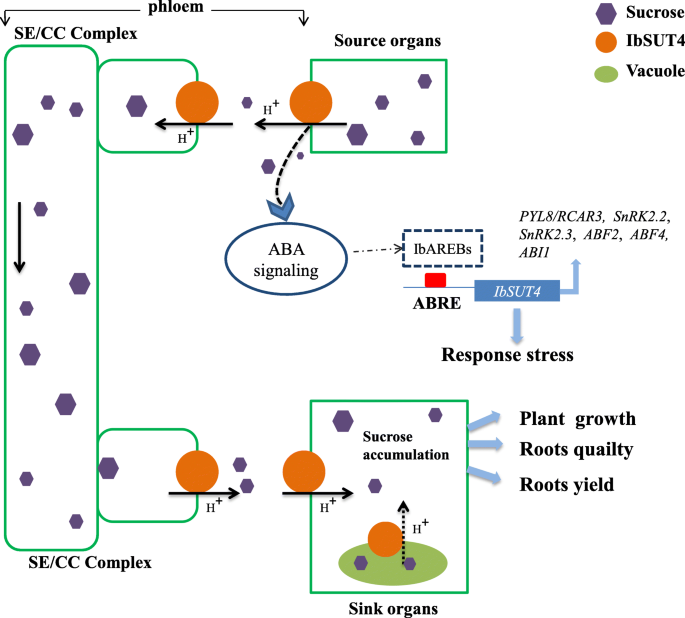
蔗糖在光合作用时产生于源叶中,作为碳源。它通过sut在整个工厂中运输,在那里它调节生长和适应环境挑战。因此,SUTs在植物生长和抗逆性中起着不可否认的重要作用[34,35,36,37].更全面地了解SUTs起作用的机制可以更好地调节蔗糖运输,从而提高甘薯的产量和品质。在这项研究中,IbSUT4 -研究了一种保守的SUT基因,其编码蛋白定位于液泡体和质膜,并在库器官中高度表达,以研究其在植物生长和抵抗非生物胁迫中的作用。结果表明IbSUT4在拟南芥可能会改善源叶片的蔗糖外排,从而增加蔗糖从源到库器官的运输,导致蔗糖在根中积累,提前开花,并通过abf依赖的ABA信号通路提高对非生物胁迫的抗性。我们的研究强调了IbSUT4在植物生长和植物对非生物胁迫的反应中。
IbSUT4编码一种功能蛋白,支持蔗糖转运
蔗糖转运蛋白在植物中最具特征的功能是将蔗糖吸收到韧皮部进行长距离的光同化物运输。然而,据报道,一些sut,如AtSUC3而且LeSUT4,不能运输蔗糖[38].之前的一项研究表明AtSUC6是编码非功能蛋白的伪基因[39].最近的研究表明AtSUC6是高亲和性H+ _调节蔗糖摄取的转运蛋白[40].植物和酵母之间的进化距离意味着植物蛋白质可能无法针对酵母中的正确膜[41,42],或者它们缺乏必要的蛋白质修饰,在异源系统中没有表现出正常的活性。在这里,我们使用SUSY7/Ura3酵母菌株转化IbSUT4以验证蔗糖摄取活性IbSUT4.转化后的细胞生长得更好(图。3.a和无花果。3.B),这与的观察结果一致StSUT1而且AtSUT4生长在以蔗糖为唯一碳源的培养基上[10,43].埃斯库林是蔗糖的荧光类似物,可在植物中运输,易于观察。拟南芥还有番茄MdSUT2过表达在根尖显示出更强的橙黄素荧光,表明蔗糖的摄取MdSUT2,并表明增强的活动MdSUT2行(44].在转基因植株中,麦青素的荧光强度比野生型植株强(图2)。3.d).转基因麦青素的荧光强度拟南芥根尖及其向外扩张积累黄豆素,可能验证了黄豆素的蔗糖摄取功能IbSUT4并解释叶青素在实质细胞空泡中的隔离作用。
我们提出了几行证据来支持这一假设IbSUT4介导甘薯中蔗糖的源库分布和蔗糖从叶片和液泡流出。IbSUT4定位于液泡体和质膜(图;2),参与蔗糖在细胞膜上的转运。的转录水平IbSUT4在汇组织中高于源组织(图S1C)。在双叶一年生植物中,SUTs如AtSUC4主要表达在花药、茎尖和花分生组织中,水槽器官的基因属于枝IV [10,45].这种表达模式与我们的观察相一致IbSUT4在根石碑。AtSUC4被证实可以释放蔗糖拟南芥液泡(42].碳汇器官不是碳自主的,而是依赖于来自源器官的光同化物的供应。蔗糖是必需的代谢库和支持生长和发育。因此,沉库以低浓度保留其液泡蔗糖,并可能使用支链IV蔗糖转运体来重新输出蔗糖。我们还测定了野生型和转基因株系的嫩枝和根的蔗糖含量。表达的IbSUT4在拟南芥结果表明,与野生型相比,在根系中蔗糖的积累量更高。6),暗示IbSUT4促进蔗糖从叶片流出,并促进蔗糖分布到库器官。Payyavula等人(2015)认为沉默PtaSUT4根据输入YL(幼叶)和ST(茎尖)时蔗糖减少的观察,减少了源叶的蔗糖流出[12].我们假设IbSUT4调节在根生长发育过程中储存在根液泡中的蔗糖的释放。当这种蔗糖被消耗时,低胞浆浓度促进蔗糖从源叶流出。未来的研究应该发展转基因技术IbSUT4甘薯系验证了这一途径。
IbSUT4在植物生长和抗非生物胁迫中起重要作用
除了作为主要的碳水化合物从来源运输到汇外,蔗糖还可能通过改变基因表达作为细胞代谢的非营养调节剂[46].因此,SUTs在植物生长和对非生物胁迫的响应中起着至关重要的作用。在高等植物中,开花标志着从营养阶段到生殖阶段的转变,对植物的生长发育非常重要。它受多种转导途径的控制,包括光周期依赖光敏色素信号转导途径、蔗糖途径和遗传因子3.通路(47,48,49].英国《金融时报》编码一种类似磷脂酰乙醇胺结合蛋白的蛋白质,在LD条件下促进开花[50,51].在本研究中,我们观察到花期早和花期增加AtFT表达式IbSUT4表示线条(图;4).这表明IbSUT4参与植物的生长发育。
以往的研究表明,其中三种的MDA含量显著降低MdSUT2MdSUT2/Col-1/2/3在胁迫处理下过表达MdSUT2在抵抗非生物胁迫方面起着重要作用,根长分析进一步支持了这一点[44].随着应激强度的提高,超氧阴离子的生成速率增加,导致细胞内超氧阴离子代谢失衡。这导致过量的超氧阴离子,诱导自由基链式反应,产生更多的自由基和活性氧,氧化膜细胞中不饱和脂肪酸的双键,导致分解和破坏。MDA是细胞膜脂质过氧化作用的重要产物,其浓度随生物和非生物应激而变化[52].在这里,我们发现更少的MDA生成IbSUT4转基因拟南芥苗(无花果。5D),表示的过度表达IbSUT4可显著提高植物对胁迫条件的耐受性。
一般来说,环境胁迫通过抑制光合作用来影响蔗糖的供应。因此,蔗糖在植物体内的跨膜转运和分布是植物抗逆性的关键步骤。迄今为止,累积的证据表明SUTs通过改变从源器官到库器官的蔗糖分配来影响植物的胁迫反应.PtaSUT4-RNAi导致大量蔗糖在液泡中积累,并影响水平衡到如此极端的程度PtaSUT4-RNAi植物在短期干旱条件下枯萎[14].功能丧失突变AtSUC2而且AtSUC4导致种子萌发和幼苗生长过程中对非生物胁迫和ABA处理的过敏反应,以及幼苗中较高的蔗糖水平[13].结果表明,不同栽培条件下,茎部蔗糖含量较高,根部蔗糖含量较低AtSUC4干旱和盐胁迫下的突变体[53].的过度表达IbSUT4在非生物胁迫条件下,导致蔗糖在根中积累较多,而在芽中积累较少(图2)。6).转基因IbSUT4系对非生物胁迫的反应是通过改变它们的蔗糖分配,突出了转基因的潜力IbSUT4在应激反应中。
IbSUT4通过依赖于abf的ABA信号通路对非生物胁迫作出反应
植物激素ABA参与植物生长发育的许多过程,包括抑制种子萌发、维持种子休眠、控制气孔关闭以及对环境胁迫的适应性反应[54,55].对非生物胁迫的适应由依赖aba和不依赖aba的途径调控[56,57].中断的AtSUC2,AtSUC4,AtSUC9在种子萌发和幼苗生长过程中,ABA处理抑制了ABA诱导和ABA反应基因的表达[13,23],表明AtSUC2,AtSUC4,而且AtSUC9通过aba依赖的信号通路参与非生物应激反应。植物中aba依赖的信号通路通过改变aba调控基因的表达来运作沛富,SNF1,PP2C,例如ABI1,ABI2[18,58,59,60].在这里,我们的启动子分析证实了ABRE-motif在IbSUT4启动子(表S3.).ABRE是一个保守的aba响应型独联体-控制aba调控基因表达的元素[18,61].MdAREB2结合ABRE-motif元素MdSUT2启动子通过aba信号通路调控胁迫诱导的蔗糖积累反应[33].进一步分析aba调控的基因表达谱表明,ABFs (—ABF2, ABF4)、ABFs上游(SnRK2.2, SnRK2.3)和ABA受体(PYL8 / RCAR3)在ABA处理中高表达,除ABF下游(ABI1)(图。7).应激和ABA信号通路之间的交叉信号涉及SnRKs(蔗糖非发酵相关蛋白激酶),这是应激反应的关键代谢调节因子[61].表达的SnRK2C在拟南芥提高抗旱性胁迫反应基因的表达[19].ABI1(ABA insensitive 1)是PP2C基因家族成员,是ABA信号转导的负调控因子。BcABI1高度同源的基因是AtABI1它呈现出一种本构表达模式,并参与伤口应激和高盐反应[62].因此,我们推测IbAREBs结合abre主题在IbSUT4启动子通过依赖于abf的ABA信号通路来应对压力。
结论
总之,IbSUT4是一种重要的SUT基因,编码一种定位于液泡体和质膜的蛋白质。它还影响蔗糖在源组织和库组织之间的分布。该基因的过度表达加速了拟南芥通过提高库器官的蔗糖含量来提高生长和非生物抗逆性。我们的研究揭示了IbSUT4在植物生长和非生物胁迫反应中。SUTs的功能是高度保守的,因此蔗糖的积累在拟南芥罗茨认为IbSUT4影响块根作物的品质和产量,尤其是甘薯(图。8).未来的研究应该通过开发转基因甘薯品系来验证这些功能。更全面地了解如何IbSUT4影响植物蔗糖分布可能为提高作物产量开辟新的途径。
方法
植物材料和生长条件
这些拟南芥本研究使用的烟草植株均在中国科学院上海植物生理生态研究所(31°18′n, 121°43′e)的气候室中获得。.的巴塔塔"台中市6”在上海五社转基因作物人工林(31°14′n, 121°29′e)大田栽培。
拟南芥(哥伦比亚生态型,Col-0),用于实验,保持在LD条件下,大约600毫米−2年代−1,温度为25°C。种子萌发试验和胁迫耐受性测定按Mas [44,并作了一些修改。我们增加了10°C的加工。为了进行植株表型分析,将WT和转基因植株在MS培养基上发芽10 d,然后在LD条件下在温室中单独种植,共6个重复。为了分析ABA信号通路基因,将WT和转基因植株在1/2 MS培养基上培养14 d,然后用40 μM ABA处理6 h。
烟草(烟草benthamiana多明;所有在本实验室)用于亚细胞定位分析的植物分别在温室、盆栽土壤和LD条件下生长。
地瓜(番薯甘薯(l)林;用于基因表达分析的“太中6号”生长在上海五社农场。组织样本取自3个月大的甘薯植株。
蔗糖转运蛋白cdna的克隆
将大约100毫克甘薯源叶用液氮研磨并转移到1.5 mL离心管中。使用RNAprep Pure Plant Kit (TIANGEN, China)从源叶片中提取总rna。E4-F和E4-R引物(表S1)根据植物SUT基因的保守序列设计IbSUT4对基因进行扩增和测序。
为了获得全长SUT cDNA序列,进行了两轮嵌套式cDNA末端快速扩增(RACE) PCR技术。SpSUT4F/R引物1)根据EST序列设计,序列的5 '端和3 '端IbSUT4根据制造商说明书,使用SMART RACE cDNA Amplification Kit (Clontech, Japan)对cDNA进行扩增和测序。的长篇IbSUT4序列通过拼接得到IbSUT4-F/R引物(表S1)根据全长序列设计,然后使用cDNA作为模板,并根据制造商的说明使用ReverTra Ace qPCR RT Master Mix 's (TOYOBO, Japan)进行扩增。
序列比对和系统发育树构建
同源确定…的同源词IbSUT4, BlastP搜索使用全长IbSUT4蛋白序列对照拟南芥、烟草、茄属、茄属、家苹果、国家生物技术信息中心(NCBI)。使用MEGA5.2对蛋白质序列进行比对,使用MEGA5.2中的Neighbor-Joining方法构建无根系统发育树。通过1000次自举迭代估计树的可靠性。
亚细胞定位分析和麦青素摄取试验
为了确定IbSUT4在甘薯中的亚细胞定位,通过PCR扩增不含终止密码子的orf(表S . 4)1).的IbSUT4扩增产物用SalI/SpeI酶切后克隆到PUC18二元载体CaMV35S启动子和GFP之间的区域。所得到的CaMV35S:IbSUT4-GFP (PUC18)构建物被用于转化烟草原生质体。从两个月大的烟草植株中产生叶肉原生质体,如Drechsels所述[63].经聚乙二醇法转化后[64].原生质体在22°C的黑暗条件下保存在试管中约18小时。将W5缓冲液中的PI加入到1.5 mL试管中原生质体悬液(pH = 5.7) 500 μL中,终浓度为50 μg mL−1.将试管轻轻倒置,原生质体在室温下黑暗中孵育30分钟。离心,上清后用W5溶液冲洗。
根据马其军[44].通过计算平均光密度,在Image J软件中定量分析荧光强度;三张图片的IntDen / Area值。
原生质体和拟南芥使用奥林巴斯FV1000共聚焦激光扫描显微镜,配备603/1.2 NA UPLSAPO油浸物镜(奥林巴斯)进行观察。激发波长为473 nm,发射波长为487-521 nm,观察到GFP荧光。在559 nm和606 ~ 673 nm的激发和发射条件下观察到叶绿体自身荧光。通过激发和发射分别在535 nm和615 nm处观察到PI荧光。在367 nm和454 nm的激发和发射条件下,观察到叶青素的荧光。
功能分析IbSUT4在酵母SUSY7/ura3中
酵母突变体SUSY7/ura3不能合成转化酶[4].当植物中编码蔗糖合酶的基因转入SUSY7/ura3后,它可以代谢细胞内的蔗糖,在以蔗糖为唯一碳源的培养基上正常生长。蔗糖在缺陷酵母中的异源表达和互补是验证SUT基因蔗糖转运活性的直接证据。我们克隆了IbSUT4PCR检测ORF(表S1).的IbSUT4用ClaI/SmaI切除ORF,克隆到p416GPD的相同位点。要分析SUT活动,向量(IbSUT4-P416)转入SUSY7/ura3感受态细胞。从诱饵菌株和对照菌株中选择健康的大菌落,分别在0.9% NaCl中重悬,OD600调整为~ 1。然后将每个转化反应稀释10、100、1000和10,000倍。每种稀释反应的10微升被镀在含有1.7 g L的琼脂培养基上−1不含氨基酸的酵母氮基(Difco), 2%蔗糖(Difco)或2%葡萄糖(Difco), 5 g L−1硫酸铵,20 mg L−1色氨酸,1.5%琼脂糖,pH值用盐酸调整到5.0。30℃保存3 d,观察并拍照。
放大IbSUT4启动子
对启动子进行分析IbSUT4,采用基因组行走法扩增启动子。引物是从已知的反向DNA序列设计的。反向引物从5 '端设计,正向引物从3 '端设计。引物位于距离末端100-200 bp处(表S1).首先,5 μg基因组DNA用一种在引物之间不会被切掉的限制性内切酶消化。消化反应在37℃下进行6-8 h。用等体积的苯酚/氯仿纯化消化后的DNA,在4℃下10000 g离心10 min,收集上相。进一步加入等体积的氯仿/异戊醇混合物,对溶液进行漩涡离心,收集上层相。DNA用0.1体积3 M醋酸钠和2.5体积100%乙醇沉淀,离心,弃上清。用80%乙醇清洗球团,离心,弃上清。将颗粒风干后重悬于水中,用T4酶进行结扎。重复这些步骤以沉淀和纯化DNA,并进行两轮PCR以扩增启动子。
的变换IbSUT4成拟南芥
的全长编码序列IbSUT4经PCR扩增后,插入pCAMBIA1301载体。结果35S:IbSUT4构造被引入农杆菌属strain GV3101 for拟南芥利用花浸法进行转化[65].收集种子,在含25 mg L的1/2 MS培养基上播种−1可供选择的湿霉素。
存在化验
用特异性qRT-F和qRT-R引物定量基因表达。肌动蛋白作为对照。用于测定的引物见表S1.每个样品进行3个生物重复分析。使用循环阈值(Ct) 2对特定mRNA水平进行相对定量-DDCt方法(66].
蔗糖含量和丙二醛(MDA)含量的测定
蔗糖浓度由高效液相色谱法(HPLC)测定,如gong [13].
丙二醛含量测定方法参照Mas [44,并作了一些修改。用10% TCA从根中提取MDA。
数据和材料的可用性
支持本文结论的数据集包含在本文及其附加文件中。有关基因数据库可按登录号从NCBI下载。这些基因的登录号如下:AtFT(At1g65480),AtABI3(At3g24650),—ABF2(ABO17160),ABF4(At3g19290),SnRK2.2(AEE78673),SnRK2.3(NP201489),PYL8 / RCAR3(At5g53160)和ABI1(At4g26080),IbSUT1(ADK62516.1),IbSUT2(ADL63117.1),IbSUT3(MN233361),IbSUT4(MN233360),LeSUT1(CAA57726.1),LeSUT2(AAG12987.1),LeSUT4(AAG09270.1),StSUT1(CAA48915.1),StSUT2(AAP43631.1),StSUT4(AAG25923.2),NtSUT1(CAQ58421.1),NtSUT3(AAD34610.1),NtSUT4(BAI60050.1),AtSUC1(AAV97807.1),AtSUC2(AAN31829.1),AtSUC4(AAO42412.1),AtSUC5(NP177334.1),AtSUC7(NP001031242.1),AtSUC8(AEC06318.1),AtSUC9(NP196235.1),MdSUT4(NP001280809)。
缩写
- 阿坝:
-
脱落酸
- 沛富:
-
aba响应的元素结合因子
- B:
-
处理
- DL:
-
发展叶
- 博士:
-
发展的根
- 高效液相色谱法:
-
高效液相色谱法
- LD:
-
长昼(16小时亮/ 8小时暗)
- MDA:
-
丙二醛
- MFS:
-
主要促进者超级家族
- 先生:
-
成熟的根
- 女士:
-
Murashige和Skoog
- NCBI:
-
国家生物技术信息中心
- 子:
-
开式阅读架
- PI:
-
Propidium碘化
- 存在:
-
定量反转录pcr
- 种族:
-
cDNA末端的快速扩增
- RR:
-
红根
- 史:
-
阀杆
- SE-CCs:
-
筛元-伴细胞
- 圣:
-
茎尖
- sut或suc:
-
蔗糖转运者或载体
- 柠檬酸:
-
三氯乙酸
- WT:
-
野生型
- 或者说是:
-
白色的根
- YL型:
-
年轻的叶
参考文献
Lemoine R, La Camera S, Atanassova R, Dédaldéchamp F, Allario T, Pourtau N,等。源汇运输与环境因素调控。植物科学进展(英文版);
颜宁。主要辅助超族(MFS)传输器的结构进展。生物化学学报,2013;38(3):151-9。
Williams LE, Lemoine R, Sauer N.高等植物中的糖转运蛋白:多种作用和复杂调控。植物科学进展,2000;
Riesmeier JW, Willmitzer L, Frommer WB。菠菜蔗糖载体cDNA的分离及其在酵母中的功能表达。中国科学院学报,2001;26(3):379 - 379。
Sauer N, Stolz J. SUC1和SUC2:两种蔗糖转运蛋白拟南芥:酵母中组氨酸标记蛋白的表达和鉴定。植物J. 1994; 6:67-77。
张志强,李志强,等。AtSUC2具有沿韧皮部途径蔗糖检索的作用:来自碳-11示踪剂研究的证据。植物科学进展(英文版);
Srivastava AC, Ganesan S, Ismail IO,等。的功能特征拟南芥AtSUC2蔗糖/小时+组织特异性互补的转运蛋白在韧皮部负荷中起重要作用,但在长距离运输中不起作用。植物物理学报。2008;148:200-11。
戈特沃德JR,克里森PJ,杨JC,等。韧皮部特异性质膜蔗糖转运蛋白在植物中作用的遗传学证据。自然科学进展,2001;
Sivitz AB, Reinders A, Johnson ME,等。拟南芥蔗糖转运蛋白AtSUC9高亲和转运活性,基因内表达控制和早开花突变表型。植物科学进展。2006;43(1):344 - 344。
一个新的蔗糖转运蛋白亚家族,SUT4,低亲和力/高容量,定位于植物去核筛元。植物学报。2000;12(8):1345-56。
张晓霞,李晓霞,Krügel U,等。蔗糖转运蛋白StSUT4从马铃薯影响开花,结节,和避荫反应。植物科学进展。2008;26(2):515 - 528。
张志刚,张志刚,张志刚,等。蔗糖转运蛋白家族杨树:扁桃体的重要性PtaSUT4生物量和碳分配。中国植物学报,2015;26(5):357 - 357。
龚霞,刘敏,张玲,等。拟南芥AtSUC2而且AtSUC4在aba依赖通路中,编码蔗糖转运蛋白的非生物胁迫耐受性是必需的。中国生物医学工程学报。2014;29(1):344 - 344。
陈志强,李志强,李志强,等。糖囊体定位蔗糖转运蛋白杨树(PtaSUT4)调节整个植物的水分关系、对水分胁迫的反应和光合作用。科学通报。2012;7(8):e44467。
徐强,陈珊珊,云小俊。蔗糖转运蛋白和韧皮部负荷对环境信号的响应。植物学报。2018;176:930-45。
李文杰,李志强,李志强,等。ABA感知和信号传递。植物科学进展,2010;15(7):395-401。
张志强,张志强,张志强,等。脱落酸(ABA)及其感知和信号通路中的关键蛋白质是古老的,但它们的作用随着时间的推移而改变。植物信号学报,2017:12(9):e1365210。
崔熙,洪俊华,河祚,等。ABFs是aba响应元件结合因子家族。中国生物医学工程学报,2000;29(3):344 - 344。
梅泽T,吉田R,丸山K等。SRK2Csnf1相关蛋白激酶2,通过控制胁迫响应基因的表达提高抗旱性拟南芥.自然科学进展(英文版);2004;
董涛,朴艳。脱落酸:生物合成,失活,稳态和信号。生物化学学报。2015;58:29-48。
王勇,陈鹏,孙林,等。转录调控PaPYLs,PaPP2Cs而且PaSnRK2s在甜樱桃果实发育期间和果实成熟开始时对脱落酸和生长素的反应。植物生理学报,2015;26(2):455-64。
Rook F, Corke F, Card R,等。受损的蔗糖诱导突变体揭示了糖诱导淀粉生物合成基因表达由脱落酸信号调节。植物学报,2001;26:421-33。
贾伟,张磊,吴东,等。蔗糖转运蛋白AtSUC9是由低蔗糖水平介导的拟南芥通过调节蔗糖分布和ABA积累的非生物抗逆性。植物生理学报。2015;56(8):1574。
Lalonde S, Wipf D, Frommer WB。有机形式碳和氮在源和汇之间的运输机制。为基础。牧师.植物学报,2004;55:34 - 72。
李勇,顾勇,秦华,等。两对蔗糖转运蛋白番薯甘薯(L.) lam主要表达于汇叶和源叶。植物科学2010;179(3): \ -256。
Kühn C, Grof CP.高等植物蔗糖转运体。植物学报,2010;13:287-97。
陈志伟,陈志强,Krügel,等。蔗糖转运蛋白的光周期调控StSUT4影响昼夜调节基因的表达和乙烯的产生。前面。植物科学学报2013;4:26。
程晓峰,王志智。过度的COL9,一种类似constans的基因,通过减少表达延迟开花有限公司而且英国《金融时报》在拟南芥.植物学报,2010;43(5):758-68。
赤霉素与光刺激种子萌发。植物生长学报,2001;20(4):369-76。
Sariyildiz Z, Demir I, Halloran N.胁迫温度下辣椒萌发及ABA含量(甜椒l)与种子发育有关的种子。中国生物医学工程学报,2005;29(2):344 - 344。
巴罗斯Galvão,蒂亚戈。拟南芥种子休眠与萌发的调控。博士论文,约克大学学位论文,White Rose eTheses Online(eTheses . whiteose .ac.uk)。2017.
藤田Y,藤田AM,佐藤CR,等。AREB1是一种新型的abre依赖性ABA信号的转录激活子,可增强植物的干旱耐受性拟南芥.植物学报。2005;17(12):3470-88。
马庆杰,孙明华,刘玉军,等。转录因子AREB2通过激活糖转运蛋白和淀粉酶基因参与可溶性糖的积累。植物物理学报。2017;174:2348。
Noiraud N, Delrot S, Lemoine R.盐胁迫下芹菜蔗糖转运蛋白的识别与表达。植物科学进展。2000;22(4):457 - 457。
李国强,李国强,李国强。糖的传感与信号。拟南芥书。2008;6:e0117。
李丽娟,李志强,李志强,等。糖的源-汇运输及其环境因素的调控。植物科学进展(英文版);
Krügel,昂丁,Kühn,克里斯蒂娜。蛋白质-蛋白质直接相互作用对蔗糖转运蛋白的翻译后调控。植物科学进展(英文版);
彭东,顾旭,薛丽娟,等。蔗糖转运蛋白的贝叶斯系统发育:单子叶和双子叶的古代起源、差异扩展和趋同进化。前面。植物科学进展(英文版);
绍尔N,路德维希A,诺布罗赫A,罗特P,加赫茨M,克莱伯F。AtSUC8而且AtSUC9编码功能性蔗糖转运蛋白,但二者关系密切AtSUC6而且AtSUC7基因编码不同拟南芥生态型中的异常蛋白。植物J. 2004; 40:120-30。
Rottmann TM, Fritz C, Lauter A,等。原生质体-麦青素法是一种检测植物蔗糖转运体的新方法AtSUC6而且AtSUC7蔗糖摄取活性拟南芥Col-0生态型。中国植物科学,2018;9:43。
Barker L, Kühn C, Weise A, Schulz A, Gebhardt C, Hirner B,等。SUT2,一种假定的筛元蔗糖传感器。《植物科学》2000;
施耐德,胡尔普克,舒尔兹,亚龙,Höll J, Imlau A,等。液泡通过液泡体定位的suc4型转运蛋白释放蔗糖。植物学报,2012;24:325-36。
Riesmeier JW, Willmitzer L, Frommer WB。蔗糖转运蛋白的反义抑制影响了转基因马铃薯的同化物分配。Embo j . 1994; 3:1-7。
马庆杰,孙明华,刘玉军,等。苹果蔗糖转运蛋白基因的克隆及功能鉴定MdSUT2.植物物理与生物化学。2016;109:442-51。
Endler A, Meyer S, Schelbert S,等。大麦液泡蔗糖转运体的鉴定拟南芥用膜质体蛋白质组学方法研究叶肉细胞。植物物理学报。2006;41:196 - 207。
李志强,李志强,李志强,等。植物糖信号的表达与表达。植物学报。2006;57:675-709。
小岛S,高桥Y,小林Y,等。Hd3a,水稻的同源物拟南芥英国《金融时报》基因,促进花期向下游过渡即在短日照条件下。植物细胞生理学杂志,2002;43(10):1096-105。
由光周期的季节变化诱导开花。中国生物医学工程学报。2002;23(6):1217-222。
花诱导物的激活标记。科学。1999;286:1962-5。
在介导开花信号中具有拮抗作用的一对相关基因。科学。1999;286:1960-2。
龚旭,刘明明,王超,等。蔗糖转运基因AtSUC4在盐胁迫下调节蔗糖的分布和代谢拟南芥.材料科学与工程,2013;
王志强,王志强,王志强,等。植物组织中丙二醛的高通量测定。分析生物化学。2005;347(2):201-7。
龚霞,刘明兰,张丽娟,等。蔗糖转运基因AtSUC4通过调节蔗糖的分布和代谢来应对干旱胁迫拟南芥.Adv Mater res 2013; 971-2975。
孙晓明,王晓明,王晓明。种子和幼苗脱落酸信号通路的研究。《植物细胞》2002;14:S15。
刘志强,王志强,等。ABA、过氧化氢和一氧化氮在气孔保护细胞中的信号传递。中国机械工程学报,2004;29(3):344 - 344。
杨晓明,杨晓明,杨晓明。干旱和寒冷胁迫下植物基因表达的调控网络。植物学报。2003;6(5):410-17。
Nakashima K, Yamaguchishinozaki K, Shinozaki K.干旱响应中的转录调控网络及其在干旱、寒冷和高温等非生物胁迫响应中的串扰。植物科学进展(英文版);
马Y, Szostkiewicz I, Korte A,等。PP2C磷酸酶活性调节剂具有脱落酸传感器的功能。科学。2009;324:1172408。
Abdeen A, Schnell J, Miki B.转录组分析表明,抗旱转基因植物过表达转录因子ABF3没有非预期效应。Bmc基因组学。2010;11:69。
Busk PK. Montserrat Pagès,脱落酸诱导转录的调控。植物分子生物学杂志,1998;37:425-35。
嘿,SJ, Byrne E, Halford NG。的在terface between metabolic and stress signaling. Ann Bot. 2010;105(2):197–203.
孔兰,丁恒,洪帅,等。2C型蛋白磷酸酶基因的分离、表达及进化分析BcABI1涉及非生物和生物胁迫芸苔属植物定ssp。对。植物生长规律,2018;85:1-11。
Drechsel G, Bergler J, Wippel K, Sauer N, Vogelmann K, Hoth S.犰狳c端重复序列是植物U-box犰狳E3泛素连接酶SAUL1与质膜关联的必要和充分条件。实验学报。2011;62:775-85。
李国强,李国强。瞬态变换拟南芥叶片原生质体:研究基因表达的多功能实验系统。植物学报1994;5:421-27。
克劳夫SJ。花浸:农杆菌介导的种系转化。方法Mol生物学,2005;286:91-102。
Livak KJ, Schmittgen TD。利用实时定量PCR和2(-Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25:402-8。
致谢
我们感谢吴晓云和张彦迪(中国科学院大学)的建议和帮助。我们要感谢Editage (www.editage.cn)进行英文编辑。
资金
本工作得到国家自然科学基金青年基金(No. 31701357)和山东省农业创新团队(No. sdait -16-01)的资助。这些发起者在研究的设计中没有任何作用;分析:在数据的收集、分析或解释中;无论是手稿的撰写,还是发表结果的决定。
作者信息
从属关系
贡献
WDD策划并执行了实验,并准备了手稿。LHJ对手稿进行了编辑,并对工作提出了建议。WHX和ZP对工作提出了建议,并提供了实验场所。秘书长监督工作,并对结果作出解释。所有作者均已阅读并批准稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
本研究所用引物的序列表S2。数一数开花植物的数量。表S3。元素的顺式元素IbSUT4启动子。图S1。A. EST序列。B. 5 ' -RACE和3 ' -RACE放大IbSUT4.C.表达IbSUT4采用qRT-PCR技术对“太中6号”甘薯不同组织中的基因进行了检测。从野外采集了三个月大的样本。DL:发育叶,B:柄,S:茎,WR:白根,RR:红根,DR:发育根,MR:成熟根。(A, B)凝胶从附加文件中裁剪2,图S.1。小写字母表示差异有统计学意义(P≤0.05)。图S2。体内蔗糖摄取活性IbSUT4.转基因植株根部的平均光密度显著高于野生型植株。平均光密度= IntDen/Area。小写字母表示差异有统计学意义(P≤0.05)。图S3。的表达式IbSUT4低温(4℃)、高盐(200 mM NaCl)、干旱胁迫(300 mM甘露醇)或外源ABA (25 μM)处理1月龄植株的根和叶中。A.量化IbSUT4叶节点中的表达式。B.量化IbSUT4根的表达式。小写字母表示差异有统计学意义(P≤0.05)。
附加文件2图S1。
EST的原凝胶和全长凝胶,5 ' -RACE和3 ' -RACE。A. EST4序列。B. 5 ' -RACE和3 ' -RACE放大IbSUT4.图S2.对原凝胶和全长凝胶进行RT-PCR分析IbSUT4在WT和3个转基因株系中的表达。图S3。最初的污点IbSUT4SUSY7/ura3酵母菌的功能分析。A.用空P416载体转化的SUSY7/ura3酵母IbSUT4在P416载体中,用2%的蔗糖培养。B.用空P416载体转化的SUSY7/ura3酵母IbSUT4在P416载体中,用2%的葡萄糖培养。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
王东,刘宏,王宏。et al。一种新的蔗糖转运基因IbSUT4通过abf依赖的ABA信号通路参与甘薯的植物生长和对非生物胁迫的响应。BMC植物生物学20.157(2020)。https://doi.org/10.1186/s12870-020-02382-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02382-8
关键字
- 地瓜
- 蔗糖转运蛋白
- 植物的生长
- 非生物胁迫
- ABA信号通路