- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
转录组和代谢组揭示了白花生突变体黄酮类化合物的重定向gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba、物品编号:gydF4y2Ba161gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
花生的毛色决定了花生的外观和营养品质。花生白色种皮可以提高花生油的加工效率和品质。对转录组、代谢组和组织细胞学进行了综合分析gydF4y2BawscgydF4y2Ba突变体及其野生型研究色素沉着的调控机制。gydF4y2Ba
结果gydF4y2Ba
代谢组显示黄酮类化合物在gydF4y2BawscgydF4y2Ba的多组学分析gydF4y2BawscgydF4y2Ba突变体种子和睾丸发现WSC影响了睾丸中黄酮类化合物的生物合成、亚木质素的形成、糖酵解、TCA循环和氨基酸代谢。该突变还增强了植物激素的合成和信号传导。此外,共表达分析表明FLS基因与MBW复合物成员基因共表达。结合组织表达模式、遗传分析和这三个阶段的共同deg注释,我们发现三个睾丸特异性表达候选基因,gydF4y2BaAraip。M7RY3gydF4y2Ba,gydF4y2BaAradu。R8PMFgydF4y2Ba和gydF4y2BaAraip。MHR6KgydF4y2Ba可能对白色睾丸表型负责吗gydF4y2Ba。WSCgydF4y2BaFLS和DFR之间的表达竞争可能是通过控制激素合成和信号传导以及MBW复合物来调控的。gydF4y2Ba
结论gydF4y2Ba
因此,本研究结果提供了候选基因和新方法,可用于改善花生的种皮颜色和类黄酮质量。gydF4y2Ba
背景gydF4y2Ba
黄酮类化合物是植物多酚类次生代谢产物,具有不同修饰但共同的三环化学结构(C6-C3-C6)。因此,在C6-C3-C6环R1和R2位点分化取代的基础上,黄酮类化合物可分为至少10个化学基团,包括黄酮、黄酮、异黄酮、黄烷(黄烷醇)、花青素和黄烷醇[gydF4y2Ba1gydF4y2Ba]。花青素是类黄酮中最显著的一类,负责花、水果、种子和叶子中的色素沉着[gydF4y2Ba2gydF4y2Ba]。黄酮醇是食物中含量最多的类黄酮;槲皮素、山奈酚和杨梅素是三种常见的异构体[gydF4y2Ba1gydF4y2Ba]。黄酮是另一类主要的类黄酮,通常通过o -糖苷连接与糖基团结合,而一些黄酮也以c -糖化形式存在。相反,c -糖基黄酮(也称为黄酮c -糖苷)是黄酮的一个重要亚群,存在于许多植物中[gydF4y2Ba3.gydF4y2Ba];这些化合物具有防紫外线、抑制毛虫生长、防御病原体和为花着色的共色素等功能。gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba]。gydF4y2Ba
模式植物中黄酮类化合物的生物合成途径已被明确阐明;众所周知,这些化合物的C6-C3-C6基本骨架由1个4- coumaryl - coa和3个丙二醇- coa分子开始,依次由CHS、CHI、F3H和F3 ' h或F3 ' 5'H催化生成二氢黄酮醇(二氢槲皮素、二氢杨梅素和二氢山奈酚)。然后通过DFR和LDOX催化的两个反应将二氢黄酮醇转化为花青素,花青素是有色的但不稳定的色素。DFR分别催化二氢槲皮素、二氢山奈酚、二氢杨梅素生成白花青素、白蜡花素、白蜡花素,LDOX分别将白花青素、白蜡花素、白蜡花素氧化生成花青素、白蜡花素、白蜡花素。最后,通过UFGTs合成有色且稳定的花青素,使花青素、花青素和飞鸽素糖基化。对于PAs,单个花青素-3-葡萄糖苷和飞鸽苷-3-葡萄糖苷被mt甲基化,分别生成芍药苷-3-葡萄糖苷和矮牵牛花苷或马柳苷-3-葡萄糖苷。LAR和ANR分别催化浅色花青素和花青素生成儿茶素和表儿茶素。随后,POD和PPOD可能通过空泡室中的儿茶素或表儿茶素与花青素分子催化PA聚合物的形成。gydF4y2Ba
黄酮醇是另一个关键的类黄酮亚群,在睾丸色素沉着中起关键作用[gydF4y2Ba6gydF4y2Ba]。黄酮醇衍生物已被证明通过共着色效应影响花青素介导的着色,而FLS催化二氢山奈酚和二氢槲皮素转化为共色素黄酮醇,从而可能影响花青素积累水平[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba7gydF4y2Ba]。gydF4y2Ba
一些类黄酮EBGs包括gydF4y2BaCHSgydF4y2Ba,gydF4y2Ba气gydF4y2Ba,gydF4y2BaF3HgydF4y2Ba,gydF4y2BaFLS的gydF4y2Ba受三个R2R3-MYB转录因子MYB11、MYB12和MYB111的转录调控[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba]。已知的类黄酮lbg如DFR、LDOX、ANR和TT12被MBW三元转录复合物激活[gydF4y2Ba10gydF4y2Ba]。近年来,植物激素在控制类黄酮代谢过程中发挥了重要的调节作用。例如,已知植物激素JA可在一系列物种中诱导花青素积累[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba],而COI1调节转录因子的表达,包括PAP1、PAP2和GL3,这些转录因子本身介导“晚期”花青素生物合成基因DFR、LDOX和UF3GT,这些基因调节ja诱导的花青素生物合成gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba16gydF4y2Ba]。此外,已知BR通过调节“晚期”花青素生物合成基因来影响ja诱导的花青素积累;人们认为这种调控可能是由MBW转录复合物介导的[gydF4y2Ba17gydF4y2Ba]。gydF4y2Ba
花青素、原花青素和黄酮醇都是在许多植物种皮中发现的丰富的类黄酮[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba]。这些化合物不仅影响外观和营养品质,而且在面对微生物病原体、昆虫攻击和紫外线时发挥保护作用[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba]。一般来说,几乎所有的天然类黄酮都以o -糖苷或c -糖苷形式存在于植物中。尽管与c -糖苷相比,o -糖苷类膳食黄酮更受关注,但在大多数情况下,c -糖苷类黄酮往往比相应的o -糖苷类黄酮具有更高的抗氧化和抗糖尿病潜能。本研究的目的是介绍一个白色种皮花生突变体的特征。对睾丸和种子代谢组的分析揭示了黄酮类化合物含量的重编程gydF4y2BawscgydF4y2Ba突变体;异黄酮、黄酮、黄酮、黄酮c -苷和黄酮醇含量升高,花青素和PA含量降低。转录组学分析的使用揭示了在发育中的睾丸中参与类黄酮生物合成的一组基因的下调gydF4y2BawscgydF4y2Ba而参与黄酮醇合成的关键基因被增强,蔗糖和谷氨酸氨基酸代谢、糖酵解、TCA循环、激素合成和信号转导都被重编程。本研究的结果为花生色素沉着的调节机制以及可用于白色种豆育种的基因提供了关键的额外信息。gydF4y2Ba
结果gydF4y2Ba
表型变异与类黄酮代谢特征gydF4y2Ba
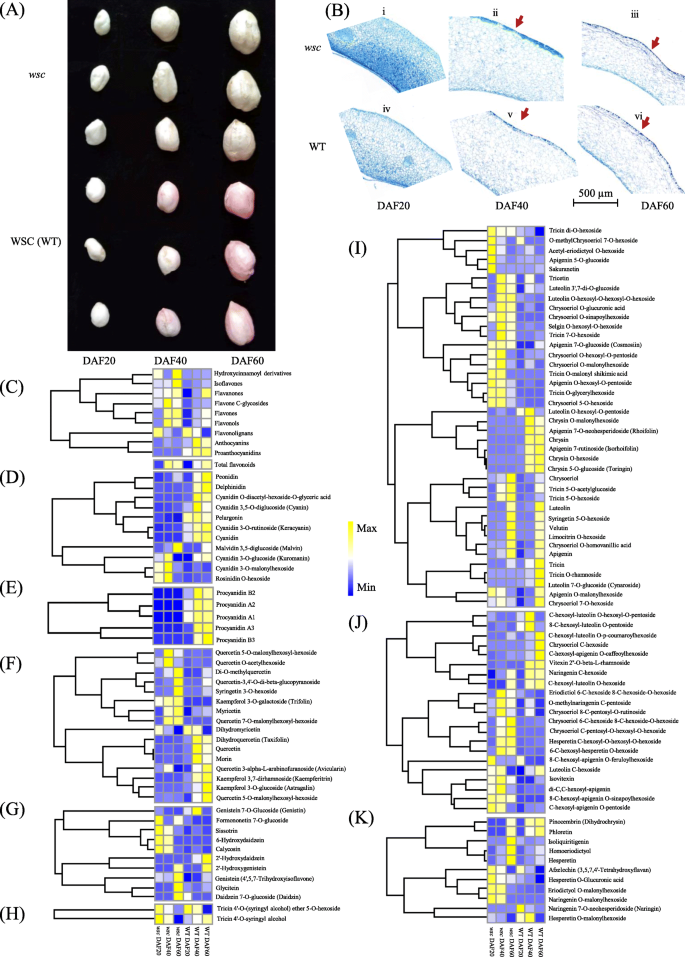
白色种皮花生突变体gydF4y2BawscgydF4y2Ba从粉色种皮优良品种中华16号(中国农业科学院油料作物研究所栽培)经gydF4y2Ba60gydF4y2BaWT积累了大量的粉红色花青素,未观察到明显的颜色变化gydF4y2BawscgydF4y2Ba在开发过程中(图1)gydF4y2Ba1gydF4y2Baa).因此,我们进行了组织化学分析,以确定两组小鼠发育中的睾丸中多酚化合物的性质gydF4y2BawscgydF4y2Ba和WT. TBO染色显示了发育中的睾丸横切面的多聚酚类化合物的分布,与大鼠和大鼠无显著差异gydF4y2BawscgydF4y2Ba和WT在三个种子发育阶段评估(图2)。gydF4y2Ba1gydF4y2Bab).因此,在两组之间进行了一系列类黄酮代谢组谱gydF4y2BawscgydF4y2Ba我们在睾丸样品中共检测到199种黄酮类化合物,包括19种花青素,23种黄酮,63种黄酮,32种黄酮c -糖苷,38种黄酮醇,3种黄酮木脂素,1种羟基肉桂基衍生物,15种异黄酮和5种原花青素(附加文件)gydF4y2Ba1gydF4y2Ba)。数据显示,黄酮类化合物的含量gydF4y2BawscgydF4y2Ba在DAF20时比WT高1.67倍,在DAF40和DAF60时分别下降到1.43倍和0.97倍(图2)。gydF4y2Ba1gydF4y2Bac)gydF4y2BawscgydF4y2BaWT在发育过程中积累黄酮类化合物;黄酮类化合物含量在DAF40时达到峰值gydF4y2BawscgydF4y2Ba与WT样品在DAF60下的对比(图2)。gydF4y2Ba1gydF4y2Bac).除黄酮木质素外,花青素、原花青素和黄酮醇均在发育过程中增强。本研究检测到的花青素包括花青素、飞燕草苷、马柳花苷、牡丹花青素、牡丹花青素、松香花青素及其衍生物,数据显示,牡丹花青素、飞燕草苷、花青素o -二乙酰己糖- o -甘油三酯、花青素3,5- o -二葡糖苷(花青素)、天竺葵苷、花青素3- o -芦丁苷(角acyanin)和花青素的水平在WT的整个睾丸发育过程中均呈上升趋势,而在WT中则保持在非常低的稳定水平gydF4y2BawscgydF4y2Ba。四种糖基化花青素[即,Malvin 3,5-二葡糖苷(Malvin),花青素3- o -葡萄糖苷(Kuromanin),花青素3- o -丙二酰己糖苷和松香苷o -己糖苷]的水平均增加gydF4y2BawscgydF4y2Ba在两个早期发育阶段,然后在DAF60的WT中减少到相同的数量(图2)。gydF4y2Ba1gydF4y2BaD),只有马尔文保持增长的趋势gydF4y2BawscgydF4y2Ba。与此同时,原花青素A1、原花青素A2、原花青素A3、原花青素B1和原花青素B2在WT样品中含量均较高,尤其是在DAF40和DAF60gydF4y2BawscgydF4y2Ba仍然低了三个数量级(图1)。gydF4y2Ba1gydF4y2Bae).在实验过程中,黄酮醇的含量也发生了变化gydF4y2BawscgydF4y2Ba和WT,其中8个上调9个下调gydF4y2BawscgydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Baf).事实上,异黄酮的含量和总量在gydF4y2BawscgydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Bag),而黄酮木质素体积在WT和WT之间没有显著变化gydF4y2BawscgydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Bah).黄酮也在gydF4y2BawscgydF4y2Ba和WT;这些化合物的总含量在gydF4y2BawscgydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Bac, i).在本分析中,共有13个黄酮c糖苷上调,8个下调gydF4y2BawscgydF4y2Ba尽管总含量总体上明显增加(图2)。gydF4y2Ba1gydF4y2Bac和j)。四种黄酮在两个早期发育阶段也有显著增加,其中三种在DAF60时显著增强,而其他四种分化黄酮中有两种在DAF60时下降,一种在DAF20和DAF 40时分别下降(图2)。gydF4y2Ba1gydF4y2Bak)。gydF4y2Ba
黄酮类化合物在睾丸中重定向gydF4y2BawscgydF4y2Ba。gydF4y2Ba一个gydF4y2Ba色差之间gydF4y2BawscgydF4y2Ba和WT。gydF4y2BabgydF4y2Ba种皮发育过程中酚类化合物的染色gydF4y2BawscgydF4y2Ba和WT。gydF4y2BacgydF4y2Ba总黄酮热图与各组分总黄酮含量之间的关系gydF4y2BawscgydF4y2Ba和WT。gydF4y2BadgydF4y2Ba花青素含量之间的热图gydF4y2BawscgydF4y2Ba和WT。gydF4y2BaegydF4y2Ba原花青素含量之间的热图gydF4y2BawscgydF4y2Ba和WT。gydF4y2BafgydF4y2Ba黄酮醇含量热图gydF4y2BawscgydF4y2Ba和WT。gydF4y2BaggydF4y2Ba间异黄酮醇含量热图gydF4y2BawscgydF4y2Ba和WT。gydF4y2BahgydF4y2Ba黄酮木质素含量热图gydF4y2BawscgydF4y2Ba和WT。gydF4y2Ba我gydF4y2Ba之间黄酮含量热图gydF4y2BawscgydF4y2Ba和WT。gydF4y2BajgydF4y2Ba黄酮C糖苷含量热图gydF4y2BawscgydF4y2Ba和WT。gydF4y2BakgydF4y2Ba之间黄酮含量热图gydF4y2BawscgydF4y2Ba和WT。代谢物含量采用热图中峰面积的z分数(三个生物重复的平均值)进行缩放。gydF4y2Ba
非靶向脂质代谢组分析也是本研究的一部分,确定了6424种不同的已知代谢物(附加文件)gydF4y2Ba2gydF4y2Ba),分化代谢物的KEGG富集分析(附加文件gydF4y2Ba2gydF4y2Ba)证实了黄酮醇的富集,也表明了异黄酮的生物合成gydF4y2BawscgydF4y2Ba和WT在类黄酮代谢组中保持相当一致。在几种代谢途径中也发现了差异过度代表,包括油菜素类固醇、角质、木质素和蜡的生物合成,以及精氨酸、脯氨酸、淀粉、蔗糖和半乳糖的代谢(附加文件)gydF4y2Ba2gydF4y2Ba)。gydF4y2Ba
进行了种子代谢组分析,以调查是否gydF4y2BawscgydF4y2Ba影响胚胎营养品质。共鉴定出439种不同水平的代谢物gydF4y2BawscgydF4y2Ba和WT(附加文件)gydF4y2Ba3.gydF4y2Ba),其中前5条富集途径分别为代谢途径、次生代谢物生物合成、类黄酮生物合成、类黄酮生物合成以及黄酮和黄酮醇生物合成(附加文件)gydF4y2Ba4gydF4y2BaA)。特别地,在这个分析中,所有异黄酮生物合成的差异代谢物都被上调(附加文件)gydF4y2Ba4gydF4y2BaA)。同时,黄酮和黄酮醇生物合成的6种代谢物中有5种含量增加,其中3,7-二- o -甲基槲皮素、槲皮素3- o -[β - d -木糖基-(1- > 2)- β - d -葡萄糖苷]和山奈素含量增加gydF4y2BawscgydF4y2Ba上升到WT(附加文件)中所见的五倍以上gydF4y2Ba3.gydF4y2Ba)。所有参与苯丙类生物合成和苯丙氨酸代谢的代谢物均在不同程度上下降(附加文件)gydF4y2Ba3.gydF4y2Ba),而参与角质、木质素和蜡质生物合成的两个基因在gydF4y2BawscgydF4y2Ba(附加文件gydF4y2Ba4gydF4y2BaA).这一分析结果与睾丸类黄酮代谢组的结果一致。作为主要的能量储存形式,脂肪酸在睾丸中起着至关重要的运输作用gydF4y2BawscgydF4y2Ba和WT进行检验。结果表明,在研究过程中,几乎所有脂肪酸组分和总脂肪酸含量均下降了5.47-19.41%(另附文件)gydF4y2Ba4gydF4y2BaB)。gydF4y2Ba
全球转录组分析揭示了在睾丸发育过程中涉及多种生物过程gydF4y2Ba
为了确定形成白色睾丸表型的基因,对两者进行了RNA-seqgydF4y2BawscgydF4y2Ba以及在DAF20、DAF40和DAF60采集的WT样本。以Fold change≥2和严格FDR值≤0.001作为鉴别deg的阈值。结果显示,这两个基因之间共有17,428个基因gydF4y2BawscgydF4y2Ba和WT(图1)gydF4y2Ba2gydF4y2Ba一个;额外的文件gydF4y2Ba5gydF4y2Ba)。在DAF20、DAF40和DAF60分别鉴定出6397、10471和9059个deg(图2)。gydF4y2Ba2gydF4y2Baa). DAF20上调基因(3725个)明显多于下调基因(2672个),DAF40上调基因(7036个)明显多于下调基因(3395个)。在DAF60上发现了7238个上调基因和1821个下调基因(图2)。gydF4y2Ba2gydF4y2Ba一个)。gydF4y2Ba
分析deg之间的功能gydF4y2BawscgydF4y2Ba和WT,在Blast2GO中使用GOseq方法进行GO分析。数据显示,代谢过程、细胞过程、单生物过程、生物调节和定位都是主要的生物过程类别(图2)。gydF4y2Ba2gydF4y2Bab、附加文件gydF4y2Ba6gydF4y2Ba)。在与细胞成分相关的氧化石墨烯术语方面,大多数氧化石墨烯与五大生物过程相关,包括细胞及其部分、膜、膜部分和细胞器(图2)。gydF4y2Ba2gydF4y2Bab、附加文件gydF4y2Ba6gydF4y2Ba)。催化活性、结合、转运体活性、结构分子活性和核酸结合转录因子活性是分子功能注释的主要类别(图2)。gydF4y2Ba2gydF4y2Bab、附加文件gydF4y2Ba6gydF4y2Ba)。gydF4y2Ba
此外,通过KEGG通路分析,分别发现了与这两个品系的三个不同发育阶段相关的deg的132、135和134条代谢途径。在本研究中确定的代谢途径的总列表在附加文件中提出gydF4y2Ba7gydF4y2Ba,以及研究中发现的16种常见代谢和生物途径gydF4y2BawscgydF4y2Ba与WT相比(图2)。gydF4y2Ba2gydF4y2Bac).这些结果表明,代谢途径最为丰富,其次是次生代谢物生物合成、植物激素信号转导、碳代谢、内吞作用、淀粉和蔗糖代谢以及氨基酸生物合成(另附文件)gydF4y2Ba7gydF4y2Ba)。gydF4y2Ba
qPCR验证gydF4y2BawscgydF4y2Ba和WT度gydF4y2Ba
为了验证RNA-seq获得的基因表达数据的重复性和再现性,我们采用生物独立的qRT-PCR检测了17个FPKM值≥2的基因的表达水平。使用primer Express 3.0软件设计的基因特异性引物对在附加文件中列出gydF4y2Ba8gydF4y2Ba。线性回归分析显示,两者的相关系数(gydF4y2BaRgydF4y2Ba)为0.84,表明RNA-Seq显示的表达数据与qRT-PCR检测的丰度之间存在很强的关系(附加文件)gydF4y2Ba9gydF4y2Ba)。gydF4y2Ba
WSC突变影响类黄酮代谢途径gydF4y2Ba
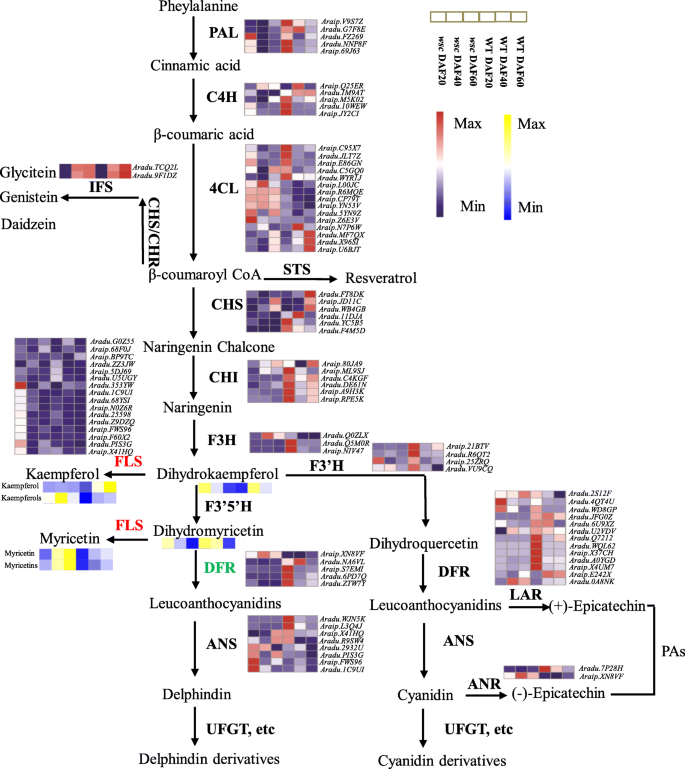
黄酮类成分决定花生皮的颜色[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba]。根据KEGG数据库中类黄酮生物合成途径基因的KO鉴定,结合功能标注,检索到类黄酮代谢途径中433个DEGs(表1)gydF4y2Ba1gydF4y2Ba)。本研究利用油菜转录本分析了与色素沉着相关的黄酮、花青素和黄酮/黄酮醇三种次生代谢途径的相关基因,并对这些途径中的核心基因进行了详细的研究,结果表明,在分析过程中,大多数基因的表达水平发生了显著变化。事实上,不管这些是否是ebg(例如,gydF4y2Ba气gydF4y2Ba)或lbg(例如:gydF4y2Ba答gydF4y2Ba,gydF4y2BaUFGTgydF4y2Ba),在WT内均表现出更高的转录物丰度gydF4y2BawscgydF4y2Ba除了4-香豆酸:辅酶a连接酶基因和它们的黄酮醇合成酶对应物(图2)。gydF4y2Ba3.gydF4y2Ba)。作为类黄酮生物合成的一个分支点,二氢黄酮醇是通过FLS和DFR分别生成无色黄酮醇和彩色花青素的中间体。花青素含量降低gydF4y2BawscgydF4y2Ba,对应于的下一级表达式gydF4y2BaDFRgydF4y2Ba基因。杨梅素和山奈酚含量增加gydF4y2BawscgydF4y2Ba,这与gydF4y2BaFLS的gydF4y2Ba表达式(无花果。gydF4y2Ba3.gydF4y2Ba)。结合转录组和代谢组信息,可以推断gydF4y2BaDFRgydF4y2Ba可能是导致粉红色丧失的目标基因gydF4y2BawscgydF4y2Ba。FLS和DFR对常见的二氢黄酮醇底物的竞争可能会明显阻碍花青素的合成,导致杨梅素和山奈酚等黄酮醇的生成增加,从而改变黄酮醇与花青素的比例gydF4y2BawscgydF4y2Ba。gydF4y2Ba
黄酮类/花青素途径参与花生种皮发育。PAL:苯丙氨酸解氨酶;C4H,肉桂酸4-羟化酶;4CL, 4-香豆酸辅酶a连接酶;CHS,查尔酮合成酶;查尔酮异构酶;CHR:查尔酮还原酶;F3H,黄酮3-羟化酶;2-羟基异黄酮合成酶;F3'H,类黄酮3 ' -羟化酶:类黄酮3 ' - 5 ' -羟化酶; FLS, flavonol synthase; DFR, dihydroflavonol 4-reductase; LAR, leucoanthocyanidin reductase; ANS, anthocyanidin synthase; ANR, anthocyanidin reductase; UFGT, anthocyanidin 3-OgydF4y2Ba葡糖基转移酶。利用FPKM的z分数对热图中三个生物重复的平均值进行基因表达缩放gydF4y2Ba
软木脂在gydF4y2BawscgydF4y2Ba外种皮表皮gydF4y2Ba
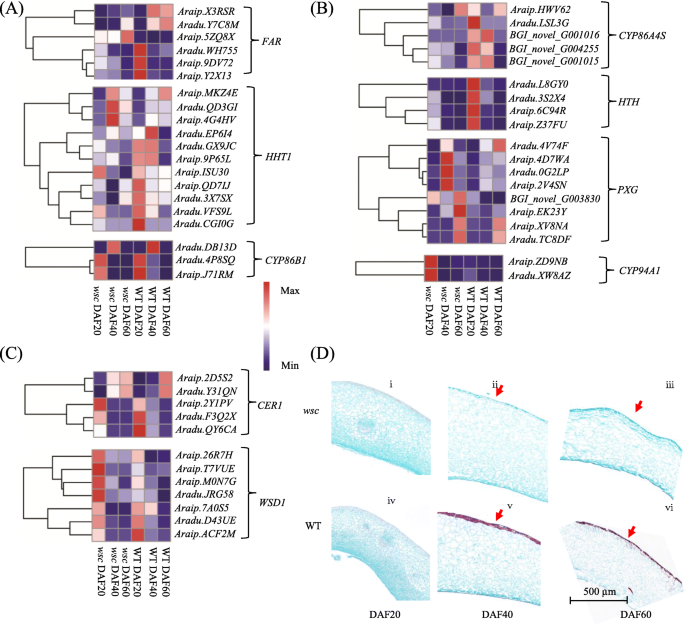
木栓素及其伴生蜡在植物发育中起重要作用[gydF4y2Ba24gydF4y2Ba]。就像黄酮类化合物一样gydF4y2BawscgydF4y2Ba在分析过程中发生了很大的变化,本研究进一步分析了参与角质、木质素和蜡的生物合成的KEGG途径。数据显示,大多数角质素和亚木质素合成途径基因的转录本水平显著高于gydF4y2BawscgydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Baa和b),而参与蜡合成的基因没有明显的规律性(图2)。gydF4y2Ba4gydF4y2Bac) 6个中的5个gydF4y2Ba远gydF4y2Ba参与脂肪结构域芳香族亚胺单体合成的族[gydF4y2Ba25gydF4y2Ba]在DAF20或DAF60处显著抑郁,11人中有8人gydF4y2BaHHT1gydF4y2Badeg被上调,等等gydF4y2BaCYP86B1gydF4y2Ba基因在gydF4y2BawscgydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Baa)五分之四gydF4y2BaCYP86A4SgydF4y2Ba四种基因均被归类为deggydF4y2BaHTHgydF4y2Ba与WTs相比,基因的表达水平增强(图2)。gydF4y2Ba4gydF4y2Baa).木素染色显示,在三个发育阶段几乎没有红色染色gydF4y2BawscgydF4y2Ba与发育过程中WT的深红色染色相比(图2)。gydF4y2Ba4gydF4y2Bad)。gydF4y2Ba
睾丸发育过程中蜡质、角质和木质素合成的变化gydF4y2BawscgydF4y2Ba和WT。gydF4y2Ba一个gydF4y2Ba木质素合成途径基因的表达。gydF4y2BabgydF4y2Ba角质素合成途径基因的表达。gydF4y2BacgydF4y2Ba谷氨酸氨基酸合成途径基因的表达。gydF4y2BadgydF4y2Ba种皮发育过程中亚胺类化合物的变化gydF4y2BawscgydF4y2BaWT. FAR,醇形成脂肪酰基辅酶a还原酶;ASFT/HHT,脂肪亚铁素转移酶;CYP86B1,脂肪酰基羟化酶(细胞色素P450单加氧酶);CER1 ECERIFERUM1;蜡合酶/酰基辅酶a:二酰基甘油酰基转移酶;CYP86A4S,细胞色素p450;HTH, HOTHEAD(葡萄糖-甲醇-胆碱
主要代谢差异gydF4y2Ba
转录组分析显示,糖酵解和糖异生途径在玉米中受到不同的调控gydF4y2BawscgydF4y2Ba糖酵解中催化14步反应的13种酶的编码基因的表达也有不同程度的增强(附加文件)gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba)。作为糖酵解途径中三个关键酶(即己糖激酶、磷酸果糖激酶和丙酮酸激酶)之一的己糖激酶中的9个deg的表达均显著增加,特别是在两个后期阶段(附加文件)gydF4y2Ba10gydF4y2Ba一个,gydF4y2Ba11gydF4y2BaA),而磷酸果糖激酶的6个deg在gydF4y2BawscgydF4y2Ba通过不同的模式(附加文件gydF4y2Ba10gydF4y2Ba一个,gydF4y2Ba11gydF4y2BaB)。12个丙酮酸激酶基因中的2个在gydF4y2BawscgydF4y2Ba尤其是在DAF20的早期阶段,包括最高表达的基因,gydF4y2BaAraip。VA90HgydF4y2Ba。其余十个丙酮酸激酶基因在突变体中也表现出增强的表达(附加文件)gydF4y2Ba10gydF4y2Ba一个,gydF4y2Ba11gydF4y2BaC)。gydF4y2Ba
糖酵解途径的产物在丙酮酸脱氢酶复合物的催化下进入TCA循环。数据显示,DAF20、DAF40和DAF60分别富集了19个、26个和37个DEGs,我们详细分析了控制这一过程的10个酶编码基因,发现6个基因在DAF20、DAF40和DAF60中存在差异表达gydF4y2BawscgydF4y2Ba。四个丙酮酸脱氢酶基因在三个发育阶段均上调gydF4y2BawscgydF4y2Ba,而其他三个仅在DAF40(附加文件)中增强gydF4y2Ba10gydF4y2BaB,gydF4y2Ba11gydF4y2BaD).与此同时,两种柠檬酸合酶基因增加,一种基因死亡gydF4y2BawscgydF4y2Ba(附加文件gydF4y2Ba10gydF4y2BaB,gydF4y2Ba11gydF4y2BaE),而该突变体中所有乌头碱酶基因均表现为激活表达,尤其是3个高表达基因(gydF4y2BaAradu。S0KU9 Aradu.83N8C,gydF4y2Ba和gydF4y2BaAraip。SB6JFgydF4y2Ba)(附加文件gydF4y2Ba10gydF4y2BaB,gydF4y2Ba11gydF4y2Ba异柠檬酸脱氢酶的表达也普遍较高gydF4y2BawscgydF4y2Ba,达到DAF40(附加文件)的最高级别gydF4y2Ba10gydF4y2BaB,gydF4y2Ba11gydF4y2BaG),而琥珀酸脱氢酶的两个deg在DAF40不同,一个激活,另一个抑制(附加文件gydF4y2Ba10gydF4y2BaB,gydF4y2Ba11gydF4y2Ba6个苹果酸脱氢酶基因中有5个在DAF40或DAF 60(或两者都有)上调gydF4y2BaAraip。M2TZZgydF4y2Ba都是下调的吗gydF4y2BawscgydF4y2Ba发展阶段(附加文件gydF4y2Ba10gydF4y2BaB,gydF4y2Ba11gydF4y2Ba我)。gydF4y2Ba
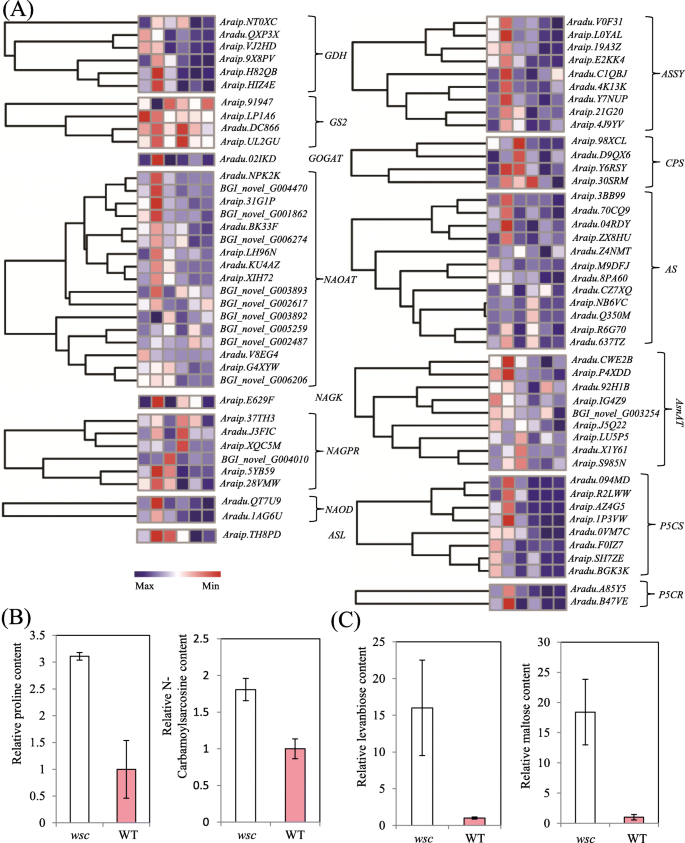
氨基酸代谢途径中的DEG研究表明,谷氨酸氨基酸合成发生在显著较高的表达水平gydF4y2BawscgydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Baa)五个gydF4y2BaP5CS (gydF4y2Ba脯氨酸合成的两个关键酶编码基因之一gydF4y2Ba)gydF4y2Ba基因在三个发育阶段均具有较强的表达水平,而其他三个基因在发育阶段具有较高的表达水平gydF4y2BawscgydF4y2Ba在两个早期阶段。两个gydF4y2BaP5CR (gydF4y2Ba另一个脯氨酸合成的关键酶编码基因gydF4y2Ba)gydF4y2Ba基因差异表达检测;gydF4y2BaAradu。A85Y5,gydF4y2Ba在所有三个阶段的表达水平都明显更高,而其对应的gydF4y2BaAradu。B47VEgydF4y2Ba,仅在DAF20和DAF40处激活(图2)。gydF4y2Ba5gydF4y2Ba一)gydF4y2Ba。gydF4y2Ba睾丸代谢组学分析表明,脯氨酸含量gydF4y2BawscgydF4y2Ba是WT的3倍,n -氨基甲酰肌氨酸含量是WT的1.8倍(图2)。gydF4y2Ba5gydF4y2Bab)。gydF4y2Ba
谷氨酸氨基酸合成途径基因的表达及氨基酸/糖含量的改变gydF4y2BawscgydF4y2Ba和WT。gydF4y2Ba一个gydF4y2Ba谷氨酸氨基酸合成途径基因的表达。gydF4y2BabgydF4y2Ba脯氨酸和n -氨基甲酰肌氨酸含量gydF4y2BawscgydF4y2Ba和WT。gydF4y2BacgydF4y2Balevaneise和麦芽糖的含量gydF4y2BawscgydF4y2BaWT. GDH,谷氨酸脱氢酶;GS2,谷氨酰胺合成酶;2、谷氨酸合成酶;n -乙氨酸氨基转移酶;n -乙酰谷氨酸激酶;n -乙酰谷氨酸-5-磷酸还原酶;n -乙酰鸟氨酸脱乙酰;精氨酸琥珀酸裂解酶;精氨酸琥珀酸合成酶;CPS,氨基甲酰磷酸合成酶; AS, asparagine synthase; AsnAT, aspartate aminotransferase; P5CS, delta-1-pyrroline-5-carboxylate synthetase; P5CR, pyrroline-5-carboxylate reductase. Gene expression was scaled using Z-scores of FPKM for mean valued of three biological replicates in heatmaps
糖为植物提供能量并在类黄酮积累中起作用[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba]。编码蔗糖转运体的三个基因家族与植物糖积累有关,包括TSTs [gydF4y2Ba28gydF4y2Ba]、SUTs [gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba]和SWEET的第三支[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba]。我们比较了这些基因家族的表达模式gydF4y2BawscgydF4y2Ba和WT(附加文件)gydF4y2Ba12gydF4y2Ba),并发现有7个sut的水平明显较高gydF4y2BawscgydF4y2Ba尽管表达模式不同,但比WT要好;gydF4y2BaAradu。M7BX0gydF4y2Ba,gydF4y2BaAradu。QA3D9gydF4y2Ba,gydF4y2BaAradu。SQ8X7gydF4y2Ba均在发育早期具有最高水平,并调整为中等水平;相比之下,gydF4y2BaAraip.53MMFgydF4y2Ba表现出更高的表达水平gydF4y2BawscgydF4y2Ba而其他三个sut在所有三个阶段的突变体中都具有一致的较高表达水平(附加文件)gydF4y2Ba12gydF4y2Ba)。SWEETs的13个deg中有9个表达增强,4个表达降低(附加文件)gydF4y2Ba12gydF4y2Ba)。在单糖转运体的情况下,两种STPs的表达gydF4y2BawscgydF4y2Ba显著高于WT(附加文件?gydF4y2Ba12gydF4y2Ba)。代谢组谱数据表明gydF4y2BawscgydF4y2Ba与WT(附加文件)相比,睾丸中麦芽糖和左苯二糖的含量增加了十倍以上gydF4y2Ba12gydF4y2BaC)。gydF4y2Ba
植物激素和TFs在水稻白睾丸表型中的重要作用gydF4y2BawscgydF4y2Ba
据报道,激素和转录因子都在类黄酮积累中发挥作用[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba35gydF4y2Ba]。本研究比较了参与激素合成和信号转导的基因。结果显示有5个deg参与BR合成途径,其中3个gydF4y2BaBR6OX1gydF4y2Ba在DAF20或DAF40和DAF60位点表达上调;相比之下,两者gydF4y2BaBAS1gydF4y2Ba降低活性BRs水平的基因显著下调gydF4y2BawscgydF4y2Ba附加文件gydF4y2Ba13gydF4y2BaA)。对睾丸代谢组的分析发现了BR生物合成途径中的16种代谢物,并且这些代谢物都被上调(附加文件)gydF4y2Ba2gydF4y2Ba)。同时,16个deg参与GA合成途径,包括gydF4y2Ba花王gydF4y2Ba(3),gydF4y2BaGA2oxgydF4y2Ba(3),gydF4y2BaGA3oxgydF4y2Ba(1)gydF4y2BaGA20oxgydF4y2Ba(9)经本分析鉴定;这些基因中的大多数在gydF4y2BawscgydF4y2Ba除了…gydF4y2BaAradu。BUI3V Araip。KVM2C,gydF4y2Ba和gydF4y2BaAradu。U5UGYgydF4y2Ba都表现出相反的表达模式(附加文件gydF4y2Ba13gydF4y2BaB).此外,睾丸代谢组分析也通过鉴定三种途径产物的含量增加来支持GA合成的增强gydF4y2BawscgydF4y2Ba(附加文件gydF4y2Ba2gydF4y2Ba)。而参与JA生物合成的deg包括两个gydF4y2BaPLA1gydF4y2Ba(例如,gydF4y2BaBGI_novel_G004010gydF4y2Ba和gydF4y2BaAradu。Y096ZgydF4y2Ba),一个gydF4y2Ba重获gydF4y2Ba(gydF4y2BaAradu。H2RVWgydF4y2Ba),四个gydF4y2Ba超载比gydF4y2Ba(例如,gydF4y2BaAradu。FV6YV Araip。F1ZZD Aradu.0C0YF,gydF4y2Ba和gydF4y2BaAraip.22RGEgydF4y2Ba),三gydF4y2BaMFPgydF4y2Ba(例如,gydF4y2BaAraip。UPC07 Araip。M6X0I,gydF4y2Ba和gydF4y2BaAraip.60KBFgydF4y2Ba)都得到了加强gydF4y2BawscgydF4y2Ba(附加文件gydF4y2Ba13gydF4y2BaC)。因此,这些表达和代谢组数据综合起来支持BR、GA和JA合成途径的增强。gydF4y2Ba
本研究还发现了一系列参与7条激素信号转导通路的deg,包括ABA中的9条,AUX中的12条,BR中的5条,CTK中的10条,GA中的7条,JA中的10条和SA中的4条gydF4y2Ba14gydF4y2Ba)。包括SRK2基因Aradu在内的7个ABA信号表达基因增强。FPKM值最高的SKS95(附加文件gydF4y2Ba14gydF4y2BaA).绝大多数AUX信号通路基因在gydF4y2BawscgydF4y2Ba;只有两家偏离了这种模式,gydF4y2BaAraip。TU273gydF4y2Ba和gydF4y2BaAraip.60Q0EgydF4y2Ba,这两个突变体在DAF20(附加文件)上都表现出明显的减少gydF4y2Ba14gydF4y2BaB)gydF4y2Ba。gydF4y2Ba此外,5个参与BR信号传导的基因中有4个在gydF4y2BawscgydF4y2Ba(附加文件gydF4y2Ba14gydF4y2BaC);参与JA信号通路的10个deg中有9个上调,均为MYC2因子(另附文件)gydF4y2Ba14gydF4y2BaD)。激素信号转导通路中deg的表达模式和FPKM值提供了ABA、AUX、JA和BR信号增强的集体证据gydF4y2Ba14gydF4y2Ba)。gydF4y2Ba
类黄酮的产生受MYB因子和MBW复合物的转录调控。在本分析中共鉴定出24个R2R3-MYB(9个向上,15个向下)、26个bHLH(17个向上,9个向下)和21个WD40(19个向上,2个向下)基因(附加文件)gydF4y2Ba15gydF4y2Ba),包括同系物(gydF4y2BaAradu。CA8XJgydF4y2Ba和gydF4y2BaAraip。MHR6KgydF4y2Ba)gydF4y2BaAtTT8gydF4y2Ba是什么使黄酮类化合物在细胞中特异性积累gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba36gydF4y2Ba和…的同系物gydF4y2BaAtMYB5gydF4y2Ba(例如,gydF4y2BaAradu。JK51ZgydF4y2Ba和gydF4y2BaAradu。WZF00gydF4y2Ba)控制外种皮分化旁边gydF4y2BaTTG1gydF4y2Ba和gydF4y2BaTT2gydF4y2Ba[gydF4y2Ba37gydF4y2Ba]。gydF4y2Ba
多组学分析揭示的白色睾丸表型候选基因gydF4y2Ba
为了确定控制花生白色睾丸突变表型的候选基因,我们分析了WT和花生白色睾丸突变表型之间的共同基因gydF4y2BawscgydF4y2Ba在三个不同的发展阶段。该分析结果鉴定出1646个unigenes(图2)。gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba16gydF4y2Ba)。在整个生长阶段和组织的观察显示,两组间无明显差异gydF4y2BawscgydF4y2Ba除了种子表型(附加文件gydF4y2Ba17gydF4y2Ba),因此gydF4y2BaWSCgydF4y2Ba被鉴定为一种种子特异性基因。以前公布的数据[gydF4y2Ba38gydF4y2Ba],以鉴定种子特异性表达的共同deggydF4y2BawscgydF4y2Ba和WT,得到86个候选基因的睾丸表型(附加文件gydF4y2Ba18gydF4y2Ba)。的gydF4y2BawscgydF4y2Ba在突变群体的M3代中得到鉴定,而WT与gydF4y2BawscgydF4y2Ba约3:1(156:49)。将种子特异表达的常见deg与遗传分析结果相结合,揭示了可能的候选基因gydF4y2BaAraip。M7RY3gydF4y2Ba(gydF4y2BaCSN1)gydF4y2Ba,gydF4y2BaAradu。R8PMF(MYB)和gydF4y2BaAraip。MHR6K(bHLH)(附加文件gydF4y2Ba18gydF4y2Ba)。的FPKM值gydF4y2BaAraip。M7RY3gydF4y2BaWT种皮基因从2.15 (DAF20)降至1.15 (DAF40),再降至0.19gydF4y2BawscgydF4y2Ba从7.55 (DAF20)增加到12.21 (DAF40),然后进一步增加到12.84 (DAF60)。注释:Araip。M7RY3我s homolog of a COP9 signalosome complex subunit 1(CSN1) encoding gene. Previous studies have revealed that several subunits of the COP9 signalosome complex are involved in regulating flavonoids and that phenylalanine metabolism further regulates proanthocyanidin biosynthesis [39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba]。Aradu。R8PMF和Araip。MHR6K一个re components of MBW complex which are widely reported function in flavonoids metabolism (Li, 2014)。gydF4y2Ba为了研究这三个候选基因在WT和突变植株之间的序列差异,我们检查了从转录组数据中调用的SNPs,并通过PCR产物的直接测序来验证SNPs。结果,我们在bHLH-MYC_N的DNA结合域(pfam14215)上发现了一个SNPgydF4y2BaAraip。MHR6KgydF4y2Ba(Araip。B06_2335496gydF4y2Ba(A / G)gydF4y2Ba)导致50gydF4y2BaTgydF4y2Ba到50gydF4y2Ba我gydF4y2Ba经测序证实的氨基酸变化(附加文件)gydF4y2Ba19gydF4y2Ba)。这些基因导致白色种子表型的信息需要在未来的功能基因组学研究中进一步证实。gydF4y2Ba
讨论gydF4y2Ba
适当的色素沉着决定了花生的外观和营养品质。因此,复杂的转录组、代谢组调节和细胞学变化表明,黄酮类生物合成等次生代谢途径和糖酵解、糖异生等初级代谢途径在黄酮类植物中存在明显差异gydF4y2BawscgydF4y2Ba类黄酮合成相关基因及其对应的糖酵解和TCA循环关键酶编码基因、谷氨酸氨基酸合成途径基因、糖合成酶和转运体基因之间的差异表达gydF4y2BawscgydF4y2Ba这些途径可能受到上游植物激素信号(AUX、BR和JA)和转录因子(MYB、bHLH和WD40)的调控。该结果提供了信息线索,增加了对睾丸着色的调控网络的理解,因此将有助于理想品质花生的遗传育种。gydF4y2Ba
WSC基因的多级调控gydF4y2Ba
本文报道的基因富集分析显示,23、17和13个主要与代谢和环境信息处理相关的生物过程、细胞成分和分子功能发生了差异改变(图2)。gydF4y2Ba2gydF4y2Bab和附加文件gydF4y2Ba6gydF4y2Ba)。与代谢过程相关的基因分别占总DEG数的36.08、38.09和37.71%(即2308/6397、3988/10471和3416/9059)gydF4y2Ba5gydF4y2Ba和gydF4y2Ba6gydF4y2Ba),而代谢途径、次生代谢物的生物合成、植物激素信号转导和碳代谢是受影响的主要生物过程gydF4y2BawscgydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Bab).与代谢相关的基因呈现混合趋势,而激素反应和生物合成过程有效上调gydF4y2BawscgydF4y2Ba。gydF4y2Ba
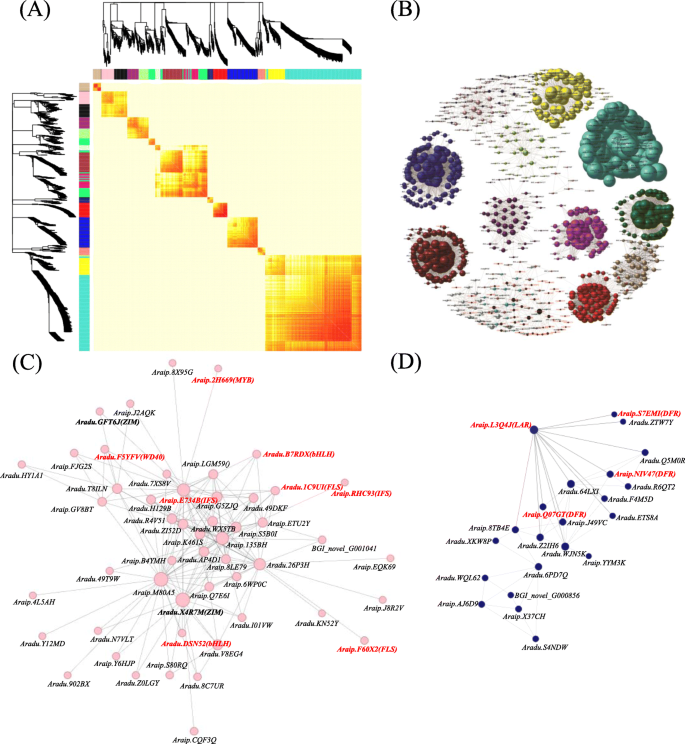
本研究中检测到的deg被分为16个共表达模块,每个共表达模块都包含具有相似表达模式的代表,因此可能具有平行的功能(图2)。gydF4y2Ba6gydF4y2Baa, b). KEGG富集表明,14个共表达的DEG模块均富集于类黄酮生物合成、植物激素合成、植物信号转导和碳代谢。多组学分析暗示竞争性表达gydF4y2BaFLS的gydF4y2Ba和gydF4y2BaDFRgydF4y2Ba基因导致黄酮醇和花青素积累的重定向。然后将重点放在包含FLS和DFR基因的模块上。令人惊讶的是,我们发现FLS基因与MYB基因共表达(gydF4y2BaAraip.2H669gydF4y2Ba), wd40 (gydF4y2BaAradu。F5YFVgydF4y2Ba), aoc (gydF4y2BaAraip。Q7E6IgydF4y2Ba,gydF4y2BaAradu。T8ILN,gydF4y2Ba和JA合成途径关键酶编码基因),JAZ (gydF4y2BaAradu。X4R7MgydF4y2Ba和gydF4y2BaAradu。GFT6JgydF4y2Ba), myc2 (gydF4y2BaAradu。DSN52gydF4y2Ba,gydF4y2BaAradu。B7RDXgydF4y2Ba,gydF4y2BaAraip。LGM59gydF4y2Ba)及IFS (gydF4y2BaAraip。RHC93gydF4y2Ba和gydF4y2BaAraip。E734BgydF4y2Ba),表明MBW复合物和JA信号通路对FLS基因的调控作用(图2)。gydF4y2Ba6gydF4y2Bac)。同时,DFR基因与CHS共表达(gydF4y2BaAradu。F4M5DgydF4y2Ba), f3h (gydF4y2BaAraip。NIV47gydF4y2Ba和gydF4y2BaAradu。Q5M0RgydF4y2Ba),及(gydF4y2BaAraip.8TB4EgydF4y2Ba)及LAR (gydF4y2BaAraip。X37CHgydF4y2Ba和gydF4y2BaAradu。WQL62gydF4y2Ba)基因(图2)gydF4y2Ba6gydF4y2Bad).据报道,花青素和原花青素的合成都受MBW复合物的调控gydF4y2Ba玉米gydF4y2Ba,gydF4y2Ba金鱼草majusgydF4y2Ba,gydF4y2Ba佩妮混合gydF4y2Ba,gydF4y2Ba答:芥gydF4y2Ba[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba];虽然本分析结果与上述研究不一致,但与花生色素调控研究结果一致,花生色素调控研究表明花青素的生物合成主要受AtMYB111同源物(即gydF4y2Bac35101_g4gydF4y2Ba和gydF4y2Bac37398_g2gydF4y2Ba),而不是通过lbg的MBW复合物。因此,本研究结果强调了花生皮色素的独特调控模式,可能来自于空中开花和地下结荚的特性。gydF4y2Ba
WSC重定向花生皮中苯丙素的代谢通量gydF4y2Ba
黄酮类化合物是次生代谢物,在植物体内积累,通过促进果实和花朵颜色的形成来促进种子和花粉的传播[gydF4y2Ba47gydF4y2Ba]。的确,当gydF4y2BawscgydF4y2Ba第一次观察到,认为与WT相比,黄酮类化合物含量明显降低,导致白色,然而,睾丸横切面发育的TBO染色显示gydF4y2BawscgydF4y2Ba代谢组学分析显示,异黄酮、黄烷酮、黄酮、黄酮c -苷、黄酮醇含量均显著升高,花青素和原花青素含量显著降低。近年来,类黄酮c -糖苷已被证明具有显著的抗氧化活性、抗癌和抗肿瘤潜力、肝保护、抗炎、抗糖尿病、抗病毒、抗菌和抗真菌活性以及其他生物效应[qh]gydF4y2Ba48gydF4y2Ba]。在大多数情况下,c -糖基类黄酮似乎比相应的o -糖基类黄酮和苷元具有更高的抗氧化和抗糖尿病潜能[gydF4y2Ba48gydF4y2Ba]。重定向在类黄酮成分中,特别是黄酮c -苷和黄酮醇含量显著较高,结合非常高的产量潜力,意味着广泛和广泛的前景应用gydF4y2BawscgydF4y2Ba。gydF4y2Ba
植物激素在白色睾丸表型形成中的关键作用gydF4y2Ba
以往的研究已经阐明了植物激素在类黄酮途径调控中的作用。MeJA是一种植物激素,在植物生长和许多生理生化过程中起关键作用[j]。gydF4y2Ba49gydF4y2Ba]。这种化合物已被用来刺激次生代谢物的生产在许多植物物种。MeJA可提高黑莓、草莓和橄榄类水果的抗氧化活性和类黄酮含量[gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba]。α-亚麻酸途径的JA合成在转录组(即JA合成途径的所有10个deg)和代谢组(即所有16种差异代谢物)数据集中均显著上调gydF4y2BawscgydF4y2Ba(附加文件gydF4y2Ba13gydF4y2BaC). jjas与COI1相互作用,然后通过26S蛋白酶体降解,释放下游转录因子如MYC2,激活JA反应[gydF4y2Ba53gydF4y2Ba]。在本研究中,10个DEGs (MYC2基因)中有9个在gydF4y2BawscgydF4y2Ba。通过基因共表达分析,鉴定出与FLS、IFS和MSW复合物相关的两个MYC2基因。MYC2调节吲哚硫代葡萄糖苷和色氨酸的生物合成,以及对坏死性病原体的抵抗力。gydF4y2Bab .灰质gydF4y2Ba),以及的表达式gydF4y2BaERF1gydF4y2Ba,gydF4y2BaORA59gydF4y2Ba,gydF4y2BaPDF1.2gydF4y2Ba通过调节ja依赖性反应[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba]。MYC2的多种功能可能是黄酮类化合物重编程的原因之一gydF4y2BawscgydF4y2Ba。gydF4y2Ba
油菜甾醇生物合成油菜素内酯的途径有两条gydF4y2Ba拟南芥gydF4y2Ba第一次是通过(6α)-羟基油菜甾醇,第二次是通过6-脱氧甾酮。在gydF4y2Ba拟南芥gydF4y2Ba包括DWF4、DET2、CPD、BR6OX和BAS1 [gydF4y2Ba60gydF4y2Ba]。一个关键基因家族的成员,gydF4y2BaBR6OX1gydF4y2BaBR生物合成负调控因子上调2倍以上,BR生物合成负调控因子上调2倍以上gydF4y2BaBAS1gydF4y2Ba基因在突变体中被抑制。几个关键的BR信号和应答基因的表达水平,包括gydF4y2BaBRI1gydF4y2Ba(gydF4y2BaAraip.0ZF73gydF4y2Ba,gydF4y2BaBGI_novel_G003679gydF4y2Ba),gydF4y2BaBSKgydF4y2Ba(gydF4y2BaAradu。NG7HHgydF4y2Ba),gydF4y2BaBAK1 (BGI_novel_G006285)gydF4y2Ba上调了两倍多。众所周知,BR信号通过BES1和BZR1抑制的表达来抑制BR的生物合成gydF4y2BaDWF4gydF4y2Ba,gydF4y2BaCPDgydF4y2Ba和其他生物合成基因[gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba]。这可能是无法确定BR合成明显增强的原因之一。gydF4y2Ba
最近的研究也表明,IAA直接与F-box蛋白TIR1相互作用,促进Aux/IAA转录抑制因子的降解,激活多种生长素应答基因。该分析结果表明,AUX的合成不受影响gydF4y2BawscgydF4y2Ba而信号转导明显增强。最高表达gydF4y2BaAUX1gydF4y2Ba的基因,gydF4y2BaAraip。TU273,gydF4y2Ba在DAF20中表达上调,而几乎所有AUX应答基因在gydF4y2BawscgydF4y2Ba。有研究表明,胚乳中AUX的产生驱动种皮发育,而中心细胞的受精导致该化合物的产生,并极有可能将其输出到母体组织;该过程通过去除PcG功能来驱动种皮发育[gydF4y2Ba65gydF4y2Ba]。激活的AUX信号可能是由于AUX在胚乳中的合成增强或从胚乳到睾丸的运输。gydF4y2Ba
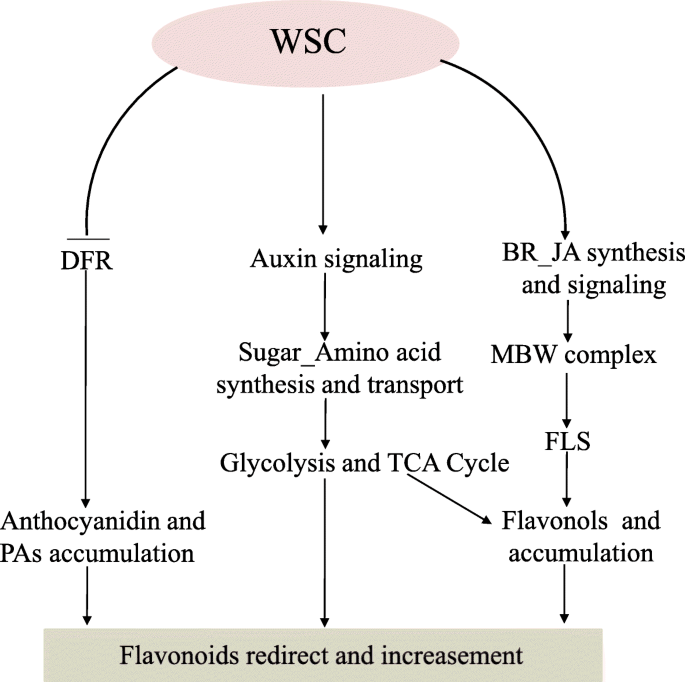
本研究描述了一种具有白色种皮的花生突变体,其黄酮醇和黄酮c -糖苷含量较高,可能具有许多有前景的应用前景。AUX、BR、JA、碳代谢和类黄酮代谢途径均存在差异gydF4y2BawscgydF4y2Ba和WT等被选为产生粉红色睾丸色素沉着的重要候选者(附加文件gydF4y2Ba20.gydF4y2Ba)。AUX信号通路可能与BR和JA合成信号通路协同作用,调节类黄酮合成和碳代谢途径相关基因,影响初级代谢,重定向类黄酮的积累。三个候选人gydF4y2BaWSCgydF4y2Ba基因(gydF4y2BaAraip。M7RY3gydF4y2Ba(gydF4y2BaCSN1)gydF4y2Ba,gydF4y2BaAradu。R8PMF(MYB)和gydF4y2BaAraip。MHR6K(bHLH)]控制的表达gydF4y2BaFLS的gydF4y2Ba通过调节激素信号和MBW复合物鉴定对应物;反过来,这增加了黄酮醇的积累,负向控制DFR基因的转录本,导致花青素和PA含量下降(图2)。gydF4y2Ba7gydF4y2Ba)。苏格兰的SNPgydF4y2BaAraip。MHR6KgydF4y2Ba(Araip。B06_2335496gydF4y2Ba(A / G)gydF4y2Ba)位于DNA结合域,可能改变其与下游基因(尤其是类黄酮合成途径基因)的DNA结合能力,从而导致白色睾丸表型。该SNP可用于基因组辅助育种,以开发具有白色种皮的花生品种。gydF4y2Ba
结论gydF4y2Ba
本研究描述了一种具有白色种皮的花生突变体,其黄酮醇和黄酮c -糖苷含量较高,可能具有许多有前景的应用前景。代谢组学分析显示,异黄酮、黄烷酮、黄酮、黄酮c -苷、黄酮醇含量均显著升高,花青素和原花青素含量显著降低。AUX、BR、JA、碳代谢和类黄酮代谢途径在不同品种间存在差异gydF4y2BawscgydF4y2Ba和WT等被选为产生白色睾丸色素沉着的重要候选者。AUX信号通路可能与BR和JA合成及其他信号通路协调,与调节类黄酮合成和碳代谢途径相关基因相互作用,从而影响初级代谢和重定向类黄酮的积累。通过激素合成和信号传导调控的FLS和DFR之间的竞争以及MBW复合物可能是调节白睾丸表型的关键分子控制节点。结合组织表达模式、遗传分析和这三个阶段的共同deg注释,我们发现三个睾丸特异性表达候选基因,gydF4y2BaAraip。M7RY3gydF4y2Ba,gydF4y2BaAradu。R8PMFgydF4y2Ba和gydF4y2BaAraip。MHR6KgydF4y2Ba可能对白色睾丸表型负责吗gydF4y2Ba。gydF4y2Ba这些数据证实了导致白色睾丸癌的因素之间存在相互作用关系gydF4y2BawscgydF4y2Ba。gydF4y2Ba
方法gydF4y2Ba
植物材料和处理gydF4y2Ba
的gydF4y2BawscgydF4y2Ba本研究中使用的突变体是从梯度中分离出来的gydF4y2Ba60gydF4y2BaCo (100 Gy, 40 Gy.hgydF4y2Ba−1gydF4y2Ba万丽云博士从中国农业科学院油料作物研究所栽培的高产高含油量品种中华16号获得了3446个突变群体。所有植株均种植在中国武汉农科院试验田内。野生型(WT)和gydF4y2BawscgydF4y2Ba平行种植(M7代)个体,并于2017年在6株不同植物开花后20天(20DAF)、40DAF和60DAF采集种皮样品。每组进行3次生物重复,从每个样品种子中分离出的睾丸切片。WT和gydF4y2BawscgydF4y2Ba然后将睾丸样品快速冷冻在液氮中,并在- 80°C保存。使用RNA提取试剂盒Qiagen RNeasy Plant Mini kit (Qiagen Inc.121 Valencia, CA)从种子中分离总RNA。gydF4y2Ba
组织制备及光镜观察gydF4y2Ba
根据Wan等人的说法,按照前面的描述进行组织制备。[gydF4y2Ba23gydF4y2Ba]。组织切片分别用TBO和红花素O/fast green染色,显示多酚和亚红素[gydF4y2Ba66gydF4y2Ba];然后在染色和干燥后使用Nikon ECLIPSE TI-SR显微镜(Nikon Instruments, Japan)进行观察。gydF4y2Ba
代谢组学和gydF4y2Ba脂肪酸含量gydF4y2Ba
对于睾丸类黄酮代谢组学、睾丸脂质代谢组学和胚胎非靶代谢组学,按照METWARE(中国武汉)和华大基因(中国武汉)的说明,用差异缓冲液提取冻干衣。样品提取采用LC-ESI-MS/MS系统(HPLC, Shim-pack UFLC SHIMADZU CBM30A系统;MS, Applied Biosystems 6500 Q TRAP;MS, API 6500 Q TRAP),并按先前描述的方法进行量化[gydF4y2Ba67gydF4y2Ba]。代谢物含量采用热图中峰面积的z分数(三个生物重复的平均值)进行标度。gydF4y2Ba
种子脂肪酸的提取和分析按照前面的描述进行[gydF4y2Ba68gydF4y2Ba]。gydF4y2Ba
RNA序列,gydF4y2Ba数据处理和基因注释gydF4y2Ba
野生和野生的种皮gydF4y2BawscgydF4y2Ba根据其发育阶段和颜色,于2017年在DAF20、DAF40和DAF60收获;然后使用华大基因(中国武汉)的Illumina HiSeq平台对这些样本进行rna测序。每个样品取3 μg的总RNA,富集信使RNA,构建互补DNA文库。因此,使用内部软件SOAPnuke过滤读取,平均每次重复产生总共6.66 Gb的干净碱基。利用HISAT在花生合成四倍体参考基因组的基础上进行制图步骤gydF4y2Ba答:duranensisgydF4y2Ba和gydF4y2Ba答:ipaensisgydF4y2Ba[gydF4y2Ba69gydF4y2Ba) (gydF4y2Bahttps://peautbase.org/gydF4y2Ba)。序列数据已上传到国家生物技术信息中心SRA数据库,登录号:PRJNA497474。共检测到61903个表达基因,其中7336个被预测为新基因。在检测到新的转录本后,我们将一系列新的编码转录本与参考转录本合并,生成一个完整的参考集,然后使用Bowtie2软件将干净读取映射到该参考集上[gydF4y2Ba70gydF4y2Ba],用RSEM计算每个样本的基因表达水平[gydF4y2Ba71gydF4y2Ba]。DEGseq通过算法鉴定样品之间的差异表达基因,得到结果gydF4y2BaPgydF4y2Ba使用Benjamini和Hochberg校正来调整值以控制FDR。通过DESeq检测到的调整P值< 0.05的基因被定义为deg。使用Blast2GO软件进行基因注释。通过使用KEGG注释将这些deg分配到代谢途径,进一步完成了对这些deg的功能解释。使用WGCNA R包进行共表达分析,如先前出版物所述[gydF4y2Ba72gydF4y2Ba,gydF4y2Ba73gydF4y2Ba]。利用热图中FPKM的Z-score(三个生物重复的平均值)对基因表达进行缩放。gydF4y2Ba
存在分析gydF4y2Ba
按照Wan等人之前的描述进行逆转录和qRT-PCR。[gydF4y2Ba23gydF4y2Ba]。gydF4y2Ba
统计分析gydF4y2Ba
统计显著性由Student 's计算gydF4y2BatgydF4y2Ba以及。将FPKM基因表达值换算成Z-score,绘制转录组和代谢组热图。每个实验重复三到六次。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
转录组测序数据可在国家生物技术信息中心SRA数据库中获得,登录号为PRJNA497474 (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/bioproject/PRJNA497474gydF4y2Ba)。gydF4y2Ba
缩写gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- ANR:gydF4y2Ba
-
花青素还原酶gydF4y2Ba
- 辅助:gydF4y2Ba
-
生长素gydF4y2Ba
- BR:gydF4y2Ba
-
BrassinosteroidgydF4y2Ba
- 气:gydF4y2Ba
-
查耳酮异构酶gydF4y2Ba
- CHS:gydF4y2Ba
-
查耳酮合酶gydF4y2Ba
- 与原:gydF4y2Ba
-
细胞分裂素gydF4y2Ba
- DAF):gydF4y2Ba
-
开花后几天gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- DFR:gydF4y2Ba
-
Dihydroflavonol 4-reductasegydF4y2Ba
- EBGs:gydF4y2Ba
-
早期生物合成基因gydF4y2Ba
- F3H:gydF4y2Ba
-
黄烷酮3-hydroxylasegydF4y2Ba
- F3'H:gydF4y2Ba
-
类黄酮3 ' -羟化酶gydF4y2Ba
- F3’5是什么:gydF4y2Ba
-
类黄酮3 ',5 ' -羟化酶gydF4y2Ba
- 罗斯福:gydF4y2Ba
-
错误发现率gydF4y2Ba
- 读者:gydF4y2Ba
-
黄酮醇合成酶gydF4y2Ba
- FPKM:gydF4y2Ba
-
每千碱基百万片段gydF4y2Ba
- 遗传算法:gydF4y2Ba
-
赤霉素gydF4y2Ba
- HISAT:gydF4y2Ba
-
转录本剪接对齐的层次索引gydF4y2Ba
- 是:gydF4y2Ba
-
茉莉酸gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因与基因组百科全书gydF4y2Ba
- 政治:gydF4y2Ba
-
Leucoanthocyanidin还原酶gydF4y2Ba
- LDOX:gydF4y2Ba
-
Leucoanthocyanidin加双氧酶gydF4y2Ba
- lbg:gydF4y2Ba
-
晚期生物合成基因gydF4y2Ba
- MBW:gydF4y2Ba
-
MYB-bHLH-WD40gydF4y2Ba
- 惩罚:gydF4y2Ba
-
甲基jasmonategydF4y2Ba
- MTs:gydF4y2Ba
-
甲基转移酶gydF4y2Ba
- PA:gydF4y2Ba
-
ProanthocyanidingydF4y2Ba
- 圆荚体:gydF4y2Ba
-
过氧化物酶gydF4y2Ba
- PPOD:gydF4y2Ba
-
多酚氧化酶gydF4y2Ba
- 存在:gydF4y2Ba
-
定量反转录PCRgydF4y2Ba
- 山:gydF4y2Ba
-
水杨酸gydF4y2Ba
- sut:gydF4y2Ba
-
HgydF4y2Ba+gydF4y2Ba/蔗糖同向转运gydF4y2Ba
- 31:gydF4y2Ba
-
甲苯胺蓝gydF4y2Ba
- 柠檬酸:gydF4y2Ba
-
三羧酸gydF4y2Ba
- 结核菌素:gydF4y2Ba
-
HgydF4y2Ba+gydF4y2Ba/蔗糖反转运蛋白位于胞质体上gydF4y2Ba
- UFGT:gydF4y2Ba
-
葡萄糖:类黄酮3- o -葡萄糖基转移酶gydF4y2Ba
- wscgydF4y2Ba:gydF4y2Ba
-
白种皮花生突变体gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
姚丽华,蒋彦明,石健,Tomás-Barberán法发,Datta N, Singanusong R,陈世生。食品中的黄酮类化合物及其对健康的益处。植物营养学报,2004;59:113-22。gydF4y2Ba
- 2.gydF4y2Ba
王晓明,王晓明,王晓明,等。黄酮醇合成酶基因家族的功能分析gydF4y2Ba拟南芥gydF4y2Ba。植物生理学报。2008;47(2):444 - 444。gydF4y2Ba
- 3.gydF4y2Ba
黄酮类化合物及其苷类,包括花青素。中华医学杂志,2011;28:1626-95。gydF4y2Ba
- 4.gydF4y2Ba
Byrne P, Darrah L, Snook M, Wiseman B, Widstrom N, Moellenbeck D, Barry B.玉米蚕丝褐变、maysin含量及对玉米耳虫的抗生素作用gydF4y2Ba近几年玉蜀黍属gydF4y2Ba(Boddie)。Maydica。1996;41:13-8。gydF4y2Ba
- 5.gydF4y2Ba
Choi J, Islam M, Ali M, Kim E, Kim Y, Jung h。c -糖基化对芹菜素抗糖尿病、抗阿尔茨海默病和抗炎作用的影响。食品化学,2014;64:27-33。gydF4y2Ba
- 6.gydF4y2Ba
陈建军,陈建军,陈建军,李建军,等。葡萄R2R3-MYB转录因子vmybf1对黄酮醇合成的调控作用。植物生理学报。2009;51(1):1513 - 1530。gydF4y2Ba
- 7.gydF4y2Ba
Kuhn B, Geisler M, Bigler L, Ringli C.黄酮醇不对称积累对植物生长素运输的影响gydF4y2Ba拟南芥gydF4y2Ba。植物生理学报。2011;56(6):585 - 95。gydF4y2Ba
- 8.gydF4y2Ba
李建军,李建军,李建军,李建军,李建军。黄酮类化合物的合成及其对黄酮类化合物积累的影响gydF4y2Ba拟南芥gydF4y2Bathaliana植物显示MYB11-, MYB12-和myb111独立的黄酮醇苷积累。中国生物医学工程学报,2010;18(8):985 - 1000。gydF4y2Ba
- 9.gydF4y2Ba
拟南芥中苯丙类生物合成相关MYB结构域转录因子的基因组序列、进化、组织和表达分析。中国生物医学工程学报,2018;36(6):591 - 591。gydF4y2Ba
- 10.gydF4y2Ba
李生。类黄酮生物合成的转录调控:MYB-bHLH-WD40 (MBW)复合物的微调。植物信号学报,2014;9:851 - 856。gydF4y2Ba
- 11.gydF4y2Ba
王晓明,王晓明,王晓明,等。大气茉莉酸甲酯对大豆营养贮藏蛋白和花青素的诱导作用。科学通报,2001;22(1):1 - 4。gydF4y2Ba
- 12.gydF4y2Ba
Feys B, Benedetti C, Penfold C, Turner J.拟南芥抗植物毒素冠状碱突变体是雄性不育的,对茉莉酸甲酯不敏感,并对细菌病原体有抗性。植物细胞。1994;6:751-9。gydF4y2Ba
- 13.gydF4y2Ba
王莹,刘伟,姜辉,毛忠,王宁,姜松,徐辉,杨刚,张忠,陈旭。R2R3-MYB转录因子MdMYB24-like参与茉莉酸甲酯诱导的苹果花青素生物合成。植物生理学报,2019;39(3):773 - 782。gydF4y2Ba
- 14.gydF4y2Ba
杜德华,张浩,李建军,李建军,张建军。表达谱显示COI1是参与伤口和茉莉酸甲酯诱导的次生代谢、防御和激素相互作用的基因的关键调节因子。植物化学学报,2005;38(1):491 - 491。gydF4y2Ba
- 15.gydF4y2Ba
Loreti E, popoo G, Novi G, Solfanelli C, Alpi A, Perata P.赤霉素、茉莉酸和脱落酸调节蔗糖诱导的拟南芥花青素生物合成基因的表达。植物科学学报,2008;39(1):391 - 391。gydF4y2Ba
- 16.gydF4y2Ba
单霞,张勇,彭伟,王铮,谢东。茉莉酸诱导拟南芥花青素积累的分子机制。[J] .中国生物医学工程学报,2009;30(1):444 - 444。gydF4y2Ba
- 17.gydF4y2Ba
彭志,韩晨,袁磊,张凯,黄辉,任晨。油菜素内酯增强拟南芥幼苗茉莉酸诱导的花青素积累。植物学报,2011;33(3):532 - 532。gydF4y2Ba
- 18.gydF4y2Ba
Gabetta B, Fuzzati N, Griffini A, Lolla E, Pace R, Ruffilli T, Peterlongo F.葡萄种子原花青素的鉴定。Fitoterapia。2000;71:162 - 75。gydF4y2Ba
- 19.gydF4y2Ba
谢迪,谢德,沙玛S.原花青素-类黄酮研究的最后前沿?植物学报,2005;16(1):9 - 28。gydF4y2Ba
- 20.gydF4y2Ba
原花青素和单宁类化合物的性质、发生、膳食摄入及其对营养和健康的影响。[J] .粮食与农业学报。2000;28(2):391 - 391。gydF4y2Ba
- 21.gydF4y2Ba
李建军,李建军,李建军,等。花生表皮颜色对花生抗氧化能力和总多酚含量的影响。中国生物医学工程学报,2009;10:491 - 491。gydF4y2Ba
- 22.gydF4y2Ba
万丽,李波,Pandey M,吴艳,雷艳,闫丽,戴旭,姜宏,张杰,魏刚,Varshney RK,廖波。花生种皮裂化和色素沉着生理调控新突变体转录组分析。植物科学,2016;7:1491。gydF4y2Ba
- 23.gydF4y2Ba
万玲,李斌,雷燕,闫磊,任鑫,陈毅,戴旭,姜宏,张健,郭伟,陈安,廖波。花生荚发育的突变体转录组测序研究gydF4y2Ba落花生hypogaeagydF4y2Bal .)。植物科学,2017;8:1900。gydF4y2Ba
- 24.gydF4y2Ba
李建军,李建军,李建军,等。细胞外屏障的生物合成与调控。植物学报,2015;34:573 - 586。gydF4y2Ba
- 25.gydF4y2Ba
Li-Beisson Y, Shorrosh B, Beisson F, Andersson M, Arondel V, Bates P, Baud S, Bird D, Debono A, Durrett TP, Franke RB, Graham IA, Katayama K, Kelly AA, Larson T, Markham JE, Miquel M, Molina I, Nishida I, Rowland O, Samuels L, Schmid KM, Wada H, Welti R, Xu C, Zallot R, Ohlrogge j。拟南芥学报,2013;11:e0161。gydF4y2Ba
- 26.gydF4y2Ba
库恩宁,关丽,戴志,吴波,罗维格特V, Gomesm E,李诗,Godoy F, Arce-Johnson P, Delrot s。[J] .中国生物医学工程学报,2014;35(5):559 - 559。gydF4y2Ba
- 27.gydF4y2Ba
艾婷,Naing A, Arun M, Lim S ., Kim C.蔗糖诱导矮牵牛营养组织花青素积累需要花青素调控转录因子。植物科学,2016;25(2):444 - 444。gydF4y2Ba
- 28.gydF4y2Ba
Bihmidine S, Julius B, Dweikat I, Braun D.糖质体糖转运蛋白(SbTSTs)控制甜高粱茎中蔗糖的积累。植物信号学报,2016;11:1117721。gydF4y2Ba
- 29.gydF4y2Ba
Milne R, Byrt C, Patrick J, Grof C.蔗糖转运蛋白表达谱与高粱生物量分配模式的关系?植物科学,2013;4:223。gydF4y2Ba
- 30.gydF4y2Ba
Bihmidine S, Bake R, Hoffner C, Braun D.蔗糖在甜高粱茎中的积累是通过外质韧皮部卸载发生的,与蔗糖转运蛋白的差异表达无关。植物学报,2015;15(3):186。gydF4y2Ba
- 31.gydF4y2Ba
李建军,陈建军,李建军,等。蔗糖转运蛋白对玉米生长发育和产量的影响。植物学报,2017;39(5):391 - 398。gydF4y2Ba
- 32.gydF4y2Ba
董军,陈磊,苏晓东,朱立平,林毅,曲旭,Braun DM, Frommer WB。糖,细胞内和细胞间糖转运的转运体。植物学报,2015;25:53-62。gydF4y2Ba
- 33.gydF4y2Ba
陶莹,张玲,李生,严军,陈玲,徐莹,Perry K, Frommer WB,冯玲。真核细胞同源三聚体中SWEET转运体的结构。大自然。2015;527:259 - 63。gydF4y2Ba
- 34.gydF4y2Ba
Mizuno H, Kasuga S, Kawahigashi H.高粱SWEET基因家族:通过转录组分析揭示的茎蔗糖积累。生物技术与生物燃料。2016;9:127。gydF4y2Ba
- 35.gydF4y2Ba
王晓明,王晓明,王晓明,等。拟南芥代谢产物糖基化和胁迫激素合成的调控。植物生理学报,2016;17(1):444 - 444。gydF4y2Ba
- 36.gydF4y2Ba
Baudry A, Caboche M, Lepiniec L. TT8通过与TTG1和同源MYB和bHLH因子的反馈调控来控制自身的表达,从而使黄酮类化合物在黄酮类化合物中具有强烈的细胞特异性积累gydF4y2Ba拟南芥gydF4y2Ba。植物学报,2006;46(6):768 - 779。gydF4y2Ba
- 37.gydF4y2Ba
李建军,李建军,李建军,等。TTG1复合物myb、MYB5和TT2对种皮分化的影响。开发生物学。2009;325:412-21。gydF4y2Ba
- 38.gydF4y2Ba
李文杰,朱勇,张建平,等。异源四倍体发育转录组图谱gydF4y2Ba落花生hypogaeagydF4y2Ba。植物科学,2016;7:1446。gydF4y2Ba
- 39.gydF4y2Ba
王晓明,王晓明,王晓明,等。光照对拟南芥根系苯丙素代谢的影响。植物科学学报,2004;38(1):765 - 768。gydF4y2Ba
- 40.gydF4y2Ba
Masclaux-Daubresse C, Clement G, Anne P, Routaboul J, Guiboileau A, Soulay F, Shirasu K, Yoshimoto K.利用代谢组学和转录组学研究自噬对拟南芥代谢、发育和植物对环境的影响。植物学报。2014;26(6):1857 - 77。gydF4y2Ba
- 41.gydF4y2Ba
Wei S, Li X, Gruber M, Feyissa B, Amyot L, Hannoufa a . COP9信号体亚基5A影响拟南芥苯丙素代谢、毛状体形成及三蛋白复合体关键基因转录。植物化学学报,2018;18(1):134。gydF4y2Ba
- 42.gydF4y2Ba
潘文杰,李春华,李春华,等。花色素苷对矮牵牛花色素合成、液泡pH和种皮发育的调控机制。植物学报。2002;14:21 - 35。gydF4y2Ba
- 43.gydF4y2Ba
Carey C, Strahle J, Selinger D, Chandler V.相对于功能相似的TRANSPARENT TESTA GLABRA1基因,玉米花青素途径的苍白糊粉粉颜色1调控基因突变具有不同的表型gydF4y2Ba拟南芥gydF4y2Ba。植物细胞。2004;16:45 - 64。gydF4y2Ba
- 44.gydF4y2Ba
李春华,赵敏,李丽娟,等。TTG1/bHLH/Myb转录复合物对拟南芥花青素合成途径的调控。植物学报,2008;53(3):814 - 827。gydF4y2Ba
- 45.gydF4y2Ba
赵M, Morohashi K, Hatlestad G, Grotewold E, Lloyd A. TTG1-bHLH-MYB复合物通过直接靶向调控位点调控毛状细胞的命运和模式。发展。2008;135:1991-9。gydF4y2Ba
- 46.gydF4y2Ba
Lloyd A, Brockman A, Aguirre L, Campbell A, Bean A, Cantero A, Gonzalez A. MYB- bhlh - wd重复(MBW)色素调控模型的研究进展:添加WRKY因子和花青素MYB对β蛋白调控的共选择。植物生理学报,2017;38(5):531 - 541。gydF4y2Ba
- 47.gydF4y2Ba
类黄酮生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物生理学报。2001;26(1):485 - 93。gydF4y2Ba
- 48.gydF4y2Ba
肖杰,Capanoglu E, Jassbi A, Miron A.黄酮类化合物c -糖苷的研究进展。食品科学学报,2016;56(增刊1):S29-45。gydF4y2Ba
- 49.gydF4y2Ba
茉莉酸盐:生物合成、感知、信号转导及其在植物逆境响应、生长发育中的作用。植物学年鉴2007年综述的更新。中国生物医学工程学报。2013;31(1):391 - 391。gydF4y2Ba
- 50.gydF4y2Ba
王松,陈超,王超,陈平。草莓果实中白藜芦醇含量受采前条件的影响。中国农业科学学报,2009;5(1):391 - 391。gydF4y2Ba
- 51.gydF4y2Ba
王凯,金鹏,曹生,尚华,杨忠,郑勇。茉莉酸甲酯抑制杨梅腐烂和增强抗氧化能力。中国农业科学学报,2009;37(1):591 - 591。gydF4y2Ba
- 52.gydF4y2Ba
Flores G, Blanch G, Del Castillo M.采后茉莉酸甲酯处理对贮藏期橄榄果实脂肪酸组成和酚酸含量的影响。食品农业学报,2017;97:2767-72。gydF4y2Ba
- 53.gydF4y2Ba
王晓华,王晓华。茉莉酸盐的生物合成、代谢和信号转导研究。[J] .中国生物医学工程学报,2017;38(2):391 - 391。gydF4y2Ba
- 54.gydF4y2Ba
Dombrecht B, Xue G, Sprague S, Kirkegaard J, Ross J, Reid J, Fitt GP, Sewelam N, Schenk PM, Manners JM, Kazan K. MYC2差异调节茉莉素依赖的多种功能gydF4y2Ba拟南芥gydF4y2Ba。植物学报。2007;19:2225-45。gydF4y2Ba
- 55.gydF4y2Ba
Fernandez-Calvo P, Chini A, Fernandez-Barbero G, Chico J, Gimenez-Ibanez S, Geerinck J, Eeckhout D, Schweizer F, Godoy M, Franco-Zorrilla JM, Pauwels L, Witters E, Puga MI, Paz-Ares J, Goossens A, Reymond P, De Jaeger G, Solano R.拟南芥bHLH转录因子MYC3和MYC4是JAZ抑制因子的靶点,并与MYC2共同作用于jasmonate应答。植物学报,2011;23:701-15。gydF4y2Ba
- 56.gydF4y2Ba
王晓明,王晓明,王晓明,等。植物叶片中茉莉素对植物生长的影响gydF4y2BaORCA3gydF4y2Ba花楸花的启动子活性于gydF4y2Ba拟南芥gydF4y2Ba由转录因子AtMYC2控制。植物物理学报。2011;52:578-87。gydF4y2Ba
- 57.gydF4y2Ba
洪刚,薛鑫,毛燕,王玲,陈晓。拟南芥MYC2与DELLA蛋白相互作用调控倍半萜合成酶基因表达。植物学报。2012;24(2):335 - 348。gydF4y2Ba
- 58.gydF4y2Ba
翟强,闫磊,谭东,陈锐,孙军,高亮,董明明,王勇,李晨。转录因子MYC2磷酸化偶联蛋白水解在茉莉素信号植物免疫中的重要作用。科学通报,2013;9:e1003422。gydF4y2Ba
- 59.gydF4y2Ba
宋松,齐涛,Wasternack C,谢东。茉莉酸信号转导与乙烯的串扰。植物生理学报,2014;21(1):1 - 9。gydF4y2Ba
- 60.gydF4y2Ba
Asami T, Nakano T, Fujioka S.植物油菜素内酯激素。营养学报。2005;72:479-504。gydF4y2Ba
- 61.gydF4y2Ba
Noguchi T, Fujioka S, Choe S, Takatsuto S, Yoshida S, Yuan H, Feldmann KA, Tax FE。拟南芥油菜素类固醇不敏感矮突变体积累油菜素类固醇。植物生理学报,1999;31(3):743 - 752。gydF4y2Ba
- 62.gydF4y2Ba
Choe S, Schmitz RJ, Fujioka S, Takatsuto S, Lee MO, Yoshida S, Feldmann KA, Tax FE。拟南芥芥油菜素类固醇不敏感的侏儒12突变体在糖原合成酶激酶3 β样激酶中是半显性和缺陷的。植物生理学报,2002;13(3):1506 - 1515。gydF4y2Ba
- 63.gydF4y2Ba
Mora-García S, Vert G, Yin Y, Caño-Delgado A, Cheong H, Chory J.含有Kelch-repeat结构域的核蛋白磷酸酶调控拟南芥对油菜素内酯的响应。基因学报,2004;18(4):448-60。gydF4y2Ba
- 64.gydF4y2Ba
孙勇,范学勇,曹德明,唐伟,何坤,朱建勇,何建新,白美梅,朱思,吴娥,Patil S,金涛,季海,黄文辉,李世石,王志强。拟南芥油菜素内酯信号转导与转录网络在植物生长调控中的整合。开发单元,2010;19(5):765-77。gydF4y2Ba
- 65.gydF4y2Ba
Figueiredo D, Batista R, Roszak P, Hennig L, Kohler C.胚乳生长素生产对拟南芥种皮发育的影响。Elife。2016;5:e20542。gydF4y2Ba
- 66.gydF4y2Ba
张陆瞿C,傅F, K, K,王R,徐X,王M,陆J, Wan H,张林T,李J .微分积累的酚类化合物和相关基因的表达在黑色和yellow-seededgydF4y2Ba芸苔属植物显著gydF4y2Ba。实验学报,2013;64(10):2885-98。gydF4y2Ba
- 67.gydF4y2Ba
董涛,韩锐,于杰,朱敏,张勇,龚勇,李铮。绿、紫芦笋花青素积累及相关基因的代谢组和转录组分析(gydF4y2Ba芦笋officinalisgydF4y2Bal .)。食品化学,2019;271:18-28。gydF4y2Ba
- 68.gydF4y2Ba
杨建军,李建军,李建军,等。大豆种子β -氧化过程中脂肪酸含量的变化gydF4y2Ba拟南芥gydF4y2Ba缺乏二酰基甘油酰基转移酶活性或合成中链长度脂肪酸。植物生理学报。1999;21(1):1 - 6。gydF4y2Ba
- 69.gydF4y2Ba
Bertioli DJ,大炮某人,黄Froenicke L G,农民广告,大炮EK,刘X,高D, Clevenger J,破折号,任L, Moretzsohn MC, Shirasawa K,黄W, Vidigal B, B,阿伯纳西楚Y, Niederhuth CE、Umale P, Araujo AC, Kozik, Kim KD Burow医学博士Varshney RK,王X, X,巴克利N,吉马良斯点,Isobe年代,郭B,廖B,跟踪狂HT、施密茨RJ, Scheffler, Leal-Bertioli SC,荀X,杰克逊SA)有限公司R, Ozias-Akins P基因组序列gydF4y2Ba落花生duranensisgydF4y2Ba和gydF4y2Ba落花生ipaensisgydF4y2Ba栽培花生的二倍体祖先。生物医学工程学报,2016;48:438-46。gydF4y2Ba
- 70.gydF4y2Ba
张建军,张建军,张建军,等。Nat Methods. 2012; 9:357-9。gydF4y2Ba
- 71.gydF4y2Ba
李波,杜威C. RSEM:从有或没有参考基因组的RNA-Seq数据中准确定量转录物。生物医学通报,2011;12:323。gydF4y2Ba
- 72.gydF4y2Ba
王志强,王志强。一种加权相关网络分析方法。生物医学通报,2008;9:559。gydF4y2Ba
- 73.gydF4y2Ba
张建军,张建军。基于快速R函数的聚类分析。[J] .计算机工程学报,2012;46(1):1 - 17。gydF4y2Ba
致谢gydF4y2Ba
我们感谢张俊成博士(中国华中农业大学)对本文英文的严格修改,以及建波博士(华大基因)对RNA-seq分析的协助。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金(No. 31971820和31301256)、中国农业科学院创新计划、中央公益性科研机构基础研究基金和中国农业科研系统(No. 31971820和31301256)资助。国家重点研究发展计划项目(2018YFD1000900),江西省农业研究系统项目(2018YFD1000900);JCARS-18)。资助者不参与研究的设计、结果的分析和稿件的撰写,但为稿件提供资金支持。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
LYW与YL1和YL2、LYY、XW、MKP合作开展实验室工作。JHF和RKV进行了数据分析和解释。LYW准备了数据和表格。LYW和BSL起草了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者无利益冲突需要申报。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1。gydF4y2Ba
花生睾丸中黄酮类化合物的检测。gydF4y2Ba
附加文件2。gydF4y2Ba
之间的睾丸脂质代谢组数据gydF4y2BawscgydF4y2Ba和WT。gydF4y2Ba
附加文件3。gydF4y2Ba
胚胎代谢组数据之间gydF4y2BawscgydF4y2Ba和WT。gydF4y2Ba
附加文件4。gydF4y2Ba
子叶代谢与脂肪酸含量gydF4y2BawscgydF4y2Ba(A)丰富的子叶代谢KEGG通路gydF4y2BawscgydF4y2Ba(B)脂肪酸含量gydF4y2BawscgydF4y2Ba和WT。gydF4y2Ba
附加文件5。gydF4y2Ba
鉴定出的deggydF4y2BawscgydF4y2Ba及WT. (xls8402 kb)gydF4y2Ba
附加文件6。gydF4y2Ba
基因本体富集的DEGs之间gydF4y2BawscgydF4y2Ba和WT。gydF4y2Ba
附加文件7。gydF4y2Ba
DEGs KEGG之间的路径gydF4y2BawscgydF4y2Ba和WT。gydF4y2Ba
附加文件8。gydF4y2Ba
用于qRT-PCR分析的基因特异性引物。gydF4y2Ba
附加文件9。gydF4y2Ba
qRT-PCR验证之间的deggydF4y2BawscgydF4y2Ba(A)平均FPKM值≥2.5的17个基因的转录本水平。y轴为qRT-PCR和RNA-Seq分析的相对基因表达水平。WT qRT-PCR(玫瑰柱)和gydF4y2BawscgydF4y2BaqRT-PCR(白色列)对应qRT-PCR表达数据。WT RNA-Seq(玫瑰线)和gydF4y2BawscgydF4y2BaRNA-Seq(灰线)为RNA-Seq数据。这里给出的数据是三次重复的平均值。误差条表示标准误差(SE) (gydF4y2BangydF4y2Ba= 3)。(B) qRT-PCR和RNA-Seq数据的基因表达比比较。表达比的RNA-Seq log2值(y轴)对应三个不同的发育阶段(x轴)。利用热图中FPKM的Z-score(三个生物重复的平均值)对基因表达进行缩放。gydF4y2Ba
附加文件10。gydF4y2Ba
糖酵解与柠檬酸循环的比较gydF4y2BawscgydF4y2Ba(A)两组糖酵解的比较gydF4y2BawscgydF4y2Ba和WT;(1)己糖激酶;(2)葡萄糖磷酸酯异构酶;(3)磷酸果糖激酶;(4)醛缩酶;(5)三糖磷酸果糖激酶;(6)甘油醛磷酸脱氢酶;(7)磷酸甘油酸激酶;(8) phosphoglyceromutase;(9)烯醇酶; (10) pyruvate kinase; (11) non-enzymatic reaction; (12) lactate dehydrogenase; (13) pyruvate decarboxylase; (14) alcohol dehydrogenase. (B) Comparison of the citrate cycle betweenwscgydF4y2Ba和WT;(预)丙酮酸脱氢酶复合物;(1)柠檬酸合酶;(2)顺乌头酸酶;(3)顺乌头酸酶;(4)异柠檬酸脱氢酶;(5) α-酮戊二酸脱氢酶;(6)琥珀酰辅酶a合成酶;(7)琥珀酸脱氢酶;(8) funarase; (9) malate dehydrogenase. Gene expression was scaled using Z-scores of FPKM for mean valued of three biological replicates in heatmaps.
附加文件11。gydF4y2Ba
糖酵解和TCA循环中deg的FPKM值。(A)己糖激酶基因的表达。(B)丙酮酸激酶基因的表达。(C)磷酸果糖激酶基因的表达。(D)丙酮酸脱氢酶组成基因的表达。(E)乌头酸水合酶基因的表达。(F)柠檬酸合酶基因表达。(G)异柠檬酸脱氢酶基因表达。(H)琥珀酸脱氢酶基因表达。(1)苹果酸脱氢酶基因的表达。gydF4y2Ba
附加文件gydF4y2Ba
蔗糖合成与转运基因的表达谱gydF4y2BawscgydF4y2BaWT. SS为蔗糖合酶;SUT,蔗糖转运蛋白;STP;糖转运蛋白;ERD,对脱水转运体的早期反应;甜,糖最终将出口运输。gydF4y2Ba
附加文件13。gydF4y2Ba
植物激素合成途径基因的表达gydF4y2BawscgydF4y2Ba(A)不同表达的BR合成途径基因的热图和FPKM值gydF4y2BawscgydF4y2Ba(B)不同表达的赤霉素合成途径基因的热图和FPKM值gydF4y2BawscgydF4y2Ba(C)不同表达JA合成途径基因的热图和FPKM值gydF4y2BawscgydF4y2BaWT. BR6OX1,油菜素类固醇-6-氧化酶1;Bas1, phyb-4激活标记抑制因子1;KAO,戊二烯酸羟化酶;gaox,赤霉素2-氧化酶;GA3ox,赤霉素3- β -双加氧酶;PLA1,磷脂酶A1;AOC,烯氧化物环化酶;12-氧植物二烯酸还原酶;MFP2:多功能蛋白2。利用热图中FPKM的Z-score(三个生物重复的平均值)对基因表达进行缩放。gydF4y2Ba
附加文件14。gydF4y2Ba
植物多激素信号通路基因的表达gydF4y2BawscgydF4y2Ba(A)不同ABA信号通路基因的热图和FPKM值gydF4y2BawscgydF4y2Ba(B)不同表达的生长素合成途径基因的热图和FPKM值gydF4y2BawscgydF4y2Ba(C)不同表达BR信号通路基因的热图和FPKM值gydF4y2BawscgydF4y2Ba(D)不同表达CTK信号通路基因的热图和FPKM值gydF4y2BawscgydF4y2Ba(E)不同表达的GA信号通路基因的热图和FPKM值gydF4y2BawscgydF4y2Ba(F)不同表达JA信号通路基因的热图和FPKM值gydF4y2BawscgydF4y2Ba(G)不同表达SA信号通路基因的热图和FPKM值gydF4y2BawscgydF4y2Ba利用热图中FPKM的Z-score(三个生物重复的平均值)对基因表达进行缩放。gydF4y2Ba
附加文件15。gydF4y2Ba
MYB、bHLH、WD40因子的差异表达gydF4y2BawscgydF4y2Ba(A) MYB转录因子差异表达的热图和表达水平gydF4y2BawscgydF4y2Ba(B) bHLH因子差异表达的热图及表达水平gydF4y2BawscgydF4y2Ba(C)两组间WD40因子差异表达的热图及表达水平gydF4y2BawscgydF4y2Ba利用热图中FPKM的Z-score(三个生物重复的平均值)对基因表达进行缩放。gydF4y2Ba
附加文件16。gydF4y2Ba
本研究评估的三个发育阶段常见deg的表达和注释。gydF4y2Ba
附加文件17。gydF4y2Ba
越来越多的观察gydF4y2BawscgydF4y2Ba和WT。gydF4y2Ba
附加文件18。gydF4y2Ba
本研究评估了三个发育阶段种子指定基因和普通基因之间的拼接基因的表达和注释。gydF4y2Ba
附加文件19。gydF4y2Ba
序列比对gydF4y2BaAraip。MHR6KgydF4y2Ba之间的gydF4y2BawscgydF4y2Ba和WT。gydF4y2Ba
附加文件20。gydF4y2Ba
WSC损失影响多种初级和次级代谢途径。WSC突变导致碳代谢途径、激素合成和信号通路转录和代谢水平的协调增加,而黄酮类代谢途径被重定向。红色和绿色分别表示上调和下调的基因和代谢物。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
万丽丽,雷艳,闫丽丽。gydF4y2Baet al。gydF4y2Ba转录组和代谢组揭示了白花生突变体黄酮类化合物的重定向。gydF4y2BaBMC Plant BiolgydF4y2Ba20.gydF4y2Ba161(2020)。https://doi.org/10.1186/s12870-020-02383-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02383-7gydF4y2Ba
关键字gydF4y2Ba
- 花生(gydF4y2Ba落花生hypogaeagydF4y2Bal .)gydF4y2Ba
- 种皮gydF4y2Ba
- 激素gydF4y2Ba
- 类黄酮gydF4y2Ba
- 转录调控gydF4y2Ba
- 代谢物gydF4y2Ba