摘要
背景
植物病毒给农业生产造成严重的经济损失。从内生真菌中提取了一种极具活性的植物免疫诱导剂(ZhiNengCong, ZNC),该诱导剂能促进植物生长,增强植物对细菌的抗性。然而,其抗病毒功能尚未得到研究。本研究旨在探讨ZNC在烟草中的抗病毒分子机制。
结果
在这里,我们使用过土豆X病毒(PVX)-键入烟草和奈格以转基因烟草为材料,研究ZNC对病毒的抗性。ZNC具有较高的抗病毒活性,最佳使用浓度为100-150 ng/mL。ZNC通过上调苯丙氨酸解氨酶(PAL)基因的表达,诱导活性氧积累,提高水杨酸(SA)含量,激活SA信号通路。我们利用RNA测序技术从znc处理的幼苗中生成了转录组谱。生物过程中的第一个GO阶段是转录后基因沉默的正调控,后续结果表明ZNC促进了RNA沉默。ZNC喷施后,野生型叶片侵染面积减少,但对PVX无保护作用奈格叶子。
结论
所有结果表明,ZnC是一种超高活性免疫诱导剂,通过通过SA途径阳性调节RNA沉默,可以以低浓度提高对PVX的烟草抗性。在本研究中首先揭示了ZnC的抗病毒机制,本研究提供了一种新的抗病毒生物制剂。
背景
病毒是生物养殖寄生虫和植物的重要病原体,导致一系列严重的植物疾病和巨大的产量损失。迄今为止,化学试剂广泛用于预防或控制农业植物疾病[1].然而,农药的广泛使用造成了有害的农药残留和环境污染,使作物品质下降,威胁人类健康。因此,由于世界人口不断增长,迫切需要创新和突破性的战略来控制植物病毒病原体和提高粮食产量[2那3.].
利用内生菌进行生物防治是防治植物病害同时消除污染的一种很有前景的措施[4.那5.].在大多数情况下,Endophytes可以产生生物活性次级代谢物,以抑制病原体,例如细菌,真菌和昆虫,或改善对病原体的抗性[3.那6.那7.]. 由于内生真菌的作用机制尚不清楚,生长条件特殊,限制了其在生物防治中的应用[8.].内生真菌提取物智能聪(ZNC)生防剂在我国已得到广泛应用;是一种新型、高效、环保的提取物。ZNC是一种诱导子,不仅能保护作物免受假单胞菌皂苷PV。番茄(太平洋标准时间) DC3000还能促进作物生长[9.].在本研究中,我们发现ZNC在很低的浓度下具有对病毒的抗性,并对其抗病毒机制进行了研究。
RNA沉默是一种保守的监测机制,在防御侵袭性核酸中发挥关键作用[10那11那12那13],如病毒,通过互补mRNA转录本的序列特异性降解(转录后基因沉默,PTGS) [14那15].双链RNA,其是由植物感染RNA病毒的病毒RNA依赖性RNA聚合酶(RDRPS)产生的复制中间体,触发RNA沉默[16].然后将该中间体通过称为Dicer样蛋白(DCl)的RNASEIII的酶切割成短21-24-核苷酸小干扰RNA(siRNA)[17那18那19那20.].双链sirna被合并到rna诱导沉默复合体(RISC)中,该复合体包含一个argonaute (AGO)蛋白,该蛋白具有一个小的rna结合域和一个用于切割目标rna的内切酶活性,然后遵循目标rna的序列特异性切割[21].
水杨酸(SA)是一种重要的植物激素,介导宿主对微生物病原体的反应。这种植物激素诱导植物对病原体的重要防御反应[22那23那24那25那26].此前的研究表明,rna沉默途径与SA调控的信号转导途径可能存在重叠[27那28那29那30.];例如,SA处理后烟草植株中的NtRDRP活性增加了[29].
在这项研究中,土豆X病毒以PVX和烟草为材料,研究了植物免疫诱导剂ZNC的抗病毒作用。我们发现ZNC诱导了植物的严重防御反应,包括H2O.2积累、SA积累和RNA沉默。SA的生物合成和信号转导途径是znc介导的防御反应所必需的。本研究首次揭示了ZNC的抗病毒机制。该研究结果将为植物免疫诱导剂ZNC作物生物防治提供新的抗病毒生物制剂,并有助于今后植物免疫诱导剂ZNC作物生物防治的应用。
结果
ZNC保护植物免受病毒侵染
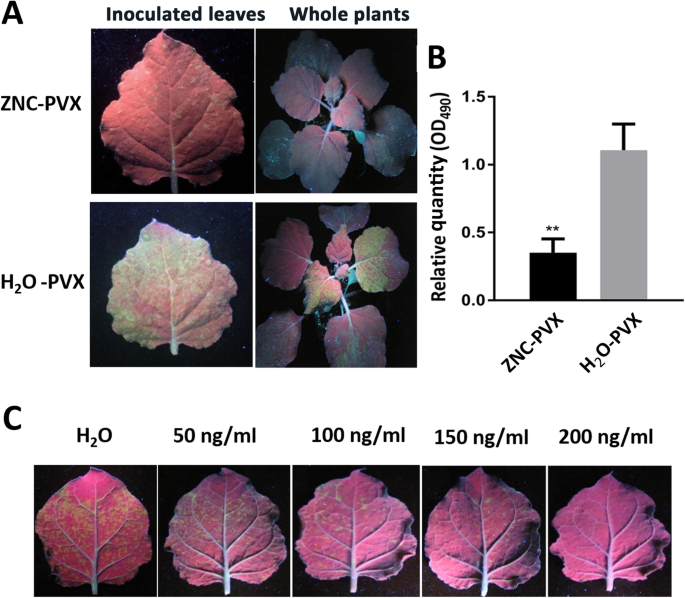
为了检测ZNC对植物的抗病毒活性,我们进行了侵染试验n benthamiana和具有GFP-YFP标签的PVX(图S1).H.2O-PVX叶片(水处理后接种PVX植株)荧光强度高(图2)。1a)和较大的PVX量(图。1b)。病毒疾病的典型症状发生5天后接种后(DPI)。相反,用100ng / ml ZnC处理的植物的症状显示出显着降低的疾病严重程度,并且来自ZnC -PVX组的PVX的相对量仅为31.77%,与H.2O-PVX组(图。1A和B)。为了进一步证实ZnC引起的抗性抗病毒的功能,在喷涂ZnC和H之前用PVX接种叶片2O。结果表明,ZNC对病毒感染有一定的预防作用(图S)2),ZNC处理叶中PVX的相对量低于H中的pVX2o组(74.42%)。然而,与ZNC处理相比(31.77%)相比,差异是微不足道的(图。1).这些结果表明,ZNC通过增强对病毒的植物抗性而是治愈植物来防止病毒。此外,ZNC还改善了植物抵抗力烟草马赛克病毒但对TMV的抗性较PVX低(图S3.).
采用梯度浓度的ZNC水溶液在0、50、100、150和200 ng/mL下测定ZNC的最佳浓度。结果表明,随着ZNC浓度的增加,其抗病毒作用逐渐增强。当ZNC浓度为200 ng/mL时,植株出现萎蔫现象。因此,我们在接下来的实验中使用了150 ng/mL的ZNC。
ZnC促进过氧化氢积累
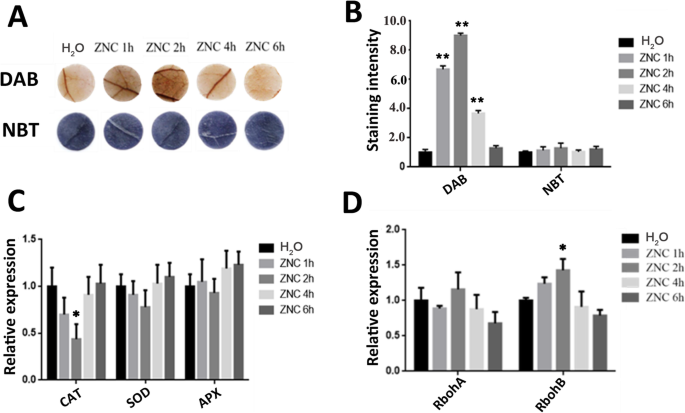
非生物应激通常会增强细胞ROS的产生并引起氧化损伤。为了研究ZNC是否调节ROS积累,采用DAB(3,3-二氨基联苯胺)和NBT染色评价其水平,即H2O.2和o.2-结果表明:水喷组和150 ng/mL氯化锌喷组离体叶片均有显著性差异(p < 0.05)。数字2a和b,表明DAB染色随着时间的延长先增强后减弱。在喷淋ZNC 2 h后DAB染色最深,说明h2O.2升高了。
ZNC促进过氧化氢的积累。ZNC促进了过氧化氢的积累n benthamiana.在处理后处理(0,1,2,4,6)小时(HPT)(HPT)(HPT)的不同(0,1,2,4,6)小时(HPT)处理过氧化氢(上升)和超氧化物积累(下降),用150ng / ml ZnC处理的叶片(0,1,2,4,6)小时(N= 5)。过氧化氢和超氧化物水平的定量n benthamiana用150ng / ml ZnC处理在0,1,2,4和6 HPT。数据显示为平均值(N = 5) ± SD.猫那草皮, 和APX型以各种时间间隔使用QRT-PCR检测。数据显示为平均值(N = 5) ± SD.qRT-PCR analysis ofrboha.和rbohb.不同时间间隔的表达式。数据显示为平均值(N = 5) ± SD. * indicates significant differences determined using the Student’s t-test (P. < 0.05), ** indicates extremely significant differences determined using the Student’s t-test (P.< 0.01).
几种重要的活性氧清除酶编码基因的mRNA水平,即过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)和活性氧生成相关基因,包括呼吸爆发氧化酶同源基因(rboha.和rbohb.),采用qRT-PCR检测,并对治疗前后进行监测。ZNC处理后猫那草皮, 和APX型在2岁时急剧下降 h后处理(hpt)与对照组植物的比较(图。2C)。相比之下,表达水平rboha.和rbohb.显着增加(图。2d)。这种现象表明过氧化氢的积累通过还原来调节猫表达和增加rbohb.表达式。这些结果表明,锌酸锌可以改善H2O.2而不是清除活性氧。
ZNC促进了SA的合成,激活了SA信号通路
通过使用HPLC,用足够的强度测定SA样品萃取并得到令人满意的结果。使用标准添加方法验证,因为在几乎每个样品中检测到SA的存在(图。3.).SA的相对浓度由Empower软件和标准SA确定。ZNC在不同时间(2,4,6,8小时)诱导的SA的量的变化烟草.Benthamiana检测到叶子,结果表明,SA浓度首先增加,然后随着时间的推移而降低,并在图2中以6小时达到其浓度最大值。3..结果表明,锌酸锌促进了SA的积累,激活了防御反应。
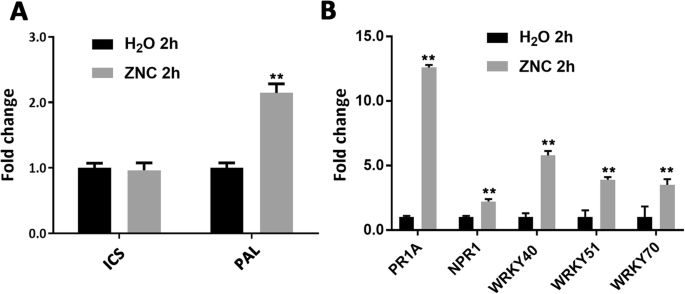
植物主要通过ICS和苯丙氨酸解氨酶(PAL)途径合成SA。因此,我们检测到了ICS和朋友基因使用qRT-PCR。结果表明:朋友基因被ZNC上调,而ICS基因基本保持不变(图。4.一种)。这些结果意味着ZnC通过改进促进SA合成朋友转录水平。
致病相关蛋白在植物防御中起着重要作用。它们通过抑制病毒繁殖提高植物抗病能力,主要参与植物获得性系统抗性。它们也可以通过SA的诱导在植物中高度表达[22那31那32].PR-1A和PR的非投资者(NPR)是SA途径的关键因素,涉及n benthamiana抵抗病毒[33]或其他病原体,如疫霉感染(34].wrky可以结合NPR的启动子区域,在SA信号通路中发挥作用[35那36那37].高表达WRKY40和WRKY70.烟草可以增强对病原体的抵抗力[38];过度表达WRKY70.能增强sa的表达吗PR.基因(39]; SA随时间而增加拟南芥突变体受正调控怀疑基因,包括WRKY51[40].WRKY转录因子基因参与激素信号通路,如SA通路[41].此外,病毒感染后烟草中几种腕基因的表达模式显着增加[42那43].要确认结果,我们检测到相对基因PR-1A(属PR1属)NPR1.那WRKY40那WRKY51, 和WRKY70.,采用qRT-PCR。结果表明,上述基因表达水平上调(图。4.b). ZNC可促进SA合成,激活SA信号通路,增强防御反应。
基因表达的定量差异n benthamianaZNC治疗后
为了进一步揭示ZnC在诱导植物抗性方面的作用,对用ZnC处理的叶片进行非参数转录组测序分析。在150ng / ml ZNC处理2小时后收获叶子。产生了超过4700万张清洁读数(表S2).共2801个基因上调2倍,1983个基因下调(P. < 0.05)英寸n benthamiana150℃处理的植物 与用H处理的相比,ZNC的ng/mL2O在2hpt(图。5.A和B)。大多数ZnC调节基因在2 HPT属于非常广泛的GO类别,例如与生物过程,细胞组分和分子功能有关的那些(图。4.).上调的Go术语(表1)生物过程包括PTGS,防御反应和对SA的响应的正调节(图。5.c) 。在KEGG分类中,植物激素信号转导基因表现出最高的表达变化,95个差异表达基因(DEG)表达上调(图。5.D和图.. s5.).因此,我们推测通过SA途径通过RNA沉默诱导对PVX的抗性。
转录组分析ZNC处理后烟草。Benthamiana.RNA样品从五个或六个叶阶段叶中取出,用0(h2O)或150 ng/mL ZNC处理2小时。每次处理包含三个样品(植物)。一种用于2 HPI的ZnC处理的一组比较热线图。图中的红颜色表明了高表达基因,蓝色表示低表达基因。B.火山图显示褶皱变化和调整P.- 转录组测序数据的归一化读数计数。日志标准2|(折叠变化)| ≥ 1 and padj ≤0.05 were used to identify the DEGs. Green dots indicate the downregulated DEGs (1983 genes), and red dots indicate the upregulated DEGs (2801 genes).C氧化石墨烯富集前10(上调)项生物过程。log的个数10P.H2筛选每学期> 2的O组和ZNC组,对前10项进行-log排序10P.对应于每个术语的值。D.部分Kegg路径分类。横坐标轴是途径中的DEG比率:所有DEG在KEGG级别2路(%),纵坐标是途径的名称。列上方的数字代表了路径中的DEG的数量。
ZNC增强RNA沉默
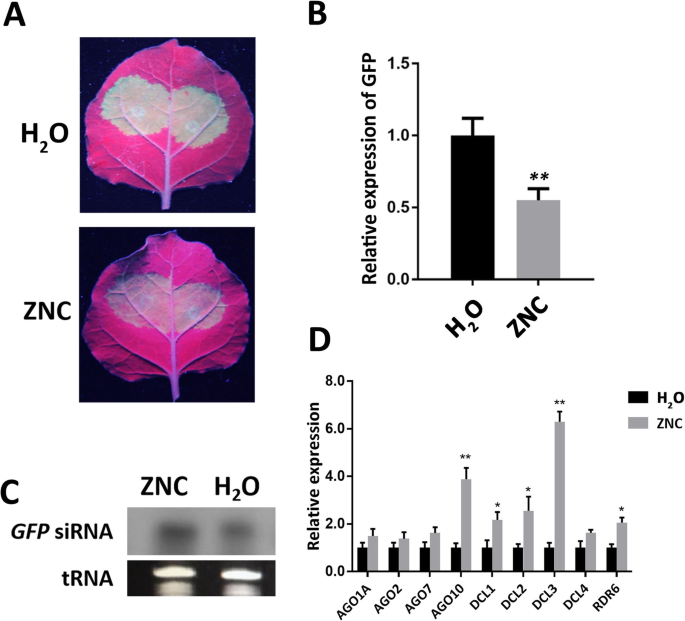
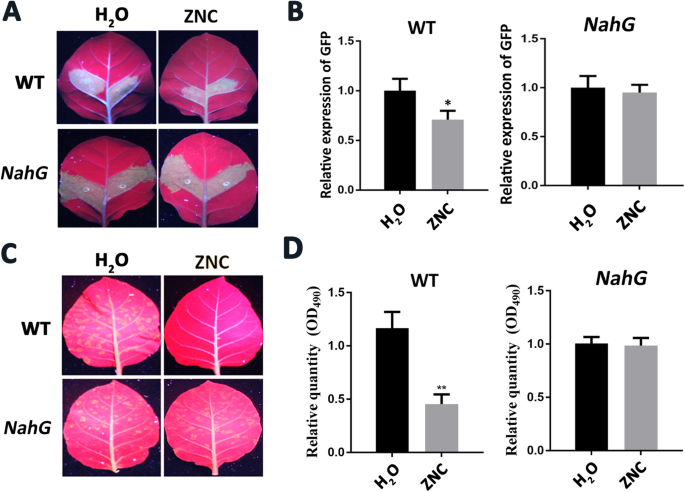
转录组测序结果显示,ZNC对PTGS具有正向调控作用。三十n benthamiana用去离子水和ZNC喷雾,研究ZNC对RNA沉默的影响。2小时后,农杆菌文化(OD600 = 1.0)将含有pBI121-GFP的基因注入叶片,在长波长紫外光照射下观察渗透和新生叶片的GFP荧光强度7小时,确定RNA沉默 天。采集新生叶片,提取总RNA,用qRT-PCR检测GFP的表达水平。如图所示。6.,GFP荧光强度在3dpi下最强,ZnC处理组的GFP荧光强度和表达水平明显低于3dpi的对照组(图。6.A和B)。此外,提取siRNA,进行Northern印迹。这GFP.ZNC处理组的siRNA积累量高于对照组(图2)。6.C)。上述结果表明ZnC促进RNA沉默。
ZNC增强了RNA沉默。一种n benthamiana叶子被接种农杆菌窝藏PBI121-GFP水(上面板)或150 ng/mL ZNC(下面板)处理2小时后。然后,在3dpi的紫外光下观察叶片。B.通过QRT-PCR检测GFP的相对表达水平。数据显示为平均值(N = 3) ± SD和**表示使用学生t检验确定的极显著差异(P.< 0.01).C北方印迹分析GFP.在3 dpi下从斑块中提取siRNA,剪切的凝胶和印迹图像如图所示。6.c, tRNA作为siRNA的负荷对照。D.ZNC处理2周后,用qRT-PCR检测RNA沉默途径相关基因的相对表达 H数据显示为平均值(N= 3)±sd。*表示使用学生的T-Test确定的显着差异(P. < 0.05), and ** indicates extremely significant differences determined using the Student’s t-test (P.< 0.01).
DCL和AGO是RNA沉默途径中的关键蛋白。DCL负责切割细胞产生的dsRNA,AGO作为RNA诱导沉默复合物(RISC)的催化成分,促进扩增沉默信号。qRT-PCR检测RNA沉默途径相关基因。NbDCL1那NbDCL2那NbDCL3那NbDCL4那NbRDR6那nbago7., 和NbAGO10上调;在这些基因中,NbDCL3和NbAGO10显著上调(图。6.d)。因此,ZNC通过调节RNA沉默的上游途径起着沉默增强的作用。
ZNC通过SA途径促进RNA沉默
此前的研究表明,SA可诱导RNA沉默相关基因和植物对RNA病原体的抗性[28].因此,我们推测ZNC诱导通过SA途径的RNA诱导的病毒抗性。要测试这个猜测,奈格转基因N塔巴库姆简历萨姆松NN.用作植物材料。SA无法累积,因为SA被分解为儿茶素。在瞬态表达实验中,我们可以看到GFP的荧光强度在3 dpi出现区域最强,然后逐渐减少。然而,GFP荧光强度显示ZNC治疗叶片和水处理组之间没有显着变化,以及表达水平GFP.从两个治疗区域符合现象(图。7.A和B)。相反,与用水喷洒的非转变植物相比,用ZnC处理的非转变植物的GFP荧光强度显着降低,GFP.表达水平与荧光强度一致。
ZnC通过通过SA途径增加RNA沉默诱导植物的抗病毒活性。一种宽型照片N塔巴库姆简历萨姆松NN.(面板)奈格转基因N塔巴库姆简历萨姆松NN.(下面的面板)渗透农杆菌窝藏PBI121-GFP在水(左面板)或ZNC(右面板)处理后,在3 dpi的紫外线灯下。B.来自野生型植物的GFP的相对表达水平奈格通过QRT-PCR检测转基因植物。数据显示为平均值(N= 3)±sd。*表示使用学生的T-Test确定的显着差异(P.< 0.05).CZNC对野生型PVX-GFP积累的影响N塔巴库姆简历萨姆松NN.(面板)奈格转基因N塔巴库姆简历萨姆松NN.(面板)。照片在3 dpi的紫外灯下拍摄。将植物用水(左面板)或ZnC(右图)处理。D.来自野生型植物的PVX的相对表达相对量奈格通过QRT-PCR检测转基因植物。数据显示为平均值(N= 3)±sd。* *表示使用学生t检验确定的显著差异(N< 0.01).
进一步确认结果,奈格转基因N塔巴库姆简历萨姆松NN.和野生型N塔巴库姆简历萨姆松NN.植株与汁液摩擦叶片接种PVX。7.d)野生型烟草在15 dpi时,水处理组比锌nc处理组出现更多,出现面积更大。为奈格转基因N塔巴库姆简历萨姆松NN.,PVX累积和新兴区域没有显着差异(图。7.C)。结果表明,ZNC不能诱导抗病毒能力奈格转基因N塔巴库姆简历萨姆松NN.和SA-deficient植物。以上结果表明,ZNC通过SA途径促进RNA沉默,进而诱导病毒抗性。
讨论
大多数植物都有内生菌(主要是细菌和真菌),在大多数情况下,内生菌可以促进生长和植物健康。在与植物的长期共同进化过程中,内生细菌和真菌产生了许多因子,帮助植物抵御逆境并促进其生长。例如,内生微生物通常具有以下功能:它们可以提高植物的抗逆能力,增强植物的抗病能力,抑制病原体的毒力,抑制竞争植物物种的发育,并将土壤中的养分带入植物。由于内生微生物的有效功能,内生微生物可显著减少农作物栽培中农药(化肥、杀菌剂、杀虫剂和除草剂)的使用[44那45那46].然而,在农业中使用的生物防治剂的数量非常少。ZNC是一种商业化的产品,它是一种天然植物的粗提物P.Variotii从植物的根中分离出来的菌株[9.].ZNC广泛用于作物,蔬菜和果树,最近评估了植物生长促进和细菌疾病保护的分子机制。为了进一步了解ZnC的抗病毒机制,我们研究了烟草中的ZnC介导的病毒抗性。在我们的研究中,我们发现ZNC不能治愈病毒感染的植物,但它具有预防功能,增强了植物中对病毒的抵抗力(图。1和s3)。ZNC可以促进h2O.2(图。2)、SA积累(图。3.)和激活RNA沉默(图。6.a和b).这些数据证实了ZNC在植物中作为主动防御反应的诱导子。本研究首次揭示了ZNC的抗病毒机制。
已经确定了许多能够诱导植物防御反应并保护它们免受病原体感染的诱变剂[47];它们包括鞭毛[48],伸长因子[49,依托丁[50那51]和其他寡糖(例如,寡糖酸酐酸,OGS)[52].它们是病原体相关分子模式(PAMPs),并与植物受体相互作用,激活pamp触发的免疫[53那54那55].然而,上述激发子的有效浓度在μg/mL和mg/mL数量级之间,远远高于ZNC (ng/mL)的工作浓度,如Flg22 (1 μM,约2.232 μg/mL)和OGs (50 μg/mL) [48].此外,几种植物激素的工作浓度高于ZNC;例如,SA的抗病毒浓度为10μm,约为1.38μg/ ml [26].ZNC是来自的发酵提取物p . variotii,主要含有核苷,糖,蛋白质和其他化合物(数据未显示)。我们不知道哪个分子是一种有效的引诱者,诱导植物抗病毒的抗性,因为我们不能获得单一化合物。因此,需要进一步的研究来分离,提取和鉴定有效化合物。
非生物胁迫通常会增加植物细胞活性氧(ROS)的产生[56].以前的研究表明,SA和过氧化氢水平密切相关,它们在许多生物过程中相互诱导彼此的积累[57那58那59].病毒侵袭引起植物过敏反应,产生丰富的过氧化氢,将细胞加速到编程的细胞死亡中,抑制病毒的繁殖和传播,增强植物病毒的抗性。因此,我们认为过氧化氢在调节许多生物学过程中的信号分子中起作用的重要作用,例如对植物中非生物刺激的反应[60那61].植物具有清除活性氧的活性,以防止植物受到活性氧的毒害。SOD和Rbohs主要负责产生过氧化氢,过氧化氢能将有害的超氧自由基转化为过氧化氢,然后清除ROS的酶APX和/或CAT水解过氧化氢。在本研究中,我们发现经ZNC处理后DAB染色有显著性差异,而NBT染色无显著性差异。NbCAT与过氧化氢清除过程相关的基因显著下调,而rbohb.基因调节。ZNC可能通过促进SA的积累而促进过氧化氢的积累;这一发现需要进一步研究。
病原菌感染诱导的SA生物合成主要依赖于ICS1基因并部分取决于朋友基因。ICS1蛋白具有等氯化合酶活性,而PAL是苯丙氨酸氨裂解酶[62那63那64].有趣的是,在我们的研究中,SA生物合成主要取决于朋友基因(图。4.一种)。原因尚不清楚,需要进一步研究。
植物激素SA在抗病性调节中起着重要作用。系统获得性抗性(SAR)依赖于植物中的SA信号,如化学苯并噻二唑通过增加内源SA水平诱导SAR [65那66].以往的研究表明,外源性SA也会增加PR基因表达[67].因此,SAR需要信号分子SA,并且与PR蛋白的积累相关,这应该有助于抵抗[22].在我们的研究中,喷射ZnC后植物中的SA含量增加,以及相关标记基因PR1A那NPR1.那WRKY40那WRKY51和WRKY 70在SA途径通过QRT-PCR上调(图。4.b).这些结果证实了在znc介导的防御反应中需要依赖于PAL的SA生物合成。
转录组测序显示,许多不同的基因表达上调;这些基因参与了PTGS的正调控、SA分解代谢过程、SA应答、防御反应等多个方面(图)。5.,无花果。4.,S.5.).上述生物过程与植物防御和抗性诱导密切相关。以前的研究表明,SA诱导RNA-沉默相关的基因[27那28].此外,rna沉默途径调节对某些胁迫的反应,并可由SA部分调节[68], sa相关转录因子与多种AGO和DCL共表达[69].在我们的研究中,我们发现NbdCl1,NbdCl2,NbdCl3,NBRDR6,NBAGO7和NBAGO10在RNA沉默途径的标记基因中进行了SA积累(图。6.).结果表明,SA通过SA抑制RNA沉默相关基因的预测抑制PVX积累。
以往的研究表明,SA诱导RNA沉默相关基因和植物对病毒的抗性[28]和SA缺陷N.Benthamiana衰减病毒诱导的基因沉默,但不会影响转基因诱导的PTGS [70].我们的研究表明,ZNC可以促进SA的积累(图。4.),转录组测序结果显示,ZNC上调了RNA沉默相关基因的表达(图。5.).沉默效率分析表明,用ZnC处理的野生型植物的荧光强度明显弱于水基。但是,荧光强度没有显着差异奈格观察到转基因植物(图。7.A和B)。此外,ZnC喷涂的野生型叶片显示出降低的感染区域,而ZnC未能对PVX引起保护作用奈格叶子。这些结果表明,通过SA途径对ZNC进行RNA沉默可以获得病毒抗性。然而,RNA沉默对于sa介导的植物RNA病毒抗性是必不可少的拟南芥蒂利亚纳[71].这些发现表明,水杨酸可能通过多种平行抗性机制提高植物对病毒的抗性,如诱导系统获得性抗性(SAS) [72]或作为烟草中RNA沉默防御的增强剂。SA和RNA沉默的防御机制也可以合作以防止病毒入侵[73那74那75].因此,我们推测ZNC通过SA途径增强RNA沉默从而增强植物对病毒的抗性,这是一种抗病机制。ZNC是否能通过其他SA途径提高对病毒的耐药性尚不清楚。
此外,SA被发现在众多植物中(尼科尼亚塔哈瓦姆那番茄那拟南芥蒂利亚纳那橙色),并且可以诱导RNA沉默相关的基因和植物抗RNA病原体[28那75].之前的报告显示ZNC活化了水杨酸生物合成和信号通路拟南芥蒂利亚纳[9.].在支持信息中,我们发现ZNC也增强了N。Benthamiana抗TMV。因此,我们推测ZNC可以通过不同植物中的SA和RNA沉默途径诱导对各种病毒的抵抗力。ZnC的抗病毒现象是非特异性的。
结论
我们首先表明,超高活性ZnC可以以低浓度诱导病毒抗性,并且初步揭示抗病毒机制。所有结果表明,通过水杨酸SA途径正调节RNA沉默,ZNC介导对病毒的抗性。本研究提供了一种新的抗病毒生物制造,即ZNC。这种生物制造将是植物抗病毒研究和应用的非常有用的生物制造。
方法
材料及生长条件
ZNC由山东鹏博生物科技有限公司提供;它是乙醇的粗提物Paecilomyces Variotii..pCaPVX440-GFP-YFP质粒由山东农业大学李向东教授提供[76](图.. S1).对于RNA沉默分析,将带GFP标签的空向量PBI121转化为根癌土壤杆菌本研究中的GV3101。野生型尼古利亚娜·宾夕法尼亚州和N塔巴库姆简历萨姆松NN.在本研究中进行繁殖和储存。奈格(编码水杨酸羟化酶将SA转化为儿茶酚)转基因N塔巴库姆简历萨姆松NN.(选自西班牙马德里atonoma大学Josefa M. Allimino博士)[74在16-H光/ 8-H黑色光周期下在24℃下在温室中升高。DNA聚合酶和其他基因工程酶购自Takara Inc.(大连,中国)。
所有其他化学品和试剂都是最高质量的。
ZNC的抗病毒研究
野生型的n benthamiana用五个或六个叶阶段接种马铃薯病毒X.(PVX)-GFP-YFP在喷射100ng / ml ZnC之前或之后,以确认ZnC的抗性对PVX感染。用于病毒接种,1g PVX感染N塔巴库姆将叶片接地在1ml 5mM磷酸盐缓冲液中,pH 7.2。通过用新鲜制备的SAP摩擦叶片接种六叶阶段的控制植物。接种植物在24℃下在无昆虫温室中生长,并监测病毒症状。每个实验都被复制三次并包括10个独立植物。
喷洒0,50,100,150和200ng / ml的ZnC的梯度浓度水溶液n benthamiana接种PVX之前2小时进一步确定ZNC抗病毒的最佳工作浓度;所有其他条件与上述相同。通过在长波长(365nm)UV光(Spectroline Model SB-100P / A; Spectronics Corporation,Lexington,Ky,USA)下观察GFP-YFP荧光来确定PVX的感染,并用Fujifilm FinePix S8000FD数码相机拍摄(Fujifilm Holdings Corporation)[77]。通过酶联免疫吸附试验(ELISA)检测病毒含量[78那79]. 使用EnSpire多标签阅读器在490处对平板进行比色读数 纳米波长。对照组为n benthamiana叶片未接种PVX。
活性氧的组织化学染色
这n benthamianaZNC和H的叶子2o用于组织化学染色程序的脱离治疗组。使用3,3'-二氨基苯甲酸(DAB)和硝基唑鎓(NBT)进行染色以检测H的积累2O.2和o.2−.h的积累2O.2在叶子中使用DAB作为指示剂可组织化学进行可视化。将叶子置于1mg / ml的DAB溶液中,真空渗透30分钟,用去离子水洗涤三次,并与H反应2O.2在28°C的光下为12小时。反应后,在叶片中清楚地看到深褐色沉积,用沸腾的乙醇洗涤过量的染料溶液,叶片成像。
对于NBT染色,n benthamiana将叶片置于1%(m / v)叠氮化物溶液中,真空渗透30分钟,转移到0.5mg / ml的NBT溶液中,然后进行另一个真空渗透30分钟。叠氮化钠可以改善细胞渗透性,以允许NBT溶液在整个幼苗中扩散。NBT与O反应2-从而形成了一种深蓝色的不溶性复合物质。用煮沸的乙醇洗去多余的染料溶液,对叶子进行成像。采用ImageJ软件定量分析H2O.2和o.2−强度 [80].
SA提取和内容分析
后n benthamiana用150ng / ml ZnC喷涂,使用前述方法在不同的时间点(0,2,4,6,8小时)中萃取游离SA。简而言之,在研磨0.1g播种样品后,在研磨物中加入1ml 70%的甲醇,然后在4℃下放入过夜。将样品转移到聚丙烯离心管中。通过离心(8000×g,10分钟)获得提取物。然后将上清液置于另一个管中以蒸发(n2, 45°C)。用500μLDDH重构干残留物2O.将总共300μl提取物用40μl0.5mg/ ml三氟乙酸(TFA)重构,混合并摇1分钟。加入1ml乙酸乙酯和环己烷用于除去有机相,然后将水相置于另一个管中以蒸发(n2, 45°C)。用500 μL流动相重建干渣。提取液经0.22 μm过滤后转移至EP管中(0),[81].通过监测306nm的吸光度,使用HPLC分析SA提取溶液(10μL)和SA标准。将所有样品分别在C18反相色谱柱(250mm×4.6mm,5μm)上装载。洗脱甲醇和0.1%乙酸水(该比例为65:35)分离,然后在35℃下在30分钟内洗脱,流速为0.8ml / min。
RNA提取和定量实时PCR
根据制造商的说明,使用Trizol试剂(Takara,Shiga,Japan)从叶中从叶中提取总RNA,并在逆转录后在37℃下用DNase I处理30分钟。使用Fastking GDNA分布RT Supermix套件(天根,北京,中国)从1μg总RNA合成cDNA。使用人才Sybr Green Kit(天根,北京,中国)进行定量实时(QRT-PCR)。每次反应一次进行并重复三次。结果由Bio-Rad CFX Manager软件(Bio-Rad,California,USA)分析。SOD,CAT,APX的相对表达,rboha., 和rbohb.使用QRT-PCR测量。每个测定重复三次。QRT-PCR实验的底漆序列列于表S中1.
RNA测序的数据分析
RNA样品从五个或六个叶阶段叶中取出,用0(h2O)或150 ng/mL ZNC处理2小时。每次处理包含三个样品(植物)。根据质量选择样本(RIN评分≥7)。它们由上海OE生物技术公司进行了汇集和测序。公司简介(上海,中国)之前的文章已经详细描述了如何分析rna测序数据[82那83].所有差异基因表达均以log2比值绝对值≥1和FDR≤0.001为标准。
RNA-silencing分析
野生型的n benthamiana那N塔巴库姆简历萨姆松NN., 和奈格转基因N塔巴库姆简历萨姆松NN.叶子在五叶或六叶阶段渗透,携带GFP基因的农杆菌GV3101。每个农杆菌培养(OD600= 1.0)孵育3h后,与其他培养物按1:1 (v/v)比例混合渗透。在长波长(365 nm)紫外光照射下,通过观察渗透叶片和新生叶片的GFP-YFP荧光来检测局部和系统RNA沉默。qTR-PCR检测沉默通路相关基因,如(AGO)蛋白、DCL蛋白、RDRP。
siRNA的Northern blot分析
如前所述从叶片中提取低分子量RNA [84].用于siRNA检测,15 μg低分子量rna在15%聚丙烯酰胺- 7 M尿素凝胶上分离,转移到Hybond-N上+薄膜在0.5 X TBE在0.8 mA cm−21 h。将膜紫外交联,80℃孵育2 h后,与DIG标记的探针GFP mRNA杂交。根据制造商的说明,使用DIG Northern Starter Kit(罗氏,巴塞尔,瑞士)进行化学发光检测。
数据和材料的可用性
在附加号PRJNA616072下将转录组序列数据沉积在NCBI序列读取存档(SRA)中。在当前研究期间分析的数据集可以从相应的作者获得合理的请求。本研究期间生成或分析的所有数据都包含在本发表的文章[及其补充信息文件]中。
缩写
- 轻拍:
-
3,3-二氨基苯胺
- H2O.2:
-
过氧化氢
- NBT:
-
氮蓝四唑
- NPR:
-
不具有致病性相关的表情
- 朋友:
-
苯丙氨酸氨裂解酶
- 公关:
-
病因相关蛋白质
- PVX:
-
马铃薯病毒X.
- ROS:
-
反应性氧气
- 山:
-
水杨酸
- TMV:
-
烟草马赛克病毒
- ZNC:
-
Zhinengcong
参考
- 1.
Rodriguez-salus m,bektas y,schroeder m,knoth c,vu t,roberts p,kaloshian i,eulgem t。合成素材2-(5-溴-2-羟基 - 苯基) - 噻唑烷-4-羧酸链接植物免疫血液化。植物理性。2016; 170(1):444-58。
- 2.
Gaffar Fy,Koch A.如果你可以抓住我!基于RNA沉默的抗病毒植物免疫力。病毒。2019; 11(7):673。
- 3.
jeon cw,金博士,kwak ys。缬胺霉素,由Streptomyces sp产生。S8是大型抗原性抑制性的关键抗真菌代谢物。世界J Microbiol Biotechnol。2019; 35(8):128。
- 4.
李辉,关勇,董勇,赵丽,荣胜,陈伟,吕明,徐辉,高旭,陈锐,李丽,徐铮。内生真菌的分离与鉴定芽孢杆菌tequilensisGYLH001在生物防治方面具有潜在的应用价值Magnaporthe oryzae.《公共科学图书馆•综合》。2018;13 (10):e203505。
- 5.
Nisa H, Kamili AN, Nawchoo IA, Shafi S, Shameem N, Bandh SA。真菌内生菌作为植物化学物质和其他生物活性天然产物的丰富来源:综述。活细胞Pathog。2015;82:50-9。
- 6.
Ryan RP,Germaine K,Franks A,Ryan DJ,拖出DN。细菌内体:最近的发展和应用。有限元微生物吧。2008; 278(1):1-9。
- 7.
生活在植物内部:细菌内生菌。植物学报。2011;14(4):435-43。
- 8.
Ownley BH,格温KD,维加FE。具有抗植物病原体活性的内生真菌昆虫病原:生态学和进化。生物防治。2010;55(1):113–28.
- 9
陆C,刘H,江D,王L,江Y,唐S,侯X,韩X,刘Z,张M,楚Z,丁X。Paecilomyces Variotii.提取物(ZNC)增强植物免疫力,促进植物生长。植物土壤。2019; 441(1-2):383-97。
- 10.
月亮jy,公园jm。在植物中的病毒防御信号中交叉谈话。前微生物。2016; 7:2068。
- 11.
吴旭,陈雪梅,周旭,程旭。植物与病毒的拔河运动:重大进展与诸多问题。病毒。2019;11(3)。
- 12.
Hannon GJ。RNA干扰。自然。2002; 418(6894):244-51。
- 13.
HEABER C,DINOYER P,Moissard G,Ritzenthaler C,Voinnet O.转运依赖性和依赖性的RNA沉默细胞对细胞运动。禁止J. 2003; 22(17):4523-33。
- 14.
VAUCHERET H,BENIN C,Fagard M.在植物中沉默的转录后基因。J Cell SCI。2001; 114(PT 17):3083-91。
- 15.
VAUCHERET H,Fagard M.植物中转录基因沉默:靶,诱导剂和调节剂。趋势类型。2001; 17(1):29-35。
- 16
Ruiz-Ferrer V,Voinnet O.植物小RNA在生物应力反应中的角色。Annu Rev植物Biol。2009; 60:485-510。
- 17
汉密尔顿AJ,鲍库姆DC。植物转录后基因沉默中的一种反义小RNA。科学。1999, 286(5441): 950 - 2。
- 18
Lichner Z,Silhavy D,Burgyan J.双链RNA结合蛋白可以抑制RNA干扰介导的抗病毒防御。J Gen Virol。2003; 84(PT 4):975-80。
- 19
吕某,石河,陶霉,易x,李立,清委。通过表达siRNA双链体,RNA在植物中沉默。核酸RES。2004; 32(21):E171。
- 20。
Baulcombe D.植物中的RNA沉默。自然。2004; 431(7006):356-63。
- 21。
Vaucheret H, Vazquez F,克里特岛P,巴特尔DP。的作用ARGONAUTE1在miRNA途径中,miRNA途径及其调控对植物发育至关重要。基因发展,2004年;18(10):1187–97.
- 22。
Durrant我们,Dong X.全身获得的阻力。Annu Rev phytopathol。2004; 42:185-209。
- 23.
傅志强,董欣。系统获得性抗性:将局部感染转化为全局防御。植物生物学杂志。2013;64:839-63。
- 24.
高QM,朱S,Kachroo P,Kachroo A.信号稳压器的系统获得性能。前植物SCI。2015; 6:228。
- 25.
Tsuda k,Sato M,Stoddard T,Glazebrok J,Katagiri F.植物强大免疫网络属性。Plos Genet。2009; 5(12):E1000772。
- 26.
王胜,韩凯,彭杰,赵军,姜玲,卢勇,郑华,林林,陈杰,严飞。nbald1.通过调节水杨酸的积累和乙烯途径介导对萝卜花叶病毒的抗性尼古利亚娜·宾夕法尼亚州.植物学报。2019;20(7):990-1004。
- 27.
刘勇,高强,吴斌,艾涛,郭旭。NgRDR1,依赖于RNA依赖性RNA聚合酶尼古利亚娜谷氨酸,参与生物和非生物胁迫。植物理性生物化学。2009; 47(5):359-68。
- 28。
Campos L,Granell P,Tárragas,彼得塞尔·格莱萨P,Conejero v,BellésJM,Rodrigo I,LisónP.水杨酸和恒定酸诱导RNA沉默相关的基因和植物对RNA病原体的抗性。植物理性生物化学。2014; 77:35-43。
- 29。
谢Z,风扇B,Chen C,Chen Z.诱导型RNA依赖性RNA聚合酶在植物抗病毒防御中的重要作用。Proc Natl Acad SCI U S A. 2001; 98(11):6516-21。
- 30.
奎利斯J、佩纳斯G、梅斯格尔J、布鲁吉杜C、圣SB。这个Arabidopsis Atnpr1.反向调节对真菌、细菌或病毒病原体的防御反应,同时赋予转基因水稻对非生物胁迫的超敏反应。植物营养与肥料学报。2008;21(9):1215-31。
- 31。
Breen S,Williams SJ,Outram M,Kobe B,Solomon PS。新兴洞察力相关蛋白质的功能1.趋势植物SCI。2017; 22(10):871-9。
- 32。
Vlot AC Dempsey DA Klessig DF。水杨酸,一种抗疾病的多面激素。植物病理学杂志2009;47:177-206。
- 33。
Villanueva-Alonzo Hj,Us-Camas Ry,Lopez-Ochoa La,Rocertson D,Guerra-Peraza O,Minero-Garcia Y,Moreno-Valenzuela OA。一种新的病毒诱导基因沉默载体大戟属植物花叶病毒-尤卡坦半岛NPR1.沉默尼古利亚娜·宾夕法尼亚州和Capsicum Annuum.var。Anaheim Biotechnol Lett。2013; 35(5):811-23。
- 34。
甘露寡糖诱导水稻和烟草的多重防御反应。植物病理学杂志2019。
- 35.
刘y,刘q,唐y,ding w。NtPR1a调节抗Ralstonia solanacearum.在尼科尼亚塔哈瓦姆通过激活防御相关基因。生物化学学报。2019;508(3):940-5。
- 36.
Backer R,Naidoo S,Van den Berg N.致病性相关基因的非简单压缩机1(NPR1.)及其相关家族:植物抗病机制的研究。植物学报。2019;10:102。
- 37.
Maier F, Zwicker S, Huckelhoven A, Meissner M, Funk J, Pfitzner AJ, Pfitzner UM。致病相关蛋白1 (NPR1)和一些NPR1相关蛋白对水杨酸敏感。植物病理学杂志。2011;12(1):73-91。
- 38.
安M,周T,郭Y,赵X,吴Y。生物抗TMV药物宁南霉素介导的宿主防御反应的分子调控。病毒。2019;11(9).
- 39.
作者:王志刚,王志刚,王志刚。植物免疫的激素调节。Cell Dev Biol. 2012; 28:489-521。
- 40。
张某,李成,王R,陈Y,舒S,黄R,张D,李继,肖S,姚n,杨c。拟南芥线粒体蛋白酶Ftsh4通过调节Wrky依赖性水杨酸叶衰老酸累积和信号传导。植物理性。2017; 173(4):2294-307。
- 41。
Thomma BP, Eggermont K, Tierens KF, Broekaert WF。要求的功能乙烯-不敏感结果表明,拟南芥对拟南芥侵染具有高效的抗性Botrytis cinerea.植物杂志。1999;121(4):1093 - 102。
- 42。
张杰,张定宇,董永强,王德新,魏静,范超,魏凤龙,王芳灿,张庆斌,文静。WRKY转录因子基因在烟草CMV侵染和植物激素处理中的表达模式。植物Prot。2017;3(43):55-9。
- 43。
京晶L,春玲C,徐玉珍,舒伟烟草NtWRKY40在植物响应病毒感染。Biotechnol Bull。2016; 10(32):188-98。
- 44。
关键词:土壤微生物,根内生菌,土壤微生物,生态环境Scientifica(开罗)。2019; 2019:9106395。
- 45。
白色jf,kingsley kl,zhang q,verma r,obi n,dvinskikh s,elmore mt,verma sk,gond sk,kowalski kp。评论:内生微生物及其在作物管理中的潜在应用。害虫管理科学。2019年。
- 46。
陈志强,王志强,王志强,等。植物内生细菌和真菌对芒草生长的促进作用。acta Microbiol Biotechnol. 2018;34(3):48。
- 47。
Boller T,Felix G. eLitorors的文艺复兴:通过模式识别受体对微生物相关分子模式和危险信号的感知。Annu Rev植物Biol。2009; 60:379-406。
- 48.
研究发现,OGs和Flg22激发子激活了防御反应通路,而OGs和Flg22激发子激活了防御反应通路拟南芥幼苗。摩尔。2008;1(3):423 - 45。
- 49.
通过受体EFR限制感知细菌PAMP EF-Tu农杆菌介导的转化。细胞。2006; 125(4):749-60。
- 50.
刘树华,王军,韩震,龚欣,张华,柴静。水稻几丁质受体OsCEBiP对真菌细胞壁识别的分子机制。结构。2016;24(7):1192 - 200。
- 51.
几丁质介导的植物-真菌相互作用:捕捉、隐藏和握手。植物学报2015;26:64-71。
- 52.
Benedetti M,Pontiggia D,Raggi S,Cheng Z,Scaloni F,Ferrari S,Ausubel FM,Cervone F,De Lorenzo G.植物免疫通过工程化的寡核苷酸,损伤相关分子图案引发。PROC NATL ACAD SCI。2015; 112(17):5533-8。
- 53.
Dangl JL,Horvath DM,Staskawicz BJ。将植物免疫系统枢转从解剖到部署。科学。2013; 341(6147):746-51。
- 54。
Dodds Pn,Rthjen JP。植物免疫:朝向植物病原体相互作用的综合图。NAT Rev Genet。2010; 11(8):539-48。
- 55。
Schwessinger B, Ronald PC。植物先天免疫:对保守微生物特征的感知。植物学报2012;63:451-82。
- 56。
活性氧的种类、非生物胁迫和胁迫组合。工厂j . 2017, 90(5): 856 - 67。
- 57。
Leon J,Lawton Ma,Raskin I.过氧化氢在烟草中刺激水杨酸生物合成。植物理性。1995年; 108(4):1673-8。
- 58。
Rao MV,Paliyath G,Ormrod DP,Murr DP,Watkins CB。水杨酸对H的影响2O.2氧化应激和H2O.2代谢酶。水杨酸介导的氧化损伤需要H2O.2.植物理性。1997年; 115(1):137-49。
- 59.
邢峰,李志,孙安,邢东。活性氧促进伏马菌素b1诱导细胞凋亡的叶绿体功能障碍和水杨酸积累。2月。2013;587(14):2164 - 72。
- 60。
Baxter A, Mittler R, Suzuki N. ROS在植物胁迫信号转导中的作用。中国生物医学工程学报。2014;65(5):1229-40。
- 61。
Mittler R. ROS很好。趋势植物SCI。2017; 22(1):11-9。
- 62。
陈智,郑智,黄杰,赖智,范B。植物中水杨酸的生物合成。植物信号行为。2009;4(6):493–6.
- 63。
Wildermuth MC, Dewdney J, Wu G, Ausubel FM。异染色质合酶是合成水杨酸用于植物防御的必需酶。大自然。2001;414(6863):562 - 5。
- 64。
Ribnicky DM,Shulaev VV,Raskin II。烟草中水杨酸生物合成的中间体。植物理性。1998; 118(2):565-72。
- 65。
Gaffney T,Friedrich L,Vernooij B,Negrotto D,Nye G,Uknes S,Ward E,Kessmann H,Ryals J.水杨酸对诱导系统性获得性的要求。科学。1993; 261(5122):754-6。
- 66。
Anand A,Uppalapati SR,Ryu Cm,Allen Sn,Kang L,Tang Y,Mysore Ks。水杨酸和全身获得的抗性在衰减冠心病引起的作用中起作用根癌土壤杆菌.植物理性。2008; 146(2):703-15。
- 67。
陈辉,陈杰,常敏,李敏,刘芳,付志强。新型水杨酸类似物在拟南芥中诱导有效防御反应。中华医学杂志。2019;20(13)。
- 68。
刁p,张q,太阳h,ma w,ca a,yu r,王j,niuy,vuriyanghan h. mir403a和sa都参与其中NBAGO2.介导的抗病毒防御TMV感染尼古利亚娜·宾夕法尼亚州.基因(巴塞尔)。2019; 10(7)。
- 69。
阿拉泽姆M,金克,林NS。脱落酸和水杨酸对拟南芥抗病毒RNA沉默途径基因表达的影响。Int J Mol Sci。2019;20(10).
- 70.
宋旭,应旭。水杨酸缺乏尼古利亚娜·宾夕法尼亚州减毒病毒诱导基因沉默,但不影响转基因诱导的后颅骨基因沉默,也不会使MicroRNA的一般生物发生。Physiolmol植物P. 2019; 106:276-80。
- 71.
Lewsey Mg,Carr JP。Dicer样蛋白2,3和4的影响黄瓜马赛克病毒和烟草马赛克病毒水杨酸处理植物中的感染。J Gen Virol。2009; 90(PT 12):3010-4。
- 72.
年轻的mo koo ayha。水杨酸作为安全植物保护剂和生长调节剂。植物Pathol J. 2020; 1(36):1-10。
- 73.
Alamillo JM,Saenz P,Garcia Ja。水杨酸介导的和RNA沉默的防御机制在限制系统蔓延的限制李子痘病毒在烟草。植物j . 2006; 48(2): 217 - 27所示。
- 74.
李Y,穆罕默德T,王Y,张D,Crabbe M,Liang Y.水杨酸与基因沉默于番茄黄叶卷曲病毒(Tylcv)的基因。Pak J Bot。2018; 50:2041-54。
- 75.
Gomez-Munoz N, Velazquez K, Vives MC, Ruiz-Ruiz S, Pina JA, Flores R, Moreno P, Guerri J.酸橙的抗性柑橘三虫草病毒是由水杨酸和RNA沉默防御途径介导的。莫尔植物途径。2017; 18(9):1253-66。
- 76.
王勇,丛qq,兰云飞,耿超,李旭东,梁永超,杨志勇,朱小平,李旭东。开发新马铃薯病毒X.基因过表达和基因沉默测定的基因载体。病毒Res。2014; 191:62-9。
- 77.
黄晓霞,于瑞,李伟,耿磊,景旭,朱超,刘辉。一种富含甘氨酸的RNA结合蛋白的克隆及表达分析尼古利亚娜谷氨酸.Planta。2019; 249(6):1811-22。
- 78。
Lin AV.间接ELISA。方法2015;1318:51-9。
- 79。
Wydgin YF,Blintsov AN,Grigorenko VG,Andreeva IP,OSIPOV AP,Varitzev Ya,Uskov Ai,Kravchenko DV,Atabekov JG。高度敏感的现场测试PVX感染的免疫诊断。苹果microbiol biotechnol。2012; 93(1):179-89。
- 80。
Xu Y, Zheng X ., Song Y ., Zhu L ., Yu Z ., Zhou S ., Liu H ., Wen F ., Zhu C. NtLTP4, a脂质转运蛋白尼科尼亚塔哈瓦姆.Sci众议员2018;8(1):8873。
- 81。
高效液相色谱-质谱联用技术测定饲料中水杨酸。中国兽医学报2018;62(3):303-7。
- 82。
李伟,郭宇。烟草叶片衰老转录组的RNA-Seq分析。方法:生物医学杂志1744;
- 83。
关键词:苹果茎麻点病毒,烟草,RNA测序数据简单。2020;29:105106。
- 84。
景XL,风扇Mn,佳G,刘LW,MA L,Zheng CC,Zhu XP,Liu HM,王XY。编码的多官能蛋白土耳其疱疹病毒抑制细胞内RNA沉默尼古利亚娜·宾夕法尼亚州.J微生物学报。2011;85(23):12792 - 803。
致谢
我们感谢湘东李教授提供矢量PCAPvx440-GFP-YFP,Josefa M. Allimino博士提供奈格转基因N塔巴库姆简历萨姆松NN.,以及费燕教授提供TMV-GFP。
资金
该研究由国家自然科学基金(授予第312721133号国国家自然科学基金(Grant 31272113)为设计和执行实验,以及山东省(ZR2019MC009)的自然科学基金,为常乡朱进行数据分析,写作和修改稿件。
作者信息
隶属关系
贡献
ZCX设计了实验,ZCX,PCE和Zal构思了原始筛选和研究计划。PCE,Zal,WQB,Syz,Ly和GQZ执行了实验。PCE,zal和zcx分析了数据。PCE和ZCX写了稿件。ZCX,ZM和DXH写作审查和编辑。所有作者读并同意发布本文。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称没有相互竞争的利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
载体pCaPVX440-GFP-YFP的基因组结构。将gfp基因克隆到pCaPVX440中AsiSI位点,而YFP基因插入之间囊我和Mlu我喜欢这个网站。RdRp,RNA依赖性RNA聚合酶;25 K、 十二, K和8 K为运动蛋白;外壳蛋白。
附加文件2:图S2。
在PVX之前给予ZnC的效果。野生型n benthamiana用PVX(GFP + YFP标签)接种在ZnC(150ng / ml)处理2小时之前,表型(一种)在长波紫外灯和PVX相对表达量中获得(B.),采用ELISA法计算5 dpi。误差条显示了三个重复的平均值±标准差(每个重复至少20株)。**表示使用学生t检验确定的极显著差异(P.< 0.01).
附加文件3:图S3。
ZNC处理增强了植物阻力对抗TMV。野生型n benthamiana经ZNC (100 ng/mL)处理2 h后接种TMV (GFP标签)。在长波紫外灯7 dpi照射下获得表型。(一)接种叶。(B)整个植物。
附加文件4:图S4。
前30名去浓缩条款。H之间的差异基因2o和znc组与-log10P.筛选每个术语中大于2的值,并通过-log排序前10个术语10P.对应于每个术语的值。案例:150 ng / ml ZNC;控制:0 ng / ml ZNC。
附加文件5:图。S5。
京都基因与基因组百科全书(KEGG)对植物中差异表达基因(DEGs)的富集分析。植物中前20种富集途径。每个圆代表一个KEGG通路,y轴代表通路名称,x轴代表富集分数,富集分数是比较在deg中注释到某一通路的基因与所有基因中注释到该通路的基因的比例。富集因子越大,途径中deg的富集越显著。
附加文件6:图S6。
GFP.siRNA积累。北方印迹分析GFP.3 dpi从贴片中提取siRNA,溴化乙锭染色的tRNAs作为siRNA的加载对照。盒子里的图片和Fig一样。6.c。
附加文件7:表S1
本研究用于测序的引物。表S2从每个样本获得的读数数。ZNC / H.2O:用ZNC或蒸馏水处理。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
彭,C.,张,A.,王,Q。等等。内生真菌的超高活性免疫诱导物通过SA途径和RNA沉默诱导烟草对病毒的抗性。植物生物学20,169(2020)。https://doi.org/10.1186/s12870-020-02386-4
已收到:
公认:
发表:
关键词
- 土豆X病毒
- 水杨酸
- H2O.2
- RNA沉默
- 防病毒