摘要
背景
R2R3-MYB转录因子(TFs)在植物生长发育、生物和非生物胁迫响应中发挥重要作用。然而,它们在木本植物创伤诱导花青素生物合成中的调控机制尚不清楚。
结果
在这项工作中,我们报告了花青素生物合成基因的表达(abg)被PdMYB118激活,这是一种MYB TF编码基因杨树三角肌, bHLH蛋白PdTT8直接与PdMYB118相互作用,可显著增强PdMYB118的激活。PdMYB118和一些abg创面诱导和茉莉酸甲酯(MeJA)处理明显诱导。过度的PdMYB118诱导伤后转基因杨树花青素积累的促进作用。此外,杨树JASMONATE zimm -domain (JAZ)蛋白PtrJAZ1通过与PdTT8结合抑制PdMYB118/PdTT8复合物的转录功能,并刺激茉莉酸(JA)的生物合成和PtrJAZ1的降解。
结论
基于这些观察,我们提出PtrJAZ1的降解引发了蛋白的表达abg导致转基因杨树受损叶片中花青素的生物合成增加。因此,我们的研究结果不仅说明了PdMYB118在杨树创伤诱导花青素生物合成中的重要作用,而且为彩色树种的基因工程提供了分子基础。
背景
花青素作为植物的主要色素,不仅为植物的花朵和果实提供颜色[1],还能帮助植物抵御不同的生物和非生物胁迫[2,3.,4,5,6,7,8,9,10,11,12]。在植物中,花青素是通过类黄酮途径的特定分支生物合成的[1,13,14]。杨树花青素的生物合成受一系列酶的催化作用,包括查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄酮3-羟化酶(F3H)、黄酮3 ' -羟化酶(F3 ' h)、类黄酮3 ' 5 ' -羟化酶(F3 ' 5 ' h)、二氢黄酮醇4-还原酶(DFR)和花青素合成酶(ANS) [7,8]。花青素生物合成基因的表达(abg)受MBW复合物的调控,MBW复合物由两种转录因子(tf) R2R3-MYB和basic helix-loop-helix (bHLH)和WD40-repeat蛋白组成[15,16,17]。在拟南芥, MBW复合物由R2R3-MYB因子PAP1、PAP2、MYB113和MYB114, bHLH因子TT8、GL3和EGL3和WD40蛋白TTG1 [16]。到目前为止,类似的MBW复合物已在不同的植物物种中被发现[13,18,19,20.,21,22]。
JA是一种必需的植物激素,在保护植物免受各种生物和非生物胁迫方面发挥重要作用[23,24]。JA信号通路受JAZs负调控,JAZs通过与MYC2等转录因子结合抑制JA反应基因的表达[25,26]。在环境刺激下,JA促进了JAZs与SCF之间的相互作用COI1泛素连接酶通过泛素/26S蛋白酶体途径触发JAZ降解[27]。JA生物合成的快速激活是由伤口刺激的,这是植物发育中常见的生物和非生物应激反应,如昆虫攻击,病原体感染,机械损伤[23,24]。在拟南芥,伤口诱导花青素生物合成[28], JA信号通路通过降解JAZ蛋白释放bHLH和MYB tf调控花青素的积累[29]。在棉花,F3H及其下游基因在原花青素(PAs)生物合成中的显著诱导作用诉dahliae感染及伤口[30.]。在苹果树中,MdWRKY40在损伤诱导的花青素生物合成中起关键的调节作用[31]。
迄今为止,许多花青素相关的R2R3-MYB tf已从不同的植物中分离出来[16,32,33]。然而,它们在伤口诱导的花青素生物合成中的调控机制仍不清楚。此前,我们证实PdMYB118调控杨树花青素的生物合成[34]。在这项工作中,我们报道了PdMYB118通过与PdTT8相互作用来激活花青素的表达,从而在花青素的生物合成中发挥作用abg在杨树。创面处理诱导JA积累,触发PtrJAZ1的降解,通过直接与PdTT8相互作用释放其对PdMYB/PdTT8复合体转录激活活性的抑制,进而激活的表达abg用于花青素生物合成。
结果
PdMYB118参与了杨树损伤诱导的花青素生物合成
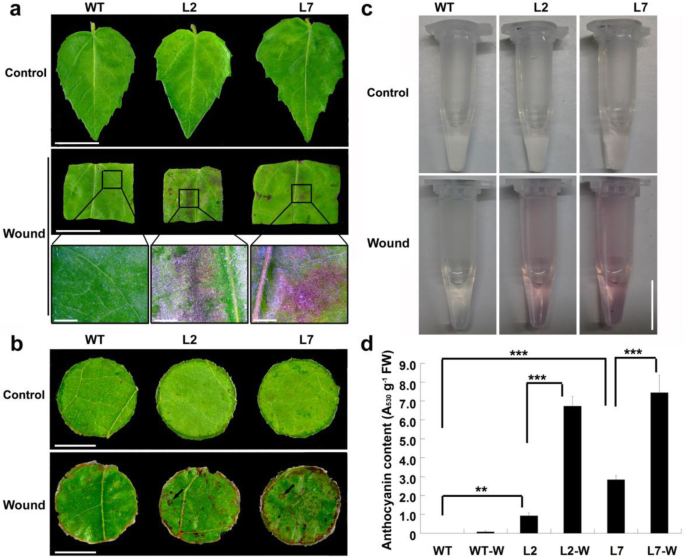
的可能功能PdMYB118在杨树花青素生物合成中,我们之前生成了转基因山杨植株[34]。过度的PdMYB118在温室和田间种植的成年转基因植株中导致红叶表型,而年轻的组织培养植株表现出与宽型(WT)一样的绿叶(附加文件)1:图S1a)。当幼苗被传代到新的MS培养基上时,它们的叶子变红,并在与母体植物切断后产生更多的花青素(附加文件)1:图S1b-d)。因此,创伤可能促进了转基因植物中花青素的生物合成。为了证实这一推测,对组织培养的转基因植株的幼叶和温室培育的转基因植株的成熟叶进行了诱伤诱导。正如我们所假设的那样,WT和来自组织培养植株的转基因叶片都是绿色的,但转基因叶片在诱导伤后2天形成了更多的红色斑点(图2)。1a).在温室种植的转基因植物的成熟叶盘中也观察到类似的结果(图。1b).转基因叶片比WT对照产生更多的花青素(图。1c, d).这些结果表明PdMYB118参与了杨树损伤诱导的花青素生物合成。
过度表达转基因植物叶片损伤诱导花青素积累PdMYB118。一个创伤促进转基因植物叶片中花青素的生物合成。将在MS培养基上培养的WT和转基因植株叶片切成片,转移到MS培养基上培养2 d。第三行图像是第二行图像框区放大倍数较高的图像。第一行和第二行图像的比例尺为1厘米,第三行图像的比例尺为1毫米。b温室栽培转基因植物损伤叶片中累积花青素的生物合成。将成熟的叶片切成叶盘,转移到MS培养基上培养2天。黑色箭头表示红色斑点。比例尺= 0.5厘米。c(b)损伤叶片中提取的花青素。比例尺= 0.5 cm。d(b)对照组叶片中花青素的相对含量,诱导前;伤口,在MS培养基上诱导2天后;WT,野生型山心阳植物叶片;L2和L7,转基因植物叶片过表达PdMYB118;WT-W,野生型植物损伤叶;L2- w和L7- w,转基因植物损伤叶(L2和L7系)。数值为三个生物重复的平均值及标准偏差(n= 3)。**和***,与WT, L2和L7相比,在P< 0.01,P分别< 0.001(学生t检验)
伤口诱发的表情abg
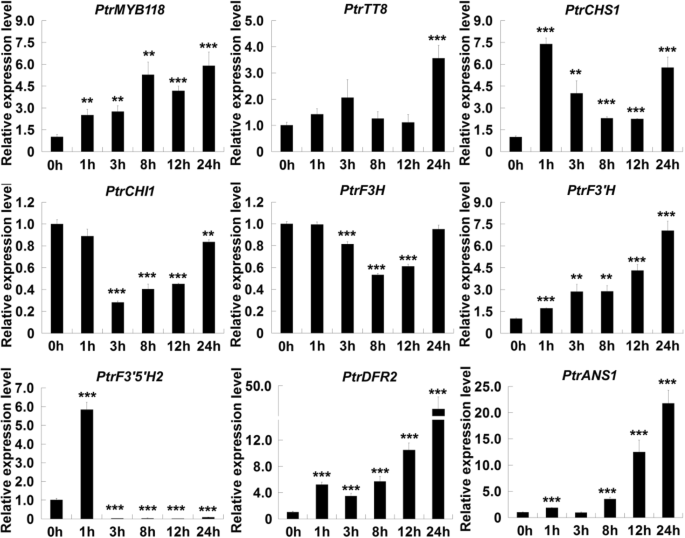
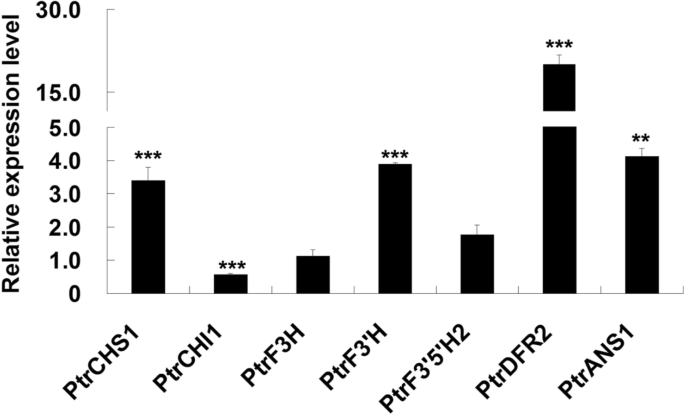
根据观察,伤口促进了花青素的积累PdMYB118过度表达转基因植物,我们假设创伤信号也可能诱导表达abg在野生型杨树。我们发现PdMYB118在创面诱导过程中,叶片中的转录物逐渐增加,并在24 h时达到最高转录水平。2)。一些abg,包括PtrF3'H,PtrDFR2而且PtrANS1的表达模式与PdMYB118。响应式表达PtrCHS1对创面诱导也观察到:1 h后增加,12 h后逐渐减少,24 h后恢复到高表达水平。PdTT83 h内轻度诱导,24 h后明显上调。PtrCHI1而且PtrF3H在创面诱导后3 ~ 12 h内下调,随后达到正常表达水平。以下是PtrF3”5 'h2创面诱导后1小时内达到峰值,随后时间点迅速下降至较低水平。从这些数据中,我们确定了四种诱发创伤的物质abg:PtrCHS1,PtrF3'H,PtrDFR2而且PtrANS1。
qRT-PCR分析PdMYB118而且abg在野生型杨树的损伤叶中。采用叶盘法对温室杨树成熟叶片进行不同时间间隔的处理,提取RNA。未处理叶片(0 h)的基因表达量为1。PtrMYB118而且PtrTT8分别为PdMYB118和PdTT8的同源性,PtrCHS1,PtrCHI1,PtrF3H,PtrF3'H,PtrF3的5是什么,PtrDFR2而且PtrANS1是ABG查尔酮合成酶、查尔酮异构酶、黄酮3-羟化酶、黄酮3 ' -羟化酶、黄酮3 ' - 5 ' -羟化酶、二氢黄酮醇4-还原酶和花青素合成酶的基因杨树。对每个时间点进行三次独立的重复测量,其值为平均值和标准差(n= 3)。***和***,差异显著P< 0.01,P< 0.001(学生t检验)
PdMYB118的转录激活活性被bHLH TF PdTT8增强
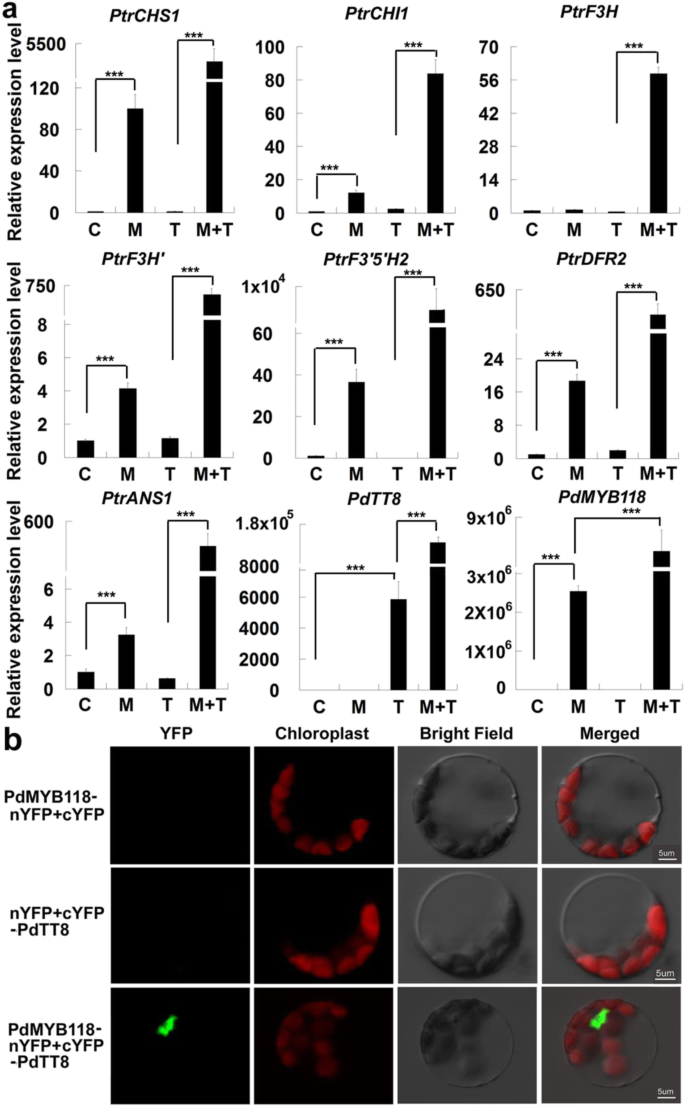
阐明…的确切功能PdMYB118在创伤诱导的花青素生物合成中,我们首次在野生型山心阳植物的叶片原生质体中瞬时表达。的瞬态表达式PdMYB118增强了大部分的转录abg,包括伤口诱导abg:PtrCHS1,PtrF3'H,PtrDFR2而且PtrANS1(无花果。3.a).在植物中,花青素相关MYB因子与bHLH tf密切相互作用,控制花青素生物合成[15]。我们克隆了一个杨树bHLH TF PdTT8,它与苹果的MdbHLH3和杨树的TT8同源拟南芥,与不同的MYB tf相互作用,并研究其转录活性。单用PdTT8不调控abg,但能显著增强PdMYB118的转录激活活性。当PdTT8短暂共表达与PdMYB118在原生质体中,所有的转录水平abg明显高于那些表达PdMYB118(图。3.a).这些结果提示PdTT8可能是PdMYB118的有效增强子,可调控abg。
PdTT8增强PdMYB118的转录激活活性。一个瞬态表达式PdMYB118或PdTT8杨树叶肉原生质体。pGreenII62-SK-的结构PdMYB118pGreenII62-SK -PdTT8或pGreenII62-SK -PdMYB118+ pGreenII62-SK -PdTT8分别转染到杨树叶片原生质体中。空载体用作阴性对照。从转染的原生质体中提取RNA进行qRT-PCR分析abg,PdTT8而且PdMYB118。PtrCHS1,PtrCHI1,PtrF3H,PtrF3'H,PtrF3的5是什么,PtrDFR2而且PtrANS1是ABG查尔酮合成酶、查尔酮异构酶、黄酮3-羟化酶、黄酮3 ' -羟化酶、黄酮3 ' - 5 ' -羟化酶、二氢黄酮醇4-还原酶和花青素合成酶的基因杨树。C,转染pGreenII62-SK的原生质体(对照);M,转染pGreenII62-SK-的原生质体PdMYB118;T,转染pGreenII62-SK-的原生质体PdTT8;m + t;用pGreenII62-SK-转染原生质体PdMYB118和pGreenII62-SK -PdTT8。bBiFC检测PdTT8和PdMYB118的相互作用。PdMYB118或PdTT8分别与YFP的n端和c端片段融合。左侧所示的结构对在WT杨树叶片原生质体中共表达。对照组基因表达量设置为1。数值为三个生物重复的平均值及标准偏差(n= 3)。***,与C和T相比差异显著P分别< 0.001(学生t检验)
PdTT8增强了PdMYB118的转录激活功能,提示这两个蛋白可能相互作用。因此,我们进行了BiFC检测来证实这种可能性。黄色荧光蛋白的N端和c端片段(nYFP和cYFP)分别与PdMYB118和PdTT8融合。正如预期的那样,PdMYB118-nYFP和cYFP-PdTT8共转染杨树叶肉原生质体时,原生质体核显示出强烈的YFP荧光;而在对照组中没有检测到信号(图。3.b).这些结果表明PdTT8可以直接与PdMYB118相互作用,增强其转录激活活性。
伤口促进JA生物合成和JAZ1降解
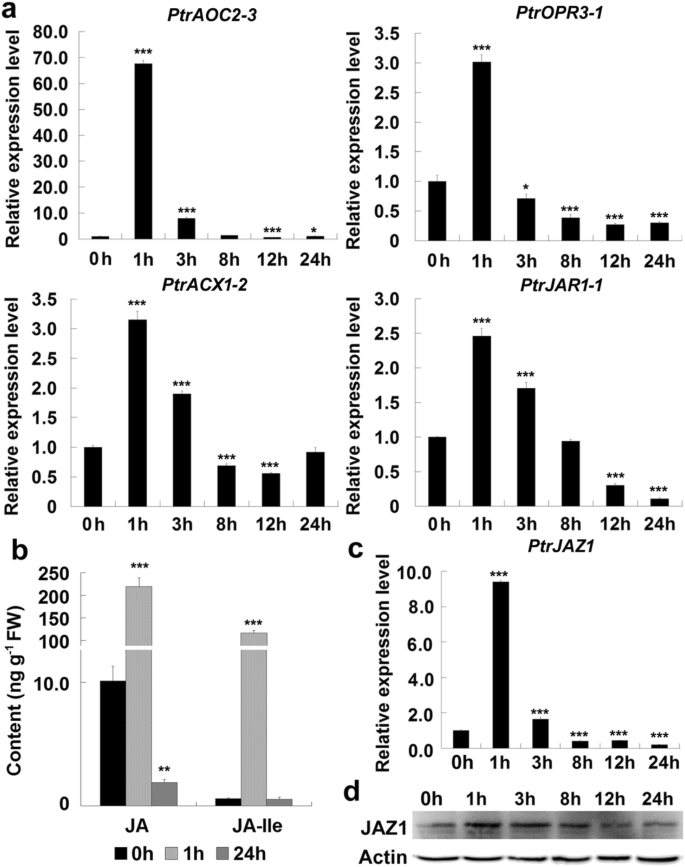
JA生物合成是由一系列生物合成酶一步一步催化的[26]。人们普遍认为JA在受到创伤刺激的植物叶片中迅速合成[23,24]。为了检测JA在创伤反应中的变化,我们检测了JA生物合成基因的表达PtrAOC2-3,PtrOPR3-1,PtrACX1-2而且PtrJAR1-1。所有这些基因都在创面诱导后1小时内迅速表达至峰值水平,然后随着治疗时间的延长逐渐降低(图2)。4a). JA生物合成基因的响应性表达可能导致JA的积累。然后,我们在机械损伤后1小时(短时间)和24小时(长时间)两个时间点测量了JA和JA- ile含量。JA和JA- ile含量约为10 ng g−10.58 ng g−1未损伤叶片的鲜重组织(FW)。然而,诱导创面1 h后,JA和JA- ile含量分别增加了约16倍和200倍(图2)。4b). 24 h后,JA和JA- ile含量分别降至约1.9和0.53 ng g−1弗兰克-威廉姆斯。损伤杨树叶片JA和JA- ile含量的变化与JA生物合成基因的表达变化密切相关。
JA生物合成基因表达、JA含量及JAZ1降解分析。采用叶盘法对温室杨树成熟叶片进行不同时间间隔的处理,然后进行RNA提取。一个损伤叶片JA生物合成基因的qRT-PCR分析。PtrAOC2-3,一种推测的烯氧化物环化酶基因杨树;PtrOPR3-1,推测为OPDA还原酶3基因杨树;PtrACX1-2,推测酰基辅酶a氧化酶基因杨树;PtrJAR1-1一种JASMONATE抗性基因(一种JA-Ile生物合成基因)杨树。b温室杨树损伤叶中JA和JA- ile含量的研究。用不同时间间隔处理的叶子进行测试。cqRT-PCR分析PtrJAZ1表达在受伤的叶子。d损伤叶片JAZ1蛋白的Western blotting分析。从不同时间间隔处理的叶盘中提取总蛋白。用10% SDS-PAGE分离30 μg蛋白,并与之杂交拟南芥JAZ1抗体(JAZ1)或植物肌动蛋白抗体(actin)。将未处理叶片(0 h)各基因表达量设为1。对每个时间点进行三次独立的重复测量,其值为平均值和标准差(n= 3)。*和***,差异显著P< 0.05和P< 0.001(学生t检验)。原始的未裁剪的斑点图像显示在另一个文件6:图S6
据报道JAZ基因明显受机械损伤诱导[23]。我们分析了一棵杨树的表情JAZ基因PtrJAZ1在伤口诱导过程中,发现PtrJAZ1创面诱导后1 h内转录物迅速上调,3 h内转录物迅速下降,24 h后转录物降至最低水平(图;4c).用Western blotting检测创面诱导后PtrJAZ1蛋白含量的变化。与PtrJAZ1在损伤叶片中的基因表达变化一致,PtrJAZ1蛋白的积累在3 h内达到较高水平,8 h后开始下降,12 h后减少到较低水平(图。4d).上述结果表明,创伤诱导杨树花青素生物合成可能是由JA信号通路介导的。
JA调控的表达abg在杨树
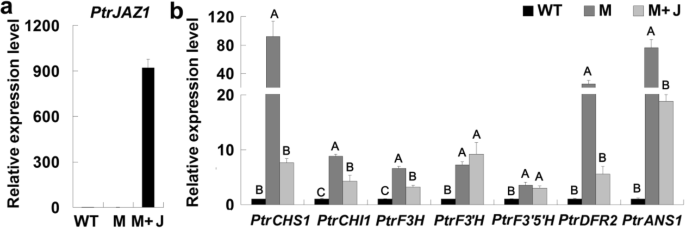
我们进一步研究了JA是否可以调控abg。用MeJA溶液对杨树叶片进行qRT-PCR分析。不出所料,创面表达水平可诱导abg(PtrCHS1,PtrF3'H,PtrDFR2而且PtrANS1)经MeJA处理后表达上调3 ~ 20倍以上(图;5)。JA信号通路受JAZ蛋白调控,JAZ蛋白通过与其他转录因子结合抑制JA反应基因的表达[35]。我们瞬时表示PtrJAZ1在叶片原生质体中PdMYB118转基因植物。大多数的上调表达abg通过PdMYB118被抑制的表达PtrJAZ1(无花果。6a, b).这些结果表明,JA诱导了abgPtrJAZ1负调控。
表达水平abg在转基因原生质体中瞬时表达PtrJAZ1。从野生型和转基因植物叶片分离的原生质体过表达PdMYB118用于分析。一个表达水平PtrJAZ1。b表达水平ABG基因PtrCHS1,PtrCHI1,PtrF3H,PtrF3'H,PtrF3的5是什么,PtrDFR2而且PtrANS1分别编码查尔酮合酶、查尔酮异构酶、黄酮3-羟化酶、黄酮3 ' -羟化酶、黄酮3 ' - 5 ' -羟化酶、二氢黄酮醇4-还原酶和花青素合酶杨树。在WT中设置基因表达水平为1。野生型原生质体转染pGreenII62-SK;M,转染pGreenII62-SK的转基因原生质体;M + J,转染pGreenII62-SK-的转基因原生质体PtrJAZ1。值(n= 3)为均值±标准差,直方图上不同字母表示差异显著(单因素方差分析;P< 0.01)
PtrJAZ1通过与PdTT8结合抑制PdMYB118/PdTT8复合物的转录激活活性
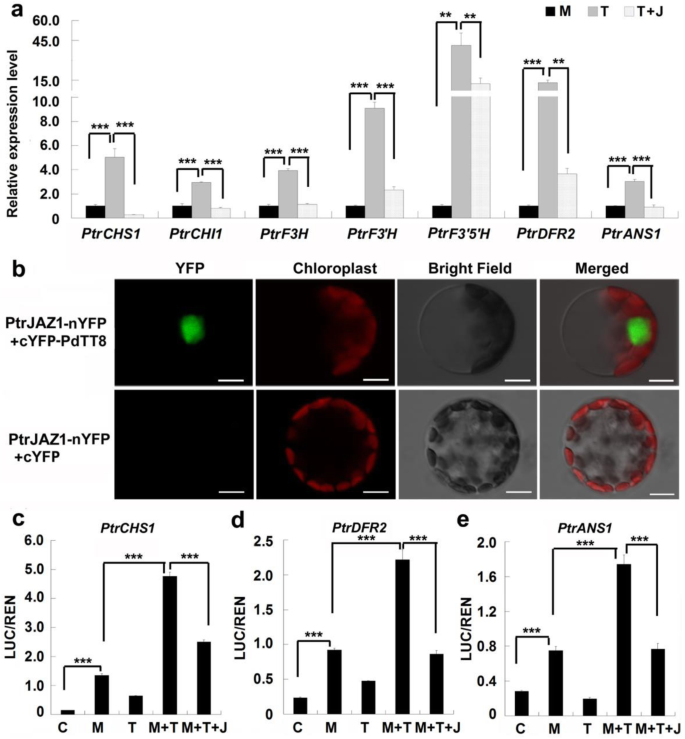
PtrJAZ1抑制PdMYB118转录激活活性可通过PdTT8调节。因此,我们用瞬态表示PdTT8而且PtrJAZ1的叶片原生质体中单独的或一起的PdMYB118转基因植物(附加文件2:图S2a, b).我们观察到PdTT8在叶片原生质体中PdMYB118转基因植物进一步提高了abg(无花果。7a).然而,当PtrJAZ1而且PdTT8的叶片原生质体共表达PdMYB118转基因植物的表达水平abg被抑制到对照样品的水平(图;7a).这些结果表明PtrJAZ1抑制了PdMYB118/PdTT8复合物的转录活性。然后,我们进行了BiFC检测,以检查PtrJAZ1是否与PdMYB118或PdTT8相互作用。PtrJAZ1-nYFP与cYFP-PdTT8或cYFP-PdMYB118在宽型杨叶叶肉原生质体中瞬时共表达。PtrJAZ1-nYFP与cYFP-PdTT8共表达在原生质体细胞核中产生了强烈的YFP荧光,而PtrJAZ1-nYFP与cYFP-PdMYB118共表达的原生质体中没有检测到荧光信号(图)。7b;额外的文件3.:图S3)。这一结果与在苹果中发现的MdJAZs与mddbhlh3 (TT8的类似物)相互作用,但不与与MdMYB9/11相关的PA生物合成相互作用一致[36]。
PtrJAZ1与PdTT8结合抑制PdMYB118/PdTT8复合物的转录激活活性。PtrCHS1,PtrCHI1,PtrF3H,PtrF3'H,PtrF3的5是什么,PtrDFR2而且PtrANS1是ABG查尔酮合成酶、查尔酮异构酶、黄酮3-羟化酶、黄酮3 ' -羟化酶、黄酮3 ' - 5 ' -羟化酶、二氢黄酮醇4-还原酶和花青素合成酶的基因杨树。一个PtrJAZ1抑制PdMYB118/PdTT8复合物的转录激活活性。从转基因植物叶片中分离出的原生质体过表达PdMYB118用pGreenII62-SK-PdTT8单独或与pGreenII62-SK-共转化PdTT8和pGreenII62-SK -PtrJAZ1。qRT-PCR分析abg在转染的原生质体中进行。以空载体为阴性对照,对照中基因表达量设为1。数值为三个生物重复的平均值及标准偏差(n= 3)。***和***,差异显著P< 0.01,P< 0.001(学生t检验)。M,转染pGreenII62-SK的转基因原生质体;T,转染pGreenII62-SK-的转基因原生质体PdTT8;T + J,共转染pGreenII62-SK-的转基因原生质体PdTT8和pGreenII62-SK -PtrJAZ1。bBiFC检测PtrJAZ1与PdTT8的相互作用。PtrJAZ1与YFP的n端片段融合,PdTT8分别与YFP的c端片段连接。左侧所示的结构对在杨树叶片原生质体中共表达。比例尺= 10 μm。一部瞬态转录双荧光素酶检测显示PtrJAZ1抑制MYB118/TT8复合物对的启动子的转录激活活性PtrCHS1(c),PtrDFR2(d)和PtrANS1(e)效应器(pGreenII62-SK-)PdMYB118pGreenII62-SK -PdTT8pGreenII62-SK -PdMYB118+ pGreenII62-SK -PdTT8或pGreenII62-SK -PdMYB118+ pGreenII62-SK -PdTT8 +pGreenII62-SK -PtrJAZ1)及记者(35个年代::任-ProPtrCHS1::卢克,35个年代::任-ProPtrDFR2::卢克或35个年代::任-ProPtrANS1::卢克)在杨树原生质体中共表达。REN的表达水平作为内部控制。LUC/REN比值代表了植物的相对活性PtrCHS1,PtrDFR2而且PtrANS1启动子。误差条表示来自三个生物重复的SDs。C,转染pGreenII62-SK的原生质体(对照);M,转染pGreenII62-SK-的原生质体PdMYB118;T,转染pGreenII62-SK-的原生质体PdTT8;M + T,转染pGreenII62-SK-的原生质体PdMYB118和pGreenII62-SK -PdTT8;M + T + J,转染pGreenII62-SK-的原生质体PdMYB118pGreenII62-SK -PdTT8和pGreenII62-SK -PtrJAZ1。数值为三个生物重复的平均值及标准偏差(n= 3)。***,差异显著于P< 0.001(学生t检验)
我们通过双荧光素酶实验进一步证实PtrJAZ1抑制PdMYB118/PdTT8复合物的转录激活活性。三绕组电感器abg(PtrCHS1,PtrDFR2而且PtrANS1)。PdMYB118在基因启动子上的转录激活活性PtrCHS1,PtrDFR2而且PtrANS1的比值高于PdTT8,表明LUC/REN比值较高(图;7一部)。在共表达PdMYB118和PdTT8的原生质体中,比例最高。当PtrJAZ1与PdMYB118、PdTT8共转化时,PdMYB118/PdTT8复合物的转录活性明显降低(图2)。7一部)。这些结果表明,PtrJAZ1通过与PdTT8结合,可以抑制PdMYB118/PdTT8复合物的转录激活活性。
JAZ1蛋白的降解促进了转基因植物损伤叶片中花青素的生物合成
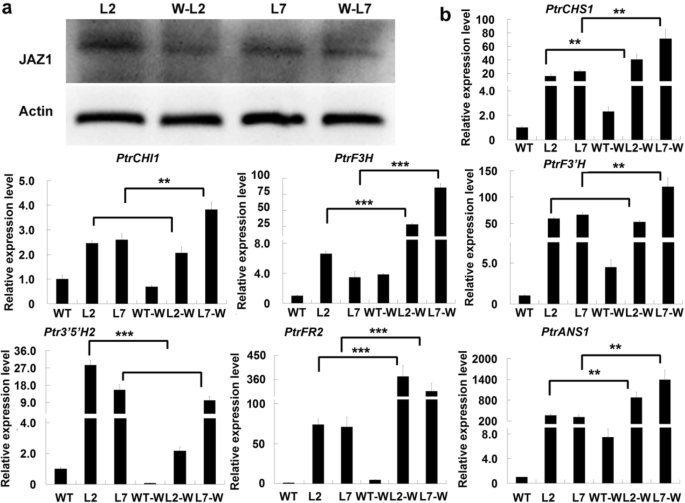
根据观察,表达abgPtrJAZ1蛋白被抑制,并且JAZ1蛋白在诱导损伤时被降解,我们推测损伤转基因叶片中花青素生物合成的增加可能是JAZ1降解的结果。采用Western blotting分析拟南芥我们发现,JAZ1在转基因植株损伤叶中的积累明显低于未处理对照叶(图2)。8a).因此,JAZ1蛋白水平的降低可能释放了MYB118/TT8复合物的转录激活活性,增加了wound-inducible的表达abg。我们进一步分析了abg在转基因植物的叶片中过度表达PdMYB118。在转基因植物(L2和L7系)未经处理的叶片中,wound−/ ja可诱导ABGs (PtrCHS1,PtrDFR2,PtrF3H而且PtrANS1)在转基因植物中表达上调。损伤诱导后,它们在WT和转基因植物叶片中的表达量均有所增加,其中转基因植物损伤叶片的表达量增加更为显著(图2)。8b).同样,的表达水平PdMYB118在WT和转基因植物的损伤叶片中均有增加,但转基因植物的增加显著更高(附加文件)4:图S4a)。然而,表达水平PdTT8在野生型和转基因叶片中变化不大(附加文件4:图S4b)。这些结果表明,转基因植物损伤叶片中花青素积累的增加可能是由于增强了abg是由创伤引起的JAZ1蛋白降解引起的。
JAZ1蛋白含量和ABG转基因杨树受损叶片中的表达。PtrCHS1,PtrCHI1,PtrF3H,PtrF3'H,PtrF3的5是什么,PtrDFR2而且PtrANS1是ABG查尔酮合成酶、查尔酮异构酶、黄酮3-羟化酶、黄酮3 ' -羟化酶、黄酮3 ' - 5 ' -羟化酶、二氢黄酮醇4-还原酶和花青素合成酶的基因杨树。一个JAZ1含量的Western blotting分析。从未处理或处理过的叶片中提取总蛋白PdMYB118overexpressing植物。采用JAZ1抗体(JAZ1)和植物肌动蛋白抗体(actin)进行杂交。原始的未裁剪的斑点图像显示在另一个文件7:图S7。bqRT-PCR分析abg在未经处理或处理过的野生型叶子和PdMYB118overexpressing植物。叶盘法机械损伤叶片2 d。提取RNA进行qRT-PCR分析。宽型叶片的基因表达水平设置为1。数值为三个生物重复的平均值及标准偏差(n= 3)。***和***,差异显著P< 0.01,P< 0.001(学生t检验)。WT,宽型杨树叶片;L2和L7,转基因植物叶片过表达PdMYB118;WT-W,宽型杨树伤叶;L2-W和L7-W是转基因植物的损伤叶
讨论
虽然创伤诱导花青素积累在植物中已被广泛观察到,但创伤如何调节杨树花青素生物合成的分子机制仍不清楚[28,37]。最近,我们对此进行了报道PdMYB118调控杨树花青素的生物合成[34]。过度的PdMYB118明显激活了花青素生物合成基因的表达,但未激活原花青素合成基因的表达,导致转基因植株出现红叶表型。有趣的是,在芽的繁殖过程中,我们观察到组织培养的植株或温室生长的转基因幼苗的叶子保持绿色或不那么红,但一旦芽被切掉,新切的芽的叶子就变成红色(附加文件)1:图S1a-d)。这一现象(创伤诱导花青素生物合成)的稳定性进一步得到了组织培养植株和温室生长植物的绿叶的证实。1模拟)。
前期研究表明JA通过JAZ蛋白与bHLH和MYB转录因子的相互作用调控WD-repeat/bHLH/MYB (WBM)复合物介导的花青素积累[29]。paa特异性R2R3-MYB因子,如杨树中的MYB134和苹果中的MdMYB9/11,对伤口处理有显著反应,而苹果中的花青素生物合成R2R3-MYB因子MdMYB1则没有反应[8,36]。MYB/bHLH复合物,如PAP1/TT8在拟南芥, AN4/AN1在佩妮混合葡萄中的VvMYBA1/VvMYC1,苹果中的MdMYB10/ mddbhlh3,也参与花青素的合成[13,38,39,40]。我们发现大多数人都这样表达abg对伤口治疗有反应(图;2)。白杨bHLH TF PdTT8与PdMYB118物理相互作用,形成PdMYB118/PdTT8复合物,更有效地激活了的表达abg(无花果。3.a, b).因此,PdTT8可能作为增强子促进PdMYB118的转录激活活性。
创伤可以迅速激活JA的生物合成,JA是植物应对各种胁迫的重要防御信号[23,24]。在植物中,JA的生物合成途径始于三不饱和脂肪酸α-亚麻酸(18:3)[26]。α-亚麻酸经过两个氧化步骤转化为一种不稳定的丙烯氧化物,随后由叶绿体中的丙烯氧化物环化酶(AOC)催化生成12-氧植二烯酸(OPDA)。然后JA生物合成的后半段在过氧化物酶体中完成,OPDA被OPDA还原酶3 (OPR3)还原为OPC-8 [41]。在β-氧化后,JA被运输到细胞质中,在那里通过JA-氨基酸合成酶(JAR1)与氨基酸结合形成茉莉酰异亮氨酸(JA- ile),这是越来越多的茉莉酸衍生物中主要的生物活性茉莉酸酯。我们发现伤口治疗在1小时内迅速上调了JA生物合成基因的表达(图。4a),导致受损叶片中JA和JA- ile的快速输出(图。4b).这些结果表明杨树JA生物合成对创伤诱导反应迅速。伤口处理增加JA生物合成可激活JA信号通路。的确,与JA生物合成基因的表达模式相似,PtrJAZ1在创面诱导开始后1 h内也上调,然后逐渐降低(图;4c).这一结果与以往的报道一致,大多数JAZ基因在创面诱导后1小时内强烈诱导,在随后的时间点呈下降趋势[23,24]。JA信号通路还通过E3泛素连接酶SCF的活性促进JAZ转录抑制因子的降解COI1JAZs [27]。我们发现,在创面处理8 h后,杨树JAZ蛋白的含量也明显降低。4d).因此,在杨树中,创伤诱导可以通过激活JA的生物合成基因,快速诱导JA的生物合成,促进JAZ蛋白的降解。
JA调控花青素积累相关的几种花青素生物合成基因[42,43]。在杨树中,MeJA处理可诱导部分基因的表达abg如PtrCHS1,PtrF3H”,PtrDFR2而且PtrANS1(无花果。5)。有趣的是,这些表达abg这表明伤口诱导的花青素生物合成可能是由JA信号通路介导的。有报道称JA通过JAZ蛋白与bHLH和MYB因子的相互作用调控WD-repeat/bHLH/MYB复合物介导的花青素积累[29]。我们发现PtrJAZ1特异性结合PdTT8,并减弱了PdMYB118/PdTT8复合物在JA/wound-inducible启动子上的转录激活活性abg(无花果。7a e)。JAZ调控表达abg在白杨和在拟南芥[29],但与苹果不同,在苹果中,MdJAZ2抑制mddbhlh3向调控花青素和原花青素生物合成的MdMYB9和MdMYB11启动子的募集[24]。因此,JA诱导JAZ蛋白降解可以取消JAZ蛋白与bHLH和MYB因子的相互作用,进而激活花青素的生物合成[29]。与这一推测一致,当PtJAZ1蛋白在转基因植物损伤叶片中降解时,JA−/wound-inducibleabg高度诱导促进花青素生物合成(图;8a、b)。
结论
综上所述,本研究阐明了PdMYB118在杨树损伤诱导花青素合成中的生物学功能。虽然还需要更详细的研究来完全了解PdMYB118在花青素合成中的机制,但我们的数据暗示了一种可能的杨树创伤诱导花青素合成的模型:创伤诱导后,JA生物合成基因被迅速激活,用于JA生物合成,随后引发PtrJAZ1的降解;然后,恢复PdMYB118/PdTT8复合物的转录激活活性,促进花青素生物合成基因的表达;最后,花青素被生物合成,导致转基因植物的红叶表型(附加文件5:图S5a, b)。
方法
植物材料和生长条件
野生型山新杨(WT)和转基因山新杨(P. davidiana × P. bolleana) overexpressingPdMYB118在我们之前的报道中使用的是在MS培养基上繁殖,转移到土壤中,并在温室中生长[34,44]。杨善新由刘桂峰教授(东北林业大学,中国)提供。杨树三角肌其红叶突变体购自中国烟台清远科技有限公司。植物在25°C(白天)/18°C(夜间)的温室中生长,光照/暗光周期为12 h。
伤口的治疗方法
将野生型和转基因杨树叶片分别在MS培养基和温室培养基上切成1.5 cm的小块,转移到MS培养基上诱导伤。在伤口诱导后的不同时间点,收获叶片,在液氮中冷冻,并在- 80°C保存,用于提取RNA、蛋白质、JA和花青素。
惩罚处理
分析归纳PdMYB118而且abg采用JA法,将100 μM MeJA (Sigma, Shanghai, China)溶液喷在温室栽培的WT杨树成熟叶片上。3 h后采集叶片进行RNA提取。用水喷洒的叶片作为阴性对照。
定量实时RT-PCR
用RNAiso试剂(Takara, Shanghai, China)从叶片和叶片原生质体中提取总RNA,并按前面所述进行qPCR [45]。将各靶基因的相对表达量归一化PtrEF1β。本研究中使用的基因特异性引物在附加文件中列出8:表S1。对每个样品进行三次独立的重复测量。
解剖观察
为了对花青素斑点进行组织学观察,将野生型和转基因植物叶片处理48 h后,在光学显微镜下进行观察。图像在SMZ800显微镜下拍摄。
花青素含量测定
缠绕诱导48 h后,温室栽培的野生型和转基因植株叶片花青素含量测定方法如前所述[46]。为了检测花青素的含量,A530采用每克鲜重(FW)。每次测量进行3次重复,并用标准差(SD)表示变异性。
西方墨点法
Western blotting分析如前所述[47]。简单地说,在不同时间点从损伤叶片中提取总含量为30 μg的蛋白质,用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离。然后将总蛋白电转移到聚偏二氟乙烯膜上。使用JAZ1抗体进行免疫印迹拟南芥JAZ1蛋白(Agrisera,http://www.agrisera.com/),然后用二抗山羊抗兔igg -辣根过氧化物酶(HRP) (Abmart,中国)孵育。为检测肌动蛋白,采用一抗(小鼠单克隆肌动蛋白抗体)和二抗(山羊抗小鼠IgG-HRP)进行免疫反应(Abmart, Shanghai, China)。在化学发光检测溶液LumiGLO (KPL,美国)中孵育后,用化学发光成像系统Tanon 5500 (Tanon,上海,中国)对膜进行成像。使用BCA蛋白测定试剂盒(Thermo, Shanghai, China)对蛋白质进行定量。
JA含量测定
对于JA和JA- ile含量的测定,分别在0 h、1 h和24 h时间点将野生型杨树损伤叶片在液氮中研磨成细粉。JA提取如前所述[48]。每个试验重复3次,用标准差(SD)表示变异。
白杨叶肉原生质体中tf的瞬时表达
为了分析PdMYB118、PdTT8和PdMYB118/PdTT8复合物的转录功能,通过插入CaMV 35S启动子驱动的转录因子效应子产生PdMYB118或PdTT8进入pGreenII62-SK [49]。如前所述,从山心杨叶片中分离出叶片原生质体[34]。合成物为greenii62 - sk -PdMYB118pGreenII62-SK -PdTT8和pGreenII62-SK -PdMYB118+ pGreenII62-SK -PdTT8分别转入原生质体。空载体用作阴性对照。暗置16 h后,收集转染的原生质体进行RNA提取和qRT-PCR分析abg如上所述。
检测PdTT8或PtrJAZ1对abg转基因植物叶片表达过表达PdMYB118,效应器pGreenII62-SK-PdTT8pGreenII62-SK -PtrJAZ1和pGreenII62-SK -PdTT8+ pGreenII62-SK -PtrJAZ1分别转化为转基因植物的叶肉原生质体。用转染的原生质体进行qRT-PCR分析abg。每个试验重复3次,用标准差(SD)表示变异。
BiFC化验
的全长编码序列PtrJAZ1,PdMYB118而且PdTT8分别克隆后重组成YFP的BiFC载体,与YFP的N端或c端(nYFP或cYFP)融合,生成pSAT4-nYFP-PdMYB118/PtrJAZ1和pSAT4-cYFP-PdTT8/PdMYB118质粒。用于基因克隆的引物见辅助信息表S1。为了检测PtrJAZ1与PdTT8或PdMYB118的相互作用,以及PdMYB118与PdTT8的相互作用,将相关结构共转染野生型植物的叶肉原生质体中。在23°C孵育16 h后,使用514 nm波长共聚焦显微镜(蔡司LSM 510 META)分析原生质体。每个试验重复3次,用标准差(SD)表示变异。
瞬时转录双荧光素酶测定
对于双荧光素酶检测,通过克隆的启动子生成LUC报告结构PtrCHS1,PtrDRF2或PtrANS1进入pGreenII0800-LUC [47]。所得到的pGreenII62-SK-PdMYB118, pGreenII62-SK-PdTT8或pGreenII62-SK-PtrJAZ1被用作如上所述的效应器结构。为了检测PtrJAZ1对PdMYB118/PdTT8复合物转录活性的抑制作用,在杨树叶片原生质体中,效应子PdMYB118、PdTT8、PdMYB118 + PdTT8或PdMYB118 + PdTT8 + PtrJAZ1与每个报告结构重复共表达[45]。用LUC/REN比值表示转录因子的相对活性。每个试验重复3次,用标准差(SD)表示变异。
统计分析
所有数据分别来自3个生物重复。对于统计分析,使用Student 's t检验(双尾)或ANOVA(单向)来生成每一个P价值。用标准差(SD)表示其可变性。*、**、***表示p-values分别< 0.05,<0.01和< 0.001。
数据和材料的可用性
本研究所分析的所有材料和数据均可从通讯作者处获得
缩写
- TF:
-
转录因子
- ABG:
-
花青素生物合成基因
- 惩罚:
-
甲基jasmonate
- JAZ:
-
JASMONATE ZIM-domain
- CHS:
-
查耳酮合酶
- 气:
-
查耳酮异构酶
- F3H:
-
黄烷酮3-hydroxylase
- F3'H:
-
黄烷酮3 ' -羟化酶
- F3’5是什么:
-
类黄酮3 ' 5 '羟化酶
- DFR:
-
Dihydroflavonol 4-reductase
- 答:
-
花青素合成酶
- bHLH:
-
基本helix-loop-helix
- WT:
-
野生型
参考文献
类黄酮生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物科学,2001;
克里斯蒂·j, Alfenito MR, Walbot V.低温胁迫对一般苯丙素和花青素通路的影响:增强玉米幼苗转录体丰度和花青素色素沉淀。足底。1994;194:541-9。
花青素-dna色素复合物:对抗氧化损伤的相互保护。植物化学。1999;52:1313-8。
王志刚,王志刚,王志刚。植物组织中花青素在光保护中的作用。新物理。2002;155:349-61。
罗丽华,李志强,李志强,等。花青素5-o-糖基转移酶在马铃薯块茎中的异位表达对细菌抗性的影响。农学通报。2005;53:272-81。
Nakabayashi R, Yonekura-Sakakibara K, Urano K, Suzuki M, Yamada Y, Nishizawa T, Matsuda F, Kojima M, Sakakibara H, Shinozaki K, Michael AJ, Tohge T, Yamazaki M, Saito K。植物学报(英文版);
蔡cj, Harding SA, Tschaplinski TJ, Lindroth RL,袁茵。调节防御苯丙烷代谢的结构基因的全基因组分析杨树。新物理。2006;172:47-62。
melway RD, Tran LT, Prouse MB, Campbell MM, Constabel CP.损伤-,病原体-和紫外线b反应MYB134基因编码R2R3 MYB转录因子,调节杨树原花青素合成。植物科学学报。2009;30(2):344 - 344。
James AM, Ma D, Mellway R, Gesell A, Yoshida K, Walker V, Tran L, Stewart D, Reichelt M, Suvanto J, Salminen JP, Gershenzon J, Séguin A, Constabel CP.杨树MYB115和MYB134转录子调控原花青素合成和结构。植物学报。2017;174:154-71。
王玲,冉玲,侯勇,田青,李超,刘锐,范东,罗坤。杨树转录因子MYB115调控原花青素生物合成,增强真菌抗性。植物学报。2017;215:351-67。
胡拉,蔡cj,薛丽娟,薛丽娟,郭申宗。杨树水杨酸对生物营养性锈病真菌的防御作用Melampsora larici-populina通过增加儿茶素和原花青素的生物合成。新物理2019a; 221:960-975。
杨晓明,王晓明,王晓明,等。黑杨树花青素和儿茶素的积累Plectosphaerella populi:激素调节、生物合成和抗真菌活性。前沿植物科学20119b; 10:1-10。
Espley RV, Hellens RP, Putterill J, Stevenson DE, Kutty-Amma S, Allan AC.苹果果实的红色是由于MYB转录因子MdMYB10的活性。植物J. 2007; 49:414-27。
Hancock KR, Collette V, Fraser K, Greig M, Xue H, Richardson K, Jones C, Rasmussen S. R2R3-MYB转录因子TaMYB14的表达三叶草arvense激活豆科植物原花青素的生物合成三叶草被而且紫花苜蓿。植物科学学报。2012;29(3):344 - 344。
Hichri I, Barrieu F, Bogs J, Kappel C, Delrot S, Lauvergeat V.黄酮类化合物生物合成途径转录调控的研究进展。中国科学(d辑),2011;
黄志刚,李志刚。生殖器官花青素合成调控的研究进展。中国植物科学,2001;21(1):19 - 19。
徐伟,李志强,李志强,等。MYB-bHLH-WDR复合物对黄酮类化合物合成的转录调控。植物科学进展,2015;20:176-85。
格罗特沃尔德E,塞恩斯MB,塔利亚尼L,埃尔南德斯JM,鲍文B,钱德勒VL。玉米C1 Myb结构域残基的鉴定,确定了与bHLH辅因子相互作用。2000; 97:13579 - 84。
Elomaa P, Uimari A, Mehto M, Albert VA, Laitinen RA, Teeri TH。在非洲菊(Asteraceae)中花青素生物合成的激活表明,在古老的分离单子叶和真子叶之间存在保守的蛋白质-蛋白质和蛋白质-启动子相互作用。植物学报。2003;133:1831-42。
Sweeney MT, Thomson MJ, Pfeil BE, McCouch S.被抓了个正着:Rc编码一种调节水稻红色果皮的基本螺旋-环-螺旋蛋白。植物细胞。2006;18:283-94。
Nakatsuka T, Haruta KS, Pitaksutheepong C, Abe Y, Kakizaki Y, Yamamoto K, Shimada N, Yamamura S, Nishihara M.龙骨花中调控花青素合成的r2t3 - myb和bHLH转录因子的鉴定与鉴定。植物物理学报。2008;49:1818-29。
Matus JT, Poupin MJ, Canon P, bordu E, Alcalde JA, Arce-Johnson P.葡萄类黄酮合成相关WDR和bHLH基因的分离(葡萄l .)。植物化学学报,2010;
Chung HS, Koo AJK, Gao X, Jayanty S, Thines B, Jones AD, Howe GA。拟南芥茉莉酸zimm结构域基因在伤害和草食中的调控和功能。植物物理学报。2008;46:952 - 64。
古AJ,高X, Jones AD, Howe GA。快速创面信号激活拟南芥中生物活性茉莉酸酯的系统合成。植物学报(英文版);2009;
Staswick体育。激活茉莉酸信号。植物科学进展,2008;13:66-71。
Gfeller A, Dubugnon L, Liechti R, Farmer EE。茉莉酸盐生化途径。科学通报。2010;3:32。
Thines B, Katsir L, Melotto M, Niu Y, Mandaokar A, Liu G, Nomura K, He SY, Howe GA, Browse J. JAZ抑制蛋白是茉莉酸盐信号转导过程中SCF (COI1)复合物的靶标。大自然。2007;448:661-5。
甘艳,李红,谢艳,吴伟,李敏,王霞,黄娟。拟南芥THF1基因突变导致基础和创伤性氧脂素水平升高,通过COI1信号通路刺激花青素生物合成。中国生物工程学报,2014;26(6):516 - 527。
戚涛,宋松,任强,吴东,黄红,陈艳,范敏,彭伟,任超,谢东。茉莉酸- zimm结构域蛋白与WD-repeat/bHLH/MYB复合物相互作用调控茉莉酸介导的花青素积累和毛状体启动拟南芥。植物学报。2011;23:1795-814。
谢超,王东,寇峰,康东,杨霞。病原菌和创伤诱导棉花叶片原花青素(PAs)合成相关基因的表达。植物科学学报,2012;3(4):344 - 344。
安杰,张鑫,尤春,毕松,王霞,郝艳。MdWRKY40与MdMYB1共同促进损伤诱导的花青素生物合成,并通过mdbt2介导降解。新植物,2019;22:38 0 - 95。
杨晓燕,杨晓燕,杨晓燕,杨晓燕。杨树R2R3-MYB转录因子家族的扩增和多样性研究。植物学报。2009;49:981 - 93。
赵俊杰,阮VP,全华威,金MH,严实,林玉杰,金卫哲,朴仁杰,崔毅,高志华。PtrMYB119,一种R2R3-MYB转录因子杨树trichocarpa促进杂交杨树花青素的产生。树木物理。2016;36:1162-76。
王洪辉,王小强,宋文敏,鲍勇,金玉玲,蒋春明,王婷婷,李波,张海霞。PdMYB118是从胡杨(Populus delids)红叶突变体中分离出来的调控杨树花青素生物合成的转录因子。植物细胞杂志2019;38:927-36。
大自然。2010;468:400-5。
安小红,田勇,陈克强,刘新军,刘大德,谢小斌,程春春,丛福平,郝玉军。MdMYB9和MdMYB11参与调控ja诱导的苹果花青素和原花青素的生物合成。中国生物医学工程学报,2015;
Tamari G, Borochov A, Atzorn R, Weiss D.茉莉酸甲酯诱导矮牵牛花冠色素沉着和类黄酮基因表达:在创伤反应中的可能作用。植物科学。1995;94:45-50。
nei N, Jond C, Debeaujon I, Caboche M, Lepiniec L.拟南芥TT2基因编码R2R3 MYB结构域蛋白,该蛋白在种子发育过程中对原花青素积累起关键决定作用。植物学报,2001;13:2099-114。
Quattrocchio F, Verweij W, Kroon A, Spelt C, Mol J, Koes R.矮牡丹的PH4是一种R2R3 MYB蛋白,通过与花青素通路的碱基-螺旋-环-螺旋转录因子相互作用激活液泡酸化。植物细胞。2006;18:1274-91。
Hichri I, Heppel SC, pilllet J, Léon C, Czemmel S, Delrot S, Lauvergeat V, Bogs J.基本螺旋-环-螺旋转录因子MYC1参与调控葡萄类黄酮生物合成途径。植物学报。2010;3:509-23。
黄志刚,宋志刚。茉莉酸类化合物的生物合成、代谢和信号通路研究。中国机械工程学报,2017;
Loreti E, Povero G, Novi G, Solfanelli C, Alpi A, Perata P.赤霉素,茉莉酸和脱落酸调节蔗糖诱导的拟南芥花青素生物合成基因的表达。新植物,2008;179:1004-16。
单晓,张勇,彭伟,王忠,谢东。茉莉酸诱导拟南芥花青素积累的分子机制。中国机械工程学报,2009;30(4):369 - 369。
王海辉,王婷婷,刘辉,唐仁杰,张海霞。农杆菌介导的两个白杨优良杂交无性系叶片外植体转化再生体系的研究杨树阿尔巴×p . berolinensis而且杨树davidiana×p . bolleana。植物细胞学报,2011;30:2037-44。
王海辉,唐仁杰,刘辉,陈友友,刘纪勇,蒋晓楠,张海霞。PtSND2嵌合抑制因子严重影响转基因木材的形成杨树。树物理。2013;33:878-86。
吉田,马德华,杨晓明。MYB182蛋白通过抑制结构类黄酮基因和调控类黄酮基因下调杨树原花青素和花青素生物合成。植物科学进展。2015;
王海辉,蒋楚明,王婷婷,杨勇,高晓宇,张海霞。束素样阿拉伯半乳聚糖蛋白PtFLA6基因的反义表达杨树在转基因树中抑制其同源基因的表达,改变茎的生物力学和细胞壁组成。中国机械工程学报,2015;
陈明明,付小明,刘建强,叶婷婷,侯秀生,黄永强,袁宝峰,吴勇,冯永强。利用衍生化方法结合纳米lc - esi - q - tof - ms分析对酸性植物激素进行高灵敏度和定量分析。中国生物医学工程学报(英文版);2012;
Hellens RP, Allan AC, Friel EN, Bolitho K, Grafton K, Templeton MD, Karunairetnam S, Gleave AP, Laing WA。功能基因组学的瞬时表达载体,启动子活性定量和植物RNA沉默。植物学报。2005;1:13。
确认
感谢刘贵峰教授(中国东北林业大学)为我们提供杨善新(p . davidiana×p . bolleana)克隆。
资金
国家重点研发计划项目(2016yfd0600106,2019yfd1000500);国家转基因研究重点项目(2018ZX08020002-003-004);国家自然科学基金项目(31700524,31870576,31871625);山东省现代农业产业技术体系创新团队(SDAIT-02-05);山东省农业品种改良项目(2019LZGC009)。资助者在研究的设计、数据的收集、分析和解释以及撰写手稿方面没有发挥任何作用。
作者信息
从属关系
贡献
HW, XW, CY, CW和YL进行实验并分析数据。HW和HZ撰写稿件并整理所有资料。所有作者都对手稿作了修改。所有作者都阅读并批准了手稿。
相应的作者
道德声明
伦理批准并同意参与
本研究不包含任何需要伦理同意或批准的研究。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
创伤诱导转基因植物叶片中花青素的生物合成。
附加文件2:图S2。
BiFC检测PtrJAZ1与PdMYB118的相互作用。
附加文件3:图S3。
的表达PtrJAZ1而且PdTT8从转基因植物叶片分离的原生质体中过度表达PdMYB118。
附加文件4:图S4。
qRT-PCR分析PdMYB118而且PdTT8在WT和过表达转基因植物的损伤叶片中PdMYB118。
附加文件5:图S5。
杨树创伤诱导花青素生物合成的模型。
附加文件6:图S6。
损伤叶片JAZ1蛋白的Western blotting分析。
附加文件7:图S7。
转基因杨树损伤叶JAZ1蛋白的Western blotting分析。
附加文件8:表S1。
本研究使用的引物序列。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
王宏,王X,于C。et al。MYB转录因子PdMYB118与bHLH转录因子PdTT8直接相互作用,调控杨树创伤诱导的花青素生物合成。BMC植物生物学20.173(2020)。https://doi.org/10.1186/s12870-020-02389-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02389-1
关键字
- 花青素
- JAZ1
- PdMYB118
- PdTT8
- 杨树