摘要
背景
鸟氨酸转氨酶(OAT, EC:2.6.1.13),又称鸟氨酸δ转氨酶(δOAT),是一种依赖磷酸吡哆醛(PLP)的酶,参与鸟氨酸转化为谷氨酰-5-半醛(GSA)和谷氨酰-5-半醛(GSA)的过程。尽管从水稻、玉米和高粱中成功分离出了OAT,但目前还没有对小麦中的OAT进行研究。本研究主要对其进行鉴定和分子表征燕麦在小麦。
结果
总共有三个同源燕麦小麦基因组的基因位于第5染色体群,命名为TaOAT-5AL,TaOAT-5BL,TaOAT-5DL。将gDNA与其对应的cDNA序列比对,共获得10个外显子和9个内含子。构建了系统发育树,结果表明单子型和双子型之间存在高度保守的结构域,并通过WebLogo生成序列标志进一步说明了这一点。进一步的亚细胞定位分析表明它们在线粒体中起作用。蛋白质-蛋白质相互作用通过与脯氨酸代谢途径中的δ 1-吡啶-5-羧酸合成酶(P5CS)和吡啶-5-羧酸还原酶(P5CR)等基因相互作用支持了它们在脯氨酸生物合成中的作用。启动子分析揭示了几种应激反应元件的存在,暗示它们参与应激调节。表情分析表明TaOAT在干旱或盐胁迫条件下的小麦植株中高度诱导。表达上调TaOATs在雄蕊和抽穗期均可见。的潜在作用TaOAT揭示了小花发育过程中的基因。此外,转基因植株过表达TaOAT通过增加脯氨酸积累来增强对干旱胁迫的耐受性。此外,转基因植株的耐盐性也有所增强。
结论
TaOATs脯氨酸合成和氮再活化基因与脯氨酸生物合成酶和精氨酸分解代谢相关基因相互作用。此外,TaOAT基因在非生物胁迫耐受中起作用,并可能在小花发育中起作用。本研究结果可为今后小麦抗非生物胁迫的研究提供参考。
背景
小麦(小麦)是一种全球种植的作物,占人类消耗的卡路里的20% [1]。然而,不利的气候对小麦产量的影响很大,同时人口的快速增长和耕地的减少加剧了目前小麦产量的短缺。因此,提高小麦产量,特别是在非生物胁迫增加的情况下,是缓解这种情况的必要措施。植物已经进化出一个复杂的系统,通过形态、生理和分子水平的变化来生存非生物胁迫[2,3.]。在过去的几十年里,基因工程在小麦育种方面取得了很大的进展。然而,小麦种质资源(又称小麦基因资源)的有限性制约了小麦非生物抗逆性品种的开发。因此,有必要鉴定更多的胁迫相关基因,以便在育种计划中利用这些基因培育耐胁迫小麦品种。
鸟氨酸转氨酶是一种高度保守的酶,存在于从单细胞细菌到多细胞动物和植物的所有原核生物和真核生物中,在脯氨酸(Pro)生物合成过程中催化鸟氨酸(Orn)转氨化成谷氨酰-5-半醛(GSA)。该酶蛋白属于磷酸吡哆醛(PLP)依赖酶的天冬氨酸转氨酶(AAT)超家族(折叠型I)。AAT超家族的关键作用是通过连接参与碳氮代谢和蛋白质生物合成的主要途径来控制氮和碳通量[4]。OAT酶通过另一种称为鸟氨酸途径的途径,在胁迫诱导的细胞质脯氨酸积累、细胞程序性死亡和植物非宿主抗病方面发挥作用[5,6]。OAT酶也参与氮代谢,Pro代谢通过两种调节酶与氮代谢呈正相关即OAT和P5CS,它们依赖于植物的氮供应[7]。此外,OAT在精氨酸分解代谢中的急性作用也证实了它在氮再利用中的功能[8,9]。
第一个工厂燕麦基因是从豇豆属aconitifolia通过an的功能互补大肠杆菌前营养不良菌株[10]。随后,燕麦基因是从拟南芥盐胁迫下幼苗转录本的同源克隆研究[j]。11]。由于这些序列在公共数据库中的可用性,燕麦-编码基因已成功克隆并在许多作物物种中进行了功能鉴定。在许多植物物种中已经报道了OAT参与干旱和盐胁迫。例如,nacl处理后的萝卜子叶中OAT表达水平升高(萝卜) [12在年轻时拟南芥幼苗暴露于200 mM NaCl [11]。类似的,过度表达OsOAT增强了胁迫条件下水稻活性氧(ROS)的清除能力[13]。然而,大多数的研究都集中在燕麦基于模式植物的非生物胁迫下的基因。目前还没有关于小麦等主要作物的报告。因此,TaOAT本研究从小麦中分离到-编码基因,并对其进行了功能鉴定。我们的分子分离和功能鉴定结果TaOAT非生物胁迫下的S对小麦抗逆性育种有一定的促进作用。
结果
的隔离和结构分析TaOAT六倍体小麦的基因
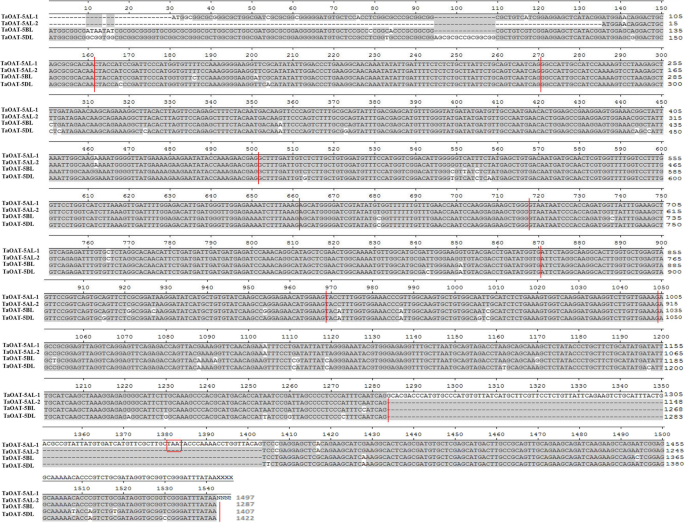
从国际小麦基因组测序联盟(IWGSC)数据库中检索序列AtOAT通过检索At5g46180,共得到3个与我们查询匹配的支架,分别是TGACv1_scaffold_374190、TGACv1_scaffold_404925和TGACv1_scaffold_435304,它们位于第5染色体长臂上,e值分别为1e-30、7e-27和4e-24。3个候选基因gDNA/cDNA长度的开放阅读框(ORF)预测值分别为4568/1419 bp、4276/1488 bp和4446/1422 bp。普通小麦品种菲尔德的序列与中国春的参考序列无差异。然而,两个转录变体TaOAT-5AL才被揭示出来。这些被命名为TaOAT-5AL-1和TaOAT-5AL-2cDNA长度分别为1497 bp和1287 bp。相比TaOAT-5AL-2,TaOAT-5AL-1包含一个额外的120 bp的插入,包含一个帧内终止密码子,这导致了一个过早的蛋白(图2)。1).本研究中使用的6个品种的测序结果证实了额外插入的基因特征。TaOAT-5AL-2根据测序结果,与参考序列相同。有趣的是,有六个剪接变体t . dicoccoides数据库和TaOAT-5AL-2转录本显示与其中两个变体TRIDC5AG054810.2和TRIDC5AG054810.3高度相似1:图S1)。经过序列比对,我们发现TaOAT-5AL-2对TRIDC5AG054810.2具有更高的同一性。我们怀疑在六倍体小麦的进化过程中,它保留了两个选择性剪接的变体TaOAT-5AL。另一方面,只找到了一个文本TaOAT-5BL一个是TaOAT-5DL。此外,TaOAT-5BL由于缺失了81个bp,该转录本由1488 bp变成了1407 bp,这与集成植物数据库中假定的转录本一致,其登录ID为traescs5b02g3769001。两组间bp和长度无差异TaOAT-5DL成绩单。我们已将这些序列提交给国家生物技术信息中心(NCBI)数据库,检索号为MK942062、MK942063、MK680533和MK748213TaOAT-5AL-1,TaOAT-5AL-2,TaOAT-5BL,TaOAT-5DL,分别。
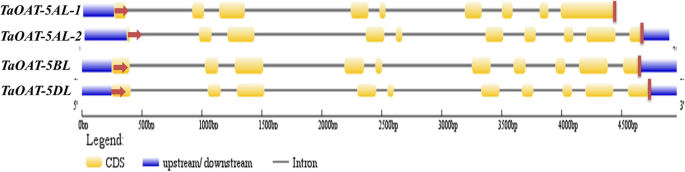
外显子-内含子的边界是通过将每个基因组中的gDNA序列与cDNA的全长序列进行比较来确定的TaOAT-5AL-1,TaOAT-5AL-2,TaOAT-5BL,TaOAT-5DL。总的来说,TaOAT基因含有10个外显子和9个内含子。的TaOAT-5AL基因有两种转录本,这可能是选择性剪接的结果。TaOAT-5AL-1由9个外显子组成,由于第9个内含子的保留,导致过早蛋白的形成(图2)。2).序列分析显示,该基因发生了T→C的核苷酸转变TaOAT-5AL(过渡由附加文件中的红色框表示1:图S2),打破了经典的内含子剪接边界(5 ' -GT(N)nAG-3 ';其中N代表任意核苷酸,N代表随机数)。这种转变可能导致第9个内含子的保留TaOAT-5AL-1对应于TaOAT-5BL和TaOAT-5DL(无花果。2).然而,TaOAT-5AL-2有相同的结构TaOAT-5BL和TaOAT-5DL(无花果。1).3个基因在gDNA和cDNA水平上的同源性分别为87.68%和87.18%。
染色体和亚细胞定位TaOAT小麦基因及其编码蛋白
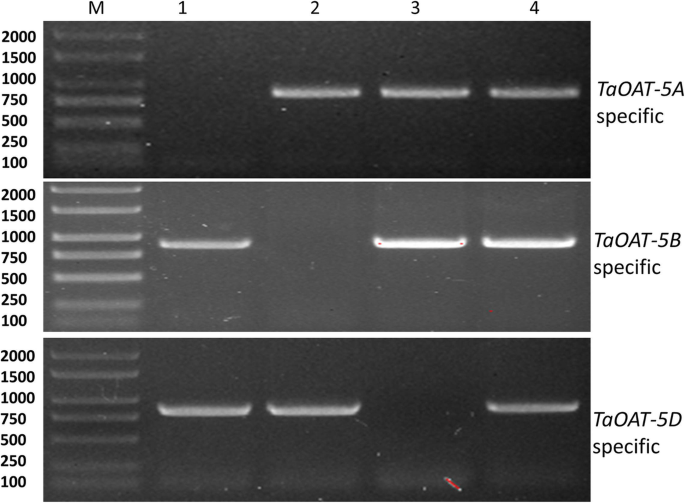
确认染色体位置TaOAT小麦里的基因,对每个基因都有特定的引物TaOAT以中国春(CS)为对照,以5号染色体组相关的3个中国春零染色体系为模板进行PCR定位。的特异引物对N5A/T5B在1巷未获得条带TaOAT-5AL,当使用特定引物时,在车道2中为N5B/T5ATaOAT-5BL的特定引物时,N5D/T5A在lane 3TaOAT-5DL(无花果。3.).这些条带的缺失表明由于相应的染色体被移除而导致基因缺失。因此,这三个基因,TaOAT-5AL,TaOAT-5BL,TaOAT-5DL,分别被分配到六倍体小麦的染色体5A、5B和5D上。
染色体位置的测定TaOAT利用特异引物和零染色体系对小麦六倍体基因的研究。lane 1中没有864 bp大小的条带,表明该引物是特异性的TaOAT-5AL由于N5A/T5B中缺少5A染色体。同样,在lane 2和lane 3中没有882和840 bp大小的条带,说明引物对TaOAT-5BL和TaOAT-5DL因为在N5B/T5A和N5D/T5A系中分别缺失5B和5D染色体。M: DL2000 DNA梯(天根生物科技)。北京有限公司);1 - 4: Chinese Spring染色体组5条零染色体组线,其中N代表零染色体,T代表四染色体,其中2条染色体替换或洗牌各自缺失的两条染色体(1:N5A/T5B, 2: N5B/T5A, 3: N5D/T5A, 4: Chinese Spring)
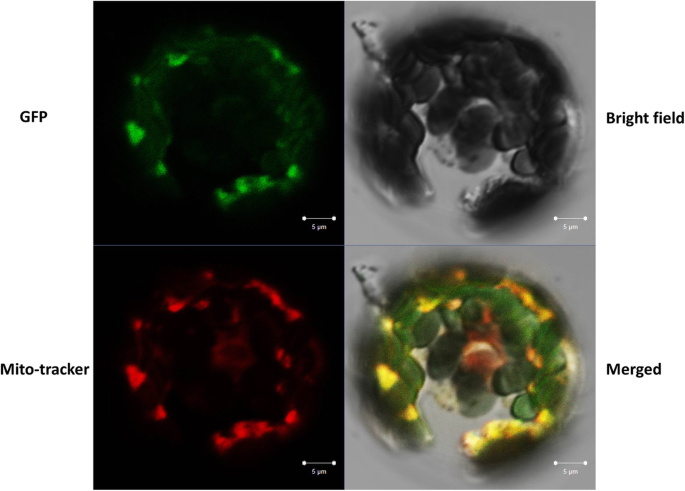
利用TargetP预测了65种植物OAT蛋白的亚细胞定位。大多数植物燕麦(83%)靶向线粒体(附加文件)2:表1)。因为燕麦被认为是高度保守的酶,以前的报道已经表明,燕麦和OsOAT是针对线粒体的[8,9],我们推测taat蛋白也在线粒体中起作用,本研究使用Mitoprot获得0.9707的高概率支持了这一推测。此外,与taat融合的GFP信号仅在小麦原生质体的线粒体中有瞬时表达;线粒体特异性染料与GFP信号的融合表明,线粒体靶向了taat蛋白(图2)。4).
小麦系统发育及启动子分析燕麦基因
系统发育分析表明,单子房(红色表示)和双子房(蓝色表示)中存在两个明显的类群(另附文件)1:图S3)。来自玉米、高粱和水稻等谷物的燕麦形成了一个独特的小簇,具有很高的相似性。例如,小麦的同源基因与其各自的祖先群表现出密切的相似性TaOAT-5AL表现出高度的相似性小麦属植物urartu和TaOAT-5DL表现出高度的相似性山羊草属tauschii表明普通小麦及其野生近缘种具有相同的基因结构和功能。总体而言,这些结果表明普通小麦及其野生近缘的OAT在进化过程中保持高度保守性。相比之下,更大的群体是dicot燕麦基因形成了5个亚群,表明dicot燕麦基因进化出了更多样化的功能。利用WebLogo(附加文件)创建的序列标识也说明了目标基因在单子叶和双子叶种之间的保守性1:图S4)。
在本研究中,起始孔上游1000个碱基对TaOATs被选来预测独联体-元素使用在线工具。结果表明,许多预测元件具有应激响应性,包括脱落酸响应元件(ABRE)、MYB (Myeloblastosis)等。独联体-元件、ros相关元件(G-box和W-box)、乙烯响应元件(ERE)、热冲击元件(HSE)、aptala2样元件(ap -2样)和低温响应元件(LTR)(附加文件)1:图5)。G-box (CACGTG)元素参与对光、脱落酸、茉莉酸甲酯和厌氧反应。G-box在乙烯诱导和种子特异性表达中也有作用。此外,G-box还具有ABRE (aba响应元件)的功能[14,15]。ABRE和G-box元件都为bZIP转录因子(TFs)提供结合位点,调控胁迫反应。ABRE和G-box均存在于这三种小麦中燕麦这个研究的基因。W盒子出现在TaAOT-5AL和TaOAT-5DL它与WRKY家族的tf相互作用。ABRE存在于所有TaOAT基因,DREs(脱水反应因子)TaOAT-5AL和TaOAT-5DL,和LTRTaOAT-5DL提供的结合位点南汽这表明taats在盐胁迫和干旱胁迫反应中都起作用。此外,ap -2样结构域在TaOAT-5DL这支持了它在小花发育中的作用。这些发现表明TaOATs在植物对干旱、盐度和病原体胁迫的反应中有潜在的作用。
与小麦OAT相关的蛋白质-蛋白质相互作用
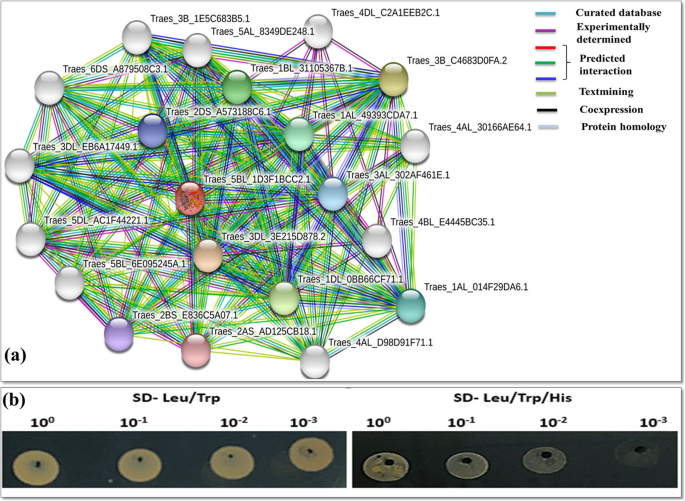
根据STRING数据库,taat与Traes_1BL_31105367B.1交互Traes_3B_1E5C683B5.1 (pyroline -5-carboxylate reductase,属于pyroline -5-carboxylate reductase家族)、Traes_3DL_EB6A17449.1 (pyroline -5-carboxylate reductase)、Traes_4BL_E4445BC35.1 (cyclin依赖性激酶的调控亚基)、Traes_5BL_6E095245A.1(精氨酸脱羧酶属于Orn/Lys/Arg脱羧酶ii类家族,SpeA亚家族),以及许多未表征的蛋白质(图2)。5a、附加文件3.).有趣的是,Traes_2BS_E836C5A07.1是小麦精氨酸酶(TaARG)基因,这些基因在我们之前的出版物[16]。在本研究中,通过STRING数据库,TaOAT-5BL蛋白与2BS_E836C5A07.1 (TaARG)相互作用,并通过酵母双杂交实验对这种相互作用进行了实验验证(图2)。5B)证明了两个基因的积极相互作用。这些结果也支持了预测的相互作用。taat与P5CS和P5CR的相互作用支持了taat在脯氨酸生物合成中的作用。此外,taarg - 5bl与精氨酸酶家族蛋白(TaARG-2BS)的相互作用表明,taat参与精氨酸代谢(图2)。5b;额外的文件1:图S6)。
taat与其他小麦蛋白的蛋白相互作用。一个通过STRING数据库预测相互作用的蛋白伴侣。的TaOAT-5BL(Traes_5BL_1D3F1BCC2.1)氨基酸序列在小麦中寻找其互作基因。节点表示单个蛋白质编码位点,边缘表示具有相同功能的有意义的相互作用。颜色节点代表交互器的第一层外壳,白色节点代表交互器的第二层外壳。空节点表示未知三维结构的蛋白质,填充节点表示已知或预测的三维结构。b酵母双杂交预测互作结果的证实。左边的图表示酵母在两种不存在的(亮氨酸/色氨酸)培养基上的生长情况。右侧的图表示酵母在三种缺席(Leu/Trp/His)培养基上的生长情况。具体的相互作用是通过在三种缺席(Leu/Trp/His)培养基上的转化子生长来确定的。100代表原始文化样本。10−1-10年−3显示10倍的连续稀释样品
小麦的表达谱燕麦不同组织和发育阶段的基因
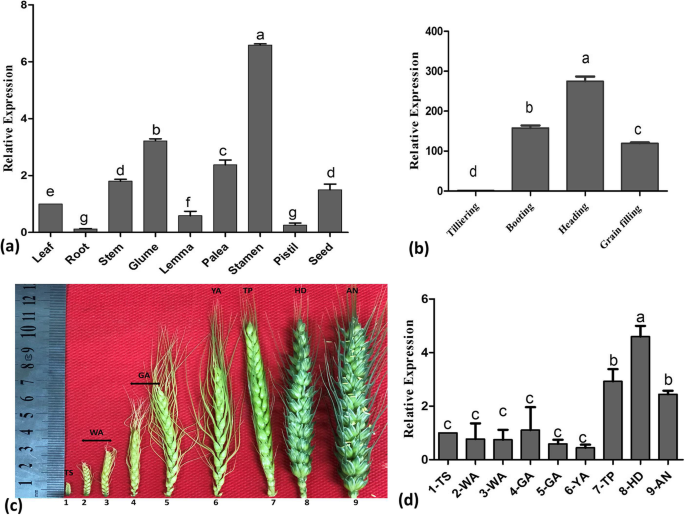
的表达模式TaOATs采用定量反转录PCR (qRT-PCR)方法对小麦系大田菌的不同组织进行分析。高TaOAT在雄蕊中观察到转录本水平;在叶、种子、茎和颖片中有中度表达;在根、雌蕊和颖花中表达极低(图2)。6的表达模式TaOAT与的相似吗OsOAT(8]。叶片中转录本的相对表达量逐渐上调,抽穗期达到峰值,灌浆期下降(图2)。6b).穗发育阶段的OAT表达结果在抽穗期、抽穗期和开花期较强,抽穗期表达量最高(图2)。6c, d).雄蕊高表达,花期低表达表明TaOATs很可能与花药开裂有关。
的表达模式TaOAT外源PEG和NaCl诱导的基因
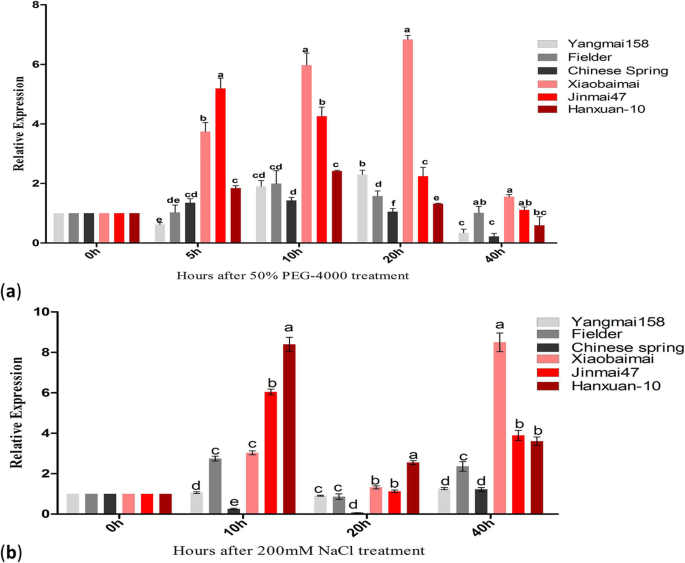
探讨非生物胁迫(干旱和盐胁迫)对基因表达的影响TaOATs以3个抗旱品种和3个抗旱敏感品种为研究对象,比较了它们的表达量TaOATs比较。在数据分析中,以0 h时的表达水平作为比较参考(图2)。7).的表达趋势TaOATs不同小麦品种对PEG和NaCl胁迫的响应不同,但差异不大。例如,表达上调TaOATs在抗旱小麦品种中比在抗旱小麦品种中更为明显。的总体表达趋势TaOATs在PEG和NaCl胁迫处理下,均先升高后降低。由于50% PEG-4000处理,表达在10 h和20 h分别达到一次峰值,然后在40 h时下降(图2)。7a)。同样,由于暴露在200 mM NaCl胁迫下,在20 h和40 h时观察到表达高峰(图2)。7b).这些结果清楚地表明TaOATs在干旱和盐胁迫中发挥重要作用。
稳定转基因品系的选育及抗旱试验
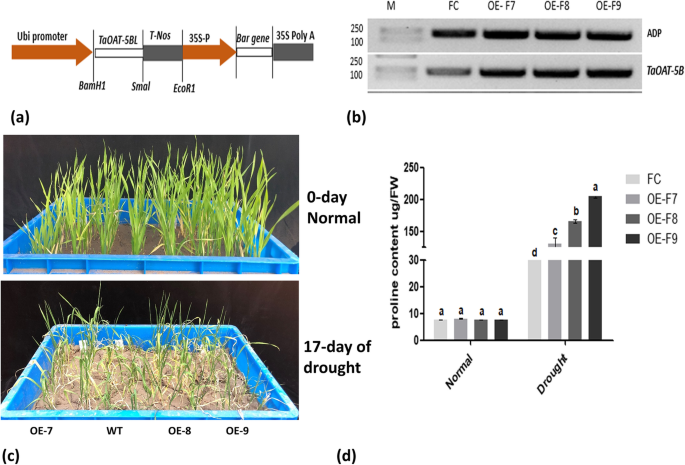
共获得35株独立的转基因小麦植株农杆菌属-介导的转化,其中30例转基因阳性TaOAT-5BL通过PCR检测酒吧QuickStix工具包(附加文件)1:图S7)。获得了6个稳定的独立转基因品系2代,其中3个分别命名为OE-F7、OE-F8和OE-F9进行功能分析。半定量PCR分析表明,转基因系表达的TaOAT-5BL比野生型菲尔德(图。8b)。
对转基因株系在三叶期进行暂水处理,以检验TaOAT-5BL关于抗旱能力。在水分胁迫17天后,野生型菲尔德的生长受到干旱的严重影响,与相应的转基因品系相比(图2)。8c).由于预测OAT参与脯氨酸的生物合成,因此在正常和胁迫条件下测量游离脯氨酸含量。结果表明:在正常条件下,转基因植株与野生型的脯氨酸含量无显著差异;在干旱胁迫条件下,转基因植株脯氨酸积累量明显高于野生型植株。这些结果表明,参与TaOAT-5BL干旱条件下脯氨酸生物合成的研究。
转基因植株在离体条件下表现出较强的耐盐性
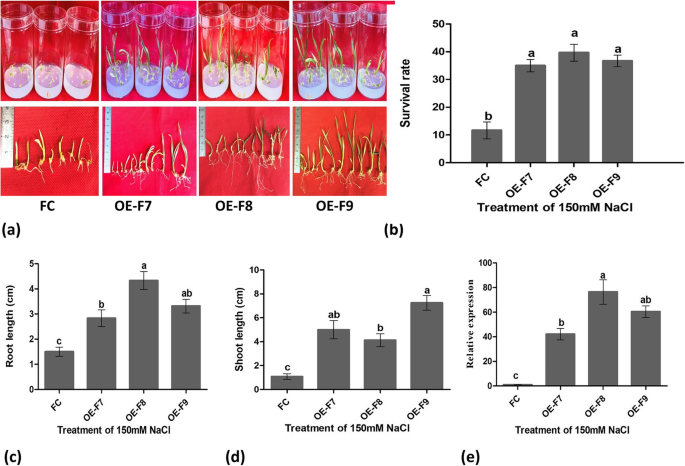
在150mm含盐培养基上,转基因植株的成熟胚发芽率为71-85%,而野生型的成熟胚发芽率仅为27%(附加文件)1:图S8)。在盐培养基上接种30天后,转基因植株成活率为35-40%,野生型植株成活率为12%(图2)。9a, b)。此外,转基因植株比野生型植株生长更快,根系更长、更密(图2)。9c, d).相对表达分析表明TaOAT-5BL与野生型植物相比,转基因植物在盐胁迫条件下的表达显著上调(图2)。9e).这些结果清楚地描述了TaOAT-5BL高表达转基因植物耐盐性增强。
耐盐试验TaOAT-5BL在150 mM含NaCI的培养基中过表达转基因系及其野生型Fielder。一个耐盐表型TaOAT-5BL转基因系和野生型大田菌培养30天。b的存活率TaOAT-5BL转基因系与野生型菲尔德培养30天。c的相对表达分析TaOAT-5BL转基因系和野生型菲尔德培养30天。d培养30天后存活植株的根长。e存活植株培养30天的芽长。FC表示野生型Fielder, OE-F7、OE-F8、OE-F9分别为TaOAT-5BL过表达来自菲尔德的转基因系。数据取3个重复的平均值,采用IBM-SPSS统计分析20。黑体小写字母表示组间差异显著(α < 0.05),采用Duncan 's多重极差检验。条形图表示平均值的标准误差
讨论
干旱和盐胁迫可能是植物生长发育的关键限制因素,严重影响作物生产力。由于全球气候变化,气温上升可能会导致严重的干旱,从而降低大田作物的产量。为了防止在不久的将来可能发生的全球粮食短缺灾难,对具有改良遗传背景的作物新品种的需求正在增加。因此,在不影响作物产量的情况下,培育更能抵抗盐和干旱胁迫的品种是至关重要的。为此,迫切需要确定更多负责耐旱和耐盐的基因。
迄今为止,许多应激反应基因已被确定并分为两类。第一类包括编码与渗透保护有关的代谢酶的功能基因,如前代谢酶;第二类包括调节功能的基因,称为TFs [17]。的燕麦基因是已在许多作物物种中发现的促代谢酶之一[11,13,18,19]。到目前为止,还没有关于克隆和功能鉴定的报道燕麦小麦中的基因。在这项研究中,小麦燕麦已成功克隆,并报道了它们潜在的功能作用。除了参与促代谢外,人们普遍认为燕麦在干旱和盐胁迫诱导Pro积累的另一途径中发挥作用[20.,21]。200-mM NaCl处理可诱导燕麦表达于萝卜子叶和中拟南芥苗(11,12,22]。同样的,OsOAT过表达表明水稻对氧化胁迫的耐受性显著提高[13]。为确定其在小麦中的作用,对其进行了硅分析TaOAT基因启动子区域最初被执行。在的启动子中发现了几个假定的tf结合位点TaOATABRE、MYB、ERE、LTR、DRE、W-box、G-box和HSE等基因为bZIP、WRKY和NAC tf提供结合位点。一些报告将这些TFs与植物对干旱和盐胁迫的反应联系起来。例如,南汽基因受应激响应调控元件的转录调控,如DREs、ABREs、茉莉酸响应元件、水杨酸响应元件、LTREs、MYB和MYC(髓细胞瘤病)结合位点[23]。W框调节防御相关(PR10)基因,并在生物和非生物胁迫、种子休眠和衰老中起作用[24,25]。TaWRKY2过表达增强小麦抗旱性[j]26]。的基因SNAC2胁迫响应NAC基因和NAC基因ONAC022与水稻耐冷性、耐盐性和耐渗透性有关[27,28]。同样,转基因棉花、番茄和玉米的耐旱性和耐盐性也增强拟南芥(29,30.,31]。与推测的在逆境耐受中的作用一致,我们通过qRT-PCR进一步检测TaOATS是由应力条件诱导的。我们发现TaOAT在PEG和NaCl胁迫下,该基因在耐旱品种中的表达量明显高于敏感品种。先前的报告表明,过度表达AtOAT和OsOAT提高水稻抗氧化能力[13,21]。在这里,我们的数据还表明,taat也参与小麦对干旱和盐度的响应。
植物ap -2样的存在独联体-作用元素将我们的注意力引向了它在小花发育中的作用。研究表明,ap -2样结构域参与了小穗发育过程中分生组织细胞命运的决定,从而导致了不同类型的小穗,如分枝无丝1/卷曲穗1/分枝无小花1 [32,33]。此外,AP2转录本是microRNA172 (miR172)的靶标,它有助于穗和小花发育过程中的层形成[qh]34,35,36]。剖析…的这个功能燕麦采用qRT-PCR方法测定小麦中TaOAT在不同的组织中(叶、根、茎、种子、颖片、外稃、旧叶、雄蕊和雌蕊)。进一步研究TaOAT我们检测了基因在不同发育阶段(分蘖、孕穗期、抽穗期和灌浆期)的表达。的高度表达TaOAT在雄蕊和抽穗期观察到,支持其在小花发育中的作用。在小花发育过程中,表达较高的TaOAT在倾倒(TP)、抬头(HD)和花期(AN)阶段进一步支持了TaOAT在小花发育中。最近一项关于水稻的研究报告称OsOAT突变系在小花发育中起作用。此外,OsOAT突变水稻的缺陷影响了授粉过程,造成结实率低和种子形状变形[8]。系统发育分析表明,OAT基因在谷物中高度保守,具有相似的基因结构和功能。我们的研究结果以及最近关于大米的报告有力地支持了这一点TaOATs通过花药开裂在授粉过程中发挥作用基于在OsOAT突变体。
蛋白-蛋白相互作用分析表明TaOAT-5BL与脯氨酸生物合成基因相互作用(TaP5CS和TaP5CR)和氮利用基因(TaARG).的参与燕麦脯氨酸生物合成和氮代谢的基因也在前人的研究中得到证实[6,7,8,9,10,11]。脯氨酸、精氨酸和鸟氨酸三种途径的交联也在前人的研究中有所回顾,发现鸟氨酸(OAT酶的前体)在这三种途径中占有重要地位[18]。此外,小麦精氨酸酶基因也有参与氮代谢的报道[16]。在这项研究中,一个积极的互动TaARG和TaOAT用Y2H法观察。结合这项研究的发现,我们推断TaOATs在脯氨酸生物合成中起重要作用,并可能参与精氨酸代谢。因此,我们推断TaOAT在氮代谢中有潜在的作用。
植物OAT被认为参与了胁迫诱导的脯氨酸生物合成。一些研究证实了OAT在非生物胁迫条件下对脯氨酸合成的积极贡献。人们发现AtOAT基因对幼体耐盐性起积极作用拟南芥幼苗和参与脯氨酸生物合成[11]。一项转基因研究表明AtOAT为脯氨酸的生物合成提供了额外的途径烟草plumbaginifolia通过增加OAT活性[22]。类似的,过度表达AtOAT在盐和干旱胁迫条件下,水稻脯氨酸含量比野生型植物增加5 ~ 15倍[21]。最近,有研究表明,过度表达OsOAT转基因水稻抗渗透能力的增强[13]。我们目前的研究表明TaOAT-5BL在干旱胁迫条件下,小麦转基因品系脯氨酸含量显著提高。根据我们的结果和之前的研究,可以得出结论TaOAT通过修饰脯氨酸生物合成提高转基因植物的抗旱性。转基因小麦植株对离体盐胁迫的耐受性也增强。从这些结果我们可以总结TaOAT在小麦的耐旱性和耐盐性中起重要作用。
结论
在这项研究中,有三份TaOAT的基因,TaAOT-5AL,TaOAT-5BL和TaAOT-5DL,克隆并定位于小麦5号染色体长臂上。我们确定,由于选择性剪接现象,存在两种类型的转录本TaOAT-5AL。类似于OsOAT和AtOAT,TaOATs也针对线粒体。系统发育分析表明,该酶在单子叶和双子叶种中均具有高度保守性。在硅启动子分析揭示了相当多的独联体-在启动子区域的作用元素TaOAT基因,表明它在干旱和盐胁迫中的作用。此外,qRT-PCR分析显示TaOAT基因对聚乙二醇和盐胁迫的反应,支持其在这两种胁迫下的潜在作用。转基因小麦植株过表达TaOAT表现出对干旱和盐胁迫条件的耐受性增强。此外,存在植物ap -2样独联体-作用元素和高表达TaOAT在雄蕊中提示其在小花发育中的作用。的最高表达TaOAT在抽穗期配合高表达TaOAT在雄蕊中,它在花药开裂和颖片打开中起重要作用。
方法
植物材料和载体
本研究从中国农业科学院作物科学研究所(ICS)国家作物种质库中获取普通小麦品种/系“大田”、“中国春”、“洋麦158”、“小白麦”、“金麦47”和“汉选10”,用于干旱和盐胁迫下的基因表达分析。“菲尔德”、“中国春”和“洋麦158”对干旱敏感,“小白麦”、“金麦47”和“汉玄10”对干旱耐受性较好。小麦品系采用大田和小白麦TaOAT亚细胞定位实验中的基因克隆和原生质体分离。同时,将大田菌置于条件可控的生长室中进行表达分析TaOAT基因在不同的组织和农杆菌属介导的转换。用于染色体定位的中国春季零染色体系N5A/T5B、N5B/T5A和N5D/T5A由中国科学院林志山教授提供。目的基因亚细胞定位的载体p16318由中国科学院徐兆石教授提供。诱饵向量pGBKT7祈祷矢量pGADT7酵母的两种杂交试验购自Clontech Laboratories (Takara Bio USA, Inc.)。表达载体pWMB110小麦转化是由我们的实验室之前构建的[37]。
序列检索
拟南芥AtOAT(accession# At5g46180)作为查询序列,使用IWGSC数据库(https://urgi.versailles.inra.fr/),使用默认参数对所有染色体支架进行IWGSC Ref Seq v1.0对照。基于在线FGENESH+工具(http://www.softberry.com/),这一结论得到了Ensembl植物数据库(http://plants.ensembl.org/index.html),并使用GSDS2.0 (Gene Structure Display Server 2.0,http://gsds.cbi.pku.edu.cn/index.php).
gDNA和总RNA的提取及cDNA的合成
gDNA采用核仁植物基因组DNA试剂盒(CWbio Inc., Beijing China)提取。DNA托盘溶解在ddH中2O和量化以供进一步使用。总RNA提取于不同植物组织(根、茎、叶、种子、颖片、外稃、古茎、雄蕊和雌蕊)和不同发育阶段(即分蘖、抽穗、抽穗和灌浆)。为了进一步调查TaOAT在小花发育中表达,穗在9个不同的穗发育时期收集。这些小穗发育时期根据小麦和大麦的鳞片分为七个小穗发育阶段[38,39]。使用TRIzol试剂盒(天根生物技术北京有限公司)提取总RNA,使用cDNA合成试剂盒(CWbio公司,北京中国)根据各自制造商的协议合成cDNA,并在- 20°C保存以作进一步分析。
全长克隆TaOAT基因
对假定的序列进行比对TaOATDNAMAN(林农公司)的基因。基因组特异性引物对(GSP)基于假定的5 ' -和3 ' -非翻译区(UTR)使用primer premier 6 (premier Biosoft)设计1表S3)。PCR成分为50 ~ 100 ng cDNA,每个dNTP 0.2 mM, 10× KOD缓冲液2 μl, MgSO 1 mM4正向引物和反向引物各0.5 μM, KOD (Toyobo) 1 U, 10% DMSO 0.6 ul,总体积为20 μl。PCR反应在ABI热循环仪(ProFlex PCR)上使用以下循环条件进行:初始变性温度为95°C,持续5分钟,然后是35个循环,分别为95°C 30秒、60°C 30秒、72°C 1分钟和30秒,最后延长至72°C 8分钟。隔离TaOAT-5DL采用巢式PCR或两步PCR,在98°C的热循环条件下进行4 min,然后进行35个循环,98°C 15 s, 68°C 1 min 30 s,最后在72°C下延长8 min。将PCR产物连接到拉钮T简单载体(TIANGEN, China)导入DH5α大肠杆菌按照厂家的建议进行排序。
染色体定位
确定小麦三个等位基因的染色体位置TaOAT利用小麦第5染色体组所涉及的中国春季零染色体系基因,利用GSP(附加文件)进行PCR扩增2表S3)。PCR条件与上述相同,只是扩增时间延长了50 s。
taat的亚细胞定位
利用TargetP (http://www.cbs.dtu.dk/services/TargetP/)及米妥普罗(https://ihg.gsf.de/ihg/mitoprot.html).的保守序列燕麦基因由WebLogo (http://weblogo.threeplusone.com/).物种的名称和它们的预测列在(附加文件)中2:表1)。为了证实这个预测,完整的ORFTaOAT-5BL在帧内与绿色荧光蛋白(GFP)载体上游融合p16318在35S启动子的控制下为了进行瞬时表达实验,从14天的小麦幼苗中分离原生质体,用1 μg的质粒转化原生质体。转化后的原生质体在28℃的黑暗环境中孵育16-20 h。然后,使用线粒体特异性染料(MitoTracker Orange, Invitrogen)对线粒体进行染色,然后使用蔡司LSM700显微镜(蔡司德国)在488和543 nm照明下对原生质体进行显微镜检查。
计算机分析
利用Mega 6.0软件(http://www.megasoſtware.net)构建系统发育树。采用最大似然法,随机重复1000次。以taat氨基酸序列作为NCBI和IWGSC蛋白数据库的查询,进行BLASTp检索。共使用了65种植物,其中单子叶植物20种,双子叶植物45种,其名称和收录号见(附加文件)2表2)。从同一种植物中去除冗余序列。为了找到与干旱反应调控有关的基序,每个基因上游的1000个碱基对(TaOAT-5AL,TaOAT-5BL和TaOAT-5DL),选取起始密码子进行研究独联体-使用PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).为了探索taat的假定功能,我们使用了STRING数据库(https://string-db.org/)的蛋白质相互作用。
酵母双杂交试验
利用酵母双杂交法对预测的TaARG与taat的STRING互作进行了验证。TaOAT-5BL将不带跨膜螺旋的编码序列克隆到诱饵载体中pGBKT7而编码序列为TaARG-2BS无跨膜螺旋克隆到祈祷载体pGADT7使用特定的引物(附加文件2表S3)。根据制造方案(酵母制造商™酵母转化系统2,Takara Bio Clontch实验室,Inc.),将诱饵和猎物载体共同转化为新鲜制备的酵母能态细胞。
向量构建与小麦变换
等位基因TaOAT-5BL作为目标基因构建过表达载体。目的基因用BamH1和从小型然后将酶插入消化物中pWMB110(附加文件1:图S9)在玉米ubi启动子控制下,用相同的酶在MCS上形成新的重组载体pWMB206(无花果。8a).将新向量变换为根癌土壤杆菌菌株C58C1的三亲杂交[40],并进一步将其引入小麦品种菲尔德的未成熟胚胎中,利用上述方法产生转基因植物[37,41]。
转基因小麦植株的检测
采用QuickStix试剂盒(EnviroLogix,美国)检测转基因小麦叶片的选择标记酒吧吉恩根据制造商的说明和我们之前的出版物[41]。的存在TaOAT-5BL用其特异性引物进行PCR扩增检测(附加文件2表S3)。PCR反应在ABI热循环仪(ProFlex PCR)上使用以下循环条件进行:初始变性温度为95°C,持续5分钟,然后是35个循环,分别为95°C 30秒、60°C 30秒、72°C 1分钟和30秒,最后延长至72°C 8分钟。将转基因植株自交2次进行单合子检测,并选择3个独立稳定的转基因品系进行功能分析。的表达式TaOAT-5BL用特异引物进行半定量PCR检测(附加文件2表S3)。PCR反应在ABI热循环仪(ProFlex PCR)上使用以下循环条件进行:初始变性温度为95°C,持续5分钟,然后是25个循环,95°C持续30秒,60°C持续30秒,72°C持续20秒,最后延长至72°C持续5分钟。
应力处理设计
对3个抗旱品种(小白麦、金麦47和汉选10)和3个敏感品种(菲尔德、中国春和扬麦158)的成熟种子进行70%乙醇表面消毒,然后用消毒液水洗2次。种子在培养皿中发芽,培养皿中含有用蒸馏水浸泡过的滤纸。发芽一周后,将幼苗移入直径6.5 mm的大罐中,并保持湿润。当初生叶长到约20 cm时,幼苗暴露在50%-PEG4000的胁迫下。在非生物胁迫处理0、5、10、20、40 h后采集叶片,立即冷冻于液氮中提取RNA。同样,盐胁迫试验,苗期在瓶中加入200 mM NaCl溶液。分别于盐胁迫后0、10、20和40 h采集叶片样品。
十个成熟的胚胎TaOAT-5BL用25%次氯酸钠和70%酒精灭菌后,在3个重复的培养箱中接种1/ 2ms 150 mmol NaCl培养基,鉴定过表达小麦系和野生型的耐盐性。在光密度为100 μmol m的光照条件下,25℃培养30 d−2年代−1光周期为16 h亮/8 h暗。接种后8 d,计算发芽率。接种30 d后,测定植株成活率和根冠长。在耐旱性试验中,将转基因植株和野生型播种在装有田间天然土壤的托盘中,在24°C条件下白昼16 h, 16°C条件下夜间8 h的温室中。截水开始于三叶期。根据先前描述的方法,在截水后17天测量小麦植株中的游离脯氨酸水平[42]。
实时定量RT-PCR
的守恒域TaOAT设计ORF区、基因特异性引物对。qRT-PCR在Applied Biosystems™7500 Real-Time PCR系统上进行。PCR反应的总体积为20 μl。每个反应含有10 μl 2× SYBR Premix Ex Taq, 400 ng cDNA,每种引物0.2 μM, ROX对照染料II 0.4 μl, ddH 6.8 μl2O (SYBR PrimeScript RT-PCR试剂盒,TaKaRa,大连,中国)。PCR样品在95°C下预热10 min,然后进行40-45个循环,95°C 15 s, 60°C 30 s, 72°C 30 s。一个组成性表达的小麦基因,TaADP,用于基因转录水平的规范化。所有的反应都是在三个生物重复中进行的。
数据和材料的可用性
本研究克隆的基因序列已存入国家生物技术信息中心(NCBI),并可在核苷酸数据库(https://www.ncbi.nlm.nih.gov/nuccore/?term=)或所有资料库(https://www.ncbi.nlm.nih.gov/search/),编号为MK942062, MK942063, MK680533和MK748213TaOAT-5AL-1,TaOAT-5AL-2,TaOAT-5BL,TaOAT-5DL,分别。所有材料均可根据要求从作者处获得。
缩写
- ABRE:
-
脱落酸响应元件
- bZIP:
-
基本亮色拉链图案
- 衣服:
-
脱水反应元件
- 之前:
-
乙烯反应元件
- GSA:
-
Glutamyl-5-semialdehyde
- GSP:
-
Genome-specific引物
- HSE:
-
热冲击元件
- IWGSC:
-
国际小麦基因组测序联盟
- LTR:
-
低温响应元件
- 南京:
-
Nam, ataf, cuc
- MYB:
-
成髓细胞瘤
- 燕麦:
-
鸟氨酸转氨酶
- 子:
-
开放式阅读框
- P5CR:
-
Pyrroline-5-carboxylate还原酶
- P5CS:
-
1-吡咯-5-羧酸合成酶
- 聚合酶链反应:
-
聚合酶链反应
- 存在:
-
定量反转录PCR
- 挂钩:
-
聚乙二醇
- 正方观点:
-
脯氨酸
参考文献
Brenchley R, Spannagl M, Pfeifer M, Barker GL, D'Amore R, Allen AM, McKenzie N, Kramer M, Kerhornou A, Bolser D,等。面包小麦全基因组霰弹枪测序分析。大自然。2012;491:705-10。
李建军,李建军,李建军,等。植物激素介导的干旱信号通路的功能基因组学分析。中国生物医学工程学报,2017;
李建军,李建军,李建军,等。干旱胁迫对植物生理生理的影响。In:植物非生物胁迫信号的阐释。纽约:Springer NY;2015.p . 195 - 225。
威尔基SE,沃伦·MJ。三种天门冬氨酸转氨酶同工酶的重组表达、纯化和鉴定拟南芥。中华医学杂志。1998;12:381-9。
脯氨酸:一种多功能氨基酸。植物科学进展,2010;15:89-97。
Senthil-Kumar M, Mysore KS。鸟氨酸-delta-氨基转移酶和脯氨酸脱氢酶基因通过调节吡咯-5-羧酸盐代谢诱导的超敏反应在非宿主疾病抗性中发挥作用。植物生态学报,2012;35(5):559 - 559。
Sánchez E, López-Lefebre LR, García PC, Rivero RM, Ruiz JM, Romero L.绿豆植株脯氨酸代谢对最高氮用量的响应(菜豆l .简历。罢工)。植物生理学报。2001;28(2):593 - 598。
刘超,薛忠,唐东,沈勇,石伟,任磊,杜刚,李勇,程铮。鸟氨酸δ -氨基转移酶通过调控水稻氮素再利用对小花发育和结实率的影响。植物学报。2018;36(6):842 - 854。
鸟氨酸-delta-氨基转移酶在精氨酸分解代谢中是必需的,但在脯氨酸生物合成中不是必需的。植物学报,2008;8(4):481 - 481。
王晓明,王晓明,王晓明,等。利用反式互补克隆乌头鸟氨酸三角洲转氨酶cDNA大肠杆菌以及脯氨酸生物合成的调控。生物化学学报。1993;28(2):387 - 398。
Roosens NH, Thu TT, Iskandar HM, Jacobs M.盐胁迫下鸟氨酸-delta-氨基转移酶cDNA的分离及其表达的影响拟南芥。植物生理学报。1998;17(5):663 - 671。
李建军,李建军,李建军,等。鸟氨酸转氨酶对nacl处理萝卜子叶脯氨酸积累的影响。植物学报。1995;18:205-10。
游静,胡辉,熊磊。鸟氨酸δ-氨基转移酶基因OsOAT赋予水稻耐旱性和抗氧化性。植物科学,2012;19(1):59 - 69。
刘建军,刘建军,刘建军,刘建军,刘建军,刘建军,刘建军,刘建军,刘建军,等。红花G-box结合因子1和2基因的克隆及表达分析。植物化学学报。2001;45(5):477 - 488。
李春华,李春华,李春华,等。水稻储存蛋白谷氨酸基因在水稻胚乳特异性表达中的调控作用。植物科学。1996;21(1):63 - 73。
佘敏,王健,王鑫,尹刚,王凯,杜磊,叶霞。普通小麦及其祖先种精氨酸酶编码基因的综合分子分析。科学通报,2017;7:6641。
王晓明,王晓明,王晓明,等。干旱和低温胁迫下植物基因表达的调控网络。植物学报,2003;6(6):1010 - 1010。
安华,佘敏,王凯,叶晓霞。鸟氨酸转氨酶(OAT)在植物抗逆性中的生物学作用研究进展及展望。中国生物医学工程学报,2018;19(3):381 - 391。
Da Rocha IMA, Vitorello VA, Silva JS, Ferreira-Silva SL, visamias RA, Silva EN, Silveira JAG。外源鸟氨酸是一种有效的前体,δ-鸟氨酸氨基转移酶途径有助于高氮循环条件下腰果叶片脯氨酸的积累。植物生理学报,2012;39(1):1 - 9。
杨春伟,高翀。鸟氨酸-δ-氨基转移酶对水分胁迫下水稻离体叶片脯氨酸积累的影响。植物学报。1999;27:191-4。
吴玲,范忠,郭玲,李艳,张伟,曲丽娟,陈哲。an的过度表达拟南芥δ-OAT基因增强了转基因水稻的耐盐性和抗旱性。科学通报,2003;48:2594-600。
杨建军,李建军,李建军,等。鸟氨酸-δ-氨基转移酶的克隆及其对脯氨酸的影响。摩尔·布里。2002;9:73-80。
王晓明,王晓明,王晓明,等。NAC转录因子在植物非生物胁迫应答中的应用。生物化学学报(英文版);2012(3):387 - 398。
崔超,黄善,方二,权四,朴老,安一,金比比,黄DJ。与W-box-like element 1结合的Oryza sativa WRKY6的分子特征栽培稻致病相关(PR) 10a启动子,降低了对病原体的易感性。植物学报,2015;08:846 - 859。
Rinerson CI, Scully ED, Palmer NA, donz - reiner T, Rabara RC, Tripathi P, Shen QJ, Sattler SE, Rohila JS, Sarath G.柳枝稷WRKY转录因子家族与衰老的关系。生物医学工程学报。2015;16:912。
高华,王艳,徐鹏,张铮。WRKY转录因子TaWRKY2的过表达提高转基因小麦的抗旱性。植物学报,2018;9(9):997。
胡慧,尤杰,方勇,朱鑫,齐铮,熊林。转录因子基因的表征SNAC2赋予水稻耐寒耐盐性。植物化学学报。2008;37(2):389 - 391。
洪燕,张辉,黄磊,李东,宋峰。应激反应性NAC转录因子基因的过表达ONAC022提高水稻的耐旱性和耐盐性。植物学报,2016;7:4。
王刚,张生,马鑫,王勇,孔飞,孟强。番茄逆境相关NAC转录因子SlNAC35在生物和非生物胁迫中的积极作用。植物物理学报,2016;38(4):444 - 444。
于鑫,刘燕,王生,陶艳,王铮,舒燕,彭慧,Mijiti A,王铮,张宏。鹰嘴豆nac型转录因子CarNAC4对干旱和盐胁迫的增强作用拟南芥。植物学报,2016;35(5):613 - 27。
Gunapati S, Naresh R, Ranjan S, Nigam D, Hans A, Verma PC, Gadre R, Pathre UV, Sane AP, Sane VAg . herbaceum转基因棉花的根系生长得到改善,抗旱能力增强拟南芥。科学通报,2016;6:24978。
李建军,李建军,李建军,等。aptala2基因对玉米小穗分生组织命运的调控。基因工程学报。1998;12(1):1 - 5。
Chuck G, Meeley R, Hake S. AP2基因调控玉米花分生组织起始和分生组织细胞命运ids1和sid1。发展。2008;135:3013-9。
Chuck G, Meeley R, Irish E, Sakai H, Hake S.玉米雄穗子4的microRNA调控性别决定和分生组织细胞命运。生物医学学报。2007;39:1517。
Nair SK, Wang N, Turuspekov Y, Pourkheirandish M, Sinsuwongwat S, Chen G, samameri M, Tagiri A, Honda I, Watanabe Y,等。大麦的闭雌花是由抑制microrna引导的hvap2mrna切割引起的。科学通报,2010;37(4):391 - 391。
朱庆华,贺立伟。miR172对植物花期和花型的调控。[J] .中国生物医学工程学报,2011;32(2):487 - 498。
王凯,刘宏,杜磊,叶霞。无标记转基因小麦的遗传育种农杆菌属-介导的中国商品小麦品种共转化策略植物学报。2017;15(3):614 - 623。
Kirby E, Appleyard M.谷物开发指南第二版。斯通利:国家农业中心耕地单位;1987.
郭忠,陈东,Schnurbusch T.面包小麦花发育过程中花药和子房大小的变异成分、遗传力及相关分析。[J] .中国生物医学工程学报,2015;33(6):591 - 591。
李建平,李建平,李建平,等。革兰氏阴性菌基因克隆技术的研究进展根瘤菌meliloti。中国科学d辑,1980;37(3):347 - 351。
石田Y, Tsunashima M, Hiei Y, Komari T. Wheat (小麦L)利用未成熟胚胎进行转化。农杆菌属协议。纽约:斯普林格出版社;2015.p . 189 - 98。
张刚,陈敏,李磊,徐铮,陈旭,郭军,马勇。大豆的过表达GmERF3AP2/ERF型转录因子可提高转基因烟草对盐、干旱和疾病的耐受性。[J] .中国生物医学工程学报,2009;30(1):391 - 391。
致谢
我们感谢澳大利亚莫道克大学的马武军博士和杨荣昌博士发起了小麦的OAT合作研究。我们也要感谢中国农业科学院作物科学研究所徐兆石博士和林志山教授分别提供了GFP载体p16318和中国春季零基因组线N5A/T5B、N5B/T5A和N5D/T5A。
资金
国家自然科学基金项目(31771788)和宁夏科技厅综合重点项目(2019BBF02020)资助。创始机构在研究的设计、数据的分析和解释以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
实验由XGY构思和监督。AA和MYS进行了生物信息学分析和基因克隆。AA对靶基因及其编码蛋白进行了分子分析、功能分析以及染色体和亚细胞定位。AA和KW分析目的基因的表达谱。KW进行了小麦遗传转化。稿件由AA、MYS、XGY共同起草,并经全体作者批改同意。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1
:图S1。的基因结构TaOAT-5AL源自六轴体小麦(一个)和四倍体小麦(b).图S2。T→C取代的存在导致了两种类型的TaOAT-5AL与一种类型的成绩单相比TaOAT-5BL和TaOAT-5DLtranscipts。图S3。植物OAT蛋白系统发育树。基于氨基酸序列比对构建了最大似然树。OAT后面的三个字母是英文中植物名称的缩写拉丁(附加文件2表2)。节点上的数字表示由自举分析确定的主要分支的置信度。图S4。65种植物的WebLogo显示其序列保护率超过75%。图S5独联体的启动子区发现的作用元素TaOAT基因。图S6的预测功能伙伴TaOAT基因。所有的彩色节点都代表了交互作用的第一层TaOAT-5BL基因。邻域、基因融合和共现被分类为基于在其他物种基因组中经常观察到的相互作用或基因家族在基因组中的发生而预测的相互作用。实验表明,通过室内实验确定的相互作用在其他品种中进行,并将信息传递给小麦,以找到预期的相互作用TaOAT-5BL相互作用的伴侣基因。数据库显示相关物种中已知的代谢途径,然后在目标物种中预期的相互作用。分数代表显著互动的水平。图S7阳性检测TaOAT-5BLT0植物。(一个)阳性筛检TaOAT-5BL利用特异引物进行PCR扩增(附加文件)2表S3)。1-35:假定的转基因植物;P:表达载体pWMB206作为阳性对照;N:野生型Fielder为阴性对照;W:水(b)用QuickStix试剂盒筛选阳性植物。两条条带表示阳性植物,一条条带表示阴性植物。图S8成熟胚胎的发芽状况TaOAT-5BL转基因系和野生型大田手在150mm含盐培养基上。(一个)接种后8天萌发情况。(b) 3个转基因株系(OE-F7、OE-F8和OE-F9)及其野生型(FC)的发芽率图解。数据为3个重复的平均值,统计学分析采用IBM-SPSS统计20。黑体小写字母表示组间差异显著(α < 0.05),采用Duncan 's多重极差检验。条形图表示平均值的标准误差。图S9父向量pWMB110用于构造包含的表达式向量TaOAT-5BL小麦的转化基因。
附加文件2
:表S1利用TargetP预测植物OAT的线粒体靶向性。表S2用于系统发育分析的OAT蛋白序列的加入号。表S3本研究设计和使用的引物。
附加文件3。
相互作用的蛋白质序列。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
Anwar, A., She, M., Wang, K.。et al。植物的克隆及分子特性小麦鸟氨酸氨基转移酶(TaOAT)编码基因。BMC Plant Biol20.187(2020)。https://doi.org/10.1186/s12870-020-02396-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02396-2
关键字
- 小麦
- 鸟氨酸转氨酶
- 耐旱
- 盐耐受性
- 小花发展