摘要
背景
全球变暖将扩大果园中新的侵入性病原体的范围,进而增加疾病流行的风险和经济损失。开发新的抗性植物品种有助于减少病原体的影响,但是,由于植物的生长速度和抗性基因的可用性,育种速度可能非常缓慢。柑桔溃疡病(XCC)、黄龙病(HLB)、柑桔腐病(CTV)等严重病害对柑桔林木造成了巨大的危害。利用早熟的转基因三叶橙与高表达的转基因三叶橙进行融合,建立了一种将近缘种抗病基因引入商品品种,以缩短抗病育种周期的快速育种系统CiFT和马斯。本试验将三叶柑桔抗CTV的特性应用于柑桔种质资源。
结果
通过快速育种系统在一年内完成了通常需要至少5年时间的一代回交育种。利用相应的DNA标记进行连锁分析,发现CTV抗性和T-DNA整合区存在于不同的连锁群中,并在BC子代中独立分离。用MAS法在每一代BC子代均可获得CTV抗性零分离株,该分离株剔除了基因组中的T-DNA整合区,并通过免疫分析证实其对CTV的抗性。公元前几3.成功获得除CTV抗性单倍型区段外,其他遗传背景均已代入柑桔种质资源的空分离子。CGH和NGS分析显示T-DNA整合区在零分离子中安全分离出来。
结论
与传统杂交育种技术相比,快速育种系统有望缩短所需育种时间的五分之一以上。利用这个系统,我们得到了BC3.-8除CTV抗性位点外,其他遗传背景均被成功替代,可作为一种新的柑桔育种材料。该快速育种系统将有助于将柑桔近缘种的重要性状引入柑桔种质资源,同时大大减少育种所需的时间。
背景
柑橘、苹果、桃子等果树,一般育种周期较长,通过常规杂交育种培育新品种,至少需要十几年,如果不是更多的话。这种较长的繁殖期主要是由于多年生树木的幼期较长;对果树来说,这从3年到15年不等,甚至更久[1].最近,由于气候变化导致的全球变暖加剧,水果行业面临着不可避免的问题。全球变暖将增加果园中新的侵入性病原体流行的风险。开发新的抗性品种是保护水果产业免受这些即将到来的问题的关键缓解方式之一。一般植物抗病育种采用常规育种方法,即将已知品种与抗病源进行杂交,然后选育抗病株系。然而,由于育种需要时间和缺乏自然抗性资源,用这种方法开发新品种所需的时间实际上无法与新疾病流行的发展和传播同时发生。柑橘溃疡病由黄citri pv。citri(XCC)、黄龙病(HLB)引起的CandidatusLiberibacter和citrus tristeza virus (CTV)是对世界各地柑橘园造成严重破坏的三大细菌性和病毒性疾病。目前还没有有效的HLB管理策略,因为耐药性的来源仍然未知,建议将受感染的树木清除,以防止其进一步传播。金橘(Fortunella spp)及三叶橙(枳壳trifoliataL. Raf.),与该属密切相关柑橘类与普通柑桔有性亲缘关系,分别对XCC和CTV具有较高的抗性。一些商业和常规品种对这些病害具有一定的田间抗性,但它们的抗性可能受多基因控制,抗性表型在育种群体中可能会崩溃。因此,柑橘育种家希望将金桔和三叶橙的遗传抗性引入商业品种。但果实品质低(低糖、高酸、苦等)、果实小、果皮硬、刺长等不利性状,使其在抗病育种的进展上犹豫不决。由于柑橘树的少年期超过5年,一个新品种从开发到被栽培用于日本的商业运输可能需要大约20年的时间。2].一种属间杂交品种“US119”是在美国开发出来的[3.],以及日本的“Kankitsu Chukanbohon no8 Gou”(“nou8”)[4]作为抗CTV的育种资源发布,但回交品系“US119”和“nou8”都具有来自三叶橙的不利性状,如高酸度、酸性和长刺等。因此,需要进一步的回交来去除这些不利性状。标记辅助选择(MAS)系统已被引入到传统柑橘育种中,利用DNA标记来提高CTV抗性[5),雄性不育(6和monoembryony [7].在日本,MAS可以通过种植目标性状的幼苗,提高有限的田间育种空间的效率。然而,减少长繁殖期以前一直是一个问题,没有可用的解决方案。
在过去的十年中,为了减少长时间的幼年期,人们开展了各种努力,从而使果实性状的评估和杂交柑橘种子的获得都能更早发生。柚子(柑橘最大值(蛇)。(Merr.)和葡萄柚(c .天堂金花蛇Macf。)8].当遗传背景转移到栽培柑橘种质中时,其早熟表型的分子机制尚不清楚,表型不稳定或消失。这使得利用这种表型来缩短传统育种周期变得困难。的描述拟南芥在过去的十年中,利用多个基因来减少木本多年生植物的长幼期[9].在柑橘方面,Peña等人(2001)成功地缩短了甜橙(素类奥斯贝克)和三叶橙,两者都有引入APETALA1(AP1)或多叶的(LFY) [10].其中一个基因的异位表达使转基因柑桔在1年半内可育花和果实。这两个基因对无融合生殖后代和合子后代表型的影响不同。他们报告说,AP1效率比LFY因为AP1在营养生长中引发的异常较少LFY.Endo et al.(2005)通过引入柑橘成功地缩短了三叶橙的生成时间开花轨迹T(CiFT).Endo等人(2009)开发了一种CiFT共表达载体系统,驱动靶基因与CiFT35S启动子,成功地对三叶橙进行了香气工程,降低了几年后的柠檬烯含量农杆菌属接种(11,12].Velázquez等人(2016)开发了一种柑橘叶满地virus-based向量(clbvINpr-AtFT而且clbvINpr-CiFT)和接种了这两种载体的不同基因型柑橘植株在4至6个月内开始开花,与未接种的成年植株相比,植株的结构、叶片、花朵或果实形态没有改变[13].因此,利用开花基因的转基因技术可以大大加快结果性状的遗传研究。
近年来,利用早花期转基因植物与MAS相结合的方法来缩短果树的繁殖期已被报道。在苹果公司马吕斯×释放有)育种,过表达一个完整同源基因的转基因早花植物(BpMADS4)与具有抗火枯病基因的野生种T1190 (Fb-F7)进行杂交马吕斯[14].早花期转基因F1与具有苹果赤霉病抗性基因(Rvi2而且RVi4), 98/6-10具白粉病抗性基因(Pl-1而且Pl-2),从而在转基因BC中形成由MAS实现的多元抗性基因金字塔1幼苗。当这些子代的基因座不同时,T-DNA插入位点可以与目的基因独立分离。结果表明,携带T-DNA的子代在播种后15 ~ 40周内开花。然后,不同的转基因株系与不同的基因位点的T-DNA插入窝藏BpMADS4,构建与各种抗性基因相容工作的基因,旨在在育种系统快速循环结束时选择非转基因零分离子[15].他们终于成功地生成了BC4在温室中7年后产生抗火枯病和苹果痂病的零子代[16].此外,Yamagishi et al.(2011)还开发了一种苹果快速开花系统苹果潜伏球形病毒向量表示一个英国《金融时报》基因的拟南芥(FT-ALSV) [17].FT-ALSV受感染的苹果幼苗在播种后2个月内开花,7个月内获得下一代种子,此时早熟花的花粉可以用于授粉。大多数下一代幼苗从FT-ALSV受感染的苹果没有病毒FT-ALSV也可以通过高温处理消除[18].这些快速循环育种系统最大限度地发挥了BC育种的潜力,利用MAS进行遗传背景置换,将野生物种的重要基因引入栽培品种。
本文利用早熟转基因三叶橙与MAS相结合的快速育种体系,将三叶橙的CTV抗性引入柑橘种质资源,首次尝试缩短抗病品种的选育周期。早熟转基因三叶橙窝藏p35区域:CiFT(T02 - 11)11]和MAS对CTV抗性的测定提高了BC育种的速度和效率。快速育种系统成功地在最短的时间(1年)内培育出一个育种代,而一般BC育种需要至少5年的时间。T- dna整合区与CTV抗性遗传位点不同0-2-11,它们被独立分离到BC后代中,产生CTV抗性的零分离子,缺乏一个T-DNA整合基因组区,可在每一代BC群体中获得。比较基因组杂交(CGH)和下一代测序(NGS)分析证实了T-DNA整合区在零分离子中的可分离性。结果表明,早熟转基因三叶橙与目标性状的MAS在快速育种系统中是相容的,它们的遗传位点位于不同的连锁群上,且T-DNA整合区不保留在零分离子基因组中。讨论了快速育种系统的有效性和T-DNA集成区在零分离中保留性的评价方法。
结果
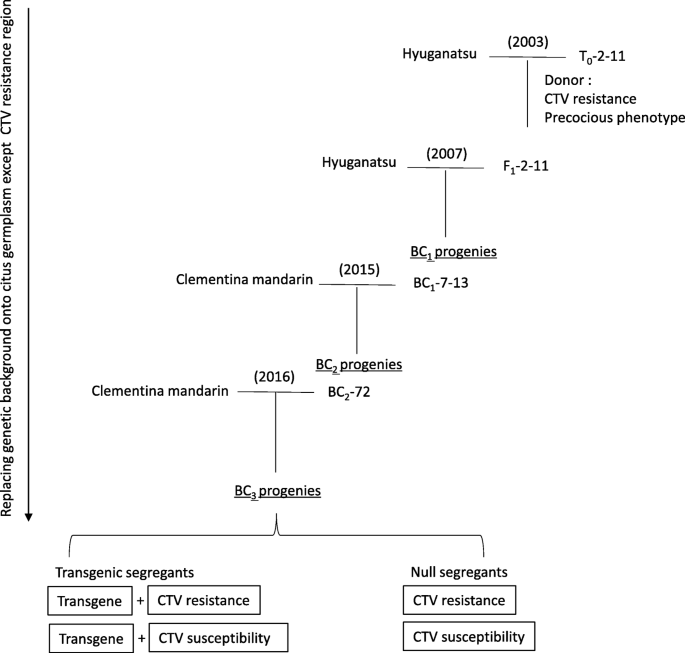
转基因三叶柑桔与“Hyuganatsu”和柑橘的传粉
转基因三叶橙系(T0-2-11),在之前的一份报告中对其分子特征进行了描述[11],作为CTV抗性和早熟表型的供体,用于快速育种系统。T0-2-11只拥有一个T-DNA整合区域的副本35 s:: CiFT在之前的报告中,Southern blot分析证实了这一结果。T的花粉0-2-11与“Hyuganatsu”(c . tamurana长的矮。前田中)和32 F1获得种子(Fig.;1).发芽F1利用CTV选择标记CTg06B [5],以及为转基因设计的特定引物集。2007年,F1-2-11同时具有CTV抗性和转基因,与公元前136年的“Hyuganatsu”花杂交1种子。2015年,BC花粉1-7-13含有这两种基因,与柑橘(c·克莱门蒂娜长的矮。(前田中)和公元前576年2种子。2016年,BC2-72同时含有这两种基因,与公元前146年的柑橘花杂交3.种子。在所有携带该转基因的BC后代中均观察到早熟表型。它们的第一次开花发生在播种后的3周左右,但第二次开花因BC后代个体的不同而不同。BC各子代的花结构均正常,花粉育性和花粉数量均满足授粉需要(图4)。2);这些表型特征与先前报道的相似[11并稳定地传给了下一代。大多数授粉后的花一般都能成果,没有严重的生理落果现象。由于资金的原因,我们的快速育种系统曾有过几次进展停滞的时期,但我们成功地在2015年至2016年一年推进了一个育种代。
利用BC构建遗传连锁图谱1后代
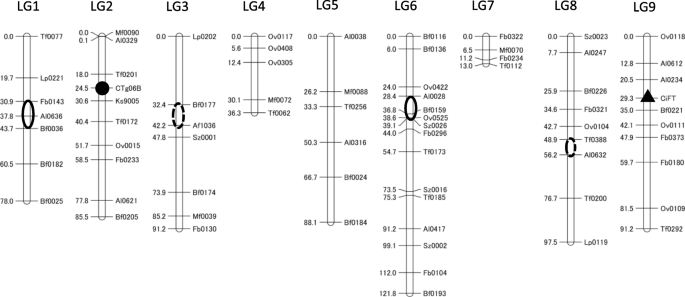
目的鉴定CTV抗性的遗传位点和T- dna整合区0-2-11,利用过去遗传图谱中报道的71个CAPS标记构建遗传连锁图谱[5,19,20.],以及两个CTV抗性DNA标记(Ctg06B)和T-DNA整合区(CiFT).这些标记被应用于公元前125年的基因分型1“Hyuganatsu”和F12 - 1。三叶橙的CTV抗性受单显性基因控制[21],以及控制CTV抗性的遗传位点(Ctv)通过连锁分析和基因组测序分析得到分子特征[5,22,23,24].遗传连锁图谱跨度为702.5 cM,共有73个位点分布在9个LGs中(图2)。3.).CTV抗性的遗传位点和T-DNA整合区分别位于LG2的Tf0201和Ks9005之间和LG9的Al0234和Bf0221之间。他们在公元前被独立隔离1其分离比例约为1:1,与单基因遗传相似(Table1).每个LG平均分配8.1个CAPS标记,这些标记可用于追踪BC后代每个遗传位点的等位基因替换。通过数量性状位点(QTL)分析,将三叶橙的几个不利性状定位在遗传连锁图谱上。控制长刺的qtl定位于LG3上的Bf0177 ~ Af1036 (LOD = 1.08), LG8上的Tf0388和Al0632 (LOD = 1.12),均为弱qtl。控制三叶的qtl定位在LG1上的Fb0143和Bf0036标记之间(LOD = 1.22), LG6上的Al0028和Sz0026标记之间(LOD = 1.32),均为弱qtl。
BC遗传背景替代的评价3.带图形基因分型图的空隔离区
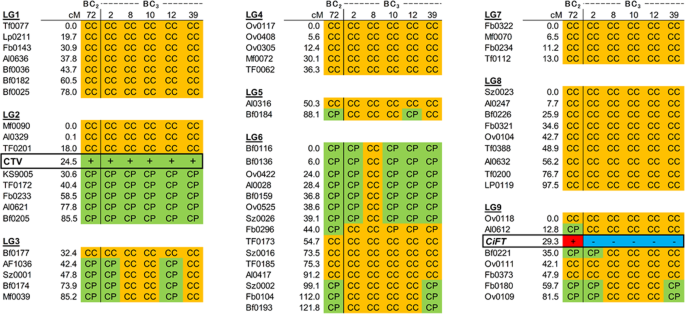
利用61个可溯源三叶橙等位基因的CAPS标记,以及CTV抗性和转基因的DNA选择标记,对三叶橙进行了基因分型3.BC的零隔离3.公元前23.公元前8,3.公元前-10年,3.公元前-12年,3.-39,花粉亲本BC2-72年。DNA诊断使我们能够了解BC后代的遗传组成,并迅速回答了CTV抗性的存在或不存在以及转基因的问题。在无花果。4,将基因分型信息汇总为每个LG的图形型基因分型图。在公元前2-72,在LG2、LG3、LG5、LG6和LG9中发现了三叶橙衍生的包含“P”等位基因的单倍型块。LG1、LG4、LG7和LG8的遗传背景已经被替换为柑橘种质资源的“C”等位基因。在BC的发展过程中从其BC开始2到BC的代3.在第一代中,从这些LGs中随机分离出三叶橙的这些单倍型块,并与柑桔的单倍型块进行替换。对于控制BC花粉亲本三叶橙长刺的qtl2-72在LG8上已经缺失了一个QTL,但在LG3上仍保留了一部分QTL,导致三叶橙与柑橘单倍型发生重组。LG3上剩余的QTL随后在BC的一些地方分离出来3.后代。对于控制三叶的QTL, BC的花粉亲本2-72在LG1上没有QTL,但在LG6上仍然有QTL。LG6上剩余的QTL在某些BC中被分离出来3.但在公元前的大部分研究中,它仍然存在3.后代。这些表型在BC中几乎消失了2和公元前3.后代。
BC的遗传背景3.-8除CTV抗性位点所在的LG2外,其余均成功取代。尽管要完全替代三叶橙的剩余单倍型块,还需要一个世代3.-8可能是一种新的抗CTV的鳜鱼育种材料。因此,该快速育种系统还可以去除三叶橙的一些不利性状,促进育种世代的发展。以上结果表明,从三叶橙和金桔等近缘种导入目标基因或替代遗传背景到柑桔种质可能需要至少4代或以上的时间。
CGH分析检测BC子代的载体构建序列
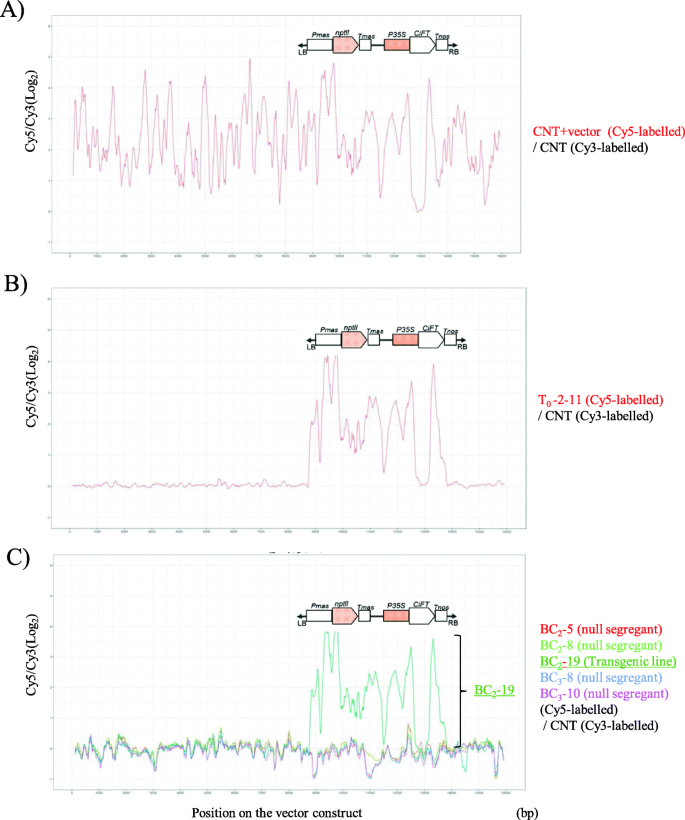
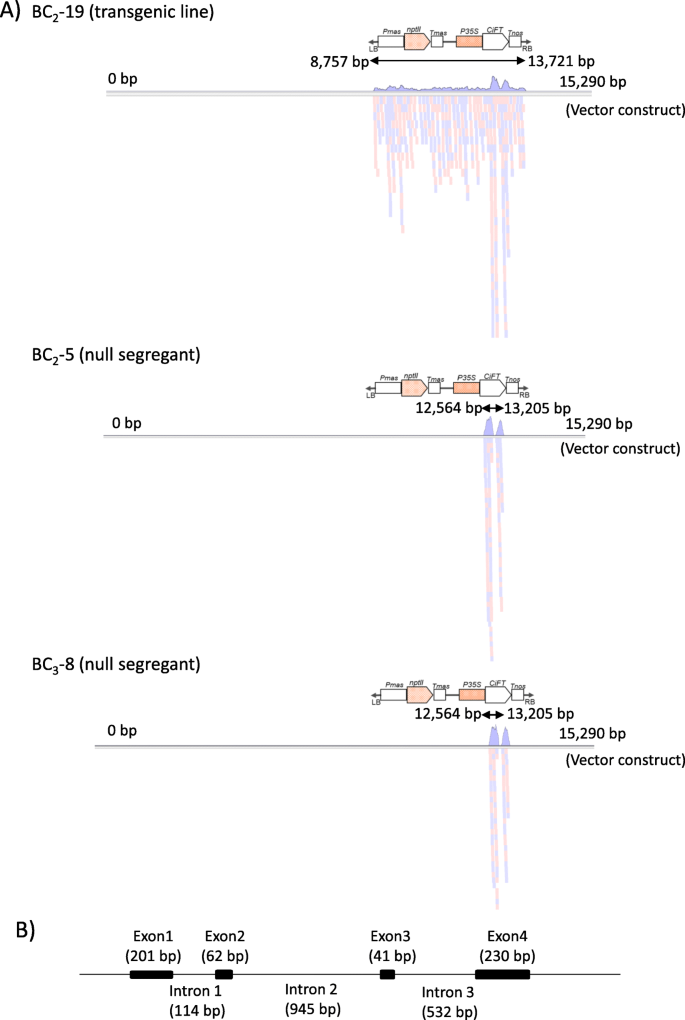
一个定制的CGH阵列由12736个60 mer探针组成,基于15920 bps的核苷酸序列,用于从pCGN157二进制载体生成的载体构建[11].用Cy5标记的花青素5 (Cyanine 5, Cy5)混合非转基因三叶橙(CNT)和载体构建物T0公元前2 - 11,2公元前5,2公元前8,2公元前-19年,3.公元前8,3.-10与Cyanine 3 (Cy3)标记的碳纳米管对照基因组DNA杂交。为了使CGH分析数据可视化,日志2根据探针在向量结构上的位置映射探针的Cy5/Cy3比值。对于cy5标记的CNT和载体构建混合物以及cy3标记的对照之间的杂交,几乎所有探针都能检测到信号(图3)。5a).在整个向量构造过程中,信号模式是上下变化的,而在的一部分周围没有检测到信号CiFT载体构建中的cDNA插入区。低信号和缺失信号的检测可能来自探针不充分、GC含量低和重复序列的序列、对基因组样本的标记效率等。周围丢失的信号CiFTcDNA插入区可能是内源基因基因组片段的干扰所致CiFT。相比之下,T0-2-11和cy3标记的对照显示,这些信号只在载体构建的T-DNA区域检测到,尽管在载体构建的T-DNA区域附近也有一个缺失的信号区域CiFTcDNA插入区域(图5b). T-DNA区域周围的信号强度模式与对照实验几乎相同,说明检测信号模式是可重复性的。数字5c为cy5标记的BC的杂交数据2公元前5,2公元前8,2公元前-19年,3.公元前8,3.-10,带有cy3标记的控件。公元前219为T- dna整合区转基因株系,其信号模式与T- dna整合区株系相似02 - 11。相反,在其余4个缺乏T-DNA整合区(BC)的零分离子中没有检测到稳定信号2公元前5,2公元前8,3.公元前8和3.-10)。因此,CGH分析可用于T- dna整合区提取0-2-11,并证明T-DNA整合区在BC基因组中是缺失的2和公元前3.,零隔离。
NGS分析检测BC子代的载体构建序列
NGS分析作为一种替代方法来检测BC中的向量结构序列2-5(零隔离),BC219(转基因系)和BC3.8(空隔离)。分别获得了4503 Mb、4802 Mb和4746 Mb的Illumina对端reads,超过了组装基因组大小的15倍c·克莱门蒂娜(301 Mb) [25].这些序列通过Genetyx-Genome(软件公司,东京,日本)程序分配到载体构建序列(图。6a).载体构建有15,920 bp的序列,其中T-DNA区域位于8726 bp至13,741 bp之间,两端有25 bp的边界重复序列CiFT从12556 bp插入到13265 bp。BC的对端读序列219个序列分别为载体构建的8757 ~ 13721 bp,与载体构建的T-DNA区域内序列相对应。序列赋值深度在整个向量构造中几乎是一致的,除了CiFT互补脱氧核糖核酸插入区域。与其他向量区域相比,这个区域周围的赋值深度非常高。这可以通过与‘Hyganatsu’、柑橘和三叶橙的内源性FT基因组序列的交叉分配来解释。事实上,在CiFT互补脱氧核糖核酸插入区域。根据T-DNA整合位点附近的相邻序列发现,在Mikan genome Database (MiGD:https://mikan.dna.affrc.go.jp/)(补充表1和无花果。1).BC的对端读序列2公元前5和3.-8只分配给CiFTcDNA插入区从12564 bp到13205 bp。BC中未分配的区域2公元前5和3.-8在长内含子2的位置附近CiFT外显子2和外显子3的短长度夹在中间。6b).因此,NGS分析得到的结果显示,null离析子不具有任何向量结构序列,与CGH分析的结果一致。
CTV电阻的评定公元前2空隔离的免疫学检测
利用快速育种技术,将三叶橙的CTV抗性引入柑桔种质资源。在BC子代的空分离子中,确定CTV标记选择的个体对CTV表型也具有抗性是很重要的。为评估CTV的实际抗性,采用免疫标记法(ImmunoStrip®for Citrus tristeza virus, CTV)完整试剂盒(Agdia)对CTV接种后的空分离子进行免疫分析。随着BC的增长3.具有CTV抗性的零分离子不足以准备接穗进行嫁接,从6个BC处制备接穗2零分离剂,并嫁接在8个月无ctv的粗柠檬(c . jambhiri郁郁葱葱的幼苗。CTV感染的母树“Kiyomi”的接穗,保存在NIFTS中,也被嫁接到中间。嫁接三叶橙和“Hyuganatsu”的接穗分别作为抗性和感病对照。利用Roy等(2010)报道的逆转录聚合酶链反应(RT-PCR)技术,对已经侵染母树“清omi”的CTV株系的基因型进行研究[26].利用‘Kiyomi’母树幼枝生成的cDNA模板进行RT-PCR,检测T36 (accession number: U16304)、B165 (accession number: EU076703)、T3 (accession number: EU857538)、VT (accession number: U56902)和T30 (accession number: AF260651)对应的PCR片段,以及EF1-α和CPG的对照片段(图2)。7a). CPG用于检测5个CTV株系的共同区域,可以检测所有CTV株系,无论CTV基因型可识别还是无法识别[26].虽然检测到的CTV株系之间的片段丰度不同,但我们发现‘清omi’母树被上述5个CTV株系侵染。嫁接两个月后,取接穗叶片进行免疫分析(图2)。7b).嫁接到根茎中部的‘清omi’接穗的所有叶片均检测到CTV病毒。在感CTV的“Hyuganatsu”接穗叶片中也检测到CTV,而在抗CTV的三叶橙接穗叶片中未检测到CTV。在公元前2在BC的叶片中检测到CTV病毒24,公元前2公元前-13年,2-14个接穗经DNA分析判定为CTV易感空分离子。与此相反,在BC的叶片中没有检测到CTV病毒2公元前5,2公元前8,2-12接穗,经DNA分析确定为CTV抗性零分离株。由此,可以确定CTg06B [5]在选择耐CTV BC子代方面非常有效。
用免疫条带法(ImmunoStrip®)检测柑桔tristeza病毒(CTV)成套试剂盒(Agdia)评价无效分离株对CTV的抗性。一个Roy等人(2010)报道了从5个CTV株系中扩增出的PCR片段,这些CTV株系已经通过特定的引物侵染了‘Kiyomi’母树。M: 200 bp梯,1:EF1-α (884 bp), 2: T36 (836 bp), 3: CPG(阳性对照:672 bp), 4: B165 (510 bp), 5: T3 (409 bp), 6: VT (302 bp), 7: T30 (206 bp)。b粗糙的柠檬树嫁接BC2-8(左)和BC2-13个(右)接穗在顶部,侧面嫁接的是CTV感染的母树,Kiyomi接穗。cCTV的免疫学检测。有CTV测试线说明在拍摄过程中发生了CTV传播,没有测试线说明CTV传播受到了抑制。K:‘Kiyomi’接穗母树,T:‘Trifoliate orange’接穗(CTV抗性),H:‘Hyuganastu’接穗(CTV敏感),1:BC2-4接穗(CTV敏感),2:BC2-5接穗(CTV抗性),3:BC2-8接穗(CTV抗性),3:BC2-12接穗(CTV抗性),5:BC2-13接穗(CTV敏感),6:BC2-14接穗(CTV敏感)
讨论
快速育种系统大大缩短了BC育种所需的时间
高水平的基因组杂合度和较长的幼年期是降低传统杂交育种效率的主要障碍。柑橘基因组具有一个天然的系统,通过珠心多胚、性不相容和雄性或雌性不育来保持高杂合性。经济上最重要的柑橘品种起源于四个祖先类群的重复自然种间杂交(c .试布兰科,c .最大值稳定,c .》L。,c . micranthaWester)并具有复杂的种间嵌合基因组[27].现代育种利用这些传统品种的能力受到其复杂杂合子基因组结构的阻碍,而且由于传统品种中观察到的典型表型经常被有性杂交的基因组混合物在其后代中破坏[28].这些观察结果同样适用于日本的育种计划,因为通过系谱分析,目前柑橘经济品种和育种系最初来源于14个柑橘祖先品种有限的遗传资源[29].因此,一般经济品种中最理想的表型性状不是来自于特定品种的特定基因,而是来自于祖先品种中常见的理想等位基因和单倍型组合。日本目前的繁殖种群与其祖先品种杂交后约为第5代。现有育种群体大多表现出高糖低酸、色香好、果粒大、田间抗病等具有重要商业价值的性状,这意味着可以在遗传位点上布置和固定理想的等位基因组合或单倍型块来控制这些性状。如果相关物种与现在的繁殖种群杂交,将需要一段非常长的时间来恢复BC后代的潜力到现在的水平。随着全球气候变暖问题的加剧,XCC、HLB等对柑桔果园造成的严重危害越来越明显。开发具有抗病基因的新品种是非常可取的,但首先需要一个特殊时期的BC育种来促进和发展抗病育种系统。
本研究证明,所研制的快速育种系统可以克服柑桔育种中早熟性较长的问题,大大缩短育种周期。虽然因为预算问题暂时中断了实验,但在一年内成功推广了一代。在与柑桔成花诱导有关的多种开花基因中,如AP1,LFY,终端花,CiFT AGAMOUS-LOKE 24型MADS-box基因等[10,11,30.,31),CiFT结果表明,在快速育种体系中效果良好。由于FT同源在被子植物高度分化物种的开花诱导中起着保守而重要的作用[32, FT同源物已被频繁地用于引起各种植物的早熟表型[33].过度的CiFT结果表明,BC后代表型早熟,花正常,花粉可育。即使将遗传背景替换到柑桔种质上,这种早熟表型在BC后代中也能稳定遗传。携带转基因的BC后代在播种后约3周开花。因此,种子亲本与花粉亲本之间的花期协调对于保证一年完成一代的提升是非常重要的。转基因BC后代在第一次开花后,尤其是将其遗传背景替换到柑桔种质后,无法预测下一次开花时间。在2015年的授粉中,BC2授粉前2个月左右将种子播种到无菌土壤中。然后,从第一朵花上采集花粉,并将其保存在冰箱中。在种子亲本开花前,通过DNA诊断可选择候选花粉亲本。BC子代的T-DNA整合基因组区可以在染色体分离过程中从其基因组中去除。在公元前的苹果,4在7年内获得抗火枯病和苹果痂病的零代,比常规育种快4-5倍[16].考虑到柑橘树平均需要5-10年的少年期[1,该快速通道育种系统有望将育种周期缩短至少5倍。
MAS在快速育种系统中起着重要的辅助作用
在有无CTV抗性和T-DNA插入的BC子代选择中,MAS起着至关重要的作用。如果没有CTV选择标记,则在有限的时间内无法选择候选花粉亲本,无法实现一年一代的提升。本研究以“Hyuganatsu”和柑桔为循环亲本,在快速育种体系中去除三叶柑桔的不利性状。基因分型图显示,从第一次杂交开始,除CTV抗性所在的染色体外,其他染色体从三叶橙型转化为柑桔型需要4代时间。实际上,长刺和三叶弱qtl周围的遗传位点被替换到柑桔基因型中,这些不利表型在BC中几乎消失2和公元前3.后代。遗传背景替换所需的时间与BC自然育种几乎相似[19],所以BC2子代在所有染色体上没有完全替代。他们报告说,64%的染色体至少有一个重组位点,36%的染色体在BC中没有重组位点2揭示染色体重组频率低是BC育种中延长周期的因素之一。的Ctv轨迹是用一个p . trifoliata细菌人工染色体文库及其周围282 kb基因组区Ctv基因座测序[24].根据该序列开发了CTg06B的CTV选择标记,并证实了利用DNA标记进行选择的有效性。增加的标记密度Ctv轨迹将允许选择一个更小的分割期间进一步回交。CTV抗性的目标性状受单基因座控制。因此,BC后代每一代的目标性状和早熟表型分离模式简单。BC各子代间的平均分离比大致符合孟德尔模式的1:1:1:无CTV抗性的转基因士达:无CTV抗性的零分离体:无CTV抗性的零分离体。因此,大约25%的后代理论上可以成为候选最终产物。但是,如果目标性状被分散在多个染色体上的多个基因控制,那么获得最终产品的比率将急剧下降。因此,需要更大的群体规模、更高的连锁标记精度,以及一系列具有单一T-DNA与不同位点整合的早熟转基因株系来获得最终产品。我们开发的DNA标记,如大量的CAPS标记(https://mikan.dna.affrc.go.jp/)和P/M标记[7]将有助于图形基因分型的评价染色体替代和选择单胚胎BC后代从性杂交获得合子胚胎。三叶橙和金桔对疫霉菌、CTV、线虫、XCC等多种病害具有抗性。对这些抗病性的分子解析及其DNA选择标记的生成,对利用快速育种系统进行抗病性育种具有重要意义。
用CGH和NGS分析评估T-DNA插入在零分离子中的可分离性
早熟表型供体T0-2-11,拥有一个T-DNA整合到基因组的副本[11].T-DNA整合区位于Hyuganatsu和F12 - 1。考虑到每个BC世代后代的分离比例均为1:1,在这些BC世代中,T-DNA整合区保持为单个位点。在本研究中,我们采用了两种技术上不同的分析方法和不同的检测目标序列的原则来评估BC空分离子中T-DNA插入的可分离性。在CGH分析中,从vector缩窄序列的两条链中设计60 mer的寡核苷酸探针,与5 bp的载玻片重叠,这些探针平均覆盖整个vector序列,共24次。在Vector和CNT、T混合样本上成功检测到Vector序列0公元前2 - 11,219,尽管这些探针之间的信号强度随矢量区域的变化而变化。技术问题可能会产生信号强度差异,因为探针被强制设计成覆盖整个矢量序列,且探针的序列特异性和熔化温度无法均衡。这种信号图谱在过去的报告中使用基因组平铺阵列被普遍观察到[34].在所有矢量序列中分配NGS序列,除CiFT互补脱氧核糖核酸插入区域。周围的序列赋值深度高CiFT从内生派生的插入CiFT基因在BC的子代,众所周知的序列和内含子-外显子结构CiFT在柑桔及其近缘种中是保守的。CiFT柑橘类特征物种由4个外显子和3个内含子组成,其中第2和第3外显子序列长度短,第1和第2内含子序列长度长。在BC的空分离子的第2和第3外显子附近没有分配任何序列2公元前5和3.-5,由于序列相似性较低,cDNA和基因组序列在第2和第3外显子附近。同时,在公元前219,来自T-DNA整合区域的序列可以成功分配到第2和第3外显子CiFT载体构建中的cDNA插入区域。因此,NGS分析能够正确检测到零隔离系与转基因系组装序列的差异。我们尝试用全基因组测序进行10 × coverage进行评价,在15 × coverage数据中至少对目标向量序列进行了相似深度的测序。因此,两种分析都成功地检测到了基因组中T-DNA整合区域的目标序列。NGS分析在序列水平上比CGH分析提供更详细的信息。事实上,T-DNA整合位点在三叶橙基因组上的位置是通过T-DNA整合位点周围的相邻序列确定的。两项分析都表明,T-DNA整合区在检测的零分离子基因组中没有保留。
结论
发展起来的快速育种系统,克服了柑桔育种中早熟性较长的问题,大大缩短了育种周期。与传统杂交育种相比,它有望将所需时间缩短至少五倍。利用这个系统,我们得到了BC3.-8,其中除CTV抗性位点位于LG2外,其余LG2的遗传背景均被完全取代。公元前3.-8在CGH和NGS两种技术上不同的方法都无法检测到T-DNA整合区,因此可能是一种新的具有CTV抗性的鳜鱼育种资源。我们认为,一旦开发出DNA选择标记,开发的系统可以应用于育种计划的其他目标。近年来,各种新的育种技术(NBT)如转录激活子样效应核酸酶(TALEN) [35和与Cas9 (CRISPR/Cas9)系统相关的聚类规则间隔短回文重复序列[36,已经被开发出来,以实现更快速的基因改造。这些技术需要目标基因序列信息,但大多数重要农艺性状,包括CTV抗性,并不针对其致病基因。与这些新技术相比,已开发的快速育种系统具有优势,可以利用DNA标记通过染色体重组获得负责目标性状的全基因组区域。关于转基因作物监管当局对食品安全和保障的必要性,国家粮食管理局生产的转基因作物经常被讨论。转基因和非转基因之间一个重要的科学区别在于基因组中T-DNA整合区域的保留情况。因此,CGH和NGS分析以及生物信息学分析可以为这一点提供明确的信息。世界上绝大多数商业化的非转基因作物都是采用转基因技术在产生过程中进行初步应用,但最终在染色体分离过程中去除T-DNA整合区。我们希望我们的报告能为NBT监管部门的讨论提供信息,并且通过将相关物种的重要基因纳入柑橘种质资源,快速育种系统将有助于减少抗病育种所需的时间。
方法
植物材料
转基因三叶橙窝藏p35区域:CiFT线路2-11 (T02 - 11)11],在之前的一份报告中曾对其分子特征进行过描述[11],作为CTV抗性和早熟表型的供体。以“Hyuganatsu”或Clementine mandarin(日本Genebank注册号:JP113161)为亲本进行BC育种,替代三叶柑桔到柑桔种质资源中除CTV抗性位点外的遗传背景(图113161)。1).为了防止BC系后代近交衰退,对种子亲本进行了切换。T0-2-11及其带有转基因的后代在−25℃保存至使用。通过杂交获得的种子按照前面描述的发芽和生长[11].这项研究中使用的所有材料都是在日本静冈县Okitsu静冈县的国家农业和食品研究组织水果和茶树科学研究所(NIFTS)培育的。
DNA提取和遗传图谱构建
采用Dellaporta等(1983)所描述的方法,从材料植物的新鲜和完全展开的叶片中提取基因组DNA [37].公元前125年1“Hyuganatsu”和“T”之间的后代0对-2-11进行连锁分析,确定CTV抗性基因的遗传位点和转基因插入位点。利用既往报道的Ctg06B基因标记检测CTV耐药位点[5]如下;Ctg06B的正向引物:5 ' -ccaccagtgcccatctacct-3 ',反向引物:5 ' -gacgcctccttgttgacgata-3 '。转基因采用以下引物组进行检测:转基因正向引物:5 ' - acctccactgacgtaagggatgacg -3 ', CTV抗性基因反向引物:5 ' -acaggattcaatcttaagaaactt-3 '。在三叶橙遗传图谱中共报道了71个CAPS标记[19],并用于构建BC的遗传图谱1后代。CAPS标记分析是根据以往报道的条件进行的[20.],并对限制性内切酶进行修饰(补充表1).利用BC进行连锁分析1软件JoinMap ver的模式。5.0 (Kyazma,瓦赫宁根,荷兰)。采用MapQTL ver进行QTL分析。三叶复叶和长刺的发生率为6.0 (Kyazma,)。由于长刺的长度受到过表达的影响CiFT,公元前601采用不含转基因的空分离子进行QTL定位。采用区间作图法,利用Kruskal-Wallis (KW)检验对长刺和三叶性状的qtl进行检测。LOD > 1.0均值的qtl被认为显著。
BC遗传背景替代的评价2和公元前3.通过CAPS标记分析后代
BC的遗传背景替代2和公元前3.利用图形型基因分型图评估后代。对上述遗传图谱中61个CAPS标记的每个遗传位点进行CAPS分析,确定各位点的基因型。利用上述引物对CTV基因和转基因的存在与否进行了研究。利用9个连锁群的基因分型数据构建图形型基因分型图。BC的遗传背景替换2公元前-72年,3.公元前23.公元前8,3.公元前-10年,3.公元前-12年,3.-39例有代表性。
比较基因组杂交(CGH)分析,以检测BC子代的载体构建序列
一个自定义的CGH阵列被设计用于检测BC子代的向量构造序列,用于生成T0-2-11个以pCGN1547为骨干的转基因亲本[11].使用SureDesign(安捷伦科技,圣克拉拉,加利福尼亚州,美国;https://earray.chem.agilent.com/suredesign/),分别与5 bp的载玻片重叠,设计60 mer的寡核苷酸探针,每条链设计3184个探针。这些探针重复安装在定制的寡核苷酸dna微阵列上,控制探针由安捷伦技术(安捷伦设计号:Agilent-085042)提供,采用安捷伦系统的8 × 15k格式。所有阵列杂交程序都按照制造商的建议进行。取基因组DNA 350 ng,用酶切法运算器我和RsaI,用Cyanine 3 (Cy3)或Cyanine 5 (Cy5)与SureTag Complete DNA Labeling Kit (Agilent Technologies)标记。cy5标记的dna如下:1:non-transgenic control trifoliate orange (CNT), no. 2: CNT with the vector construct; no.3, T02 - 11,没有。4:公元前25,不。公元前5:28,不。公元前6:2-19年,没有。公元前7:3.8,不。公元前8:3.-10年。所有阵列的CNT DNA用Cy3标记作为内部对照。标记的dna用纯化柱(Agilent Technologies)纯化,NanoDrop 1000 (Thermo Fisher Scientific, Waltham, MA, USA)采用Microarray测量模式测定吸光度。将Cy5-和cy3标记的dna混合,在65°C阵列杂交24小时。执行标准洗涤条件。阵列的扫描条件为5 m分辨率,TIFF为20位。采用安捷伦特征提取12.0.3.1软件进行图像分析。数据使用genspring GX ver.14.9软件(Agilent Technologies)进行分析。为了消除各阵列间的系统性偏差,将各探针的Cy5/Cy3值除以各阵列中13个阳性对照探针Dark Corner、SM_01 ~ SM_12的中位数进行归一化处理。数组中每个探针的规范化值。 2 to 8 was divided with the value in arrays No. 1, the negative controls, to remove the effect of nonspecific hybridization to each probe. Sample values of each probe were calculated as log2 ratio, i.e. log2(样本(Cy5/Cy3)/阴性对照(Cy5/Cy3))。根据安捷伦特征提取软件12.0.3.1中的标志描述来评估探针质量。所有8个数组中带有“未检测到”标志的探针都被排除在分析之外。示例日志2数值用于计算20个探针的移动平均值。完整的微阵列数据已存储在NCBI基因表达Omnibus (http://www.ncbi.nlm.nih.gov/gds)系列条目GSE135027。
NGS分析检测BC子代的载体序列
BC基因组DNA2公元前5,2公元前-19年,3.-8使用TruSeq DNA PCR-Free文库制备试剂盒构建平均插入长度为350 bps的Illumina对端(PE)文库。每个文库使用Illumina HiSeq 2000系统中的单通道流单元进行测序,读取长度为100 bp。使用Trimmomatic v.0.36 (ILLUMINACLIP: truseq3 - p -2)对低质量的碱基和Illumina测序适配器进行修剪。fa:2:30:10 LEADING:20 TRAILING:20 SLIDINGWINDOW:10:15 MINLEN:50)和NxTrim(−-minlength 50)用于Illumina PE读取[38].Illumina PE reads与向量结构的引用序列对齐[11]使用Genetyx-Genome ver的测序组装程序。1.1.1在计算机软件Genetyx-Win Ver. 13.0(软件开发)。公元前2公元前5和3.-8为无转基因的零分离子219为转入基因组的转基因分离株。
BC对CTV抗性的评价2免疫检测无效分离
公元前六世纪的后裔2将带有或不带有CTV抗性基因的空分离子嫁接在8月龄的粗柠檬幼苗顶部,将保存在NIFTS中的CTV感染的‘Kiyomi’母树接穗嫁接在中间。利用Roy等人(2010)报道的多重反转录聚合酶链反应(RT-PCR)技术鉴定了侵染母树“Kiyomi”的CTV的基因型[26].以延伸因子1 α (EF1-α)作为母树‘Kiyomi’的内源转录对照,用以下引物扩增PCR片段:正向引物5 ' - aaggctgagcgtgaacgtgg-3 '和反向引物5 ' -acggcaatgtgggaggtgtg-3 '。用RNeasy®植物Mini Kit (Qiagen, Hilden, Germany)从新鲜叶片中提取总RNA,用quantitative®Reverse transcriptkit (Qiagen)提取1 μg纯化总RNA,制备cDNA。PCR反应在ProFlex PCR系统(Applied Biosystems, Foster City, CA)的热循环仪中进行Taq交货®DNA聚合酶(Takara,东京,日本)在报告条件下[26].嫁接两个月后取新鲜叶片检测BC接穗的CTV感染情况2在制造商的指导下,使用ImmunoStrip®用于柑桔tristeza病毒(CTV)完整试剂盒(Agdia, IN, USA)。以“生花柑”和“三叶柑”的接穗为对照,分别进行感病对照和抗性对照。
数据和材料的可用性
完整的CGH分析数据保存在NCBI基因表达总集(http://www.ncbi.nlm.nih.gov/geo/)列于系列条目GSE135027下。
缩写
- 公元前:
-
回交
- 帽子:
-
裂解扩增多态性序列
- 全息:
-
比较基因组杂交
- CTV:
-
柑橘橘树根枯病病毒
- 格林:
-
连锁群
- MAS:
-
分子标记辅助选择
- 门店:
-
新一代测序
参考文献
van Nocker S, Gardiner SE。选育良种快:应用新技术快速部署优良园艺林木作物。如果短杂志2014;1:14022。
日本柑桔育种、遗传和基因组学研究。Sci繁殖。2016;66:3-17。
Hearn CJ, Garnsey SM, Barrett HC。柑桔育种品系US119对柑桔枯病病毒抗性的传播。HortScience。1993; 28:483。
柑橘新亲本“Kankitsu Chukanbohon noou 7 Gou”和“Kankitsu Chukanbohon noou 8 Gou”选育抗柑橘萎黄病毒新品种。如果短杂志2005;74:323。
Ohta S、Endo T、Shimada T、Fujii H、Shimizu T、Kuniga T、Yoshioka T、Nesumi H、Yoshida T、Omura M. PCR引物辅助回交引入CTV抗性基因枳壳trifoliata(l)英国皇家空军。成柑橘类.中国科学:地球科学。2011;20(3):393 - 397。
后藤S,田吉冈,Ohta S, Kita M, Hamada H, Shimizu T.萨摩太孙雄性不育及传递模式的QTL定位。《公共科学图书馆•综合》。2018;13:e0200844。
Shimada T, Endo T, Fujii H, Nakano M, Sugiyama A, Daido G, Ohta S, Yoshioka T, Omura M. MITE插入依赖性表达具有RWP-RK结构域的CitRKD1调控柑橘珠心组织体细胞胚胎发生。植物学报。2018;18:166。
山田Y,伊藤Y,上野I,吉田T.柑橘和金桔幼苗早熟开花。公牛果树Res Stn. 1991; 20:13-23。
Martín-Trillo M, Martínez-Zapater JM。快速成长:控制树的生成时间。生物技术。2002;13:151-5。
Peña L, Martín-Trillo M, Juárez J, Pina JA,纳瓦罗L, Martínez-Zapater JM。拟南芥leaf和APETALA1基因在柑橘中的组成表达缩短了它们的世代时间。生物科技Nat》。2001;19:263-7。
田文华,田文华,田文华,田文华,田文华,田文华柑橘类赋予三叶柑桔早开花表型(枳壳trifoliatal . Raf)。转基因研究》2005;14:703-12。
远藤T、岛田T、藤井H、西川F、杉山A、中野M、清水T、小林Y、荒木T、Peña L、大村M开发ACiFT柑橘花和果实中基因功能分析的共表达系统。日本科学。2009;78:74-83。
Velázquez K, Agüero J, Vives MC, Aleza P, Pina JA, Moreno P, Navarro L, Guerri J.柑橘叶斑病病毒载体诱导幼柑橘早熟开花:一种新的遗传育种工具。植物生物技术学报。2016;14:1976-85。
Flachowsky H, Roux PL, Peil A, Patocchi A, Richter K, Hanke M.高速育种技术在苹果(马吕斯×有明显),基于转基因早花植物和标记辅助选择。新植醇。2011;192:364 - 77。
Weigl K, Wenzel S, Flachowsky H, Peil A, Hanke M. BpMADS4在不同连锁群上的整合提高了苹果快速循环育种系统的利用率。植物学报。2015;13:246-58。
Schlathölter I, Jänsch M, Flachowsky H, Broggini GAB, Hanke M, Patocchi A.一代高级抗火枯苹果(马吕斯×有明显)在7年内进行第五代的选育。足底。2018;247:1475 - 88。
Yamagishi N, Sasaki S, Yamagata K, Komori S, Nagase M, Wada M, Yamamoto T, Yoshikawa N.通过外源表达促进苹果幼苗开花和缩短世代时间拟南芥英尺基因的使用苹果潜伏球形病毒向量。植物化学学报。2011;35(5):393 - 397。
李春春,杨志明,张志明,张志明痘潜伏球形病毒在高温下消除病媒和病毒可以加速苹果和梨的育种。植物学报,2016;
假回交F的遗传连锁图谱构建及图形分型研究2(公元前'2)后代引入CTV抗性枳壳trifoliata(l)英国皇家空军。成柑橘类渐渗现象滋生。Geno. 2015;11:797。
Shimada T, Fujii H, Endo T, Ueda T, Sugiyama A, Nakano M, Kita M, Yoshioka T, Shimizu T, Nesumi H, Ikoma Y, Moriguchi T, Omura M.构建基于708个基因标记的柑橘遗传图谱。Geno. 2014; 10:1001-13。
田文华,田文华,田文华,田文华,田文华,田文华,田文华,田文华,田文华,田文华,田文华,田文华,田文华。柑桔品种和杂交苗木对柑桔疫病毒(CTV)的抗性调查。公牛果树Res Stn B. 1983; 10:51-68。
黄珊珊,肖淑玲,王晓玲,邓卓。柑橘叶枯病抗性基因区域的局部连锁图谱。中国科学:地球科学。1996;
邓智,肖松,黄松,等。柑橘萎黄病毒抗性基因SCAR标记的建立及鉴定枳壳trifoliata.基因组。1997;40:697 - 704。
杨志刚,叶晓峰,刘志刚,刘志刚,刘志刚。柑桔桔枯病抗性基因周围282千碱基区序列分析(Ctv)轨迹枳壳trifoliata中国植物学报。2003;31(3):482 - 482。
吴GA, Prochnik年代,詹金斯J,泥火山U, Hellsten F, Murat X,毕雷矿泉水M, Ruiz年代,Scalabrin J,马尸,她们K, J,也不会Couloux, Jabbari K, Cattonaro F,德尔Fabbro C, Pinosio年代,Zuccolo,查普曼J, Grimwood J, Tadeo FR,艾斯特内尔LH, Munoz-Sanz合资,Ibanez说V, Herrero-Ortega, Aleza P, Perez-Perez J,雷蒙D,布鲁内尔D, F Luro,陈C, Farmerie工作组,Desany B, Kodira C, Mohiuddin M,哈金斯T, Fredrikson介绍K, P,燃烧Lomsadze, Borodovsky M, Reforgiato G, Freitas-Astua J, Quetier F,Navarro L, Roose M, Wincker P, Schmutz J, Morgante M, Machado MA, Talon M, Jaillon O, Ollitrault P, Gmitter F, Rokhsar D.对不同柑橘、柚和橙子基因组的测序揭示了柑橘驯化过程中混合的复杂历史。Nat生物技术。2014;32:656 - 62。
Roy A, Ananthakrishnan G, Hartung JS, Brlansky RH。反转录聚合酶链反应法在柑桔曲菌病毒全球分离株筛选中的应用植物病理学。2010;10:1077 - 88。
García-Lor A, Luro F, Navarro L, Ollitrault P.比较利用InDel和SSR标记解读栽培柑橘遗传多样性的种间结构:遗传关联研究的一个新视角。基因组学。2012;287:77-94。
刘志强,刘志强,刘志强,刘志强,刘志强,刘志强,刘志强,刘志强,刘志强,刘志强,刘志强,刘志强。新一代单倍型分析对柑桔种间核基因组混合性状的影响。BMC麝猫。2014;15:152。
Imai A, Kuniga T, Yoshioka T, Nonaka K, Mitani N, Fukamachi H, Hiehata N, Yamamoto M, Hayashi T.国家柑橘育种计划的遗传背景、近交和遗传一致性。日本Hort J. 2017; 86:200-7。
Pillitteri L, Lovatt CJ, Walling LL。柑橘末端花同源物的分离、鉴定及其与幼年性的相关性。植物杂志。2004;135:1540-51。
孙立明,张军,胡聪。PtAGL24,短V负相/ agamous-like 24 (svp / agl24三叶橙MADS-box基因(枳壳trifoliatal . Raf)。前面。植物科学。2016;7:823。
辛普森GG院长c拟南芥,罗塞塔石的开花时间?科学。2002;296:285-9。
McGarry RC, Klocko AL, Pang M, Strauss SH, Ayre BG。病毒诱导开花:生殖生物学在植物研究和育种中的应用。植物杂志。2017;173:47-55。
Endo M, Kumagai M, Motoyama R, Sasaki-Yamagata H, Mori-Hosokawa S, Hamada M, Kanamori H, Nagamura Y, Katayose Y, Itoh T, Toki S.产生的耐除草剂突变水稻全基因组分析农杆菌属介导的基因打靶。植物生理学报。2015;56:116-25。
jung JK, Sander JD。TALENs:一种广泛应用的目标基因组编辑技术。中国生物医学杂志。2013;14:49-55。
张峰,徐丽萍,张峰,等。CRISPR-Cas9基因工程技术及其应用。细胞。2014;157:1262 - 78。
德拉波特SL,伍德J,希克斯JB。一种植物DNA微型制剂:版本二。植物生物学杂志1983;1:19-21。
Bolger AM, Lohse M, Usadel B. Trimmomatic:用于Illumina序列数据的灵活修剪器。生物信息学。2014;30:2114-20。
确认
这项研究得到了日本农林水产省(genome -based Technology for Agricultural Improvement, GMO-1003)的资助。感谢NARO农业生物科学研究所远藤正崎博士(Masaki Endo)对CGH阵列分析的技术建议。
资金
这项工作得到了日本政府农林水产省(MAFF)的资助,以促进农业生物技术的基础研究(基于基因组的农业改良技术,GMO-1003)。
作者信息
从属关系
贡献
TE构建和管理转基因和空BC后代,组织所有实验的通讯作者。HF进行了基因组CGH分析。MO构建了BC子代的遗传图谱和图形型基因分型图。TS对BC后代进行了NGS分析,是整理稿件的通讯作者。所有作者阅读并批准最终稿。
相应的作者
道德声明
伦理认可和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明不存在利益冲突。
额外的信息
出版商的注意
施普林格《自然》对出版的地图和机构附属关系中的管辖权要求保持中立。
补充信息
附加文件1:表S1。
CAPS标记信息用于遗传连锁图谱和图形型基因分型图。
附加文件2:图S1。
Mikan基因组数据库(mid:https://mikan.dna.affrc.go.jp/).
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议授权,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和源代码,提供知识共享许可协议的链接,并说明是否进行了修改。本文中的图像或其他第三方材料均包含在本文的知识共享许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的知识共享许可中,并且您的预期使用不被法定法规允许或超过允许的使用,您将需要直接从版权所有者获得许可。如欲查阅本牌照副本,请浏览http://creativecommons.org/licenses/by/4.0/.知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在对数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
远藤,T.,藤井,H.,大村,M.。et al。利用早花期转基因植物与分子标记辅助选择相结合的快速育种体系,将三叶橙抗CTV的特性引入柑橘种质资源。BMC植物杂志20.224(2020)。https://doi.org/10.1186/s12870-020-02399-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02399-z
关键字
- 枳壳trifoliata
- CTV阻力
- 柑橘类
- 少年果树
- 空隔离
- 回交
- 繁殖时期