摘要
背景
糖含量是水果甜味的重要决定因素,但有关果糖积累的复杂分子机制的细节仍然稀缺。在这里,我们举报了蔗糖运输车(SUT)家庭在调节苹果中果糖积累的作用。
结果
基因标记标记被开发,以进行候选基因基型关联研究,以及SUT4成员MdSUT4.1与果糖积累显著相关。MdSUT4.1编码液泡膜定位蛋白,其表达量与果糖含量呈负相关。过度的MdSUT4.1草莓和苹果愈伤组织对糖的积累总体上有负面影响,说明它的作用是将糖从液泡中重新动员出来。此外,MdSUT4.1位于染色体上的一个糖含量QTL区域,表明该基因是苹果果实糖积累的候选基因。
结论
MdSUT4.1参与调控苹果中果糖的积累。本研究不仅有助于了解果糖积累的复杂机制,而且为苹果品质的遗传改良提供了分子工具。
背景
蔗糖是植物光合作用的主要产物,是碳水化合物最常见的形式,从源叶通过韧皮部运输到根部和果实等下沉器官。在过去的三十年中,人们对蔗糖在植物中的运输进行了广泛的研究,蔗糖转运体(SUTs)被认为是蔗糖从源到库的输出和有效移动的关键[1].Suts含有主要促进剂超家族(MFS)蛋白的典型12跨膜(TM)α-螺旋[2那3.那4.].大多数sut的特征是能量依赖的质子蔗糖/H+利用质子动力穿过细胞膜以反浓度梯度运输蔗糖的共体[5.那6.].
首先SUT通过酵母功能互补从菠菜中分离基因[7.].随后,综合全基因组序列分析表明Suts.属于一个小型基因家族,有九个和五个成员拟南芥[8.] 和栽培稻[9.),分别。系统发育分析表明,SUT家族可分为SUTI、SUTII和SUTIII三个亚科,其中SUTI亚科仅存在于双独体中[1那10那11那12].SUTII亚科进一步分为SUTIIA和SUTIIB两个支系,后者是单子叶植物特有的[11那12].SUTIIA是被子植物SUTII亚科的一种祖先形式,比SUTIIB具有更长的中央细胞质环[12那13].SUTI亚家族成员仅位于质膜,负责将蔗糖装载到韧皮部或将蔗糖摄取到库组织的细胞中[14那15那16那17那18那19那20.那21].虽然大多数SUTII成员位于质膜,作为糖传感器,但最近的研究表明MdSUT2.2位于液泡膜,其过表达导致液泡中蔗糖积累增加[22那23].Sutiii亚家族的成员以前已经与真空膜相关联,其中它们与液泡中的蔗糖流入液体进入Cytosol [24那25那26那27那28那29].然而,一些SUTIII成员,如拟南芥Atsut4 [30.],大麦HVSUT2 [31],Lotus对虾LiSUT4 [25],烟草NTSUT4和马铃薯STSUT4 [32和apple MdSUT1 [33,位于质膜中。值得注意的是,单子叶和双子叶植物利用不同类型的SUTs将蔗糖装载到韧皮部。SUT1亚家族对底物蔗糖具有最高亲和力,这对双子叶植物中蔗糖的有效韧皮部装载至关重要,而单子叶植物则利用高亲和力SUT2转运体[14那17那34那35].此外,Sut4对蔗糖相对于Sut1和Sut2具有较低的亲和力[30.].
除了与蔗糖运输有关,SUT基因在植物的各种发育和生理过程中也起着重要的作用。例如,SUT1基因亚家族参与营养生长的调节[17,花粉发育[36那37]、花期[38]、果实及种子发育[39那40,花青素积累[41]和块茎产量[42].这SUT2基因亚家族最初被描述为糖传感器[13那43].然而,这种假定的蔗糖感知功能随后受到了质疑[2,越来越多的证据表明SUT2基因作为糖转运体,有助于提高粮食产量[44]、生殖器官发育[31]和对非生物压力的抵抗力[23].
糖积累与果实产量和品质密切相关。由于糖转运基因在糖积累中起重要作用[45那46,越来越多的人开始关注调查SUT在过去的20年里,许多水果品种的基因家族,如葡萄藤[47那48那49,甜橙[50],桃子[29那51),梨(52]和苹果[53].一种SUT2基因,即。MdSUT2.2在Apple中,最近被证明可以调节苹果中的水果糖积累[22那23那54].一些SUT4基因,包括柑橘类CsSUT4[50),小道消息VvSUC11[55),苹果MdSUT1[33)和枣zjsut4.[56,被发现可能与果糖积累有关。然而,它的作用SUT4基因家族在果糖积累中的作用尚不明确。
苹果 (马吕斯x有明显是蔷薇科的一员,是世界上重要的经济水果作物。它是一个二倍体,但具有同源多倍体起源,基本染色体数目为x = 17,单倍体基因组大小约为750 Mb [57].糖含量是水果感官质量的重要组成部分,因此在苹果育种计划中获得了高优先级。然而,糖含量被定量遗传,并且已经鉴定了几种负责水果糖积累的基因,尽管在苹果苹果上广泛地进行了用于水果糖含量的定量性状基因座(QTL)的遗传映射[58那59那60那61那62].为了便于了解控制水果中的复杂机制的复杂机制,我们调查了该角色SUT苹果果实糖含量测定的基因家族MdSUT4发现基因参与调控果糖积累。本研究将有助于我们了解SUT4蛋白对果实糖积累的影响。这SUT4基因及其分子标记也可以作为分子工具,在苹果育种过程中对果实甜度进行遗传改良。
结果
识别的SUT苹果基因组中的基因家族
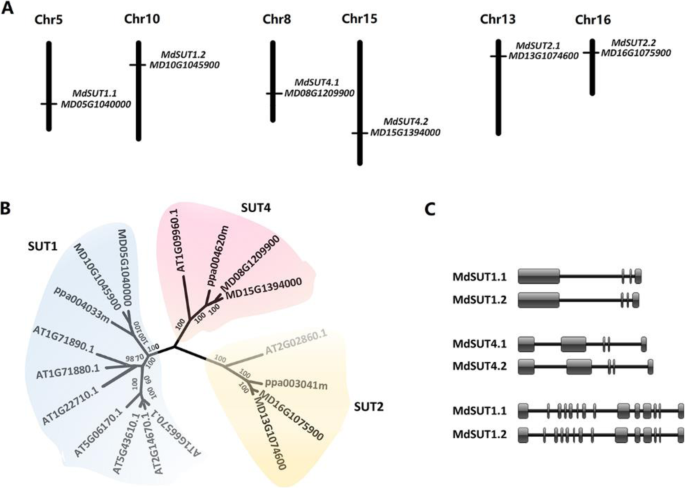
对‘Golden Delicious’双单倍体GDDH13的苹果参考基因组序列进行筛选,共发现6个参考基因组MdSUT这些基因位于不同的染色体上。1a).推导的蛋白质MdSUTs所有α-螺旋都包含12个可能的跨膜螺旋(图S1).系统发育分析表明,这6种植物均具有较好的发育潜力MdSUTs可以分为三个亚属,每个都包含两个成员(图。1b),MdSUT基因随后按标准基因命名法命名[1].有趣的是,二MdSUT同一亚家族的基因具有相似的基因组结构,并位于一对同源染色体上(图。1a,c)。这MdSUT1那MdSUT2,MdSUT4基因包含4个外显子、14个外显子和5个外显子,分别位于3对同源染色体5-10、13-16和8-15上。此外,MdSUT2蛋白在TM6和TM7之间有一个大的中心环,长度超过90个氨基酸,而MdSUT1和MdSUT4的中心环长度都小于45个氨基酸(图S)1).同样,MdSUT2的n端结构域长度是MdSUT1和MdSUT4的2.7倍。这些结果与之前的报道一致,SUT2亚家族具有扩展的n端和中心环路[13].
之间的联系MdSUTs以及苹果果实中糖分的积累
开发了SSR标记MdSUT1.1和MdSUT2.1基于两颗电子微卫星(CAAAAA)N(助教)N分别(表1).位于起始密码子(CT)上游的两个微卫星N和(AG)N,已成功用于开发SSR标记MdSUT1.2和MdSUT4.1,分别。而SSR标记MdSUT4.2和MdSUT2.2是基于(TA)开发的N和(CT)N微卫星分别位于终止密码子下游。估计协会SUT利用这些新开发的SSR标记对353份苹果材料进行基因型分析[63].结果,两种植物均检测到4个多态条带MdSUT1.2和MdSUT2.2,分别鉴定出3、3、2和2个多态性条带MdSUT1.1那MdSUT4.1那MdSUT4.2和MdSUT2.1(图S2a, b).最后,多态位点的关联MdSUT采用候选基因关联策略对含糖基因进行分析。结果仅显示(AG)N微卫星位于起始密码子的上游15 BPMdSUT4.1与果糖含量显著相关,其概率值(P.-value)0.0028(表1).三个等位基因,(AG)6.(AG)9., (AG)11,被识别出来MdSUT4.1通过直接测序PCR产物的轨迹(图。2a).基于(AG)的存在或缺席9.在MdSUT4.1将所有材料分为3个基因型:(AG)9/9(AG)6/9, (AG)6/6或11.一份或两份(署理)9.(AG)基因的果糖含量显著低于无(AG)基因的9.等位基因(无花果。2b)。但是,(AG)9.等位基因对总糖和蔗糖含量均无显著影响。
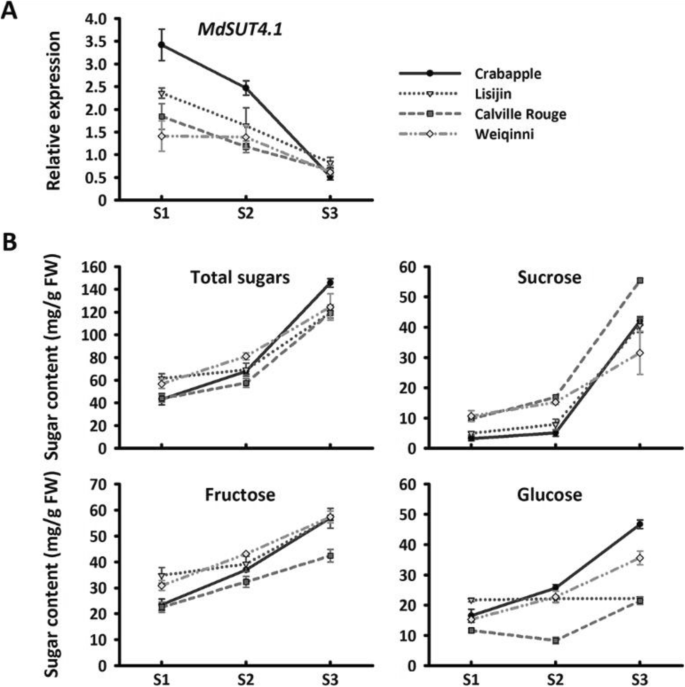
进一步确认关联关系MdSUT4.1研究了苹果果实糖积累基因的表达谱MdSUT4.1的水果三在不同发展阶段的品种和一个Crabapple(图。3.).总的来说,MdSUT4.1基因在年轻阶段表达最高,然后在果实发育过程中表达减少,成熟阶段下降约7-9倍。相比之下,糖积累显示出果实发育的积极趋势,成熟阶段的峰值(图。3.).此外,表达水平MdSUT4.1与葡萄糖含量显着呈负相关(R.=−0.359,P.<0.05),果糖含量(R.=−0.618,P.< 0.001)、蔗糖含量(R.=−0.604,P.<0.001)和总糖含量(R.=−0.624,P.< 0.001)。综上所述,这些结果表明MdSUT4.1是参与水果糖积累的候选者,进一步进行功能分析。
烟草中MDSUT4.1的亚细胞定位
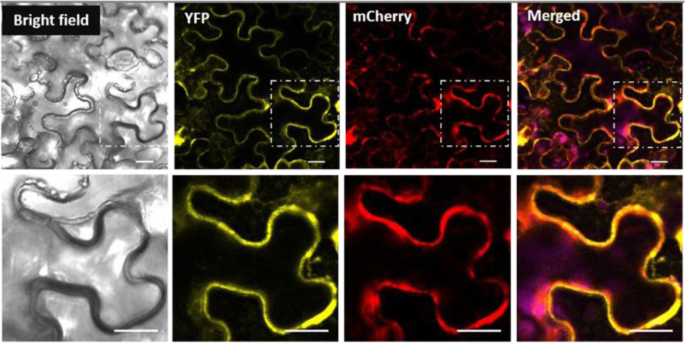
如上所述,MdSUT4.1包含12个假定的跨膜结构域。为了进一步确定MdSUT4.1的亚细胞定位,将黄色荧光蛋白YFP融合到MdSUT4.1的c端。由CaMV 35S启动子驱动的MdSUT4.1-YFP融合结构在烟草中瞬时表达(烟草benthamiana),发现MdSUT4.1-YFP融合蛋白位于液泡膜(图。4.).此外,我们与标准液泡膜标记Vac-rk CD3-975进行共定位,以确定MdSUT4.1的亚细胞位置(图1)。4.).激光共聚焦荧光显微镜显示液泡膜标记vacr -rk CD3-975的mCherry荧光与MdSUT4.1-YFP的YPF荧光合并。说明MdSUT4.1是液泡膜定位蛋白。
过度的MdSUT4.1草莓和苹果愈伤组织中的基因
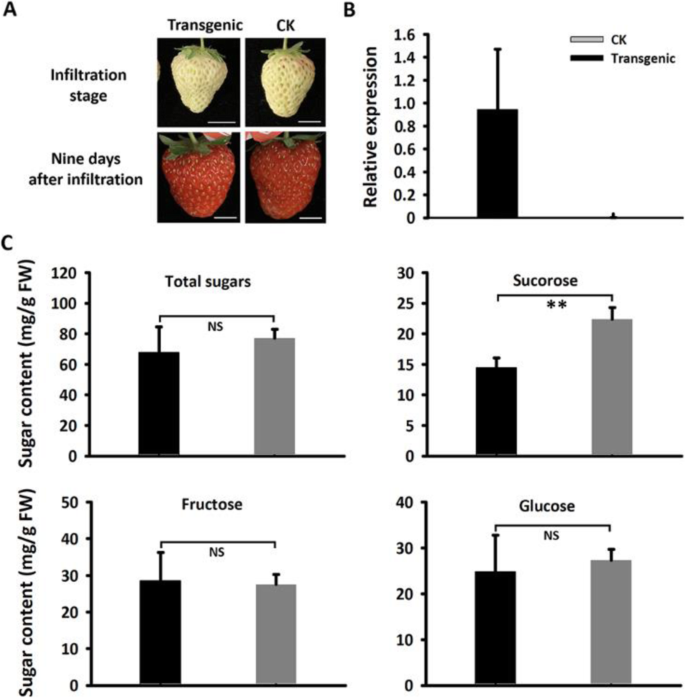
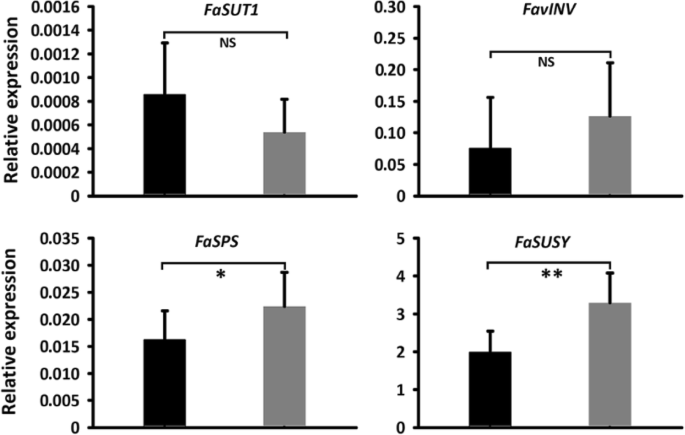
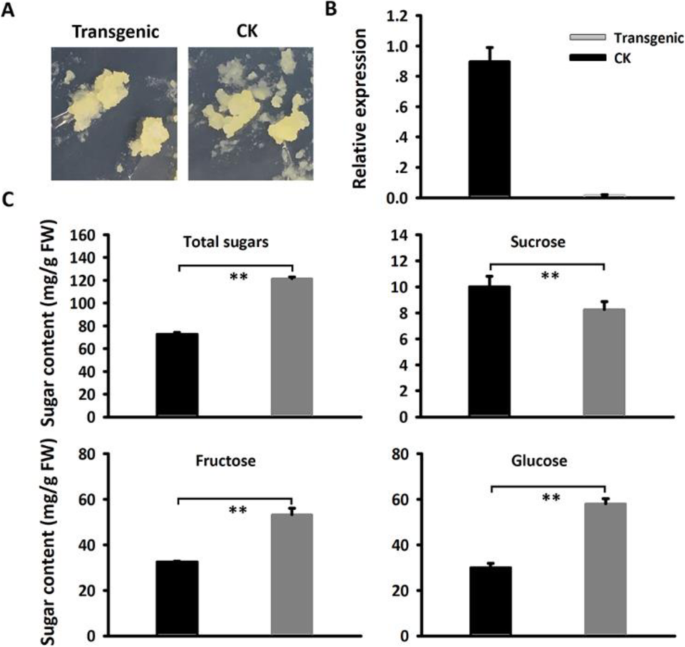
为了检验MdSUT4.1是否能够运输糖分,将其暂时转移到草莓未成熟的白色果实中(图1)。5.a).实时定量PCR (qRT-PCR)分析表明MdSUT4.1在转基因果实中高表达。5.b)。果实过表达的蔗糖含量明显减少了35%MdSUT4.1与空载体渗透的水果相比(图。5.c).但过表达果实的葡萄糖、果糖和总糖含量无显著差异MdSUT4.1或者引入空向量。通过qRT-PCR检测蔗糖代谢或转运相关基因的表达水平,包括Fasps.(蔗糖磷酸合成酶)Fasusy.(蔗糖合酶),FavAINV(液泡酸转化酶)和FaSUT1,在测定草莓果实蔗糖含量中起重要作用[40那64].因此,表达水平Fasps.和Fasusy.显著降低了水果的过度表达MdSUT4.1与空白载体浸润的果实相比,表达量无显著差异FaSUT1和FavINV(无花果。6.).这与果实过表达降低了蔗糖积累的结果一致MdSUT4.1.
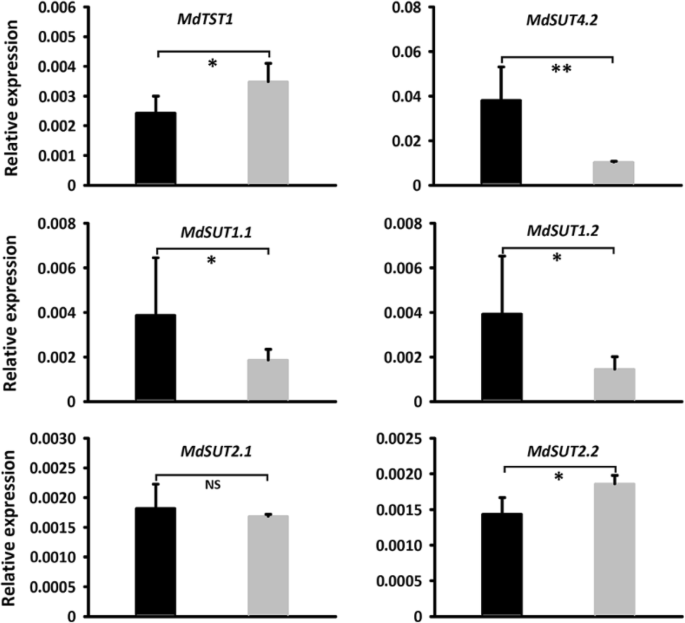
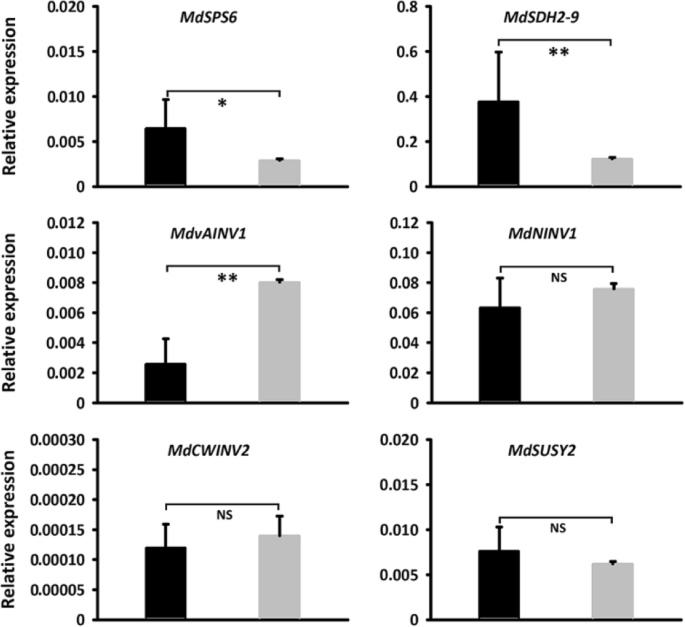
进一步证实的功能MdSUT4.1在苹果愈伤组织中(Fig。7.一种)。QRT-PCR测定显示MdSUT4.1基因在转基因株系中高表达(图。7.b).愈伤组织过表达的蔗糖浓度MdSUT4.1与引入空载体愈伤组织相比,葡萄糖、果糖和总糖浓度分别显著降低了27.96、20.68和48.88 mg/g FW(图3)。7.c).利用qRT-PCR分析糖转运相关基因的表达水平(图。8.).结果,a液泡内糖转运体MdTST1和MdSUT2.2在Calli过表达中显示出显着降低的表达水平MdSUT4.1在引入空载体的愈伤组织中,愈伤组织的变化趋势与此相反MdSUT4.2那MdSUT1.1和MdSUT1.2.相比之下,MdSUT2.1愈伤组织过表达间表达量无显著差异MdSUT4.1calli引入空向量。此外,据报道影响苹果果实糖积累的糖代谢相关基因的表达水平[65)也进行了研究(图。9.).MdvAINV1在Calli过表达中显示出显着降低的表达水平MdSUT4.1在引入空载体的愈伤组织中,愈伤组织的变化趋势与此相反MdSPS和MDSDH2-9.(山梨糖醇脱氢酶)的基因。相比之下,mdninv1.(中性/胞质转化酶),mdsusy2.,MdCWINV2(细胞壁转化酶)显示CALLI过表达之间表达水平没有显着差异MdSUT4.1calli引入空向量。
讨论
SUT4蛋白靶向液泡膜的机制的复杂性
在果实中,可溶性糖主要储存在液泡中,液泡吸收或释放是液泡内液泡定位转运体催化的。植物中N-和/或c端结构域内的二亮氨酸基序(LXXLL)负责将糖转运到液泡膜的靶向[11那66那67].各种含有二亮氨酸基序的Sut4亚家族成员,例如拟南芥AtSUT4(又称AtSUC4) [24],Lotus粳稻LjSUT4 [25],大麦HVSUT2 [24稻米[68] 和杨树PtaSUT4 [26,已经被证明存在于液泡膜中。在果树中,桃的PpSUT4,苹果的MdSUT4.1和MdSUT4.2,梨的PbSUT2都含有瞄准二亮氨酸基元LXXLL的液泡(图S3.),因此,它们将定位于液泡膜。MdSUT4.2在以前的一份报告中也被称为MdSUT1 [33].与MDSUT4.1一样,PPSUT4显示在烟草叶中的瞬时表达中存在于真空膜中[29].然而,MdSUT1和PbSUT2均通过在细胞中的异位表达定位于质膜拟南芥原生质体及洋葱表皮细胞[33那52].这种不一致性表明,除了二亮氨酸基序,其他未知因素也可能影响SUT4亚家族成员的亚细胞定位。
MdSUT4.1参与调控苹果果实糖分积累
我们的研究表明MdSUT4.1与苹果果糖积累显著相关,位于LG8上的甜度QTL区间[58].表达水平MdSUT4.1草莓和苹果愈伤组织中过表达对糖积累总体呈负相关。这些结果表明MdSUT4.1基因是苹果中果糖积累调控的强大候选者。
如上所述,MDSUT4.1将其存在于真空膜中,并且其在草莓中的瞬态过度表达显着降低了果实中的蔗糖积累。这表明MDSUT4.1具有类似的功能拟南芥AtSUT4和玉米ZmSUT2,均为SUT4亚家族成员,具有将蔗糖从液泡中再动员出来的功能[27那28那69].这一假设与蔗糖合成基因表达的发现相一致Fasps.与用空载体的果实渗透相比,表达过表达MDSut4.1的草莓果实显着降低。这种表达水平的变化Fasps.可以归因于由过表达引起的芳瓦的蔗糖的排出的反馈MdSUT4.1.
同样,过度表达MdSUT4.1在苹果愈伤组织中己糖的积累显著减少,这与苹果愈伤组织中己糖的表达MdSUT4.1与苹果果实中糖的积累呈负相关。MdSUT4.1可能也介导了苹果愈伤组织液泡中蔗糖的流出,这一假设与结果吻合MdvAINV1在苹果愈伤组织过表达时,液泡中负责蔗糖分裂的细胞数量显著减少MdSUT4.1.苹果愈伤组织过表达后蔗糖积累量略有增加MdSUT4.1可能是由于激活MdSUT1.1和MdSUT1.2随着SUT1已知基因作为高亲和力蔗糖转运蛋白和蔗糖摄取的功能,进入水槽储存组织[70那71].
先前的研究表明,SUT4可以与其他糖转运体如SUT1和TST相互作用[29那43那72].因此,它不能排除过度表达MdSUT4.1在苹果愈伤组织中可能影响其与其他糖转运体如MdTST的互作,导致糖积累的变化。此外,我们的结果表明,过度表达MdSUT4.1结果糖代谢和转运基因的级联反应影响糖积累,这与以前的报道相似[32那73].
在苹果中,山梨醇是韧皮部中主要的糖,但在成熟的水果中它只占5%左右,因为大多数转化为果糖[74].编码山梨糖醇转运体(SOT)的基因表达,包括mdsot1.那MDSOT4.和MdSOT5.3,减少了苹果Calli过表达MdSUT4.1(无花果。4.).因此,是否过度表达值得进一步研究MdSUT4.1对表达有影响吗MdSOTs,导致苹果果实中的糖积聚变化。
结论
我们的结果表明,Tonoplast局部蔗糖转运蛋白MDSut4.1参与调节苹果中的水果糖积累。我们的结果对于更好地了解Sut4蛋白对水果糖积累的影响是有用的。此外,分子标记物MdSUT4.1可作为苹果育种中果实甜度遗传改良的工具。
方法
植物材料
本研究使用的所有苹果品种均在中国农业科学院兴城果树研究所保存。收集每个品种的幼叶,在液氮中冷冻,然后在−80℃保存至使用。测定含糖量的水果样品在2015年的成熟期随机收获,这是根据之前的成熟日期、皮肤背景颜色和腮红发育以及种子颜色变为棕色的记录估计的。此外,一只海棠果(苹果属良性),选择‘Calville Rouge’、‘lisjin’和‘Weiqinni’3个品种进行qRT-PCR分析。果实采自开花后60、90、120 d的幼、幼、成熟阶段。3个生物重复,每次添加10个果实。水果样品在液氮中冷冻,在−80°C下保存用于qRT-PCR分析,或在−40°C下保存用于糖的测定。草莓品种‘红岩’由湖北省农业科学院经济作物研究所提供,在自然光照条件下,温度为10°C - 26°C的温室中栽培。以苹果品种‘Orin’果肉为材料诱导的苹果愈伤组织由西北农业大学关庆梅教授提供。
水果含糖量的测定
根据我们之前报道的方案,采用高效液相色谱(HPLC)测定糖含量[75].本研究中的总糖是指主要可溶性糖的总和,包括蔗糖、果糖和葡萄糖,它们加起来占苹果果实总糖的95%以上[74].简单地说,使用A11基本分析磨(IKA-Werke, Staufen, Germany)将水果样品在液氮中磨成粉末,大约0.5克粉末转移到一个干净的Eppendorf管中。用6 mL去离子水超声提取可溶性糖,超声处理15 min,然后在5000×g离心15 min。上清液通过0.22 μm Sep-Pak过滤器(ANPEL,中国)过滤。采用高效液相色谱系统(Agilent 1260 Infinity,德国Waldbronn, Agilent, 1260 Infinity)和折射率检测器(RID)对滤膜进行糖含量测定。进样量为20 μL,色谱柱为CarboSep CHO-620 Ca (300 × 6.5 mm, 10 μm粒径)和CarboSep CHO-620 Cartridge (Transgenomic, San Jose, Ca, USA)。流动相为去离子水,流速为0.5 mL/min,柱温保持在90℃。糖浓度是通过与标准曲线的值比较来估计的。蔗糖(CAS号57-50-1)、葡萄糖(CAS号50-99-7)、果糖(CAS号57-48-7)均购自Sigma。每次添加都有3个生物重复。
RNA分离及qRT-PCR分析
在制造商的说明之后用RNAPREP纯植物套件(天根,北京,中国)提取全RNA,使用DNase I(Takara,China)除去基因组DNA污染。使用转肌型单步GDNA去除和cDNA合成Supermix(Trans,北京,中国)进行CDNA模板的合成。QRT-PCR测定用TBGreen®Mifix进行Taq™II(TLI RNase H Plus)(TARI RNASE H Plus)(Takara,大连,中国),对应用生物系统进行扩增第一加上实时PCR系统(Life Technologies Corporation),卡尔斯巴德,加州,美国)。在40个循环结束时分析熔化曲线以确认特异性扩增产物。先前报道的actin基因[76]作为本构对照,同时对每个样品进行阴性对照。每个样本有三个生物重复。底漆序列列于表s中1.
的识别SUT苹果基因组中的基因及其分类
的识别SUT基因最初是基于苹果基因组注释数据库GDDH13 [77),和六个MdSUT基因被确定。随后,每一个的编码序列SUT将基因进一步使用在线计划BLASTN与苹果草案基因组进行比较(https://www.rosaceae.org/blast),E.值截止值为1e-10,没有额外的成员被识别。来验证MdSUT利用BLASTp技术对GenBank的非冗余蛋白(NR)和Swiss-Prot蛋白数据库进行blast分析E.值截止1e-5。染色体的位置MdSUTs是根据GDDH13的基因组草图序列提出的[77].使用Psipred进行蛋白质跨膜结构域的预测(http://bioinf.cs.ucl.ac.uk/psipred/)[78].使用可视化软件IBS Version 1.0绘制基因结构[79].
分类MdSUTs,它们的氨基酸序列与SUT基因拟南芥和使用MEGA5和默认参数的桃子。所得数据矩阵采用Neighbor-Joining方法构建系统发育树。从1000次重复中估计引导值。
基因标记标记的开发和基于候选基因的关联分析
每个基因组DNA序列MdSUT从GDDH13的基因组草案中取出[77],然后使用微卫星重复探测仪(http://insilico.ehu.eus/mini_tools/microsatellites/).使用Primer总理5.使用聚丙烯酰胺凝胶电泳检测到SSR多态性的SSR标记的引物,与前一份报告后的银染色相结合检测到SSR多态性[80].
多态SSRs的MdSUTs用于筛选与我们之前的研究中相同的353个Apple Reversion的收集[63],引物序列列于表S2.协会MdSUTs采用混合线性模型,在TASSEL 3.0版上进行P.<0.01作为显着标志性状协会的标准。在我们之前的研究中相同的KILESHIP(K矩阵)和最可能的K值(Q矩阵)是相同的[63].Bonferroni阈值设为≤1/n,其中n表示样本量。
MdSUT4.1在烟草中的亚细胞定位分析
从pEarleyGate104中扩增出YFP片段,利用Hieff CloneTM Plus One Step Cloning Kit (Yeasen, Shanghai, China)克隆到pFGC5941的BamHI-SpeI位点,构建pFGC-eYFP载体。全长编码序列的扩增MdSUT4.1使用由'Calville Rouge'的果实制备的cDNA模板进行。将纯化的PCR产物插入PFGC-EYFP载体的BamHI位点,以产生沿着制造商的说明书中的融合®HD克隆套件(Takara,大连)的PFGC-EYFP-MDSut4.1构建体。用于表达载体结构的引物序列列于表S中3..
空泡膜标记物vacrk CD3-975 [81], pFGC-eYFP-MdSUT4构建物分别转入根癌土壤杆菌用热休克法将菌株GV3101 (pMP90)涂于琼脂平板上,28℃孵育3天。取单个菌落,悬浮在LB培养基中,28℃摇匀培养过夜。用4000 g离心5分钟收集农杆菌细胞,用10 mM MES、10 mM MgCl的渗透缓冲液重悬2, 450 μM乙酰丁香酮,pH 5.6)。4-5周的叶子n benthamiana共聚焦显微镜(TCS SP8, Leica, Microsystems, Wetzlar, Germany)检测荧光。所有的扫描仪都使用一个× 20物镜来获取数字图像。用512 nm激光对YFP进行激发,用552 nm激光对mCherry进行激发。荧光发射波长分别为530 ~ 550 nm (YFP)和600 ~ 650 nm (mCherry)。
的功能分析MdSUT4.1在草莓和转基因苹果愈伤组织中
整个CDSMdSUT4.1通过同源重组扩增并插入EcoRI和Xbai酶位点之间的表达载体PSAK277的位点。底漆序列列于表s中3..将重组载体pSAK277- mdsut4.1和空载体pSAK277分别转入农菌株EHA105具有热冲击方法,然后将含有50mg / L链霉素,50mg / L庆氨酰和100mg / L旁观霉素的琼脂平板。在28℃温育3天后,挑选单枚菌落,悬浮在LB培养基中,并在28℃下振荡温育过夜。通过以4000g以4000g离心5分钟来收集农杆菌细胞,然后用于渗透草莓CV的果实。从CV肉体诱导的宏岩和苹果疾病。orin。
瞬态过度表达MdSUT4.1根据之前的一份报告[82].简而言之,将收集的细菌粒料重悬于浸润缓冲液(50mM MES,5mg / ml D-葡萄糖,2mM NA中3.阿宝4.(100 μM乙酰丁香酮),细胞密度调节至OD值600海里0.2。将悬浮液用注射器的针头注射到未成熟的白色果实的果肉中,将渗入的植株置于自然光和温度为10°C - 26°C的温室中。浸渍后9 d采集果实样品,进行qRT-PCR分析和糖含量测定。
为了转化苹果愈伤组织,收集的细菌球被重悬在5%的蔗糖溶液(pH 5.3)中,并调整细胞密度到OD600海里2.0。将苹果愈伤组织浸泡在悬浮液中15 min,经无菌尼龙网(200目)过滤收集,在含3%蔗糖、1 mg/L 2,4- d、1 mg/L 6-BA和400 mg/L头孢氨苄的MS培养基上,在25℃黑暗条件下培养2 d。将转基因苹果愈伤组织用含400 mg/L头孢氨苄的无菌Mili-Q水洗涤5次,过滤后干燥,然后在含3%蔗糖、1 mg/L 2,4- d、1 mg/L 6-BA、400 mg/L头孢氨苄、50 mg/L卡那霉素的MS选择培养基上培养。转基因愈伤组织连续传代3代后,采用高效液相色谱法测定其糖含量。此外,转基因愈伤组织通过PCR扩增和表达得到证实MdSUT4.1采用qRT-PCR分析。底漆序列列于表s中1.
可用性数据和材料
本研究中所使用和分析的数据集可由通讯作者根据合理要求提供。
缩写
- SUT:
-
蔗糖运输车
- 结核菌素:
-
液泡膜糖转运蛋白
- 说:
-
山梨糖醇运输车
- SPS:
-
蔗糖磷酸合成酶
- SDH:
-
山梨糖醇脱氢酶
- vAINV:
-
空泡的酸性转化酶
- NINV:
-
中性/胞质转化酶
- CWINV:
-
细胞壁转化酶
- Susy:
-
蔗糖合酶
- DAF):
-
几天后开花
- 存在:
-
实时定量PCR
- 高效液相色谱法:
-
高效液相色谱法
参考文献
- 1.
Kühnc,grof cpl。高等植物的蔗糖转运蛋白。CurrOp植物BIOL。2010; 13:288-98。
- 2.
高志强。植物蔗糖转运体的分子生物学特性。2月。2007;581:2309-17。
- 3.
Reddy VS, Shlykov MA, Castillo R, Sun EI, Saier MH Jr.超级家庭(MFS)的重访。2月j . 2012; 279:2022-35。
- 4.
闫宁。主要促进超家族(MFS)转运体的结构研究进展。生物化学进展。2013;38:151-9。
- 5.
Chandran D,Reinders A,Ward JM。底物特异性拟南芥蔗糖转运蛋白AtSUC2。中国生物化学杂志。2003;278:44320-5。
- 6.
Carpaneto A,Geiger D,Bamberg E,Sauer N,Fromm J,Hedrich R.Ploem局部化的质子偶联蔗糖载体Zmsut1在蔗糖梯度和质子动力的控制下介导蔗糖流出。J Biol Chem。2005; 280:21437-43。
- 7.
Riesmeier JW, Willmitzer L, Frommer WB。酵母功能表达从菠菜中蔗糖载体cDNA的分离与表征。Embo J. 1992; 11:4705-13。
- 8.
拟南芥基因组倡议。开花植物基因组序列分析拟南芥.大自然。2000;408:796 - 815。
- 9.
Aoki N, Hirose T, Scofield GN, Whitfeld PR, Furbank RT.水稻蔗糖转运基因家族。acta botanica sinica(云南植物学报),2003;44(4):423 - 432。
- 10.
Lalonde S, Frommer WB。卷藻基因组SUT、蔗糖和MST单糖转运体的研究。植物学报2012;3:24。
- 11.
Reinders A Sivitz AB Ward JM。植物蔗糖摄取转运体(SUTs)的进化。植物科学学报2012;3:22。
- 12.
彭丹,顾旭,薛立军,李本斯。蔗糖转运体的贝叶斯系统发育:单子叶和双子叶的古老起源、差异扩展和收敛进化。植物科学学报2014;5:615。
- 13.
Barker L, Kühn C, Weise A, Schulz A, Gebhardt C, Hirner B, Hellmann H, Schulze W, Ward JM, Frommer WB。SUT2,筛元中假定的蔗糖传感器。植物细胞。2000;12:1153 - 64。
- 14.
Riesmeier JW, Willmitzer L, Frommer WB。蔗糖转运体在韧皮部装载和同化物分配中重要作用的证据。EMBO j . 1994; 13:1-7。
- 15.
Bürkle L, Hibberd JM, Quick WP, Kühn C, Hirner B, Frommer WB。H+-蔗糖协同转运体NtSUT1是烟草叶片糖出口的关键。植物杂志。1998;118:59 - 68。
- 16.
王志强,王志强,王志强,等。植物源特异性蔗糖/H的研究进展+来自胡萝卜的交钥者。植物理性。1998年; 118:1473-80。
- 17.
植物韧皮部特异性质膜蔗糖转运蛋白的遗传学证据。美国国家科学学院2000;97:13979-84。
- 18.
质外体和共形成层韧皮部载入Quercus栎树和Fraxinus精益求精的.J Exp Bot. 2014; 65:1905-16。
- 19.
Öner-Sieben S, Rappl C, Sauer N, Stadler R, Lohaus gFraxinus精益求精的.J Exp Bot. 2015; 66:4807-19。
- 20.
Nieberl P,EHRL C,Pommerrenig B,GRAUS D,Marten I,Jung B,Ludewig F,Koch W,危害K,Flugge UI,Neuhaus He,Hedrich R,Sauer N.BVSUT1的功能表征和细胞特异性将蔗糖载入甜菜的韧皮酚(甜菜属l .)源叶。植物医学杂志。2017;19:315-26。
- 21.
李志刚,李志刚,李志刚,等。欧洲常见树种蔗糖转运体表达和糖分配的季节变化。树杂志。2018;39:284 - 99。
- 22.
马启军,孙明辉,陆军,刘永军,胡东,郝永军。转录因子AREB2通过激活糖转运体和淀粉酶基因参与可溶性糖的积累。植物杂志。2017;174:2348 - 62。
- 23.
马庆军,孙明辉,卢杰,康辉,尤春霞,郝玉娟。苹果蔗糖转运体MdSUT2.2是响应干旱的蛋白激酶MdCIPK22的磷酸化靶点。Plant Biotechnol J. 2019; 17:625-37。
- 24.
Endler A,Meyer S,Schelbert S,Schneider T,Weschke W,Peters SW,Keller F,Baginsky S,Martinoia E,Schmidt UG。鉴定大麦的真空蔗糖转运蛋白拟南芥通过调色剂蛋白质组学方法的叶片细胞。植物理性。2006; 141:196-207。
- 25.
Reinders A, Sivitz AB, Starker CG, Gantt JS, Ward JM。蔗糖液泡转运体LjSUT4的功能分析Lotus对虾.植物学报。2008;68:289-99。
- 26.
Payyavula RS, Tay KHC, Tsai CJ, Harding SA。杨树的蔗糖转运体家族:液泡膜PtaSUT4对生物量和碳分配的重要性。植物j . 2011; 65:757 - 70。
- 27.
Schulz A, Beyhl D, Marten I, Wormit A, Neuhaus E, Poschet G, Büttner M, Schneider S, Sauer N, Hedrich r。植物j . 2011; 68:129-36。
- 28.
液泡通过液泡质体定位的suc4型转运体释放蔗糖。植物医学杂志。2012;14:325-36。
- 29。
Zanon L,Falchi R,Hackel A,Kühnc,vizzotto g.桃子蔗糖运输扣在异源系统中的表达指出了它们不同的生理作用。植物SCI。2015; 238:262-72。
- 30.
Weise A,Barker L,KühnC,Lalonde S,Buschmann H,Frommer WB,Ward JM。蔗糖转运蛋白的新亚家族,Sut4,具有低亲和力/高容量的植物的筛选元素。植物细胞。2000; 12:1345-56。
- 31.
Weschke W,Panitz R,Sauer N,Wang Q,Neubohn B,Weber H,Wobus U.蔗糖输送到大麦种子中:两种运输器的分子表征和种子发育和淀粉积累的影响。工厂J. 2000; 21:455-67。
- 32.
关键词:蔗糖转运体StSUT4,光周期调控,昼夜节律调控基因,乙烯生成植物学报2013;4:26。
- 33.
风扇rc,peng cc,xu yh,王xf,李x,尚y,du sy,zhao r,张xy,张丽,张dp。Apple蔗糖转运蛋白SOT1和山梨糖醇转运蛋白SOT6与细胞色素B5相互作用以调节它们对衬底糖的亲和力。植物理性。2009; 150:1880-901。
- 34.
蔗糖转运体1在玉米叶片韧皮部负荷中的作用。J Exp Bot. 2009; 60:881-92。
- 35.
Sun Y,Reinders A,Lafleur Kr,Mori T,Ward JM。水稻蔗糖运输司机Ossut1和Ossut5的运输活性。植物细胞生理。2010; 51:114-22。
- 36.
Lemoine R, Bürkle L, Barker L, Sakr S, Kühn C, Regnacq M, Gaillard C, Delrot S, Frommer WB。烟草花粉特异的蔗糖转运蛋白NtSUT3的鉴定。2月。1999;454:325-30。
- 37.
AtSUC1蔗糖载体可能代表了拟南芥花药开裂和花粉管生长的渗透驱动力。植物j . 1999; 19:269 - 78。
- 38.
Sivitz AB, Reinders A, Johnson ME, Krentz AD, Grof CPL, Perroux JM, Ward JM。拟南芥蔗糖转运体AtSUC9。高亲和力转运活性,基因内调控表达,开花早的突变体表型。植物杂志。2007;143:188 - 98。
- 39.
Hackel A, Schauer N, Carrari F, Fernie AR, Grimm B, Kühn C.蔗糖转运体LeSUT1和LeSUT2抑制对番茄果实发育的影响不同。植物j . 2006; 45:180 - 92。
- 40.
贾海峰,王玉华,孙明志,李宝宝,韩颖,赵应祥,李晓玲,丁宁,李超,纪伟林,贾文生。蔗糖作为一种信号参与草莓果实发育和成熟的调控。新植醇。2013;198:453 - 65。
- 41.
Sivitz AB, Reinders A, Ward JM。拟南芥蔗糖转运体AtSUC1对花粉萌发和蔗糖诱导的花青素积累具有重要作用。植物杂志。2008;147:92 - 100。
- 42.
Kühn C, Hajirezaei MR, Fernie AR, Roessner-Tunali U, Czechowski T, Hirner B, Frommer WB。蔗糖转运体StSUT1定位于马铃薯块茎韧皮部的筛分子,影响块茎的生理发育。植物杂志。2003;131:102-13。
- 43.
Reinders A, Schulze W, Kühn C, Barker L, Schulz A, Ward JM, Frommer WB。不同亲和的蔗糖转运体之间的蛋白质-蛋白质相互作用定植于同一个去核筛元件。植物细胞。2002;14:1567 - 77。
- 44.
张建军,马文杰,张建军TaSUTs干旱条件下小麦的粒重。植物学报。2018;98:333-47。
- 45.
王伟,周浩,马伯强,奥维提A,科尔班党卫军,韩延平。糖转运基因的不同进化模式与禾草和双子叶植物的糖积累差异有关。Sci众议员2016;6:29153。
- 46.
李春林,孟D,马春霞,毛义祥,丹德卡姆,程丽丽。在苹果花粉管的离体生长中,一种糖转运体同时吸收己糖和蔗糖以调节山梨醇。植物细胞。2019;32:449 - 69。
- 47.
陈志强,陈志强,陈志强,等。一种葡萄果实蔗糖载体的克隆及功能表达。植物生理与生物化学。2000;38:177-85。
- 48.
关键词:蔗糖转运子,LAHC,酵母,功能特性植物生长规律2007;54:71-9。
- 49.
关键词:葡萄,蔗糖转运体,过表达VvSUC27)在离体条件下,蔗糖的存在可提高植株的生长速度。植物学报,2017;
- 50。
郑启明,唐智,徐强,邓XX。甜橙糖转运蛋白基因的分离、系统发育及表达谱分析(柑橘sinensis.).acta botanica yunnanica(云南植物研究中心)2014;
- 51。
李志刚,李志刚,李志刚,等。桃果实韧皮部的韧皮部卸载与蔗糖转运:两种转运体在不同细胞类型中的作用。杂志杆菌。2015;154:179 - 93。
- 52.
关键词:蔗糖转运体,基因,过表达pbsut2.从Pyrus bretschneideri,提高蔗糖含量茄属植物lycopersicum水果。植物生理学报。2016;105:150-61。
- 53.
彭CC,徐毅,XI RC,赵XL。苹果果实中官能蔗糖转运蛋白(MDSUT1)的表达,亚细胞定位和植物激素刺激。SCI Hortic。2011; 128:206-12。
- 54.
马启军,孙明辉,刘永军,陆俊,胡东,郝永军。苹果蔗糖转运基因的克隆及功能分析MdSUT2.植物生理学报。2016;109:442-51。
- 55.
阿富法-巴斯蒂安D,美第奇A, Jeauffre J, Coutos-Thévenot P, Lemoine R, Atanassova R, Laloi m葡萄糖转运蛋白基因家族:系统发育概述和宏阵列表达谱分析。BMC Plant Biol. 2010;10:245。
- 56.
张春明,边勇,侯胜,李晓刚。在大枣驯化过程中,糖的转运比糖的生物合成对果实糖的积累起更重要的作用。足底。2018;248:1187 - 99。
- 57.
Velasco R,Zharkikh A,Firourtit J等人。驯化苹果的基因组(Malus×Divelsa.Borkh)。Nat麝猫。2010;42:833-ss。
- 58.
苹果数量生理性状的定位研究(马吕斯x有明显Borkh)。植物学报。2003;52:511-26。
- 59.
Kenis K, Keulemans J, Davey MW。苹果果实品质性状qtl的鉴定及稳定性树木基因组。2008;4:647-61。
- 60.
Kunihisa M, Moriya S, Abe K, Okada K, Haji T, Hayashi T, Kim H, Nishitani C, Terakami S, Yamamoto T.日本苹果果实品质性状qtl的鉴定:早熟qtl与收获前落果密切相关。育种科学。2014;64:240-51。
- 61.
Guan YZ, Peace C, Rudell D, Verma S, Evans K.苹果个体糖和可溶性固形物含量的qtl检测。摩尔繁殖。2015;35:135。
- 62.
马宝强,赵胜,吴碧波,王东敏,彭强,Owiti A,方涛,廖玲,Ogutu C, Korban SS,李姝,韩艳萍。苹果可溶性糖和有机酸组分的高密度连锁图谱构建及其qtl鉴定树基因基因组。2016;12:1。
- 63.
马百克,廖升,郑海,陈俊,吴富通,ogutu c,li s,korban ss,han yp。编码铝活化苹果酸盐II的基因及其与苹果果酸的关系。植物基因组。2015; 8:1-14。
- 64.
田璐,贾海峰,李春林,范鹏,邢勇,沈媛媛。葡萄、草莓果实成熟过程中蔗糖的积累主要受蔗糖合酶活性的控制。中国生物医学工程学报。
- 65.
李MJ,冯FJ,程吕。苹果果实发育中糖代谢和积累中涉及糖代谢的基因的表达模式。Plos一个。2012; 7:E33055。
- 66.
作者简介:Yamada K, Osakabe Y, Mizoi J, Nakashima K, Fujita Y, Shinozaki K, Yamaguchi-Shinozaki K拟南芥非生物胁迫诱导的单糖促进扩散转运体。J Biol Chem. 2010; 285:1138-46。
- 67.
Wolfenstetter S,Wirsching P,DotZauer D,Schneider S,Sauer N. on the Tonoplast的路线:拟南芥中蛋白质蛋白质蛋白质蛋白质中的调色剂转运蛋白的分选。植物细胞。2012; 24:215-32。
- 68.
加工JS,秋霁,Reinders李西南,Yoo Y,老爷PQ,崔某人,爆炸G,公园,曹MH, Bhoo SH, G,哈恩TR,病房JM,全JS。水稻液泡体定位的蔗糖转运体OsSUT2功能受损,限制液泡储备蔗糖的运输,影响植物生长。植物杂志。2011;157:109-19。
- 69.
Leach KA, Tran TM, Slewinski TL, Meeley RB, Braun DM.蔗糖转运体2对玉米生长发育和产量的影响。acta botanica yunnanica(云南植物研究). 2017;
- 70.
Rosche E, Blackmore D, Tegeder M, Richardson T, Schroeder H, Higgins TJ, Frommer WB, Offler CE, Patrick JW。马铃薯蔗糖转运体的种子特异性过表达增加了豌豆子叶对蔗糖的吸收和生长速度。植物j . 2002; 30:165 - 75。
- 71。
Leggewie G, Kolbe A, Lemoine R, Roessner U, Lytovchenko A, Zuther E, Kehr J, Frommer WB, Riesmeier JW, Willmitzer L, Fernie AR.在马铃薯中过表达蔗糖转运体SoSUT1会导致叶片碳分配和块茎代谢的改变,但对块茎形态影响不大。足底。2003;217:158 - 67。
- 72。
Schulze WX, Reinders A, Ward J, Lalonde S, Frommer WB。共表达的拟南芥蔗糖转运体在分裂泛素系统中的相互作用。学生物化学BMC。2003;4:3。
- 73。
关键词:马铃薯,蔗糖转运体StSUT4,开花,块茎,避光反应植物杂志。2008;146:515-28。
- 74。
王志强,王志强,王志强,等。苹果果实的细胞分隔和膜对糖的渗透性的变化。acta Hortic sinica, 1992; 117:951-4。
- 75。
马BQ,陈继,郑清,方笃,奥格图,李世,韩yp,吴班。培养苹果糖和苹果酸组合物的比较评估。食品化学。2015; 172:86-91。
- 76.
马比特,廖升,方t,彭q,ogutu c,周h,ma fw,han yp。一种MA10编码p型atp酶的基因参与了苹果果实有机酸的积累。Plant Biotechnol J. 2019; 17:674-86。
- 77.
Daccord N,Celton JM,Linsmith G等人。高品质的德诺族组装苹果基因组和早期水果发育的甲虫动态。NAT Genet。2017; 49:1099-106。
- 78.
琼斯dt。基于特定位置的评分矩阵的蛋白质二次结构预测。J Mol Biol。1999年; 292:195-202。
- 79.
刘禾,谢烨,马杰,罗XT,聂丕ZX,拉哈曼u,赵q,郑yy,zhao x,zue x,ren j.Ibs:用于呈现和可视化生物序列的插画者。生物信息学。2015; 31:3359-61。
- 80。
珍QL,方q,彭q,廖l,赵l,oviti a,汉yp。开发基因标记的分子标志物,用于评估苹果遗传学关联甜蜜的具有果糖积累的基因。Hortic杂志2018;习用。
- 81。
黄志强,蔡晓峰,刘志强,等。拟南芥和其他植物的多色细胞器标记。植物j . 2007; 51:1126-36。
- 82。
程金涛,文淑英,肖胜,卢斌,马先生,别中良。液泡内糖转运体的过度表达CMTST2.在甜瓜果实中增加糖的积累。J Exp Bot. 2018; 69:511-23。
确认
不适用。
资金
国家重点研发计划项目(No. 2018YFD1000200);中国科学院战略性先导技术专项(No. XDA24030404-4);国家自然科学基金项目(No. 31420103914)。关键词:岩石力学,数值模拟,数值模拟
作者信息
从属关系
贡献
QP进行分子标记发育,基因表达和转基因分析,并制备了稿件。LL和QP进行了统计分析。YC,EL和MN参与基因功能研究。CO,SC,BZ和YH修订了手稿。耶是整体项目领导者。所有作者阅读并认可的终稿。
作者的信息
中国科学院种子设计创新研究院武汉植物园,中国科学院植物种质创新与特色农业重点实验室,武汉430074
钱彭那蔡亚明,赖恩慧,廖辽,郑蓓蓓,Collins Ogutu, Sylvia Cherono,韩月鹏。
中国科学院大学,19A Yuquanlu,北京100049。
钱彭那蔡亚明,赖恩慧,Collins Ogutu & Sylvia Cherono。
日本名古屋大学转型性生物分子研究所。
中村)。
经济植物学中心,中国科学院核心植物园,武汉430074。
廖辽,郑蓓蓓,韩月鹏。
中国科学院中非联合研究中心,湖北武汉430074
Yuepeng汉族。
相应的作者。
给韩月鹏的信。电子邮件:yphan@wbgcas.cn..
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
用于qRT-PCR的引物序列。
附加文件2:表S2。
引物序列的基因标记SSR标记MdSUT在苹果的基因。
附加文件3:表S3。
用于构建载体的引物序列。
附加文件4:图S1。
苹果MdSUTs的预测拓扑示意图。AA,氨基酸。
附加文件5:图S2。
利用SSR标记对苹果品种进行基因分型MdSUT基因。
附加文件6:
图S3。真空靶向靶向苹果,桃,梨和梨和梨子和的末端末端(Lxx11)的真空靶向二亮氨酸基序(Lxx11)的对准拟南芥.
附加文件7:
图S4。表达式MdSOTs在苹果愈伤组织中过度表达MdSUT4.1(黑柱)和引入进入载体PSAK277(控制,灰色柱)。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
彭强,蔡勇,赖鹗。et al。蔗糖转运体MdSUT4.1参与调控苹果的果糖积累。BMC植物杂志20.191(2020)。https://doi.org/10.1186/s12870-020-02406-3
收到了:
公认:
发表:
关键字
- 马吕斯x有明显
- 基因标记标记
- SUT
- 调色剂本地化
- 水果甜