摘要
背景
小麦属植物kiharae(一种T.一种T.GGDD,2N = 42)对于改善面包小麦作为高晶粒蛋白和麸质含量的来源,以及许多疾病的抵抗力是有意义的。指某东西的用途T基哈雷为了改进T. Aestivum.L.由于其基因组的同源程度低,这导致其第一代的配子中的一种不平衡的染色体和一些基因型。本研究的目的是分析外星血栓异性的性质及其对从面包小麦品种交叉中获得的杂种的细胞学稳定性的影响T基哈雷。
结果
使用C键,整个染色体的存在T基哈雷杂种的核型(基因组间代换2G/2B)、染色体臂(中心易位Т2AT.S:2AL),发现涉及第1,第3和第5族同工基团的染色体的终端易位形式的大插入物。分子标记显示出短渗流T基哈雷进入普通小麦品种的基因组。其中1A、1B、2A、5B和6A染色体的渐渗频率最高,而4A和4B染色体未检测到外来染色质。大多数渐渗品系具有较高的细胞稳定性(减数分裂指数为88.18-93.0%)。但含有5B染色体结构重组的品系却例外,影响了染色体突触的主要基因的功能。
结论
在杂交核型稳定期间,遗传物质的迟钝T基哈雷进入基因组T. Aestivum.以短片段的形式才能通过分子标记可检测到的,以全染色体(骨髓组织组)及其大碎片(中心和终端易位)的形式。F中达到的细胞学稳定性水平10.大多数血栓引入线确保了足以成功再现所获得的杂种的功能性配子的形成。
背景
小麦属植物kiharaeDorof。et migusch。(一种T.一种T.GGDD,2N = 42)是在京都大学(日本)的二十世纪60年代在京都大学(日本)开发的人工合成的壮普碘t . timopheevii甲虫。(一种T.一种T.GG, 2n = 28)山羊草属tauschii输出电容。(DD, 2n = 14) [1]. 它结合了两个亲本物种的一系列特征,如正性——对大多数疾病和害虫的抗性、高谷物蛋白质和面筋含量、存在具有抗菌特性的面粉物质——防御素[2那3.],负-低粮食产量,脱粒坚硬,麸质非常强[1].众所周知t . timopheevii甲虫。和近缘种是小麦多倍体进化的一个独立分支,包含完整的染色体T.- 和G-genomes,其在核型结构中不同于普通小麦的A-和B-基因组的染色体的c-粘结4.那5.].
指某东西的用途T基哈雷为了改进T. Aestivum.由于它们的基因组之间的染色体同源性很低,因此导致F的配子中的染色体簇的不平衡1并导致低生育率。其结果是在世代中消除了许多基因型,从而缩小了它们的遗传多样性范围和选择有价值的不同基因组合形式的可能性。
监测异染色质渗入普通小麦基因组的过程是成功利用近缘种的重要经济基因丰富基因库的关键。c带法是定位外来基因渗入的主要方法之一,它可以检测染色体或其臂的替换,以及扩展易位和大缺失[6.根据每条染色体的eu-和异染色质块的模式。然而,许多谷物基因组含有少量异染色质,这限制了该方法的使用。
随着面包小麦和其他谷类作物饱和分子遗传图谱的构建,利用分子标记检测低异色基因组的结构变化和识别短渐渗片段成为可能。然而,这种方法也有局限性,因为它不能识别非同源重排和易位[7.].我们早先展示[8.那9.[只有这两种方法的组合使得可以揭示在远程杂种的基因组稳定过程中产生的结构变换的性质。本研究提供了使用两种方法进行的杂化线的基因组组成的评估。该研究的目的是分析外星血栓异性的性质及其对从面包小麦品种十字架获得的杂种的细胞学稳定性的影响T基哈雷。
结果
小麦线的发展与T基哈雷遗传物质
由于面包小麦品种的杂交T. Aestivum.L. (AABBDD, 2n = 42T基哈雷(一种T.一种T.GGDD,2N = 42),在六个交叉组合中获得杂交颗粒(其中两个是直接的,在哪里T基哈雷用作母植物,4 - 逆,合成小麦用作调用粉。应注意父母小麦品种的影响和交叉方向对三种杂交成功的影响。因此,在其直接和逆转杂交中,在与Saratovskaya 29种类的交叉组合中发现了最高百分比的生育能力。同时,直接交叉组合中的晶粒形成要高得多(47.92-53.85%)(T基哈雷×Festivalnaya,T基哈雷×Saratovskaya 29)比反向方向 - 1.79-9.09%。
我们检测到典型的形态特征的遗传T基哈雷在F1生成,以及f的重组过程中的高水平2 - 4代[10.].在F.中4.鉴定了杂种后代,包含遗传的形态特征T基哈雷(叶子上没有蜡盖,茎和尖峰;茎的紫色着色;暗色和绒毛的青色,纺粉型尖峰)。这些后代被包括在进一步的研究中。对于分子细胞遗传学分析,我们使用了基于世代中的形态特征和生产率的遗传基础上选择了七条杂交线4.- F9.。
c波段
如前所述,C显带技术的有效性直接取决于染色体差异染色模式的饱和度,在该染色模式中分析结构转换。如果这些重组发生在不包含诊断性异染色质带的染色体区域,则不可能使用C-带鉴定重排。这是我们已经鉴定的大多数染色体畸变影响到B-和G-小麦基因组的染色体的原因,其特征是异染色质含量高。
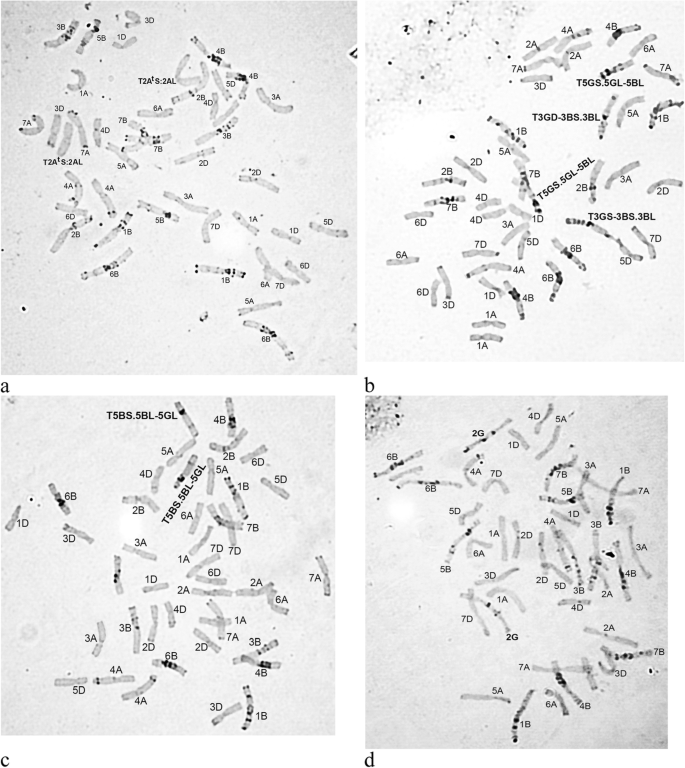
对遗传物质的渐渗进行了研究T.基因组T基哈雷,C键只揭示了这样的事件中心的一个变种T.S.2AL易位,其存在于管线19的所有植物中的发性状态(图。1a).这种易位是单价染色体在减数分裂后期移动,端粒形成时的着丝粒错分裂造成的,再进一步的随机融合导致重组染色体的形成[11.].
在研究的线条中,C绑定没有揭示一个突出T基哈雷d -基因组遗传物质进入普通小麦品种的基因组。
转让T基哈雷G-基因组遗传物质主要通过在相应的同源G-与其同源b基因组之间形成的间质染色体区域的断点易位来实现。共发现4种易位类型,包括1号、3号和5号同源群染色体。
因此,在第20-1号中,在发酵状态下检测异常T1BS.1BL-1GL染色体,由染色体长臂的长臂转移到染色体1B的长臂的远端部分中。在第25-2线的核型中,鉴定出两个易位:T3GS-3BS.3BL和T5GS.5GL-5BL(图。1b)。在第一种情况下,染色体3g的短臂的末端片段被转移到染色体3b的短臂上。在第二种情况下,修饰影响了染色体5g的长臂,到远端部分转移染色体5b的长臂的末端片段。
染色体5G也参与了在34-1和34-2线的核型稳定期间发生的结构重排。然而,这里鉴定的易位是对线25-2描述的易位的互敏:染色体5g长臂的末端片段转移到5B染色体的远端部分(图。1c)。
除了迟钝T基哈雷染色质以染色体臂或大的染色体片段的形式出现,c显带揭示了基因组间染色体替换的形成:在第28行染色体组型中,一对2G染色体替换了一对2B染色体(图2)。1d)。从普通小麦品种的交叉中获得的后代类似替代的高频T基哈雷和t . timopheevii早些时候由一些作者指出[5.那7.那12.那13.].与原始小麦品种相比,唯一没有证明C型绷带图案中的任何变化的线是线31,可能是由于交叉的不同方向(这种情况下的小麦品种用作杂交的母组分)。
SSR-analysis
使用82个SSR标记进行血栓增的分子分析,其中大多数均显示父母小麦品种之间的多态性T基哈雷(附加文件1).PCR图谱分析显示,27%的标记片段为非合成片段T基哈雷基因组。基因分型结果显示,利用渐渗品系DNA扩增出241个等位基因,平均每个位点扩增2.9个等位基因,低于小麦品种(271个,每个位点扩增3.3个等位基因)。由于遗传物质的存在,亲本品种的遗传多样性指数(0.62)高于渐渗品系(0.54)T基哈雷在细胞系的基因组中
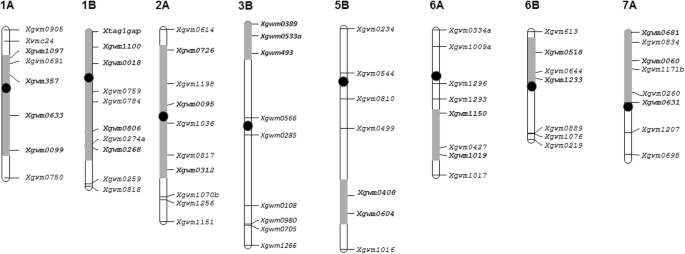
不同品种SSR标记扩增谱的比较分析T基哈雷小麦品种和渐渗系在染色体定位和数量上存在差异T基哈雷渐渗系的基因组片段。渗入片段的数量从4个到8个不等,最大的数量在第19行(表1;无花果。2).没有特异的SSR等位基因T基哈雷在第31行中发现,这与C显带结果一致。
根据微卫星分析,在杂交线中检测到D基因组染色体中的血栓分子。我们不排除存在AE。Tauschii.D基因组染色体中的短暂废物。但是,要识别此类档次,有必要使用额外数量的SSR标记。在基因组中发现滴定:染色体1a(所有研究的线),2a(9,25-2和28),5Al(线20-1和28),6al(19,25-2和34-1)和7as(19,20-1)。使用C键,仅在第19行的染色体2a中检测到结构变化。由于染色体中的少数诊断杂粒素嵌段,未建立基因组的其他染色体中的重排的存在T.的T基哈雷,这也是Badaeva等人之前的。[5.那13.].
扩增特异性PCR片段T基哈雷使用SSR标记定位在染色体3B的短臂(第19和25-2线)中定位的SSR标记。染色体2bl,6bs和7bl中的单个速增收仅在第28,19和34-1线中发现(表1).通过对异染色质大小的比较,发现1A、1B和2A染色体的基因片段长度存在差异。在20 - 1,28和34-1中,1A染色体的渐渗捕获了一条长臂和部分短臂。第25-2行异物片段与第19行长度相同(图)。2),但明显短于其他品系。品系19和28在1B染色体上的导入片段长度相似。在品系20-1中,1B染色体的长臂被替换,而在品系25-2中发现短臂替换。
在2A染色体上也检测到了导入片段长度的差异:在19号品系中,染色体的短臂被替换;第25-2行——它的长臂;在第28行中,在两条染色体臂中都发现了外来片段。至于3B、5A和6A染色体的导入片段长度,根据SSR分析,两个品系之间没有差异。应该注意的是,在第20–1和28行中,似乎有一个完整的5A染色体长臂替换为5A长臂T.从…起T基哈雷。
除第28行外,所有品系5B长臂染色体均有变化。在第19系和第20-1系中,只有5BL端粒区域的两个SSR标记扩增了一个典型的片段T基哈雷(图。2),这表明存在短的外来片段,并且无法通过C-带鉴定它们。适用于具有大型T基哈雷染色质渐渗(25-2和34-1),微卫星分析数据与c带结果一致。
小孢子发生
花粉母细胞(PMC)在减数分裂中的研究表明了F的高细胞学稳定性10.线条。在中期I中,根据0至0.07的小麦品种,每微胞细胞的平均单数量的平均单数变化(表2).在T基哈雷,该参数略高,达到0.4,但在面包小麦(5%)的规范内。
所有杂交种在中期I也发现了高水平的二价染色体配对(表2).应该指出的是,从交叉组合的线条中T基哈雷×Festivalnaya和T基哈雷×Saratovskaya 29,一个足够高水平的染色体突触已经在F2杂交种[14.].在这些杂种的二价染色体中包括的染色体数量为90.8-96.2%。通常,2或4条染色体未参加交配过程。f中确定的最大单价数量2是八点。
F的中期I分析10.线条显示,在大多数线中形成二价的染色体的数量接近100%。在31线中发现了类似于原始小麦品种的最高水平的辛膜,其特征在于没有异血。在第19行,20-1和28线中,单个PMC发生两个单价;线25-2系列具有60%的细胞,其中具有两个单价,其中较少的PMC具有障碍(占分析的PMC的16%)和剩余的40% - 四个。在34-2号线中发现了在减数分裂的阶段(73.3%)和最大单价的最大单位(PMC的最大单位数)的最多PMC(73.3%)和最大单价(6-3.3%)。
完成中期I的分析,应该注意的是,在几代变化期间,开放二偶联的数量显着减少:在F.2后代的平均数量在4.0到5.4之间[14.],在f10.-从0.96到2.87(表2).尽管F2,这种发生的后续分子阶段进行了显着的紊乱,导致正常曲线的百分比低(所谓的减数分子指数,这是正常类型的分裂的指标)从0到32%变化[14.].本研究中获得的结果表明,最多的第十代具有显着稳定的减数循环(表3.). 正常四分体在F10.生产线处于较高水平,通常超过90%。减数分裂阶段的主要异常是微核的存在,微核的数量在所分析的材料中从1到6不等,但通常形成一个四分体,有一个和两个微核。花粉母细胞含有六个微核,仅在两个品系34-1和34-2中观察到T基哈雷×Festivalnaya交叉组合。它们的频率非常低,占分析细胞总数的0.91-1.67%。
通常,微孢菌素的分析使我们得出结论是F的细胞学稳定水平10.大多数的渐渗系保证了足够数量的功能性配子的形成,以保证系的成功繁殖。
讨论
本文报道了由人工合成小麦杂交获得的普通小麦渐渗系的细胞学稳定性和染色体重排的研究结果T基哈雷。根据文献,由于三种杂交而获得的第一代和后续几代杂种的肥力在很大程度上取决于面包小麦的遗传背景。因此,在面包小麦品种Skala,Novosibirskaya 67,Botanicheskaya 2,Altaiskaya 81,Ghnitsa和Chinese Spring之间的三种杂交中许多核的比较t . timopheevii(基因组T.一种T.GG)表明,以新西伯利亚67和斯卡拉为基础的杂交种的育性显著较高[15.].然而,受体的倍率水平对杂交种的生育和染色体配对没有显着影响[16.那17.那18.那19.].
还众所周知,杂交方向会显着影响种类杂交种的生育和细胞学稳定性。因此,在属之间的杂交实验中小子结果表明,如果普通小麦作为雌性而二倍体小麦作为传粉者,其生育能力远低于反向组合[20.那21那22]. 六倍体(2n)杂交结果分析 = 42)和四倍体(2n = 28)早期获得的小麦证明,当传粉者是多色体物种时,可育性要高得多[14.].例如,在组合中,在哪里t . persicum与面包小麦品种Toma交叉作为母植物,与逆向组合相比,生育指数比较高了三倍。
分子细胞学分析T . aestivum / T。kiharae渐渗株系表明有足够高的频率T基哈雷遗传物质渗入普通小麦品种的基因组,分子标记检测到的小片段明显占优势。使用C-分带法,可以检测到T基哈雷(骨髓组替代2g / 2b)和染色体臂(以中心易位т2aT.s:2al)被发现。然而,用于G-基因组染色质转移的主要方法是形成末端易位的形成,导致重组染色体臂的形成,含有两种小麦品种的遗传物质。考虑到识别的易位的特征,假设其形成机制是早期几代同源术中的染色体段的交叉交换的逻辑。在f中存在这种交换的显着有利条件1,基因组A的所有染色体,aT.,b和g是单体状态,一个Ph1在一次剂量中存在基因座。T5GS相互易位的存在支持了这一假设。5GL-5BL(第25-2行)T基哈雷×Saratovskaya 29)和T5BS.5BL-5GL(线34-1和34-2 T基哈雷×节日的纳亚)。值得注意的是,从不同杂交组合中染色体互换的两个产物中,可以选择不同的重组染色体变体。这一事实表明杂交形式(在本例中为原始小麦品种)的遗传背景对外来遗传物质的渗入过程的影响。
发现具有最长外源染色质插入的异常染色体处于二体状态,因此减数分裂中的配对过程应在不受干扰的情况下进行,以确保功能配子的形成。同时,根据C-带分析,三个研究品系(25-2、34-1和34-2)和微卫星分析,大多数品系(品系19、20-1、25-2、34-1)含有涉及染色体5B长臂的易位(表1)1),其中一个Ph1染色体突触的主稳压器的遗迹是本地化的。根据5BL中易位断点的位置,这些易位可能导致完整的Ph1轨迹删除,或表达的变化。在这方面,在杂交线和父母形式的不同阶段的不同阶段的染色体行为的比较研究具有很大的兴趣。
中期分析显示,在所有的F中二价染色体配对水平较高10.行(表1)2).第25-2行突触轻微减弱,包含对异常染色体T3GS-3BS。3提单和Т5 g。5.GL-5BL, is most likely to be a result of structural 3B chromosome transformations, the short arm of which contains a gene that prevents asinapsis (in the case ofPh1基因座功能障碍,后果将是更激进的)。如前所述[23],软质小麦核型中3B染色体或其短臂的缺失导致同源物的部分不同步,这在我们的材料中观察到。在34-2细胞系中,含有一对异常基因Т5ВS的PMC中,I中期异常PMC数量最多(73.3%),单价PMC数量最多(6-3.3%)。5ВL-5GL染色体,当然是由5B染色体的结构重排和变化引起的Рh1轨迹表达。同时,在来自相同交叉组合的第二线(34-1)中,染色质5g-染色体的类似血栓形成的负效应不太明显:具有障碍的PMC的数量是26.6%,这是3-4倍比具有易位不涉及5B染色体的旋转线3-4倍。这些差异可能是由于外星片段的不同长度。
f的减数分子指数10.从Rassvet×××T基哈雷杂交组合和T基哈雷×Saratovskaya 29比亲本小麦品种低6-9%,但25-2也超过90%,其中I中期突触减弱。34-1和34-2T基哈雷×FestivalNaya杂交组合的特点是最低的减数分裂指数(分别为77.0和55.83%)。这些结果与中磷酶I中线的染色体行为的数据吻合良好,并确认在5B染色体中鉴定的结构重排的负面影响。父母小麦品种FestiveNaya的遗传背景与用于杂交的品种中最低的减数分裂指数的影响不应被排除在外。(桌子3.).
结论
研究结果表明,在杂交核型的稳定过程中,突出T基哈雷遗传物质进入T. Aestivum.基因组以仅由分子标记检测的短片段的形式,以全染色体臂(骨髓组织组)及其片段(中心和终端易位)的形式发生。在普通小麦基因组中保存外星取代和易位的必要条件是它们对发育状态的过渡,以及参与其原始基因组的形成染色体。在这些条件下,在配子形成过程中没有显着的紊乱,这确保了许多世代中的血栓引入线的成功再现。异常是影响主要基因染色体突触的功能的缺陷。这导致减数分裂指数的显着降低,对植物的生产力负面影响。
方法
植物材料
在这项研究中,我们使用了f10.由普通小麦品种与合成小麦三个杂交组合获得的株系T基哈雷:第31行(Rassvet×T.Kiharae.);第19行,20 - 1,25 - 2 (T基哈雷×Saratovskaya 29);第28行,34-1,34-2(T基哈雷×Festivalnaya)。这些系是F . c .自花授粉的结果1杂种和随后的几代,基于对世代的形态特性和生产力的遗传评估的基于分子细胞遗传学研究2- F9.。
初始父母面包小麦品种(Rassvet,Festivalnaya)于白俄罗斯共和国的国家植物遗传资源银行收到。面包小麦品种Saratovskaya 29(K-40599)种子和T基哈雷(k-47897)是从俄罗斯联邦国家基因库获得的(vir,联邦研究中心N.i.Vavilov全俄罗斯植物遗传资源研究所,圣彼得堡;http://db.vir.nw.ru/virdb/maindb.).T. Aestivum.XT基哈雷渐渗系是由白俄罗斯国家科学院遗传与细胞学研究所的生态遗传学和生物技术实验室开发的。所有植物材料都保存在明斯克的白俄罗斯国家科学院遗传学和细胞学研究所。
c波段
根据Badaeva等人的方法进行细胞学准备和c显带[24].种子在26°C的培养皿中发芽。根长0.5 - 1.5 cm的幼苗置于26℃0.2%秋水仙碱(Fluka)溶液中2h。之后,用冷蒸馏水洗根,剪断后放入冰水中1小时。醋酸(45%)作为固定物;固定时间- 4小时,2-4℃。冷蒸馏水醋酸洗涤6次,每次10 min。洗涤后将根置于4°C的0.2 N HCl中15分钟。在0.2 N HCL中,在60°C下水解5分钟。在那之后,根被转移到冰水中。 The roots were washed with cold distilled water (six times) for 5 min each. After that, the tips of the roots were cut off and placed in the 0.2% aqueous solution of cellulysin (100,000 cu, “Calbiochem”) at 26 °C for 14 h. The enzyme was washed with cold distilled water. The tips of the roots were macerated for 3 min in 45% acetic acid at room temperature on the slide and then were crushed. The cover glass was removed after slide freezing in liquid nitrogen. The slides were placed in 96° alcohol and stored at 4 °C. The dried slides were treated with the saturated solution of barium hydroxide at room temperature for 6 min. After alkali, the preparations were rinsed first in 1 N HCI for no more than 15 s, then thoroughly washed in running water and dried with hot air. After that, the slides were incubated in the solution of 2 × SSC (0.3 M NaCl + 0.03 M Na citrate, pH = 7.0) at 60 °C for an hour, then washed with running water for 15 min and dried.
用10%Giemsa溶液(“Merck”)在0.125M Tris-HCl缓冲液(“SERMA”)pH = 6.8中进行染色。实验选择染料浓度和染色时间,聚焦在15-30分钟的最佳染色时间上。用自来水流洗掉载玻片,然后用冷空气干燥载玻片并置于二甲苯中以进行脱水。将制备的载玻片置于羚羊(“Serva”)中。
A-, B-, D-, A-的个体染色体鉴定T.- 和G-Genomes根据Badaeva等人开发的差异染色染色体的意识形图进行。[5.那25].使用幅数显微镜(Carl Zeiss,Jena)分析染色的幻灯片。使用Leica DC 300数字摄像机拍摄所选中期板。使用图形编辑器Adobe Photoshop 2017执行所获得的图像的处理。
SSR-analysis
如Skolotneva等人所述,基因组DNA从5至7天幼苗中分离出来。[26].利用SSR标记(WMC、GSM和GSM)对六倍体小麦株系和亲本进行基因分型27那28].如Röder等人所述进行聚合酶链反应(PCR)。[28].在ABI棱镜3100自动测序仪(Applied Biosystems,USA)上进行PCR片段的分离。使用由应用生物系统开发的计算机程序ABI Genescan(版本2.1)计算片段的大小。该计划Genalex M. 6.5 [29]用于SSR分析结果的统计处理。
小孢子发生
在临时压扁制剂上研究了微孢子发生。在离开叶片护套并固定在乙醇 - 乙酸混合物(3:1)之前,切割尖峰。固定后的一天,将该材料转移至70%乙醇,在T = + 2-4℃的分析之前储存。acetoorcein(2%)用作染料。对于每种交叉组合和初始形式,分析了分析了30个中期I和50-80平板的分裂(神木子I和II,即副,所述四苯)的30-80平板。用镜晶透镜100x孔径1.32 mi分析在显微镜幅度(Carl Zeiss,Yena)上分析幻灯片。使用Microsoft Excel执行统计数据分析。
数据和材料的可用性
作者可以确认所有相关数据都包含在文章和/或其补充信息文件中。本研究中使用和/或产生的任何材料均可在通信作者的合理要求下获得。
改变历史
2021年1月15日
这篇文章的修订本已经发表,可以通过原始文章访问。
缩写
- c波段:
-
着丝粒带染色剂
- 脱氧核糖核酸:
-
脱氧核糖核酸
- PCR:
-
聚合酶链反应
- PMC:
-
花粉母细胞
- 苏维埃社会主义共和国:
-
简单的序列重复
参考
- 1。
Dorofeev VF, Filatenko AA, Migushova EF, Udachin RA, Yakubtsiner MM.前苏联文化植物群。L; 1979年。
- 2.
Odintsova TI, Egorov TA, Musolyamov AK, Odintsova MS, Pukhalsky VA, Grishin EV。种子defensinsT Kiharae.和相关物种:防御素编码基因的基因组定位。生物chimie。2007; 89:605-12。
- 3.
刘X,张米,刘x,李h,郝m等。新合成的分子细胞遗传学鉴定小麦属植物kiharae具有高抗条纹锈蚀。遗传资源作物evol。2018; 65:1725-32。
- 4.
结构染色体的分化小麦属植物timopheevii那Triticum Turgidum.和T. Aestivum.。Al Appl Genet。1999; 98:744-50。
- 5。
Badaeva ED,Budashkina EB,Bilinskaya EN,Pukhalskiy VA.小麦种间杂种的基因间染色体替换及其在小麦遗传命名中的应用小麦属植物timopheevii染色体。rus j genet。2010; 46(7):769-85。
- 6。
Gill BS,Friebe B,Endo Tr。标准核型和命名系统,用于描述小麦的染色体带和结构畸变(小麦L.)。基因组。1991年; 34(5):830-9。
- 7。
蒂莫诺娃EM,莱昂诺娃IN,Röder MS,萨利纳EA。标记辅助开发和鉴定一组小麦携带不同基因渗入的品系t . timopheevii基因组。摩尔品种。2013;31:123-36。
- 8.
Silkova Og,Dobrovolskaya ob,Adonina Ig,Kravtsova La,Salina Ea,Shchapova Ai,Shumny VK,Dubovets Ni,RöderMs。使用C型粘结,GISH和SSR标记的麦克赖特替代线和核型染色体组成的鉴定。rus j genet。2006; 42(6):645-53。
- 9.
Orlovskaya oa,Leonova In,Adonina Ig,Salina ea,Khotileva Lv,舒米沃克。小麦和小麦系的分子Сytogency分析具有突出的遗传物质Triticeae部落的物种。《应用研究》2016;6:527-36。
- 10。
Orlovskaya OA,Koren LV,Khotyleva LV。小麦杂交种的形态学分析在Triticeae部部落中的远程杂交。Vestsínanbelarusí,er。Bíyal。Navuk。=新闻南白俄罗斯。Ser Biol Sci。2011; 3:29-33。
- 11.
对配对基因的影响Ph1关于普通小麦的Centromere误区。遗传学。1998年; 148(4):1285-94。
- 12.
Brown-Guedira G,Badaeva E,Gill BS,Cox Ts。染色体替代品小麦属植物timopheevii在普通小麦和一些观察的多倍体小麦种的进化。Theor Appl Genet 1996; 39:1291-8。
- 13.
Badaeva ed,Zelenin Av,Prokofieva Zd,Bilinskaya en,Obolenkova La,Pukhalskii Va,Solomatin da。通过跨越普通小麦获得抗黄色生锈和粉状霉菌的细胞遗传学分析(小麦L., AABBDD)与Timopheevi群小麦(AT.一种T.GG)。中国科学(d辑:地球科学)2000;36(12):1401-10。
- 14.
Orlovskaya OA,Koren LV,Khotyleva LV。远程杂交产生的小麦杂种的细胞学特征Triticeae部落。Vestsínanbelarusí,er。Bíyal。Navuk。=新闻南白俄罗斯。Ser。BIOL。SCI。2010; 4:50-4。
- 15.
Kozlovskaya vf,mesalitin gm。交叉结果的变化小麦L.t . timopheevii甲虫。rus j genet。1992年; 28(9):97-104。
- 16。
Grigorieva LP。在第一代中的形式建设过程中的小麦三代杂种杜鲁姆desf。Xt . timopheevii甲虫。阿尔泰消息报国立大学J. 2006; 3:61-3。
- 17。
赫勒波娃有限公司。小麦基因型多样性和生长条件对第一回交后代育性的影响硬粒小麦desf。X小麦属植物timopheevii甲虫。Izvestiya阿尔泰国立大学J.2010; 3:64-8。
- 18。
Järve K, jacobson I, Enno T.四倍体小麦种小麦属植物timopheevii和小麦科在普通小麦改良中。农学学报。2002;50(4):463-77。
- 19.
Bai D,Knott Dr,Szale J.叶锈抗力的转移小麦属植物timopheevii到硬粒小麦和面包小麦,以及1A染色体上一个基因的定位。acta botanica sinica(植物科学学报)1998;78:683-7。
- 20。
molnár-lángm,linc g,szakácsé。小麦大麦杂交:过去40年。Euphytica。2014; 195:315-29。
- 21。
Bozhanova v,Todorovska E,Hadzhiivanova B,Dechev D.获得杜伦特小麦(2N = 28)和小黑麦(2N = 42)之间的间隙杂交种和先进的回车线中外星血栓分子的分子证据。土耳其J学业NAT SCI。2014; 1:868-74(特别问题)。
- 22。
WHITFORD R,FERURY D,REIF JC,GARCIA M,Okada T,Korzun V,Langridge P.杂种繁殖在小麦:技术改善杂交小麦种子生产的技术。J EXP BOTANY。2013; 64(18):5411-28。
- 23。
西尔斯。普通小麦的非整倍体。密苏里农业试验站与美国农业部合作;1954
- 24.
巴达耶娃ED、巴达耶夫NS、吉尔DS、菲拉滕科AA。水稻种内核型分化Triticum Araraticum.(Poaceae)。植物系统中的Evol。1994年; 192(1):117-45。
- 25.
《染色体护照》小麦L. Em Thell。简历。中国春季与谷物染色体分析的路障。咖喱店。1990; 18(4):273-81。
- 26.
Skolotneva es,Leonova In,Bukatich Ey,Salina EA。鉴定具有宽谱抗性疾病的有效小麦基因的有条理方法。VAVILOVSKII ZHURNAL GENETIKI I SELEKTSII = VAVILOV J Genet繁殖。2017; 21(7):862-9。
- 27.
面包小麦的高密度微卫星共识图(小麦L.)。Al Appl Genet。2004; 109(6):1105-14。
- 28。
RÖDERSMS,Korzun V,Wendehake K,Plaschke J,Tixier MH,Leroy P,Ganal MW。小麦微卫星地图。遗传学。1998年; 149:2007-23。
- 29。
山顶R,Smouse P.Genalex 6.5:Excel中的遗传分析。教学和研究人口遗传软件 - 更新。生物信息学。2012; 28(19):2537-9。
确认
作者感谢M.S. Röder (IPK, Gatersleben, Germany)收集了本研究中使用的微卫星引物。
关于这个补充剂
本文已作为BMC Plant Biology Volume 20 Supplement 1, 2020: Selected articles from the 5th International Scientific Conference“Plant genetics, genomics, bioinformatics, and biotechnology”(PlantGen2019)的一部分发表。该补充的全部内容可在网上找到//www.cinefiend.com/articles/supplements/volume-20- supplement-1.。
资金
这项工作得到了白俄罗斯共和党基础(ProMallb18R-028)和俄罗斯基础研究基础(项目18-516-00001)的支持。俄罗斯基础基础研究资助出版成本(项目18-516-00001)资助。资助者在研究设计,数据收集和分析中没有作用,决定发布或准备稿件。
作者信息
隶属关系
贡献
ОО渐渗系的发展,小孢子基因分析。染色体的ND c带分析与鉴定。IL SSR基因分型及数据分析。LS制备细胞学玻片。OO, ND和IL准备了手稿的初稿。所有作者都已阅读并批准了手稿的最终版本。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者声明没有竞争利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
本文已更新。原始出版物包含错误的历史日期。
补充信息
附加文件1
小麦亲本和渐渗系SSR标记扩增片段长度(bp)。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Orlovskaya,о.,杜布茨,N.,Sovovey,L.et al。小麦异基因导入的分子细胞学分析Triticum aestivum.与T基哈雷。BMC植物BIOL.20,201(2020)。https://doi.org/10.1186/s12870-020-02407-2
已收到:
公认:
发表:
关键字
- 常见的小麦T. Aestivum.L.
- 合成小麦T基哈雷
- 渐进线
- c波段
- SSR分析
- 小孢子发生
- 细胞学稳定性