- 研究文章
- 开放访问
- 发布:
CYP450和UGT超级家庭成员从转录组的鉴定和分析Aralia Elata.(MIQ。)似乎揭示了三萜类皂苷生物合成的候选基因
BMC植物生物学体积20., 文章编号:214.(2020)
摘要
背景
细胞色素P450(CYP450)和UDP糖基转移酶(UGT)基因超家族的成员在次级代谢产物的生物合成中起着重要的调节作用。然而,系统鉴定CYP450s和UGTs在国内外尚未见报道Aralia Elata.(miq。)似乎,一个高度重视的药用植物。
结果
在本研究中,我们进行了叶片、茎和根的rna测序(RNA-seq)分析答:补给线,总共产生66713个单基因。通过注释和KEGG通路分析,共鉴定出64个与三萜骨架合成相关的unigenes, 254个cyp450位点和122个UGTs位点。利用编码> 300个氨基酸蛋白的150个CYP450s和92个UGTs进行系统发育和组织特异性表达分析。这使得我们可以将150个CYP450蛋白聚为9个家族和40个家族,然后这些CYP450蛋白进一步分为两个主要分支:a型(53%)和非a型(47%)。对92种ugt和其他植物ugt进行系统发育分析,聚类为16组(A- p)。我们进一步评估了这些CYP450和UGT基因的表达模式A. Elata.分别选取23个CYP450和16个UGT成员进行qRT-PCR验证。根据这些数据,我们确定CYP716A295和CYP716A296是最有可能与齐墩果酸合成相关的候选基因,而CYP72A763和CYP72A776被确定为最有可能在hederagenin生物合成中发挥作用的基因。我们还选择了5个单基因作为齐墩果酸3-O-葡萄糖基转移酶的最佳候选基因。最后,我们评估了三种CYP450蛋白在细胞内的亚细胞定位拟南芥原生质体,突出了它们定位成内质网的事实。
结论
本研究系统分析了基因家族的CYP450和UGTA. Elata.并为这两个多烯家族的进一步函数表征提供基础。
背景
Aralia Elata.(miq。)似乎is a member of the五茄科家庭和在韩国,日本,俄罗斯和中国的广泛发展,在那里它用作食物和药用植物[1].由于他们独特的味道,年轻A. Elata.射击常见于亚洲的许多地区[2].此外,这些植物的根和树皮通常纳入称为“Cilaoya”的中药。之前的植物化学研究已经确定了三萜类皂苷是内部的主要生物活性物质A. Elata.,这些化合物已用于治疗神经衰弱[3.,糖尿病[4],肝炎[5]和胃痉挛[6].从叶子中分离出许多不同的三萜皂苷(Chikusetsusaponins IVA和IV和IV和araloI族A,B,V,VII和X)[7,8根本吠[9,10.].因此,A. Elata.是研究三萜皂甙生物合成的理想选择,尤其是那些hederagenin和oleanane类型的皂甙。
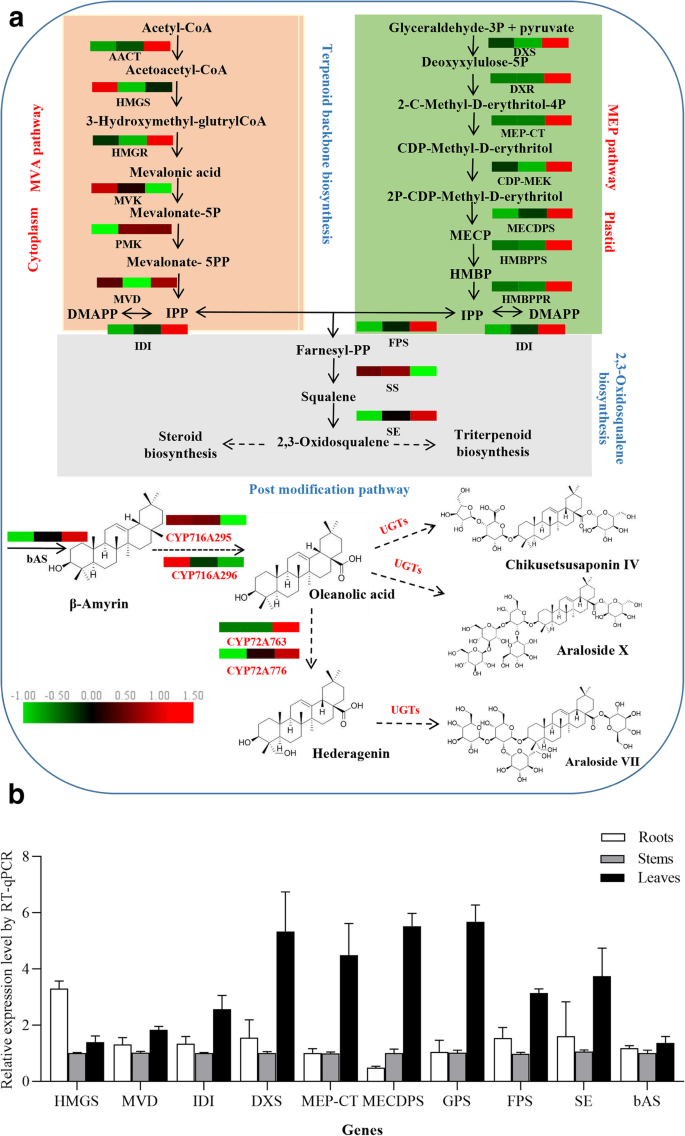
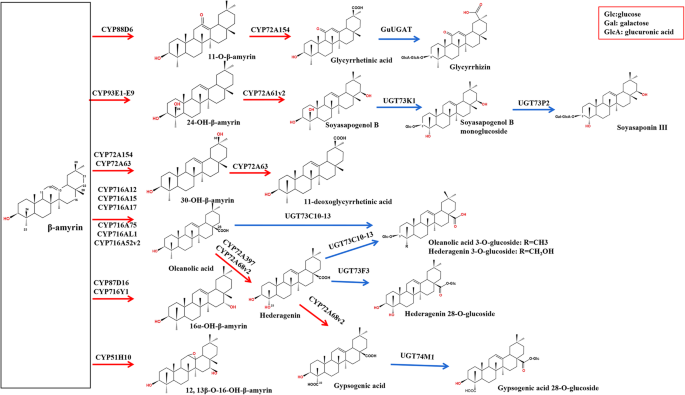
Triterpenoids和类固醇是一种高度多样化的天然产品,它们主要共享一种代谢途径,可分为三个部分[11.] (图。1一种)。最初由异戊烯基二磷酸(IPP)产生三萜素,其衍生自胞质溶素酸(MVA)或磷酸性甲基吡咯醇磷酸(MEP)途径。MVA途径负责三萜类生物合成。IPP还可以通过IDI(异戊烯基二磷酸异构酶)的作用进行异构转化为DMAPP(二甲基丙烯酸二磷酸)[12.]. 法尼基二磷酸(FPP)合酶(FPS)负责催化IPP和DMAPP单元进行连续缩合,与反应中间体香叶基二磷酸(GPP)一起生成FPP。两个FPP分子被角鲨烯合成酶(SS)和角鲨烯环氧化酶(SE)催化生成2,3-氧化角鲨烯。其次,2,3-氧化角鲨烯环化由氧化角鲨烯环化酶(OSCs)驱动,产生不同的三萜主链[13.],包括β-amyrin、植物甾醇、达玛烷和羽羽素[11.].因此,该步骤是三萜类化合物和植物甾醇生物合成的关键分支点[14.] (图。1a).最后,CYP450s和UGTs控制随后的氧化、羟基化和糖基化步骤,以生成三萜皂苷和植物甾醇[15.].在五胞苷三萜类化合物生物合成的背景下,预测在C-2β,C-16α,C-23和C-24的C-28,C-16α,C-23和C-24的C-28中引入羧基的CYP450S以形成多个皂苷,如烯醇酸,海燕蛋白和甘草酸[16.].可以将糖基化酶糖素蛋白在C-3和C-28位置糖素溶解,以形成具有特定结构和活动的单核苷或双泡醛皂苷[17.].先前的研究已经强调了不同的酶在三萜骨架合成中的关键作用,而参与这些蛋白质生物合成后多样化的酶仍有待完全描述。
植物中的CYP450和UGT基因高度多样化,对Triterpenoid Saponin结构的多样化至关重要[18.,19.].因为这些基因家族中有很多成员,所以很难完全阐明它们在生物合成中的作用[20.].然而,RNA-SEQ和其他测序技术现在提供了更容易识别CYP450和UGTS的机会[21.].一个先前的RNA-SEQ分析三个Panax诺辛植物LED作者分别识别编码CYP450S和UGT的预测未预测的未预测[22.].类似的,转录组学评估冬青属植物研究人员发现了233个cyp450和269个UGT,其中14个cyp450和1个UGT在三萜皂苷生物合成中起作用[12.]. 尽管A. Elata.该植物具有巨大的经济和药理应用价值,迄今为止尚未建立该植物的转录组数据库,也没有研究系统地鉴定涉及花生苷生物合成的基因。
在这项研究中,我们进行了RNA测序以分析三种不同的转录组谱A. Elata.组织。我们进一步进行了系统分析A. Elata.CYP450和UGT家族成员在转录组水平。接下来,基于系统发育分析和表达谱,我们鉴定了参与氨罗糖苷的候选CYP450和UGT家族成员基因。最后,然后进行三个候选CYP450S进行亚细胞定位分析。本研究的结果将有助于促进进一步的研究,以更好地了解CYP450和UGT基因在Biosynthestic Saponis生物合成后生物合成的作用中的作用A. Elata..
结果
定量分析的A. Elata.aralosides
皂苷存在于A. Elata.主要含有齐墩果酸和皂苷元苷元[3.],这些植物组织间总芳香苷和单体芳香苷的积累存在显著差异。确切地说,是叶子A. Elata.已发现这些皂苷的含量最多,在根和茎组织中含量逐渐降低。这些植物的根中齐墩果酸含量高于其他测试组织,而hederagenin含量在叶片中相对于根和茎最高1;额外的文件1:图S1)。在这些样品中还检测到两种油酸型皂苷(chikusetsusaponin IV和araloside X)和一种hederagenin型皂苷(araloside VII)A. Elata.样品中,根chikusetsusaponin IV含量相当高,而在叶和茎组织中含量最低。相比之下,我们在这些植物的叶片中检测到高水平的芳香苷VII和X,这表明不同的ugt对它们的产生起作用。这些组织特异性的皂苷分布模式为研究确定参与花生皂苷生产的CYP450s和UGTs提供了有价值的参考A. Elata..
新创A.elata序列组件
鉴定这些与皂苷生物合成有关的基因A. Elata.植物,我们接下来使用Illumina Hiseq 4000平台来序列,序列,叶子和干组织样品中的总RNA转录om。总共产生了448,112,618个读数,该读数组装成82,238个折叠,最长为16,016bp,平均折叠长度为1058 bp。然后,我们能够将这些Contig组装成66,713个未成熟,1846 BP N50长度(表2).接下来,使用BLASTN和BLASTX算法对这些unigenes进行KEGG、UniProt、NCBI non - redundant nucleotide (Nt)和Nr数据库的注释,共注释35232 (52.81%)unigenes (Additional file .)2:图S2)。这些转录组序列数据已存储在NCBI Short Read Archive (SRA)中,注册号为SRP216867,注册号为BioProject的注册号为PRJNA555256。
萜类主干和三萜生物合成途径的富集
在注释7291之后A. Elata.通过KEGG数据库,分别发现79个和47个unigenes与萜类主干和倍半萜/三萜生物合成途径有关,其中包括MVA和MEP途径以及2,3-氧化角鲨烯生物合成途径(图1)。1a). KEGG通路分析显示,编码6种酶(AACT、HMGS、HMGR、MVK、PMVK和MVD)的14个unigenes与MVA通路相关。其中,5个unigenes被注释为HMGR, HMGR在该途径中至关重要,因为它催化3-羟甲基-谷甘油三酯辅酶a转化为美拉醛酸(Fig.)。1a).然而,在质体中,IPP是通过MEP途径形成的,其开始于丙酮酸和甘油醛-3-磷酸。共编码9种酶(DXS、DXR、MEP-CT、COP-MEK、MECDPS、HMBPPS、HMBPPR、IDI、GPS)的22个unigenes被注为参与该通路的酶(图1)。1一种)。另外,发现编码4个推定酶(FPS,SS,SE和BAS)的28个未成熟与碳环生物合成相关(附加文件3.:表S1)。对于这些基因中的大多数,我们能够将> 1单基因映射到一个给定的基因或基因家族(附加文件3.:表S1),表明这些序列可能对应于一个给定基因的多个拷贝或部分片段[23.].在每一个酶促反应步骤中,那些在不同组织中有差异表达且与功能特征基因具有高度一致性的unigenes被选择并排列成一个热图。如图所示。1A,这些基因在不同的地方表现出明显的差异表达A. Elata.组织。有趣的是,涉及MEP途径的所有基因相对于根或茎,叶片在叶中表现出更稳健的表达,而参与来自HMGS,MVK和SS以外的MVA途径的基因也以较高的叶片表达。为了确认这些RNA-SEQ发现是准确的,选择这些19个基因中的10个,通过QRT-PCR评估它们在一系列组织中的表达谱。同意与我们的转录组数据,所选基因在叶中的较高水平表达,除了HMG,其在根中以较高水平表达(图。1b)。这些发现表明,关键三萜骨架生物合成反应主要发生在叶片中,解释为什么发现叶片含有更高的皂苷浓度(表1).
A. Elata.CYP450鉴定和系统发育分析
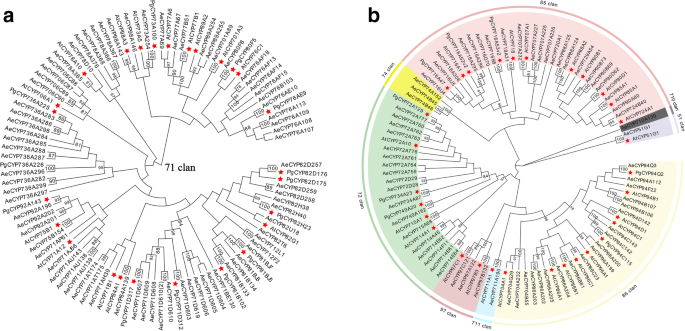
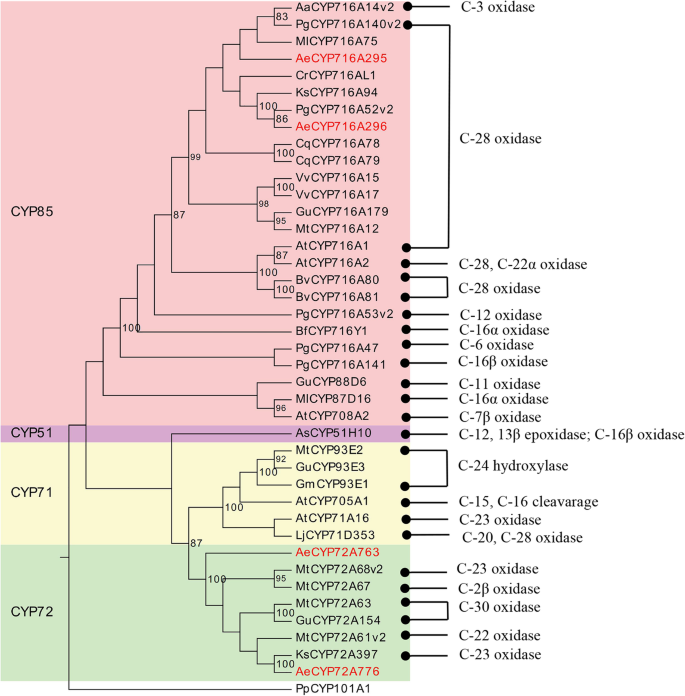
通过转录组学分析,我们鉴定出254个CYP450基因A. Elata.样本。CYP450单基因总数(254个)低于研究中确定的数量拟南芥(272)和人参(484)。为了获得更全面的CYP450基因家族的理解,我们可以使用等位基因,亚家族和家庭变量截止值分别与CYP450数据库的比对分类为150 CYP450编码蛋白> 300氨基酸,分别为97,55和40%[24.].David Nelson教授根据仔细注释的CYP450参考数据库中的参考序列命名为这些CYP450。我们最终能够将这些CYP450分为9个分类,40个家庭和75个亚属,53%是CYP450S,47%是非A型CYP450S(附加文件4:表S2)。CYP71家族代表所有a型cyp450家族,共包含17个家族的79个基因(包括CYP71、CYP73、CYP75-CYP78、CYP80-CYP82、CYP84、CYP89、CYP92、CYP98、CYP701、CYP706、CYP712和CYP736)。
为了进一步探讨它们的功能作用和进化关系A. Elata.CYP450S,150 CYP540S以及57 CYP450SA. Thaliana.(37)p .人参(20)用于产生用于型的NJ系统发育树(图。2a)和非型(图。2b) cyp450,分别。如图所示。2a, 79个CYP71成员和28个具有代表性的cyp450被分入17个单支系。非a型CYP450s的系统进化树分为8个分枝,包括3个单家族(CYP51、CYP710和CYP711)和5个多家族(CYP72、CYP74、CYP85 - 86和CYP97),其中CYP85、CYP86和CYP72最大,分别含有23、20和17个CYP450s;和CYP711各只包含一个成员(图。2b)。
A. Elata.UGT鉴定及系统发育分析
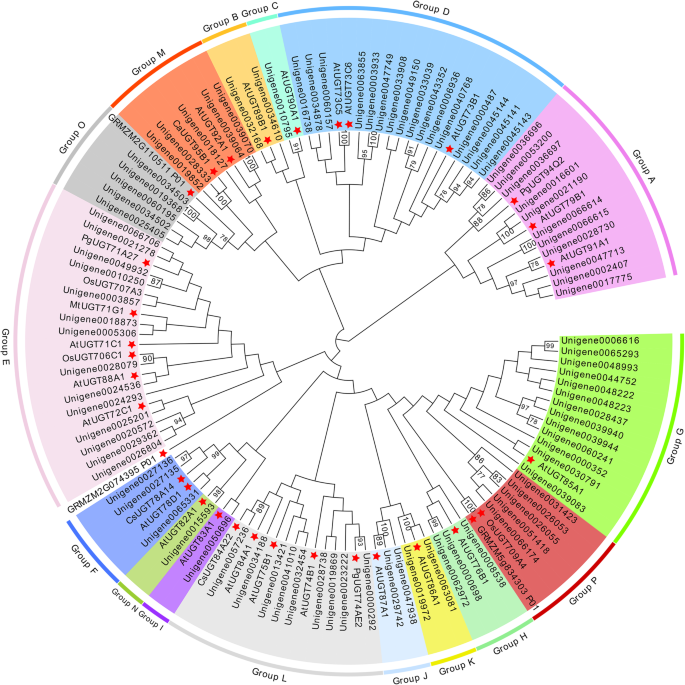
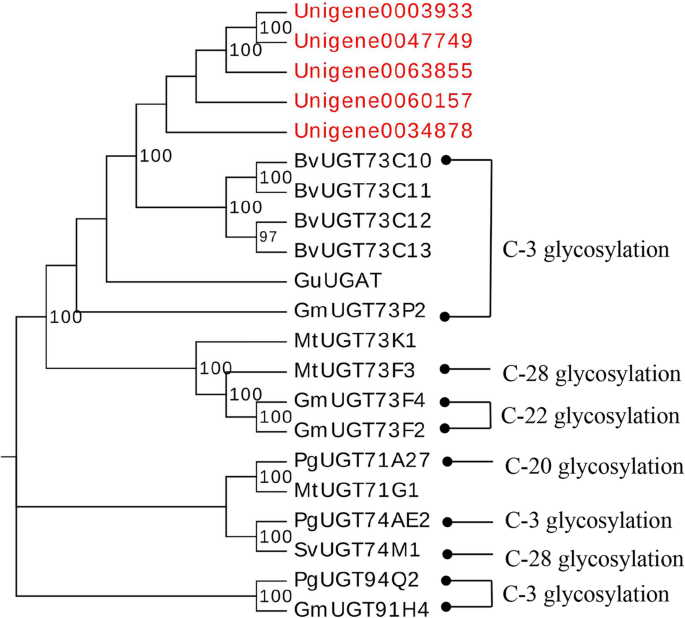
我们注释了122个单基因A. Elata.转录组作为编码蛋白质的UGTS,其长度为77-704氨基酸。然后,我们省略了那些未替代蛋白质的植物,其屈服于300个氨基酸,得到92 ugts,其与功能表征植物UGT的胚乳进行了底层,其中具有> 40%蛋白质序列相似性的那些被纳入同一家族(附加文件5:表S3)。我们将87 UGTs分成22个UGT家族,而5 UGT(Unigene0019368; Unigene0025405; Unigene0034502; Unigene0034503; Unigene0034503; Unigene0034503; Unigene0034503)推导出与代表性序列相同的氨基酸序列<40%,因此无法分配。UGT73家族是最大的家庭,16个基因,下一个最大的家庭是UGT 85家族,有13名成员。
我们对齐A. Elata.UGT氨基酸序列与其他功能表征植物UGTS的序列拟南芥,人参,Medicago truncatula,奥雅萨苜蓿,玉米,中投arietinum,和番红花(附加文件6:表S4),构建系统发育树。这些A. Elata.将UGTs在文源分离成16组中,其中包含14个保守基团(A-N)拟南芥和两种新的组(O和P;图。3.)鉴定于玉米[25.,26.].不A. Elata.ugt纳入q组,D组有16个UGT73家族成员,数量最多A. Elata.UGT组,而组C,I和N仅包含一个UGT。
A. Elata.CYP450和UGT基因组织特异性表达模式
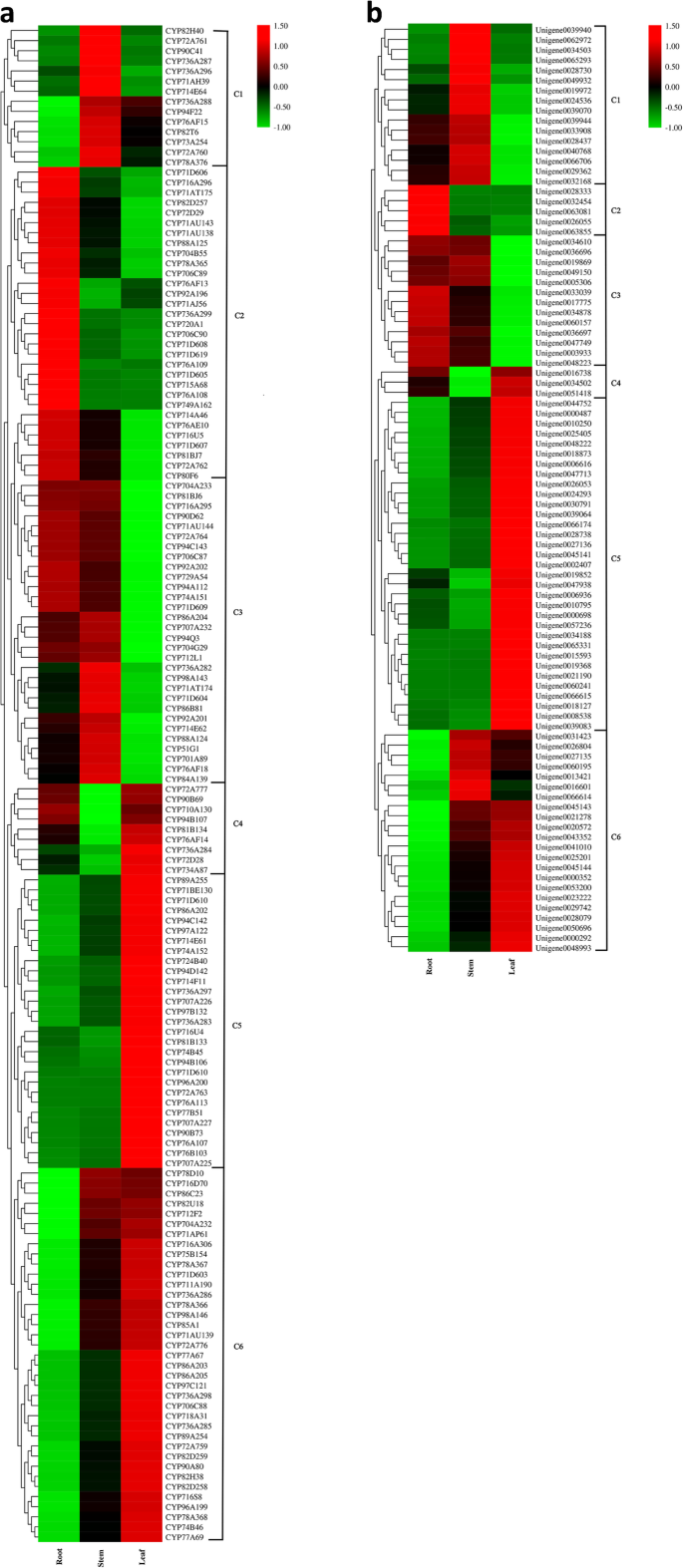
了解CYP450S和UGTS的组织特异性表达A. Elata.,接下来,我们分析了它们在三种不同组织中的表达谱,这些组织已经进行了RNA-seq分析。在这150个cyp450和92个ugt中,我们发现分别有132个(87.42%)和78个(84.78%)在这些组织中表现出不同的表达模式。使用层次聚类分析来评估这些不同分析中CYP450和UGT的共表达模式,并根据RPKM归一化表达值构建这些基因的表达谱热图。聚类分析将150个CYP450s和92个ugt划分为6个聚类(C1-C6;无花果。4将在根(31个基因)、叶(29个基因)和茎(15个基因)中表达量最高的cyp450分别归为C2、C5和C1簇。此外,C3(31个基因)、C4(8个基因)和C6(36个基因)的cyp450基因在叶、茎和根组织中表达量最低。对不同的A. Elata.组织表明CYP450在叶子(48.67%)和根(41.33%)的高水平下表达(图。4a).然而,相对于根(19.57%)和茎(17.39%),叶中ugt的高表达比例(63.04%)较高(图3)。4b).这表明ugt的修饰主要发生在叶片中,解释了叶片中次生代谢产物的多样性。
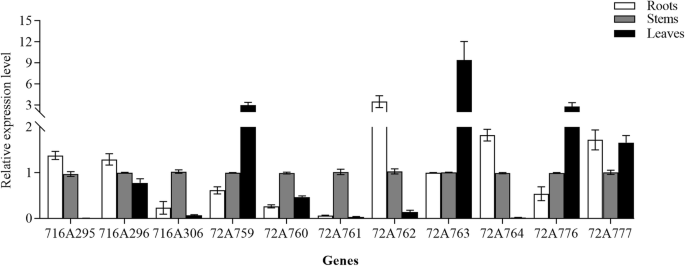
QRT-PCR方法进一步用于验证这些转录组体发现,表达式为12个随机选择的CYP450S量化(附加文件7:图S3)。这些CYP450表达谱与RPKM值一致,证实了我们的RNA-seq数据的有效性。先前的研究表明,CYP72A和CYP716A亚家族成员是参与五环三萜皂苷生物合成的主要cyp4508:表S5)。因此,我们接下来专门专注于3CYP716A和8 CYP72A基因的表达模式A. Elata.转录组。这些基因的qRT-PCR图谱显示两个CYP716A基因(CYP716A295和CYP716A296)和两个CYP72A基因(CYP72A762和CYP72A764)在相对于茎和叶的根组织中高水平表达。这四个基因的表达与齐墩果酸含量的测定结果一致。相比之下,CYP72A759、CYP72A763和CYP72A776在叶片中的表达水平较高,在茎和根中的表达水平较低,这三个基因的表达模式与hederagenin的含量一致(图。5).这些结果为三萜皂苷生物合成相关CYP450候选基因的筛选提供了参考。
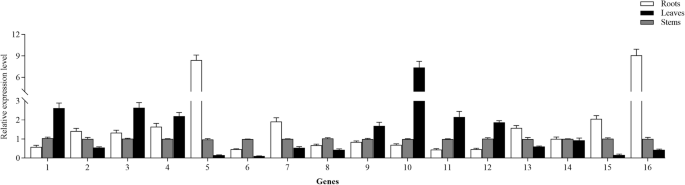
考虑到UGT73家族成员主要催化齐墩果酸和hederagenin在C-3和C-28位点的糖基化(附加文件9:表S6),通过qRT PCR分析本研究中鉴定的16个UGT73成员的组织特异性表达谱。如图。6,这16个UGT73成员中的15例在三种组织中表现出显着的差异表达谱。其中,7个转移酶(Unigene0000487,Unigene0006936,Unigene0016738,Unigene0043352,Unigene0045141,Unigene0045143和Unigene0045144)在叶中最高度表达,尽管有六个转移酶(Unigene0003933,Unigene0033039,Unigene0034878,Unigene0047749,Unigene0060157和Unigene0063855)的根部大多表达,茎和叶中逐渐降低。这些发现表明,大多数UGT73成员都高度表达A. Elata.根和叶。
参与三萜生物合成的候选CYP450s的鉴定
Hederagenin糖苷酮和olearolic acid是主要的sapogenins答:补给线,因此,我们专门评估了与这些Sapogenins的合成相关的CYP450S.迄今为止,共发现36个cyp450在三萜生物合成中起作用(图1)。7;额外的文件8:表S5)。CYP716A和CYP72A Subcamilies是参与五环素萜类皂苷多样化的主要CYP450基因系列,CYP716A系列是参与此类甲烷型三萜类皂苷生物合成的最大的多功能C28-氧化酶系列[16.,27.,28.] (图。8).我们能够鉴定3种CYP716A基因(CYP716A295,CYP716A296和CYP716A306)和8种CYP72A基因(CYP72A759-764,CYP72A759-764,CYP72A776-777)A. Elata.转录组。为了鉴定涉及五胞苷三萜类皂苷生物合成的最相关的未成年人进行进一步分析,我们对这些比较了Blastx搜索A. Elata.CYP450S到已知参与三萜类生物合成的那些36个CYP450。该分析透露了A. Elata.CYP716A295和CYP716A296的同源性分别为93.97和94.39%p .人参CYP716A52V2分别是含有蛋白酸生产的β-淀粉酶28-氧化酶[29.] (图。8).此外,CYP716A295和CYP716A296在根中的表达量高于茎和叶,与齐墩果酸含量一致(图1)。5桌子1).因此,我们选择CYP716A295和CYP716A296作为可能参与齐墩果酸生物合成的最佳候选cyp4500s答:补给线。两个CYP450s (CYP72A397和CYP72A68v2)已被鉴定为齐墩果酸23氧化酶,催化齐墩果酸氧化成hederagenin [30.,31.] (图。8).在本研究中,我们观察到CYP72A759、CYP72A763和CYP72A776在叶组织中的表达水平较高,而在茎和根中的表达水平逐渐降低,这与观察到的hederagenin分布曲线相一致(图1)。6).BLASTx分析进一步表明,CYP72A763和CYP72A776对齐墩果酸23-羟化酶CYP72A397的同源性分别为54.92和70%。基于这些结果,我们进一步选择了CYP72A763和CYP72A776作为最可能参与hederagenin生物合成的cyp450位点,虽然还需要进一步的功能验证。
系统发育分析显示CYP716A295和CYP716A296在CYP716A亚家族中分组并与其最密切相关美沙、CYP716A75和p .人参CYP716A52V2分别编码β-淀粉酶参与OLEALIC酸生产的β-淀粉酶28-氧化酶[29.,32.].CYP72A763和CYP72A776聚集在CYP72A组中,与CYP72A776的亲缘关系最为密切M. Truncatula.CYP72A68V2和kalopanax septemlobus.分别编码β-amyrin 23-羟化酶的CYP72A397 [30.,31.] (图。7).
参与三萜生物合成的候选UGTs的鉴定
为了确定哪些ugt参与了花生苷糖基化,用blastp比较92A. Elata.到16个功能特征的ugt。我们确定了5个Unigene0003933、Unigene0034878、Unigene0047749、Unigene0060157和Unigene0063855的同源性为50-60%Barbarea寻常的UGT73C10-13,其催化葡萄球酸和HEDeragenin的3-O-葡糖基化[17.] (图。8).这表明这些unigenes可以编码在C-3位置催化奥沙尔醇和Heederagen葡萄糖糖基化的重要酶。我们还使用QRT-PCR确认这五种UGT在根中的高水平表达,茎和叶中的表达水平较低,与这些组织中观察到的OleAlolic acid分布一致。这表明OleAlic酸的3-O-葡萄糖化发生在根中。系统发育分析表明,这五种UGT在UGT73家族中被分组,并且与之密切相关Barbarea寻常的UGT73C10(图。9).因此,我们将这些UGT鉴定为参与在C-3位置的蛋白酸的糖基化的候选者,尽管未来的功能测定是必要的确认这一结果。
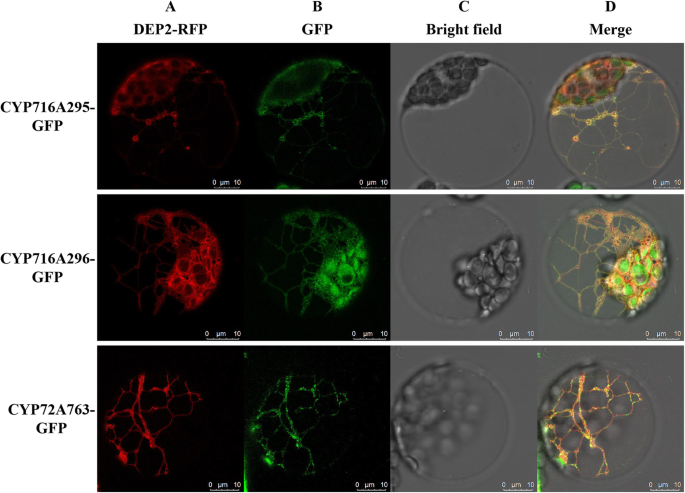
评估三种CYP450的亚细胞定位:GFP融合蛋白
几乎所有CYP450S都是膜相关蛋白质,其定位于ER,相对较少地定位叶绿体和线粒体[33.].如上所述,所有150人A. Elata.预计本研究中识别的CYP450S将定位于ER。为了确认这种预测,我们进行了PEG介导的瞬态表达拟南芥用CYP450-GFP报告蛋白和DEP2-RFP(ER靶向标记)共转化原生质体[34., CYP716A295、CYP716A296和CYP72A763均被选中进行亚细胞定位分析。与在拟南芥研究发现,在表达DEP2-RFP的原生质体中,CYP450-GFP荧光蛋白在CYP716A295、CYP716A296、CYP72A763荧光蛋白和DEP2-RFP荧光蛋白之间存在重叠,呈网状带状。因此,我们得出结论,CYP716A295、CYP716A296和CYP72A763是结合在ER膜上的酶,这与Cell-PLoc的预测一致(图1)。10.).
讨论
虽然两A. Elata.和p .人参是Triterpenoid Saponin的成员五茄科通常用于传统药用背景的家庭,p .人参迄今为止,其基因组已在人参基因组数据库(http://ginsengdb.snu.ac.kr/).相比之下,迄今为止进行的分子生物学研究的重点是A. Elata.,没有相应的基因组或转录组数据在NCBI数据库中可用于此类物种。本研究是第一个进行DE Novo转录组分析A. Elata.对这些植物的根、茎和叶组织样本进行3次重复分析。利用Illumina HiSeq 4000平台对9个样本的文库进行测序,得到66713个unigenes,其中一半以上在公共数据库中注释良好。unigenes的N50和平均长度与这些测序结果的有效和高质量组装一致[35.].这种深度测序分析的结果具有巨大的价值,作为鉴定参与药理学相关次生代谢物生物合成的那些基因的方法A. Elata.我们对这些植物中涉及三萜皂苷的CYP450s和UGTs进行了鉴定。
装配后和注释A. Elata.转录组在本研究中,我们能够在这些样品中开始检查三萜骨架生物合成和癫痫萜类生物合成途径,导致鉴定19个功能基因。虽然这两个途径是众所周知的,但对于Terpenoids和甾醇的生物合成很重要P. notoginseng.[22.] 和Hedera螺旋l . (23.[目前分析的结果是对这些途径的首次综合分析A. Elata..三萜和倍半萜通过MVA途径合成,主要发生在细胞质中,而单萜、二萜和四萜通过MEP途径合成,主要发生在质体中[11.].基于RPKM值比较基因表达水平,用QRT-PCR用于验证。这些分析A. Elata.表明参与皂苷前体和骨架合成的基因,特别是MEP通路相关基因在叶片中的表达量最高。相同的基因表达模式也发现在姜状三七和Cymbobogon Winterianus.[36.,37.].因此,我们推测皂苷主干生物合成主要发生在叶片中。这一事实也可以解释为什么我们观察到较高的三萜皂苷在叶A. Elata.相对于根和茎组织。
CYP450S构成最大的酶系列之一,催化不可逆氧化反应并进行复杂的功能分类[38.].迄今为止,已鉴定出超过5100个CYP450序列(http://drnelson.uthsc.edu/CytochromeP450.html),用数百种这些蛋白质在给定植物的基因组中编码。例如,已识别272个功能CYP450S拟南芥,而在水稻[39.]和484已被识别p .人参.在本研究中,我们对CYP450基因进行了系统的鉴定,命名作用和组织特异性表达分析A. Elata..共鉴定出254个CYP450基因,均为新基因,未见文献报道A. Elata..我们进一步将150种CYP450S编码> 300氨基酸编码为9种族,CYP727和CYP746氏族在本分析中未鉴定出不存在可用的全基因组序列答:补给线。CYP51家族成员基因被认为是进化上最古老的cyp450基因,是从固醇代谢的CYP51祖先进化而来的[39.].我们在本分析中仅识别出单个CYP51氏族构件(CYP51G1)。CYP71系列是最大的CYP450氏族,由17个不同的家族组成,并在次生代谢物或天然产品的生物合成中占据了多种作用的全部作用[40].
自从CYP716A12首次被描述为一种三萜氧化酶,它分别催化α-amyrin、β-amyrin和lupeol在C-28位置生成熊果酸、齐果酸和白桦脂酸[28.,41.此外,该CYP716家族的其他几个成员也被发现在不同的植物中发挥着复杂的作用。在五环三萜的合成中,CYP716家族的酶分别在C-28, C-22α, C-3和C-16β位置显示出氧化活性。8).在达摩尼型三萜合成中,CYP716家族酶还在C-12和C-6位置表现出催化活性(图。7).在答:补给线,主要皂苷是烯烃型五环三萜类化合物,其通过CYP450基因催化在C-28位置的β-淀粉蛋白[3.] (图。8).该CYP716A亚家族在几种植物物种中与烯烃型三萜生物合成密切相关[15.,42.].在本研究中,我们能够识别三种CYP716a家族成员(CYP716A295,CYP716A296和CYP716A306),我们进一步发现CYP716A295和CYP716A296的表达水平与烯唑酸内容物一致。因此,我们假设CYP716A295和CYP716A296最有可能成为参与合成OleAlic酸的基因A. Elata..
我们还检测到显着水平的Hederagen甘氨酸SapogeninA. Elata.这种化合物是通过齐墩果酸的C-23氧化产生的(图。8).CYP72A亚家族的成员已被证明参与各种Sapogenin生物合成反应,有四种M. Truncatula.CYP450基因(CYP72A63、CYP72A61v2、CYP72A67、CYP72A68v2) 1个glycyrrhiza uralensisCYP450基因(CYP72A154),一个k . septemlobus已显示基因(CYP72A397)参与Sapogenin生物合成[30.,31.,43.,44.]. CYP72A68v2酶M. Truncatula.已被证明通过中间Hederagen蛋白形成催化葡萄糖酸转化为喹啉酸转化,而CYP72A397k . septemlobus产生Hederagenin作为单一化合物[30.,31.] (图。8).提出这些CYP450s在烯醇酸基质的C-23位的C-23位置具有羟基化活性。BLASTX分析表明A. Elata.CYP72A763和CYP72A776的氨基酸序列与dna序列同源性分别为54.91和70%k . septemlobus分别CYP72A397。鉴于它们的表达模式与hederagenin的组织特异性分布一致A. Elata.因此,我们确定CYP72A763和CYP72A776为参与hederogen生物合成的候选基因。
糖基修饰可以显著增加植物化学物质的多样性,UGT超家族成员催化这些化合物的糖基化[36.].迄今为止,在某些模型植物和工业作物中,已经系统地识别了UGTS,包括A. Thaliana.,芸苔和玉米25.,26.,45.].这些过去的研究通过全基因组分析确定ugt,而很少有研究通过转录组分析确定ugt。在本研究中,共鉴定了122个UGT基因A. Elata.转录组,包括在16组中聚集的92 ugts> 300个氨基酸,其中14个高度保守(A-N)和玉米中鉴定的两种新(O和P)组。该分类方案符合桃子和最近的发现芸苔物种(45.,46.].此外,我们只发现了一组N UGTA. Elata.没有组Q成员。与现有结果相比,D组是最大的A. Elata.ugt,表明独特的进化特异性A. Elata..
自Achnine等[47.首先,表征了UGT73K1和UGT71G1与三萜类皂苷生物合成相关的功能M. Truncatula.,已经对其生化职能进行了14个UGTS(附加文件9:表S6)。在这些ugt中,UGT73家族主要催化齐墩果酸和hederagenin在C-3和C-28位置的糖基化。爆炸性搜索显示这五个A. Elata.UGT73家族中的UGTS密切相关B. vulgarisa.UGT73C10,其编码的OleAlic酸或Hederagenin 3-O-葡糖基转移酶[17.].这些unigenes以根组织的最高水平表达,与测量的olearolic酸含量一致。因此,我们假设这五个unigenes是候选Olearolic酸3-O-葡糖基转移酶基因。
结论
在本研究中,叶、根和茎的转录组来自A. Elata.第一次测序。结果的转录物和unigenes的大型数据集提供了稳健的遗传基础,用于鉴定这些植物中的重要基因和次生代谢途径。基于这些转录组数据和可用数据库,发现了与三萜皂苷生物合成相关的两种途径和19个诱导基因。我们系统地识别CYP450和UGT超家族基因,首次识别254 CYP450和122 UGTA. Elata..进一步进行了150种CYP450和92 UGT基因的分析,其相对于它们的系统发育和不同组织中的系统发生和表达模式进行了大于300氨基酸的序列。通过序列同源分析,鉴定了四种候选CYP450和与三萜类皂苷生物合成相关的四种候选CYP450和五种UGT。最后,分析了三种CYP450候选者的亚细胞定位。这项研究在一起,为CYP450和UGT基因家庭提供了全面的洞察力A. Elata.并有助于确定这两个基因家族的功能在此和相关物种中。
方法
植物材料
一个A. Elata.本研究中使用了品种(黑龙江作物委员会Ch02-1-03的植物材料),由恒天赵教授(中国科学院东北地理和农业学院)提供,并在野生植物中生长东北农业大学种质资源托儿所(哈尔滨,黑龙江,中国; 45。44”21 N, 126°43'22“e)。两岁的植物用于本研究,具有根,叶子的样品,从而从而从这些植物的三种生物学重复收集,冷冻,并储存在-80℃。
Saponin内容量化
由Huang等人设计的Vanillin-Glacial古老比色方法略微修改。[48.用来量化皂苷含量A. Elata.样品,用含油酸作为分析标准。简而言之,将200mg的每种冻干组织样品研磨成细粉,之后略微改性超声辅助方法[49.用于从这些样品中充分提取皂苷。使用6ml体积的80%乙醇悬浮每个样品,并使萃取程序在25℃下进行1小时。然后在10mL体积的80%乙醇中稀释之前过滤提取物。接下来,收集100μl滤液并在70℃水浴中蒸发,直至干燥,此时向样品中加入400μl5%的香草酰胺 - 冰醋酸和1.6ml高氯酸,然后加热在60℃水浴中15分钟,在加入8ml乙酸乙酯之前将其冷却至25℃。然后彻底混合样品,并通过微孔板读取器(Biotek Elx800,USA)定量560nm(A560)的吸光度。使用回归等式计算样品的总皂苷含量。y = 5.31x-0.036(r2 = 0.9995), with Y indicating the A560 and X corresponding to the amount of oleanolic acid (μg).
采用超高效液相色谱-四极杆飞行时间-质谱(UPLC-QTOF-MS)技术鉴定了两种主要的皂甙元和三种已分离的花生四烯酸单体答:补给线,通过保留时间和MS数据与标准的数据进行比较,以促进其识别。对于该分析,使用10mL体积的80%甲醇在22℃下超声提取100mg每种冷冻干燥的组织样品60分钟,然后通过0.22μm的Econofilter提取过滤。用于UPLC-QTOF-MS的水域Ullasulc-QTOF质谱仪(Waters,MA,USA)用于UPLC-QTOF-MS,使用ACQUITY UPLC BEP C18分析柱(100mm×2.1mm,1.7μm粒径)用于分离40°C。对于这种分离,流动相由(a)0.1%的水和(b)乙腈组成。线性梯度条件如下[50.]: 0–5.0 最小值,5-95%B;5–11 最小值,95%B;11–12 最小值,95–5%B;12–15 最小值,5%B。对于每个样品,5 采用μl进样量,0.4 mL/min流速。质谱仪在负离子模式下进行了全扫描。N2用作脱溶化气体。TOF质量和产物离子的扫描范围分别为100-2000 m / z和50-2000 m / z。使用PeakView 2.0 / Masterview 1.0软件(AB Sceix,USA)进行数据分析。在5分钟内分离出五种化合物(附加文件1:图S1),用Peakview 2.0/Masterview 1.0软件分析其分子式和保留时间(RT)10.:表S7)。对于定量分析,重复鉴定各种化合物(n = 3), and the height of peaks was used to measure the intensity. Next, standard curves for five standards were prepared and used to calculate saponin contents based on the regression equation (Additional file10.:表S7)。齐墩果酸、hederagenin、chikusetsusaponin IV、araloside VII和araloside X来自ChemFaces (http://www.chemfaces.cn/),并被用作标准。
RNA-sequencing
然后使用基于提供的方向的全部RNA试剂盒,将约100mg冷冻组织用于总RNA提取。对于RNA-SEQ分析,NEBNEXT,寡核苷酸(DT)25珠子(NEB,USA)用于特异性富集在50μL总RNA样品中存在的mRNA,之后是illumina的NEBNEXT,Ultra RNA文库制备试剂盒(NEB)用于根据规定的方向从该富集的样品中制备mRNA文库。然后使用Illumina Hiseq™4000平台进行测序。所得到的原始读取然后接受质量过滤以消除那些具有低质量,包含的Poly-N序列或包含的适配器序列的读数。干净的读数然后用三位一体组装[51.],从而产生转录组参考数据库。
功能注释和途径分析
一项BLASTx分析,将从我们的转录组数据库中鉴定出的假定unigenes与美国国家生物技术信息中心(NCBI)的非冗余蛋白(Nr)数据库(http://www.ncbi.nlm.nih.gov)、Swiss-Prot蛋白数据库(http://www.expasy.ch/sprot),以及COG (clustered of Orthologous Groups)/ KOG (EuKaryotic Orthologous Groups)数据库(http://www.ncbi.nlm.nih.gov/cog.)。此外,每个unigene根据其与KEGG数据库内基因的相似性被分配到定义的KEGG通路(http://www.genome.jp/kegg),通过BLAST搜索确定,使用1e- 5作为截止值。该途径分析的输出结果包括酶活性(EC)和KEGG同源性(KO)数。
A. Elata.CYP450和UGT基因的鉴定和系统发育分析
从pam数据库中检索到隐马尔可夫模型(HMM)。http://pfam.sanger.ac.uk.),用于CYP450和UGT家族成员的鉴定,HMMER用于搜索A. Elata.用于P450.HMM(PF00067)和UGT.HMM(PF00201)序列的推导氨基酸数据库。然后通过该初始分析确定的那些未通过简单的模块化建筑研究工具进行额外验证(智能;http://smart.embl-heidelberg.de.)使用ORF Finder软件识别出这些基因的开放阅读框(ORF)(http://bioinf.ibun.unal.edu.co/servicios/sms/orf_find.html).去除编码长度小于300个氨基酸的蛋白序列的基因后,进一步分析150个CYP450s和92个ugt。使用ClustalX 2.1软件进行多序列比对[52.].采用带有泊松模型和成对删除的邻居连接算法,用MEGAX软件生成系统发育树[53.],1000次复制用于Bootstrap测试以验证该树。Evolview(http://www.evolgenius.info/evolview/)对引导共识树进行修改,导出为Newick格式文件[54.].
基因表达模式的评估
采用RPKM方法,定量分析了植物的根、茎和叶组织中CYP450和UGT基因的表达水平A. Elata.在这个研究中。TBTools(生物学家的工具箱,V0.6652)用于分层聚类分析。此外,QRT-PCR用于验证RNA-SEQ结果23个选定的CYP450和16 UGT,如下:
使用RNAPREP纯植物套件(天根,北京)分离来自植物组织样品的RNA,之后使用与GDNA去除剂(TOYOBO)的反向ACE QPCR RT主混合物进行第一链cDNA合成。然后将QTower实时PCR系统(Analytik Jena,德国)用于QRT-PCR分析,以及雷鸟Sybr QPCR混合(Toyobo)。作为归一化控制,答:补给线GAPDH也是衡量。温度循环器设置如下:95°C, 30 s;40个循环95°C 10 s, 55°C 10 s, 72°C 15 s。每个样本进行3个生物重复分析,2-△△CT方法用于量化基因表达结果。本研究中使用的引物在附加文件中编译11.:表S8。
亚细胞定位分析
我们选择了CYP716A295,CYP716A296和CYP72A763基因,通过PCR扩增这些基因的ORF来评估代表性CYP450亚细胞定位,而不使用具有相应酶位点的特异性引物(附加文件11.:表S8)。然后Sangon Biotech(中国上海)然后进行了分离的PCR产物的序列验证,之后在Pan580-35S-GFP载体的适当限制酶消化位点插入增强的绿色荧光蛋白(GFP)的上游,产生Pan580-35S-CYP450 :: GFP向量。将这些重组质粒转化为拟南芥利用聚乙二醇(PEG)介导的瞬时转化系统[55.].通过Airyscan共聚焦激光扫描显微镜观察表达GFP融合蛋白的原生质体(ZEISS710, Carl Zeiss, Jena, Germany)。
数据和材料的可用性
本研究生成的所有RNA-SEQ读取在NCBI Short Read Archive(SRA)下公开可用,如下SRP216867(https://trace.ncbi.nlm.nih.gov/traces/sra/?study=srp216867.)和Bioproject加入Prjna555256(https://www.ncbi.nlm.nih.gov/Traces/study/?acc=PRJNA555256).
缩写
- A. Elata.:
-
Aralia Elata.(miq。)似乎
- RNA-SEQ:
-
RNA-sequencing
- CYP450:
-
细胞色素P450
- 存在:
-
实时定量逆转录聚合酶链反应
- SRSS:
-
基底识别位点
- 呃:
-
内质网
- IPP:
-
异戊烯基二磷酸酯
- DMAPP:
-
Dimethylallyl焦磷酸
- MVA:
-
甲羟戊酸
- MEP:
-
甲基吡啶醇4-磷酸盐
- OSC:
-
氧喹啉环基
- UGTS:
-
UDP-糖基转移酶
- anc:
-
乙酰辅酶a乙酰转移酶
- HMGS:
-
羟甲基戊二酰辅酶a合酶
- HMGR:
-
羟甲基gutryl CoA还原酶
- MVK:
-
甲戊二醇酯激酶
- 两家公司:
-
Phosphomevalonate激酶
- 多功能显示器:
-
二磷磷酸脱羧酶
- 伊迪:
-
异戊烯基焦磷酸酯
- DXS:
-
1-deoxy-D-xylulose-5-phosphate合酶
- DXR:
-
1-deoxy-D-xylulose-5-phosphate reductoisomerase
- MEP-CT:
-
2-C-甲基-D-赤藓糖醇4-磷酸胞嘧啶甲基转移酶
- CDP-MEK:
-
4-diphosphocytidyl-2-C-methyl-D-erythritol激酶
- MECDPS:
-
2-C-甲基-D-赤藓糖醇2,4-环二磷酸合酶
- HMBPPS:
-
(E) -4-羟基-3-甲基-2-苯基二磷酸合酶
- HMBPPR:
-
4-hydroxy-3-methylbut-2-en-1-yl二磷酸还原酶
- 全球定位系统(GPS):
-
香叶二磷酸合酶
- 帧:
-
法呢基二磷酸合成酶
- SS:
-
Squalene合成酶
- SE:
-
squalene单氧基酶
- BAS:
-
β香树脂醇合成酶
参考
- 1。
王敏,徐鑫,徐辉,文峰,张鑫,孙辉,等。总皂苷的作用Aralia Elata.(Miq)与心肌收缩功能和细胞内钙循环调节有关。J Ethnopharmacol。2014;155(1):240 - 7。https://doi.org/10.1016/j.jep.2014.05.024.
- 2。
张敏,刘刚,唐树松,宋树松,山下K, Manabe M,等。五种三萜化合物的影响Aralia Elata.人中性粒细胞中刺激诱导的超氧化物生成、酪氨酸磷酸化和胞质化合物向细胞膜的易位。足底医学。2006;72(13):1216 - 22所示。https://doi.org/10.1055/s-2006-951679..
- 3.
张勇,王伟,何华,宋晓燕,姚国栋,宋世杰。一种野生蔬菜中具有神经保护作用的三萜皂苷Aralia Elata..J Func Foods. 2018; 45:313-20。https://doi.org/10.1016/j.jff.2018.04.026.
- 4.
引用本文:席珊,周刚,张旭,张伟,蔡玲,赵超。黄芪总黄酮的保护作用Aralia Elata.(Miq)似乎(TASAES)对大鼠糖尿病性心肌病的早期防治作用及其可能机制。中国生物医学工程学报。2009;41(8):538。https://doi.org/10.3858/emm.2009.41.8.059.
- 5。
黄国安、黄英杰、金哲、崔杰斯。提取物Aralia Elata.(MIQ)似乎通过改善肝胰岛素敏感性来缓解肝胃蛋白病变。BMC补充另外MED。2015;15(1)。doi:https://doi.org/10.1186/s12906-015-0871-5.
- 6。
陈R-C,王J,俞Y-L,孙G-B,孙X-B。黄芪总皂苷的保护作用Aralia Elata.(Miq)似乎是通过下调小鼠炎症信号来抑制脂多糖诱导的心功能障碍。RSC放置2015;5(29):22560 - 9。https://doi.org/10.1039/C4RA16353B.
- 7。
(1)齐藤(Saito S),田村(Tamura N),长村(Nagamura Y),西田(Nishida K),伊藤(Ito M)等。皂素从叶子中提取Aralia Elata.似乎。(五茄科)。化学药品。1990;38(2):411-4。https://doi.org/10.1248/cpb.38.411.
- 8.
匡洪祥,孙辉,张宁,冈田洋,奥山T.从黄叶中分离出两种新的皂苷a和BAralia Elata.在黑龙江收集。中国化学药公牛。1996年; 44(11):2183-5。https://doi.org/10.1248/cpb.44.2183.
- 9.
Kang Ss,Kim Js,Kim Ok,Lee EB。来自根吠声的三萜皂苷Aralia Elata..Arch Pharm Res。1993年; 16(2):104-8。https://doi.org/10.1007/bf03036855.
- 10。
酒井S, Katsumata M,佐藤Y, Nagasao M, Miyakoshi M, Ida Y,等。齐墩果酸皂苷Aralia Elata..Phytochem。1994年; 35(5):1319-24。https://doi.org/10.1016/s0031-9422(00)94846-5.
- 11.
植物中三萜的生物合成与工程。植物科学与技术,2011;
- 12.
Wen L,Yun X,Zheng X,Xu H,Zhan R,Chen W等人。转录组的比较揭示了三种密切相关的三萜类生物合成的候选基因冬青属植物物种。植物科学与技术,2017;
- 13。
Cordoba E,Porta H,Arroyo A,SanRománC,Medina L,Rodríguez-concepciónm等。玉米1-脱氧-D-木糖苷5-磷酸合酶的三种基因的功能表征。J Exp Bot。2011; 62(6):2023-38。
- 14。
Aharoni A,Jongsma Ma,Kim T-Y,Ri M-B,Giri AP,Verstappen FWA,等。植物萜类生物合成的代谢工程。Phytochem Rev. 2006; 5(1):49-58。https://doi.org/10.1007/S11101-0055-3747-3..
- 15.
p450和UGTs:三萜皂苷结构多样性的关键角色。植物生理学杂志。2015;56(8):1463-71。https://doi.org/10.1093/pcp/pcv062.
- 16。
田村K, Teranishi Y, Ueda S, Suzuki H, Kawano N, Yoshimatsu K,等。细胞色素P450单加氧酶CYP716A141是一种独特的β-amyrin C-16β氧化酶,参与三萜皂苷的生物合成Platycodon grandiflorus.Plant Cell Physiol. 2017;58(6): 1119。doi:https://doi.org/10.1093/pcp/pcx067.
- 17。
Augustin JM,Drok S,Shinoda T,Sanmiya K,Nielsen JK,Khakimov B等人。来自UGT73C亚家族的UDP-糖基转移酶Barbarea寻常的催化皂苷介导的抗虫抗虫病中的Sapoolin 3-O-葡糖基化。植物理性。2012; 160(4):1881-95。
- 18.
Nelson博士细胞色素P450和物种的个性。生物化学与生物物理学报,1999;https://doi.org/10.1006/abbi.1999.1352.
- 19.
植物细胞色素P450:一种用于植物保护和修复的工具。生物技术。2003;14(2):151-62。https://doi.org/10.1016/s0958 - 1669 (03) 00024 - 7.
- 20。
Augustin JM,Kuzina V,Andersen SB,Bak S.分子活动,生物合成和三萜类皂苷的进化。Phytochem。2011; 72(6):435-57。https://doi.org/10.1016/j.phytochem.2011.01.015.
- 21。
van dijk el,奥格尔H,Jaszczyszyn Y,Thems C. Terms C.十年的下一代测序技术。趋势类型。2014; 30(9):418-26。https://doi.org/10.1016/j.tig.2014.07.001.
- 22。
Liu M-H, Yang B-R,张W-F, Yang KY, Zhou H-F, Kwok JS-L, et al. .叶、根和花的转录组分析Panax诺辛识别参与人参皂苷和生物碱生物合成的基因。BMC基因组学。2015;16(1)。doi:https://doi.org/10.1186/s12864-015-1477-5.
- 23。
Sun H,Li F,Xu Z,Sun M,Cong H,Qiao F等人。De Novo叶片和根转录组分析以鉴定参与三萜皂苷生物合成的推定基因Hedera螺旋L. Plos一个。2017; 12(8):E0182243。https://doi.org/10.1371/journal.pone.0182243.
- 24。
纳尔逊博士。细胞色素p450主页。人类基因组学。2009; 4(1):59-65。
- 25。
Li Y,Baldauf S,Lim E-K,Bowles DJ。UDP-糖基转移酶多核家族的系统发育分析拟南芥.中国生物医学工程杂志。2000;276(6):4338-43。https://doi.org/10.1074/jbc.m007447200.
- 26。
李啊,李鹏,王义,董罗,俞h,侯B.玉米家庭-1 udp糖基转移酶的基因组型鉴定和系统发育分析(玉米).Planta。2014; 239(6):1265-79。https://doi.org/10.1007/S00425-014-2050-1..
- 27。
关键词:番茄,CYP716, P450,生物合成,酶学植物生态学报,2017;https://doi.org/10.3389/fpls.2017.00021.
- 28。
福岛能源局,关奇,大海山,小野,梅本,水谷等。CYP716A亚家族成员是用于三萜生物合成的多功能氧化酶。植物生理学杂志。2011;52(12):2050-61。https://doi.org/10.1093/pcp/pcr146.
- 29。
韩志勇,黄洪生,蔡少伟,金洪俊,蔡宜娥。细胞色素P450 CYP716A53v2在人参皂苷生物合成过程中催化原人参二醇生成原人参三醇人参.植物生理学杂志。2012;53(9):1535-45。https://doi.org/10.1093/pcp/pcs106.
- 30.
韩杰,春家,俄亥俄州,公园S-B,Hwang H-S,Lee H,等。转录组分析kalopanax septemlobus.KSBAS,CYP716A94和CYP72A397基因的表征参与Hederagen皂苷生物合成。Plant Cell Physiol. 2017;59(2):31.9–30.https://doi.org/10.1093/pcp/pcx188.
- 31.
福岛行政主任,Seki H, Sawai S, Suzuki M, Ohyama K, Saito K,等。豆科植物天然和稀有三萜在工程酵母中的组合生物合成。植物生理学杂志。2013;54(5):740-9。https://doi.org/10.1093/pcp/pct015.
- 32。
摩西T,Pollier J,Faizal A,Apers S,Pieters L,Thevelein Johan M等人。解开Triterpenoid saponin生物合成的非洲灌木美沙、.莫尔植物。2015; 8(1):122-35。https://doi.org/10.1016/j.molp.2014.11.004.
- 33。
舒勒马。植物细胞色素p450单氧基酶。CRIT Rev Plant Sci。1996年; 15(3):235-84。
- 34。
朱克,唐D,燕C,奇z,yu h,chen j等。竖起胰腺2编码一种调节籼稻胰穗间直立的新蛋白质。遗传。2010; 184(2):343-50。https://doi.org/10.1534/genetics.109.112045.
- 35。
张X,阿兰A,李C,王Y,姚Q。中草药转录组的从头组装和鉴定,龙胆rigescens.int j mol sci。2015; 16(12):11550-73。https://doi.org/10.3390/ijms160511550.
- 36。
唐清云,陈刚,宋文林,范伟,魏克华,何士明,等。转录组分析姜状三七识别编码葡萄糖葡萄糖糖醇糖苷酶中涉及烯烃型人参皂苷的生物合成的基因。Planta。2018; 249(2):393-406。https://doi.org/10.1007/s00425-018-2995-6.
- 37。
Devi K,Mishra Sk,Sahu J,Panda D,Modi Mk,Sen P. Genome宽转录组分析显示次级代谢物途径中的差异基因表达Cymbopogon Winterianus。SCI REP。2016;6(1)。doi:https://doi.org/10.1038/srep21026.
- 38。
拉苏尔S,穆罕默德R。植物细胞色素p450:命名和参与天然产物生物合成。原生质体。2015;253(5):1197–209.https://doi.org/10.1007/S00709-015-0884-4.
- 39。
魏凯,陈慧。水稻细胞色素P450单加氧酶超家族的整体鉴定、结构分析及表达特性。BMC基因组学,2018;19(1)。doi:https://doi.org/10.1186/s12864-017-4425-8.
- 40。
Morant M, Jørgensen K, Schaller H, Pinot F, Møller BL, Werck-Reichhart D等。CYP703是陆地植物中一种古老的细胞色素P450,它催化月桂酸链内羟基化,为花粉中孢粉素的合成提供基石。植物细胞。2007;19(5):1473 - 87。https://doi.org/10.1105/TPC.106.045948.
- 41。
Carelli M,Biazzi E,Panara F,Tava A,Scaramelli L,Porceddu A等。Medicago truncatulaCYP716A12是涉及溶血性皂苷的生物合成的多功能氧化酶。植物细胞。2011; 23(8):3070-81。https://doi.org/10.1105/TPC.111.087312.
- 42。
Miettinen K,Pollier J,Buyst D,Arendt P,Csuk R,Sommerwerk S等人。古代CYP716家族是eudicot三萜类生物合成的多样化的主要原因。NAT Communce。2017; 8:14153。
- 43。
Seki H, Sawai S, Ohyama K, Mizutani M, Ohnishi T, Sudo H,等。甘草三萜功能基因组学鉴定参与甘草酸生物合成的CYP72A154植物细胞。2011;23(11):4112 - 23所示。https://doi.org/10.1105/TPC.110.082685..
- 44。
Biazzi E, Carelli M, Tava A, Abbruscato P, Losini I, Avato P,等。CYP72A67催化关键的氧化步骤Medicago truncatula溶血性皂苷生物合成。莫尔植物。2015; 8(10):1493-506。https://doi.org/10.1016/j.molp.2015.06.003.
- 45。
关键词:udp -糖基转移酶,超家族,全基因组分析芸苔属植物拉伯和芸苔属植物oleracea揭示了其进化历史和功能特征。BMC基因组学,2017;18(1): 474。doi:https://doi.org/10.1186/s12864-017-3844-x..
- 46。
吴斌,高磊,高军,徐勇,刘慧,曹鑫,等。桃UDP糖基转移酶家族的全基因组鉴定、表达模式和功能分析碧桃L. Batsch)。前植物SCI。2017年;8:389-。doi:https://doi.org/10.3389/fpls.2017.00389..
- 47。
Achnine L,Huhman DV,Farag Ma,Sumner LW,Blount JW,Dixon Ra。基于基于基于基于基于基于基于基于基于基于基于基于种族糖基转移酶的选择性和功能性研究Medicago truncatula.工厂J. 2005; 41(6):875-87。https://doi.org/10.1111/j.1365-313x.2005.02344.x.
- 48。
黄芳,赵慧,周凯,李芳,张凯。中药材总芳香苷含量分布特征的研究Aralia Elata.(筛选)。中国野生植物资源,2014;33:1-8。
- 49。
马宁,高明军,崔晓敏,陈志军。超声提取三七皂苷的研究16:854 - 855。
- 50.
宋h - h,金D-Y,吴森,李h - k,吴s - r。同时确定朝鲜语地理起源的一种方法人参通过Uplc-qtof / ms与OPLS-DA模型耦合。j ginseng res。2013; 37(3):341。
- 51.
Haas BJ,Papanicolaou A,Yassour M,Grabherr M,血液PD,Bowden J,等人。从RNA-SEQ使用Trinity平台进行参考生成和分析的DE Novo转录序列重建。NAT PROTOC。2013; 8(8):1494-512。https://doi.org/10.1038/nprot.2013.084.
- 52.
Mahés,Duhamel M,Le Calvez T,Guillot L,Sarbu L,Bretaudeau A等。PHYMYCO-DB:一种策划数据库,用于分析真菌多样性和进化。Plos一个。2012; 7(9):E43117。https://doi.org/10.1371/journal.pone.0043117.
- 53.
Kumar S,SteCher G,Li M,Knyaz C,Tamura K. Mega X:计算平台的分子进化遗传分析。Mol Biol Evol 2018;35(6):1547-1549。doi:https://doi.org/10.1093/molbev/msy096.
- 54.
张辉,高胜,李世杰,胡胜,陈卫华。EvolView是一个可视化、注释和管理系统发生树的在线工具。核酸杂志2012;40(W1): W569-W72。https://doi.org/10.1093/nar/gks576..
- 55.
Yoo S-D,Cho Y-H,Sheen J.拟南芥叶片原生质体:一种用于瞬态基因表达分析的通用细胞系统。NAT PROTOC。2007; 2(7):1565-72。https://doi.org/10.1038/nprot.2007.199.
致谢
感谢赵恒田教授提供的植物材料。我们还要感谢David R. Nelson博士(田纳西大学)为p450命名。
资金
这项工作得到了国家重点研究发展计划(2016YFC0500307–06)的资助。资助者在研究设计、数据收集和分析、出版决定或手稿准备方面没有任何规则。
作者信息
隶属关系
贡献
YC、XY和XJ构思并设计了实验。YC、XT、HL、XZ和DL进行了实验。YC, HL, ZL进行数据分析并撰写稿件。所有作者阅读并批准最终稿件。YC和HL是共同第一作者。
相应的作者
伦理宣言
道德认可和参与同意
不适用。
同意出版
不适用。
相互竞争的利益
我们声明我们没有利益冲突。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图S1。
叶片(a),茎(b)和根(c)中的芳钠的典型离子电流(tic)色谱图A. Elata.并通过UPLC-QTOF-MS鉴定的混合参考物质(D)。峰值对应于这些不同的氨基罗肽,包括:araloSide VII(1),araloSide X(2),ChikusetsusAkonin IV(3),Hederagenin(4)和烯醇酸(5)。
附加文件2:图S2。
KEGG、KOG、Nr和Swissprot数据库注释基因的维恩图。每个图表部分都列出了注释的基因数量。
附加文件3:表S1。
与皂苷骨架生物合成相关的unigenes,在三个独立的生物学经过三次独立的生物学复制以及其平均值之后获得。
附加文件4:表S2。
150个cyp450的列表A. Elata.在本研究中确定。
附加文件5:表S3。
列出92 UGTSA. Elata.在本研究中确定。
附加文件6:表S4。
功能表征了UGTS拟南芥和其他植物种类。
附加文件7:图S3。
qRT-PCR用于验证随机选择的CYP450s在RNA-seq研究中的表达水平。
附加文件8:表S5。
36个先前报道的涉及三萜生物合成的植物cyp450的列表。
附加文件9:表S6。
16以前报道的植物UGTS在三萜类生物合成中发挥作用的植物UGT。
附加文件10:表S7。
UPLC-QTOF-MS分析的五种标准清单。
附加文件11:表S8。
本研究中使用的引物的序列。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用这篇文章
程烨,刘洪,童晓明。et al。CYP450和UGT超级家庭成员从转录组的鉴定和分析Aralia Elata.三萜皂苷生物合成的候选基因。BMC植物BIOL.20,214(2020)。https://doi.org/10.1186/s12870-020-02411-6
已收到:
接受:
发表:
关键字
- Aralia Elata.(miq。)似乎
- 细胞色素P450
- UGT
- 转录组范围内识别
- Triterpenoid saponin.
- 亚细胞定位