抽象的
背景
开花是植物发育的关键时期。植物对不利条件的反应可能是加速开花等繁殖过程。在最近的一项研究中,我们发现早熟1(POCO1)是一种线粒体五三肽重复序列(PPR)蛋白,参与开花时间和脱落酸(ABA)信号传导拟南芥. 在这里,我们使用RNA-seq数据来研究细胞中的整体基因表达改变poco1突变体。
结果
在野生型和野生类型的不同发育阶段进行RNA-SEQ分析poco1植物。当野生型和野生型时,发现基因表达最深刻的差异poco1对同一发育阶段的植物进行了比较。覆盖率分析证实T-DNA在细胞中插入POCO1,这是伴随着截短的转录本。许多生物过程被发现是丰富的。一些开花相关基因如开花轨迹T.(英国《金融时报》),这可能参与早期开花的表型poco1,是由差异调控的。大量ABA相关基因,包括ABA受体、蛋白磷酸酶、蛋白激酶、ABA响应元件(ABRE)结合蛋白(AREBs)/ABRE结合因子(ABFs)等ABA信号的核心成分,以及气孔功能的重要基因,均在中表达下调poco1.差异调节包括ABA诱导的应力基因的干旱和氧化应激相关基因。RNA-SEQ分析还发现编码各种转录因子和参与细胞信号传导的基因的差异调节基因。此外,发现编码线粒体蛋白(Ngemps)的应激相关核基因的表达被改变poco1.氧化还原相关的基因受到影响,暗示氧化还原状态poco1可能会被改变。
结论
各种富集的生物学过程的鉴定表明复杂的监管机制是基础的poco1发展。与开花相关的差异调节基因可能有助于早期开花的表型poco1.我们的数据表明POCO1参与在ABA发信号过程早期。许多与ABA相关基因的下调表明协会poco1与ABA信令缺乏的突变。这种情况进一步影响了许多与应激相关的,特别是干旱相关基因的表达poco1,与干旱敏感度一致poco1.poco1突变还会影响与细胞调控、氧化还原和线粒体扰动相关的基因的表达。
背景
植物生物学研究的主要兴趣之一是了解植物细胞器是如何参与植物的生长、发育和逆境适应的。开花是一个复杂的发育阶段,由不同途径的基因控制。植物整合了许多不同的信号来转换成开花[1].在各种压力或不利条件下开花时间的改变是植物采取的策略,以确保生殖生活[2].有助于开花的各种基因的合作作用导致该过程的发作。开花时间综合了解需要识别此过程中涉及的所有因素。
脱落酸(ABA)是调节植物对生物和非生物胁迫的防御反应的内源激素[3.]调节植物生长发育的重要过程[2,4,5].ABA生物合成和信号迅速激活,以应对植物耐受性所需的应力和调节应力相关基因。因此,ABA被认为是一个主要的压力调节因子[6].尽管藻类广泛合成ABA,但没有发现ABA依赖的反应,这表明ABA介导的信号转传导是陆地植物在干旱中存活的关键进化因子[7].此外,ABA在其他发育过程中的重要作用也已被描述,如调节根模式、根细胞维持和根木质部形成[8,9,10.].ABA受体(RCAR)蛋白(RCAR)蛋白的丙比蛋白抗性1(Pyr1)/ Pyl)或调节组分是ABA的细胞内受体,其在细胞溶胶或细胞核中,其与ABA信号传导,蛋白质的负调节剂形成复合物磷酸酶2Cs(PP2CS)。结果,磷酸酶被灭活并允许蔗糖氧化物的1-相关蛋白激酶2(SNRK2s)与核目标相互作用,例如ABA响应元件(ABRE)结合蛋白(ABF)/押压件(ABF)以激活ABA响应基因表达[6,11.].突变体在ABA的生物合成、感知、信号传导和响应方面发生了改变,对各种胁迫的敏感性也发生了改变[12.].通过ABA独立和/或ABA依赖性信号转导级联涉及应力响应函数的几个基因[4,5].许多ABA诱导基因含有保守的基因独联体-代理的ABRE,可以被AREB/ abf识别[13.,14.].ABRES和ABF是ABA依赖性基因表达的先决条件[15.].
除了对压力反应的主要调节外,ABA在开花时间方面具有关键作用。通过研究ABA不敏感突变体,显示出早开花的表型并表现出通过ABA治疗开花的抑制,表明ABA对花卉过渡的阻碍效果[15.,16.].ABA对开花时间的抑制作用是由脱落酸不敏感5(ABI5)和其他ABF(ABF1,ABF3和ABF4)介导的开花基因座C.(方法)表达被促进,随后是花卉积分者,如开花轨迹T(英国《金融时报》)被压抑[17.,18.,19.].研究发现开花通过英国《金融时报》另一方面,可以与应力诱导的开花相关以逃避应力条件[2].
线粒体对传感和整合信号,压力反应和植物开发非常重要[20.].生殖发育对线粒体突变严重敏感,影响线粒体功能[21.,22.].然而,在植物发育期间的线粒体活性和调节后的分子和遗传机制仍然大多是无论如何。在由于非优质条件导致代谢功能的任何变化的情况下,线粒体与核之间的通信将被改变以适应新的条件。在线粒体中,反应性氧物质(ROS)作为线粒体电子传输链(METC)的正常代谢的一部分产生。如果在呼吸复合物的扰动后超过正常水平,则ROS导致氧化还原状态和基因表达的改变[23.,24.,25.].逆行信号调控了大量核基因的表达,其中包括编码线粒体蛋白(NGEMPs)的应激反应核基因[20.].值得注意的是,植物激素ABA显着调节线粒体功能,可以改变线粒体蛋白的丰度[26.].因此,目的是确定线粒体功能与核基因调节之间的分子链接,这可能是通过逆行信号发生的。
在最近的一项研究中,我们表明,线粒体PPR蛋白,POCO1的T-DNA插入突变导致了早期的花卉过渡[27.].PPR蛋白包含一个在土地植物中的大家庭,其中450个不同的成员A. Thaliana.并且参与转录后基因表达,例如细胞器中转录物的翻译,剪接,编辑和稳定性[28.,29.].poco1通过降低呼吸速率、低ATP水平和高ROS产生来阻止线粒体的正常功能。此外,还发现了多个RNA编辑缺陷poco1.poco1植物的表达水平降低了Abi5.和方法增强表达英国《金融时报》.这可以解释ABA不敏感和早花表型poco1植物。这些植物还表现出对干旱胁迫的易感性。
在本研究中,我们使用RNA-seq来鉴定对POCO1功能有贡献的靶基因。几个与花相关的基因,这可能解释了花的起始加速poco1被确定了。在里面poco1突变体,下调包括ABA诱导的应激基因的无数与ABA信令和反应相关的基因。同样地,发现与干旱和氧化应激,氧化还原相关基因和线粒体扰动标记基因有关的基因被差异调节。还发现与细胞调节和信号传导相关的基因进行差异调节。
结果
差异表达基因分析
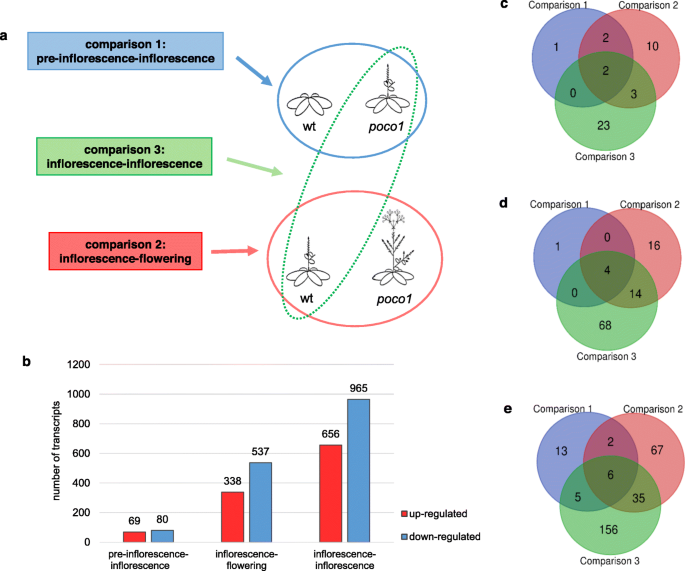
该研究中的RNA样品在两个时间点分离:播种后第一次点为20天,当野生型植物尚未形成任何花序茎poco1植物已经有了(比较1:Poweroferess-powercoperess)。第二次时间点是在播种后25天,当野生型植物开发了花序茎,poco1植物花(比较2:花序开花)。进行了一种额外的比较,其中野生型和poco1植物已经开发了花序茎(比较3:花序 - 花序)。因此,我们分析了野生型和poco1同一发展阶段的植物(图。1一种)。使用Illumina平台测序分离的RNA样品,并在质量分析后,进一步修剪读数。随后,进行RNA-SEQ分析。RNA-SEQ数据已在Embl-Ebi(www.ebi.ac.uk/arrayexpress),注册编号为E-MTAB-8912 (http://www.ebi.ac.uk/arrayexpress/experiments/E-MTAB-8912/).表中显示了每个样本的读取总数1.鉴定了总数的2645个差异表达基因。
RNA-seq实验的建立和三次比较中差异表达基因的分析。RNA-seq策略及差异表达基因分析综述。一种rna在两个时间点分离。阶段1:无花序茎的野生型植物和有花序茎的poco1植物(花序前-花序前)。第二阶段:具有花序茎的野生型植物和有花的poco1植物(花序-开花)。对野生型和poco1进行了三次RNA-seq比较。比较1和2分别为花序前-花序和花序-开花。比较3是同一发育阶段的野生型和poco1植物的比较,两者都有花序茎(花序-花序)。B.三次比较中上调和下调差异表达基因的数量。差异表达基因被定义为fold change≥2或≤−2和FDR < 0.05的基因。花序-花序的差异表达基因最多。维恩图显示独特或共同的差异表达基因在每个基因的利益类别CFlowering-related基因,D.ABA相关基因,以及E.干旱和氧化应激相关基因。维恩图是用在线工具(http://bioinformatics.psb.ugent.be/webtools/venn/)
基因表达改变poco1对不同发育阶段进行了研究。如图。1B,花序前-花序间差异调控基因数量最少。另一方面,花序-花序,代表野生型和poco1同一发育阶段的植物,显示出最多数量的差异表达基因。所有差异表达的基因(折叠改变≥2或≤ - 2,FDR <0.05),其中表示(附加文件)1:表S1、S2和S3)。
进一步分析遗传基础poco1鉴定了与这些类别相关的早期开花和ABA不敏感的表型,并研究了它们的基因表达变化。由于干旱应力易感性和升高的RO水平poco1,这与氧化应激高度相关,在所有三个比较中都发现了与这些类别相关的基因。维恩图描绘了每个类别中共同和独特的上调和下调基因的数量(图。1C,D和E)。获得更多有可能效果的证据poco1,研究了与细胞调节相关的基因的表达谱。还鉴定了与氧化还原状态,气孔函数和线粒体扰动相关的差异表达基因。
了解基因表达的生物学意义poco1,在每个比较中,使用检测到的基因(折叠变化≥2或≤ - 2,FDR <0.05)进行基因本体学(GO)富集分析(附加文件2:图S1)。去分析揭示了丰富群体在监管中的重要作用poco1在每个比较中。生物过程与生物应力和防御反应相关的术语,如“糖基化合物生物合成”,“对生物刺激的反应”,“糖苷化生物合成,”和“硫磺化合物生物合成过程”在预调节的前- 荧光 - 花序(69个基因)(附加文件2:图S1)。GO术语“细胞氧化还原稳态”、“细胞稳态”和“电子传递链”在花序前-花序(80个基因)下调的基因中富集(补充文件)2:图S1),它可能与更高产生的RO相关poco1[27.].GO富集花期上调和下调基因(338和537个基因)(附加文件2:图S1)表明,各种应力响应相关的过程高度超过,这可能表明不同的应力分配一些相同的途径。同样在花序开花中,与衰老和细胞壁组织相关的术语分别富集和下调基因。致富富集的花序 - 花序(656基因)(额外文件2:图S1)表示与“翻译”和“肽生物合成过程”相关的术语以及与生物合成和代谢过程相关的GO术语。与氮化合物生物合成相关的生物过程GO期被过度代表。GO术语主要与“对含氧化合物的反应”的应力相关,“对化学物质的反应”,“对甲壳素的反应”,“反应应力”,“反应生物刺激”“对其他生物的防御反应”,““对有机氮化合物的反应”,“对水剥夺的反应”和“对脱落酸的反应”富集在花序 - 花序(965基因)的下调基因中富集。干旱应激反应的监管和功能归因,这是“对水剥夺”和“水的反应”的浓缩,也是富集的生物过程中(附加档案2:图S1)。去富集分析的概述在图2中表示。2.
基于25个最高的上调和下调基因(附加文件1:表S1,S2和S3)三种基因在所有三种比较中通常是上调:磷脂酰肌醇4-激酶γ样蛋白(ATPI4Kɣ3型),Cwf18前mRNA剪接因子,和Pr5样受体激酶(PR5K). 在所有三个比较中,有四个基因普遍下调:TGG2,富含亮氨酸的重复[LRR]家庭(AT4G16880)假设蛋白质(AT5G22608.)和抗病蛋白质(AT5G43740).上调ATPI4Kɣ3型和下调TGG2被证明导致ABA不敏感表型[30.,31.].Cwf18pre-先前提示mRNA剪接因子在基因表达和非生物应激中具有关键作用[32.].
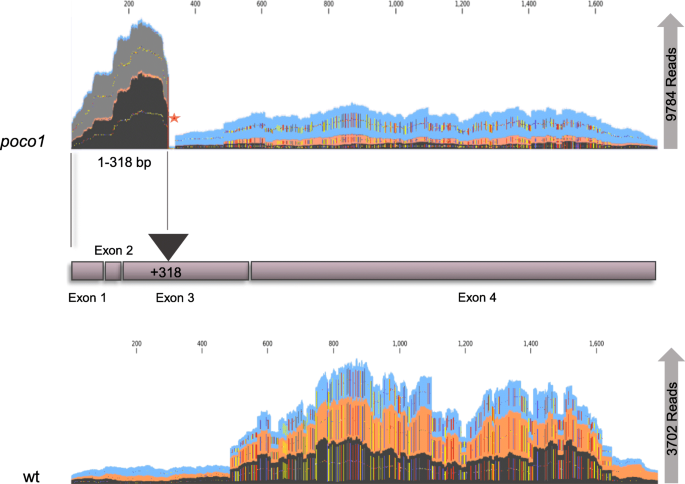
覆盖率分析确认poco1T-DNA插入突变与截短的转录物
最近的一项研究表明poco1携带T-DNA插入,并鉴定为纯合T-DNA插入突变体[27.].不POCO1转录本可以在poco1通过RT-PCR。但是,RNA-SEQ分析来自野生型和poco1表明POCO1(AT1G15480型)显着上调poco1与野生型相比。因此,我们首先检查了野生型和poco1.数字3.结果表明,在+ 1 ~ + 318 bp的序列丰度非常高poco1,这在野生型中无法观察到。位置+ 318是T-DNA插入的位置POCO1(flag_465f03)。在里面poco1突变体,位置+ 318之后存在间隙,其不映射到任何读数。这种情况表明存在截短的POCO1突变体中的RNA,由于T-DNA插入,不允许POCO1蛋白的翻译。
受影响与开花相关的基因
在三种比较中的差异表达基因中,鉴定了与开花的41个基因,包括普遍已知的途径的普通开花相关基因以及有助于开花的其他基因。开花相关基因的基因表达分析可能有助于解开花卉过渡机制poco1.开花相关基因的热图在不同的比较中显示了这些基因的差异调节(附加文件3.:图S2)。鉴定出的基因属于光周期途径和赤霉酸途径。此外,花的整合因子和与开花有关的光感受器,以及一种方法具体调节器,差别调节poco1(附加文件3.:图S2)。RNA-SEQ结果确定了开花相关基因,其上调或下调适合poco1的表型。基于与开花相关的差异调节基因的分析,poco1导致基因表达的改变导致开花的加速度。鉴定差异表达基因的一些例子poco1与开花相关的数据见表2.
poco1使ABA信号和反应失活
最近的一项研究表明poco1植物对ABA的不敏感的表型关于主要根生长和开花时间。这项研究表明Abi5.在ABA信号传导的核心中起作用,在细胞中被下调poco1植物 [27.].为了提高我们的理解,将重点放在与ABA信令相关的其他因素上,在RNA-SEQ结果中在差异表达基因中搜索响应。总共104个基因与ABA信令和所有三种比较相关联的基因,被识别出差别表达poco1.已开发出差异表达aba相关基因的热图(附加文件4:图S3)。大多数与之相关的差异表达基因在花序开花中发现,发现大部分下调。有趣的是,确定了在ABA感知和信令的核心中运行的几个基因。紫鼠抵抗1状5/aba受体8的调节成分(Pyl5./rcar8.),Pyl9 / RCar1.,参与早期ABA感知和信号转导。PP2Cs等阿巴-不敏感1(Abi1.),(Abi2.),过敏的发芽1(AHG3.),Abi 1的同源性(HAB1.),HAB2.也在下调poco1.Abi1.和Abi2.是2C型蛋白磷酸酶,参与ABA信号转导。Abi1.和Abi2.具有ABA不敏感的表型并防止ABA信号转导[50.].蛋白激酶(SNRK2),SNF1相关蛋白激酶2.1(SNRK2.1.),SNRK2.8.被发现在poco1.SNRK2.1.和SNRK2.8.通过磷酸化不同的靶蛋白来开启ABA信号[51.].ABA激活的转录因子,担任绑定因子3(ABF3.),ABF4.参与ABA信号转导。参与ABF3.和ABF4.在防水反应中已经证明了[52.,53.].钙依赖蛋白激酶(CDPKs)是钙2+结合的感觉蛋白并已先前据报道参与ABA /应力信号拟南芥和其他物种[54.,55.].钙-依赖蛋白激酶32(CPK32)属于通过ABF4磷酸化调节ABA响应基因表达的ABA信号传导组分。差异表达基因的一些例子poco1被识别与ABA信令和响应相关联的响应在表中表示3..
鉴定干旱和氧化应激相关的基因
我们最近的一项研究表明poco1植物对干旱胁迫更敏感,并积累较高量的ROS [27.].因此,关注鉴定鉴定与干旱相关的差异表达基因,从RNA-SEQ结果中从差异表达基因搜查氧化应激。在此类别中,确定了相对较多的基因(附加文件5:图S4)。许多ABA诱导的基因除了在ABA信号转导和响应中发挥作用外,还参与了逆境,特别是干旱胁迫。许多由ABA高度诱导的胁迫基因,如脂质转移蛋白3(LTPS.),ERDs公司,对干燥反应(RDs),冷调47(科47.),冷调节的413浆膜2(COR413-PM2),rab18.,被压抑了poco1(附加文件5:图S4)。此外,是ABA信号传导的稳压因子的基因,如Pyl5./rcar8.,Pyl9./rcar1.,Abi1.,Abi2.,SNRK2.1.,SNRK2.8.,ABF3.,和ABF4.据报道,在ABA介导对非生物胁迫的反应中的作用[71.,72.].真实干旱诱导基因的表达水平,如rab18.[73.] 和RD29A.[74.],这是ABA信号传导的标记基因,在下调poco1.总的来说,这些结果可以理想地解释更高的敏感性poco1与野生型植物相比干旱胁迫。
在poco1检测到较高量的ROS,而不是野生型[27.].更高水平的RO与氧化应激条件相关联。许多氧化应激相关基因poco1与野生型植物相比,被发现有差异调控(附加文件5:图S4)。发现许多鉴定的基因具有氧化还原酶活性,这可能与ROS的较高积累相关联poco1.一些已鉴定的差异表达基因的例子poco1与干旱和氧化应激的关系见表4.
鉴定与细胞调节和信号相关的基因
提供对控制的监管网络的洞察poco1从差异表达基因鉴定了对蜂窝信号传导中涉及的不同类别的转录因子和基因的组织代谢。已经确定了许多转录因子以差异表达poco1在所有三种比较中,将其分类为BHLH,BZIP,CCCH锌手指,C2H2锌手指,共同,ERF,GATA,GRAS,HMG,Homeobox,HSF,MTERF,MYB,MYB样,NAC,NF-Y,普拉茨,rwp-rk,Rav,Sigma 70样,TCP和Wrky转录因子(附加文件6:图S5)。类似于其他分析,预粉末 - 花序和花序分别具有编码转录因子的最低和最高数量的受调节基因。花序开花中的大多数差异调节的转录因子是上调的。相反,花序 - 花序中的大多数差异调节的转录因子被下调。来自BHLH,MYB样和NAC转录因子家族的差异调节基因在花序开花中显示出上调。相反,MyB样和NAC转录因子在花序下显示下调。这也是编码Homeobox和MyB转录因子的大多数基因的情况。编码转录因子的最高限制基因数属于ERF转录因子家族。差异表达基因编码转录因子的一些实例poco1在表中表示5.
研究报告说,ABA影响许多编码转录因子的基因的诱导[102.].作为植物中最丰富的转录因子类,MyBS参与植物发育,激素信号转导和非生物胁迫耐受性[88.].Wrky转录因子也是最大的转录因子之一,生物和非生物胁迫的功能是[98.,103.].手表的表达poco1大多是下调的(附加文件6:图S5)。据报道,WRKY2通过结合AREBs/ abf启动子区域的W-box序列(WRKYs的核心结合位点),作为AREBs/ abf的转录调控因子[98.].ABA响应基因如ABF4.,Abi5.,myb2.,和rab18.是wrkey的靶基因。一些与应激适应有关的基因RD29A.和科47.据报道是在wr[98.].mTERFs是另一组参与细胞器基因表达的转录因子。它们大多被上调poco1.总的来说,这些结果表明,可以改变调节关键生物过程的许多转录因子的活动poco1.
信号分子调节不同的细胞反应,影响植物发育,激素和应力反应途径[68.,104.].RNA-SEQ数据的分析表明,几种编码与细胞信号传导相关的蛋白质的基因,例如受体样激酶(RLK),受体样蛋白(RLP),促丝氨酸活化的蛋白激酶(MAPK)和富含亮氨酸的重复蛋白激酶(LRR-RKS)在差异上调poco1(附加文件7:图S6)。
与线粒体扰动相关的基因显示出改变的表达谱
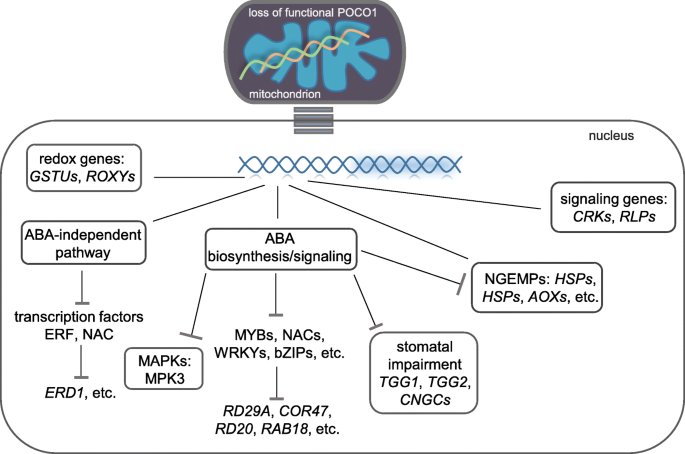
线粒体在传感应力和指导细胞反应中起着重要作用[20.,105.].线粒体功能受到应力的干扰,并激活反馈机制以调节基因表达以维持线粒体和细胞功能[105.,106.].信号由线粒体传递到细胞核(逆行信号),通过改变细胞核基因的表达而引起相应的反应。POCO1定位于线粒体,其功能丧失导致线粒体功能障碍[27.].因此,逆行信号对编码线粒体蛋白(NGEMPS)的核基因表达的影响是合理的poco1.始终如一地,RNA-SEQ分析鉴定了几个NGEMPS,其是线粒体扰动状态的靶标(附加文件7:图S6)。鉴定了与线粒体扰动相关的三十七种基因被鉴别算法poco1在所有三个比较中。这些基因的差异表达模式暗示了不同途径和信号的存在poco1,线粒体通过哪个线粒体与核沟通。
编码线粒体HSP的转录物特别参与线粒体功能障碍,作为逆行信号的一部分[107.].两个线粒体HSPS.,HSP60.,和mtHsc70–1个在poco1.以前建议其中许多NGEMP如HSP70.,AOX1a公司,和BCS1.可能是真正的ABA响应性,因为在ABA治疗后,他们的转录性丰度发生了变化[108.]. 新发现的基因家族,未知功能的域295(DUF295)报告称被诱发拟南芥线粒体功能障碍的突变体[109.,110.].一名成员DUF295基因家庭(ATDOA11)发现上调poco1.鉴定的差异表达的NGEMPS的一些例子poco1在表中表示6.
细胞氧化还原状态可能受到影响poco1
线粒体电子传输链的氧化还原级联产生氧化还原信号,其可以进一步参与基因表达和调节。基于氧化还原的信令可以是线粒体 - 核通信中的至关重要的组成部分[105.,114.].增加的ROS直接导致氧化还原状态的改变[24.]. 由于ROS水平升高,细胞氧化还原状态发生改变poco1是相关的。许多氧化还原相关的基因,如戊二酮(谷氧还蛋白)、谷胱甘肽转移酶(GSTS),Thioredoxins(trxs.)和旋转酶环菌素(Rocs.)在差异表达的基因中被发现(附加档案8:图S7)。氧化还原酶如戊二糖苷(谷氧还蛋白)具有过氧化物酶活性的,参与不同的细胞方法,尤其是氧化应激[115.].几位成员gr参与细胞氧化还原稳态的基因家族如ROXY2,ROXY3,ROXY8,ROXY9,ROXY12,ROXY13,ROXY14,ROXY15,ROXY17,ROXY20,和ROXY21被发现在差异上表达poco1。几个消费税是否发现在poco1.除了一个,所有差分调节消费税在花序 - 花序中鉴定下调。但是,监管消费税在花序-开花中表现出不同于花序-花序的表达模式,其中四种表达模式均表现为花序-花序消费税显示上调,三个显示下调。这些结果支持了细胞氧化还原改变的假说poco1,这可能验证了POCO1在线粒体功能中的作用。一些已鉴定的差异表达基因的例子poco1与氧化还原状态相关联在表中表示7.
的影响poco1对气孔功能
植物为适应逆境,特别是干旱胁迫而进化的最重要的策略之一就是控制气孔开度。ABA介导的胁迫反应涉及基因表达的改变,最终可能影响气孔关闭的调控,从而调控水分的流失。poco1植物是ABA的不敏感和易受干旱胁迫的影响。因此,气孔功能障碍poco1非常可能。RNA-SEQ结果确定了气孔闭合中关键作用的基因(附加档案8:图S7)。葡萄糖苷葡糖水解酶2(TGG2),在保护细胞中高度丰富的近苯胺酶,在强烈下调poco1在所有三个比较中(最低折叠性能的最低折叠性 - 花序和花序开花以及花序开花的第六个最低折叠变化)(附加文件1:表S1、S2及S3)。TGG1揭示了花序-开花和花序-花序的差异表达模式。环状核苷酸门控通道(CNGCS.)植物离子通道的家族是响应于导致公差机制的非生物应力而表达[126.].潜在的气孔失效的另一个提示来自下调呼吸爆发氧化酶同源物D.(rbohd.) 在poco1[127.].据报道,RBOHD的功能被损害一般条款2ABA内敏感突变体[128.].GRP7.在保护细胞中广泛表达并影响口腔开口和闭合,从而导致降低的脱水耐受性[129.,130.].这些结果提出了这一点poco1突变可能导致气孔衰竭。一些已鉴定的差异表达基因的例子poco1与气孔函数相关的是表中的表现8.
讨论
开花过渡是植物生命周期中的一个关键步骤,因为它保证了植物物种的连续性。各种因素参与开花已被确定。然而,POCO1是一种线粒体PPR蛋白,其相应的突变体表现出早期开花表型,其特性将提供有关线粒体-核相互作用的额外信息。在这项研究中,RNA序列数据被用来更好地了解POCO1的功能,并确定其他因素,可能导致poco1的表型。有趣的是,通过花序开花鉴定大多数差异表达的基因,其中植物在相同的发育阶段,这可能表明在野生型和野生型的相同发展阶段的代谢过程中的高度变化poco1植物。此外,可能是由于性繁殖前的发育重新编程,可能发生了更集中的poco1.此外,虽然处于相同的发展阶段,但他们的年龄并不相同。的覆盖率分析POCO1确认截断的成绩单poco1植物,不允许功能性POCO1的翻译。
每次比较中,GO对上调和下调基因的富集表明了这些生物过程的关键作用,特别是,在调节发育过程中,与应激反应相关的许多过程的过度代表poco1.与防御反应相关的富集的生物过程可能是由于植物防御途径的相互作用和转变为生殖阶段。葡糖苷含量调节与开花时间之间的重要联系Aethionema arabicum(Brassicaceae)已被确定。FLC被确定为氨基葡萄糖含量的潜在调节剂[137.].此外,葡萄糖酸盐和糖苷化生物合成方法(富含开花性 - 花序中的上调基因)被认为是过渡阶段的主要调节剂,并促进植物在开花期间对病原体的保护[138.].这些化合物由硫和氮组成。有趣的是,TGG2,这是高度下调poco1在所有比较中,被证明是葡糖苷崩溃所必需的[135.].与老化相关的术语可以强调最前沿发育成熟poco1并且作为衰老相关过程的逻辑后果,显示细胞壁组织和生物发生的富集为开花的下调基因。GO术语“翻译”和“肽生物合成过程”以及与“核糖体组件”相关的术语,其高度富集的花序开采的上调基因,可能表明核糖体的控制。因此,De Novo蛋白质合成对于花卉过渡至关重要poco1.翻译机制的改变已在A. Thaliana.在压力条件下[139.].这种情况可能会突出翻译设备的重要性poco1,它承受着不利的条件。因此,Cwf18pre-据报道,MRNA剪接因子(在所有三种比较中的前10个最上调的基因中)在早期反应对非生物应激的反应中起作用。Cwf18pre-mRNA剪接因子被认为在基因表达过程中起作用,并与作为核糖体一部分的蛋白质一起发挥作用[32.].因此,其过表达可以进一步支持应激诱导的转录事件的重编程poco1.研究报道,植物可以利用来自有机化合物的所需的氮,例如蛋白质和酰胺[140.,141.].根据与氮化合物生物合成方法相关的GO生物学处理术语,蛋白质和酰胺生物合成方法高度富集的花序 - 花序的上调基因。氮的可用性是植物生长和发展的限制因素,其控制发展相变[142.,143.].一些研究表明,高氮条件促进开花拟南芥[144.,145.,146.,147.].在花序-花序中,被下调的基因被称为“对脱落酸的响应”和“对水分剥夺的响应”,这可能解释了ABA信号通路受损和易感性受损poco1干旱压力。
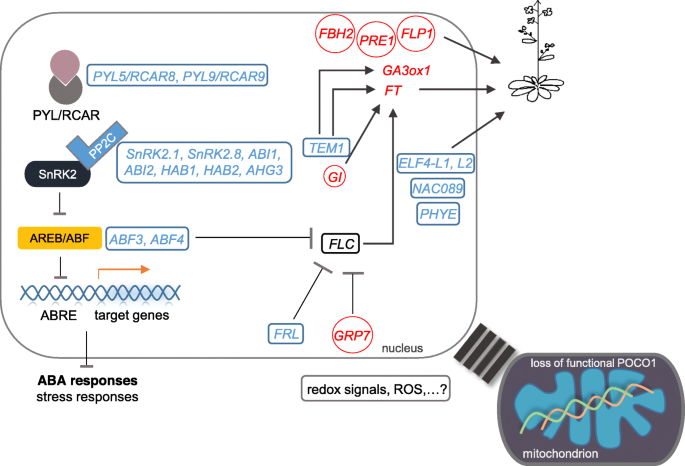
我们发现了几种功能在促进开花中,因此对早期的花卉过渡至关重要poco1.与我们最近的研究一致[27.,花卉集成商英国《金融时报》强烈上调poco1在花序中开花。有趣的是,它的一个集成商,胃肠道,也被发现在上调poco1在花序开花。表达式胃肠道以前据报道是一种压力逃避响应,以及早期的花卉过渡拟南芥需要GI [148.].除了GI外,FT还参与了应力诱导的开花[148.,149.],表明这些基因在不利条件下通过促进花的过渡缩短生活史的重要作用。除此之外,这些数据强化了这样一种观点,即早开花在poco1可能与压力诱导的开花相关。该结果与所有差异表达基因的富集分析一致,其中发现许多术语与对应激的反应有关。从RNA-SEQ结果,我们还确定了一种阻遏物英国《金融时报》,丹魄1(TEM1),是一个推广者FLC,泥泞的样子(FRL),两者都展示了下调poco1.此外,据报道,GRP7的功能丧失增加了总功能意义方法转录和延迟开花时间[150.].这一结果进一步强调了早开花的假说poco1通过镇压和提升来发生方法和英国《金融时报》分别(图.4).除了直接镇压英国《金融时报》,TEM1也抑制了表达式GA3OX1直接绑定到GA3OX1基因座[151.].赤霉酸生物合成基因GA3OX1在植物发育中起主导作用[42.,43.].两个功能冗余的赤霉素受体,吉布林素-不敏感矮人1(GID1B.),gid1c.[45.]来自赤霉酸信号通路,差分调节poco1.紫杉醇抗性1(前1)过表达线导致胃肠蛋白依赖性响应,并激活吉布林素信号的分支途径[86.].开花促销因子1(FLP1),被证明促进在凝胶酸依赖的信号通路中的开花时间拟南芥[152.].这些结果可能表明赤霉酸在花的转变中起一定作用poco1.此外,上调FBH2,前1,和FLP1和下调Phytochrome E.(植物),早开-喜欢(ELF4-L1),与ABI3 / VP1 1相关(RAV1),NAC089,富含半胱氨酸的受体样激酶6(CRK6型),CRK19允许早期开花的表型(图.4).
ABA信号传导和开花的核心组件中受影响的基因poco1在示意图中。在拟南芥中,多种因素影响开花时间以适应不利的条件。在POCO1突变体中,下调核心ABA信号传导基因(PYRS / PYLS / RCARS,PP2C,SNRK2S和ABF),这可能导致ABA受损和应力反应。ABF3和ABF4的下调,FRL和GRP7的上调可能对FLC表达具有抑制作用。此外,TEM1的下调和GI的上调可能诱导FT表达。TEM1的下调还诱导甘草酸生物合成基因GA3Ox1。ELF4-L1,ELF4-L2,NAC089和PHYE和FLP1,PRE1和FBH2的植物的下调与早期开花表型一致。红色和蓝色基因分别表示上调和下调的基因。箭头和虚线箭头分别表示诱导和抑制效果
POCO1功能缺失导致aba不敏感表型[27.].我们提供了证据表明,与ABA信令和反应相关的许多基因在下调poco1.ATPI4Kɣ3型是最上调的基因poco1在前花序和花序中也是其他两个比较中最高上调的基因之一(附加文件1:表S1、S2及S3)。ATPI4Kɣ3的功能在发育和非生物胁迫条件下非常重要。表达的ATPI4Kɣ3型通过减少诱导来增加对ABA的耐受性ABI5,这与poco1.受体-喜欢蛋白激酶1(RPK1.)参与于ABA早期的感知拟南芥在早期阶段作为ABA信号的调节者。因此,它影响ABA信号转导的许多下游基因[67.,68.].RNA-SEQ分析来自ABA信令的不同组分的基因:ABA受体(Pyl5./rcar8.和Pyl9 / RCar1.)、蛋白质磷酸酶(ABI1,ABI2,AHG3,HAB1.,和HAB2.),蛋白激酶(SNRK2.1.和SNRK2.8.)和AREB/ABFs (ABF3.和ABF4.).因此,ABA信号传导途径因早期对许多ABA响应基因表达的早期感知中断poco1(图.4).功能性ABA信号在胁迫耐受性,特别是干旱胁迫中至关重要[4,5,11.].许多与干旱胁迫相关的基因含有独联体-acting ABRE和脱水响应元件(DRE)[153.].研究表明,ABF与ABRE元素结合以激活ABA响应基因表达,这对干旱胁迫耐受至关重要[16.,72.].因此,下调ABFS.在poco1如ABF3.和ABF4.可能是许多aba诱导的应激反应基因下调的一种可能情况,如本研究所示。abf的另一个有趣的特征是它们对花过渡的影响。据报道,除ABI5外,其他abf均能显著促进表达方法通过与启动子区域的ABRE元素结合方法[18.].因此,可能除了ABI5外,ABF3和ABF4对抑制有直接作用方法在poco1(图.4).特别注意,ABFS的抑制作用方法表达可能通过snrk2调节,其功能是磷酸化abf。这种调节直接影响花的过渡[18.].然而,方法和Abi5.在RNA-SEQ分析中未被鉴定为差异表达基因。上调的表达nced4.在花序开花和下调表达中CYP707A3在相同的比较可能表明ABA的生物合成和分解代谢失衡poco1.这种不平衡也可以在花序-花序中观察到nced4.是下调的,但没有检测到ABA分解代谢功能的基因。
许多众所周知的干旱压力的积极效应或调节因子,比如rds.,ERDs公司,拉伯18,和科47.被发现下调poco1.因此,如我们最近的研究所示,poco1植物更容易受到干旱压力的影响,从而更容易受到影响,因此poco1负面调节干旱反应。虽然ABA最初证明了协调非生物反应,但进一步的研究报告了ABA在非生物胁迫中的额外参与。ABA赋予病原体和疾病的抵抗力[154.,155.].因此,据称,与非生物胁迫相关的富集生物过程是由于ABA信号障碍poco1,这可能导致生物应激相关基因表达的改变。我们的RNA-SEQ分析还确定了与氧化还原过程相关的许多基因,其可以参考以前所观察到的ROS升高的rOS水平poco1植物 [27.].
ABA在干旱胁迫中的一个重要作用是调节气孔关闭,防止蒸腾失水[156.].ABA通过调节参与脱水耐受的许多基因来促进气孔闭合[157.].我们的转录组数据支持气孔闭合的假说poco1可能会失败。TGG1和TGG2是两种芥子酶,被证明是保卫细胞中ABA信号转导的重要组成部分[136.].据报道,TGG1和TGG2在ABA信令中具有功能冗余拟南芥保卫细胞(31.].研究表明,SNRK2S在气孔运动中具有关键功能[158.].因此,可以推测较低的诱导SNRK2.1.和SNRK2.8.可能对气孔调节产生负面影响poco1.此外,改变表达的GRP7.,RPK1.,CNGCS.,rbohd.,CPK6,abi1,abi2.,和MYB44在poco1,它们参与了气孔的调控,可能导致气孔关闭不正常。因此,这种情况会增加水的流失poco1,不允许耐旱。此外,这些结果提示了ABA和ROS在控制气孔功能中的重要性[159.].
不同种类的许多转录因子的表达在不同的发育阶段发生改变poco1,表明发育过程poco1由复杂的转录调节控制。ERF转录因子家族涉及与生长和发展有关的不同细胞功能的转录调节,响应环境刺激[160.].BHLH转录因子BHLH81(FBH2)和bhlh136(前1)、NAC转录因子(NAC089)、RAV转录因子(TEM1)和ERF转录因子(RAV1)对开花有显著影响。据报道WRKY和MYB转录因子参与了ABA信号转导[88.,100.].编码参与ABA信令的转录因子的差异调节基因如下:WRKY2,WRKY33,WRKY25,WRKY46,MYB20,MYB32,MYB51,MYB73,和MYB44.其他差分调节转录因子组poco1如bZIP、CCCH锌指、C2H2锌指、ERF、GATA、GRAS、Homeobox、MYB-like等参与多种植物过程。与这些调控蛋白相关的常见生物学过程参与了应激和发育调控。最可能的解释是ABA信号通路的缺失poco1影响植物的抗逆性和生长发育。此外,有研究报道NAC、CCCH锌指、bHLH和WRKY转录因子参与调控胁迫反应和开花[85.,94.,161.,162.,163.].基于上一份报告[23.[几种转录因子与线粒体中所有五种呼吸复合物的转录因子结合,并作为线粒体基因表达的调节剂。发现编码这些转录因子的几个基因被差异表达poco1在我们的RNA-SEQ结果中,包括WRKY15,WRKY30,WRKY33,ABF4.,ATHB-6.,BZIP10,bZIP25型,和bhlh81.
MAPK瀑布参与ABA信令和应力耐受性,并通过广泛的信号触发,包括ABA,生长素,乙烯,ROS和病原体[164.].因此,MAPK瀑布的下调可能受到ABA缺陷的影响poco1(图。5).MAPK经常调节各种下游事件,从而定义下游信号。因此,其表达的任何变化可能导致其他信令因子的变化[165.,166.].RLP是膜结合的信号分子,其含有细胞外受体结构域,可以转移到细胞核,叶绿体或线粒体中。rlps采取改善对生物和非生物胁迫的植物反应[167.].改变基因的诱导如受体激酶,CRKs公司,mapk瀑布,LRR.-rks.,和rlps.可能强调的影响poco1关于蜂窝信号。
氧化还原信号涉及植物生物学的各个方面,并且在交叉耐受现象中特别关键,允许将植物的一般适应施加到压力条件下[24.].作为与氧化还原级联相关的基因,如谷氧还蛋白,GSTS,TRXS.,和Rocs.氧化还原状态在poco1可以更改。ROS在细胞内的高积累支持了这一假说poco1活性氧水平的改变导致氧化还原状态的改变[24.].基于氧化还原的信令是一种有吸引力的候选者,是线粒体 - 核通信级联的关键组成部分[105.,114.,168.,169.].然而,已经证明逆行信号利用了在其他情况下扩展的因子,如与MAP激酶或ABA信号相关的信号因子[103.].因此,一般的线粒体应激反应似乎与ABA信号有关[170.].谷胱甘肽s-转移酶(GSTs)是一个酶家族,催化还原性谷胱甘肽与多种底物的结合,并调节谷胱甘肽稳态,以调节发育拟南芥[171.].以前的研究表明GST.转录物在植物组织中被诱导以响应外源GSH、ABA和乙烯的应用[172.,173.].因此,几个诱导较低消费税在poco1可能是由于ABA信令和响应缺陷。耐胁迫表型,特别是干旱胁迫,可以通过更大的谷胱甘肽(GSHS),ABA积累和微调ABA信号传导充分解释[174.,175.].此外,较低的谷胱甘肽氧化还原状态导致了花期的提前oncidium.兰花(176.]. 这些证据与早花和对干旱胁迫表型的敏感性是一致的poco1.
在细胞细胞(例如,ROS积累)中细胞或代谢状态的任何变化的情况下,调整转录物水平以优化细胞内蛋白质组。由于NGEMP参与了广泛的线粒体扰动,它们代表不同的表达特征,这种情况朝着存在多种线粒体逆行法规的可能性[23.].由于ABA影响替代氧化酶1A(AOX1a公司)[177.],并且由于在启动子区域中存在ABA响应元件的潜在结合位点AOX1a公司[23.,177.),镇压AOX1a公司可能是腐败的ABA信令的影响poco1(图。5).然而,Aox1a.显示植物积累更高的超氧化物自由基,对干旱和轻应力更敏感,与之一致poco1表型[178.,179.].增强应力响应诱导AOX1d公司建议激活补偿性AOX途径poco1突变线粒体。许多基因表达的改变poco1特别是ngmp和氧化还原状态基因,为线粒体向细胞核的逆行信号的存在提供了可能性。
结论
我们使用RNA-seq分析提供了一个概述的全球转录组变化poco1在不同的发育阶段。大部分差异调控基因在花序-花序中被鉴定出来,说明了在不同发育阶段进行生物学分析的必要性。不同的生物过程在不同的比较中得到了丰富,说明不同的过程参与了调控poco1.在不同的发育阶段,有与开花、ABA信号和响应、干旱和氧化胁迫、氧化还原状态和线粒体扰动相关的差异表达基因。根据rna测序结果,poco1导致一些开花基因的差异调控,从而影响开花时间的促进。此外poco1从其早期信号转导的显着影响ABA信号。我们的数据支持更改氧化还原状态poco1.此外,氧化还原状态和NGEMPS表达的改变突出了逆行信号的存在,以传递其功能状态以调节植物开发。根据这些数据和我们以前的研究,线粒体功能的损害poco1较高的ROS产生可能导致氧化还原失衡,从而影响ABA-、开花-和胁迫相关基因的表达,进而导致对干旱胁迫的耐受性降低。综上所述,本研究的数据可为进一步研究开花时间和ABA信号与线粒体蛋白相关的分子机制提供依据,提高对PPR蛋白家族的认识。
方法
植物材料
在这项研究中,拟南芥植物野生型,WS-4(Wassilewskija),和poco1突变体(Flag_465F03)[180.使用过。野生型和FLAG_465F03是从Versailles Arabidopsis股票中心获得的(Inra;http://publiclines.versailles.inra.fr/).在22℃下在生长室的受控条件下在65%相对湿度下植物生长,光强度为110μmolm- 2 s- 1光周期为16 h灯和8 h黑暗。在一天开始的两个半小时后(11:00),采集用于RNA分离和RNA-seq分析的样本 上午)。
RNA分离和RNA测序
从野生型和野生型分离总RNApoco1使用Trizol(Peqlab,Erlangen,德国)植物叶子。在2%琼脂糖凝胶上检查RNA降解和污染。对每个基因型进行三个生物复制,每种基因型进行,总共有12个样品。RNA测序由Hiseq 2000机器(125bp配对读数)使用Illumina技术进行GATC Biotech AG(Konstanz,Germany)进行。所执行的所有步骤都是由GATC Biotech AG开发和验证的。
差异基因表达分析
通过CLC基因组学工作台7.5.1基于[QIAGEN,HILDEN)的CLC基因组学工作台7.5.1计划评估所得原始序列。181.].RNA-SEQ数据最初通过质量控制并进行修剪。修剪序列被映射到揭露版本拟南芥(WS-0)的参考基因组来自1001基因组计划(https://1001genomes.org/)(http://mtweb.cs.ucl.ac.uk/mus/www/19genomes/fasta/).根据拟南芥基因组注释(Tair10)使用注释的基因模型。从RNA-SEQ数据的表达水平读取每百万映射的读取读取(RPKMS)[181.使用CLC Genomics Workbench 7.5.1报道,报告了折叠变化。CLC Genomic Workbench 7.5.1遵循[181.].选择假发现率(FDR)<0.05作为截止阈值,以识别显着的表达差异[182.].差异表达的基因被定义为折叠变化的那些≥2或≤-2。
基因本体,Venn图和热图
对每个类别提取唯一的基因标识符,进行基因本体富集分析。GO富集是通过g:profiler在线工具对背景基因(每次比较中检测到的基因)进行的[183.[Venn图表以在线工具制作的Venn图表显示不同比较的重叠基因(http://bioinformatics.psb.ugent.be/webtools/venn/).调整后的截止值P.值(P.adj)用于去分析。折叠变化(log10)用于表示热图。
覆盖分析POCO1
cDNA序列POCO1,由NCBI (https://www.ncbi.nlm.nih.gov/)(GenBank登录:NM101417.4)并导入CLC Genomics Workbench 7.5.1程序。CLC Genomics Workbench 7.5.1程序中的“Map reads to contigs”工具用于绘制野生型和非野生型中的读取poco1突变体(N = 3 for each genotype) to the reference gene (AT1G15480型),检查读取深度。通过CLC基因组学工作台7.5.1计划获得目视检查。
支持本文结论的数据集包含在文章及其附加文件中。
可用性数据和材料
本次研究中生成和分析的数据集可在[ArrayExpress数据库EMBL-EBI (www.ebi.ac.uk/arrayexpress)]在加入号码E-MTAB-8912下的存储库(http://www.ebi.ac.uk/arrayexpress/experiments/E-MTAB-8912/).
缩写
- 阿巴:
-
脱盐酸
- ABFS:
-
ABRE-binding因素
- AREBs:
-
掌管结合蛋白质
- 伊稳定石:
-
ABA响应元件
- A. Thaliana.:
-
拟南芥
- 罗斯福:
-
错误发现率
- 英国《金融时报》:
-
开花轨迹T.
- 去:
-
基因本体论
- grxs:
-
戊糖豆毒素
- GSTS:
-
谷胱甘肽S转移酶
- Mapks:
-
增殖蛋白激酶
- NGEMPS:
-
核基因编码线粒体蛋白
- Poco1:
-
revocious1.
- PPR:
-
戊庚二肽重复
- PYR1/PYL/RCAR:
-
丙面基蛋白抗性1 / Pyr1样/监管组分ABA受体
- ROS:
-
活性氧
- 公里数:
-
每千碱基每百万次读取
- SnRK2:
-
蔗糖鞣剂1相关蛋白激酶2
- TF:
-
转录因子
- trxs:
-
硫氧还蛋白
参考
- 1。
Kim D-H,Doyle Mr,Sung S,Amasino RM。春化:冬天和植物开花的时机。Annu Rev Cell Dev Biol。2009; 25:277-99。
- 2。
植物开花时间与抗逆性的关系。实验机器人。2016;67:47-60。
- 3。
Cuming Ac,Cho Sh,Kamisugi Y,Graham H,Quatrano Rs。微阵列对苔藓和渗透性,盐,盐和干旱胁迫的转录反应分析,肺孢子虫.新植醇。2007;176:275 - 87。
- 4.
Finkelstein RR,Gampala SSL,摇滚CD。种子和幼苗中的脱落酸信号传导。植物细胞。2002; 14:S15-45。
- 5。
Hirayama T,Shinozaki K.脱落酸信号的感知和转导:键对多功能植物激素ABA功能的键。趋势植物SCI。2007; 12:343-51。
- 6。
张j,贾w,杨j,ismail am。ABA在整合植物反应对干旱和盐胁迫下的作用。f crop res。2006; 97:111-9。
- 7。
Sun Y,Harpazi B,Wijerathna-Yapa A,Merilo E,De Vries J,Michaeli D等人。独立于配体的脱落酸感知的起源。Proc Natl Acad Sci U S A. 2019; 116:24892-9。
- 8。
张H,韩W,De Smet I,Talboys P,Loya R,Hassan A等。ABA促进静态中心的静态,并抑制拟南芥原代根系中的干细胞分化。工厂J.2010; 64:764-74。
- 9。
Ramachandran P,Wang G,Augstein F,De Vries J,Carlsbecker A.连续根Xylem形成和水缺损的血管适应涉及通过MiR165的内胚层ABA信号传导。开发。2018; 145:1-7。
- 10。
Bloch D,Puli Mr,Mosquna A,Yalovsky S.非生物胁迫通过ABA调节的微小RONE表达调节根本图案化。2019; 146:DEV177097。https://doi.org/10.1242/dev.177097.
- 11.
Verslues PE,Zhu J-K。脱落酸感知和代谢的新进展。植物生物学。2007;10:447–52.
- 12.
Umezawa T,Nakashima K,Miyakawa T,Kuromori T,Tanokura M,Shinozaki K,等。ABA响应中核心监管网络的分子基础:传感,信号和运输。植物细胞生理。2010; 51:1821-39。
- 13。
关键词:aba,渗透胁迫,信号转导,植物abstract:植物生物学杂志。2014;21:133-9。
- 14。
Jaradat Mr,Feurtado J,Huang D,Lu Y,Cutler AJ。转录因子ATMYBR1 / ATMYB44在ABA信号,应力响应和叶片衰老中的多种作用。BMC植物BIOL。2013; 13:192。
- 15。
崔H,洪俊,哈俊,姜俊,金世贤。abf是aba反应元件结合因子家族。生物化学杂志。2000;275:1723-30。
- 16。
Uno Y,Furihata T,Abe H,Yoshida R,Shinozaki K,Yamaguchi-Shinozaki K.拟南芥在干旱和高盐度条件下,粘性依赖依赖性信号转导途径的基本亮氨酸拉链转录因子。PROC NATL ACAD SCI。2000; 97:11632-7。
- 17。
Domagalska Ma,Sarnowska E,Nagy F,Davis SJ。赤霉素,脱落酸和芸苔类固醇中的相互作用遗传分析拟南芥.Plos一个。2010; 5:E14012。
- 18。
王Y,Li L,YE T,Lu Y,Chen X,Wu Y. ABA对花卉过渡的抑制作用是由Abi5在拟南芥中介导的。J Exp Bot。2013; 64:675-84。
- 19。
Helliwell CA, Wood CC, Robertson M, James Peacock W, Dennis ES。拟南芥FLC蛋白直接相互作用体内与SOC1和英国《金融时报》染色质是高分子量蛋白质复合体的一部分。植物j . 2006; 46:183 - 92。
- 20。
Vanlerberghe GC。替代氧化酶:一种线粒体呼吸道途径,以维持在非生物和生物胁迫期间的代谢和信号通向稳压。int j mol sci。2013; 14:6805-47。
- 21。
Skinner DJ, Baker SC, Meister RJ, Broadhvest J, Schneitz K, gasasser CS。拟南芥的休伦罗斯基因是胚珠正常发育所必需的,编码线粒体核糖体蛋白。植物细胞。2001;13:2719-30。
- 22
Landschütze V, Willmitzer L, Müller-Röber B.通过反义抑制枸橼酸线粒体合成酶抑制花的形成导致了花子房组织的特异性解体。EMBO j . 1995; 14:660-6。
- 23
吴永平,王永平,王永平,等。编码线粒体蛋白的核基因在生长、发育和胁迫中的顺行和逆行调控。摩尔。2014;7:1075 - 93。
- 24
Foyer Ch,Noctor G.氧化还原和信号与叶绿体,过氧化物血清和线粒体中的反应性氧有关。physiol植物。2003; 119:355-64。
- 25.
Zsigmond L,Rigo G,Szarka A,Szekely G,Otvos K,Darula Z等人。拟南芥PPR40将非生物应激反应连接到线粒体电子传输。植物理性。2008; 146:1721-37。
- 26.
KMIECIK P,LEONARDELLI M,TEIGE M.植物细胞器信号传导链接不同应力响应和信号通路的新型连接。J Exp Bot。2016; 67:3793-807。
- 27.
Emami H,Kempken F.预焦点1(POCO1),一种线粒体五戊肽重复蛋白质影响开花时间拟南芥.工厂J. 2019; 100:265-78。
- 28。
卢林,Andrés C, Aubourg S, Bellaoui M, Bitton F, Bruyère C,等。拟南芥五肽重复蛋白的全基因组分析揭示了它们在细胞器生物发生中的重要作用。植物细胞。2004;16:2089 - 103。
- 29。
O'Toole N,Hattori M,Andres C,Iida K,Lurin C,Schmitz-Linneweber C等人。关于植物五戊肽重复基因家族的扩张。mol Biol Evol。2008; 25:1120-8。
- 30
Akhter S、Uddin MN、Jeong IS、Kim DW、Liu XM、Bahk JD。的作用拟南芥AtPI4Kγ3,一种Ⅱ型磷酸肌醇4-激酶,在非生物胁迫反应和花转变中的作用。植物生物技术杂志。2016;14:215–30.
- 31
伊斯兰教MM,Tani C,Watanabe-Sugimoto M,Uraji M,Jahan Ms,Masuda C等人。Myrosinase,TGG1和TGG2,在Aba和Meja信号中冗余功能在拟南芥保护细胞中。植物细胞生理。2009; 50:1171-5。
- 32
gehring c,paolocci f,alqurashi m,lilley k,bianchet c,chiapello m.早期反应对严重的干旱胁迫拟南芥细胞悬浮培养蛋白质组。蛋白质。2018; 6:38。
- 33。
Torti S,Fornara F,Vincent C,Andrésf,Nordströmk,Göbelu,等。分析对拟南芥花过渡过程中茎分生组织转录组识别出独特的调控模式和促进开花的富含亮氨酸的重复蛋白。植物细胞。2012;24:444 - 62。
- 34。
Idänheimon.在ROS信号中的富含半胱氨酸的受体样蛋白激酶的作用拟南芥.芬兰:赫尔辛基大学;2015.
- 35。
Lin K,Zhao H,GaN S,Li G.拟南芥ELF4样蛋白EFL1和EFL3影响开花时间。基因。2019; 700:131-8。
- 36。
关键词:ffp基因,花控,开花时间拟南芥.第11届INT CONF ARF。2000年。https://doi.org/10.2172/807954.
- 37。
王杰,田玲,李洪生,陈志军。非相加的监管星期五和方法基因座介导植物开花时间的变异拟南芥异源多倍体。遗传学。2006;173:965 - 74。
- 38。
Quesada V,Dean C,Simpson GG。控制控制中的RNA处理拟南芥开花。int j dev biol。2005; 49:773-80。
- 39。
Choi K,Kim J,Hwang H-J,Kim S,Park C,Kim Sy,等。泥蛋白复合物激活转录方法,一个强大的开花压缩机拟南芥,通过招募染色质修饰因子。植物细胞。2011;23:289 - 303。
- 40.
Michaels SD, Bezerra IC, Amasino RM。在拟南芥中,与frigdia相关的基因是冬年习性所必需的。美国国家科学研究院2004;101:3281-5。
- 41.
Koornneef M, Hanhart CJ, van der Veen JH。滇中晚花突变体的遗传和生理分析拟南芥.Mol Gen Genet MGG。1991; 229:57-66。
- 42.
清赫,湖湖我,古德曼·赫姆。拟南芥的孤立GA4轨迹。植物细胞。1995年; 7:195-201。
- 43。
太阳T。拟南芥赤霉素代谢、感知和信号传导途径。阿拉伯B。2008;6:e0103。
- 44。
雷迪GP。超生命突变体拟南芥.遗传学。1962;47:443-60。
- 45。
Griffiths J,Murase K,Rieu I,Zentella R,Zhang Z-L,Powers SJ等人。GID1赤霉素受体的遗传表征及功能分析拟南芥.植物细胞。2006; 18:3399-414。
- 46
Steitner C,Danisman S,Wehrle F,SchöningJC,Alfano JR,Staiger D.小甘氨酸富含RNA结合蛋白atgrp7.促进花卉过渡拟南芥.植物J. 2008; 56:239-50。
- 47
BOSS PK,Bastow RM,Mylne JS,Dean C.在决定中的多种途径:启用,推广和重置。植物细胞。2004; 16:S18-31。
- 48
Halliday KJ,Salter Mg,Thingnaes E,Whitelam GC。开花的Phytochrome控制是温度敏感和与花卉积分器的表达相关英国《金融时报》.植物j . 2003; 33:875 - 85。
- 49.
邢S, Zachgo S。ROXY1和ROXY2两个glutaredoxin基因是花药发育所必需的。植物j . 2008; 53:790 - 801。
- 50。
梁杰、梅洛S、吉拉达特J。拟南芥脱钙酸 - 不敏感2(Abi2.),Abi1.基因编码参与脱落酸信号转导的同源蛋白磷酸酶2C。植物细胞。1997;9:759 - 71。
- 51。
Kulik A,Wawer I,Krzywińskae,Bucholc M,Dobrowolska G.SNRK2蛋白激酶 - 植物反应对非生物胁迫的关键调节因子。OMI A J INTECT BIOL。2011; 15:859-72。
- 52。
康J,Choi H,IM M,Kim Sy。拟南芥碱性亮氨酸拉链蛋白介导应力响应性脱落酸信号传导。植物细胞。2002; 14:343-57。
- 53。
Hwang K,Susila H,Nasim Z,Jung J-Y,Ahn Jh。拟南芥ABF3和ABF4转录因子与NF-YC复合物进行调节SOC1表达和介导干旱加速开花。摩尔植物。2019;12:489–505.
- 54
Cheng S-H,Willmann M,Chen H,Sheen J.通过蛋白激酶的钙信号传导。拟南芥钙依赖性蛋白激酶基因家族。植物理性。2002; 129:469-85。
- 55
Antoni R,Rodriguez L,Gonzalez-Guzman M,Pizzio Ga,Rodriguez PL。关于ABA运输,蛋白质退化和ABA信令中的ABFS / WRKYS的新闻。CurrOp植物BIOL。2011; 14:547-53。
- 56
Kuhn JM,Boisson-Dernier A,Dizon MB,Maktabi MH,Schroeder Ji。蛋白质磷酸酶AtPP2CA公司负调节脱钙酸信号转导拟南芥和效果ABH1.上AtPP2CA公司mRNA。植物理性。2006; 140:127-39。
- 57。
Yoshida T,Nishimura N,Kitahata N,Kuromori T,ITO T,Asami T,等。ABA过敏性发芽3编码蛋白质磷酸酶2C(ATPP2CA),该蛋白磷酸酶2C(ATPP2CA)强烈调节在萌芽期间的积极酸信号传导拟南芥蛋白磷酸酶2 cs。植物杂志。2006;140:115-26。
- 58。
Choi H, Park H, Park JH, Kim S, Im M, Seo H,等。拟南芥钙依赖蛋白激酶AtCPK32与ABF4相互作用,并调节其活性。ABF4是aba响应基因表达的转录调控因子。植物杂志。2005;139:1750 - 61。
- 59。
[10]梅泽涛,熊本华,韩志明,等。CYP707A3是一种主要的ABA 8 ' -羟化酶,参与细胞的脱水和复水反应拟南芥.植物j . 2006; 46:171 - 82。
- 60.
郭璐,杨辉,张欣,杨松。脂质转移蛋白3作为MYB96的目标,介导冻结和干旱压力拟南芥.J Exp Bot。2013; 64:1755-67。
- 61.
Deeken R,Saupe S,Klinkenberg J,Riedel M,Leide J,Hedrich R等人。非特异性脂质转移蛋白Atttpi-4参与Suberin形成拟南芥冠胆。植物理性。2016; 172:1911-27。
- 62.
他,Gan S.一种新型锌 - 手指蛋白,具有富含脯氨酸的域名介导ABA监管的种子休眠拟南芥.中国生物医学工程学报,2004;
- 63.
王颖,杨玲,陈旭,叶涛,钟斌,刘锐,等。主要胶乳蛋白样蛋白43(MLP43)在脱落酸反应期间用作阳性调节剂,并赋予耐旱耐受性拟南芥.J Exp Bot。2016; 67:421-34。
- 64.
Gonzalez-Jorge S,Ha S-H,Magallanes-Lundback M,Gilliland Lu,周A,Lipka Ae,等。类胡萝卜素裂解二恶英是拟南芥β-胡萝卜素含量的负调节剂。植物细胞。2013; 25:4812-26。
- 65.
Ma Y,Szostkiewicz I,Korte A,Moes D,Yang Y,Christmann A等。PP2C磷酸酶活性的调节剂作为脱落酸传感器。科学。2009; 324:1064-8。
- 66.
赵勇,陈子强,高杰,邢力,曹M,于C,等。ABA受体PYL9促进抗旱性和叶片衰老。国家科学院学报。2016;113:1949–54.
- 67。
Osakabe Y,Maruyama K,Seki M,Satou M,Shinozaki K,Yamaguchi-Shinozaki K.富含纯胰岛的重复受体Kinase1是拟南芥中脱落酸早期信号的关键膜结合调节器。植物细胞。2005; 17:1105-19。
- 68。
Sharma M, Pandey GK。植物逆境和发育过程中重复结构域蛋白的扩增和功能。植物科学,2016;6:1-15。
- 69。
Umezawa T,Yoshida R,Maruyama K,Yamaguchi-Shinozaki K,Shinozaki K.SRK2C,SNF1相关的蛋白激酶2,通过控制应力响应基因表达来改善耐旱性拟南芥.自然科学学报2004;101:17306-11。
- 70。
关键词:NtSyp121, Ca2+通道门控,Ca2+瞬时信号,气孔保卫细胞摩尔。2008;1:347-58。
- 71。
栾氏菌蛋白磷酸酶在植物中。Annu Rev植物Biol。2003; 54:63-92。
- 72。
Yoshida T, Fujita Y, Sayama H, Kidokoro S, Maruyama K, Mizoi J等。AREB1、AREB2和ABF3是协同调控abre依赖的ABA信号传导参与干旱胁迫耐受的主转录因子,需要ABA才能完全激活。植物j . 2010; 61:672 - 85。
- 73。
郎v,palva et。Rab相关基因的表达,rab18,是由脱落酸诱导的冷驯化过程拟南芥(L.)Heynh。植物mol biol。1992年; 20:951-62。
- 74。
Yamaguchi-Shinozaki K,Shinozaki K.一部小说独联体拟南芥基因中的元素参与干旱,低温或高盐胁迫的反应性。植物细胞。1994年; 6:251-64。
- 75。
郭伟,沃德RW,托马斯肖。一个冷调控小麦基因的特性分析拟南芥cor47..植物理性。1992年; 100:915-22。
- 76。
关键词:拟南芥,多跨跨膜蛋白,转录因子,表达谱,生物信息学植物杂志。2003;132:64 - 74。
- 77。
Tran L-SP,Nakashima K,Sakuma Y,Simpson SD,Fujita Y,Maruyama K,等。拟南芥应激诱导NAC转录因子的分离与功能分析与干旱响应的影响独联体- 在早期响应于脱水应激1启动子。植物细胞。2004; 16:2481-98。
- 78
Kim Sy,Nam Kh。ERD10在拟南芥中非生物应激中的生理作用。植物细胞代表2010; 29:203-9。
- 79
Arondel v,Vergnolle C,Cantrel C,Kader J-C。脂质转移蛋白由小型多岛家族编码拟南芥.植物SCI。2000; 157:1-12。
- 80.
Jain A,威尔逊GT,Connolly El。不同的角色摇来摇去铁和铜稳态中的家族金属还原酶。植物科学与技术,2014;https://doi.org/10.3389/fpls.2014.00100.
- 81。
一种干燥反应性表达的表征RD29.基因拟南芥转基因植物启动子分析。Mol Gen Genet MGG。1993年; 236-236:331-40。
- 82。
ÅdénJ,Wallgren M,Storm P,Weise CF,Christiansen A,SchröderWp等。非凡的μs-ms骨干动力学拟南芥过氧杂志Q. Biochim Biophys Acta。2011; 1814:1880-90。
- 83.
Kiddle G,Pastori Gm,Bernard S,Pignocchi C,Antoniw J,Verrier PJ,等。叶片抗坏血酸含量对防锈和光合作用基因表达的影响拟南芥.抗氧化氧化还原信号2003;5:23-32。
- 84.
Alexandersson E,Fraysse L,Sjövall-Larsen S,Gustavsson S,Fellert M,Karlsson M等。全基因家族表达及水盆蛋白的干旱胁迫调节。植物mol biol。2005; 59:469-84。
- 85.
Ito S,Song YH,Josephson Day AR,Miller RJ,Breton G,Olmstead RG等。开花BHLH转录激活物控制光周期开花调节器的表达概要在拟南芥.PROC NATL ACAD SCI。2012; 109:3582-7。
- 86.
Lee S, Lee S, Yang KY, Kim YM, Park SY, Kim SY,等。过度的前1其同源基因激活吉布林素依赖性反应拟南芥. 植物细胞生理学。2006;47:591–600.
- 87.
Abe H,Uraao T,Ito T,Seki M,Shinozaki K,Yamaguchi-Shinozaki K. Arabidopsis AtmyC2(BHLH)和AtmyB2(MYB)用作脱钙酸信号传递的转录激活剂。植物细胞。2003; 15:63-78。
- 88.
关键词:非生物胁迫,转录因子,结构,功能,网络科学通报。2013;
- 89.
Cui MH, Yoo KS, hyyoung S, Nguyen HTK, Kim YY, Kim HJ,等。拟南芥R2R3-MYB转录因子AtMYB20负调控2C型丝氨酸/苏氨酸蛋白磷酸酶以增强盐耐受性。2月。2013;587:1773-8。
- 90。
Preston J, Wheeler J, Heazlewood J, Li SF, Parish RW。AtMYB32是正常花粉发育所必需的拟南芥.工厂J. 2004; 40:979-95。
- 91。
Jung C, Jun SS, Sang WH, Yeon JK, Chung HK, Sang IS,等。过度的atmyb44增强气孔闭合,增强拟南芥的非生物胁迫耐受性。植物杂志。2008;146:623-35。
- 92。
Frerigmann H, Gigolashvili T. MYB34, MYB51和MYB122明显调控Indolic硫代葡萄糖苷的生物合成拟南芥.摩尔。2014;7:814-28。
- 93。
赵y,xing l,wang x,hou y j,gao j,王p等。ABA受体Pyl8通过增强患有症响应基因的MyB77依赖性转录来促进侧向根生长。SCI信号。2014; 7:ra53。
- 94。
李JQ,张杰,王旭,陈杰。一种膜栓系转录因子ANAC089负调控植物的花起始拟南芥.科学生中国生活SCI。2010; 53:1299-306。
- 95。
Matías-hernándezl,aguilar-jaramillo ae,Marín-gonzáleze,苏拉斯-LópezP,Pelaz S.rav.基因:调节花卉诱导及超越。Ann Bot。2014; 114:1459-70。
- 96。
Eulgem T, Rushton PJ, Robatzek S, somsich IE。植物转录因子WRKY超家族。植物科学学报,2000;
- 97。
van de Cotte B, Muhlenbock P, de Rycke R,等。在拟南芥中,当AtWRKY15被干扰时,线粒体的应激反应就会被破坏,而线粒体的应激反应则会引导植物对渗透胁迫的耐受。Proc Natl academy Sci. 2012; 109:20113-8。
- 98。
Bakshi M, Oelmüller R. WRKY转录因子。植物信号行为研究。2014;9:e27700。
- 99。
江伊,Deyholos MK。非生物胁迫中拟南芥NaCL诱导口号25和Wrky33转录因子的功能表征。植物mol biol。2009; 69:91-105。
- 100。
Rushton DL,Tripathi P,Rabara RC,Lin J,Ringler P,Boken AK等。WRKY转录因子:脱落酸信号传导的关键成分。植物生物技术杂志。2012;10:2–11.
- 101。
丁ZJ,闫杰,李力,李gx,吴毅,郑sj。转录因子Wrky46通过调节ABA信号传导和养蛋白稳态来调节奥斯糖/盐胁迫条件下的拟南芥横向根部的发育。工厂J. 2015; 84:56-69。
- 102.
Shinozaki K,Yamaguchi-Shinozaki K,Seki M.干旱和冷应力反应中基因表达的监管网络。CurrOp植物BIOL。2003; 6:410-7。
- 103.
Kleine T,Leister D. Retrograde Signaling:Unirselles Go Networking。Biochim Biophys Acta Bioenerg。1857年; 2016:1313-25。
- 104.
何Y,周J,单L,孟X。植物细胞表面受体介导的信号-多样性中的共同主题。细胞科学杂志。2018;131:jcs209353。
- 105.
植物线粒体逆行调控。线粒体。2007;7:177 - 94。
- 106.
泰勒NL,Day Da,Millar啊。环境压力导致植物线粒体造成氧化损伤,导致甘氨酸脱羧酶的抑制。J Biol Chem。2002; 277:42663-8。
- 107.
Van Aken O,Giraud E,Clifton R,Whelan J.替代氧化酶:应激反应的目标和调节器。physiol植物。2009; 137:354-61。
- 108.
Berkowitz O,De Clercq I,Van Breusegem F,Whelan J.在生长,发展和植物防御反应期间激素和线粒体信号之间的相互作用。植物细胞环境。2016; 39:1127-39。
- 109.
喇嘛S,Broda M,Abbas Z,Vaneechoutte D,Belt K,SällT等。线粒体蛋白的新官能化并掺入植物信号网络中。mol Biol Evol。2019; 36:974-89。
- 110。
van aken o,福特e,lister r,huang s,millar啊。由遗传线粒体功能障碍引起的逆行信令部分由ANAC017部分介导并提高植物性能。工厂J. 2016; 88:542-58。
- 111。
Clifton R,Millar Ah,Whelan J.拟南芥的替代氧化酶:基因家族中差异表达的比较分析为非磷酸化旁路提供了新的见解。Biochim Biophys Acta Bioenerg。2006; 1757:730-41。
- 112。
De Clercq I,Vermeirssen V,Van Aken O,Vandepoele K,Mucha MW,法律SR等。膜结合的NAC转录因子ANAC013在氧化应激反应的线粒体逆行调节中的作用拟南芥.植物细胞。2013; 25:3472-90。
- 113。
Nakashima K,Satoh R,Kiyosue T,Yamaguchi-Shinozaki K,Shinozaki K.编码脯氨酸脱氢酶的基因不仅由脯氨酸和低摩尔磷诱导,而且在生殖器官中也受到发展拟南芥. 植物生理学。1998;118:1233–41.
- 114。
植物线粒体氧化还原生物学研究进展。植物科学,2007;12:125-34。
- 115。
Rouhier N,Vlamis-Gardikas A,Lillig Ch,Berndt C,Schwenn J-D,Holmgren A等。杨树胶质毒素氧化还原性能的表征。抗氧化氧化还原信号。2003; 5:15-22。
- 116。
Dixon DP,Hawkins T,Hussey PJ,Edwards R.酶活性和拟南芥成员的亚细胞定位转移酶超家族。J Exp Bot。2009; 60:1207-18。
- 117。
Horváthe,bela k,papdi c,galléá,szabados l,tari i等。拟南芥谷胱甘肽转移酶F9基因在幼苗氧化胁迫下的作用。Acta Biol Hung。2015; 66:406-18。
- 118。
KITAMURA S,Akita Y,Ishizaka H,Narumi I,Tanaka A. Cyclynen中的花青素相关谷胱甘肽S转移酶基因的分子表征。J植物理性。2012; 169:636-42。
- 119。
Park S-W, Li W, Viehhauser A, He B, Kim S, Nilsson AK等。在应激反应调节细胞氧化还原稳态过程中,亲环素20-3传递12-氧-植物二烯酸信号。2013; 110:9559-64。
- 120。
Gutsche N,Thurow C,Zachgo S,Gatz C.植物特异性CC型戊二酮:在发育过程和应力反应中的功能。Biol Chem。2015; 396:495-509。
- 121。
李楠,Muthreich M,黄磊,Thurow C,孙涛,张勇,等。tgacg结合因子(TGAs)和tga相互作用的cc型谷胱甘肽蛋白调节睡眠减退生长拟南芥.新植醇。2019;221:1906-18。
- 122.
Ota R,Ohkubo Y,Yamashita Y,Ogawa-Ohnishi M,Matsubayashi Y.射击到根移动CEPD 2集成了拍摄氮气状态以全系统调节硝酸盐摄取拟南芥.Nat Commun。2020;11:641。
- 123.
植物谷胱甘肽系统的全基因组分析。实验机器人。2006;57:1685-96。
- 124。
Wimmelbacher M,Börnkef.硫昔嗪Z和Fruceoinase样蛋白1的氧化还原活性可分配用于自养生长拟南芥.J Exp Bot。2014; 65:2405-13。
- 125。
Laloi C,Mestres-Ortega D,Marco Y,Meyer Y,Reichheld J-P。拟南芥细胞溶质硫酸细胞素H 5基因氧化应激及其对病原体引发器的响应的基因诱导。植物理性。2004; 134:1006-16。
- 126.
Jha SK, Sharma M, Pandey GK。环核苷酸门控通道在植物逆境管理中的作用。咕咕叫基因组学。2016;17:315-29。
- 127.
Kwak Jm,Nguyen v,Schroeder ji。反应性氧物种在激素反应中的作用。植物理性。2006; 141:323-9。
- 128.
Pei Z-M,Murata Y,Penning G,Thomine S,Klüsenerb,艾伦GJ等。通过过氧化氢激活的钙通道介导防脱钙信号在保护细胞中。自然。2000; 406:731-4。
- 129.
关键词:植物,气孔运动,信号通路,干旱胁迫Adv Plants agricultural Res. 2018; 8:290-7。
- 130。
Kim JS, Jung HJ, Lee HJ, Kim KA, Goh CH, Woo Y,等。富含甘氨酸的rna结合蛋白7通过调节气孔的开放和闭合来影响非生物胁迫反应拟南芥.工厂J. 2008; 55:455-66。
- 131.
Roflsema MRG,PRINS HBA。脱落酸对ABI突变体中孤立表皮条带的气孔开口的影响拟南芥.physiol植物。1995年; 95:373-8。
- 132。
PEI ZM,Kuchitsu K,Ward JM,Schwarz M,Schroeder Ji。拟南芥野生型保护细胞慢阴离子通道的差异脱落酸调节Abi1.和Abi2.突变体。植物细胞。1997; 9:409-23。
- 133。
王YF,Munemasa S,Nishimura N,Ren HM,Robert N,Han M等。鉴定循环GMP活化的非选择性CA2 +可达到的阳离子通道和相关CNGC5.和CNGC6.拟南芥保护细胞中的基因。植物理性。2013; 163:578-90。
- 134。
田中俊,田中俊,田中俊,田中俊,田中俊,田中俊。膜结合受体样蛋白激酶1 (RPK1)的过量产生增强了细胞对非生物胁迫的耐受性拟南芥.J Biol Chem。2010; 285:9190-201。
- 135。
Barth C, Jander G.拟南芥芥子酶TGG1和TGG2在芥子油苷分解和昆虫防御中具有冗余功能。植物j . 2006; 46:549 - 62。
- 136。
赵Z,张文,斯坦利巴,艾斯曼姆。功能蛋白质组学拟南芥保护细胞揭示了新的气孔信号通路。植物细胞。2008; 20:3210-26。
- 137。
哈尔兹巴尔,Gershenzon J.生物学和生物化学的葡萄糖苷。Annu Rev植物Biol。2006; 57:303-33。
- 138。
Deshpande S,James A,Franklin C,Leach L,杨J.使用RNA-SEQ管道采用组合方法的新型开花基因的鉴定拟南芥时间序列顶端拍摄商品。int j bioinform res appl。2017年;在新闻。
- 139。
Harb A,Krishnan A,Ambavaram MMR,Pereira A.在拟南芥中干旱胁迫的分子和生理分析揭示了植物生长中驯化的早期反应。植物理性。2010; 154:1254-71。
- 140。
NäsholmT,Kielland K,Ganeteg U.由植物吸收有机氮。新植物。2009; 182:31-48。
- 141。
Rentsch D,Schmidt S,Tegeder M.用于摄取和植物中有机氮化合物的分配的转运蛋白。费用。2007; 581:2281-9。
- 142。
Vidal EA,Moyano TC,Calales J,Gutiérrezra。发育阶段转型的氮气控制拟南芥.实验机器人。2014;65:5611-8。
- 143。
韦伯K,埋葬M.氮气 - 必需的Macronurient和信号控制开花时间。physiol植物。2018; 162:251-60。
- 144。
袁S,张Z-W,郑C,赵Z-y,王Y,Feng L-Y等。拟南芥加密1在开花的氮气调节中的作用。PROC NATL ACAD SCI。2016; 113:7661-6。
- 145。
Pigliucci m,schlichting cd。反应规范拟南芥(Brassicaceae)。III。来自全球收集的26个人群中营养成分的反应。我是J机器人。1995年; 82:1117-25。
- 146.
Marín IC, Loef I, Bartetzko L, Searle I, Coupland G, Stitt M,等。硝酸盐调节花的诱导拟南芥,独立于光、赤霉素和自主途径。足底。2011;233:539–52.
- 147.
Teng Y,Liang Y,Wang M,Mai H,Ke L.硝酸盐转运仪1.1参与通过转录调节调节开花时间开花基因座C.在拟南芥.植物SCI。2019; 284:30-6。
- 148。
Riboni M,Galbiati M,Tonelli C,Conti L. Gigantea通过富集的苯并抑制和抑制剂的过表达的富集抑制剂的活化,可以通过脱落酸依赖性激活来逃避响应。植物理性。2013; 162:1706-19。
- 149。
竹野K。胁迫诱导开花:第三类开花反应。J实验机器人。2016;67:4925–34.
- 150.
萧j,李c,xu s,xing l,xu y,Chong K.Jacalin-凝集素样调节核蛋白质7,影响甘氨酸富含RNA结合积累的RNA加工开花基因座C.拟南芥的反义转录和开花时间。植物生理学。2015;169:2102–17.
- 151.
Song YH、Ito S、Imaizumi T。开花时间调节:叶片对光周期和温度的敏感。植物科学趋势。2013;18:575–83.
- 152.
Kania T,Russingberger D,Peng S,Apel K,Melzer S. FPF1促进了拟南芥的开花。植物细胞。1997; 9:1327-38。
- 153.
山口茂崎,筱崎独联体-渗透和冷应激反应启动子中的作用调节元件。植物科学趋势。2005;10:88–94.
- 154.
Yasuda M,Ishikawa A,Jikumaru Y,Seki M,Umezawa T,Asami T,等。全身性质抗性与脱落酸介导的非生物应激反应之间的拮抗相互作用拟南芥.植物细胞。2008; 20:1678-92。
- 155.
吨J,Flors V,Mauch-Mani B. ABA在抗病性中的多方面作用。趋势植物SCI。2009; 14:310-7。
- 156。
曹明杰,张义利,刘旭,黄宏,周旭,王文利,等。化学与遗传相结合提高植物抗旱性的研究。自然公社。2017;8:1183.
- 157。
Himmelbach A,Yang Y,Grill E.继电器和脱落酸信号传导的控制。CurrOp植物BIOL。2003; 6:470-9。
- 158。
Yoshida R,Hobo T,Ichimura K,Mizoguchi T,Takahashi F,Aronso J等。ABA活化的SNRK2蛋白激酶是拟南芥中脱水应力信号传导所必需的。植物细胞生理。2002; 43:1473-83。
- 159。
ROS和ABA在系统获得性驯化中的作用。植物细胞。2015;27:64 - 70。
- 160。
中野T、铃木K、藤村T、新市H。拟南芥和水稻ERF基因家族的全基因组分析。植物生理学。2006;140:411–32.
- 161。
Chao Y,张T,杨Q,康J,Sun Y,Gruber My,等。Alfalfa CCCH型锌指蛋白基因MSZFN延迟转基因的开花时间的表达拟南芥.植物SCI。2014; 215-216:92-9。
- 162。
Kim S,Choi K,Park C,Hwang H-J,Lee I.冷冻症抑制剂4锌指蛋白是一种c2h2型锌指蛋白,通过转录激活锌指蛋白抑制开花拟南芥开花基因座C..植物细胞。2006; 18:2985-98。
- 163。
yoo sy,金y,金sy,lee js,ahn jh。拟南芥中NAC结构域蛋白的开花时间和冷响应控制。Plos一个。2007; 2:E642。
- 164。
植物MAP激酶信号转导的研究进展。植物生物学。2002;5:15 - 24。
- 165。
Fujita M,Fujita Y,Noutoshi Y,Takahashi F,Narusaka Y,Yamaguchi Shinozaki K,et al.非生物和生物胁迫反应之间的串扰:从胁迫信号网络的收敛点看当前的观点。植物生物学。2006;9:436–42.
- 166。
张t,刘y,杨t,张l,xu s,xue l等。不同的信号在植物中Mapk瀑布融合。植物理性生物化学。2006; 44:274-83。
- 167。
Törm,Lotze Mt,Holton N.受体介导的植物中的信号传导:分子模式和程序。J Exp Bot。2009; 60:3645-54。
- 168。
Rhoads DM, Umbach AL, Subbaiah CC, Siedow JN。线粒体活性氧。对氧化应激和细胞器间信号传导的贡献。植物杂志。2006;141:357 - 66。
- 169。
SchwarzländerM,Finkemeier I. Mitochondrial Energy和植物中的氧化还原信号。抗氧化氧化还原信号。2013; 18:2122-44。
- 170。
Schwarzländer M, König AC, Sweetlove LJ, Finkemeier I.线粒体功能受损对逆行信号传导的影响:转录组响应的meta分析。实验机器人。2012;63:1735-50。
- 171。
江H-W,刘M-J,陈I-C,黄C-H,Chao L-Y,Hsieh H-L。由光和激素调节的谷胱甘肽S-转移酶参与拟南芥幼苗发育的调节。植物理性。2010; 154:1646-58。
- 172。
Mang HG, Kang EO, Shim JH, Kim S, Park KY, Kim YS,等。一项蛋白质组学分析确定了谷胱甘肽s-转移酶亚型,其丰度在早期根表皮形成过程中受到乙烯的差异调控拟南芥幼苗。Biochim Biophys Acta。2004; 1676:231-9。
- 173。
Sinha R,Kumar D,Datta R,Hazra S,Bhattacharyya D,Mazumdar Ab等。集成转录组和蛋白质组学分析拟南芥暴露于谷胱甘肽揭示了它在植物防御中的作用。植物细胞组织器官培养。2015;120:975-88。
- 174.
陈建华,蒋洪伟,谢恩杰,陈海英,简长涛,谢洪林,等。干旱和盐胁迫的耐受性拟南芥谷胱甘肽S-转移酶U17敲除突变体归因于谷胱甘肽和脱落酸的综合作用。植物理性。2012; 158:340-51。
- 175。
Thompson Aj,Andrews J,Mulholland Bj,Mckee Jmt,Hilton HW,Horridge JS等人。番茄中脱落酸的过度生产增加了蒸腾效率和根液态传导性,影响叶片膨胀。植物理性。2007; 143:1905-17。
- 176.
CHIN DC,HSIEH CC,LIN HY,YEH KW。低谷胱甘肽氧化还原态伴有降低抗坏血酸氧化钠比率,以加速开花在甲胞内兰花。植物细胞生理。2016; 57:423-36。
- 177.
giaud E, Van Aken O, Ho LHM, Whelan J.转录因子ABI4是线粒体逆行表达的一个调节因子。植物杂志。2009;150:1286 - 96。
- 178.
Giraud E,Ho LHM,Clifton R,Carroll A,Estavillo G,Tan Y-F等人。拟南芥中没有替代的氧化酶1a导致急性敏感性与组合的光和干旱胁迫。植物理性。2008; 147:595-610。
- 179.
Amirsadeghi S, Robson CA, McDonald AE, Vanlerberghe GC。植物线粒体电子运输的改变改变了细胞活性氧水平和对细胞死亡信号分子的敏感性。植物细胞物理学报2006;47:1509-19。
- 180。
Samson F,Brunaud V,Balzergue S,Dubreucq B,Lepiniec L,Pelletier G,et al.《FLAGdb/FST:人类侧翼插入位点的数据库》拟南芥T-DNA转化体。核酸RES。2002; 30:94-7。
- 181。
Mortazavi A,Williams Ba,McCue K,Schaeffer L,Wold B.用RNA-SEQ进行测绘和量化哺乳动物转录om。NAT方法。2008; 5:621-8。
- 182。
控制错误发现率:一种实用而强大的多重检测方法。中华人民共和国科学技术委员会1995;
- 183。
Reimand J,Kull M,Peterson H,Hansen J,Vilo J.G:Profiler-A基于Web的工具集,用于来自大规模实验的基因列表的功能分析。核酸RES。2007; 35:W193-200。
确认
不适用。
资金
不适用。
作者信息
隶属关系
贡献
他为RNA样品制备促进,分析了RNA-SEQ数据,解释结果,写了稿件和设计的数字;AK分析了RNA-SEQ数据,审查了稿件,并辅助数字制备;和FK构思了这项研究,审查了稿件,并监督整个项目。所有作者均认批准了最终手稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1、表S2
和表S3。差异表达基因列表。差异表达基因poco1在葡萄花前开花和开花和花序 - 花序(折叠变化≥2或≤ - 2 FDR切断<0.05)。
附加文件2:图S1。
去浓缩。结果显示,在花序前-花序、花序-开花和花序-花序中上调和下调基因的分子功能排名前5位(GO:MF)和生物过程排名前30位(GO:BP)。的调整P.值(P.adj)以负对数10表示。
附加文件3:图S2。
患有开花相关基因的表达poco1.与开花相关基因的热图。差异表达的开花基因poco1与野生型在三个比较显示。开花相关基因表达的改变可能解释了poco1的早花表型。在热图中使用折叠变化(log10)表示。红色和蓝色分别代表上调和下调的转录本。黑色表示未检测到≥2或≤−2且FDR < 0.05的折叠变化。褶皱变化是相对于野生型的。
附加文件4:图S3。
poco1受损的ABA信号和反应。aba相关差异表达基因的热图。poco1抑制大量ABA相关基因,导致ABA信号通路缺失。在热图中使用折叠变化(log10)表示。红色和蓝色分别代表上调和下调的转录本。黑色表示未检测到≥2或≤−2且FDR < 0.05的折叠变化。褶皱变化是相对于野生型的。
附加文件5:图S4。
干旱和氧化应激基因的Fold change表达。中差异表达的干旱和氧化胁迫相关基因的折叠变化热图poco1.在热图中使用折叠变化(log10)表示。红色和蓝色分别代表上调和下调的转录本。黑色表示未检测到≥2或≤−2且FDR < 0.05的折叠变化。
附加文件6:图S5。
折叠改变编码转录因子的基因的热图。通过热图可视化编码转录因子的基因的折叠变化表达。不同类转录因子的表达受到影响poco1.在热图中使用折叠变化(log10)表示。红色和蓝色分别代表上调和下调的转录本。黑色表示未检测到≥2或≤−2且FDR < 0.05的折叠变化。TFs,转录因子。
附加文件7:图S6。
细胞信号转导和线粒体扰动靶点相关基因表达的改变poco1.发现与细胞信号传导和线粒体扰动相关的基因差异调节poco1. 在热图中用褶皱变化(log10)表示。红色和蓝色分别代表上调和下调的转录物。黑色表示褶皱也会改变≥2或 ≤ − 2个FDR < 未检测到0.05。褶皱变化与野生型有关。
附加文件8:图S7。
氧化还原相关基因和气孔功能相关基因的表达改变。与氧化还原状态和气孔功能相关的基因在细胞中有不同的调节poco1.折叠变化(log10)用于表示热图。红色和蓝色分别代表上调和下调的转录本。黑色表示未检测到≥2或≤−2且FDR < 0.05的折叠变化。褶皱变化是相对于野生型的。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
转录组学分析poco1,线粒体五戊肽重复蛋白质突变体拟南芥.BMC植物BIOL.20,209 (2020). https://doi.org/10.1186/s12870-020-02418-z
收到:
接受:
发表:
关键字
- PPR蛋白质
- POCO1
- 开花时间
- 线粒体
- ABA信号
- RNA-SEQ.
- A. Thaliana.