摘要
背景
农杆菌属rhizogenesARM转化是一种高效的由转基因根和野生型茎组成复合植株的技术,为研究根生物学提供了有力的工具。在包括大豆在内的许多植物物种中已经建立了ARM转化。然而,传统的大豆转化,转化效率较低。另外,将毛状根在一种培养基中诱导,然后将生成的复合植株移栽到另一种培养基中生长。这两步操作不仅耗时,而且增加了研究植物与微生物相互作用的污染风险。
结果
本文报道了一种具有较高转化效率的一步ARM转化方法,用于生成复合大豆植株。毛状根的诱导和复合植株的连续生长均在单一培养基中进行。将7 d龄幼苗的初生根斜切去头,接种剩余的下胚轴(顶端部分保持0.7 ~ 1 cm)一个。rhizogenes拥有感兴趣的基因结构。随后,将受感染的幼苗种植在装有湿的无菌蛭石的花盆中。在接种16天后,7个被试基因型中几乎100%的受感染幼苗都能产生转基因阳性根。重要的是,每株复合植株的转基因毛状根数量是传统ARM转化的3倍左右,说明一步法操作更简单,转化效率更高。通过CRISPR/Cas9系统验证了一步法敲除大豆的可靠性Rfg1在Williams 82 (Nod-)中,通过Sinorhizobium frediiUSDA193。并将该方法应用于拟南芥么大豆中的启动子。的活动姚启动子在全根中检测到,在根尖中较强。我们还将协议扩展到番茄。
结论
我们建立了一种一步ARM转化方法,该方法操作更方便,转化效率更高(几乎100%),用于生成复合大豆植株。该方法已在启动子功能分析和根瘤菌-豆科植物相互作用中得到验证。我们期望该方法能广泛应用于番茄和大豆等其他植物的根系相关事件分析。
背景
大豆(大豆(l)小麦(Merr.)是世界上最重要的作物之一,其种子中含有高含量的食用油(18-20%)和高蛋白(35-40%)。目前,世界上超过三分之一的食用油和三分之二的蛋白粉来自大豆[1,2]。2017年,全球大豆产量超过3.4亿吨,用于满足不断增长的人类消费和动物饲料需求[3.]。在过去的几十年里,人们对大豆的遗传学、多组学和全基因组关联(GWAS)进行了深入的研究[2,4,5,6,7,8,9]。然而,一种简单高效的转换方法是对大量候选基因进行功能注释的前提。
农杆菌属rhizogenes-介导(ARM)毛状根转化为研究根生物学提供了一种强大的瞬时工具,并已广泛建立在各种植物物种中,包括稳定的遗传转化抗性植物物种,如大豆[10,11]。然而,基于传统的ARM转化方案,刺入下胚轴(广泛应用于大豆)和体外(或in -vitro)的转化效率通常较低。此外,由于毛状根的诱导和复合植株的连续生长是在不同的培养基中进行的,因此转化方法需要两步操作来生成复合植株[11,12,13,14,15,16,17,18,19]。本文报道了一种具有较高转化效率的一步ARM转化方法,用于生成复合大豆植株。毛状根的诱导和复合植株的生长均在单一培养基中完成。这是大豆与微生物相互作用研究中操作简单、转化效率高、污染风险低的一项有前景的技术突破。此外,通过CRISPR/ cas9介导的敲除结瘤抗性基因,验证了一步ARM转化方法的可靠性Rfg1在大豆基因型Williams 82 (Nod-)中接种Sinorhizobium frediiUSDA193 [20.,21]。的表达模式也采用了一步变换的方法进行分析拟南芥么启动子(22在大豆根中。利用一步ARM变换方法生成了复合番茄植株。我们预计一步转化方法将广泛应用于番茄和大豆等植物根系相关事件的分析。
结果
大豆复合植株一步ARM转化方法的建立
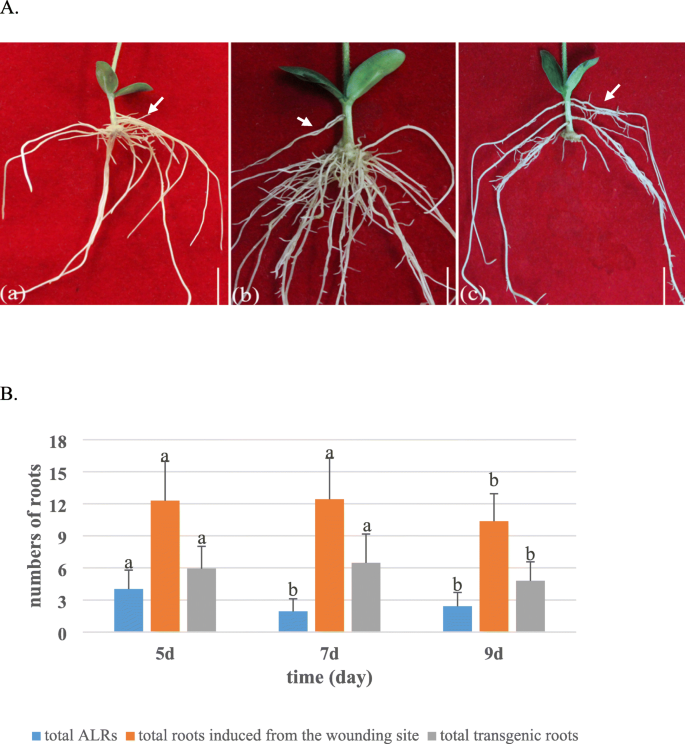
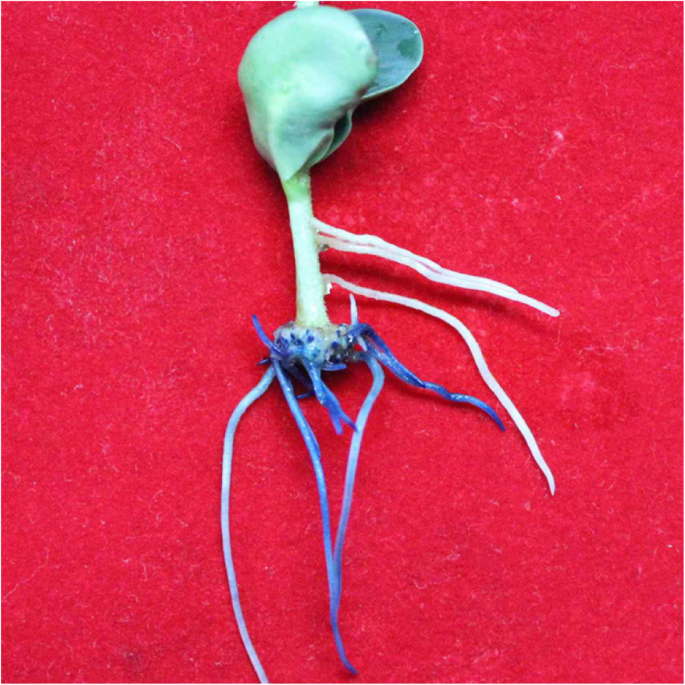
本研究使用的大豆基因型Williams 82,其基因组已被完全测序。的一个。rhizogenes选用菌株K599,因为它能有效地诱导大豆毛状根[11,23]。通过切断大豆幼苗的下胚轴,建立了一种单步ARM转化方法,以获得复合大豆植株。健康幼苗的主根(图2)1A)在接种前被移除一个。rhizogenes携带目标基因构建体的K599菌株(K599- hgci)。将K599-HGCI接种并包被在幼苗残下胚轴的斜切处(图5)。1c)。接种后的幼苗直接种植于湿无菌蛭石中,并用K599-HGCI (OD600 = 0.6-1.0)悬浮液浇灌,图5。1d)。随后,将接种后的幼苗用塑料袋覆盖,保持高湿,持续16天,使毛状根发育(图2)。1e)。1F为诱导毛状根。为了优化转化方案,我们测试了苗龄对转化效率的影响。分别对5天、7天和9天的健康幼苗进行毛状根和转基因根的诱导数量测定。结果表明,7天龄的幼苗诱导毛状根的效果最好(图2)。2).与7日龄幼苗相比,5日龄幼苗未转化的不定侧根(ALRs)更多,转化效率略低(图2)。2a, B)。相比之下,9日龄幼苗的毛状根总数和转基因阳性根数量最少(图2)。2c, B)。因此,后续试验均采用7天龄的幼苗接种。
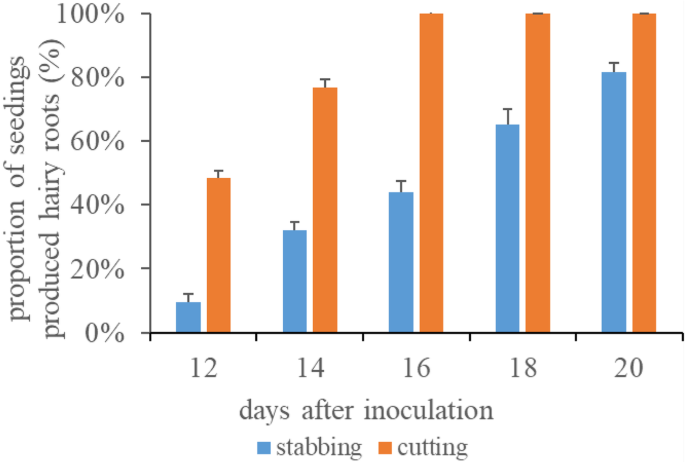
在此之前,广泛采用刺刺幼苗下胚轴的ARM转化两步生成复合大豆植株[11]。比较了一步法和两步法的变换效率。接种后16天(dpi),采用一步法,30株幼苗100%产生毛状根(图2)。3.).与传统的刺入下胚轴的两步方法不同[11],只有47%的幼苗在16 dpi时产生毛状根,而在20 dpi时达到80%(图2)。3.).在一步法和两步法中,诱导毛状根总数在20 dpi时达到最大值(数据未显示)。
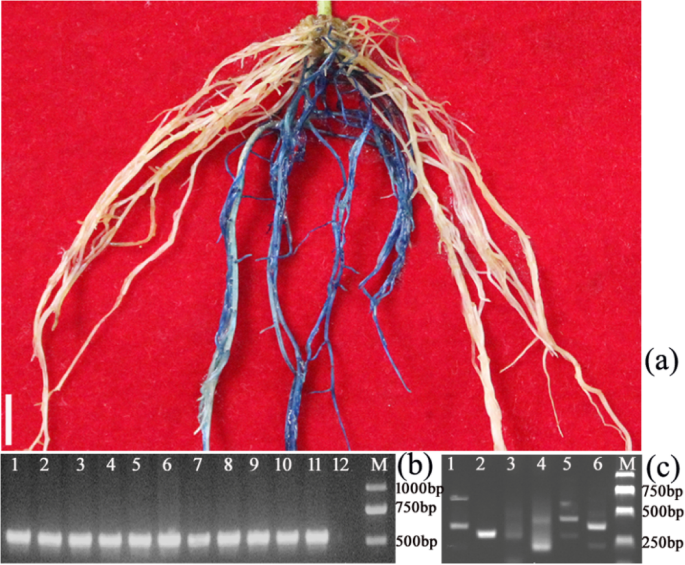
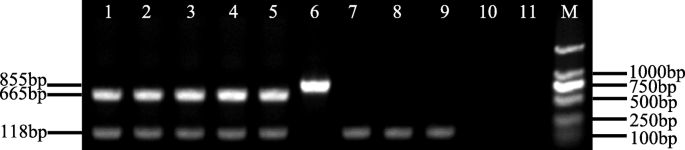
为了确定诱导的毛状根是否转基因,我们对每个独立毛状根进行了GUS (β-葡萄糖醛酸酶)染色和PCR分析。结果显示pcr阳性根与gus阳性根一致(图2)。4a - b)。为了进一步确认外源DNA及其整合位点在基因组中的整合,TAIL-PCR [24完成。结果表明,外源DNA在独立转基因毛状根的不同位点插入大豆基因组(图2)。4c,年代1).此外,RT-PCR分析表明,外源DNA在转基因毛状根中被转录(图2)。5).
在一步转化法中,每根幼苗都能产生转基因阳性根,其中转化效率(定义为至少产生一个转基因根的被试植株芽的百分比[16])在16 dpi时为100%(表1).16 dpi时毛状根数为5.80±1.40根,转基因阳性根数为3.10±0.96根,20 dpi时毛状根数为12.4±3.8根,转基因阳性根数为6.5±2.7根(表2)1).相比之下,在两步法中,在16 dpi时转换效率仅为40%;每株幼苗毛状根数和阳性根数在16 dpi时分别为1.43±1.72根和0.77±0.97根,在20 dpi时分别增加到5.6±1.8根和1.8±1.2根(表2)1).与两步法相比,我们的一步法在每株16 dpi时获得了4倍的转基因毛状根(3.1 vs 0.77,表1).综上所述,一步法获得的复合植株毛状根总数和转基因阳性根数均高于两步法。即使在16 dpi时,两种转化方法的转化频率(转基因根占总根的比例)相似(表2)1),在20 dpi时,一步法的转化频率高于两步法(表1)。一步法诱导毛状根的生长速度快于两步法(表S)1).此外,一步法可适用于不同基因型的大豆,但不同基因型之间的转化效率存在一定差异(表1)2).
采用一步ARM转化法分析大豆与根瘤菌的相互作用
豆科植物,包括大豆,可以与根瘤菌建立共生关系[25]。豆科植物与根瘤菌的相互作用是高度特异性的,因此一种特定基因型的大豆只能与一组有限的根瘤菌株结瘤。例如,大豆基因型Williams 82对根瘤菌菌株具有抗性美国frediiUSDA193 (Nod-)和基因Rfg1在大豆中负责结瘤限制。如果失去功能突变Rfg1在Williams 82中,接种了USDA193的转基因毛状根形成了成熟的固氮根瘤[21]。
为了评估一步法的可靠性,我们采用一步法引入了靶向的CRISPR/Cas9载体Rfg1在威廉姆斯1982年(点头)。与之前的报道一致,成熟的固氮根瘤在转化的毛状根上形成,而在接种了菌株的野生型根上没有形成美国frediiUSDA193(图52).转基因结节经PCR分析和测序证实(图S)3.).因此,我们的一步转化方法是可靠的,并通过大豆-根瘤菌互作分析得到了验证。
一步ARM转化方法在启动子功能分析及其他植物物种中的应用
为了检验毛状根是否适合研究基因启动子活性,我们采用一步走法生产了转基因大豆毛状根GUSPlus基因由姚启动子的拟南芥[22]。整个变形的pYAO::GUSPlus根系表现出GUS信号,根尖表现出高水平的活性(图2)。6).这一结果与姚在拟南芥[22]。因此,我们证明了拟南芥么该基因在大豆根系中保守表达。
我们还测试了一步法是否可以应用于其他植物物种。复合番茄植株已经成功生成(图S)4).转换效率和转换频率分别为86.7%和38.1%。
讨论
一步ARM转化法是一种更快、更简单、更高效、污染风险更低的大豆复合植株生成方法
到目前为止,ARM毛状根转化已经在多个植物类群中建立,覆盖了100多个物种[11,13,23,26,27,28]。复合植物的发展是候选基因功能分析的一个重要里程碑[19,29,30.,31]。然而,对于复合植株的生成,一步ARM转化方法仅在鹰嘴豆中有报道[32]。鹰嘴豆采用25-30日龄植株顶端茎段进行细菌培养接种,15 dpi后出现毛状根[32]。鹰嘴豆毛状根的形成需要40-45天。本研究采用7日龄大豆幼苗接种。所有感染的外植体在16 dpi时均产生毛状根,毛状根长度为24.27±8.76 cm(图2)。3.表51).播后大豆毛状根的诱导时间仅为23 d。相比之下,在传统的大豆两步ARM转化中,只有47%的大豆幼苗产生毛状根,16 dpi时毛状根为0.53±0.29 cm(图2)。3.表51).因此,我们的一步协议需要更短的转换时间。
在大豆两步转化法中,用含有一个。rhizogenes(HGCI)诱导毛状根[11,23]。毛状根产生后,需剪除原根,复合植株移栽到另一个用无菌蛭石的新盆中[11,23]。在我们的一步转化方案中,复合植株可以在接种后直接在无菌蛭石中生长。复合植株从接种后到生长均在同一锅中完成。两步法操作次数多,步骤多,在分析植物与微生物相互作用的实验中污染风险较高。因此,我们的一步转换协议可以降低污染风险。
采用一步法实现了更高的转换效率。在两步法中,只有80%的幼苗产生毛状根,在20 dpi时转化效率仅为66.7%(表2)1).而在我们的一步法中,所有感染的幼苗都产生了毛状根,转化效率为100%(表1)1).值得注意的是,每株复合植株毛状根总数和转基因阳性根数均高于两步法(表2)1).转化效率高的原因可能是表面积较大的下胚轴的斜切增加了转化的可能性一个。根的生长感染。此外,我们的一步法比两步法的毛状根出现时间更早,生长速度更快(表S)1);可能的原因是,“一步法”中的毛状根生长在深色土壤中,吸收了更多的矿物质营养和水分。此外,诱导的毛状根可以在不受原根抑制的情况下快速生长。
迄今为止,在传统的两步ARM转化方法中,除了刺扎下胚轴获得复合大豆植株外,还有两篇论文报道了体外(或in -vitro) ARM转化方法[14,16]。然而,在体外(或in -vitro)转化方法中,毛状根是在Fibrgro®立方体或岩棉上诱导的[14,16]。将毛茸茸的根从培养基中分离出来是乏味、费力和耗时的。此外,这个过程可能会导致一些诱导毛状根和/或根毛断裂或损坏。在植物与微生物相互作用的研究中,它也会增加污染的风险。相比之下,我们的一步协议避免了将根从介质中分离出来的繁琐工作。
在一步法和两步法中,从复合植物中产生的毛状根并不是100%是转基因的。与转基因阳性根相比,非转基因根不需要切断,可以对野生型表型起到阴性控制作用。基于我们的结果和之前的讨论,我们的一步转换协议是一种特别优化的方法,可以用于解析候选基因功能的根-微生物相互作用,如共生相互作用,包括根瘤菌豆科植物的共生关系,如大豆、豌豆和黄豆Medicago truncatula以及植物和线虫的相互作用。
一步ARM变换方法在研究启动子功能和其他物种中的适用性
ARM毛状根转化已被用于各种目的,如植物与微生物的相互作用(根瘤菌、丛枝菌根真菌、病原体等),涉及植物激素、rna和蛋白质的根-芽通讯,以及植物与环境的相互作用(生物/非生物胁迫)[11,23,26,27,28,33]。在本研究中,我们采用新的一步法来分析拟南芥么大豆根部的启动子。结果表明拟南芥么保存在大豆根部[22]。
除了在大豆上的实验外,我们还测试了一步转化方法是否可以应用于其他植物物种。复合番茄植株已经成功生成(图S)4).这些结果表明,新方法可以应用于其他植物物种。对于给定的植物物种,需要筛选相容且高效的一个。根的生长应变因共转化效率不同而不同一个。根的生长压力(34]。
一些关键步骤影响着一步ARM变换方法的变换效率
要实现高转化效率,需要注意几个关键步骤。苗龄是提高转化效率的重要因素。我们建议使用7天大的健康幼苗,发育不良的幼苗应丢弃。幼苗应在水里斜切一个。rhizogenes(HGCI)使用锋利的手术刀。斜切可以增加细菌感染的表面积。一个。rhizogenes应该是新鲜培养的,健康的。在毛状根诱导过程中,需要保持较高的湿度,接种的幼苗不需要浇水。毛状根产生后,在16 dpi后,通过去除透明盖或塑料袋(打开通风口或在盖或袋上打一些孔)来缓慢降低湿度,使复合植物很好地适应环境。
结论
建立了一种更快、更简单、更高效、污染风险更低的大豆一步ARM转化新方法,是研究大豆与根瘤菌相互作用的最佳方案。预计该方法将广泛应用于番茄和大豆等植物根系相关事件的分析。
方法
植物材料和生长条件
大豆种子经70%乙醇处理3分钟表面灭菌,用无菌水冲洗5次,种植于1-2 cm (0.25× Gamborg B-5基础培养基)的无菌湿蛭石(11.6 cm × 8 cm × 9.5 cm)花盆中。在温室中以80 μmol m的浓度培养植株−2年代−1在24-26°C,相对湿度约为70%的条件下,光照16 h /黑暗8 h。中国农业科学院作物科学研究所作物基因资源与遗传改良国家重点项目(NFCIR)提供了基因型为Williams 82、金斗17、中黄39、祥丰4、禾斗19、PI377578和北京的大豆种子。
CRISPR/Cas9靶向构建物的构建Rfg1基因和姚启动子:GUSPlus向量和答:rhizogenes应变
CRISPR / Cas9-mediatedRfg1基因敲除载体按照前面的描述构建,并进行如下修改[21]。格斯由CaMV 35S启动子驱动的报告基因取代了一对二世(潮霉素磷酸转移酶ⅱ),可用于从复合植物中选择转基因阳性根。一个目标位点被设计用来敲除Rfg1。CRISPR/Cas9构建体命名为pGSE401-KtRfg1(图5)5一个)。姚启动子序列经PCR扩增拟南芥(ecotype Col-0)基因组DNA使用引物YAOF18带aKpnI酶切位点和YAO19R带an以区域I限制位点。用限制性内切酶酶切的PCR产物Kpn我和以区域我被克隆到pCAMBIA1305载体,其中放置姚启动子来驱动转录GUSPlus。pYAO::的二进制向量GUSPlus被称为pYGUS1305。所有构建均通过测序进行验证。所有构造和序列的映射如图5所示5。二值向量pGSE401-KtRfg1(图5)5a), pCAMBIA1305(图S5b)和pYGUS1305(图S5C)被引入答:rhizogenes菌株K599 [34,35]。K599菌株按前面描述的方法培养[35]。接种培养基选用0.25× Gamborg B-5基础培养基,将培养在平板上的新鲜培养K599菌(HGCI)重新悬浮至OD600≈0.6-1.0。Gamborg B-5基础培养基以粉末形式从Phyto Technology实验室(Shawnee Mission, Kansas)购买。本文所用引物的核苷酸序列如表5所示2。
一步法ARM毛状根转化及复合大豆植株的生成
在切割下胚轴的一步方案中,使用一对无菌剪刀从7天龄的健康幼苗中切除原根,这些幼苗具有未展开的真叶。用无菌手术刀在接种培养基中斜切0.7 ~ 1 cm的下胚轴顶端(切0.5 cm)。将剩余的部分下胚轴斜切刮在K599-HGCI培养板上,然后用完全湿润的无菌蛭石直接种植到花盆中,使用前用蒸压蒸馏水浇灌。然后每株幼苗接种~ 5 ml接种培养基。下胚轴切割后接种K559-HGCI感染后,保持幼苗生长环境的高湿(用无菌塑料袋覆盖)(关键步骤如图所示)。1a e)。在接下来的两周内,接种的幼苗不需要浇水。2周后,毛状根发育。通过在透明无菌塑料袋上打通风口,在2天内逐渐降低湿度。之后,袋子被取出。定期检查植株是否保持水分(0.25× Gamborg B-5)和湿度。刺入下胚轴的两步转化方法如前所述[11]。
根瘤菌生长条件及结瘤试验
美国fredii按照Fan等的方法进行USDA193培养和结瘤试验。[21]。每棵16 dpi的幼苗用水接种培养的根瘤菌。无菌无氮营养液[11是用来浇花的。
GUS组织化学染色,DNA提取,PCR(聚合酶链反应),TAIL-PCR(热不对称交错PCR)分析
有一个GUSPluspCAMBIA1305.1基因(图S5b)因此,进行GUS活性测定。GUS活性定性分析的组织化学染色方法如下[36稍加修改。将转化后的毛状根用1 mM铁氰化钾和1 mM亚铁氰化钾代替8 mM巯基乙醇浸泡在GUS染色液中,37℃浸泡2-10 h。染色样品在70%乙醇中冲洗10-20分钟。为了进一步鉴定转基因和非转基因根,还进行了PCR扩增GUSPlus。目的:确定CRISPR/ cas9介导的基因序列Rfg1提取结核的基因组DNA,进行PCR扩增和DNA测序。为了进行PCR分析,按照前面的方法从叶片或根瘤中分离基因组DNA [37]。按照先前公布的方法进行PCR扩增[38]。对于CRISPR/ cas9介导的基因破坏,PCR产物通过DNA测序验证了目标基因破坏。PCR产物进行Sanger测序。按照Tan等的方法进行TAIL-PCR [24],并作以下修改。利用LAD1-1、LAD1-2、LAD1-3和LAD1-4组合引物和SPNos1对转基因毛状根进行预扩增。然后用巢式特异引物SPNos2和AC进行一次TAIL-PCR。将二次TAIL-PCR产物稀释500倍,作为模板,用巢式引物SPNos3和AC进行第三次扩增。预计从二级和三级TAIL-PCR得到的PCR产物的大小差异为111 bp。引物SPNos1、SPNos2和SPNos3是pCAMBIA1305二进制矢量所特有的号与T-DNA RB相邻的终止序列。
rt - pcr分析
RT-PCR检测GUSPlus。由于扩增片段覆盖了内含子区域,因此PCR和RT-PCR产物的大小不同(分别为855 bp和665 bp)GUSPlus。总RNA被分离,poly (A)±从总RNA中纯化mRNA,合成第一链cDNA,按照前面的描述进行RT-PCR扩增[38],并作以下修改。在反应混合物中进行RT-PCR反应,扩增转录本GmActin和GUSPlus。反应条件:96℃下3 min;30个循环(95°C 30 s, 56°C 45 s, 72°C 1 min);在72°C下5分钟。大豆Gmactin基因作为内源对照(118 bp产物)。基因特异性引物对RTGusF和RTGusRGUSPlus基因,引物GmActinF和GmActinR为Gmactin基因被使用。
根长度分析
使用爱普生(中国)有限公司的EPSON V700扫描仪对各处理的根系进行扫描,并使用WinRHIZO PRO 2012根系分析系统(Regent Instruments Inc., Quebec, Canada)对根系形态指标进行分析。
统计分析
每个实验30株为生物重复,重复2次。采用Excel和DPS统计软件对数据进行分析。每个值代表三个独立实验的平均值,具有标准差(SD)。图中a, b后面跟着不同的字母表示LSD检验在5%显著水平上的显著性差异。2B。
数据和材料的可用性
本研究产生或分析的数据包含在本文及其补充信息文件中。支持本研究结果的其他材料可应要求从通讯作者处获得。
缩写
- 臂:
-
农杆菌属rhizogenes介导的
- GWAS:
-
全基因组关联研究
- CRISPR / Cas9:
-
聚集规则间隔的短回文重复序列与Cas9相关
- HGCI:
-
拥有感兴趣的基因结构
- 规律:
-
不定的侧根
- dpi:
-
天post-inoculation
- 格斯:
-
β-葡萄糖醛酸酶
- 聚合酶链反应:
-
聚合酶链反应
- 一对二世:
-
(潮霉素磷酸转移酶ⅱ)
- TAIL-PCR:
-
热不对称交错PCR
- rt - pcr:
-
逆转录酶聚合酶链反应
- k599 - 1305:
-
携带pCAMBIA1305载体的k599
参考文献
林松涛,莫奇达。大豆在逆境条件下生产力提高的功能基因组学研究。函数积分基因组。2010;10(4):447-62。
张凯,刘生,李伟,刘生,李旭,方勇,等。利用多位点全基因组关联研究鉴定控制大豆种子蛋白含量的QTNs。植物科学,2018;9(9):1690。
Soystats。http://soystats.com。2019年5月8日获取。
林海明,徐翔,刘翔,陈伟,杨刚,王福林,等。对31个野生和栽培大豆基因组的重测序鉴定了遗传多样性和选择模式。物理学报,2010;42(12):1053-9。
李建军,李建军,李建军,等。古多倍体大豆基因组序列。自然。2010;463(7278):178 - 83。
沙安,李超,闫霞,单忠,周霞,姜敏,等。大豆种子不同发育阶段标准化cDNA文库的大规模测序及基于ESTs的基因表达谱分析中华生物医学杂志,2012;39(3):2867-74。
梅泽涛,樱井涛,田东木,丰田一,石田一,等。测序和分析来自全长富集cDNA文库的约40,000个大豆cDNA克隆。生物医学进展,2008;15(6):333-46。
张辉,李丽娟,张丽娟。大豆种质资源中抗病位点的全基因组关联分析。植物病理学。2016;106(10):1139 - 51。
db。http://www.ncbi.nlm.nih.gov/dbEST/index.html。2019年5月8日获取。
李松,丛勇,刘勇,王涛,帅强,陈宁,等。优化农杆菌属-介导的大豆转化。植物科学,2017;8:246。
李德华,李德华,金科马,等。农杆菌属rhizogenes-介导的大豆转化研究根系生物学。地理学报,2007;2(4):948-52。
刘建军,刘建军,刘建军,刘建军,等。快速、高效、可复制的基因转化菜豆spp。通过农杆菌属rhizogenes。地理学报,2007;2(7):1819-24。
Plasencia A, Soler M, Dupas A, Ladouce N, Silva-Martins G, Martinez Y,等。桉树毛状根,一个快速,高效和通用的工具,以探索功能和表达参与木材形成的基因。植物学报,2016;14(6):1381-93。
Ho Plágaro T, Huertas R, Tamayo Navarrete M, Ocampo J, García GJ。一种改进的农杆菌属rhizogenes适用于番茄介导转化的研究丛枝菌根共生关系。植物学报,2018;14(1):34。
Ilina E, Logachov A, Laplaze L, Demchenko N, Pawlowski K, Demchenko K.转基因南瓜复合植株根系发育的研究。安Bot-London。2012, 110(2): 479 - 89。
李建军,李建军,李建军,李建军。例体外复合植物:一种廉价、快速的根系生物学研究方法。植物学报,2005;43(3):449 - 457。
潘建平,姚德。影响生产效率的因素根瘤菌rhizogenes根寄生植物的根转化Triphysaria杂色的它的宿主拟南芥。植物学报,2018;14(1):61。
Clemow S, Clairmont L, Madsen L, Guinel F.豌豆毛状根再生转化和点接种方法的根系共生研究。植物学报,2011;7(1):46。
李建军,李建军,李建军,李建军,李建军。农杆菌属rhizogenes的转化根Medicago truncatula用于固氮和内生菌根共生关系的研究。植物微生物学报。2001;14(4):695 - 700。
杜德娜,夏鹏杰。基因组编辑。CRISPR-Cas9基因工程的新前沿。科学。2014;346(6213):1258096。
范勇,刘军,吕生,王强,杨生,朱华Rfg1基因限制结瘤Sinorhizobium frediiUSDA193。植物科学,2017;8:1548。
李红,刘宁,石丹,刘军,杨伟。YAO是一种对植物胚胎发生和配子体发生至关重要的核仁wd40重复蛋白拟南芥。植物学报,2010;10(10):693。
曹东,侯伟,宋松,孙华,吴超,高勇,等。评估影响环境的条件农杆菌属rhizogenes介导的大豆转化。植物学报,2009;96(1):45-52。
谭建军,龚强,于思忠,侯玉坤,曾立东,朱清林,等。一种改进的高效热不对称交错PCR扩增长未知侧翼序列的方法。[J]中国生物医学工程学报,2019;46(6):336 - 336。
杨松,唐峰,高敏,Krishnanc H,朱红荣。豆科植物与根瘤菌共生的寄主特异性基因调控。中国科学:自然科学学报,2010;37(3):18735-40。
利用i介导转化生产转基因植物。中国生物医学工程学报,2001;37(6):687-700。
杨建军,杨建军,李建军,等。植物根系遗传转化研究进展。生物技术进展,2012;30(10):528-37。
刘建军,刘建军,刘建军,等。毛状根研究进展与展望。植物学报,2006;9(3):341 - 346。
Aggarwal P, Nag P, Choudhary P, Chakraborty N, Chakraborty S.基因型无关农杆菌属rhizogenes鹰嘴豆-介导的根转化:一种快速有效的反向遗传学研究方法。植物学报,2018;14(1):55。
李建军,李建军,李建军,等。毛状根的根瘤转基因研究进展。植物学报,1989;8(1):12-5。
李建军,李建军,李建军,等。复合材料植物的遗传育种农杆菌属rhizogenes。方法:中华医学杂志。2006;34(3):155 - 67。
杨建军,张建军,张建军,等。鹰嘴豆根瘤发育研究工具箱:毛根转化方案和高效实验室菌株Mesorhizobium sp。植物微生物学报,2019。https://doi.org/10.1101/362947。
孟东,杨强,董斌,宋忠,牛磊,王磊,等。鸽豆高效根转基因体系的建立及其在其他重要经济植物上的应用。植物学报。2019;17(9):1804-13。
Mankin SL, Hill DS, Olhoft PM, Toren E, Wenck AR, Nea L.农杆菌属rhizogenes菌株K599 (NCPPB2659)质粒pRi2659。植物学报,2007;43(6):521-35。
范玉玲,徐福林,周洪辉,刘祥祥,杨学勇,翁克祥,等。一种快速、简单、高效、一步培育黄瓜转基因根复合植株的方法农杆菌属rhizogenes介导的转换。植物学报。2020;141:207-16。
高燕,昝小玲,吴晓峰,姚磊,陈玉玲,贾文生,等。酵母启动子中真菌反应性顺式元件的鉴定芸苔属植物juncea几丁质酶基因BjCHI1。植物科学,2014;22(4):391 - 391。
mcouch S, Kochert G, Yu Z, Wang Z, Khush S, Coffman W,等。水稻染色体的分子定位。理论与应用。1988;76(6):815-29。
Lü S,樊颖,刘玲,刘森,张伟,孟哲TrPI,一个Taihangia rupestris(蔷薇科)π同源,引起植物结构的变化拟南芥。植物生理学报,2010;32(6):1145 - 1145。
致谢
我们感谢韩天富教授和侯文生教授(中国农业科学院)为我们提供的一个。根的生长K599菌株,邱丽娟教授(中国农业科学院)提供大豆种子,刘国富(中国聊城大学)提供拟南芥Col-0种子。
资金
项目资助:国家自然科学基金(no. 1);山东省自然科学基金项目(31271751);ZR2012CL16和ZR2010CQ025)和张星辉本科生创新项目(项目编号:ZR2012CL16和ZR2010CQ025);CXCY2018033)。资助机构没有参与研究的设计和数据的收集、分析和解释,也没有参与论文的撰写。
作者信息
从属关系
贡献
YF和SL设计实验并撰写论文。YF, XZ, LZ, XW和LJ进行工作和数据分析。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:图S1。
通过TAIL-PCR产物测序确定大豆基因组中的T-DNA插入位点。对三种不同的独立转基因毛状根(分别在A、B和C中)的TAIL-PCR产物进行测序分析(指出部分序列)。Chr 13(图A), Chr 20(图B), Chr 2(图C)表示染色体数目。灰色填充三角形表示T-DNA插入,数字表示插入位点的位置。绿色高亮字母表示pCAMBIA1305.1右侧边界的T-DNA序列。黄色高亮字母表示T-DNA插入的基因组侧翼序列。
附加文件2:图S2。
CRISPR/ cas9介导的Rfg1在威廉姆斯82(点头)。转基因根上形成的成熟固氮根瘤(箭头所示)
附加文件3:图S3。
CRISPR/ cas9介导的基因敲除Rfg1威廉姆斯82(点头)的背景。在Williams 82野生型背景及其侧翼序列中有一个靶向敲除位点(黑箱中表示)。原间隔邻近基序(PAM)为“TGG”(a)。转基因根瘤DNA的测序分析显示,导致了两个突变等位基因,一个缺失152 bp (b),另一个缺失70 bp (c)。
附加文件4:图S4。
利用ARM转化一步生成转基因根番茄复合植株。含有CaMV35S启动子驱动的GUS报告基因pCAMBIA1305的K599转化番茄毛状根的组织化学分析番茄(茄属植物lycopersicum)种子采用毛粉802。
附加文件5:图S5。
二进制向量的映射和序列。pGSE401-KtRfg1vector。目标地点以红色背景突出显示(a);pCAMBIA1305载体(b);pYGUS1305 (c)。
附加文件6:图S6。
原始印迹如图2所示。4b。
附加文件7:图S7。
原始印迹如图2所示。4c。
附加文件8:图S8。
原始印迹如图2所示。5。
附加文件9:表S1。
一步法和两步法生产毛状根的比较。
附加文件10:表S2。
本文所使用的引物序列。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
范伊尔,张晓华。,钟,Lj。et al。转基因大豆复合植株一步代研究农杆菌属rhizogenes介导的转换。BMC Plant Biol20.208(2020)。https://doi.org/10.1186/s12870-020-02421-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02421-4
关键字
- 毛状根变换
- 农杆菌属rhizogenes
- 大豆(大豆(l)稳定)。
- 复合植物
- Rfg1
- 应变K599
- 姚启动子
- 番茄(茄属植物lycopersicum)
- Sinorhizobium frediiUSDA193