摘要
背景
作物耐盐性的研究大多是在一个生长阶段的短期胁迫条件下进行的。了解作物对长期盐胁迫的响应机制对提高作物的耐盐性具有重要意义。在本研究中,我们将六倍体小麦种子从萌发期到幼苗期暴露在LSS条件下30天。为了阐明四倍体小麦对LSS的适应策略,我们分析了叶绿体超微结构、叶片解剖、转录组分析、植物激素和有机兼容溶质浓度,并与对照植株进行了比较。
结果
转录组分析和生物化学分析表明,一般代谢维持和应力反应之间的能量分配可能对LSS下的allohexaploid小麦的存活至关重要。在LSS下,小麦似乎通过刺激脱离酸(ABA)途径和抑制叶中的赤霉素和茉莉酸途径来将能量从一般性维持到应力响应。我们进一步区分了任何基因三合会的A,B和D产地的表达状态,并调查了LSS对盐度耐受性三合会的物质表达偏差的影响。我们发现LSS对大多数盐度耐受性三合会的三个家庭表达具有类似的影响。然而,在一些三合会中,LSS对三个家业的表达产生了不同的影响。
结论
从一般维护到压力反应的能量转移对于小麦LSS耐受性可能是重要的。LSS影响盐度耐受性的家用表达偏差。
背景
六倍体普通小麦(Triticum Aestivum.L.,基因组BBAADD)通过两次异源多倍体化事件产生。第一个这样的事件导致异源四倍体小麦的形成(小麦属植物turgidum,基因组BBAA) 36 - 50万年前[1那2那3.].大约8500年前,第二次异源多倍体事件(六倍体化)产生了六倍体小麦。第二次六倍体化发生在一个驯化的异源四倍体小麦(基因组BBAA)和一个二倍体物种之间的杂交Aegilops Tauschii.(基因组DD)和随后的染色体加倍[1那2那3.].BBAA和DD基因组在四倍六倍体小麦细胞中共存和相互作用仅8500年,在此期间同源基因的广泛表达和功能分配以及染色体结构的改变都发生了[4.那5.那6.].由于DD和BBAA基因组之间的相互作用,多重和复杂的BBAADD基因组赋予了六倍体小麦增加的生理和生态可塑性,这有助于其对不同胁迫条件的显著耐受性[1那7.那8.那9.].小麦的耐盐性在六倍体化后立即增强,六倍体表现出比四倍体更强的耐盐性,T. Turgidum.[8.那10].目前尚不清楚盐胁迫是否会改变一个基因三联体中A、B和D同源基因的表达模式,以及同源基因表达模式的改变是否与四倍六倍体小麦的盐胁迫反应有关。
研究盐度耐受的最终目的是提高作物植物中盐度耐受性以及随后利用广泛的盐渍土地。不幸的是,大多数作物盐度耐受的研究在单一生长阶段的短期应激状况下在温室下进行。如果农作物植物在自然盐水耕地种植,则作物植物的生长将在不同的生长和发展阶段进行整个生命周期的土壤盐度应力。因此,对对长期盐度应力(LSS)的作物反应机制有助于作物盐度耐受性改善。据我们所知,植物响应盐度应力的机制已经利用短期盐度应力系统在很大程度上研究,而LSS条件很少用于研究盐度耐受性[11那12那13].低盐胁迫对植物代谢和发育的影响可能比短期盐胁迫更为复杂。植物对LSS的响应可能是一个更为复杂的过程,涉及几乎所有发生在不同层次的代谢过程,包括分子、亚细胞、细胞、组织和全植物水平,并跨越不同的生长阶段。据我们所知,作物植物对LSS的协调响应知之甚少。因此,我们对四倍六倍体小麦种子从萌发期到幼苗期进行LSS处理30天。我们分析了叶绿体超微结构、叶片解剖、植物激素浓度、37种有机兼容溶质、两种无机离子,以及相对于对照的非胁迫植物的转录组分析。我们还试图将转录组反应与综合生理反应联系起来。本研究的目的是描述六倍体小麦植株在萌发和苗期对LSS的生理响应,鉴定LSS下小麦植株的关键响应基因,阐明LSS对同源基因表达模式的影响。并阐明LSS的基因表达和生理适应策略。
结果
解剖学和溶质
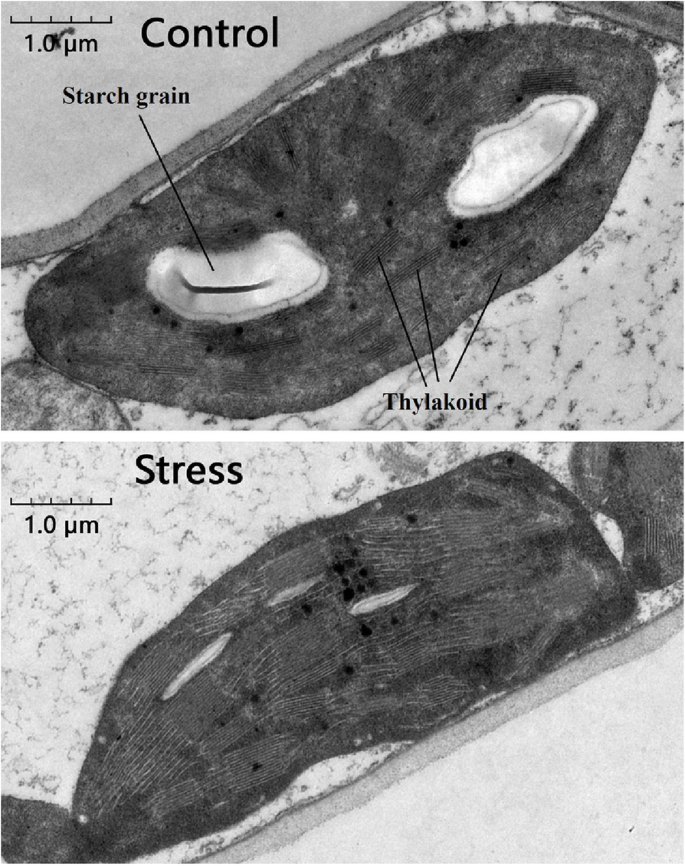
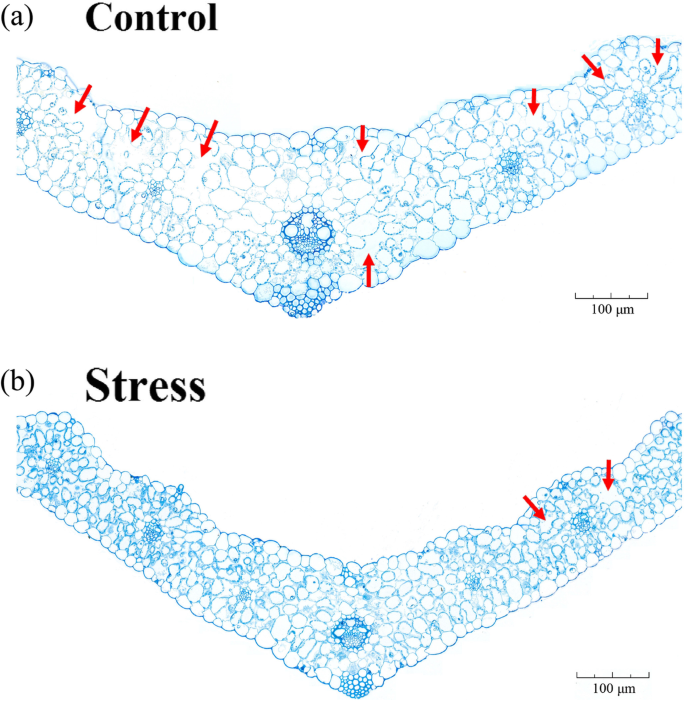
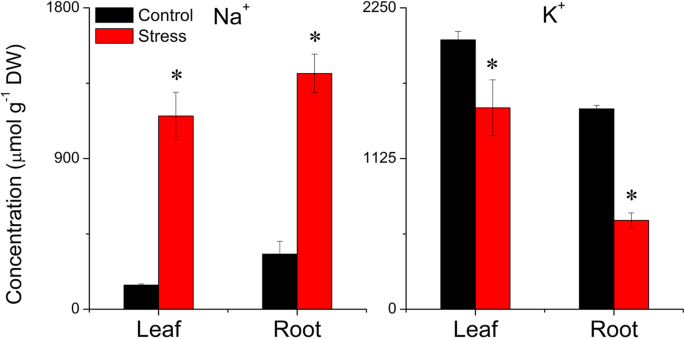
我们比较了盐胁迫和对照小麦叶片的解剖结构和叶绿体的超微结构。我们发现,受胁迫植株叶绿体中类囊体的堆积密度高于对照植株,淀粉粒在对照植株中更多、更大。1)。解剖学比较显示,对照植物具有比应力植物更大且较大的雾化(图。2)。LSS显著增加Na+浓缩并减少k+叶片和根部浓度(图。3.)。为了确定各溶质对渗透调节的贡献,我们计算了各溶质的摩尔浓度对总摩尔浓度的贡献百分比。与对照植物相比,受胁迫植物的变化为50%P被认为<0.05的值反映了显着的变化,浓度的丝氨酸,天冬酰胺,组氨酸和脯氨酸在LSS下的叶片中显着上调,而脯氨酸的浓度仅在强调植物的根部显着上调(附加文件2:表S1)。叶片中焦糖、乳糖和麦芽糖浓度显著升高,而根系中几乎所有碳水化合物浓度均升高。在胁迫叶片中,丙氨酸(10.15%)、脯氨酸(8.80%)、蔗糖(44.6%)和麦芽糖(9.69%)对总摩尔浓度的贡献远高于其他溶质,被认为是主要的相容渗透调节物质(附加文件)2:表S1)。在胁迫根系中,丙氨酸(12.79%)、葡萄糖(8.72%)、蔗糖(19.36%)和果糖(17.55%)对总摩尔浓度的贡献明显大于其他溶质2:表S1)。
植物激素
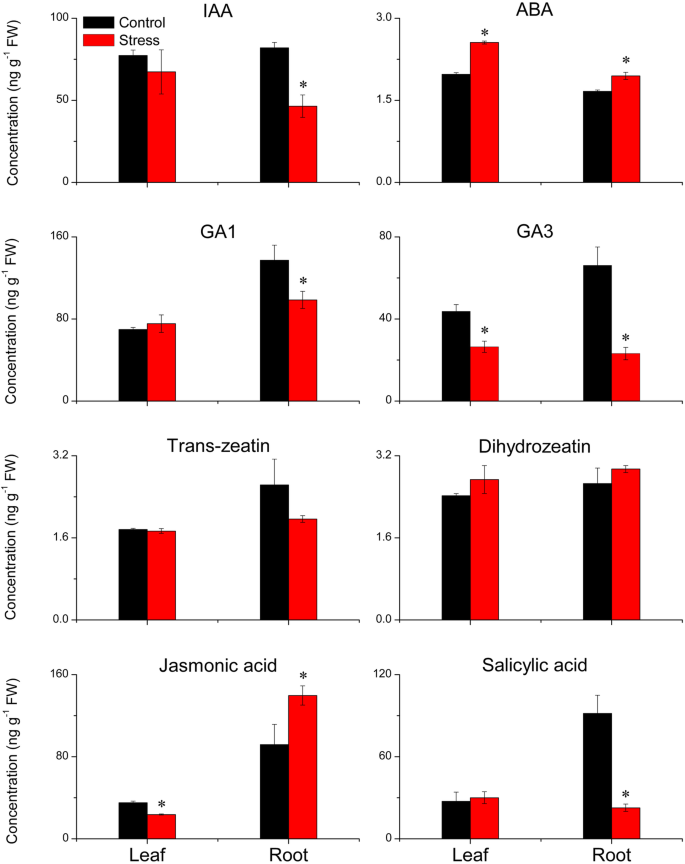
茉莉酸(JA)、二氢玉米素、trans-玉米素、脱落酸(ABA)、水杨酸(SA)、赤霉素A1 (GA1),吲哚-3-乙酸(IAA)和Gibberellin A3(GA3.)测定(图。4.)。LSS对二氢玉米苷和二氢玉米苷的浓度无显著影响trans-Zeatin,但显着增加了根部的JA浓度,并降低了叶片中的浓度。LSS增加了叶子中的ABA浓度,并增强了根部的浓度。lss减少了ga3.降低了IAA、GA的浓度1和SA在根中的含量,但对叶片中的浓度无显著影响(图。4.)。
转录组分析
在转录组分析中,9311基因(3741个上调的差异表达基因(DEG)和5570个下调的次数)和6572个基因(4896个上调的次数和1676个下调的次数)分别在根和叶中差异表达.我们经历了所有的舞台(调整了P值<0.05和| log2fold变化| ≥ 1) to KEGG enrichment (Additional file1:图S1-S2)。在30条途径(调整后)中,叶片DEGs显著富集P值< 0.05),根DEGs相对于13个途径富集(调整后)P值<0.05)。植物和叶子共同的四种富集的途径是植物激素信号转导,α-亚麻酸代谢,谷胱甘肽代谢和亚油酸代谢(附加文件1:图S1-S2)。在叶片中,几乎所有的DEGs在角质、木脂和蜡的生物合成、脂肪酸伸长、不饱和脂肪酸的生物合成、脂肪酸代谢和类黄酮的生物合成5个途径中都上调(Additional file)1:图S1)。
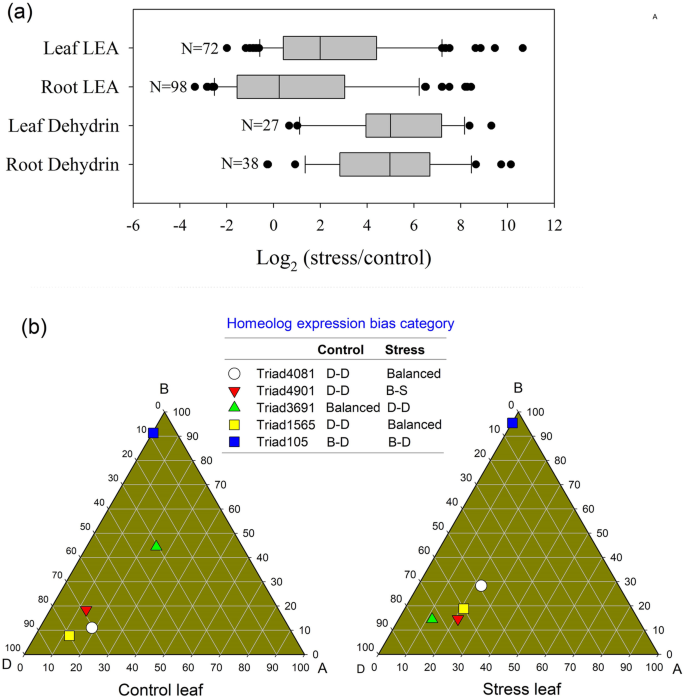
九ABF.大幅上调基因(ABA-associated转录因子)在回应LSS叶(表1)。两个GA-related德拉基因和十个ja相关jaz.基因在LSS下的小麦叶中高度调节(表1)。度(6远、6MAH1和7WSD1LSS下,与蜡质合成相关的基因在叶片中表达上调(附加文件)1:图S1和S3)。这TaHKT1; 5 d基因(TraesCS4D01G361300)在根中高度上调,而在叶中没有上调2:表S2)。四的表达式NHX.基因,四HKT基因,两H v形+腺苷三磷酸酶基因,一个钾通道SKOR基因和三个钾离子转运蛋白LSS作用下,根中基因表达显著上调。一个SOS1.基因在LSS下的根中也上调(附加文件2:表S2)。两个水通道蛋白TIP2; 3基因在叶片中显著上调,而在根中则无显著上调2:表S2)。此外,我们观察到69胚胎晚期丰富(lea)基因和39dehydrin基因在LSS下的根部或叶子中显着上调(附加文件2:表S2与图5.)。在LSS下,许多基因表现出超过300倍的上调,包括两个lea基因(TraesCS1B01G381400和TraesCS3B01G285100)dehydrin基因(Traescs6a01g350500,traescs6d01g332900,traescs5a01g369800和traescs6d01g333600)在根和四个lea基因(TraesCS2B01G313900、TraesCS2D01G295700、TraesCS7D01G026300、TraesCS2B01G232700)dehydrin在盐压力下的植物叶片中的基因(Traescs5b01g426800和traescs6b01g383800)(附加文件2:表S2与图5.)。KEGG富集分析表明,在对照和胁迫条件下,只有2个光合途径基因存在差异表达1:图S4)。图年代4.表明两种铁氧脱氧蛋白- nadp+还原酶(petH)基因在LSS下表达下调。这petH基因是产生NADPH的关键光合作用基因。
长期盐胁迫对同源基因相对表达的影响
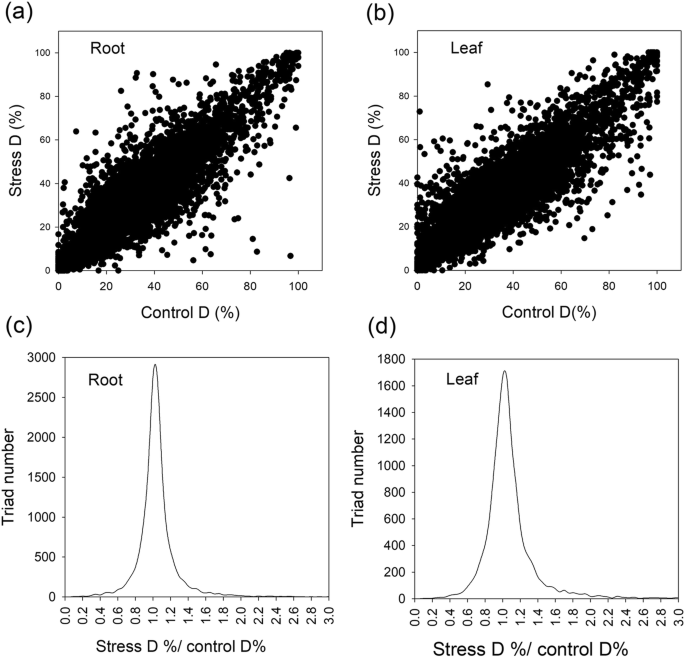
我们检测到16,438三元的表达(图。6.)。我们计算了一个给定三元组内三个同源基因的相对表达值(REV)。例如,我们计算给定三元组的D同源项REV (D%),使用下面的公式:D% = TPMD.* 100%/(TPM一种+ TPMB.+ TPMD.),其中TPM为给定三元组内各同源项的绝对TPM值。在这里,我们特别感兴趣的是在控制和压力条件下D%的变化(图。7.)。为了测试LSS如何影响D%,我们比较了控制和LSS条件下D%的差异(图。7.A-B)和绘制控制D%(X轴)和所有三合会的应力D%(Y轴)(图。7.A-B)。我们发现大多数数据点与对角线相关联,表明LSS对D Homeogog的相对表达的效果很小。我们还计算了所有三合会的对照D%和LSS D%的比率,并获得了比率的概率分布图(图。7.c - d)。当LSS对同源物相对表达的显著影响为变化≥20%(对照D%和LSS D%的比值)时,77%的根三联体和70%的叶三联体中,对照和LSS植株的D%差异< 20%(图)。7.c - d)。同样的,在23-32%的三元组中,LSS条件对a或B同源物的相对表达有显著影响(附加文件2:表S3)。占据,LSS对大多数三合会的家乡相对表达造成了小的影响。
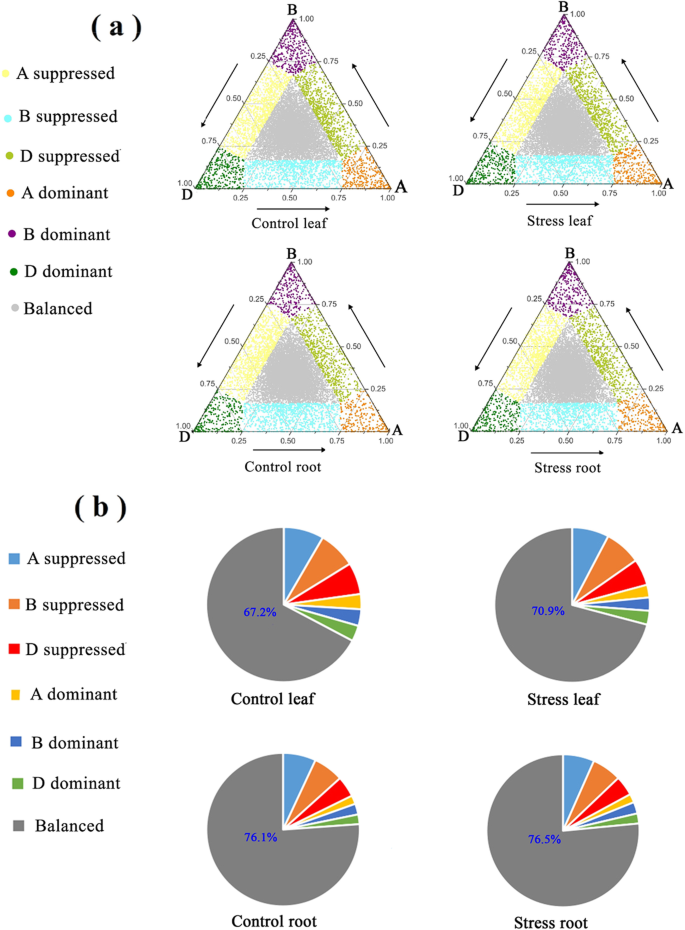
在每个三合会的家庭Revs的基础上,我们使用了Ramírez-gonzález等的方法。(2018)将所有三合一分配成七个职业表达式偏差类别(图。6.A和8.) (14].三角形的三个顶点(A,B和D)代表了相应物质的理想主导的表达。例如,在Triangle的顶点A表示的三合会中,B Homeolog和D Homeogoggog为这一三合会的三个家业的总表达进行了0%的贡献,它是一个100%的贡献。接近顶点的圆圈显示了优势的家庭表达。数字6.b显示“平衡”是HEBC的主导类别,占67-77%。“抑制”类(4.2-8.3%)所占百分比显著高于“主导”类(2.0-3.5%)。在两种情况下,“D”被抑制的百分比都小于“B”和“A”被抑制的百分比。最后,我们考虑LSS是否改变了检测到的所有三元组的HEBC(附加文件2:表S4)。在叶片中,17.4%的三联体表现出胁迫引起的HEBC变化,而在根中,只有11.0%的三联体表现出胁迫引起的HEBC变化2:表S4)。
耐盐三联体中同源基因对长期盐胁迫的表达响应
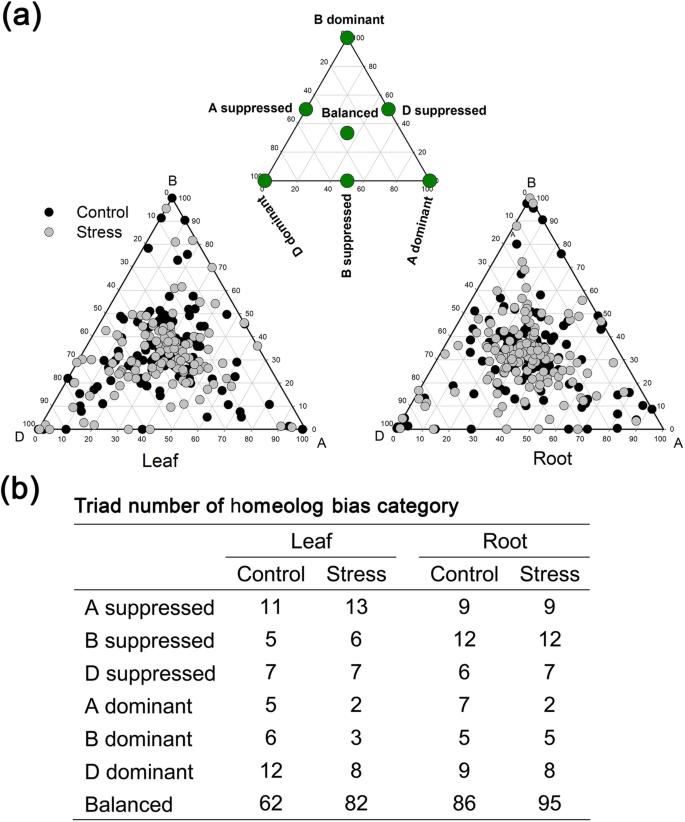
起初,我们考虑了耐盐基因三联体在LSS下同源基因绝对表达的变化。我们从DESeq2 R包生成的转录组分析中确定了同源物绝对表达的fold change (stress/control)值。直角坐标图是用x = A homeolog褶皱和y = D homeolog褶皱改变耐盐三合会,以及x = B homeolog褶皱变化和y = D homeolog褶皱变化,和x = A homeolog褶皱变化和y = B homeolog褶皱变化(附加文件1:图S5)。对于大多数耐盐三元组,A、B、D同源体的fold change值(stress/control)相似。然而,在几个耐盐三元组中,一个三元组内的不同同源性显示出不同的fold change值(附加文件)2:表S5和附加文件1:图S5-6)。在一些三合会,如lea(Triad1212)和lea(Triad5607), d同源物的折叠变化远远大于A-和b同源物(附加文件1:图S6和附加文件2:表S5)。在一些盐度耐受性三联社中,如lea(Triad14049),lea(Triad14050),lea(Triad10483),lea(三合一14474),和钾离子转运蛋白基因(Triad16538), b同源物的折叠变化远远大于a同源物和d同源物(附加文件1:图S6)。在lea(三合一14048),lea(Triad14050),lea(Triad10483),lea(三合一14474),和钾离子转运蛋白基因(Triad16538), a同源物比b同源物和d同源物表现出明显的折叠变化(附加文件1:图S6)。
接下来,我们基于同源物的转速重点研究了LSS对耐盐三元组HEBC的影响。我们发现,在LSS条件下,d -优势hebc的耐盐三联基数远远大于a -优势和b -优势hebc。在低盐胁迫下的根中,8个耐盐基因三联体表现出d -显性(图)。8.b),也就是三个lea基因,一个dehydrin基因,两钾离子转运蛋白基因和二水素蛋白基因(额外的文件2:表S5)。在低盐胁迫下的叶片中,8个耐盐基因三联体显示出d -显性(图1)。8.B),即五lea基因,一个dehydrin基因,两个钠/阳离子交换基因和一个水通道蛋白基因(附加文件2:表S5)。我们还比较了在控制和胁迫条件下耐盐三元组的HEBC,发现少数耐盐三元组的HEBC值被LSS改变(附加文件)2:表S5)。几个臭氧区的变化lea在三联图中揭示了叶片中的基因三联图(图2)。5.b)。结果表明,LSS条件将TRIAD4081和TRIAD1565的HEBC从D-D转移到平衡,从D-D到B-S的TRIAD901的STIAD901,以及D-D到B-S的TRIAD4901的STIAD4901的HEBC,而TRIAD105的Hebcs保持不变。
QRT-PCR验证
RNA- seq (RNA测序)结果通过qRT-PCR进行验证(附加文件)2:表S6)。结果表明,10个选择的基因中有8个在qRT-PCR和RNA-Seq之间的结果一致(附加文件2表S6),证实了RNA-Seq结果的可靠性。
讨论
渗透调节和组织耐受
在盐渍土壤中,植物利用各种性状和机制来保护自己免受盐分的伤害。其主要机制是渗透调节、活性氧(ROS)解毒和组织耐受。因为有机溶质的积累比钠的积累有更高的能量消耗+或Cl.−,在盐胁迫下,耐受性强的作物品种或盐生植物通常积累无机离子作为渗透调节剂[15那16].为了减轻这些离子的毒性,这些盐度耐受性植物将分居Na+或Cl.−在液泡中使其在细胞质中的浓度降低到低于毒性水平,并积累相容溶质和K+在细胞质中,平衡Na引起的渗透压+或Cl.−在液泡。对于成熟的叶或根细胞来说,由于细胞质只占细胞体积的很小一部分,细胞质中相对较少的有机溶质绝对含量就可以产生高的摩尔浓度来缓解液泡的渗透胁迫。我们的结果表明,在低盐胁迫下,氨基酸的浓度在叶中特别高,而在根中没有。相比之下,LSS下,根中碳水化合物浓度的增加比叶中更明显2:表S1)。丙氨酸、脯氨酸、麦芽糖和蔗糖是小麦叶片的优势亲和性溶质,而丙氨酸、果糖、葡萄糖和蔗糖是小麦根系的优势亲和性溶质。氨基酸和碳水化合物对叶细胞质渗透势的贡献相似,而碳水化合物对根细胞质渗透势的调节作用大于氨基酸。
常见的组织耐受机制是NA+-排斥策略HKT1两种作物中的基因和拟南芥[13那17那18].这TaHKT1; 5结果表明,该基因具有调节钠的功能+异六倍体小麦的排除[10那17].在本工作中,我们发现TaHKT1; 5基因(TraesCS4D01G361300)在LSS下的根中显著上调(附加文件2:表S2),结果与杨等人的发现一致。2014 [8.].此外,我们观察到在LSS下的根部中的许多其他临界盐度耐受基因的显着上调,例如四个NHX.基因,四HKT基因,两摘要+腺苷三磷酸酶基因,一个钾通道SKOR基因和三个钾离子转运蛋白基因(额外的文件2:表S2)。一个SOS1.基因在根中也上调(附加文件2:表S2)。我们认为,这些盐度耐受基因可能在LSS下的小麦根中的组织耐受和离子稳态中起重要作用。有趣的是,我们观察到两个水素TIP2; 3基因在叶子中明显上调,但不是根(附加文件2:表S2)。在拟南芥那PIP2; 1和PIP2; 2Aquaporins用作非选择性阳离子通道(NSCC),将所有阳离子运送到细胞中[19].在受胁迫的小麦叶片中,水通道蛋白TIP2; 3基因许多方便k+提高小麦耐盐性的细胞积累。
在渗透调节方面,我们观察到69胚胎晚期丰富(lea)基因和39dehydrin基因在根和叶中均显著上调。LEA蛋白和脱水蛋白被认为在渗透调节中起关键作用[20.那21那22那23].的数量lea和dehydrin小麦的基因比其他植物的基因要多得多。小麦至少有57个dehydrin基因和429lea而其他植物大约有15个基因dehydrin基因和100lea基因(22].共表达量非常高dehydrin和lea基因在LSS反应中应表现出剂量效应。渗透胁迫的另一个有趣的反应与通气组织和蜡的合成有关。小麦叶片的通气组织比对照少,这减少了水分流失的频率,但同时限制了光合作用的气体交换速率。在盐胁迫或干旱胁迫下,合成蜡并应用于叶片角质层以减少水分流失[24那25那26那27].在目前的工作中,关于蜡生物合成的显着富集叶中的上调的次数(附加档案1:图S1和S3)。此外,LSS下叶片中类黄酮生物合成基因大幅上调(附加文件)1图S1),黄酮类化合物可能在小麦对LSS反应过程中产生的ROS的解毒过程中发挥作用。
由植物激素介导的能量分区对于小麦盐度耐受性可能是重要的
光合作用产生的能量分布在三个主要的生物过程中:生物量积累、代谢过程的一般维持和对环境胁迫的响应[15那28那29].大部分能源被植物用于一般维护,只有一小部分(10-40%)被分配用于生物量积累[15].增加土壤盐度显着促进了能量从生物质积累转变为应力反应[15那28那29].例如,限制代谢和生长的一种策略是气孔闭合,由ABA信号通路介导,可以降低蒸腾流量和伴随NA+流入树叶。众所周知,植物根部吸收的水分只有1-5%被保留下来,其中95-99%被用于蒸腾。在盐胁迫下,蒸腾流将携带大量的钠+和Cl−,但大多数这些有毒离子需要被排除到根际溶液中,这将产生显著的能量成本[15那16].
ABA信号介导了气孔导度的降低,从而减少了水和有毒离子流入植物地上部分,从而降低了排除Na所需的能量消耗+和Cl−[15那16].本研究结果表明,LSS诱导了六倍体小麦叶片中ABA的积累。4.),与植物激素信号,特别是ABA, GA和JA相关的deg显著富集(附加文件1:图S1-S2)。我们观察到9个代表ABA信号系统最终功能的ABF (ABA响应元件结合因子)转录因子基因在LSS下显著上调(表)1)。ABF基因的上调不仅可以介导气孔关闭和限制生长,而且还可以上调启动子区域含有aba响应元件(ABRE)的盐度响应基因的表达[30.那31].LSS还能诱导JA和GA的减少3.浓度和上调三种德拉基因和10jaz.小麦叶子的基因(表1)。Della和Jaz分别抑制了赤霉素和茉莉酸介导的途径。根据这些激素表达数据,我们提出,在LSS下,小麦可能会通过增强ABA途径来将能量从一般性维持转变为应力响应,并抑制叶子中的气体和JA控制的途径。在这里,我们提出了Ga和Ja对Allohexaploid小麦的LSS响应产生了负面调节的假设,这可以通过气体和/或Ja的外源应用来测试,以及对露出过度表达或敲除的小麦线的分析德拉和jaz.基因。此外,我们观察到,压力小麦植物叶绿体中的囊体比对照小麦植物中的密度更高。我们还观察到两者的下调petH在光合光反应过程中产生NADPH的基因(图S4.)。在光合作用的光化学反应中起作用的蛋白质和色素嵌入在类囊体膜中。这些发生在类囊体上的光化学反应的最终产物是ATP和NADPH,它们用于碳固定反应以及一些盐度响应溶质的生物合成,如脂肪酸(蜡合成的底物)、氨基酸和甜菜碱(相容溶质)。高密度的类囊体可能弥补小麦在盐胁迫下的低表达petH基因和有利于ATP和NADPH的产生,以燃料盐胁迫反应。
长期盐度胁迫下同源基因的表达偏倚
多倍体产生的重复基因可能有三种进化命运:功能多样化(亚功能化或新功能化),基因沉默或丢失,或原始或类似功能的保留(剂量共享模型)[32].重复基因的功能多样化可能是多倍体物种在进化过程中成功的重要因素[32].然而,我们与Ramírez-González et al.(2018)和Xiao et al.(2020)的研究结果均表明,在不同应激条件下和不同组织中,大多数三元组HEBC平衡(三个同源基因表达水平相似)[14那23].在现有的天然小麦中,六倍体化产生的重复基因或同源基因大部分可能保留了其原始(亲本)功能。对于HEBC平衡的三元组,三个同源基因的表达总和可能是相加的,或与其二倍体或四倍体祖先的表达水平相似,甚至是越界的。三聚体的越位表达可能有助于小麦的高抗逆性的发展,因为植物对逆境的许多适应机制依赖于剂量效应。例如,植物耐盐性与LEA、DHN、HKT、AKT、SOS、H等关键耐盐蛋白的绝对丰度有关+- atp酶和NHX [11那12那13那22].
虽然大多数三元组显示出平衡的hebc,但我们仍然预期在不同应激条件下同源基因的表达和功能划分会在某些三元组中存在差异。不幸的是,同源基因的功能划分很难确定。然而,RNA-Seq实验可以很容易地分析同源基因的表达划分。在本研究中,我们主要研究同源基因对LSS的响应。在目前的研究中,只有大约30%的基因三合体在同源物的相对表达上表现出应激诱导的变化(附加文件)2:表S3),这与Dong and Adams的结果并不一致(2011)[33,其中超过70%的三联征在应激条件下表现出应激诱导的重复基因相对表达水平的变化。对于那些没有因胁迫而引起同源基因相对表达变化的小麦基因三元组,三个同源基因的表达可能受到共享的共同调控CIS-代理元素和trans在对LSS的反应中。
与一般三元组相似,大多数耐盐三元组也显示出平衡的hebc(图。8.b)在控制和LSS条件下。这些含有耐受性三元的三种家业的共表达可能在盐度应力反应中表现出剂量效应[23].有趣的是,一些耐盐三联征在hebc中显示出应激诱导的变化,甚至在许多关键的耐盐基因中,如dehydrin那lea那钠/阳离子交换器,水素蛋白基因。LSS引起的盐度耐受性三合会的HEBC变化更频繁于叶子(28.57%),而不是根(13.8%)。令人惊讶的是,对于一般三合会,叶片的百分比仅为17.7%(附加文件2:表S4)。这说明耐盐三联征的响应机制可能与一般三联征的响应机制不同。
结论
六倍体小麦对LSS的响应是一个在分子、细胞器、细胞、组织和全株水平上综合协调的过程。一般代谢的维持与胁迫反应之间的能量分配可能是四倍六倍体小麦在低盐胁迫下存活的关键。在低胁迫条件下,小麦叶片通过增强ABA途径和抑制GA和JA途径将能量从一般维持转向胁迫反应。此外,胁迫叶片叶绿体中类囊体密度的增加将产生更多的ATP和NADPH,为盐响应溶质的生物合成提供燃料。此外,LSS还影响耐盐三元组同源物的表达偏倚。
方法
植物生长与长期盐胁迫处理
本实验在东北师范大学实验园进行。小麦种子30粒(Triticum Aestivum.L.,基因组BBAADD, cv。每个塑料花盆里都装着洗净的沙子。本研究使用的中国春小麦种子由东北师范大学刘宝博士提供。将中国春播种子分别播种于10盆含半强霍格兰营养液的土壤中作为对照组,同时播种于10盆含胁迫处理液的土壤中作为胁迫处理组。以添加100 mM NaCl的半强度霍格兰营养液作为盐胁迫处理液。对照盆用半强霍格兰营养液浇灌,胁迫处理盆用胁迫处理液浇灌。胁迫处理从种子萌发期到幼苗期,持续30 d。试验时间为4月中旬至6月上旬,昼夜温度范围为18-25°C/ 15-20°C,日光周期为14-15 h。所有20个花盆都被放置在室外,有防雨设施。试验设计为随机完全区组设计。
叶片解剖、叶绿体超微结构和生化测定
收集成熟的叶子在同一叶子位置以用于叶绿体超微结构和叶形解剖学实验。使用Xiao等人的工作流程,由商业公司(ServiceBio)进行叶绿体超微结构和叶子解剖学实验。(2020)[23].我们收集了成熟的(功能)叶片在叶中位置和根样品进行生化测定。将10株植物汇集成一个生物重复,每个处理×组织组合包含3个生物重复。所有采集的样品进行冷冻干燥,用于生化分析。采用LC-MS-MS系统(API3200MD, AB SCIEX)测定冻干样品中游离氨基酸和碳水化合物的浓度,使用Zhao et al. (2017) [34].使用Xiao et al.(2020)的工作流,使用LC-MS-MS系统测定新鲜样品的植物激素浓度。[23].干燥样品在65%的HNO中消化3次3.在120°C,和他们的钠+和K.+用原子吸收分光光度计(TAS-990super, PERSEE,中国)测定。
RNA测序和qRT-PCR
我们收集30日龄小麦幼苗叶片中部成熟(功能)叶片和根系样本,进行qRT-PCR和RNA测序实验。每个处理选择相同叶位的成熟叶片进行进一步试验。将10株植物聚在一起代表一个生物重复,每个处理有3个生物重复。我们采用Xiao et al.(2020)的方法进行RNA测序和qRT-PCR实验[23].我们从国际小麦基因组测序联盟主页(http://www.wheatgenome.org)。我们将deg定义为具有调整过的P值≤0.05,|log2倍变化|≥1。采用调整后的超几何检验对DEGs进行KEGG富集P值(费舍尔测试)。随机选取10个耐盐基因进行qRT-PCR实验,验证RNA测序结果。基因特异性引物序列如表S6所示。肌动蛋白和扶轮领导学院(RLI)用作内部对照基因[35那36].计算基因的相对表达量△△Ct方法(37].
Ramírez-González et al.(2018)基于小麦参考基因组(iwgsc_refseqv1.0),鉴定出17,400个同序和1074个非同序三联体[14].每个基因三联体由一个A同源物、一个B同源物和一个D同源物组成。我们用TPM值来表示每个基因的绝对表达值[14].我们还使用Ramírez-González et al.(2018)的方法定义和计算每个三元组的同源词表达偏倚类别[14].
统计分析和实验设计
试验设计为完全随机区组设计,每个处理有3个生物重复。植物化学指标和qRT-PCR检测结果的统计学差异t -采用SPSS 16.0 (IBM)软件,在α0.05水平上进行检验。RNA-Seq数据用DESeq2 R包(1.20.0)进行统计学检验。
数据和材料的可用性
每种样品中约有10 GB的清洁数据用于进行RNA-SEQ实验。转录分析的所有原始数据都沉积在NCBI(登录号,SRR10177014,SRR10177013,SRR10177012,SRR10177011,SRR10177010,SRR10177009,SRR10177008,SRR10177007,SRR10177006,SRR10177005,SRR10177004和SRR10177003)。在当前研究期间使用和/或分析的数据集可根据要求从相应的作者获得。本工作中使用的所有SRA数据可在以下链接上获得:
SRR10177014:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177014
SRR10177013:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177013
SRR10177012:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177012
SRR10177011:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177011
SRR10177010:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177010
SRR10177009:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177009
SRR10177008:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177008
SRR10177007:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177007
SRR10177006:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177006
SRR10177005:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177005
SRR10177004:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177004
SRR10177003:https://www.ncbi.nlm.nih.gov/sra/?term=SRR10177003
缩写
- LSS:
-
长期盐度压力
- 赫伯克:
-
同源词表达偏倚范畴
- 山:
-
水杨酸
- 遗传算法:
-
赤霉素
- 国际宇航科学院:
-
Indole-3-acetic酸
- 阿坝:
-
脱落酸
- DEG:
-
差异表达基因
- rev:
-
相对表达价值
- D %:
-
D同源物相对表达值
- 史:
-
抑制
- D:
-
占主导地位的
- 赫伯克:
-
同源词表达偏倚范畴
- 沛富:
-
ABA反应元件结合因子
- JAZ:
-
Jasmonate ZIM-domain
- LSS:
-
长期盐度压力
- 李:
-
晚期胚胎发生丰富
- DHN:
-
Dehydrin
- k_trans:
-
钾离子转运蛋白
- V-H_PPase:
-
Vacuolar-H+- 磷酸糖苷
- NCX:
-
钠/钙交换器
- 山:
-
K Efflux Antiporter.
参考文献
- 1.
关键词:多倍体小麦,基因组可塑性,驯化abstract:科学。2007;316:1862-6。https://doi.org/10.1126/science.1143986.
- 2.
Feldman M, Lupton FGH, Miller TE。小麦。在:Smartt J, Simmonds N,编辑。作物植物的进化,2。哈洛:朗文科技;1995.p . 84 - 192。
- 3.
栽培小麦多倍体的进化:驯化、自然杂交和异源多倍体物种形成在其多样化中的作用。植物生理学杂志。2011;52:750-64。https://doi.org/10.1093/pcp/pcr018.
- 4.
关键词:小麦,同源基因,基因结构,编码序列,遗传多样性,遗传多样性植物杂志。2013;161:252 - 65。https://doi.org/10.1104/pp.112.205161.
- 5.
张H,朱禄,齐B,苟X,董义,徐C,张B,黄W,刘C,王X.在异丙醇水平历史中历史上的BBAA成分的演变。植物细胞。2014; 26:2761-76。https://doi.org/10.1105/tpc.114.128439.
- 6.
张安华,李宁,龚丽,郭晓,王斌,邓晓东,李春华,董强,刘斌。六倍体小麦全染色体非整倍体基因表达的整体分析。植物杂志。2017;175:828-47。https://do.org/10.1104/pp.17.00819..
- 7.
Bottley A, Xia GM, Koebner RMD。六倍体小麦的同源基因沉默。植物j . 2006; 47:897 - 906。https://doi.org/10.1111/j.1365-313X.2006.02841.x.
- 8.
杨C,赵立,张H,杨Z,王H,Wen S,张C,Rustgi S,von Wettstein d,刘B.六倍倍麦盐胁迫的生理反应演变。P Natl Acad Sci USA。2014; 111:11882-7。https://doi.org/10.1073/pnas.1412839111.
- 9.
杨超,杨志明,赵磊,孙飞,刘斌。一种新形成的六倍体小麦对缺氮的耐受性明显高于亲本。BMC Plant Biol. 2018;18:113。https://doi.org/10.1186/s12870-018-1334-1.
- 10。
Byrt CS, Platten JD, Spielmeyer W, James RA, Lagudah ES, Dennis ES, Tester M, Munns R. HKT1;与Na相连的5样阳离子转运体+小麦中的排除基因座,Nax2和Kna1.植物杂志。2007;143:1918-28。https://doi.org/10.1104/pp.106.093476.
- 11.
吴华,夏芭拉,阿扎雷洛+胞质和组织特异性钠+根的封存使硬粒小麦和面包小麦对盐胁迫的耐受性不同。J Exp Bot. 2018; 69:3987-4001。https://doi.org/10.1093/jxb/ery194.
- 12.
TJ, Glenn EP, Volkov V.能进行Na的囊泡运输+和cl−成为烟道中耐盐性的特征。Ann Bot。2019年; 123:1-18。https://doi.org/10.1093/aob/mcy164.
- 13.
Ganie SA, Molla KA, Henry RJ, Bhat KV, Mondal TK。水稻耐盐性研究进展。Theor Appl Genet. 2019; 132:851-70。https://doi.org/10.1007/s00122-019-03301-8.
- 14.
Ramírez-gonzálezrh,Borrille P,Lang D,Harrington SA,Brinton J,Venturini L,Davey M,Jacobs J,Van Ex F,Pasha A,Khedikar Y,Robinson Sj,Cory At,Florio T,Concia L,Cory C那Schoonbeek H, Steuernagel B, Xiang D, Ridout CJ, Chalhoub B, Mayer KFX, Benhamed M, Latrasse D, Bendahmane A, International Wulff BBH, Appels R, Tiwari V, Datla R, Choulet F, Pozniak CJ, Provart NJ, Sharpe AG, Paux E, Spannagl M, Bräutigam A, Uauy C. The transcriptional landscape of polyploid wheat. Wheat Genome Sequencing Consortium. Science. 2018;361:eaar 6089.https://doi.org/10.1126/science.aar6089..
- 15.
Munns R,Gilliham M.盐度耐受性作物 - 成本是多少。新植物。2015; 208:668-73。https://doi.org/10.1111/nph.13519.
- 16.
Munns R, Passioura JB, Colmer TD, Byrt CS。盐碱地植物生长的渗透调节和能量限制。2019年新植醇。。https://doi.org/10.1111/nph.15862.
- 17.
王敏,夏光。小麦耐盐性的分子机制。作物j . 2018; 6:42-7。https://doi.org/10.1016/j.cj.2017.09.002.
- 18.
张建军,张建军,张建军,等。棉花耐旱盐胁迫研究进展与展望。2019; 130:118-29。https://doi.org/10.1016/j.indcrop.2018.12.070.
- 19.
BYRT CS,赵MC,KOURGHI M,BOSE J,HENDERSON SW,邱捷,Gilliham M,SCHULTZ C,SCHWARZ M,Ramesh SA。Aquaporin atPip2的非选择性阳离子通道活动; 1由CA调节2+和pH. Plant Cell Environ. 2017; 40:802-15。https://doi.org/10.1111/pce.12832.
- 20。
植物脱水醇的组织定位、结构和功能。Cell Mol Biol Lett. 2006; 11:536-56。https://doi.org/10.2478/s11658-006-0044-0.
- 21。
韩磊,肖晓,肖波,王敏,刘杰,Bhanbhro N, Khan A,王浩,杨超。蛋白质组学分析对小麦耐碱性的影响。植物生理生化。2019;138:58-64。https://doi.org/10.1016/j.plaphy.2019.02.024.
- 22。
Pedrosa AM, Martins CPS, Gonçalves LP, Costa MGC。Late embryogenesis abundant (LEA)由一个涉及甜橙(sweet orange)发育和非生物胁迫响应的大而多样的蛋白质家族组成。柑橘sinensis.l .的Osb)。《公共科学图书馆•综合》。2015;10:eo145785。https://doi.org/10.1371/journal.pone.0145785.
- 23.
肖波,卢华,李超,Bhanbhro N,崔星,杨晨。碳水化合物和植物激素对六倍体小麦碱胁迫响应的调节作用Triticum Aestivum.l .)。环境Exp Bot. 2020;175:104053。https://doi.org/10.1016/j.envexpbot.2020.104053.
- 24.
黄志强,王志强,王志强,等。水分亏缺对花生表皮蜡质含量影响的基因型差异。作物科学。2003;43:1294-9。https://doi.org/10.2135/cropsci2003.1294.
- 25.
张敏,彭志强,谢斌,谭飞,杨宇。水分胁迫下甘薯扦插叶片失水速率与渗透调节因子的关系。中国农业科学。2005;37:152-6。
- 26.
关键词:拟南芥,水分缺乏,叶表皮脂质,叶绿素含量植物杂志。2009;151:1918-29。https://doi.org/10.1104/pp.109.141911.
- 27.
关键词:拟南芥,EsWAX1,抗坏血酸,表皮蜡质,抗旱性植物生理生化。2014;75:24-35。https://doi.org/10.1016/j.plaphy.2013.11.028.
- 28.
Amthor JS。麦克雷-德与弗里斯-索恩利的呼吸范式:30年后。安机器人。2000;86:1-20。https://doi.org/10.1006/anbo.2000.1175.
- 29.
雅各布rp,泰勒nl,millar啊。线粒体呼吸在盐度耐受的作用。趋势植物SCI。2011; 16:614-23。https://doi.org/10.1016/j.tplants.2011.08.002.
- 30.
王志强,王志强,王志强,等。脱落酸的合成及其信号转导机制的研究进展。咕咕叫医学杂志。2011;21:346-R355。https://doi.org/10.1016/j.cub.2011.03.015.
- 31.
李建军,李建军,李建军,等。植物对脱落酸和非生物胁迫的耐受性。植物学报2016;7:571。https://doi.org/10.3389/fpls.2016.00571.
- 32。
Wendel的摩根富林明。多倍体的基因组进化。植物学报。2000;42:225-49。https://doi.org/10.1007/978-94-011-4221-2_12.
- 33。
张志强,张志强,张志强,等。合成多倍体对非生物胁迫反应中复制基因转录组的差异贡献。新植醇。2011;190:1045-57。https://doi.org/10.1111/j.1469-8137.2011.03650.x.
- 34。
赵林,杨泽,杨春春。盐生植物的转录组分析和生理反应Kochia Sieversiana深入了解耐盐性。植物学报2017;8:1985。https://doi.org/10.3389/fpls.2017.01985.
- 35.
Ravel C, Martre P, Romeuf I, Dardevet M, El-Malki R, Bordes J, Duchateau N, Brunel D, bal傅里叶F, Charmet G.小麦转录激活因子Spa的核苷酸多态性影响其表达模式,并对籽粒蛋白质组成、面团粘弹性和籽粒硬度有多效性影响。植物杂志。2009;151:2133-44。https://doi.org/10.1104/pp.109.146076.
- 36.
Giménez MJ, Pistón F, Atienza得分后卫。在比较转录组学分析中鉴定适合qPCR数据规范化的内参基因Triticeae.足底。2011;233:163 - 73。https://doi.org/10.1007/s00425-010-1290-y.
- 37.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相对基因表达数据。方法。2001;25:402-8。https://doi.org/10.1006/meth.2001.126.
确认
不适用。
资金
该工作得到了中国国家自然科学基金(第31971762和31670218)的支持,是中美大学的基本研究资金(第2412019Fz026),以及中国博士后科学基金会(2017年M610197和2018 T110262)。融资机构在研究和收集,分析和解释方面没有在数据和撰写手稿中的设计中发挥作用。
作者信息
隶属关系
贡献
C.Y.构思了这项研究并设计了实验。n.b.、B.X、l.h.、h.l.和H.W.进行了实验。c.y., n.b., b.x., l.h., h.l.,和H.W.分析和解释数据。C.Y, N.B.和B.X.起草了这篇文章,并对文章进行了关键性的修改。所有作者都已阅读并批准了最终稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
作者宣称不存在相互竞争的利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1
.《京都基因与基因组百科全书》(KEGG)对小麦叶片差异表达基因的富集。调整后的前20个KEGG路径P显示值< 0.05。图S2.《京都基因与基因组百科全书》(KEGG)对小麦四倍体根差异表达基因的富集。调整KEGG通路P显示值< 0.05。图S3.长期盐胁迫对蜡质生物合成相关基因表达的影响。(a)蜡质生物合成途径上的基因表达发生了变化,红框表示在长期盐胁迫下表达上调。蜡的生物合成途径图改编自KEGG网站的图。(b)长期盐胁迫下小麦叶片蜡质代谢相关基因表达数据。醇形成脂肪酸辅酶a还原酶。中链烷烃羟化酶MAH1;CYP96A15;WSD1, wax-ester合酶/甘油二酯O酰基转移酶。折页变化=应力/控制,Q值为调整值Pbenjamin - hochberg方法。图S4。长期盐胁迫对两种铁氧还原蛋白- nadp表达的影响+还原酶(petH)基因。图S5.在表达折叠变化(应力/控制)中的所有盐度耐受性三合会的关系中的关系。图S6。15个典型耐盐三元组的A、B和D同源基因的表达倍数(胁迫/对照)发生变化。*表示显著差异(经调整)P值< 0.05和|log2倍变化|≥1)。
附加文件2:表S1
.折叠变化和对每个相容性溶质的总摩尔的贡献百分比。折叠变化为应力/控制的比率。用以下等式计算贡献百分比:给定溶质的百分比=其摩尔含量(μmolg-1 dw)×100 /总摩尔性含量,其中总摩尔含量为所有37个溶质的摩尔含量的总和。用100 mM NaCl处理小麦种子30 d。CL,控制叶;SL,压力叶;CR,控制根;SR,压力根。表S2.参与渗透调节、离子稳态和组织耐受的耐盐基因的表达数据。表S3.显示应力诱导同源物相对表达显著变化的三联征百分比。显著变化定义为胁迫与对照之间同源基因相对表达差异≥20%。表S4。显示差分职业表达式偏置类别的三合会数量控制和应力处理。表S5。参与渗透调节、离子稳态和组织耐受的耐盐三联征的表达数据和同源物表达偏倚类别。的,抑制;模拟,主导;台球,B抑制;罪犯,B占主导地位;D - s、D抑制;D D, D占主导地位。表S6:小麦叶片qRT-PCR结果。每个处理有三个生物重复。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
肖斌,韩磊。et al。AlloHexaploid小麦对长期盐度应力的自适应策略。BMC植物杂志20,210(2020)。https://doi.org/10.1186/s12870-020-02423-2
已收到:
公认:
发表:
关键字
- 小麦
- 盐度应力
- 能源分区
- 阿巴
- 遗传算法