- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
树牡丹杂色的花朵显示出一个小插入gydF4y2BaF3'HgydF4y2Ba无氰花部分的基因gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba, 文章编号:gydF4y2Ba211.gydF4y2Ba(gydF4y2Ba2020.gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
树牡丹(gydF4y2BaPaeonia suffruticosa.gydF4y2BaAndr。)栽培品种'ER Qiao'对其不稳定的杂色花朵着色表示赞赏,用氰和酰氰花朵出现在同一植物的不同分支上,偶尔在一朵花或花瓣中。但是,差异机制仍然不清楚。gydF4y2Ba
结果gydF4y2Ba
在本研究中,我们发现青色花瓣中花青素的含量显著高于非青色花瓣,花色组合的多样性也显著高于非青色花瓣。两种花的转录组比较分析显示有477个差异表达基因(DEGs)。实时荧光定量PCR结果验证了该基因的转录水平gydF4y2Ba黄酮醇合成酶gydF4y2Ba(gydF4y2BaFLS的gydF4y2Ba)基因在亚氰酸的花瓣中显着增加。此外,我们发现在246bp中插入GCGGCG插入gydF4y2Ba类黄酮3 ' -羟化酶gydF4y2Ba(gydF4y2BaF3'HgydF4y2Ba)基因编码区域构成241-245bp部分的重复,并且仅在亚烷饰品中持续发现。序列对准gydF4y2BaF3'HgydF4y2Ba结果表明,只有“二巧”的无氰花瓣中含有GCGGCG插入。的变换gydF4y2Ba拟南芥tt7-1gydF4y2Ba线条表明异位表达gydF4y2BaF3'H-cyanicgydF4y2Ba, 但不是gydF4y2BaF3'H-acyanic.gydF4y2Ba,可以补充下胚轴和种皮的颜色。gydF4y2Ba
结论gydF4y2Ba
总之,我们发现一个indelgydF4y2BaF3'HgydF4y2Ba和上调的gydF4y2BaFLS的gydF4y2Ba在亚氰植物中大大降低了花青素含量。我们的结果提供了分子候选者,以更好地了解树牡丹中的杂色机制。gydF4y2Ba
背景gydF4y2Ba
树牡丹(gydF4y2Ba芍药gydF4y2Ba芍药科)牡丹组。是一种多年生木本植物,有各种花色。由于其观赏价值高,牡丹被认为是中国重要的园艺花。牡丹在中国已经种植了1600年,大约培育了2000个品种[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].花色是牡丹最重要的性状之一,它决定了牡丹在市场上的观赏价值,也通常用于品种分类[gydF4y2Ba3.gydF4y2Ba].“欧乔”是一本古老的牡丹,清楚地描述了在宋代盛侯周撰写的900岁的“洛阳牡丹”书中清楚地描述。'ER Qiao'通常用单个植物中的氰和酰氰藻花产生不同的分支(图。gydF4y2Ba1gydF4y2Ba),在少数情况下产生杂色的花,有氰化和氰化的体细胞部分。杂色花的颜色变化如下:半氰化和半氰化,或有一小部分氰化或氰化。由于其不稳定的杂色,是一个有价值的品种,并因其独特的杂色特性而受到科学家的关注[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].然而,“二桥”杂色花的遗传机制尚未阐明。gydF4y2Ba
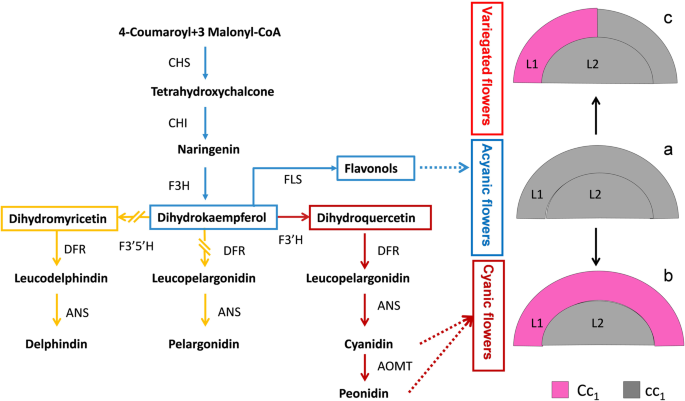
花色杂色通常与花青素含量的差异有关。花青素生物合成途径已经在许多植物中得到了很好的表征[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].底物丙二酰辅酶a和4-香豆蔻酰辅酶a通过查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄酮3-羟化酶(F3H)、二氢黄酮醇4-还原酶(DFR)和花青素合成酶(ANS)依次转化为花青素。黄酮类化合物3 ',5 ' -羟化酶(F3 ' 5 ' h)和3 ' -羟化酶(F3 ' h)对中间底物的作用分别产生飞燕花苷(3 ' 4 ' 5 ' -羟化)和花青素(3 ' 4 ' -羟化),而不是天球花苷(4 ' -羟化)花青素。花青素的3 ' -羟基甲基化生成花青素。花青素通过尿苷二磷酸-葡萄糖:类黄酮-3- o -糖基转移酶(UFGTs)的糖基化转化为花青素。然后,花青素被运输到液泡中,在那里它们被储存并完成重要的功能,如花的色素沉着。MYB-bHLH-WD40复合物在调控花青素生物合成途径中起着核心作用,许多信号通过影响MYB、bHLH和WD40家族调控基因的转录来调控花青素的积累[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].在许多植物中观察到杂色的表型,包括早晨的荣耀[gydF4y2Ba12gydF4y2Ba],gydF4y2Ba托纳尼亚gydF4y2Ba[gydF4y2Ba13gydF4y2Ba,桃子[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba[variegation最常被展示为斑点,条纹,条纹或与不同的花瓣或叶缘颜色s [gydF4y2Ba16gydF4y2Ba].在许多植物中研究了与花杂色相关的基因突变,研究表明,在与花青素合成,运输或调节相关的基因中插入的转换元素在很大程度上是负责任的[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].DNA甲基化和RNA干扰也影响着颜色变形;例如,未珍化的扇区中的CHS的短暂干扰RNA导致喇叭花中的恒星型红眼和白色双色图案[gydF4y2Ba19gydF4y2Ba],而MYB10启动子的甲基化导致苹果皮中的可变彩色图案化[gydF4y2Ba20.gydF4y2Ba].最近,发现在花青素输送基因中的一个小吲哚在桃花中导致杂色着色[gydF4y2Ba21.gydF4y2Ba].gydF4y2Ba
牡丹基因组的庞大和花青素途径的复杂性使得传统的方法很难识别出影响牡丹杂色的关键基因。转录组测序是鉴别差异表达基因(DEGs)的一种有效方法。一些研究使用了下一代测序技术来调查与牡丹颜色积累相关的基因[gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba23.gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba].在这项研究中,使用Illumina Hiseq2000平台测序“ER Qiao”的氰和嘧曲面的转录om。对比较转录组分析和有关的与花青素相关的基因分析,目的是发现参与树木牡丹花卉杂色的候选基因。gydF4y2Ba
结果gydF4y2Ba
二桥花的花青素组成gydF4y2Ba
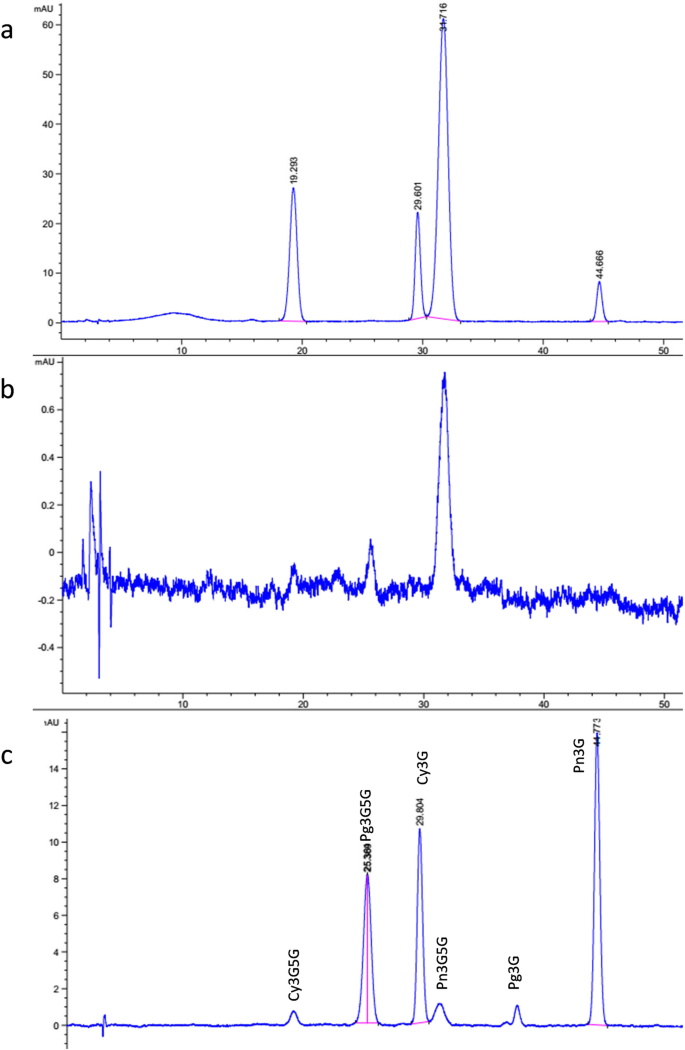
采用高效液相色谱(HPLC)分析,研究不同花部位花青素含量的差异。gydF4y2Ba2gydF4y2Ba).量化花青素,结果显示在表中gydF4y2Ba1gydF4y2Ba.在氰化瓣中,主要花青素是Cyanidin-3,5-二 -gydF4y2BaOgydF4y2Ba葡萄糖苷(Cy3G5G) cyanidin-3 -gydF4y2BaOgydF4y2Ba- 葡萄糖苷(Cy3g),芍药蛋白-3,5-二 -gydF4y2BaOgydF4y2Ba-Glucoside(pn3g5g)和pelargonidin-3-gydF4y2BaOgydF4y2Ba葡萄糖苷(Pn3G)。Pn3G5G含量最高(2244 μg/g),其次是Cy3G5G (392 μg/g)、Cy3G (93 μg/g)和Pn3G (37 μg/g)。在氰化花中仅检测到Pn3G5G,约为24.3 μg/g(比氰化花低92.3倍)。此外,天竺葵苷-3,5-二-含量极低gydF4y2BaOgydF4y2Ba在氰和酰氰化葡萄花瓣中检测到葡萄糖苷(PG3G5G),氰和酰氰化物花瓣之间的PG3G5G的峰面积没有显着差异。氰化瓣中的三孔素含量远高于亚氰酸葡萄花瓣。在斑点地区,PN3G5G和CY3G5G分别是最多的组分,分别占2427μg/ g和1201μg/ g。gydF4y2Ba
转录组测序和组装gydF4y2Ba
采集来自三种独立植物的花瓣并用于cDNA文库构建。在数据过滤后,9.34,9.31和9.27 GB高质量数据是从三个酰氰库生成的,9.35,9.98和9.32 GB高质量数据是从三个氰图库中产生的。高Q20分数的清洁读数大于96.8%,GC百分比在六个数据集中的每一个中约为45%。六种测序结果中的每一个都是组装的,并且在表中指出了所产生的Contigs,Unigene号码和质量gydF4y2BaS1gydF4y2Ba.用Tigal去除多余基因后,共生成75,669个unigenes,总残基80,664,445个,平均长度为1066 nt, N50为1679 nt。全长200 ~ 500 nt的单基因序列28647条,占37.9%;长度在500 ~ 1000 nt的unigenes有16,973个(22.4%);1000 ~ 1500 nt的unigenes 11460个(15.1%);长度在1000 ~ 1500 nt之间的unigenes有7800个(10.3%);长于2000 nt的基因有10789个(14.3%)。在已组装的unigenes中,有43,832个在公共数据库中得到注释。gydF4y2Ba
在氰化和青色花瓣中的变异gydF4y2Ba
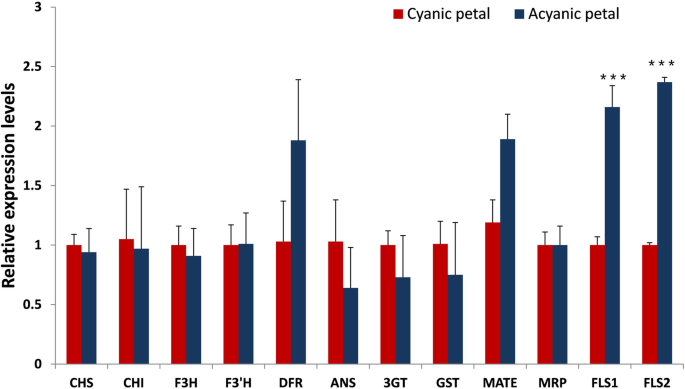
比较转录组分析显示,无氰和蓝绿色花瓣之间有477个DEGs(图)gydF4y2BaS1gydF4y2Ba).与无氰花瓣相比,有131个unigenes表达显著上调,346个unigenes表达显著下调。随后在KEGG通路数据库中对这些deg进行分析,将477个deg全部分配到71个KEGG通路中,其中18个显著富集,q值≤0.05(表)gydF4y2BaS2gydF4y2Ba).在显着富集的途径中,最大数量的序列是与代谢途径(58,30.21%)相关的序列,其次是涉及二次代谢物生物合成的序列(44,22.92%)和苯丙醇生物合成(15,7.81%).特别地,显着富集了三种花色相关途径,包括“黄酮类生物合成”(KO00941),“黄酮和黄酮和黄酮化生物合成”(KO00944)和“异戊类化生物合成”(KO00943)。一种gydF4y2Ba黄酮醇合成酶gydF4y2Ba(gydF4y2BaFLS的gydF4y2Ba)基因,引导花青素往黄酮醇,基于注释,序列对准和系统发育分析鉴定了三种颜色相关途径。参与花青素生物合成途径的步骤的关键基因未发现在DEG中。gydF4y2Ba
与花色相关候选基因的转录水平分析gydF4y2Ba
基于组装的unigenes,我们确定了两个gydF4y2BaFLS的gydF4y2Ba与花青素生物合成、转运和调控相关的21个基因gydF4y2Ba2gydF4y2Ba).外显子模型每千碱基的片段每百万reads mapping (FPKM)值表明只有一个片段gydF4y2BaFLS1gydF4y2Ba在两种花类型之间显着变化的基因。转录水平的两个gydF4y2BaFLS的gydF4y2Ba使用定量实时(QRT)-PCR来评估基因和10个花青素生物合成基因,以验证转录组数据。结果表明gydF4y2BaFLS1gydF4y2Ba和gydF4y2BaFLS2gydF4y2Ba在亚尾花瓣中比在氰化物上更明显高度表达(gydF4y2BaPgydF4y2Ba< 0.001)(图gydF4y2Ba3.gydF4y2Ba).的显著上调gydF4y2BaFLS1gydF4y2Ba被两种分析技术证实,而gydF4y2BaFLS2gydF4y2Ba在转录组测序分析中未发现明显变化。总的来说,qRT-PCR结果与转录组测序数据一致。gydF4y2Ba
嘧霉素与氰化物花瓣之间的花青素相关转录物的序列比较gydF4y2Ba
在六个样品中,从独立的组件中提取了与ophocyanin相关的转录物并分析。在21例与三孔素相关基因中分析单核苷酸多态性和简单的序列重复多态性,但在两个样品类型之间没有始终鉴定出来。使用indel分析,在247 bp位置发现了小插入gcggcggydF4y2Ba类黄酮3 ' -羟化酶gydF4y2Ba(gydF4y2BaF3'HgydF4y2Ba)基因是其5'侧翼片段的重复(241bp至246bp)。在所有三种酰氰样品中存在小插入,但是从三个氰样品中不存在。gydF4y2Ba
侧翼GCGGCG插入的一对引物被设计为放大gydF4y2BaF3'HgydF4y2Ba互补脱氧核糖核酸片段。选取了5株同时具有氰化和氰化分枝的独立植株。以其cdna为模板,对PCR产物进行测序。结果表明,所有的氰化花瓣中都含有GCGGCG插入,而氰化花瓣中没有GCGGCG插入gydF4y2BaS2gydF4y2Ba).此外,在三个与氰和酰氰花瓣的花朵中,插入仅存在于亚氰花瓣中。我们的结果表明GCGGCG插入gydF4y2BaF3'HgydF4y2Ba基因与“二桥”的无氰花瓣相关。gydF4y2Ba
的gydF4y2BaF3'HgydF4y2BaPCR扩增基因组DNA片段,并从每个样本中选择20个克隆进行测序。通过3个生物重复,我们发现在蓝和蓝花瓣中既有正常序列,也有6 bp插入片段的序列。gydF4y2Ba
F3'HgydF4y2Ba基因分析gydF4y2Ba
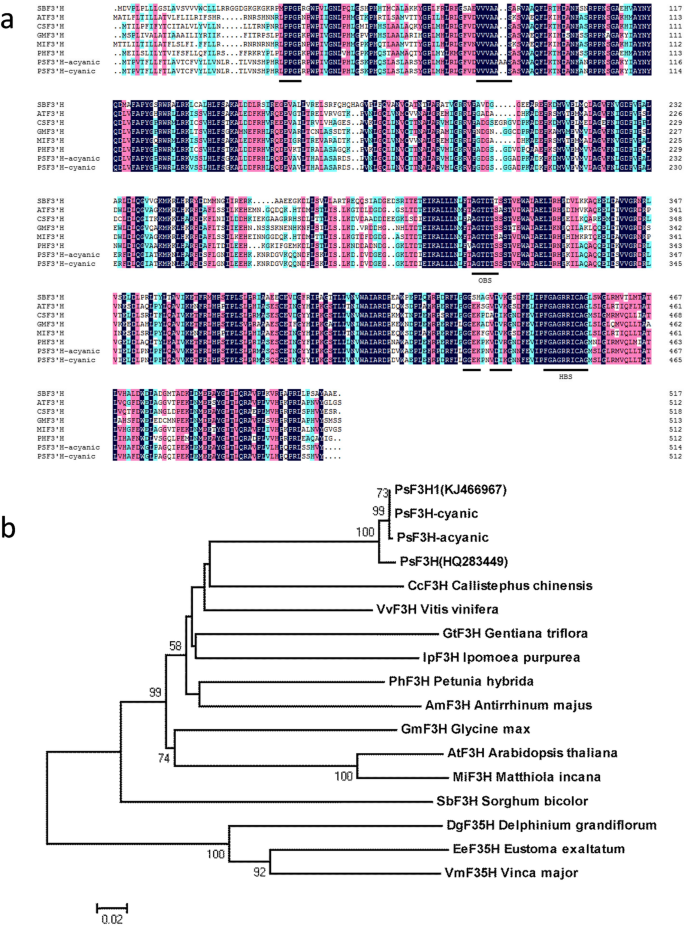
为了验证通过转录组测序得到的基因序列结果gydF4y2BaF3'HgydF4y2Ba使用PCR扩增cDNA并克隆到PMD19-T载体中。测序十个克隆,结果表明,基因序列与DE Novo组件的序列相同。F3'H与来自其他植物物种的氨基酸序列对准如图2所示。gydF4y2Ba4gydF4y2Baa. F3'H-cyanic与牡丹品种“洛阳红”相同[gydF4y2Ba25.gydF4y2Ba]并与来自Dicots和单焦点的其他F3'Hs显示60-73%相似之处。它具有最高的相似之处gydF4y2BaCallistephus对gydF4y2Ba在73%。在牡丹的F3'H中也发现了许多细胞色素p450中保守的结构域,包括血红素和氧结合位点。三个f3 ' h特异性保守基序VDVKG、VVVAAS和GGEK与之前报道的相同[gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba27.gydF4y2Ba].While for F3’H-acyanic, two alanine insertions caused by the GCGGCG insertion altered the F3’H specific motif from VVVAAS to VVVAAAAS, which was only present in the acyanic flowers of ‘Er Qiao.’ Phylogenetic analysis was performed based on the deduced amino acid sequences of F3’H and F3’5’H, which have diverse functions in plants (Fig.4gydF4y2Bab)。系统发育树表明树牡丹的两种F3'H蛋白在具有来自双子斑点和单子叶的F3'H蛋白的疏水膜中聚集。gydF4y2Ba
序列表征和系统发育分析。gydF4y2Ba一个gydF4y2Ba.使用DNAMAN软件对来自'ER QIAO'cDNA和六种其他植物物种的推导氨基酸序列的多序列比对。使用的序列来自gydF4y2BaA. Thaliana.gydF4y2Ba(af271651),gydF4y2BaCallistephus对gydF4y2Ba(af313488),gydF4y2Ba甘氨酸最大gydF4y2Ba(AF499731),gydF4y2BaMatthiola incanagydF4y2Ba(AF313491),gydF4y2Ba佩妮矮牵牛gydF4y2Ba(af155332),和gydF4y2Ba高粱双色gydF4y2Ba(AAV74195)。gydF4y2BabgydF4y2Ba.系统发育树,显示了“Er Qiao”F3'H与其他植物的进化相关性。包含的F3'H蛋白的加入号如下:gydF4y2Bap .矮牵牛gydF4y2Ba(X71130),gydF4y2BaAntirrhinum Majus.gydF4y2Ba(AB028151),gydF4y2Ba龙胆trifloragydF4y2Ba(BAD91808),gydF4y2BaIpomoea purpureagydF4y2Ba(AAR00229),gydF4y2BaMatthiola incanagydF4y2Ba(AAG49301),gydF4y2Bavitis ViniferagydF4y2Ba(BAE47006),gydF4y2Ba飞燕草羊藿gydF4y2Ba(AAX51796),gydF4y2Baeustoma Exaltatum.gydF4y2Ba(bad34460),gydF4y2Ba长春花大gydF4y2Ba(BAC97831),gydF4y2BaPaeonia suffruticosa.gydF4y2Ba(HQ283449),和gydF4y2BaPaeonia suffruticosa.gydF4y2Ba(KJ466967)。在MEGA5软件中采用邻居连接方法构建树。沿着分支的数字表示从1000次重复中确定的引导支持,条形表示进化距离为0.02%gydF4y2Ba
我们也克隆并测量了gydF4y2Badihydroflavonol 4-reductasegydF4y2Ba(gydF4y2BaDFRgydF4y2Ba)来自Cdnas的氰和酰氰化物花瓣的基因。结果表明gydF4y2BaDFRgydF4y2Ba序列在两个样品中相同。gydF4y2Ba
的功能分析gydF4y2Bapsf3'h.gydF4y2Ba基因的gydF4y2Ba拟南芥gydF4y2Ba突变体gydF4y2BaTT7-1gydF4y2Ba
的gydF4y2Ba拟南芥透明Testa7-1gydF4y2Ba(gydF4y2BaTT7-1gydF4y2Ba突变体没有功能gydF4y2BaF3'HgydF4y2Ba基因。由于花青素途径破坏,种子涂层是浅棕色,并且由于花青素途径破坏,显微胶是浅绿色。比较两者的功能gydF4y2Bapsf3'h.gydF4y2Ba等位基因基因,gydF4y2BaPsF3'H-cyanicgydF4y2Ba和gydF4y2BaPsF3'H-acyanicgydF4y2Ba单独连接到花椰菜马赛克病毒35s启动子并转移到gydF4y2Ba拟南芥tt7-1gydF4y2Ba突变体。为每一个生产超过五种转基因植物gydF4y2Bapsf3'h.gydF4y2Ba等位基因基因。野生型的发芽幼苗,gydF4y2BaTT7-1gydF4y2Ba突变体,gydF4y2Bapsf3'h-亚尾,gydF4y2Ba和gydF4y2BaPsF3'H-cyanicgydF4y2Ba转基因株系如图所示。gydF4y2Ba5gydF4y2BaA-D,以及野生型的种子,gydF4y2BaTT7-1gydF4y2Ba突变体,gydF4y2Bapsf3'h-亚尾,gydF4y2Ba和gydF4y2BaPsF3'H-cyanicgydF4y2Ba转基因株系如图所示。gydF4y2Ba5gydF4y2Ba情况。野生型和gydF4y2BaPsF3'H-cyanicgydF4y2Ba转基因系有红色的幼杆子,但是gydF4y2Ba拟南芥tt7-1gydF4y2Ba突变体和gydF4y2BaPsF3'H-cyanicgydF4y2Ba转基因系有淡绿色的缺点。gydF4y2Ba
色素的补充gydF4y2Ba拟南芥tt7gydF4y2Ba突变与gydF4y2Bapsf3'h.gydF4y2Ba基因。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba,野生型表型,gydF4y2BaTT7-1gydF4y2Ba,gydF4y2BaF3'H-acyanic,gydF4y2Ba和gydF4y2BaF3'H-cyanicgydF4y2Ba转基因线幼苗;gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba,野生型表型,gydF4y2BaTT7-1gydF4y2Ba,gydF4y2BaF3'H-acyanic.gydF4y2Ba,gydF4y2BaF3'H-cyanicgydF4y2Ba转基因种子行gydF4y2Ba
此外,从表达转基因素中收集的种子gydF4y2BaPsF3'H-cyanicgydF4y2Ba展示了野生型的色素沉着特性gydF4y2Ba拟南芥gydF4y2Ba,而种子的种子gydF4y2Ba拟南芥tt7-1gydF4y2Ba突变体和转基因株系表达gydF4y2BaPsF3'H-acyanicgydF4y2Ba浅棕色的颜色。gydF4y2Ba
讨论gydF4y2Ba
与氰化花瓣相比,二桥的氰化花瓣中花青素的含量低得惊人,这表明氰化花瓣中花青素途径的活性有限。花青素途径中基因的转录水平直接决定了花青素的含量和组成。据报道,其中一些基因的下调导致桃花青素积累的减少[gydF4y2Ba15gydF4y2Ba],gydF4y2BaLinariagydF4y2Ba[gydF4y2Ba28.gydF4y2Ba,日本喇叭花[gydF4y2Ba12gydF4y2Ba和日本杏[gydF4y2Ba18gydF4y2Ba].However, in the present study, differential transcript levels of key genes in each step of the anthocyanin pathway were not found between the two flower samples of ‘Er Qiao.’ Therefore, the varied pathway activity may not be related to the differential transcription levels of genes in the anthocyanin pathway.FLS的gydF4y2Ba编码黄酮醇合酶,可影响植物色素。其底物二氢黄酮醇与之竞争gydF4y2BaDFRgydF4y2Ba,gydF4y2BaF3'HgydF4y2Ba和gydF4y2BaF3’5是什么gydF4y2Ba在花青素途径中,将途径指向黄酮醇。在gydF4y2Ba拟南芥gydF4y2Ba,花青素含量降低gydF4y2BaFLS的gydF4y2Ba过表达线,但增加gydF4y2Bafls的gydF4y2Ba突变体[gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].在这项研究中,我们发现了一个gydF4y2BaFLS1gydF4y2Ba基因差异表达,并在嘧吡氏花瓣中上调2.1倍。的gydF4y2BaFLS2gydF4y2Ba通过QRT-PCR验证基因也被验证为嘧啶瓣上的上调。我们推导出更高的转录水平gydF4y2BaFLS的gydF4y2Ba无氰花瓣可能会将更多的二氢黄酮醇导向黄酮醇的生物合成,底物的缺乏会减少花青素的生物合成,这可能是花瓣颜色降低的一个重要原因。gydF4y2Ba
编码区中的小吲哚可以影响基因的功能,但不会改变其转录水平。如在桃栽培中观察到的“洪贝瓦涛”,基因序列的微妙差异,如小吲哚gydF4y2BaGST.gydF4y2Ba基因[gydF4y2Ba21.gydF4y2Ba],可以破坏酶活性并导致颜色变种。通过分析来自氰和绯红色花的花青素相关的基因序列,我们发现只有GCGGCG插入gydF4y2BaF3'HgydF4y2Ba基因可以明显区分两种基因型,提示插入可能影响‘二桥’花的颜色。gydF4y2Ba
黄酮类化通道分叉分成侧枝gydF4y2BaF3'HgydF4y2Ba和gydF4y2BaF3’5是什么gydF4y2Ba最后生成cyanidin - /peonidin -,飞燕草苷-和天竺葵苷衍生的花青素gydF4y2Ba.F3'HgydF4y2Ba是决定氰化/氰化花瓣变化的关键酶。它在3 '位置羟基化二氢山酚(DHK)的β环,生成二氢槲皮素(DHQ),最终导致以花青素为基础的色素的生成[gydF4y2Ba31.gydF4y2Ba].一个突变gydF4y2BaF3'HgydF4y2Ba基因通常导致植物颜色的变化;例如,大豆中的单碱基删除gydF4y2BaF3'HgydF4y2Ba基因导致了从棕色到灰色的柔毛颜色的变化[gydF4y2Ba32.gydF4y2Ba].早上荣耀物种gydF4y2BaIpomoea nil.gydF4y2Ba,gydF4y2BaI. Tricolor,gydF4y2Ba和gydF4y2Ba即紫竹gydF4y2Ba,红色的花也是由自然突变引起的gydF4y2BaF3'HgydF4y2Ba基因[gydF4y2Ba33.gydF4y2Ba].多项研究表明,f3’h蛋白中存在GGEK、GGSH、VVVAAS、VDVKG等标志性序列[gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba27.gydF4y2Ba].在这项研究中,将来自VVVAAS的保守基序改变为VVVAAAA的GCGGCG插入仅存在于“ER乔”的亚氰分枝中。gydF4y2Ba拟南芥tt7-1gydF4y2Ba线已证明gydF4y2BaF3'HgydF4y2Ba青蓝色的,但不是gydF4y2BaF3'HgydF4y2Ba- 氰基,可以补充其颜色在缺苗和种子涂层中。我们的结果表明,小插入gydF4y2BaF3'HgydF4y2Ba基因功能受损,导致'二翘'无氰花瓣中的花青素- /芍药型花青素急剧减少或缺失。牡丹种子的种皮通常是深棕色的。二桥不育,一般采用嫁接繁殖。由于我们没有成熟的种子,在本研究中我们无法显示小插入与种皮颜色的关系。gydF4y2Ba
一般来说,非功能性gydF4y2BaF3'HgydF4y2Ba将花青素-花青素型花青素转化为天竺葵型花青素和飞燕花型花青素。此前,研究表明飞燕草型花青素和gydF4y2BaF3’5是什么gydF4y2Ba在树牡丹中缺席[gydF4y2Ba34.gydF4y2Ba,gydF4y2Ba35.gydF4y2Ba].在这项研究中,Delphinidin型花青素和gydF4y2BaF3’5是什么gydF4y2Ba在二桥也没有发现。因此,我们建议gydF4y2BaF3’5是什么gydF4y2Ba基因在'qiao'中缺席和功能中断gydF4y2BaF3'HgydF4y2Ba在亚氰花瓣不能导致德尔芬蛋白型花青素积累。DFR酶具有底物特异性确定区域,并且如在Petonia中所观察到的,底物特异性DFR没有有效地减少二氢戊二醛,这是Pelargonidin生产的重要步骤[gydF4y2Ba36.gydF4y2Ba,gydF4y2Ba37.gydF4y2Ba].一个单个氨基酸的改变可以足以改变DFR的底物特异性[gydF4y2Ba36.gydF4y2Ba].通过对大量彩花牡丹品种的分析,发现有的品种含有天竺葵素型,有的不含[gydF4y2Ba34.gydF4y2Ba,gydF4y2Ba35.gydF4y2Ba].这可能与不同的底物特异性有关gydF4y2BaDFRgydF4y2Ba基因。在我们的研究中,序列gydF4y2BaDFRgydF4y2Ba在氰和绯红色花中相同(图gydF4y2BaS3gydF4y2Ba),但我们没有观察到无氰花瓣中花青素- /芍药苷型向天竺葵苷型花青素的变化,这可能是由于二氢山奈酚转化效率低或DFR与FLS之间存在底物竞争。gydF4y2Ba
嵌合体是负责杂色的重要因素,通常是由拍摄顶端商品细胞分裂中的基因突变引起的[gydF4y2Ba21.gydF4y2Ba].在双子叶植物中,茎尖分生组织通常包含三个细胞层:L1层产生表皮,L2和L3负责内部组织,花瓣仅来自L1和L2层[gydF4y2Ba38.gydF4y2Ba].根据枝条分子的遗传学不同细胞的安排,嵌合体可以分为三种类型,包括扇形,默认和蠕动嵌合体,其决定了不同的植物表型[gydF4y2Ba16gydF4y2Ba].在桃栽培品种“宏白虎,”白花分支是主要分支,L1层含有两个无功能gydF4y2Ba赏心悦目的gydF4y2Ba等位基因,无法积累花青素[gydF4y2Ba21.gydF4y2Ba].粉红色的花是一个周壁嵌合体,其L1层包含一个功能gydF4y2Ba赏心悦目的gydF4y2Ba等位基因和非功能性基因gydF4y2Ba赏心悦目的gydF4y2Ba等位基因。显示粉红色和白色躯体扇区的杂色花源来自默认嵌合体,其中L1层的一部分含有功能gydF4y2Ba赏心悦目的gydF4y2Ba等位基因和非功能性基因gydF4y2Ba赏心悦目的gydF4y2Ba等位基因。在'ER QIAO'中,'亚尾花分支是主要分支,氰花和杂色花枝被认为是从芽运动中产生的。我们发现氰和绯甘油花瓣之间的色差主要在表皮细胞中,而内部组织没有显示颜色(图gydF4y2BaS4gydF4y2Ba).结合gydF4y2BaF3'HgydF4y2Ba从基因组DNA和cDNA片段中推测,氰化花可能是杂合子gydF4y2BaF3'H-acyanic.gydF4y2Ba和一个非转录的gydF4y2Baf3'hgydF4y2Ba没有6-BP插入的片段(gydF4y2BaF3'H-acyanic2gydF4y2Ba),两者都是非功能性等位基因gydF4y2BaF3'HgydF4y2Ba.我们推断氰花是一种蠕动嵌合体,L1层含有功能性gydF4y2BaF3'H-cyanicgydF4y2Ba并能积累花青素。杂色的花,显示无氰和蓝绿色的体细胞部分,可能来自于一个分生嵌合体,其中L1层的一部分包含功能gydF4y2BaF3'H-cyanicgydF4y2Ba.因此,提出了一种模型,用于“ER Qiao”的花色中的杂种表型(图。gydF4y2Ba6gydF4y2Ba).在模型中,蓝花的L2层包含一个gydF4y2BaF3'H-acyanic.gydF4y2Ba基因,但未检测到其转录水平。在牡丹花中,色素主要积聚在表皮细胞中[gydF4y2Ba39.gydF4y2Ba,gydF4y2Ba40gydF4y2Ba]这表明花青素合成基因主要在表皮细胞中转录。我们建议gydF4y2BaF3'H-acyanic.gydF4y2Ba基因未转录或在'ER QIAO'花瓣的内细胞中具有非常低的转录水平,这可能解释为什么gydF4y2BaF3'H-acyanic.gydF4y2Ba未在氰化瓣的转录水平上检测到。gydF4y2Ba
在'ER乔的花色建议模型。'红色箭头代表了氰鲜花中黄酮类途径的主要分支,蓝色箭头代表亚尾花的主要分支。橙色箭头表示可能非常低的步骤。L1和L2表示不同的花卉分商层。c代表了这一点gydF4y2BaF3'H-cyanicgydF4y2Ba基因,C代表gydF4y2BaF3'H-acyanic.gydF4y2Bac基因,gydF4y2Ba1gydF4y2Ba代表假定的非转录gydF4y2Baf3'hgydF4y2Ba无6-bp插入基因(gydF4y2BaF3'H-acyanic2gydF4y2Ba).一种。亚尾花携带两位非功能等位基因gydF4y2BaF3'HgydF4y2Ba基因。由周缘嵌合体衍生的蓝绿色花。L1层携带一个功能gydF4y2BaF3'HgydF4y2Ba等位基因。由花冠嵌合体衍生的杂色花(显示无青色和蓝色的体细胞部分)。L1层的一部分携带一个功能gydF4y2BaF3'HgydF4y2Ba等位基因gydF4y2Ba
在树牡丹转录组中,几项研究中组装的unigenes的数量不同。例如,从芽转录组组装29,275个unigenes [gydF4y2Ba41.gydF4y2Ba,共从心皮转录组中组装了66,536个ungenes [gydF4y2Ba42.gydF4y2Ba],从花的转录组中组装了80,390个unigenes [gydF4y2Ba43.gydF4y2Ba]但在我们的研究中,总共组装了75,669个unigenes,从花瓣转录组中组装。在所有上述研究中获得关键候选基因。因此,我们建议所有上述组件是可靠的,并且组织特异性差异是组装的unigenes数量差异的一个原因。通过使用KEGG数据库分析447次,发现18个途径被显着富集。这表明两种颜色花瓣之间的细胞内代谢存在显着差异,可能是由于gydF4y2BaF3 ' HgydF4y2Ba突变,导致花青素合成途径向其他代谢途径的切换。在未来的研究中,对477个DEGs的挖掘将进一步阐明不同代谢途径与花颜色的关系,进一步完善杂色花的形成机制。最近,Wang等人[gydF4y2Ba41.gydF4y2Ba]对牡丹花蕾转录组进行测序,得到29,275个ungenes。他们的发现应该有助于确定病因gydF4y2BaF3 ' HgydF4y2Ba通过在芽中转录的基因采矿基因突变。gydF4y2Ba
结论gydF4y2Ba
我们分析了类黄酮通路中的基因变异,并提出了‘二桥’花的杂色着色模型(图。gydF4y2Ba6gydF4y2Ba).通过减少转移黄酮途径分支朝向Cyanidin- / PeoNidin型花青素的转移gydF4y2BaFLS的gydF4y2Ba活动和功能性gydF4y2BaF3'HgydF4y2Ba形成了蓝绿色的花瓣相反,在无氰花瓣中,活性显著增加gydF4y2BaFLS的gydF4y2Ba可能导致底物二氢山奈酚转向形成黄酮醇。此外,在gydF4y2BaF3'HgydF4y2Ba扰乱其活性,阻碍了Cyanidin- / PeoNidin型化性化学生物合成,其解释了颜料的严重减少。我们推测染色的花朵衍生自蠕虫嵌合体,与氰中间扇形的乙型糖花衍生自化学嵌合体。我们的结果为树牡丹的花卉杂色特征提供了分子机械洞察力。gydF4y2Ba
方法gydF4y2Ba
花青素的组织收集与定量gydF4y2Ba
Paeonia suffruticosa.gydF4y2Baandr。简历。'er qiao'是中国的传统品种,被记录在中国的树木牡丹中[gydF4y2Ba44.gydF4y2Ba].本研究中使用的植物被尊敬,并由高级工程师郑峰彭(洛阳研究所,洛阳,中国洛阳研究所)提供,并保存在洛阳研究所牡丹研究所(洛阳)的树牡丹种质储存库中。选择三种健康植物在不同分支上显示氰和绯红色花卉进行研究。在软芽阶段,从每株植物中除去花瓣碱的斑点,剩余的氰和酰氰化物花瓣分别取样并合并。gydF4y2Ba
对于花青素的定量,花青素的提取方法如Zhang等所述[gydF4y2Ba23.gydF4y2Ba].将每个样品的瓣研磨成液氮中的粉末,用5mL酸化甲醇(0.05%盐酸)萃取0.5g样品。离心后,将上清液通过0.22-μm膜过滤器过滤并用于检测。Agilent 1290 HPLC系统(Agilent,Santa Clara,CA,USA)用于分析花青素,并且色谱分析条件如Zhao等人所述。[gydF4y2Ba45.gydF4y2Ba].注射体积为20μL。流动相由10%的甲酸水溶液组成,作为溶剂A(10:90; v / v,HCOOH:H 2 O)和甲醇/乙腈/水(10:40:50; v / v / v,CH 3 OH:CH3CN:H 2 O)作为溶剂B.线性梯度曲线在0分钟,20%B在30分钟,30%B以50分钟,40%B,60分钟。以0.8ml / min的流速施加上述溶剂梯度。六个花青素,包括cy3g,cy3g5g,pn3g,pn3g5g,pelargonidin-3-gydF4y2BaOgydF4y2Ba-Glucoside(PG3G)和PG3G5G已被报告为树牡丹中的原始颜料[gydF4y2Ba34.gydF4y2Ba,并对‘二桥’花的花色苷组成进行定性和定量分析。花青素标准订购自北京太阳生物科技有限公司(中国北京)。进行了3次生物重复。gydF4y2Ba
图书馆建设与排序gydF4y2Ba
用CTAB法提取总RNA,然后用RNase-Free DNase I (Qiagen, USA)去除基因组DNA。通过安捷伦2100生物分析仪检测,筛选出完整号> 8.5的高质量RNA进行进一步分析。用oligo (dT)磁珠纯化poly- a mRNA,然后用裂解缓冲液裂解成小片段。首先用随机六聚体引物和逆转录酶合成cDNA链,然后用DNA聚合酶I和RNase h合成第二链cDNA链。(美国),并与试剂盒中提供的EB缓冲液溶解,用于末端制备和聚(A)添加。将序列适配器连接到短cDNA序列的两端。琼脂糖凝胶电泳选择合适大小的片段,然后进行PCR扩增。利用北京基因组研究所(中国深圳)的Illumina HiSeq™2000平台(Illumina Inc., San Diego, CA, USA)对文库进行测序。对三个生物重复进行转录组测序检测。本文报道的原始序列数据已保存在Genome sequence Archive [gydF4y2Ba46.gydF4y2Ba在大数据中心[gydF4y2Ba47.gydF4y2Ba],中国科学院北京基因组研究所(BIG), accession number: CRA000698gydF4y2Bahttp://bigd.big.ac.cn/gsagydF4y2Ba.gydF4y2Ba
从头组装和基因注释gydF4y2Ba
我们使用Zhang等人描述的方法进行了从头组装和基因注释[gydF4y2Ba48.gydF4y2Ba].过滤了原始读取,六个库中的每一个的清洁读数都是使用Trinity软件v的De Novo组装。2.0.6 [gydF4y2Ba49.gydF4y2Ba].使用TGI聚类工具(Tgicl) v. 2.06进行进一步组装[gydF4y2Ba50.gydF4y2Ba生成非冗余的单基因。BLAST算法v. 2.2.23 (value<1egydF4y2Ba- 5gydF4y2Ba)被用于查询公共数据库,包括NCBI非冗余(NR),核苷酸(NT),瑞士 - PROM,Accordo和Kyoto Enfclopedia的基因和基因组(Kegg)数据库。最好的击中结果用于解释基因功能。gydF4y2Ba
显著差异基因的识别gydF4y2Ba
使用Bowtie2 v. 2.2.5将Clean reads映射到unigenes [gydF4y2Ba51.gydF4y2Ba]使用每百万千克读数(FPKM)的片段测量基因表达水平[gydF4y2Ba52.gydF4y2Ba].差异表达的统计学意义采用NIOSeq软件测定[gydF4y2Ba53.gydF4y2Ba].选择DEGs的阈值为概率≥0.8,绝对值为log2比值≥1。基于KEGG和GO注释,采用超几何检验进行富集分析。以错误发现率(FDR) < 0.05为阈值筛选显著富集的GO和KEGG项。gydF4y2Ba
表达水平验证gydF4y2Ba
在ABI 7500系统上采用qRT-PCR检测基因转录水平。每个反应包含5 μL的2 × SYBR Green qPCR Master Mix、4 μM的基因特异性引物和1 μL的cDNA,最终体积为10 μL。PCR反应条件为:95℃3 min, 95℃7 s, 57℃10 s, 72℃15 s,共45个循环。引物如表所示gydF4y2BaS3gydF4y2Ba.对每个基因进行三种生物重复。使用2计算每个基因的相对表达水平gydF4y2Ba——ΔΔCtgydF4y2Ba方法 [gydF4y2Ba54.gydF4y2Ba],和gydF4y2Ba泛素gydF4y2Ba基因被用作内部控制[gydF4y2Ba55.gydF4y2Ba,gydF4y2Ba56.gydF4y2Ba].gydF4y2Ba
表达矢量建设与植物转化gydF4y2Ba
设计引物5 ' -GACTCTTGACCATGGTAGATCTAATGACTCCCGTGACTTTTC-3 ' /5 ' - gggaaattcgagctggtcaccctagtacacgtgggatag -3 '扩增该基因的编码区gydF4y2Bapsf3'h.gydF4y2BaS使用从鲜花合成的cDNA作为模板。用Bglii和Bstei消化质粒pcambia1301,以及PCR产品gydF4y2BaF3'H-cyanicgydF4y2Ba和gydF4y2BaF3'H-acyanic.gydF4y2Ba使用Vazyme ClonExpress-II一步克隆试剂盒(Vazyme Biotech Co., Ltd)连接pcambia1301。的gydF4y2Ba拟南芥tt7-1gydF4y2Ba突变体(CS88)来自拟南芥生物资源中心(Ohio State University, OH, USA)。gydF4y2Ba拟南芥gydF4y2Ba根据花浸法进行转换[gydF4y2Ba57.gydF4y2Ba].对于转基因植物选择,将T0种子灭菌并在含有20mg / L潮霉素B的Murashige和Skoog培养基上灭菌。耐药线以后将其移植到土壤10d中并置于25℃和50-80%的生长室中相对湿度。的gydF4y2BaDFRgydF4y2Ba利用引物5 ' -GTTCATCGGTTCATGGCTTGT-3/5 ' -TTCCA TGGGAAGTGGAAGCAA-3 '克隆基因。gydF4y2BaF3'HgydF4y2Ba使用引物5'-attcaccttagcggtttacctg-3'/ 5'-tgcaaaacaa ggtcctgata-3'克隆片段。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本文结论的数据集可在中国科学院北京基因组研究所大数据中心基因组序列档案中找到,登录号为CRA000698 (gydF4y2Bahttps://bigd.big.ac.cn/gsa/gydF4y2Ba),并在NCBI序列读存档(SRA)中,登录号为PRJNA431059 (gydF4y2Bahttp://www.ncbi.nlm.nih.gov/sra.gydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- ANS:gydF4y2Ba
-
花青素合成酶gydF4y2Ba
- 大:gydF4y2Ba
-
北京基因组学研究所gydF4y2Ba
- 气:gydF4y2Ba
-
查耳酮异构酶gydF4y2Ba
- CHS:gydF4y2Ba
-
查耳酮合酶gydF4y2Ba
- Cy3G:gydF4y2Ba
-
Cyanidin-3-gydF4y2BaOgydF4y2Ba配糖体gydF4y2Ba
- Cy3G5G:gydF4y2Ba
-
Cyanidin-3,5-二gydF4y2BaOgydF4y2Ba配糖体gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- DFRgydF4y2Ba:gydF4y2Ba
-
二氢烷醇4-还原酶gydF4y2Ba
- DHK:gydF4y2Ba
-
DihydrokaempferolgydF4y2Ba
- DHQ:gydF4y2Ba
-
DihydroquercetingydF4y2Ba
- FDR:gydF4y2Ba
-
假发现率gydF4y2Ba
- FLS的gydF4y2Ba:gydF4y2Ba
-
黄酮醇合成酶gydF4y2Ba
- F3h:gydF4y2Ba
-
黄烷酮3-羟化酶gydF4y2Ba
- F3'HgydF4y2Ba:gydF4y2Ba
-
黄酮类化合物3'-羟化酶gydF4y2Ba
- F3’5是什么gydF4y2Ba:gydF4y2Ba
-
类黄酮3 ',5 ' -羟化酶gydF4y2Ba
- FPKM:gydF4y2Ba
-
每百万百万百万千濑群岛的碎片读物映射gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- HPLC:gydF4y2Ba
-
高效液相色谱gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因和基因组百科全书gydF4y2Ba
- NR:gydF4y2Ba
-
非冗余gydF4y2Ba
- NT:gydF4y2Ba
-
核苷酸gydF4y2Ba
- PG3G:gydF4y2Ba
-
Pelargonidin-3 -gydF4y2BaOgydF4y2Ba配糖体gydF4y2Ba
- PG3G5G:gydF4y2Ba
-
Pelargonidin-3 5-di -gydF4y2BaOgydF4y2Ba配糖体gydF4y2Ba
- Pn3G:gydF4y2Ba
-
Peonidin-3 -gydF4y2BaOgydF4y2Ba配糖体gydF4y2Ba
- Pn3G5G:gydF4y2Ba
-
Peonidin-3 5-di -gydF4y2BaOgydF4y2Ba配糖体gydF4y2Ba
- 存在:gydF4y2Ba
-
定量实时聚合酶链反应gydF4y2Ba
- TGICL:gydF4y2Ba
-
家聚类工具gydF4y2Ba
- TT7-1gydF4y2Ba:gydF4y2Ba
-
透明Testa7-1gydF4y2Ba
- UFGTS:gydF4y2Ba
-
尿苷二磷酸 - 葡萄糖:黄酮-3-O-糖基转移酶gydF4y2Ba
参考gydF4y2Ba
- 1.gydF4y2Ba
成福在树脂育种中的进展和品种组的繁殖。int j植物繁殖。2007; 1(2):89-104。gydF4y2Ba
- 2。gydF4y2Ba
吴九,蔡C,程F,Cui H,周H.使用转录组序列的树木牡丹EST-SSR标记的特征与发展。mol繁殖。2014; 34(4):1853-66。gydF4y2Bahttps://doi.org/10.1007/S11032-014-0144-X.gydF4y2Ba.gydF4y2Ba
- 3。gydF4y2Ba
郭东,侯兴国。张娟:不同花色牡丹品种的序列相关扩增多态性分析。acta Horti Sci. 2009;84(2): 131-6。gydF4y2Bahttps://doi.org/10.1080/14620316.2009.11512493gydF4y2Ba.gydF4y2Ba
- 4.gydF4y2Ba
张继,舒Q,刘Z,王H,王L,De Keyser E. Tree牡丹中栽培品种鉴定的两个EST衍生的标志体系。植物细胞批准。2012; 31(2):299-310。gydF4y2Bahttps://doi.org/10.1007/S00299-011-1164-1.gydF4y2Ba.gydF4y2Ba
- 5。gydF4y2Ba
俞H-P,Cheng F-Y,Zhong Y,Cai C-F,Wu J,Cui H-L。从芍药ostii的简单序列重复(SSR)标记的研制研究树牡丹(Paeoniaceae)之间的遗传关系。SCI Hortic。2013; 164:58-64。gydF4y2Bahttps://doi.org/10.1016/j.scienta.2013.06.043gydF4y2Ba.gydF4y2Ba
- 6。gydF4y2Ba
王X,范H,李啊,太阳X,太阳X,王W,郑C.使用保守的DNA衍生多态性标记分析不同颜色树牡丹牡丹的遗传关系。SCI Hortic。2014; 175(1):68-73。gydF4y2Bahttps://doi.org/10.1016/j.scienta.2014.05.026.gydF4y2Ba.gydF4y2Ba
- 7。gydF4y2Ba
黄酮类化合物生物合成途径的转录调控研究进展acta photonica sinica . 2011;62(8): 2465-83。gydF4y2Bahttps://doi.org/10.1093/jxb/erq442gydF4y2Ba.gydF4y2Ba
- 8.gydF4y2Ba
Petroni K,Tonelli C.最近关于生殖器官中的花青素合成的调控的进展。植物SCI。2011; 181(3):219-29。gydF4y2Bahttps://doi.org/10.1016/j.plantsci.2011.05.009.gydF4y2Ba.gydF4y2Ba
- 9.gydF4y2Ba
戴维斯km,albert nw,schwinn ke。从降落灯到模拟:花环的分子调节和色素沉着图案化机制。Funct植物Biol。2012; 39(8):619-38。gydF4y2Bahttps://doi.org/10.1071/FP12195gydF4y2Ba.gydF4y2Ba
- 10.gydF4y2Ba
徐伟,王志强,王志强,等。MYB-bHLH-WDR配合物对黄酮类化合物合成的调控作用。植物科学进展。2015;20(3):176-85。gydF4y2Bahttps://doi.org/10.1016/j.tplants.2014.12.001gydF4y2Ba.gydF4y2Ba
- 11.gydF4y2Ba
MYB - bhlh - wd重复(MBW)色素调节模型的研究进展:添加WRKY因子和利用花青素MYB调控甜菜碱。植物生理学报。2017;58(9):1431-41。gydF4y2Bahttps://doi.org/10.1093/pcp/pcx075gydF4y2Ba.gydF4y2Ba
- 12.gydF4y2Ba
稻崎英,田志华,田志华,等。一种从牵牛花中分离到抑制-突变/增强样转座因子Tpn1的研究。植物细胞。1994;6(3):375 - 83。gydF4y2Bahttps://doi.org/10.2307/3869757gydF4y2Ba.gydF4y2Ba
- 13。gydF4y2Ba
Nishijima T, Morita Y, Sasaki K, Nakayama M, Yamaguchi H, Ohtsubo N, Niki T, Niki T. A Torenia (Torenia fournieri Lind.)。exfourn .)新突变体通过将一个DNA转座子插入R2R3-MYB基因,产生杂色的花。中国科学(d辑:生命科学)2013;82(1):39-50。gydF4y2Bahttps://doi.org/10.2503/jjshs1.82.39gydF4y2Ba.gydF4y2Ba
- 14。gydF4y2Ba
陈艳,毛颖,刘辉,余芳,李树华,尹涛。桃花斑纹相关基因的转录组分析。《公共科学图书馆•综合》。2014;9 (6):e90842。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0090842gydF4y2Ba.gydF4y2Ba
- 15.gydF4y2Ba
Uematsu C, Katayama H, Makino I, Inagaki A, Arakawa O, Martin C. Peace,一种myb样转录因子,调节开花桃“Genpei”的花瓣色素沉淀。[J] .机器人。2014;65(4):1081-94 .]gydF4y2Bahttps://doi.org/10.1093/jxb/ert456gydF4y2Ba.gydF4y2Ba
- 16。gydF4y2Ba
奇美拉与杂色:欺骗的模式。Hortscience。1997;32(5):773 - 84。gydF4y2Bahttps://doi.org/10.21273/HORTSCI.32.5.773gydF4y2Ba.gydF4y2Ba
- 17。gydF4y2Ba
Morita Y, Ishiguro K, Tanaka Y, Iida S, Hoshino A.自发突变的udp -葡萄糖:类黄酮3- O -葡萄糖基转移酶基因赋予日本和普通的牵牛花苍白和暗色。足底。2015;242(3):575 - 87。gydF4y2Bahttps://doi.org/10.1007/s00425-015-2321-5gydF4y2Ba.gydF4y2Ba
- 18。gydF4y2Ba
吴X,龚q,倪x,周y,高z.ufgt:与日本杏的花瓣viegation相关的关键酶。前植物SCI。2017; 8:108。gydF4y2Bahttps://doi.org/10.3389/fpls.2017.00108gydF4y2Ba.gydF4y2Ba
- 19.gydF4y2Ba
Koseki M,Goto K,Masuta C,Kanazawa A.培养杂交曲线'红星'花的星式色彩模式是由Chalcone合酶RNA的序列性劣化引起的。植物细胞生理。2005; 46(11):1879-83。gydF4y2Bahttps://doi.org/10.1093/pcp/pci192gydF4y2Ba.gydF4y2Ba
- 20.gydF4y2Ba
Telias A, Lin-Wang K, Stevenson DE, Cooney JM, Hellens RP, Allan AC, Hoover EE, Bradeen JM。苹果皮肤模式与MYB10的差异表达相关。植物学报。2011;11(1):93。gydF4y2Bahttps://doi.org/10.1186/1471-2229-11-93gydF4y2Ba.gydF4y2Ba
- 21。gydF4y2Ba
关键词:桃,花青素转运体,indel突变,颜色变化J Exp Bot. 2015;66(22):7227。gydF4y2Bahttps://doi.org/10.1093/jxb/erv419gydF4y2Ba.gydF4y2Ba
- 22。gydF4y2Ba
张C,王Y,傅J,Dong L,Gao S,Du D.使用RNA-SEQ技术对葡萄糖供应切割树牡丹的转录组分析。植物细胞批准。2014; 33(1):111-29。gydF4y2Bahttps://doi.org/10.1007/S00299-013-1516-0.gydF4y2Ba.gydF4y2Ba
- 23。gydF4y2Ba
张Y,Cheng Y,Ya H,Xu S,Han J.树牡丹紫色花瓣点区域的转录组测序显示差异表达的花青素结构基因。前植物SCI。2015; 6:964。gydF4y2Bahttps://doi.org/10.3389/fpls.2015.00964gydF4y2Ba.gydF4y2Ba
- 24。gydF4y2Ba
石强,林志,严伟,李凯,郑斌,苗锴。芍药野生群体花中紫红和黄色花瓣着色相关差异表达基因的转录组分析。《公共科学图书馆•综合》。2015;10 (8):e0135038。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0135038gydF4y2Ba.gydF4y2Ba
- 25。gydF4y2Ba
张超,王伟,王勇,高胜,杜东,付军,董磊。洛阳红牡丹(Paeonia suffruticosa)开花过程中花青素的合成与积累。采后生物技术2014;97:11-22。gydF4y2Bahttps://doi.org/10.1016/j.postharvbio.2014.05.019gydF4y2Ba.gydF4y2Ba
- 26。gydF4y2Ba
在高粱中胚轴合成3-脱氧花青素类黄酮3 ' -羟化酶的表达。植物病理学杂志。2004;65(2):101-13。gydF4y2Bahttps://doi.org/10.1016/j.pmpp2004.11.007gydF4y2Ba.gydF4y2Ba
- 27。gydF4y2Ba
徐伯,李杰,张XK,王R,谢LL,柴YR。芸苔内腹腔功能性黄酮3'-羟化酶基因的克隆与分子表征。J植物理性。2007; 164(3):350-63。gydF4y2Bahttps://doi.org/10.1016/j.jplph.2006.03.001gydF4y2Ba.gydF4y2Ba
- 28。gydF4y2Ba
李志刚,李志刚。亚麻属植物花色变异的分子遗传基础。麝猫》2007;89(3):129 - 34。gydF4y2Bahttps://doi.org/10.1017/s0016672307008786gydF4y2Ba.gydF4y2Ba
- 29。gydF4y2Ba
Lee WJ,Jeong Cy,kwon J,Van Kien V,Lee D,Hong SW,Lee H.急剧下降的PAP1过表达在FLS1敲除突变体赋予拟南芥的渗透胁迫耐受性增强。植物细胞批准。2016; 35(11):2369-79。gydF4y2Bahttps://doi.org/10.1007/S00299-016-2040-9.gydF4y2Ba.gydF4y2Ba
- 30。gydF4y2Ba
李志刚,李志刚,李志刚,李志刚。拟南芥黄酮醇合成酶1 (FLAVONOL SYNTHASE 1, FLS1)过表达植物对非生物胁迫的响应。植物生理生化。2016;103:133-42。gydF4y2Bahttps://doi.org/10.1016/j.plaphy.2016.03.010gydF4y2Ba.gydF4y2Ba
- 31.gydF4y2Ba
Brugliera F,Barri-Rewell G,Holton Ta,Mason JG。对应于Petunia hybrida的HT1基因座的黄酮3'-羟化酶cDNA克隆的分离与表征。工厂J. 1999; 19(4):441-51。gydF4y2Bahttps://doi.org/10.1046/j.1365-313x.1999.00539.xgydF4y2Ba.gydF4y2Ba
- 32.gydF4y2Ba
Toda K,Yang D,Yamanaka N,Watanabe S,Harada K,Takahashi R.在大豆黄酮3'-羟化酶基因中的单碱基缺失与灰色的阴部颜色相关。植物mol biol。2002; 50(2):187。gydF4y2Bahttps://doi.org/10.1023/a:1016087221334gydF4y2Ba.gydF4y2Ba
- 33.gydF4y2Ba
Hoshino A, Morita Y, Choi JD, Saito N, Toki K, Tanaka Y, Iida S.三种牵牛花类黄酮3 ' -羟化酶基因的自发突变。植物生理学报。2003;44(10):990-1001。gydF4y2Bahttps://doi.org/10.1093/pcp/pcg143gydF4y2Ba.gydF4y2Ba
- 34.gydF4y2Ba
张娟,王玲,刘宗崇辉,李:牡丹花色研究进展。植物学报。2006;33(6):1383-8。gydF4y2Bahttps://doi.org/10.1360/yc-006-1280gydF4y2Ba.gydF4y2Ba
- 35.gydF4y2Ba
王立生,白石一,桥本F,青木N, Shimizu K, Sakata Y.花瓣花色苷对中、日两种牡丹品种花色的影响。植物学报2001;114(1):33。gydF4y2Bahttps://doi.org/10.1007/PL00013966.gydF4y2Ba.gydF4y2Ba
- 36.gydF4y2Ba
Johnson Et,Yi H,Shin B,OH B-J,Cheong H,Choi G. Cymbidium Hybrida二氢烷酚4-还原酶没有有效地减少二氢戊戊醇以产生橙色肺炎素型花青素。工厂J.999; 19(1):81-5。gydF4y2Bahttps://doi.org/10.1046/j.1365-313x.1999.00502.xgydF4y2Ba.gydF4y2Ba
- 37。gydF4y2Ba
关键词:二氢黄酮醇4-还原酶,氨基酸,底物特异性植物j . 2001; 25(3): 325 - 33所示。gydF4y2Bahttps://doi.org/10.1046/j.1365-313x.2001.00962.xgydF4y2Ba.gydF4y2Ba
- 38。gydF4y2Ba
爱尔兰人VF。拟南芥花瓣:植物有机组织的模型。趋势植物SCI。2008; 13(8):430-6。gydF4y2Bahttps://doi.org/10.1016/j.tplants.2008.05.006.gydF4y2Ba.gydF4y2Ba
- 39。gydF4y2Ba
李X,段J,Luo X,张Y,NIU L. Shi问:解剖学和生物化学不同树牡丹花色的形成机制。J东北森林大学。2019; 47(3):38-43。gydF4y2Bahttps://doi.org/10.3969/j.issn.1000-5382.2019.03.008gydF4y2Ba.gydF4y2Ba
- 40.gydF4y2Ba
杨强,袁涛,孙旭。两个牡丹品种花期花色变化的初步研究。植物学报。2015;42:930-8。gydF4y2Bahttps://doi.org/10.16420/j.issn.0513-353x.2014-0996.gydF4y2Ba.gydF4y2Ba
- 41.gydF4y2Ba
王树华,高军,薛建军,李东,关颖,张晓霞。牡丹(Paeonia suffruticosa)转录组基因的重组测序及其与开花和花器官发育相关的关键基因。BMC基因组学。2019;20(1):572。gydF4y2Bahttps://doi.org/10.1186/s12864-019-5857-0gydF4y2Ba.gydF4y2Ba
- 42.gydF4y2Ba
刘宁,程飞,钟毅,郭旭。牡丹心皮数量变异的转录组和共表达网络分析。BMC基因组学。2019;20(1):683。gydF4y2Bahttps://doi.org/10.1186/s12864-019-6036-zgydF4y2Ba.gydF4y2Ba
- 43.gydF4y2Ba
李勇,常勇,陆军,王锐,何东,杨强,李勇。两种不同砧木上牡丹花瓣转录组的比较分析。植物生长规律。2019;38(4):1287-99。gydF4y2Bahttps://do.org/10.1007/S00344-019-09933-019-09933-0.119-09933gydF4y2Ba.gydF4y2Ba
- 44.gydF4y2Ba
李俊杰,张晓峰,赵晓强。中国的牡丹。北京:中国大百科全书出版社;2011.gydF4y2Ba
- 45。gydF4y2Ba
赵德,姜y,宁c,萌j,林某,丁二,陶茹的转录组序列测序培养黄色牡丹黄色形成的花青素生物合成基因的协调表达(gydF4y2BaPaeonia Lactiflora.gydF4y2Ba棺罩)。BMC基因组学,2014;15(1):689。gydF4y2Bahttps://doi.org/10.1186/1471-2164-15-689gydF4y2Ba.gydF4y2Ba
- 46。gydF4y2Ba
王y,宋f,zhu j,张某,杨y,陈t,唐b,dong l,ding n,张Q.GSA:基因组序列档案。基因组学蛋白质组学生物信息学。2017; 15(1):14-8。gydF4y2Bahttps://doi.org/10.1016/j.gpb.2017.01.001gydF4y2Ba.gydF4y2Ba
- 47。gydF4y2Ba
2018年大数据中心的数据库资源。核酸Res。2017; 46(D1):D14-20。gydF4y2Bahttps://doi.org/10.1093/nar/gky993gydF4y2Ba.gydF4y2Ba
- 48。gydF4y2Ba
张Y,徐某,程y,彭Z,汉族,花青素相关基因的转录组分析揭示了光强度对红叶生菜中花青素生物合成的影响。peerj。2018; 6:E4607。gydF4y2Bahttps://doi.org/10.7717/peerj.4607gydF4y2Ba.gydF4y2Ba
- 49。gydF4y2Ba
Grabherr Mg,Haas Bj,Yassour M,Levin JZ,Thompson Da,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q.从RNA-SEQ数据的全长转录组件没有参考基因组。NAT BIOTECHNOL。2011; 29(7):644-52。gydF4y2Bahttps://doi.org/10.1038/nbt.1883gydF4y2Ba.gydF4y2Ba
- 50。gydF4y2Ba
黄雪梅,梁飞,黄雪梅,等。tiger基因指数聚类工具(TGICL):一个用于大型EST数据集快速聚类的软件系统。生物信息学。2003;19(5):651 - 2。gydF4y2Bahttps://do.org/10.1093/bioinformatics/btg034gydF4y2Ba.gydF4y2Ba
- 51。gydF4y2Ba
Langmead B, Salzberg SL.快速间隙读对齐与领结2。Nat方法。2012;9(4):357 - 9。gydF4y2Bahttps://doi.org/10.1038/nmeth.1923gydF4y2Ba.gydF4y2Ba
- 52。gydF4y2Ba
基于RNA-Seq的哺乳动物转录组的定位和定量研究。Nat方法。2008;5(7):621 - 8。gydF4y2Bahttps://doi.org/10.1038/nmeth.1226gydF4y2Ba.gydF4y2Ba
- 53。gydF4y2Ba
Audic S,Claverie JM。数字基因表达谱的意义。Genome Res。1997年; 7(10):986-95。gydF4y2Bahttps://doi.org/10.1101/gr.7.10.986gydF4y2Ba.gydF4y2Ba
- 54。gydF4y2Ba
Livak KJ, Schmittgen TD。使用实时定量PCR和2−ΔΔCT方法分析相关基因表达数据。方法。2001;25(4):402 - 8。gydF4y2Bahttps://doi.org/10.1006/meth.2001.1262gydF4y2Ba.gydF4y2Ba
- 55.gydF4y2Ba
魏彦杰,李丹,赵志超,魏晓青。牡丹实时荧光定量PCR内参基因的筛选。农业生物技术学报。2012;20(5):521-8。gydF4y2Bahttps://doi.org/10.3969/j.issn.16747968.2012.05.008gydF4y2Ba.gydF4y2Ba
- 56.gydF4y2Ba
李家,汉族,胡y,杨杰。树牡丹花卉发育过程中对数量实时PCR的参考基因的选择(gydF4y2BaPaeonia suffruticosa.gydF4y2Ba)。植物学报2016;7:516。gydF4y2Bahttps://doi.org/10.3389/fpls.2016.00516gydF4y2Ba.gydF4y2Ba
- 57.gydF4y2Ba
阵伤SJ,弯曲AF。花卉浸:农杆菌介导的拟南芥转化的简化方法。工厂J. 1998; 16(6):735-43。gydF4y2Bahttps://doi.org/10.1046/j ,1365-313x.1998.00343.x.gydF4y2Ba.gydF4y2Ba
致谢gydF4y2Ba
我们非常承认郑峰彭有助于讨论。gydF4y2Ba
资金gydF4y2Ba
该工作得到了中国国家自然科学基金(31400602),河南省科技突破项目(172102310054和202102110046),以及洛阳师范大学的应用科技研究基金(2015年YYJJ-003)。资金机构对数据的研究和收集,分析和解释的设计没有贡献,并撰写稿件。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
YZZ和SX设计了研究。YZZ和SX进行了实验。YZ,HM和YC分析了数据。YZZ写了稿件,JH和YC修订了稿件。所有作者阅读并认可的终稿。gydF4y2Ba
相应的作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
额外的文件1:gydF4y2Ba
图S1。gydF4y2Ba在蓝色和蓝色花瓣之间的差异。对三个生物重复进行转录组测序。以“概率≥0.8”和“log2比值≥1”为阈值确定DEGs。橙色的三角形表示上调基因,绿色的正方形表示下调基因,灰色的圆点表示在两个转录组之间没有显著变化的基因。gydF4y2Ba
附加文件2:gydF4y2Ba
图S2。gydF4y2Ba验证小插入gydF4y2BaF3'HgydF4y2Ba互补脱氧核糖核酸。a.蓝花f3’h cDNA片段序列;片段序列的gydF4y2BaF3'HgydF4y2Ba无氰花中的cDNA。gydF4y2Ba
额外的文件3:gydF4y2Ba
图S3。gydF4y2Ba从“Qiao”的氰化物和酰氰化物分支的DFR氨基酸对齐。'PSDFR(GenBank登录号kJ466968)获得gydF4y2BaPaeonia suffruticosa.gydF4y2Ba品种“洛阳红”。gydF4y2Ba
附加文件4:gydF4y2Ba
图S4。gydF4y2Ba花瓣细胞层花青素积累的检查。在显微镜下拍摄表皮细胞(原始放大倍数400倍)和横切面(原始放大倍数100倍)的照片。gydF4y2Ba
附加文件5:gydF4y2Ba
表S1。gydF4y2Ba装配质量统计。gydF4y2Ba表S2。gydF4y2BaKegg富集氰和亚尾花之间的果酒。gydF4y2Ba表S3。gydF4y2BaqRT-PCR的引物。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
张,Y.,Cheng,Y.,徐,S。gydF4y2Baet al。gydF4y2Ba树牡丹杂色的花朵显示出一个小插入gydF4y2BaF3'HgydF4y2Ba无氰花部分的基因。gydF4y2BaBMC植物BIOL.gydF4y2Ba20.gydF4y2Ba211(2020)。https://doi.org/10.1186/s12870-020-02428-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02428-xgydF4y2Ba
关键字gydF4y2Ba
- 牡丹gydF4y2Ba
- 组合成花gydF4y2Ba
- 转录组gydF4y2Ba
- 花青素gydF4y2Ba
- 类黄酮3 ' -羟化酶gydF4y2Ba(gydF4y2BaF3'HgydF4y2Ba)基因gydF4y2Ba