摘要
背景
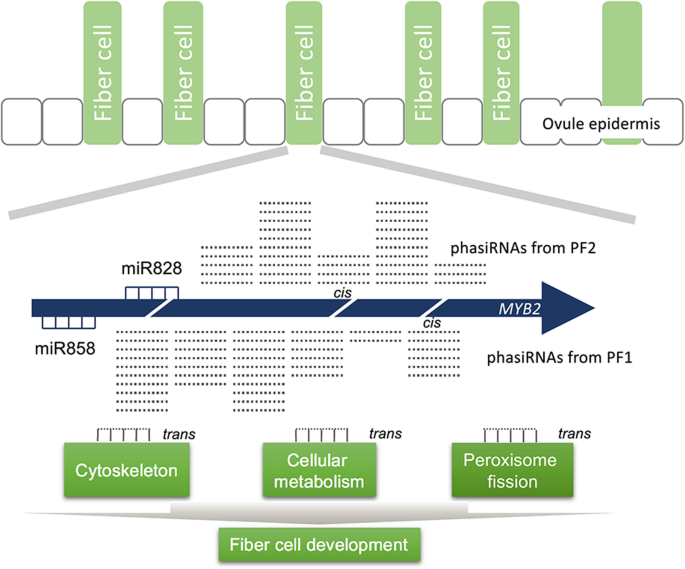
阶段性小干扰RNA (phasiRNA)主要来源于22-nt miRNA靶向位点。GhMYB2是miR828和miR858在phasirna生成过程中的靶基因,在棉纤维细胞命运决定中具有潜在作用。
结果
在本文中,通过对分相评分和分相rna分布模式的评估,我们发现来自GhMYB2分别来自22-nt miR828和21-nt miR858的3 '切割片段。这两个miRNA靶向位点在一个基因座的转录本上启动了两个相位框架。通过RNA连接酶介导的cDNA末端快速扩增(RLM-RACE),我们进一步证明了来自这两个相框的相RNA在遗传过程中发挥了作用独联体监管的GhMYB2。phasirna来源于GhMYB2均在体细胞组织中表达,尤其是在花药和下胚轴中。我们进一步利用我们之前的小RNA测序数据以及公开数据库中发表的棉纤维胚珠、花药、下胚轴和胚性愈伤组织的降解数据,验证了phasiRNAs的表达、分期模式和功能。
结论
本研究提供了相rna调控细胞凋亡的分子机制GhMYB2位点。
背景
阶段性小干扰rna (phasiRNAs)广泛存在于多种植物基因组中,从藻类和苔藓物种到单子叶植物和双子叶植物[1]。第一个报道的相RNA是来自长非编码RNA位点的反式小干扰RNA (tasiRNA),即助教基因:TAS1/2, TAS3和TAS4[2]。作为一种特殊类型的相rna, tasirna起源于助教基因转录和功能作用于反式在转录后水平调控mRNA [3.]。启动phasiRNA生成的mirna被称为phasiRNA触发器[4]。TAS1/2是由miR173 [2,5,6]。TAS3是由miR390 [5,7,8,9),TAS4by miR828 [10,11,12,13]。除了由单个miRNA触发外,还有一种替代的phasiRNA生成模式,称为双命中模型[7]和phasiRNA的产生可以由两种不同的小RNA触发,正如在矮牵牛基因组中观察到的那样,phasiRNA的产生可以由两种不同的小RNA靶向触发[14]。
虽然在过去的十年中已经探索了phasiRNAs的生物发生,但我们对phasiRNAs的表达和相位模式的理解仍然有限。phasiRNA分布研究证实了其组织特异性表达模式。例如,phasiRNAs是被子植物花药中发现的主要小RNA类型[15]。此外,对玉米花药小RNA谱的分析表明,在细胞发育过程中,phasiRNA的表达会发生变化[16]。根据小RNA的长度,phasiRNA模式可分为21-nt和24-nt的分相间隔。在细胞命运规范和分化的各个阶段,21-nt phasiRNAs比24-nt phasiRNAs更活跃,而减数分裂与24-nt phasiRNAs的激活有关。最新的DNA修饰分析表明,减数细胞中21-nt和24-nt组的phasiRNAs位点上的CG、CHG和CHH甲基化水平都很高[15]。这些特征表明,phasiRNAs在花药发育和潜在的表观遗传修饰中发挥着重要作用。
近年来对植物相RNA的研究表明,相RNA作为小干扰RNA (small interfering RNA, siRNA)在调控关键农艺性状中起着重要作用。例如,miR2118在水稻穗发育阶段表达[17]及其他种子植物品种[18]。进一步的遗传学和转基因证据表明,miR2118触发Pms1水稻光敏雄性不育(PSMS)产生相rna的位点[j]19]。选择性研究表明,miR828靶点参与非生物胁迫反应拟南芥[13],苹果[20.]和红薯[21],以及类黄酮的生物生成[22,23]和棉花表皮纤维细胞的发育[24]。
phasiRNA的功能模式包括按照反向互补方式切割靶基因序列。一些TAS2衍生的sirna可以通过这种方式识别五肽重复(PPR)蛋白编码基因[25]。最近的一项功能研究报道,水稻AGO5同源物MEL1优先结合phasiRNAs [26]。这种现象与mir2118靶向序列和mir2118触发的phasiRNAs高度相关。
棉花基因组中的PhasiRNAs在很大程度上仍然是未知的。在陆地棉中有11个基因被预测为助教基因(27]。此外,在海岛棉中已鉴定出约200个相位基因座[28]。此前,我们在棉花基因组中首次报道了一个功能性相rna衍生基因,GhMYB2,被miR828和miR858靶向[24]。GhMYB2编码MYB转录因子,该因子在植物表皮细胞命运决定中起作用。启动子活性测定和mRNA原位数据表明GhMYB2在细胞分化阶段主要在棉籽纤维细胞中表达[29,30.]。miR858对相rna生物发生的影响GhMYB2仍然是未知的。的功能GhMYB2-产生的phasirna尚不清楚。在这里,我们检查了我们之前研究的棉花叶片和胚珠组织的小RNA测序数据,以及我们从在线发表的数据库中获得的棉花纤维胚珠、花药、下胚轴和胚性愈伤组织(EC)的mRNA降解数据。结合这些来源,我们进一步探索了由两个microrna靶向位点驱动的新的分相模式GhMYB2和独联体-调节作用GhMYB2-衍生的phasiRNAs在棉纤维分化的早期阶段。
结果
棉花GhMYB2分两个阶段产生phasirna
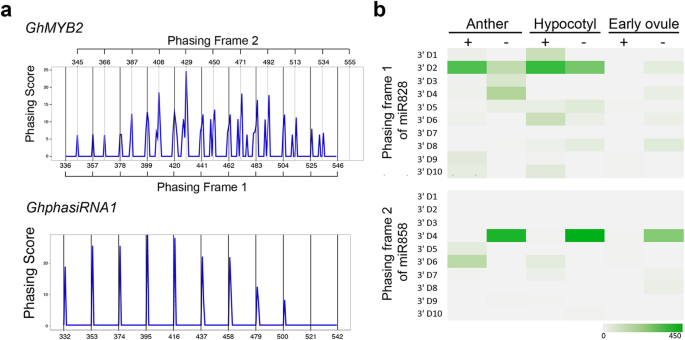
phasirna衍生基因在形成dsRNA后发生相变以产生同相siRNA,这在模式植物中有报道。拟南芥[31]。来检验是否GhMYB2可以推导出siRNA的相位,我们采用相位评分的计算来评价GhMYB2利用陆地棉胚珠组织的小RNA文库(陆地棉,加入Texas Marker-1, TM-1)在0 DPA(花后第一天)收获。如图所示。1的相位曲线模式GhMYB2在miR828切割位点的3′端出现了清晰的峰。这证实了我们之前的报道GhMYB2miR828触发的衍生phasiRNAs [24]。在phasirna衍生的候选基因中,Gh_D07G1901(miR390靶向)预计相当于GhphasiRNA1在棉花基因组中。相位曲线打开GhMYB2不像那些有规律吗GhphasiRNA1。虽然可以清楚地观察到21-nt phasiRNA间隔,但在胚珠和其他组织中也存在不同的峰。只有…的行动GhphasiRNA1在21 nt间隔内,下胚轴产生平滑的相位曲线(图2)。1a).我们通过分析交替峰的间隔来检验它们的模式。在曲线中观察到21-nt的间隔(图2)。1a).进一步检测phasiRNA的丰度和位置表明GhMYB2从miRNA858靶点的3 '切割位点得到相位曲线(图2)。1b、补充表1)。此外,在胚珠和花药组织中也观察到反复出现的小峰。因此,我们确认GhMYB2可以在miR828和miR858的3 '切割片段上相生siRNA。相应的,我们将miR828的3′裂解片段命名为phasing frame 1 (PF1)。miR858的替代相位框架被命名为相位框架2 (PF2)。在PF2相中发现的phasirna多于PF1相,如图所示。1A和b。
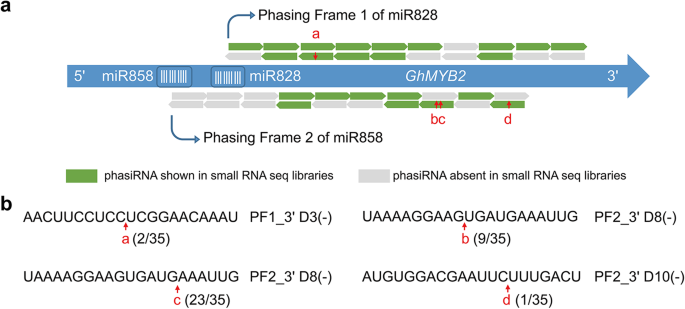
与miR390触发的二次命中模型的交替相位相反[7],表示miR828与miR858之间的距离GhMYB2短至12个基点。这两个miRNA靶向位点之间没有足够的相位空间(一个小RNA在相位中为21 nt),因为大多数phasiRNA触发器是22 nt的miRNA。根据对两个分相框架的分相rna的观察,分相过程应该分别从独立转录本上的miR858和miR828切割片段开始。由于miR858本身不能触发phasiRNA的发生,因此在内源miR858的切割位点上启动了phasiRNA的分期过程GhMYB2可能受到miR828触发的相变的影响。由两个miRNA 3 '裂解片段触发phasiRNA发生的两个miRNA位点应该位于不同的起始位点。
GhMYB2衍生的phasiRNA可以降解GhMYB2通过顺式效果
的两个相位框架GhMYB2在相位评分曲线上显示为两个主要的相位峰(图2)。2a).这些phasiRNAs可能通过在in的起始位点上形成dsRNA来加速mrna的降解独联体。为了验证这一假设,我们检测了GhMYB2通过phasiRNAs表达mRNA。RNA连接酶介导的cDNA末端快速扩增(RLM-RACE)使用从主动表达相RNA的花药中提取的总RNA进行。结果表明:GhMYB2被miR828和miR858产生的phasirna切割。检测到的裂解位点与phasiRNA预测的裂解位点完全一致。裂解位点a(如图所示)。2b)由pf1衍生的phasiRNA PF1_3 ' D3(−)产生。裂解位点在PF1_3 ' D3(−)的第10 ~ 11个核苷酸之间。这种模式与植物基因组中mirna介导的mRNA切片相似。在由pf2衍生的phasiRNA PF2_3 ' D8(−)产生的裂解位点b上也观察到类似的模式。PF2_3 ' D8(−)在第15和第16个核苷酸之间也产生了另一个裂解位点c。切割位点d位于pf2衍生的phasiRNA PF2_3 ' D10(−)上。虽然由于DNA片段克隆效率的不同,该方法不能用于切割产物的定量测定,但该结果提供了直接证据GhMYB2-衍生的phasiRNAs可以降解GhMYB2记录在独联体。
我们进一步检测了GhMYB2mRNA在花药、下胚轴和胚性愈伤组织(EC)中的表达(补充表2(见方法)。的数量GhMYB2花药降解组的图谱读数明显高于下胚轴和EC降解组(补充图2)。2(典型的是Wilcoxon秩和检验P< 0.01)。MYB109,而GhphasiRNA1则不遵循这种模式(补充图2)。2)。这些数据表明GhMYB2转录本优先降解其自身的副相rna独联体在花药。
phasiRNAs的组织特异性表达GhMYB2位点
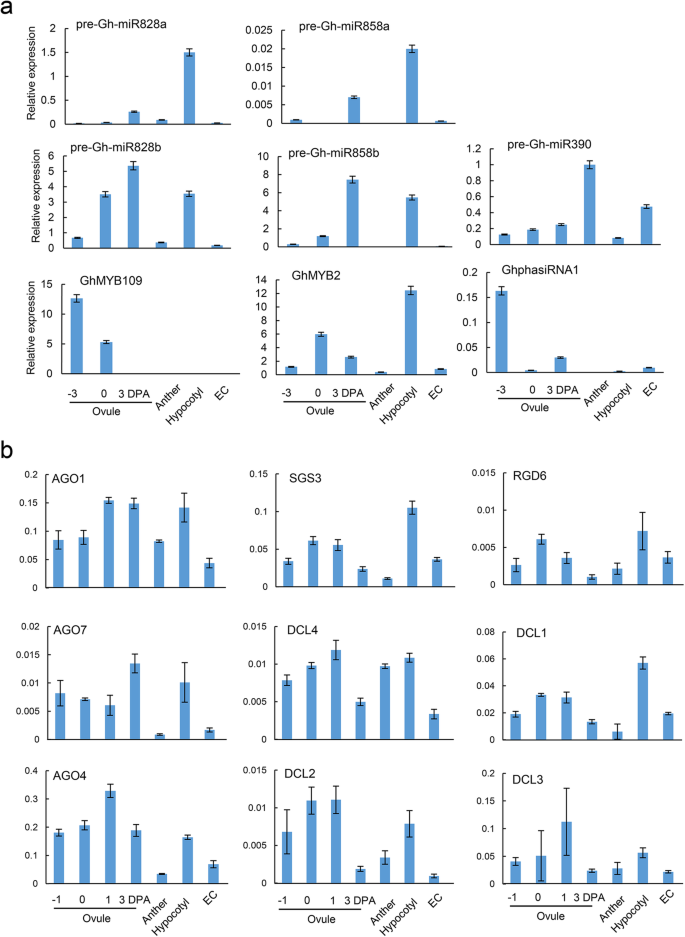
为了确定phasiRNA的产生是否与起源基因的表达相关,我们检测了两种miRNA前体和GhMYB2在棉花胚珠、花药、下胚轴和EC组织中进行qRT-PCR。结果表明,GhmiR828和GhmiR858前体在花后0天和3天的胚珠(DPA)、下胚轴中表达水平较高,但在DPA - 3天的早期胚珠、花药和EC组织中表达水平较低(图2)。3.a、补充表6和补充图。3.)。的GhMYB2−3 DPA、花药和EC组织的下胚轴组织表达水平最高,早期胚珠表达水平最低,0和3 DPA的早期胚珠表达水平介于两者之间(图2)。3.a). 0 DPA和3 DPA胚珠中miR828和miR858的丰富积累与先前的发现一致[24]。值得注意的是,与0 DPA胚珠相比,miR828和miR858水平相对较高的3 DPA胚珠表现相对较低GhMYB2mRNA表达的精确调控GhMYB2在棉纤维发育过程中通过miRNA表达基因。
触发miRNA的分相RNA表达模式及其靶基因和参与tasiRNA生物发生的基因。一个, qRT-PCR分析包括GhmiR828、GhmiR858及其靶基因在内的mirna前体形式GhMYB2。以GhmiR390及其靶基因GhphasiRNA1作为phasiRNA生成的阳性对照。GhMYB109为miR828靶向基因,作为phasiRNA衍生的阴性对照。b, qRT-PCR分析参与tasiRNA生物发生的基因,包括AGO1,SGS3,RDR6,DCL4。基因AGO4,AGO7,DCL1,DCL2和DCL3以花后−1、0、1和3天的早期胚珠、花药、下胚轴和种子的基因冗余作为内部对照。每个组织进行3次生物重复
的组织特异性表达的分子基础GhMYB2派生phasiRNAs
棉花基因组经历了多轮全基因组复制。我们推测棉花基因组在phasiRNA生物发生过程中携带冗余蛋白。为了验证这一假设,我们检测了Ago1, sg3, rdr6和DCL4利用mRNA测序数据和qRT-PCR对棉花胚珠、花药、下胚轴和EC组织进行研究。我们发现,负责phasiRNA生物发生的基因在早期胚珠组织中活跃表达,这与受精胚珠中的小RNA活性相对应(图2)。3.)。这些基因在花药组织中的表达较低。AGO1在胚珠和下胚轴组织中表达相似,但RDR6和DCL4下胚轴的表达明显高于其他组织(图2)。3.b).所有这些基因表达模式都与来源于GhMYB2下胚轴(图2)3.a).而EC组织中phasiRNA生物发生的缺失对应于GhphasiRNA1和GhphasiRNA1的未检测水平GhMYB2未分化EC组织中的phasiRNAs。在生殖组织中,AGO1表达非常活跃(图2)。3.B),类似于在水稻中观察到的模式[32],我们之前提到过。的表达式DCL基因在下胚轴组织中的表达也高于花药组织(图2)。3.b)我们知道拟南芥,的功能DCL4可以由DCL1。但不像21-nt的最终产品DCL4,DCL1产生更多22-nt siRNA [33]。同样,GhphasiRNA1,和GhMYB2在棉花基因组中,它们不仅产生21 nt的phasiRNAs,而且还可以产生18-29 nt的sirna(补充数据集)1)。为了揭示棉花中相rna -生物发生蛋白的潜在冗余功能,我们在全基因组范围内扩展了相应的同源物。的表达模式以前,rdr6, SGS和DCL通过mRNA-seq分析,对14个棉花组织的同源物进行了广泛的检测。这些基因总体上显示出明显的组织特异性模式,这与qRT-PCR分析显示的模式相似(补充图2)。2、补充表6)。这些结果排除了qRT-PCR内控基因选择带来的潜在误差。因此,AGO1可能主导miRNA/mRNA的切割,而DCL1和DCL4可能主导dsRNA的最终切割。与未分化细胞相比,Argonaute和DCL编码基因在体细胞组织中的主动表达活性可能是phasirna表达丰富的原因。
GhMYB2棉花基因组中的位点在体细胞组织中产生phasirna,而在未分化的细胞中不产生phasirna
GhMYB2是一种在棉花纤维组织中产生相rna的编码基因[24]。phasiRNA触发器miR858和miR828GhMYB2基因表达显示组织特异性模式与GhMYB2在纤维细胞调节中的功能一致。为了检测GhMYB2因此,我们研究了棉花基因组中可能产生相rna的基因。我们之前的研究预测了这一点GhMYB109被miR828靶向产生phasirna。然而,小RNA定位和miRNA切割试验表明GhMYB109并不是棉花中产生相rna的基因。因此,在本研究中GhMYB109作为phasiRNA产生的阴性对照。我们利用miRNA靶向的反向互补规则预测了陆地棉基因组中miR173和miR390的靶位位点(g .,TM-1),允许三次错配和一次T-G凸起。然后,我们确定了棉花基因组中45个预测的miR173靶点和13个预测的miR390靶点作为潜在的phasirna衍生位点(补充表)3.)。GhphasiRNA1在早期胚珠、花药、下胚轴和EC中显示了特别丰富的小RNA转录本(图2)。4)。因此,选择它们作为phasirna衍生棉花基因的阳性对照。最后是棉花GhUBL1选择编码泛素的基因作为非mirna靶向对照。
GhMYB2在不同的棉花组织中产生phasirna。小RNA定位结果显示了tasiRNA在dna上的分布GhMYB2从接穗TM-1 (一个)、下胚轴和胚性愈伤组织(EC)b)。通过每个组织样本的每百万读取数(CPM)将小RNA作图比较归一化。A和D亚基因组等位基因GhMYB2和GhMYB109提出了。由于多态性很少,小RNA定位密度在两个等位基因之间没有明显差异。GhMYB109为miR828靶向的阴性对照。Gh_D07G1901(miR390靶向)预计与棉花基因组中的GhphasiRNA1相当,因此可以作为phasiRNA衍生基因的阳性对照。UBL1-Gh非mirna靶向位点的阴性对照是什么
小RNA密度图使用来自每个样本的完美映射reads。为了弥补每个组织样本生物复制的不足,我们选择了三个体细胞组织,早期胚珠,花药和下胚轴作为独立的生物样本,与未分化的EC组织进行比较(补充表)2)。
我们观察到GhMYB2来自棉花A和D亚基因组的位点在胚珠、花药和下胚轴中产生高密度的小RNA分布(图2)。4),类似于GhphasiRNA1。由于A和D等位基因之间的多态性较低,GhMYB2小RNA密度没有明显的等位差异(图2)。4a).如预期,GhMYB109,其模式与…相似GhUBL1在任何组织中都没有产生高水平的小RNA(图2)。4)。此外,我们注意到GhMYB2也不GhphasiRNA1在胚性愈伤组织(EC)中产生了大量siRNA,如图2所示。4b.这些结果表明GhMYB2由于组织特异性的表达模式,在已分化的体细胞中可以表达和产生phasiRNAs,而在未分化的EC细胞中则不能表达和产生。
GhMYB2衍生的phasirna在反式-调节下游指标
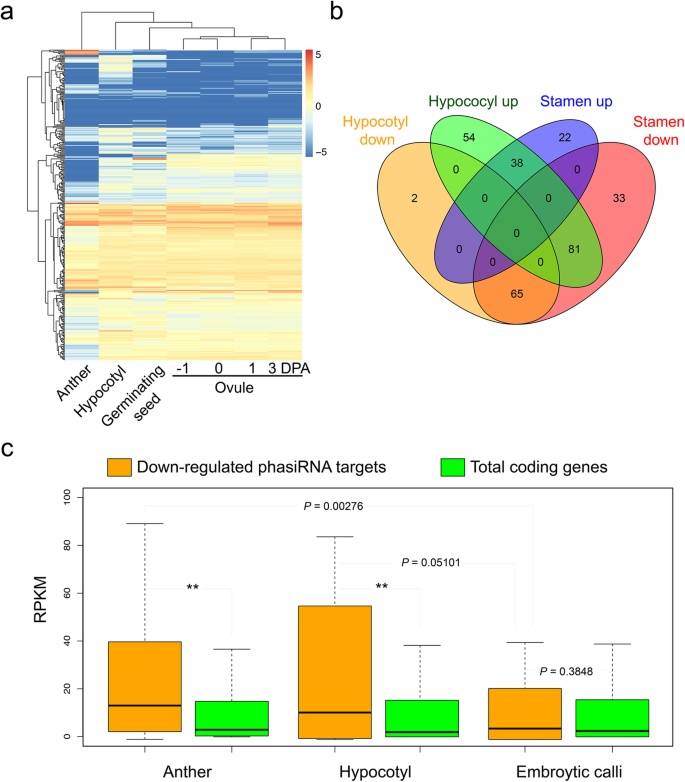
进一步研究的潜在功能GhMYB2我们根据反向互补规则预测棉花基因组中的phasiRNA靶标,允许2次错配(补充数据集)2)。为了避免随机小RNA的影响,我们只选择了来自胚珠、花药和下胚轴的重叠相RNA进行靶标预测研究。phasiRNA靶点在棉花胚珠、花药和下胚轴组织中的表达情况如图热图所示。5a. phasiRNA靶基因在花药和下胚轴中的差异表达基因(DEGs)用VENN图表示,如图所示。5b.只有41.3%(38/92)和63.3%(38/60)的靶基因是下胚轴和花药中常见的上调基因。然而,97.2%(65/67)下调的下胚轴靶基因与花药靶基因重叠。花药中下调的靶基因在下胚轴中显著富集(Fisher’s exact test;P< 6.54 e−15)。在花药和下胚轴中常见的、下调的基因比例很高,这表明这些组织中的phasirna在相似的功能途径中靶向相似的基因。氧化石墨烯富集分析表明,在高富集因子条件下,这些phasiRNA靶点参与了质膜上的细胞骨架锚定(补充图2)。4)。细胞骨架的排列与细胞的形状结构有关。我们发现这一类下调基因的富集反映了其独特的功能GhMYB2在特定的细胞形态中,特别是在纤维细胞中,作为phasirna衍生基因(补充表4)。
phasiRNA靶基因表达谱。一个:热图显示预测的phasiRNA靶点在棉花基因组中的表达模式。PhasiRNAs来源于GhMYB2位点。只选择在胚珠、花药、下胚轴组织中一致表达的保守的tasirna。根据其组织表达模式对phasiRNA靶点进行聚类。b:预测的phasiRNA靶基因表达模式差异的维恩图。所有的比较结果都与早期胚珠组织相反。c,下调的phasiRNA靶点在花药、下胚轴和EC组织中的降解分析。用RPKM值表示花药、下胚轴和EC组织中降解片段的丰度的方框图。每个箱形图的中心线表示中位数。黄色表示花药和下胚轴组织中下调的phasiRNA靶点群体。编码基因降解片段的总水平作为背景对照(绿色)。的P值采用Wilcoxon秩和检验计算
花药富含21-和24-nt相rna [16]。为了研究抑制花药和下胚轴中phasiRNAs靶表达是否由于GhMYB2我们将65个phasiRNA靶点的降解片段与总基因组进行了比较。为了避免随机降解片段的影响,在phasiRNAs靶向位点的5 '端上绘制的reads被过滤掉。在花药和下胚轴中,65个phasiRNA靶点降解的中位数水平是整个基因组的两倍(图2)。5c) (Wilcoxon秩和检验,花药vs ECP= 0.0276;下胚轴与ECP= 0.05101)。在花药、下胚轴和EC组织中,phasiRNA目标降解片段显著高于总编码基因背景(通常为Wilcoxon秩和检验)P< 2.2 e -16)。因此,65个phasiRNA靶基因的表达差异可能是由phasiRNA引起的反式——监管。这表明由GhMBY2可通过增加靶基因mRNA的降解来下调靶基因的表达。
讨论
GhMYB2棉花基因组中有两个相rna合成的分相框架
PhasiRNAs是一种独特的小RNA。它可以由长度为21 nt或22 nt的触发mirna衍生[34]。在过去的十年中,已经在苔藓中发现了几种phasiRNA触发器[35],橄榄[36]、杉木[37],苹果[20.],大米[38],棉花[27,39]、高粱[40],龙眼树[41]和大豆[42]。phasiRNA触发的一种模型由“一次命中”系统组成,通常涉及22个nt的microRNA触发。MiR173是植物基因组中保守的相rna触发器。phasiRNA生物发生的另一种模式由“双击”系统组成,每个mrna转录物使用两个21-nt microrna [34]。代表助教“双击”模式基因携带两个miR390靶向位点,在苔藓和拟南芥[7]。这些mrna在200-300 nt区域携带两个miR390反向互补位点。研究发现,PhasiRNAs在5′期至miR390切割位点的两个miRNA靶向位点之间的区域具有活性。另据报导,该地区的分期方案也有[7]。对于这种交替阶段的原因有两种假设:独联体-激活其中一个phasirna,或激活5 ' miR390切割位点。
据报道,苹果和棉花基因组中的一些miR828靶向位点被两个miRNAs靶向;miR828和miR858 [20.,24]。两面夹攻GhMYB2可以在3 ' miR828切割位点产生phasirna [20.,24]。在我们目前的研究中,我们观察到GhMYB2位点在3 ' miR858切割位点的交替相框中主动生成相rnaGhMYB2可以在多种组织中产生PF1和PF2上的phasirna。
由于存在双相位框架的轨迹,相位分数曲线为GhMYB2在每个相位显示双峰。这不是一个典型的相位曲线。在phasiRNAs分析中从未考虑过其他分期小rna。因此,传统的phasiRNA预测评估遵循一个位点上一个相框的原则,可能低估了基因组中phasiRNA的数量。这一发现可能反过来影响phasirna功能的分析。
棉花中phasiRNA表达的组织特异性
起始位点的phasirna丰度因组织而异。GhphasiRNA1在生殖组织中产生phasiRNAs(图2)。4),GhMYB2在营养组织中比在胚珠中产生更多的phasirna。4)。因此,phasiRNAs的生物发生效率很可能在不同的组织中有所不同。
phasiRNAs的生物发生需要一组独特的蛋白质,但集体数据揭示了所涉及的Argonaute和DCL蛋白家族的功能冗余。在拟南芥,一种Argonaute蛋白被认为是22-nt mirna靶向mRNA切片所必需的[43]。在最近的报道中,这些衍生的21-nt phasiRNA在一个细胞中被检测到ago1零突变体[43]。AGO2和AGO7在phasiRNA生物发生中的同化作用[j]6,8,44]在Argonaute蛋白家族中是多余的。类似地,dicer样蛋白DCL1-4将dsRNA消化成小RNA [4],而几种不同的DCL蛋白执行与miRNA、siRNA和phasiRNAs相关的功能。DCL4特异性识别rdr6生成的双链RNA并将其切割成21 nt RNA [2]。但在没有DCL4的情况下,DCL1采用了这一功能,其产物为长度为22 nt的阶段性小rna [33]。
我们观察了phasiRNA生物发生相关基因在棉花组织中的表达模式。这些结果表明,phasiRNAs位点的相变主要依赖于Argonaute和dicer样蛋白的活性,而这种活性在不同组织中是不同的。的活动Dcl1, dcl2, dcl3和DCL4在早期胚珠和纤维组织中持续高表达(图2)。3.b)。RDR6和DCL4下胚轴mRNA表达模式相同。DCL1, DCL2和DCL3均在下胚轴中活跃表达(图2)。3.b).下胚轴中AGO1、AGO4和AGO7 mRNA的表达也很高(图2)。3.b).因此,冗余的Argnaute和dcl很可能将长dsRNA切割成不同长度和相的小rna。
的独联体- phasiRNAs的功能
PhasiRNAs在植物基因组中很常见,但对这些小rna的生物学功能知之甚少。2014年,对不同发育阶段的玉米花药进行了小RNA测序,发现phasiRNA的表达与减数分裂过程有关[15,16]。在花药发育过程中,21-nt phasiRNAs的表达先于24-nt phasiRNAs的表达,说明21-nt phasiRNAs和24-nt phasiRNAs在减数分裂中起着不同的作用。对玉米小RNA的分析也表明,phasiRNAs是花药组织中的优势小RNA群体[16]。这些发现开始阐明21-nt phasiRNAs的具体功能。然而,这些phasirna的确切功能仍然未知。
作为回应,我们试图通过RNA降解数据分析来证明phasiRNA可能在mRNA降解中发挥作用独联体监管(无花果。6)。phasiRNA的原始位置可能是phasiRNA的主要靶点,特别是在花药中。降解的碎片GhMYB2在phasiRNA生成水平高的组织中,mRNA富集。这一现象似乎表明,phasiRNA以与miRNA相似的方式靶向原始mRNA,以指导mRNA的切割。然而,我们也发现降解片段在下胚轴组织中不富集,尽管有phasiRNAs表达。因此,mRNA降解是组织特异性的。这最终表明mRNA的降解必须受到基因组中除小RNA之外的其他未知元素的控制。
的反式- phasiRNAs在基因沉默中的作用
小RNA在纤维发育中起着独特的作用,其过程可以反映在phasiRNA的功能上。叶片和胚珠的小RNA谱在纤维发育的早期阶段以及受精期间和受精后明显不同[45]。绒毛纤维的分化是由N1的基因,GhMYB25-like / GhMML3[46];绒毛的抑制是由小rna引起的GhMML3轨迹。小RNAGhMML3在N1是由?的正义和反义转录本形成的dsRNA产生的GhMML3。
虽然生物发生途径不同,但phasiRNAs可以以类似于天然反义转录物(Natural anti - sense transcripts, NATs)中的小RNA的方式影响基因组[47]。集体数据表明,nat衍生的小rna参与从头DNA甲基化和组蛋白修饰[46]。这些小rna可以遵循反向互补碱基对规则,以较高的精度找到演绎的靶标位置。在此,我们预测了棉花基因组中的phasiRNA靶点,这些靶点似乎在下胚轴中受到抑制。发现下胚轴组织中产生的phasiRNA最高GhMYB2在所有被检查的组织中。下胚轴组织中这些基因的抑制表明phasiRNAs与其潜在靶标之间存在相关性,这意味着phasiRNAs可能在反式-基因调控(图2)6)。
结论
在本研究中,我们广泛地分析了GhMYB2派生phasiRNAs。我们整合了小RNA序列、mRNA序列和mRNA降解数据,研究了phasiRNA在棉花基因组中的行为和功能。使用棉GhMYB2,TAS1/2,TAS3作为研究的例子,我们发现GhMYB2可以在两个相位框架上生成相位rna;一个位于miR828的3 '切割端,另一个位于miR858靶位点。已知的两个miR390位点对TAS的两次触发仅呈现一个相位帧。这种phasiRNA生物发生的单相框架原理激发了大量的全基因组phasiRNA检测拟南芥水稻、玉米和许多其他物种。我们在一个基因座上发现了一个可选择的相位框架,这一新发现可能会改变相rna预测和评估的公式。PhasiRNAs可以独联体——调节GhMYB2通过降解mRNA。在我们的研究中,我们提供了phasiRNA在植物基因组中内源性功能的直接证据。
方法
棉料生长条件及棉组织采集
陆地棉(陆地棉)标准加入Texas Marker-1 (TM-1)从美国农业部农业研究所作物研究部获得。TM-1在28°C, 16/8 h(光/暗)光循环的温室中生长。在开花当天(0days - po花期,DPA)采集表皮上的胚珠纤维和花药,进行小RNA测序取样。从4周龄的棉花幼苗中采集下胚轴组织。下胚轴组织培养的愈伤组织在胚性培养基中培养8周,获得胚性愈伤组织。每个组织至少进行了三次生物复制。收集胚珠、下胚轴、花药和胚性愈伤组织进行RNA提取和qRT-PCR验证。
小RNA测序,降解和棉花mRNA测序数据源
棉花胚珠小RNA测序数据陆地棉, acc。TM-1之前在我们的实验室生产,并发表在国家生物技术信息中心,基因表达综合(NCBI GEO),https://www.ncbi.nlm.nih.gov/geo/),加入号PRJNA293171, TM-1小RNA加入号SRX1174194。将−1、0、1、3和5 DPA胚珠组织的RNA混合,制备早期胚珠小RNA文库。小RNA测序数据g .分子囊,下胚轴和胚性愈伤组织下载自NCBI GEO,登录号为GSE43531(花药、小RNA和降解体)和GSE41132(下胚轴和胚性愈伤组织、小RNA和降解体)[48]。参考基因组为陆地棉TM-1基因组[49]。
RNA提取和实时定量反转录PCR (qRT-PCR)
采用Plant RNA Express extraction kit (RK2002, Zoonbio Biotechnology)提取RNA,并用Nanodrop检测RNA质量。采用首链cDNA合成试剂盒(pc24 - 50t, Zoonbio Biotechnology)进行反转录,在ABI 7500上进行qRT-PCR。将相关基因表达归一化到棉花上组蛋白3基因(46]使用ΔΔCt方法[50]。qRT-PCR引物设计如下[51]。所有基因加入号和qRT-PCR引物信息在补充表中列出5。在补充表中列出了MiRNA前体6。
小RNA定位和降解组定位的生物信息学分析
从NCBI GEO公开的数据库中获得小RNA的原始reads和降解组测序文库,分别代表胚珠、花药和下胚轴三种体细胞组织,以及胚性愈伤组织一种未分化组织。由于每个样本缺乏足够的生物重复,因此采用三种不同的体细胞组织作为独立的生物样本进行比较。适配器剪切后,使用Bowtie将每个文库中的clean reads定位到候选基因上。52(settings -a -v 0),不允许不匹配并保留所有对齐。保留的sRNA读数分别为:早胚珠14956687,花药16347976,下胚轴24948581,EC 25984975(补充表)2)。组织样本之间的小RNA比较采用同一相RNA衍生位点上的百万计数(CPM)值归一化。小RNA总定位率为90-93%(补充表)2)。各文库的唯一映射率和多次映射率均在40%以上(补充表)2),为进一步研究提供了一个精细的小RNA图谱。小RNA密度以每百万计数(CPM)值归一化。
用Ylab: RPKM检测降解性。每个箱形图的中心线表示中位数。盒的顶部和底部边缘表示第25和75个百分位数,胡须延伸到盒边缘以外的四分位数范围的1.5倍。采用Wilcoxon秩和检验评估显著性。
的映射MYB2分相rna的mRNA内部切割位点
用于绘制内部裂解位点MYB2使用FirstChoice®RLM-RACE试剂盒(Invitrogen)进行mRNA、RNA连接酶介导的cDNA末端快速扩增(RLM-RACE)。从结果中显示的组织中分离总RNA,包括花药、下胚轴、胚珠和EC。总RNA (4 μg)不经小牛肠碱性磷酸酶(CIP)和烟草酸性焦磷酸酶(TAP)处理,直接连接到GeneRacer RNA Oligo适配器上。外5 ' RLM-RACE PCR采用5 ' RACE外引物(5 ' -GCTGATGGCGATGAATGAACACTG-3 ')和5 ' RACE基因特异性外引物(5 ' -TACCATTGCTAATGGATCCTGTTGAT-3 ')引物进行逆转录反应合成首链cDNA。然后使用5 ' race内引物(5 ' -CGCGGATCCGAACACTGCGTTTGCTGGCTTTGATG-3 ')和5 ' race基因特异性内引物(5 ' - catcaagttcaaggaacttattccc -3 ')进行内5 ' RLM-RACE PCR。PCR产物经凝胶纯化后克隆至pGEM-T Easy载体(Promega, Madison, WI)进行测序。
相变评定
相变数据由优化后的方程[31]:
其中,n为在8周期窗口内至少一个小RNA被读取占据的相周期位置的数目,k为在8周期窗口内给定相中所有具有整合序列的小RNA的读取总数。分相的截止点被任意设置为5分。
PhasiRNA靶标预测
基于来自GhMYB2A和GhMYB2D在所有胚珠、花药、下胚轴和胚性愈伤组织中作为保守的phasiRNA查询,预测了陆地棉TM-1基因组中的phasiRNA靶点[qh]49]。phasiRNA靶标预测方法采用TargetFinder (https://github.com/carringtonlab/TargetFinder)在线工具。参数设置为TargetFinder评分≥140,小RNA::mRNA相互作用二级结构最大自由能(MFE)≤- 20 kcal/mol。
数据和材料的可用性
在目前的研究中使用和分析的数据集可以在国家生物技术信息中心,基因表达综合(NCBI GEO),https://www.ncbi.nlm.nih.gov/geo/),编号为PRJNA293171、GSE43531(花药、小RNA和降解体)和GSE41132(下胚轴和胚性愈伤组织、小RNA和降解体)。如有合理要求,可向通讯作者索取植物资料。
缩写
- phasiRNA:
-
相控小干扰RNA
- RLM-RACE:
-
RNA连接酶介导的cDNA末端快速扩增
- phasiRNA:
-
反式作用的小干扰RNA
- 电子商务:
-
胚胎发生的愈伤组织
- PF:
-
定相架
- 分区:
-
花后天数
- 度:
-
差异表达基因
参考文献
- 1.
郑勇,王勇,吴军,丁波,费震。植物阶段性小干扰rna的动态进化与功能景观。生物医学工程学报,2015;13:32。
- 2.
王晓明,王晓明,王晓明,等。拟南芥中tasirna的表达及其调控机制。中华医学杂志2009;10(3):264-70。
- 3.
Vazquez F, Vaucheret H, Rajagopalan R, Lepers C, Gasciolli V, Mallory AC, Hilbert J-L, Bartel DP, crsamuest .内源反式sirna调控拟南芥mrna的积累。生物化学学报,2004;16(1):69-79。
- 4.
谢志强,陈志强,陈志强。DICER-LIKE 4在拟南芥反式小干扰RNA生物发生和营养相变中起作用。科学通报,2005;32(3):394 - 394。
- 5.
Allen E, Xie Z, Gustafson AM, Carrington JC。植物中反式siRNA生物发生过程中的microrna定向相位。细胞。2005;121(2):207 - 21所示。
- 6.
Montgomery TA, Yoo SJ, Fahlgren N, Gilbert SD, Howell MD, Sullivan CM, Alexander A, Nguyen G, Allen E, Ahn JH,等。AGO1-miR173复合物在植物中启动阶段性siRNA的形成。中国科学:自然科学进展,2008;35(5):555 - 562。
- 7.
杨建军,杨建军,杨建军,杨建军。植物中siRNA生物发生的双重触发。细胞。2006;127(3):565 - 77。
- 8.
Montgomery TA, Howell MD, Cuperus JT, Li D, Hansen JE, Alexander AL, Chapman EJ, Fahlgren N, Allen E, Carrington JC。ARGONAUTE7-miR390相互作用的特异性和TAS3反式siRNA形成的双重功能。细胞。2008;133(1):128 - 41。
- 9.
Cuperus JT, Montgomery TA, Fahlgren N, Burke RT, Townsend T, Sullivan CM, Carrington JC。拟南芥MIR390a前体加工缺陷突变体的直接基因组测序鉴定中国科学:自然科学版,2010;37(1):466-71。
- 10.
谢丽玲,林思,施国强,陈建伟,林毅伟,曾颖颖,李文辉,邱天杰。通过深度测序揭示小rna介导的拟南芥对磷酸盐缺乏的反应。植物生理学报,2009;31(4):2102 - 2102。
- 11.
陈海明,陈立林,Patel K,李永华,Baulcombe DC,吴世生。22核苷酸rna触发植物次生siRNA生物发生。中国科学:自然科学版,2010;37(3):569 - 574。
- 12.
Cuperus JT, Carbonell A, Fahlgren N, Garcia-Ruiz H, Burke RT, Takeda A, Sullivan CM, Gilbert SD, Montgomery TA, Carrington JC。22-nt mirna在拟南芥靶转录物中触发rdr6依赖性siRNA生物发生的独特功能。中华生物医学工程学报,2010;17(8):997-1003。
- 13.
罗秋军,米塔尔A,贾峰,Rock CD:拟南芥中PAP1和TAS4对糖的响应。植物生理学报,2012,31(1):379 - 379。
- 14.
De Paoli E, Dorantes-Acosta A, Zhai J, Accerbi M, Jeong DH, Park S, Meyers BC, Jorgensen RA, Green PJ。矮牵牛中与共抑制相关的独特的极其丰富的sirna。RNA(纽约,纽约)。2009; 15(11): 1965 - 70。
- 15.
Dukowic-Schulze S, Sundararajan A, Ramaraj T, Kianian S, Pawlowski WP, Mudge J, Chen C.新的减数分裂mirna及其在减数分裂中的作用。植物科学,2016;7:762。
- 16.
翟军,张辉,Arikit S,黄坤,南桂林,Walbot V, Meyers BC。玉米花药中时空动态、细胞类型依赖的减数分裂前期和减数分裂相rna。中国科学:自然科学版,2015;112(10):3146-51。
- 17.
Ta KN, Sabot F, Adam H, Vigouroux Y, De Mita S, Ghesquiere A, Do NV, Gantet P, Jouannic S. mir2118触发的分阶段sirna在野生和驯化非洲水稻穗发育过程中的差异表达。水稻学报,2016;9(1):10。
- 18.
夏锐,徐军,Arikit S, Meyers BC。挪威云杉中广泛的mirna和phasas位点家族证明了种子植物中复杂的phasiRNA网络的起源。生物学报,2015;32(11):2905-18。
- 19.
范勇,杨军,Mathioni SM,于军,沈军,杨欣,王磊,张强,蔡铮,徐超,等。PMS1T产生阶段性小干扰rna,调控水稻光敏雄性不育。中国科学:自然科学版,2016;33(5):444 - 444。
- 20.
夏锐,朱华,安永强,Beers EP,刘忠。苹果mirna和tasirna调控网络的研究进展。中国生物医学工程学报,2012;13(6):447。
- 21.
林剑生,林春春,林海红,陈玉春,郑晓东。MicroR828调控甘薯木质素和H2O2的积累。植物学报,2012;36(2):427-40。
- 22.
瞿东,严锋,bbbbr,姜鑫,杨华,高铮,董勇,杨勇,赵忠。利用高通量测序技术鉴定“青梅”苹果外果皮果实套袋及后续阳光再暴露相关microrna及其靶点。植物学报,2016;7:27。
- 23.
罗秋军,米塔尔A,贾峰,Rock CD.拟南芥中PAP1和TAS4的自调节反馈回路。植物化学学报,2012;31(1):379 - 379。
- 24.
关晓,庞明,娜刚,石晓,叶伟,斯泰利·道明,陈志军。miR828和miR858调控同源MYB2基因在拟南芥毛状体和棉纤维发育中的功能。大自然。通信。2014;5:3050。
- 25.
王晓明,王晓明,王晓明,等。拟南芥中sirna转录因子的表达及其调控机制。基因工程学报,2005;19(18):2164-75。
- 26.
Komiya R, Ohyanagi H, Niihama M, Watanabe T, Nakano M, Kurata N, Nonomura K.水稻种系特异性Argonaute MEL1蛋白与700多个lincRNAs产生的phasiRNAs结合。植物学报,2014;38(3):385 - 391。
- 27.
谢峰,王强,孙锐,张波。小RNA测序鉴定了miRNA在胚珠和纤维发育中的作用。植物学报;2015;13(3):355-69。
- 28.
胡华,于东,刘华。皮马属植物小rna的生物信息学分析海岛棉l .)。科学通报,2015;10(2):e0116826。
- 29.
王松,王建伟,于宁,李超,罗波,苟建勇,王立军,陈学勇。棉纤维MYB基因对植物毛状体发育的控制。植物学报。2004;16(9):2323-34。
- 30.
上官旭,徐斌,于志祥,王立军,陈学勇。棉纤维MYB基因启动子在拟南芥毛状体和烟草腺毛状体中的功能。实验学报。2008;59(13):3533-42。
- 31.
Howell MD, Fahlgren N, Chapman EJ, Cumbie JS, Sullivan CM, Givan SA, Kasschau KD, Carrington JC。拟南芥中RNA依赖性RNA polymeras6 /DICER-LIKE4通路的全基因组分析揭示了对miRNA和tasirna定向靶向的依赖性。植物学报。2007;19(3):926-42。
- 32.
noonomura K, Morohoshi A, Nakano M, Eiguchi M, Miyao A, Hirochika H, Kurata N. ARGONAUTE家族生殖细胞特异性基因对水稻减数分裂过程中有丝分裂和减数分裂的进展至关重要。植物学报。2007;19(8):2583-94。
- 33.
Petsch K, Manzotti PS, Tam OH, Meeley R, Hammell M, conni G, Timmermans MC.新的DICER-LIKE1 sirna在玉米发育中绕开了DICER-LIKE4的需要。植物学报,2015;27(8):2163-77。
- 34.
Borges F, Martienssen RA。植物中不断扩大的小rna世界。中华生物医学工程学报,2015;16(12):727-41。
- 35.
李建军,李建军,李建军,刘建军,等。苔藓植物中sirna转录因子的研究进展。植物学报,2006;48(4):511 - 521。
- 36.
Donaire L, Pedrola L, Rosa Rde L, Llave C.橄榄RNA沉默相关小RNA的高通量测序(英文)齐墩果欧洲公司l .)。科学通报,2011;6(11):e27916。
- 37.
陆Wan LC,王F,郭X,年代,邱Z,赵Y,张H,林j .识别和描述的小非编码rna从杉木高通量测序。植物化学学报,2012;12(1):1 - 6。
- 38.
夏R,迈耶斯公元前,刘Z,啤酒EP,你们年代,刘Z MicroRNA总科的后裔miR390和他们的角色在二级小干扰RNA在Eudicots生源论。植物学报,2013,25(5):1555-72。
- 39.
薛伟,王铮,杜敏,刘勇,刘建勇。棉纤维细胞中8个与纤维伸长相关的小rna全基因组分析和257个新的microrna。生物医学工程学报,2013;14(4):629。
- 40.
Katiyar A, Smita S, Muthusamy SK, Chinnusamy V, Pandey DM, Bansal KC.高粱抗旱响应microrna和反式sirna的鉴定[j]。通过高通量测序分析。前沿。植物科学,2015;6:506。
- 41.
林燕,林丽,赖瑞,刘伟,陈燕,张志,徐汉霞,赖忠。龙眼龙眼体细胞胚胎发生过程中,microrna390定向的TAS3裂解导致tasiRNA-ARF3/4的产生。植物科学,2015;6:1119。
- 42.
翟杰,郑东华,De Paoli E, Park S, Rosen BD, Li Y, González AJ,闫震,Kitto SL, Grusak MA。microrna作为植物NB-LRR防御基因家族的主要调控因子,通过产生阶段性的、反式的sirna。基因学报,2011;25(23):2540-53。
- 43.
Arribas-Hernandez L, Marchais A, Poulsen C, Haase B, Hauptmann J, Benes V, Meister G, Brodersen P.在拟南芥中,ARGONAUTE1的切片活性是调控短干扰rna的特异性必需的,而不是产生的。植物学报,2016;28(7):1563-80。
- 44.
Endo Y, Iwakawa HO, Tomari Y.拟南芥ARGONAUTE7在RISC组装过程中通过多个检查点选择miR390。生物医学进展,2013;14(7):652-8。
- 45.
关霞,李建军,庞明,石霞,斯泰利·迪姆,陈志军。棉纤维相关基因对拟南芥种子毛发育的激活作用科学通报,2011;6(7):e21301。
- 46.
万强,关霞,杨宁,吴华,潘明,刘波,方林,杨生,胡勇,叶伟,等。来自GhMML3_A12双向转录本的小干扰rna调节棉纤维的发育。植物学报,2016;21(4):1298-310。https://doi.org/10.1111/nph.13860。
- 47.
王晓军,Gaasterland T,蔡宁华。拟南芥顺式天然反义转录物的全基因组预测与鉴定。中国生物医学工程学报,2005;6(4):930。
- 48.
杨霞,王丽,袁冬,Lindsey K,张霞。小RNA和降解组测序揭示了棉花体细胞胚胎发生过程中复杂的miRNA调控。实验学报,2013;64(6):1521-36。https://doi.org/10.1093/jxb/ert013。
- 49.
异源四倍体棉花的序列分析。TM-1)为光纤的改进提供了资源。生物工程学报,2015;33(5):531-7。
- 50.
Livak KJ, Schmittgen TD。采用实时定量PCR和2(−Delta Delta C(T))法分析相关基因表达数据。方法。2001;25(4):402 - 8。
- 51.
Kawahara Y.使用常规方法对microrna的腺苷-肌苷编辑进行定量。自然学报,2012;7(7):1426-37。
- 52.
李建军,李建军,李建军,等。基于遗传算法的人类基因组短序列比对研究。基因工程学报。2009;10(3):R25。
致谢
不适用
资金
国家重点研发计划项目(2016YFD0101006)、国家自然科学基金项目(NSFC, 31971985, 31900395)、中国博士后科学基金项目(2018m632477, 2019 M652094)、中央高校基本科研业务费专项资金、jic - mcp项目、浙江大学大北农学科发展与人才培养基金资助。所有这些资助都支持研究的设计、数据的收集、分析和解释以及撰写手稿。
作者信息
从属关系
贡献
x.g.构思研究方案,设计实验并协调项目。曾国光、曾志、曾田和曾政分析了所有的数据并撰写了手稿。小田、m.g.、m.l.、n.z.、j.c.、g.m.、j.l.、k.w.、l.d.进行了实验室实验,并参与了数据分析。L.F, j.c.b.z和t.z.提供了mRNA-seq数据。所有作者讨论了结果并对稿件进行了评论。作者阅读并批准了最后的手稿。
相应的作者
道德声明
伦理批准并同意参与
本研究中进行的植物实验研究符合机构、国家和国际准则。
发表同意书
不适用
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
miR828和miR858前体的二级结构
附加文件2:图S2。
基于mRNA序列分析的陆地棉基因组AGO、DCL、RDR6、SGS3同源物的mRNA活性热图
附加文件3:图S3。
退化碎片的分布GhMYB2信使rna。GhMYB109作为miR828靶向的阴性对照。预测GhphasiRNA1是棉花基因组中phasiRNA衍生基因,作为阳性对照。UBL1-Gh作为非mirna靶向位点的阴性对照。正如花药降解数据所示,PhasiRNA可能在其起源位点的mRNA降解中发挥作用。它们也可能在其他靶点发挥作用,如下胚轴降解分布和热图所示
附加文件4:图S4。
图2中下调基因群的功能富集分析。5下胚轴和花药组织中的面板b
附加文件7:表S1。
GhMYB2上两个分相框架的小RNA文库中的phasiRNA读取数
附加文件8:表S2。
本研究中使用的小RNA文库和降解物文库的图谱统计
附加文件9:表S3。
miR173和miR390在棉花基因组中的预测靶点
附加文件11:表S5。
基因接入与引物
附加文件12:表S6
。miRNA前体序列
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
赵涛,陶晓,李,明。et al。来自两种不同的分相框架的分相rna的作用GhMYB2位点在独联体-棉花基因组中的基因调控。BMC Plant Biol20.219(2020)。https://doi.org/10.1186/s12870-020-02430-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02430-3
关键字
- 棉花
- 纤维
- phasiRNAs
- RLM-RACE