抽象的
背景
营养生长是植物进行光合作用时的重要阶段,积累和收集所需的所有资源,为繁殖阶段做好准备。竹是植物种类最快的一种。快速增长毛竹结果来源于节基部闰分生组织的扩张,与根状茎侧芽的顶端分生组织不同。然而,对于竹子在这个快速发展阶段所涉及的主要信号通路和参与者知之甚少。为了研究这一问题,我们采用高通量测序技术,比较毛竹根茎芽在萌发期和发育后期的转录组。
结果
我们发现,毛竹根茎侧芽的发展是由多种途径,包括分生组织发育,糖的代谢和激素信号协调。植物激素对植物发展的根本影响。我们发现参与毛竹根茎侧芽发展的几个主要激素的证据。此外,我们发现直接证据表明,赤霉酸(GA)信令参加了毛竹茎的伸长。
结论
在根状茎侧芽发育过程中,各种信号通路发生显著变化。理解这些变化是如何转化为毛竹快速增长。这些结果扩展了我们对毛竹节间快速生长的认识,为进一步研究提供了研究基础。
背景
植物的营养生长是一个复杂的发育过程,其是植物的遗传程序和各种环境因素[的组合结果1].系统理解植物增长机制为研究人员和农民提供了增加作物产量和应对危险农业情况的关键。莫斯竹子(毛竹)研究植物生长的一个优秀模型[2].毛竹有很高的营养价值和经济价值,但由于其生长迅速的能力,研究人员对它特别感兴趣[2].
几十年的研究都集中在竹子快速生长的一般机制上[3.那4.那5.那6.那7.],观察节间从秆的底部向顶部依次伸长。毛竹的快速生长是由于根状茎侧芽中分化出的分生组织的扩张[8.那9.].根茎侧芽的出现为在极端环境中获取营养和光照提供了额外的优势,从而提高了成活率[10].因此,竹根侧芽分生组织在竹的形态发生中起着重要的作用。
根茎侧芽向直立茎的发育取决于环境、亲本芽和根茎顶端[11].土壤中氮含量和水状况等环境因素调节侧芽的生长[12那13那14那15].碳水化合物代谢对根茎侧芽射击的影响是对曝光的反应[16].通过使用水稻跨物种微阵列杂交,发现几种基因与发展的发展密切相关Phyllostachys Praecox.根茎横向芽,包括激素信号传导因子HB1和CLV1,在公司发育中的信号肽[17]. 多种转录因子在根茎芽发育过程中起作用[17那18那19那20.].尽管如此,根茎横向发芽的调节网络仍然仍然不明。
植物激素是植物生长和发展的主要调节因素,并在模型生物中进行广泛研究,如雅雅武则多组和选用.各种激素(养肝剂,芸苔醇和赤霉酸)信号传导途径基因被调节在草石队的不同趋势或阶段以后的萌芽发展[21]. 在竹子中,激素介导的信号通路是快速生长秆的主要信号转导调控之一[22].不同植物激素对毛竹发育的影响最近被报道在转录组水平[23那24那25].
尽管了解根茎侧芽发育的分子机制的重要性,但最先前的研究仅关注上下芽。在竹子形态发生中,根茎芽的长期无性繁殖控制竹林的崛起和下降[8.].此外,作为整个竹生植物的初始开发阶段,根茎横向芽的发展进展有很多未知的细节。
生物信息学已经成为非经典模式植物研究的一个有用和普遍的工具。然而,研究毛竹由于缺乏从竹子中提取DNA,RNA或蛋白质缺乏技术支持,铰接并滞后。它只是直到最近,测序莫斯竹基因组草案,使机会在没有读组装的情况下更方便和细致的方式研究莫斯竹中功能基因的分子调节22].Peng等利用Illumina测序平台对毛竹扩叶后的笋和秆进行测序,寻找控制竹子快速生长特性的关键调控因子[22].他。通过显微镜实现RNA-SEQ,分析MOSO竹中康马斯迅速生长的mRNA和microRNA表达[26].
替代剪接(AS)事件导致蛋白质结构的多样化和创建新功能,使生物体受益或可以与遗传疾病相关[27那28那29].在植物中,AS通过改变一些重要蛋白的结构域,对植物的生长发育和防御具有重要的影响。可变剪接导致的结构域丢失促进了某些生长素反应因子的功能转移[30.]. 茉莉酸ZIM结构域蛋白(JAZ10.4)的一种剪接变体,缺乏Jas结构域,在JA存在时会减弱信号输出[31.].作为含有巨大内含子基因的生物体,毛竹AS事件也不例外。在最近发表的参考基因组中,几乎一半的注释基因包含AS变异[32.].作为事件的人也在不同的组织中变化[33.、成长阶段[34.]并响应荷尔蒙和环境的变化[34.那35.].单核苷酸多态性(SNPs)和核苷酸插入和缺失(Indels)是自然发生的遗传变异,与疾病、遗传性状和基因进化有关。以单核苷酸多态性(SNPs)为标记,研究了温带竹种间的亲缘关系[36.].对竹相关转录组研究中的SNP和Indels的系统审查是可怕的需求。
在本研究中,我们对根状茎侧芽在萌发期和芽早期的地下样本的转录组进行了测序。我们报道了新基因的发现,如事件、SNP和INDEL,这补充了竹子基因组中当前的注释。我们比较了这两个阶段的转录组,并研究了转录因子、分生组织发育、碳水化合物代谢和激素信号的动态变化。我们通过研究GA在竹子快速生长中的作用,进一步验证了我们的转录组分析结果。本研究为毛竹根茎侧芽发育的调控机制提供了新的思路。
结果
读取映射和分析
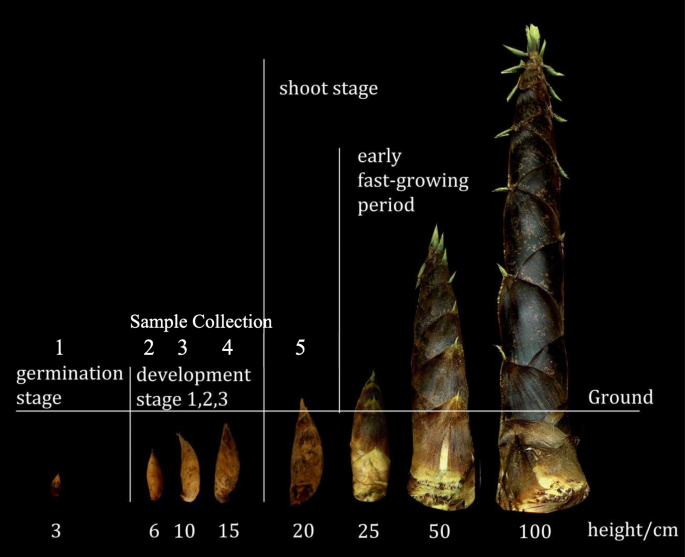
竹笋发育可分为6个阶段:休眠、萌发、发育一、二、三阶段和笋期[37.那38.(图。1).为表征和生成毛竹根茎芽发育的表达谱,对毛竹萌发期和新梢早期根茎侧芽的cDNA进行了测序。
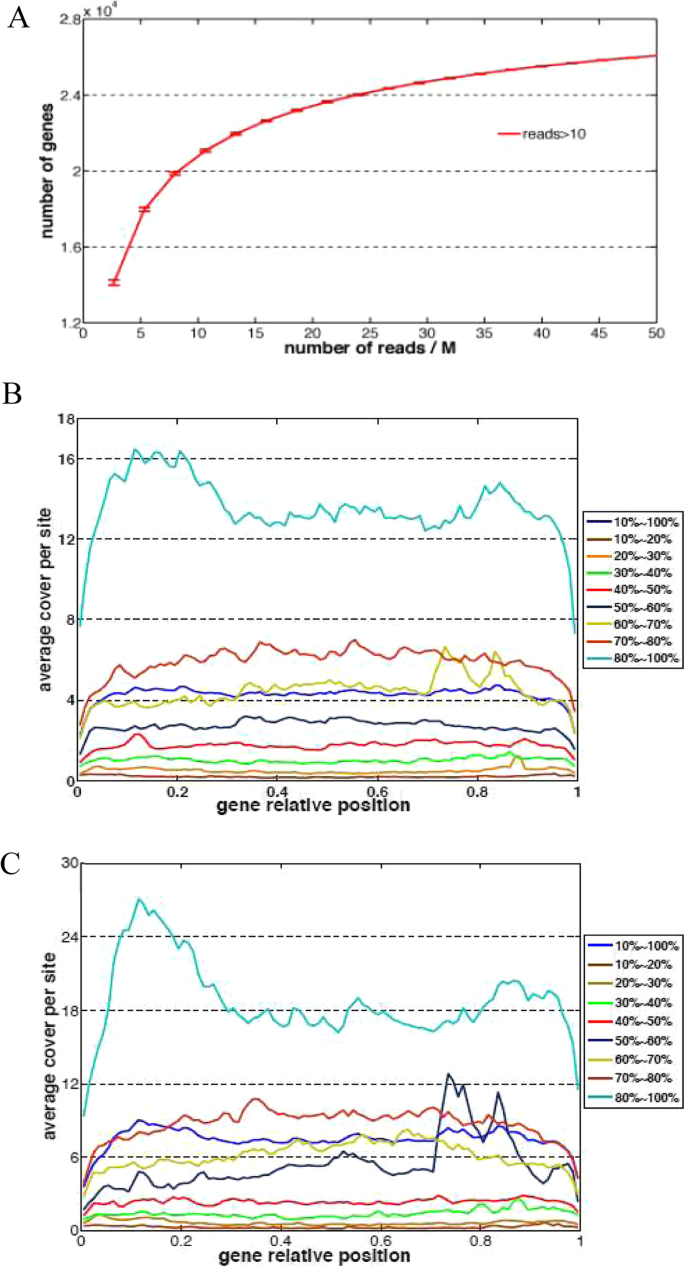
在整个RNA-SEQ读数中映射到发布的莫斯竹草案基因组序列中[22] (桌子1).通过对所产生的读取预处理,11,863,411个合并的单读和萌发阶段样本中的3,885,776个成对读数,20,854,206个合并的单读合并的单读和6,910,356个配对读数。其中,14,769,297(94.9%)在萌发阶段样品中读出,25,909,031(93.3%)在芽阶样品中读数可以映射到基因组序列上。在萌发阶段样品中只有32.6%的映射读数和芽阶样样品中的映射读数的31.9%被映射到先前注释的基因组区域上。
因此,我们通过将信息集成在读取映射模式和先前的注释中使用信息来使用袖扣来成果新基因,并获得55,869个基因的总目录[39.].因此,萌发阶段样品中的13,939,159次读取(94.4%)和24,674,009读(95.2%)映射到这些遗传区域,表明成果涵盖了绝大多数读取。在基因饱和线中(图。2a),新覆盖基因的增加达到了高原,随着更多读数测序,这表明我们的测序深度足够高,以涵盖在我们样品中表达的大多数基因。基因相对位置的平均读取显示,尽管位于基因终止的一部分遗失,但我们的数据没有明显的5个素数或3次偏压(图。2B和C)。
RNA-seq新基因的鉴定
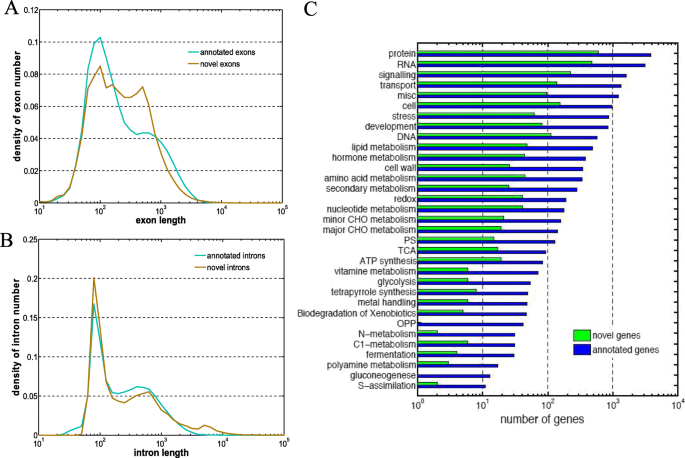
我们在RPKM截断值为1.0的遗传区域内鉴定了22107个新基因(25808个转录本或60454个外显子),并比较了这些新基因与已发表的竹子基因组中注释过的基因的外显子和内含子长度的分布(图)。3.). 新基因和注释基因的外显子长度分布相似,在200左右有两个峰值 英国石油公司和700 英国石油公司,与最近的数据一致。然而,在700处有较大的基因密度 由于单个长外显子基因的比例(图。3.一种)。新型基因和注释基因中的内含子长度的分布也类似,在约100bp的高尖峰和约500bp的低峰值(图。3.b)。外显子和旧基因之间的外显子和内部长度的这种相似性证实了新鉴定基因的有效性。
根据外显子的数量对新的基因进行分组,用5770个多个外显子基因(MEG)和16,337个单个外显子基因。在Meg Set中,Trinity预测5986非冗余编码序列[40[5149,其中5149可以与之对齐和注释Oryza sativa japonicae值小于1e-5的基因组数据。我们在Mapman中聚集了3153个新注释的MEG和23213个先前注释的基因。在每个类别中,新注释的MEG的数量与先前注释的基因数量成正比(~ 10%,图。3.c).新注释的MEG大部分涉及基础代谢、蛋白质和RNA合成以及细胞信号转导。此外,在与分生组织发育密切相关的类别中发现了新的基因,如细胞壁(26个基因)、细胞分裂和组织(77个基因)和激素代谢[41.].
在单一外显子的基因组,蛋白质7962个序列通过三位一体[预测40]和1737个非编码RNA序列被抗Rfam的blast发现[42.],包括1055 rRNA,58 rtNA,12个微RNA和37个静脉排行队员(表2).上述结果表明,本研究中鉴定的序列捕获了在莫斯竹状根茎侧芽和早期芽中表达的新型基因(功能蛋白质和非编码RNA)。对于大多数植物而言,只有小于〜37%的基因是无元的[43.那44.].MEG集被认为更可靠。因此,我们继续使用MEG设置进行进一步的功能分析。
选择性剪接(AS)的事件识别
我们还使用我们的数据来确定竹子中的事件。Astalavista-3.2在这两个样本中共识别出28217个AS事件[45.] (桌子3.),类似于以往利用PacBio技术对根茎芽组织AS事件的研究[46.].内含子保留事件(IR),替代3'拼接站点事件(ALT 3'SS),外显子跳过事件和替代5'拼接站点事件(ALT 5'SS)构成了最常见的事件类型,也是如此与以前的研究结果一致[32.那33.].AS结的约37.2.2.2个作为结的预先注释发芽阶段样品和芽阶段样品的剪接位点,而38.0和40.6%被分配给注释基因的未知剪接位点。其余的24.9和27.2%的结位于新的基因中。我们共同鉴定了总共10,588年作为相关拼接变体。九千二百六十三种变种源于〜40%的竹子基因组的注释基因[22],而其余的1325则来自新基因。
AS产生蛋白质亚型并导致蛋白质复杂性和功能多样性增加。冬季竹笋发育中的大部分AS事件导致激素相关基因的结构域丢失,可能调节激素信号传导[34.].Wang等人。根据其在域体系结构的影响[划分选择性剪接事件分为两大类47.],更改域的长度(I类)并保留/删除域(II类)。为了研究毛竹RNA转录过程中是否有任何蛋白质家族“偏好”AS,我们对数据进行了聚类分析。PKinase和PKinase_-Tyr、DEAD和PP2C家族中的蛋白质富含I类AS,而WD40、TPR_11、IQ和zf-CCCH结构域家族则倾向于II类AS(图。4.一种)。
单核苷酸多态性(SNPs)和碱基插入和缺失(Indels)的鉴定
接下来,我们检查了单核苷酸多态性(SNPs),以及数据中出现的插入和删除(indels)。与草图基因组相比,共获得18602个纯合SNPs和25979个杂合SNPs。44.2%的纯合子SNPs和67.8%的杂合子SNPs位于已注释基因的编码区域。我们在纯合子SNPs中观察到非同义SNPs(5019个)多于同义SNPs(3208个),而在杂合子SNPs中观察到相反的情况(10415个同义SNPs和7206个非同义SNPs)。非同义SNPs在具有p激酶结构域、WD40结构域、核酸结合结构域和锌指FYVE结构域的蛋白中更常见(图)。4.b)。
我们还确定了6544个纯合的吉尔斯和15347个杂合的诱惑。与SNPS相反,仅5.34%(350)纯合吲哚,11.8%(1811)杂合子靛蓝位于注释编码区。还有注意,大多数诱导(268个纯合和1430个杂合)没有引起框架偏移。在功能聚类后,我们发现诱导吲哚富含蛋白激酶,用臂状或RRM-DOM结构域(图。4.c).过早终止密码子(ptc)通常起源于非同义SNPs或移码。因此,非同义SNPs和indele丰富的蛋白质家族也更频繁地具有PTC(图。4.c) 。
具有两个或两个以上非同义等位基因的基因是高度变异的基因。在我们的RNA-seq数据中,只有不到10%(1518)的基因是高度变异的,这表明测序后的转录组和草图基因组之间存在密切关系。这些基因在运输、激素代谢、核苷酸代谢、少量碳水化合物代谢和光合作用等过程中富集,特别是在ABC运输和多药耐药系统和茉莉酸信号通路中富集,表明这些类别的基因进化速度较快。
差异表达基因的功能分析
接下来我们研究了种子萌发期和芽期基因表达的差异。在RPKM截断值为1.0(两个样本中基因的RPKM值都应该大于截断值)的情况下,我们观察了两个阶段之间植物生长的主要途径是如何变化的(图。S1).
转录因素
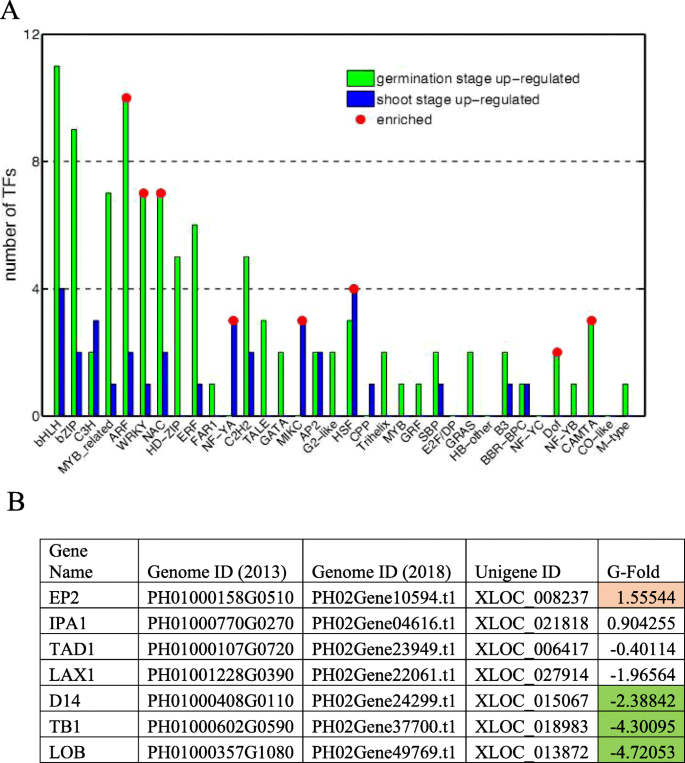
转录因子通过与顺式元件结合来调节基因表达,以应对环境和发育变化。根据植物转录因子数据库估计,毛竹有来自54个科的约1768个转录因子。在35个家族中发现138个转录因子的表达水平在萌发期和芽期之间发生变化。高达4 / 4的转录因子在萌发期高表达,包括ARF、WRKY、NAC和DOF家族,其余4 / 4的转录因子在芽期早期高表达,包括NF-YA、HSF和MIKC型MADS家族(图1)。5.一种)。
粉末分生组织发展
根茎芽的地下发育决定了成熟竹子的大小和产量。顶端分生组织维持细胞增殖和分化以促进茎伸长,辅助分生组织分化并发育为分枝、叶和鞘。我们发现一些辅助分生组织发育的负调控因子LAX1、D14和LOB在萌发期高表达,而促进辅助分生组织发育的基因(IPA1和EP2)在芽期上调(图。5.b).我们的数据表明,辅助分生组织的发育在萌发期受到抑制,在拔节期受到促进。
碳水化合物新陈代谢
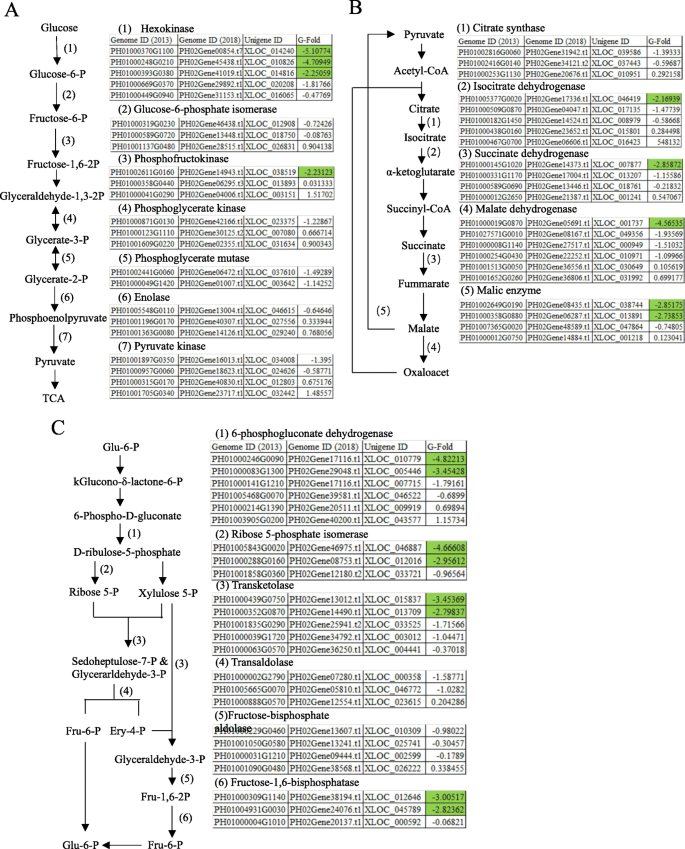
根茎芽在萌发和茎尖早期是异养生物,通过代谢地上部组织合成的碳水化合物来消耗能量。我们比较了根茎-芽两个发育阶段糖酵解、三羧酸(TCA)循环和戊糖磷酸(PPP)三种主要碳水化合物代谢途径的基因表达(图)。6.).
糖酵解是根茎芽细胞葡萄糖代谢的主要途径。葡萄糖被己糖激酶磷酸化是第一个限速和不可逆的步骤,它引发糖酵解。由此产生的葡萄糖-6-磷酸(G6P)转化为果糖-6-磷酸,然后再通过atp依赖的磷酸果糖激酶(PFK)进行另一次磷酸化。最后,第三个限速激酶,丙酮酸激酶,将磷酸基从磷酸烯醇丙酮酸转移到ADP,并产生ATP和丙酮酸,一种三羧酸循环前体。我们观察到所有6个推测的己糖激酶相关序列在萌发期都有大量的表达,其中3个序列在萌芽期的表达量超过2g倍(图2)。6.一种)。其他两个速率限制激酶也强烈地锯(PFK,XLOC_038519, - 2.23123)和适度(丙酮酸激酶,XLOC_034008, - 1.395)在发芽期期间的活性增加。
由糖酵解产生的丙酮酸可以形成乙酰基 - COA,并通过TCA循环中的一系列氧化,是最有效的能量产生途径。我们注意到,在发芽期间,在TCA循环中所有步骤中的大多数推定基因都上调(图。6.b)。类似的趋势也在PPP途径观察到的,作为基因表达在发芽阶段均升高,包括限速6-磷酸氢化(图6.c) 。因此,碳水化合物代谢比较早芽的发育芽萌发过程中出现了较为活跃。
激素
植物激素在竹笋的生长中发挥重要作用。我们发现注释以吲哚-3- acettic乙酸(IAA)推定的基因,油菜素类固醇(BR)和赤霉素(GA)的合成和信号转导途径显示毛竹根茎期间显著表达水平的变化芽地下发展。
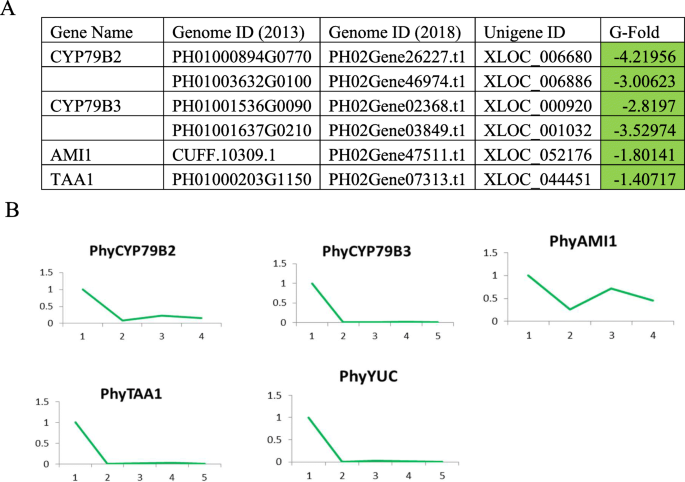
IAA是植物中产生的主要养羊酸,参与细胞增殖,细胞周期调节,细胞伸长和细胞壁延伸和细胞壁的开发。使用TRPTOPHAN作为前体,可以通过多条路线合成IAA(图。7.).我们发现指定基因的表达水平降低为主要IAA合成途径(IAOX路线中的CYP79B2和CYP79B3,IAM1在IAM LITED中的IAM1和IPA路线中的TAA1)。使用逆转录QPCR进一步证实了这种衰退,以测量在莫斯竹根茎芽的五个地下开发阶段整个推定基因的表达(图。7.).感兴趣的是,即使在地下发展的早期阶段也开始下降,促使IAA合成如何受到监管的问题以及IAA水平在根茎芽中保持问题。
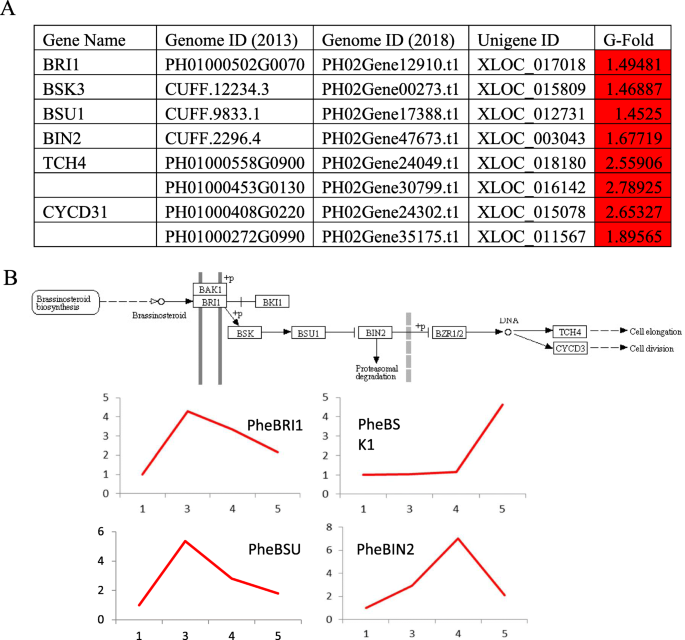
BRS是一组甾体植物激素,促进细胞生长和应力响应,参与植物发育的所有阶段。我们的转录组分析数据和QPCR定量都显示出BR信号通路中涉及的推定基因显示出早期芽阶段表达的系统增加(图。8.).因此,BR在早期拍摄的发展发挥强有力的作用表示。
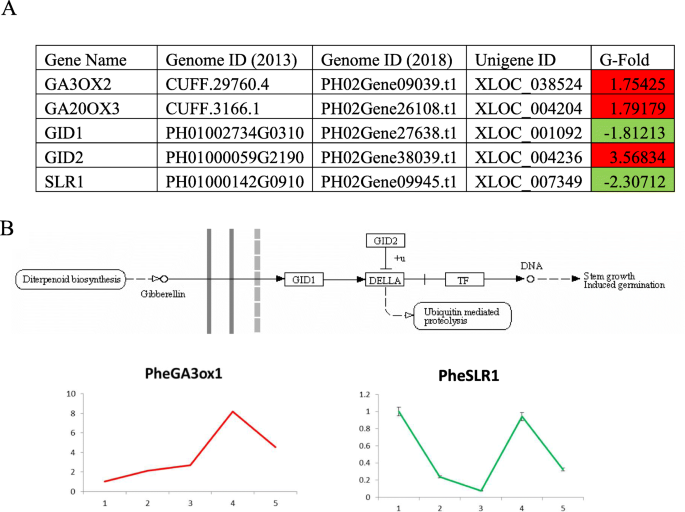
赤霉素能促进种子萌发和分生组织发育,并在后期触发向开花和结果的过渡。GA合成的关键基因GA3ox2和GA20ox3的转录表达在芽期早期显著升高,这与qPCR结果的趋势一致(图2)。9.). GA信号活性导致DELLA的下降,DELLA是一种抑制细胞生长和促进分枝的蛋白质。GA合成缺陷导致德拉积累,表现出矮小和分枝表型。在我们的研究中,DELLA基因的表达从萌发到芽的早期下降,这表明在根茎芽发育的各个地下阶段存在一条活跃的GA信号通路(图。9.).
GA在莫斯竹中刺激基底节间伸长率
为了确认从转录组分析中的结果,我们研究了GA信号对Moso竹子快速增长的影响。从Anji Bamboo Garden收集Moso Bamboo幼苗,在实验室温室中生长,直到连续6个月在喷洒Ga,生长抑制剂Pac和水之前建立五到七个真实叶子(图。10一种)。
该GA处理显著升压后的竹相比水处理对照(图幼苗垂直生长。10A,右),与之前的研究一致[35.].相反,PAC控制较暗的叶子,短的节间茎长和距碱基到第一真叶的距离短,表示较慢的杆伸长率(图。10a、 中)。两种处理均不影响竹叶宽度(LW)、叶片长度(LL)和叶鞘长度(SL)(图。S2,A及B)。
我们进一步解剖和比较了不同处理的节间生长分布(图。10B和C)。水处理的野生型具有增加的茎长,对于前三个基础间,茎长,茎长急剧下降,因为它更接近顶端侧。治疗Ga没有打扰基底茎生长图案,但导致较长且更细长的基础间。PAC治疗完全废除了所有间的基础茎生长。
植物开发期间,Della是一种关键的生长抑制剂。与其他单官器相同,我们只检测到一个Della序列毛竹,SLR1(图S3). 野生型A. Thaliana.或della缺陷的突变体rga,由于DELLA蛋白经常被快速降解,因此无法检测到其水平。然而,一种抗体针对A. Thaliana.DELLA能够检测到DELLA在GA3.,在拟南芥中,在GA合成中有缺陷的突变体(图。S2C) 。与我们之前的研究结果一致,在PAC处理的竹干蛋白提取物中,只有使用相同的抗体才能观察到DELLA的积累,其中生长受到抑制(图。10d).因此,GA及其信号通路积极参与毛竹的快速生长。
讨论
探讨其作用机制Phyllostachys杂环从系统的角度,我们分析和比较了根茎芽在萌发时的转录组。我们发现了新的推测基因,可变剪接和SNPs,这将补充目前的竹子基因组数据库。我们评估了转录因子、分生组织发育、碳水化合物代谢和植物激素在竹根快速芽发育中的作用。
转录组数据和草图基因组之间的强关联和高序列匹配
我们的高通量测序数据与已发表的竹子基因组进行了比对,匹配率超过93%[22]. 如此高的图谱读取率可能是因为我们测序的组织来自同一物种,这使得我们的读取在识别新基因和检测蛋白质表达水平变化方面具有很强的应用价值。然而,只有不到40%的读取被映射到带注释的区域。最可能的原因是我们测序的组织与之前用于基因注释的组织不同[22]. 因此,我们能够从以前的基因间区域中识别出新的假定基因。最近发布了一个在染色体水平上组装的改良参考基因组[32.].随着测序技术的加速度和对莫斯竹子的兴趣越来越令人兴趣,更全面地了解竹子基因组是不可避免的需求,并将极大地利用该领域的研究人员。
作为转录组分析样品中的SNP和Indels
我们的AS分析与之前在拟南芥中的发现一致,即PKinase结构域是最常被截断的结构域家族(I类AS),WD40结构域最有可能被完全插入/删除(II类AS)[47.].这两个域族的AS类偏好在双子叶植物和单子叶植物中可能是普遍存在的,可能是从它们的祖先派生出来的。事实上,最近的一项研究表明,AS更有可能发生在保守的基因中。此外,我们还发现在第一类中PP2C、DEAD和SNF2_N富集,在第二类中TPR_11域、ZF-CCCH域和IQ域富集。SNF2-N和ZF-CCCH家族的剪接变异此前在拟南芥中已有报道[48.那49.].作为莫斯竹根茎芽中的事件的高度丰富会讲述其重要性的卷。在这项研究中,我们向您的RNA-SEQ数据提出了作为事件的初步评估。如何在更详细的参考基因组的帮助下,如何在各个阶段影响各个阶段的根茎芽发展的人[32.]更深的测序技术[46.].
在我们的样本中,SNP和INDEL等自然基因组变异相对较低。这可能是因为我们的样本与用于测序基因组草案的样本在中国同一省份采集,这可能表明类似的气候、温度和其他环境因素。我们发现参与信号转导或转录调控的蛋白质容易发生基因组变异。这些蛋白质家族对于应激反应或环境适应尤为重要。未来的研究需要比较不同地区毛竹的基因组变异及其与环境因素的相关性。
毛竹根茎侧芽转录因子、分生组织发育及糖代谢相关基因的表达模式
我们的转录组分析没有识别所有35个转录因子家族。其他转录因子家族可能在其他发育和生殖阶段特异表达,或者由于可靠性低而从结果中删除。发芽期高表达的转录因子数量远高于茎早期,说明根茎萌发期转录活性更强。各发育阶段丰富的过程功能也存在差异。ARF、DOF、NAC和WOX家族成员在萌发期富集。这四个转录因子家族都积极参与植物的发育。生长素反应因子(Auxin response factor, ARF)是调控生长素反应基因表达的转录因子[41.].该NAC和WOX转录因子可能参与细胞分裂的调控原基[早期发展50.那51.]. DOF家族参与胚乳发育、种子萌发和萌发后糊粉化过程中赤霉素反应中种子贮藏蛋白合成的调节[52.].以这种方式,DOF转录因子可能调节萌发根茎侧芽以从根茎运输并在地下秆附近的营养。在另一方面,核系数Y亚科A(NF-YA)热休克因子(HSF)和MIKC型MADS域家族在拍摄初期阶段只富集。NF-YA和HSF蛋白质均为响应非生物胁迫的重要转录因子,这对于竹笋或环境适应至关重要。MIKC型MAD域蛋白对花卉四重奏模型的植物开花至关重要。在早期芽阶段期间在该类别中的基因表达的富集可能表明它们在竹生长期间具有添加功能。
在我们的结果中鉴定的其他推定转录因子如BHLH蛋白富集两种发育阶段。BHLH蛋白是转录网络中的重要调节组分,控制从细胞增殖到细胞谱系建立的过程的多样性,这与地下发育的根茎横向芽突然相关[53.].总之,我们的地下开发阶段的转录因子分析建议未来的功能分析假定的调控元件池。
根茎芽顶端分生组织和辅助分生组织的发育是竹笋地上生长的决定因素。辅助分生组织分化为鞘、叶和枝。我们的数据表明,辅助分生组织发育相关基因在萌发期和芽早期之间存在差异表达。我们推测,由于顶端优势,辅助分生组织在地下芽发育后期才建立。由于我们没有观察到调控顶端分生组织发育的基因表达的显著变化,因此在整个根茎芽地下阶段,顶端分生组织的发育可能是一致的。
碳水化合物代谢是根茎芽生长的主要途径,在地下发育过程中不具备光合作用。有趣的是,碳水化合物代谢活性在茎尖早期出现了系统性的下降。在萌发阶段可能需要更多的能量和养分。
毛竹根茎侧芽激素合成及信号转导调控
在我们的研究中,我们观察了三种激素信号通路在根茎侧芽期和茎早期的动态变化。
IAA合成和信号通路成分在物种间高度保守[24].我们发现IAA合成途径在萌发阶段非常活跃,这与它在分生组织发育中的重要作用相一致。前期研究发现,早熟根茎侧芽IAA/ABA比值调节根茎芽萌发[54.].探讨萌发阶段的脱落酸途径的活性将是有趣的。虽然IAA合成在我们的结果中在早期拍摄阶段下降。在Novo合成旁边的早期拍摄阶段,极性养素素转运对IAA水平的贡献。我们的分析未识别助枝素信号通路的显着变化。很可能是IAA信号在整个根茎芽的地下发展中始终如一。
芸苔类固醇(BRS)是通过促进根细胞分裂和伸长来调节植物生长的甾体激素。与竹子的BR相关基因的最近详细分析一致[23]在我们的数据中,几乎所有BR信号通路基因的表达在芽早期显著增加,表明BRs在根茎芽发育过程中的潜在作用。这种升高也可能与BRs在血管组织生长和环境适应中的作用有关[55.].未来的研究需要深入探讨BRs在发育后期的作用。
根状茎侧芽中的激素检测结果表明,根状茎侧芽中GA含量较高Phyllostachys propinqua拍(56.].在我们的结果中,我们发现GA信号在根瘤菌芽发展的后期越来越活跃。Phedella(SLR1),其在拟南芥和Oryza中的直观调节Ga信号通路,显着下调在早期芽阶段。与最近的报告一致,GA-处理的竹苗刺激了节水伸长,而不会扰乱生长模式[35.].这种模式可以通过分生组织发育调控或其他激素等的存在,这需要进一步的研究来维持。
Della是植物开发期间的关键生长抑制剂,GA信号通路涉及Della的降解。我们观察了PAC处理竹苗SLR1的积累。在蛋白质印迹中可以看到非特异性相互作用可以通过拟南芥特异性抗体来解释毛竹.当摩尔竹研究的更多工具可用时,我们将能够解析GA对竹快速增长的影响。
结论
在这项研究中,我们利用高通量RNA测序来分析转录om毛竹在两个发育阶段的根茎侧芽。我们将数据与先前的基因组项目进行了比较,发现了超过20,000个新的基因,我们还将新的事件,SNP和诱导识别,其可以作为基因研究的遗传研究和暗示的标志。在本研究过程中,更新的参考基因组毛竹提高了精确和恒星出版了[32.],这将极大地使莫斯竹研究界有益。将令人兴趣地分析我们的RNA-SEQ结果在未来的研究中基于新参考基因组,特别是如何在侧向根茎芽发育的各个阶段进行不同的事件和SNP。仿制性基因分析,差异表达了根茎横向芽的两种发育阶段,转录因子作用,碳水化合物代谢和植物激素在莫斯竹笋发育中的作用,以及用于进一步功能研究的候选基因的丰富列表。我们验证了GA在刺激摩擦竹节间伸长率方面的作用。我们的研究在一起,对当前基因组学资源的重要补充和未来的竹快速增长研究的宝贵来源。
方法
摩梭人的竹鞭侧芽收藏
全部毛竹在江苏竹博览会(119°14' - 119°53'e),中国浙江省浙江省,中国浙江省的竹博博览会(119°14' - 119°53'n)收集了根茎横向芽。在不断增长的季节(2月)2010年20日)。样品收集符合当地法规,不需要具体许可。对于高通量测序,萌发阶段(MSAJ-01)和早期芽阶段(MSAJ-05)的样品根据芽长度收集(图。1). 用于定量PCR(图。8.),对所有地下发育阶段收集样品(MSAJ-01发芽; MSAJ-02开发阶段1; MSAJ-03开发阶段2; MSAJ-04开发阶段3; MSAJ-05早期拍摄阶段)。对于每个发育阶段,收集来自不同根茎的三个样品。收集来自根茎侧芽的新鲜组织没有鞘毛,并立即在液氮中冷冻以避免RNA降解。所有优惠券样品所有储存在中国南京林业大学玉龙博士的实验室。
毛竹侧芽cDNA文库的构建
Total RNA were extracted from pooled lateral bud samples using the EASYSPIN RNA extraction kit (Yuanpinghao Biotech Co.,Ltd) and treated with RNase-free DNase I for 30 min at 37 °C to remove residual DNA. RNA electrophoresis was run for an initial assessment of sample quality and quantity.
然后从总RNA样品中纯化mRNA,并用于合成cDNA。在终止后,添加DA和适配器后,PCR使用饱和底漆序列进一步扩增cDNA产物。然后量化cDNA文库并使用Illumina基因组分析仪II送去测序。
处理RNA-seq数据
两个配对端读取的终端之间的距离被设计为大约150bp,这短于两个读取的长度的总和。结果,在将这些读取的预处理映射到将其映射到发表的竹子基因组草稿之前,应采取预处理[22]. 如果每对读取共享长度超过30的序列,则首先将它们合并为单个读取 bp和一个大于0.9的单位。对每个未合并的读取进行修剪,以保留高质量的50 bp从它的终端分离出一部分。
为了映射读取,将Tophat-V2.0.8b应用于参数-g 1,以确保每次读取的唯一地图结果。接下来将基于来自竹子基因组注释的第一版本的信息来提供对unigenes的混合注释来提供混合诠释[22]我们自己的映射结果。为图。5.那6.那7.那8.和9.,从新发表的参考基因组中获得基因ID[32.].
新转录本的发现
我们首先挑选了所有外显子不固定在先前注释的遗传区域(类码)的基因 = ‘u'在袖扣产生的GTF文件中)。为了避免测序的背景噪声,应该确定表达截止点以排斥低表达的基因。我们描述了在发芽期样本和芽期样本中遗传区域和遗传间区域的表达分布(图。2c) 。遗传区域与易于区域之间的边界区域(图1中的阴影区域)。2c)在0.2〜0.2(log10rpkm)之间。测试值 - 0.2,0和0.2,几以时只有几种基因中的几种基因。因此,我们将截止值设置为RPKM 1.0。
然后使用Trinity-v2013-8-14来预测这些基因的每个转录本(两个或多个转录本可能来自一个基因)的orf,从而产生一个蛋白质序列列表,用于blast against annotated水稻蛋白质组学具有1E-5的电子值截止值。转录物未被预测,ORF用于爆炸RFAM以查看这些基因中是否存在一些NCRNA。具有多个外显子的新基因用于制备功能性富集分析。
识别作为事件,SNP和INDELS
Astalavista-3.2被应用于根据袖扣产生的GTF文件来判断替代拼接事件(如开关)。通过根据代码计算不同类型的异常事件(如Intron保留(IR),外显子跳跃(ES)。为了通过替代剪接来学习对蛋白质结构域形态发生的影响,我们使用PFAMScan鉴定来自每种同种型的三位一体-V2013-8-14预测的每个蛋白质的域形态发生。
从我们的转录物样本和基因组序列之间的读取之间的SNP和这些读数映射到通过Ingap-3-0-1计算。只选择了超过200次映射读数的Contig。采用序列长度短于10bp的诱导。为高SNPS基因进行功能性富集分析。
转录组分析
我们采用Gfold-v1.0.8对两种毛竹转录本进行比较,找出差异表达基因。从Plant-TFDB下载原始数据[57.]和kegg [58.]数据库。绝对值大于1.0的基因被认为是差异表达基因。横向芽抑制的基因和芽调节基因均分别用于制造功能性富集分析。
功能注释和富集分析
我们首先将trinity预测的所有蛋白质从整个转录本爆炸到水稻从RAPDB下载,e值截止值为1e-5。与RAPDB版本水稻从Mapman作为功能性注释系统下载的映射列表,然后从一个基因的每种同种型的每种异常中的每种蛋白质中的每种蛋白质中的最低电子值拿起目标蛋白质,并使用Mapman的靶蛋白的注释来预测该基因的功能类别。
为了使功能性富集,来自控制集和背景集的两种基因在每个类别中计数,并且由于Mapman注释的分层结构,在其父类别中分配了一个类别的基因。然后,每个等级,在类别上拍摄了一个Fisher精确测试。在差异表达基因和差异表达同种型的功能性富集分析中,携带腹链丝发现的所有基因被视为背景基因集,而在SNP的分析上,仅使用公开的竹基因组中的注释基因。
激素相关基因的定量PCR表达
从每个地下期样品中提取的总RNA逆转录为cDNA。根据样本的可获得性,我们使用qPCR中的基因特异性引物对选定的基因在至少四个地下阶段的表达进行了定量(见表)S1).Moso Bamboo actin被用作内部参考。PCR程序包括:94℃,5分钟,35个循环为94℃,30s,54℃,30s和72℃,1分钟,72℃,10分钟。
竹苗生长试验
在生长试验之前,在温室条件下在锅中种植摩尔竹幼苗,直至建立5〜7颗真实叶子。然后将幼苗分成三组,并分别用水,Ga和Pac喷射约180天。治疗后,记录并比较每组幼苗的生长。
Western Blotting检测Della(SLR1)蛋白质
从上面的生长试验中的0.1g每个样品在液氮中收集在液氮中并在加入300μl蛋白质萃取缓冲液(50mM Tris-HCl pH 8.0,150mM NaCl,1%Triton-x 100和100μg/ ml PMSF之前研磨.将样品混合在冰上30分钟,然后在100℃下煮沸10分钟。然后将粗提取物以12000rpm离心30分钟。将10μl上清液与标准SDS加载缓冲液混合并加载到SDS-PAGE凝胶上。电泳后,将样品转移到PVDF膜中,并在5%NFDM-TBST溶液中依次呈抗Della抗体(1:3750)(Ref)和二抗(1:5000)。Chemifflooresh揭示了Western印迹的结果。
数据和材料的可用性
目前研究的RNA-seq数据(GSE142030)可以在GEO上获得。
缩写
- 为:
-
选择性剪接
- 比尔:
-
油菜素内酯
- GA:
-
赤霉酸
- SNP:
-
单核苷酸多态性
- 梅格:
-
多外显子基因
- 赛格:
-
单个外显子基因
- IAA:
-
吲哚-3-腺酸
- TCA:
-
三柠檬酸
- 购买力平价:
-
磷酸戊糖途径
- 每公里:
-
每千基百万读取数
参考文献
- 1.
贝弗里奇CA,Mathesius U,玫瑰RJ,Gresshoff PM。共同的管理主题,分生组织发育和全厂的动态平衡。CURR OPIN植物生物学。2007; 10(1):44-51。
- 2.
傅杰。中国毛竹:它的重要性。竹子2001;22(5):5–7.
- 3。
艾尔法,李光。植物体内激素的含量和分布Phyllostachys杂环CV。pubescens.在射击期间。SCI Silvae Sin。1998; s1 ..
- 4。
他X-Q,铃木K,北村S,林J-X,崔K-M,伊藤T。了解竹竿中两种薄壁组织细胞的不同功能。植物细胞生理学。2002;43(2):186–95.
- 5。
李X,舒佩T,彼得G,Hse C,埃伯哈特T。竹种成熟过程中的化学变化植被类型下毛竹.J Trop for SCI。2007; 19(1):6。
- 6。
余Y,田G,王H,费B,王G。利用纳米压痕和微拉伸技术对竹纤维单纤维的力学特性进行表征。霍尔斯福松。2011;65(1):113–9.
- 7。
中国竹子的比较解剖学研究。植物学报。1960;9:76-95。
- 8。
王颖,李军。植物构型的分子基础。植物生物学学报2008;59:53 - 79。
- 9。
Magel E,Kruse S,Lütjeg,Liese W.可溶性碳水化合物和酸转化酶参与发展中的快速生长莎莎palmata(豆)加缪。竹科学崇拜。2005;19(1):23–9.
- 10
Calvo S,Livison G,Pirrotta M,Di Maida G,Tomasello A,Sciandra M.建模性生殖与根茎生长之间的关系波喜荡草(L.)饮食。Mar Ecol。2006; 27(4):361-71。
- 11.
Bateman Rm,Crane Pr,Dimichele Wa,Kenrick Pr,Rowe NP,Speck T等人。土地植物的早期演变:初级陆地辐射的系统发育,生理学和生态学。Annu Rev Ecol Evol Syst。1998年; 29:263-92。
- 12.
McIntyre Gi。氮营养对芽和根茎发育的影响冰草L. Beauv。自然。1964年; 203:1084-5。
- 13.
McIntyre Gi。在根茎顶端优势冰草:水分胁迫对芽活力的影响。[J] .中国科学(d辑:地球科学)1976;
- 14。
McIntyre Gi。氮气供应对生长发育的一些影响acropyron repens.湖Beauv。*。杂草res。1965; 5(1):1-12。
- 15.
McIntyre Gi。研究成长与发展研究冰草:湿度、钙和氮对根茎顶端和侧芽生长的交互作用。我可以用J机器人。1987;65(7):1427–32.
- 16。
Leakey R,Chancellor R,Vince-Prue D.从根茎碎片中再生冰草(L.)Beauv。IV。光对多节点碎片射击芽休眠和发展的萌芽。Ann Bot。1978; 42(1):205-18。
- 17。
王K,彭H,林权证,进Q,华X,姚S等人。与竹鞭芽发育的基因的鉴定。J Exp Bot。2010; 61(2):551-61。
- 18。
刘HL,吴男,李男,高YM,陈女,在毛竹翔Y. TCP转录因子(毛竹):全基因组鉴定和表达分析。前植物SCI。2018; 9:1263。
- 19。
毛竹bZIP转录因子基因的全基因组鉴定及表达分析毛竹). Int J Mol Sci。2019;20(9).https://doi.org/10.3390/ijms20092203.
- 20
石烨,刘浩,高烨,王烨,吴敏,向烨。毛竹生长调控因子的全基因组鉴定(毛竹):在Silico和实验分析中。Peer J. 2019; 7:E7510。
- 21
胡楼王d,赵X,张T,孙H,朱L,等人。通过在全基因组差异表达分析的根茎特异性基因识别oryza longistaminata..BMC植物BIOL。2011; 11(1):18。
- 22
彭Z,鲁Y,李力,赵Q,冯Q,高Z,等人。快速增长的非木材森林物种毛竹的基因组草图(Phyllostachys杂环).中国科学(d辑:地球科学)2013;45(4):456 - 661 - 1。
- 23.
王S,Sun H,Xu X,Yang K,Zhao H,Li Y等。摩尔竹笋芽孢杆菌作用相关基因的基因组鉴定及表达分析。MOL BIOL REP。2019; 46(2):1909-30。
- 24.
王炜,顾L,叶S,张辉,蔡Ç,向M等人。全基因组分析和生长素生物合成,运输的转录谱和信令家族基因毛竹(Phyllostachys杂环).BMC基因组学。2017;18(1):870。
- 25.
YE J,张Y,傅Y,周M,唐D.胃肠杆菌素生物合成,新陈代谢和信号家族基因的基因组鉴定及表达分析毛竹.生物技术学报。2019;35(4):647-66。
- 26。
何赛,崔克,张JG,段阿格,曾YF。基于下一代测序的mRNA和microRNA表达谱分析揭示了毛竹发育中秆快速生长的途径。植物生物学。2013;13(1):119.
- 27。
光S,Elofsson A.拼接对蛋白质领域架构的影响。CurrOgin struct Biol。2013; 23(3):451-8。
- 28。
Kriventseva EV、Koch I、Apweiler R、Vingron M、Bork P、Gelfand MS等。通过选择性剪接增加功能多样性。Genet。2003;19(3):124–8.
- 29。
Keren H,Lev Maor G,Ast G。选择性剪接和进化:多样性,外显子定义和功能。纳特·杰内牧师。2010;11(5):345–55.
- 30.
Finet C,Berne-Dedieu A,Scutt CP,MarlétazF.土地植物中ARF基因家族的演变:旧域名,新技巧。mol Biol Evol。2013; 30(1):45-56。
- 31。
Chung HS,Howe GA.TIFY基序在通过茉莉酸ZIM结构域蛋白JAZ10的稳定剪接变体抑制茉莉酸信号传导中的关键作用拟南芥.植物细胞。2009; 21(1):131-45。
- 32
赵H,高Z,王L,王J,Wang S,Fei B等。摩擦竹子的染色体级参考基因组和替代拼接图谱(毛竹).Gigascience。2018;7 (10):giy115。
- 33
李丽,石强,侯德成,李军,马勇,李旭,穆胜,高建军。毛竹组织选择性剪接的转录组分析。植物学报。2018;40:89。
- 34
Li L,Hu T,Li X,Mu S,Cheng Z,Ge W等人。摩尔竹中射击生长相关替代拼接的基因组分析。Mol Gen Genomics。2016; 291:1695-714。
- 35.
张H,王浩,朱Q,高Y,赵L,王Y,等人。毛竹的转录表征(毛竹)幼苗响应外源性胃肠杆菌素应用。BMC植物BIOL。2018; 18(1):125。
- 36.
王XQ,赵L,伊顿DA,李DZ,郭ZH。SNP标记的鉴定,在温带竹子推断系统发育(禾本科:竹亚科),采用RAD测序。生态学报。2013;13(5):938-45。
- 37.
胡C,金A,张Z。雷竹根茎混合芽分化过程中内源激素的变化。J浙江大学。1995;13(1):1–4.
- 38。
张Z,胡c,金A.观察形态和结构的观察Phyllostachys Praecox.根茎侧芽发育射击。j bamboo res。1995; 15(2):60-6。
- 39。
罗伯茨A,Pimentel H,Trapnell C,Pachter L.使用RNA-SEQ鉴定注释基因组中的新转录物。生物信息学。2011; 27(17):2325-9。
- 40。
Grabherr MG,哈斯BJ,Yassour男,莱JZ,汤普森DA,艾米特我,等人。从RNA测序数据全长转录组件而不参照基因组。NAT BIOTECHNOL。2011; 29(7):644-52。
- 41。
生长素反应因子。植物学报。2007;10(5):453-60。
- 42。
Burge SW, Daub J, Eberhardt R, Tate J, Barquist L, Nawrocki EP,等。Rfam 11.0: 10年RNA家族。核酸学报2013;41:D226-32。
- 43。
严华,戴旭,冯轲,马强,尹涛。IGDD:双子叶植物无内含子基因数据库。BMC生物信息学。2016;17:289。
- 44
严浩,张伟,林艳,董强,彭兴,江洪,等。玉米基因组中无内含子基因的不同进化模式。生物化学学报。2014;449(1):146-50。
- 45
Foissac S,Sammeth M. Astalavista:自定义基因数据集中的替代拼接事件的动态和灵活分析。核酸RES。2007; 35:W297-9。
- 46
王T,王H,蔡D,高Y,张H,王Y,等。毛竹根茎相关选择性剪接和选择性多聚腺苷酸化的综合分析(毛竹).植物J. 2017; 91:684-99。
- 47.
王华,尤晨,常飞,王永强,王丽,齐军,等。可变剪接在拟南芥花的发育导致组成和阶段调节的异构体。麝猫。2014;25。
- 48.
阿迪帕利B,亨特股份有限公司。核糖核酸酶活性是细胞的共同特性拟南芥含CCCH的锌手指蛋白。费用。2008; 582(17):2577-82。
- 49.
Archacki R,Sarnowski TJ,Halibart-PuzioĴ,Brzeska K,Buszewicz d,Prymakowska-Bosak M等人。BRM的ATP酶和ATSWI3C亚基的功能冗余的遗传分析拟南芥SWI / SNF染色质改造复合物。Planta。2009; 229(6):1281-92。
- 50.
方y,y j,谢k,谢w,xiong l。Nac转录因子家庭中Nac转录因子家族中组织特异性或应激反应基因的系统序列分析及鉴定。Mol Genet Genom Med。2008; 280(6):547-63。
- 51.
范德格拉夫E,劳克斯T,伦辛SA。WUS同源框包含(WOX)蛋白质家族。基因组生物学。2009;10(12):248.
- 52。
Lijavetzky D,Carbonero P,Vicente-carbajosa J.基因组 - 宽的大米对比系统发育分析拟南芥自由度基因家族。BMC生物学EVOL。2003; 3(1):17。
- 53。
托莱多·奥尔蒂斯G,胡克E,鹌鹑博士拟南芥碱性/螺旋-环-螺旋转录因子家族。植物细胞。2003;15(8):1749–70.
- 54。
黄Ĵ,张B,刘升,邱L.动态在rhizomal芽endophytohormones的变化Phyllostachys Praecox..林业科学,2001;38(3):38 - 41。
- 55。
Ye H,Li L,Yin Y.最近的芸苔类固醇信号和生物合成途径的调节进展。J Intent Plant Biol。2011; 53(6):455-68。
- 56
Zhihong SXCXX,志华WXSZP。早期射击,高产量和保持母竹的研究Phyllostachys propinqua.J Zhejiang为SCI Technol。1996; 4:9。
- 57
金杰,张H,孔力,高庚,罗杰。PlantTFDB 3.0:植物转录因子功能和进化研究的门户网站。《核酸研究》,2014年;42:D1182-7。
- 58
Kanehisa M, Goto S. KEGG:京都基因和基因组百科全书。核酸学报2000;28(1):27-30。
致谢
我们感谢复旦大学的Kuai博士和Ji Qi博士在设备和试剂方面提供的帮助。
资金
基金资助:国家自然科学基金项目(no . 31301808, no . 31670602);江苏省高等学校学术发展重点项目(no . 31670602)。资助机构没有参与研究设计、数据收集和解释以及手稿的撰写。
作者信息
隶属关系
贡献
Y.S.鉴定和收集的根茎芽样本,设计和执行实验,分析了数据并写了稿件。Y.Z.写下并审查了手稿。Y.D.讨论和设计了该项目。所有作者都读过并批准了稿件。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件2:表S1。
引物用于定量PCR。
权利和权限
开放获取本文根据知识共享署名4.0国际许可证获得许可,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,前提是您给予原作者和来源适当的信任,提供知识共享许可证的链接,并说明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料信用额度中另有说明。如果文章的知识共享许可证中未包含材料,且您的预期用途未经法定法规许可或超出许可用途,则您需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条中提供的数据,除非数据信用额度中另有规定。
关于这篇文章
引用这篇文章
寿,Y.,朱,Y.&Ding,Y.转录组侧芽的分析毛竹萌发和早期射击期间的根茎。BMC植物BIOL.20,229(2020)。https://doi.org/10.1186/s12870-020-02439-8
收到:
公认:
发表:
关键词
- 毛竹
- 根茎横向芽
- RNA-SEQ.
- 选择性剪接
- 植物激素
- 遗传算法
- Della蛋白质