抽象的
背景
碱性/螺旋-环-螺旋(basic/helix-loop-helix, bHLH)转录因子家族作为生物生长发育的重要参与者存在于所有三个真核生物王国。到目前为止,全面的基因组和功能分析bHLH黄瓜中尚未发现相关基因(Cucumis巨大成功L.)。
结果
这里共142岁bHLH根据黄瓜基因保守基序、系统发育分析和基因结构,将黄瓜基因划分为32个亚科。多序列比对结果显示,CsbHLH蛋白序列高度保守。这142株的染色体分布、共通性分析和基因复制CsbHLHs进一步分析。该启动子区中存在许多与胁迫响应和植物激素相关的元件CsbHLH基于一个CIS.-Element分析。通过比较黄瓜的系统发育和拟南芥bHLH蛋白,我们发现黄瓜bHLH蛋白聚集在不同的功能支系中拟南芥bHLH蛋白质。选择的表达分析CsbHLHs在非生物胁迫(NaCl、ABA和低温处理)下鉴定出5种CsbHLH可以同时应对三种非生物应激的基因。还分析了这五种基因的组织特异性表达谱。此外,35年代:CSBHLH041在转基因中增强了盐和ABA的耐受性拟南芥在黄瓜幼苗中,提示CSBHLH041是响应非生物胁迫的重要调节因素。最后,分析了CSBHLH蛋白中的功能性互操作性网络。
结论
本研究为进一步研究CSBHLH蛋白的功能和调节机制以及鉴定黄瓜胁迫性抗胁迫性基因的良好基础。
背景
基本螺旋-环-螺旋(bHLH)转录因子是TFs中最大的家族之一,广泛存在于所有三个真核生物界[1,2].BHLH TFS被命名为自己的结构特征[3.],主要由保守的60个氨基酸残基组成。根据不同的功能,它们可以分为两部分:基本区域和HLH区域[4].基本区域分布在BHLH保守结构域的N-末端,含有约15至20个残基,其与DNA结合有关[5,6].HLH结构域分布在基因序列的C-末端,其两种两亲性α-螺旋组成,主要构成由可变序列和长度的环形区域连接的疏水残留物。HLH结构域是BHLH TFS中形成同源或异源二聚体的基本结构[6,7].
根据进化起源、序列相似性、DNA结合模式和功能类型,在动物中,bHLH转录因子主要分为6类,A-F类,包含45个亚组[8,9].在植物中,bHLH基因家族已分为15-26群[10.]如果包括非典型BHLH蛋白质,甚至最多32个组[2].在拟南芥, 167种bHLH蛋白分为21个亚家族[2,11.];165个水稻bHLH家族成员被划分为22个亚家族[12.];159个BHLH蛋白分为番茄中的21个亚壳[13.].目前,在植物中发现的bHLH蛋白越来越多,对其功能的研究也逐渐增多。
在植物中,bHLH基因参与代谢调节、植物生长发育和对环境信号的反应等过程。的第一个成员bHLH被发现的家庭是玉米R基因显示,其显示在花青素合成中发挥关键作用[14.].随后,越来越多的bHLHs被证明参与了更广泛的生理途径。例如,光敏相互作用因子(PIFs)已被报道对光信号有反应[15.];过度的Pre1激活吉布林素依赖的反应拟南芥[16.];AtGL3,AtEGL3和ATTT8已被证明参与花青素和PA生物合成[17.,18.];尽管AtGL3,AtEGL3和ATMYC1还调节毛状体形成和根毛图案[19.].此外,一些BHLH TFS也被认为能够应对各种非生物胁迫并改善植物应激耐受性,包括对耐旱性,盐和寒冷的耐受性。在小麦,过度表达BHLH39.增加对盐胁迫的耐受力[20.].BHLH TFS通常通过与其他蛋白质形成同偶二二聚物或异二聚体来起作用。例如,Myc3和Myc4转录因子都可以与多个Jaz蛋白(如Jaz1,Jaz4和Jaz9)相互作用,共同调节JA信号通路[21.].MYB-bHLH-WD40复合物参与了不同的过程,如花青素和PAs的生物合成,叶毛的形成和根毛的形成[22.].总之,植物中的BHLH可以形成与BHLH蛋白质或其他蛋白质的同源或异源复合物,以延长其生物学功能。
黄瓜 (Cucumis巨大成功L.)是全球培育的经济上重要的作物[23.].其功能atbhlh.家庭已被广泛研究拟南芥[2].但是,关于成员的基因组信息CsbHLH家庭尚未报告。在这项研究中,我们确定并表征了142bHLH黄瓜家族基因。它们可分为32个亚群,分布在7条染色体上。他们的基因结构,保守的基序,共时性分析,基因复制和CIS.对启动子中的-元素也进行了研究。此外,表达水平有些CsbHLH通过qRT-PCR检测基因对低温(4℃)、盐(NaCl)和ABA胁迫的响应,所有基因均为胁迫响应基因。预测了CsbHLH蛋白之间的相互作用网络,有助于理解CsbHLH蛋白可能的功能机制。此外,过度的CSBHLH041与黄瓜和黄瓜中的对照相比,耐盐性和ABA抗性增加拟南芥.本研究为进一步研究在黄瓜非生物胁迫响应中发挥重要作用的CsbHLH蛋白的功能和调控机制提供了有益的资源。
结果
黄瓜的鉴定与分析bHLH基因
识别CsbHLH黄瓜中的家庭基因,我们使用BLASTP程序通过使用166来搜索黄瓜基因组数据库拟南芥BHLH蛋白[2,10.]和bHLH结构域的一致蛋白序列,以隐马尔可夫模型(HMM)剖面(PF00010)为查询条件。我们得到了164个假定成员CsbHLH家庭。确认可靠性bHLH在黄瓜基因组中,我们使用Pfam (http://pfam.janelia.org/)和智能(http://smart.embl-heidelberg.de/)[24.]在164个蛋白质的氨基酸序列中寻找bHLH结构域的存在。仅有142个蛋白具有相应的bHLH保守结构域,并命名csbhlh1至CsbHLH142根据其序列相似性和具有单独的Atbhlh蛋白的文学。最后,表中存在142个典型的BHLH基因的特定信息,包括基因ID,氨基酸长度,染色体位置和基因长度存在于表中1.CsbHLH蛋白序列的长度从84个残基(CsaV3_1G005290)到960个残留物(CsaV3_1G043790),等电点(pI)从4.57 (csav3_2g030090)至11.79 (CsaV3_6G028530).
系统发育分析,基因结构和保守的基序分析CsbHLH基因家族
为了确定CsbHLH蛋白的结构特征,我们对142个CsbHLH蛋白进行了多序列比对(MSA)分析。142个CsbHLH蛋白均包含bHLH的特征区:两个螺旋区、一个环区和一个基本区(图1)。1).此外,在bHLH结构域中,序列同源性大于50%的保守氨基酸以浅蓝色或紫色呈现。1一种)。使用142 CSBHLH同源结构域氨基酸序列产生序列徽标(图。1b).黄瓜中CsbHLH蛋白含有17个bHLH结构域的保守氨基酸,这些保守氨基酸存在于黄瓜中bHLH基因家族拟南芥和莫斯竹[2,25.].如图1所示。1B,我们可以清楚地观察到,在142个CSBHLH蛋白中,颈部氨基酸残基Arg-10,Arg-11,Leu-21和Leu-53分别高度保守(分别为92,87,96和90%)。随后,在142个CSBHLH蛋白上构建系统发育树,基于50%引导载体(图),将其分成32个亚组(C1-C32)(图。2一种)。
黄瓜BHLH基因的系统发育关系,基因结构和保守蛋白质基序。(一个)基于使用Mega 7.0软件的142个CSBHLH蛋白的全长蛋白质序列构建系统发育树。该树显示具有高自举值的32个系统发育亚组(C1-C32)。(b) CsbHLH蛋白的保守基序。这些图案,数字1-10,被陈列在不同颜色的盒子里。序列标志和E每个基序的值如图4所示。S1。(c)外显子系统结构CsbHLH基因。外显子和内含子分别用绿框和单线表示。蓝框代表上游或下游。每个基因的长度列于表中1
然后我们进行了基因结构分析CsbHLH基因支持系统发育分析,表明CsbHLHs在相同的亚组中,外显子和内含子的数量相似,且不论内含子大小CsbHLH相同亚群的基因具有相似的内含子-外显子基因结构(图。2C)。
为了进一步研究同一亚群中CsbHLH蛋白的特定基序,我们使用MEME工具鉴定了10个保守基序。142个CsbHLH蛋白中存在不同数量的保守基序(图1)。2b).同样亚群的CsbHLH蛋白中也存在类似的基序。例如,23亚组的所有蛋白都包含motif 1、2、4和6,而motif 5在大多数CsbHLH蛋白中均有发现。我们还发现某些母题在某些子组中缺失。例如,motif 4在1、2和3亚群的所有蛋白中均缺失(图1)。2b)。
通常,保守的基序和基因结构的结果进一步证实了系统发育分析的结果,表明同一亚组内的蛋白质可以具有相似的功能。
同线性分析bHLH基因在黄瓜、拟南芥和番茄
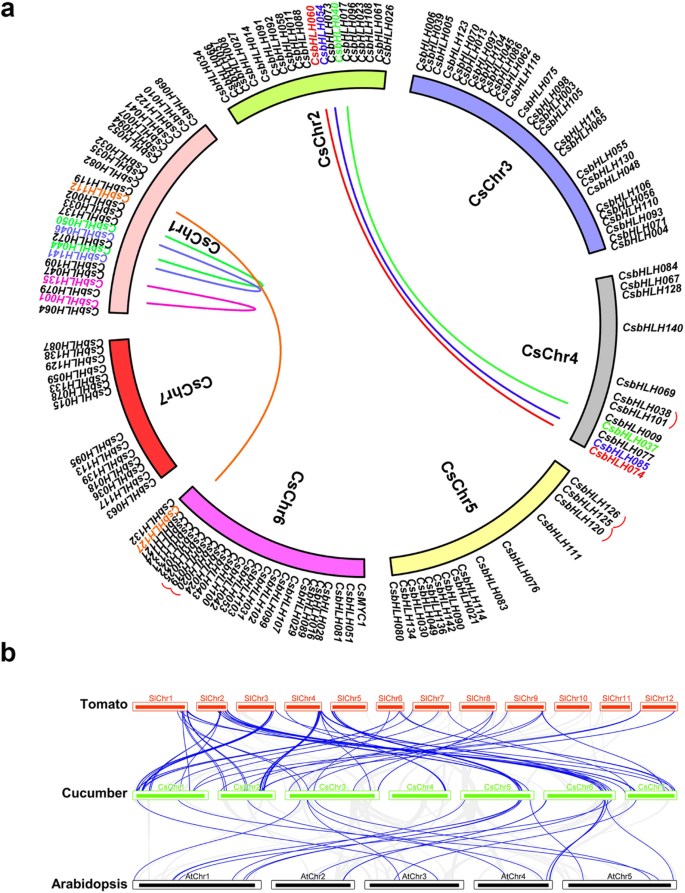
通过分析CsbHLH基因,我们发现了142CsbHLH年代(除了CsaV3_UNG229040),均位于染色体1-7上(图。3.一种;桌子1;无花果。S2).根据[26.]确定重复的CsbHLH基因,我们分析了同系区域。黄瓜基因组包含231个重复片段和1468个串联重复基因对。我们获得了5对串联重复基因对(CsbHLH019/CsbHLH020;CsbHLH019/CSBHLH025;CSBHLH120/CsbHLH125;CsbHLH125/CsbHLH126;csbhlh038./csbhlh101)和七个分段重复基因对(csbhlh112/CsbHLH127;CSBHLH040/CSBHLH037;CSBHLH054/CSBHLH085;CSBHLH060/CSBHLH074;CSBHLH001./CsbHLH135;CsbHLH141/csbhlh046;CSBHLH050/CSBHLH044),黄瓜CsbHLH家庭(图。3.一种;桌子S1).
为了进一步阐明其系统发育机制CsbHLH家庭,我们构建了与番茄相关的黄瓜的同步图的比较拟南芥分别(无花果。3.b)。我们发现了csbhlh024,CSBHLH040和CSBHLH054在黄瓜和番茄之间,基因与两个以上的共连基因对相关。此外,例如,CsbHLH020和CSBHLH049.黄瓜和黄瓜之间的两个共连基因对也有相应的基因拟南芥,表明这些bHLH基因可能在进化中起着关键作用。此外,我们发现黄瓜与两者之间存在一定的共线对拟南芥和番茄(如CSBHLH132,CsbHLH135和CsbHLH136) (图。3.b;桌子S2),说明在祖先发散之前,这些正交对可能已经存在。与此同时,某些人CsbHLH基因与共连基因对不相关拟南芥或番茄,表明它们在进化过程中可能是黄瓜特有的。
CIS.-元素的推广CsbHLH黄瓜中的基因
根据[27.),很多bHLH基因可能能够应对各种非生物胁迫。我们孤立了2-KB启动子地区CsbHLH基因识别潜力CIS.-元素(表S3),其中有一些CsbHLH特别呈现与植物激素(例如养肝剂,脱钙酸和甘油酸)相关的元素和应激反应性(例如干旱诱导性和低温)。此外,一些促进者区域CsbHLH基因含有涉及类黄酮生物合成基因调控的MyB结合位点,其可能参与黄瓜中黄酮类化合物的合成(图。S3;桌子S3).的启动子区域CsbHLH基因包含G字箱和与光响应性相关的盒子4元件。的CIS.监管元素CsbHLH启动子包括植物光响应元件,植物生长和显影响应性元件,并响应不同的应力(表S3)。
进一步分析是否有共同表达CsbHLH相同的基因CIS.-Elements,我们构建了一个共同表达网络CsbHLH基于关于黄瓜之间的相关的10种黄瓜组织的可用RNA-SEQ数据bHLH基因[26.].包含23的共表达网络CsbHLH基因(节点)和191个相关性(边缘)显示了每个CsbHLH相同的基因有多个共表达基因CIS.-Elements(图。S4;桌子S3).结果表明,基因的共表达可能与此相关CIS.-元素在启动子区域。
功能预测CsbHLHs基于系统发育分析
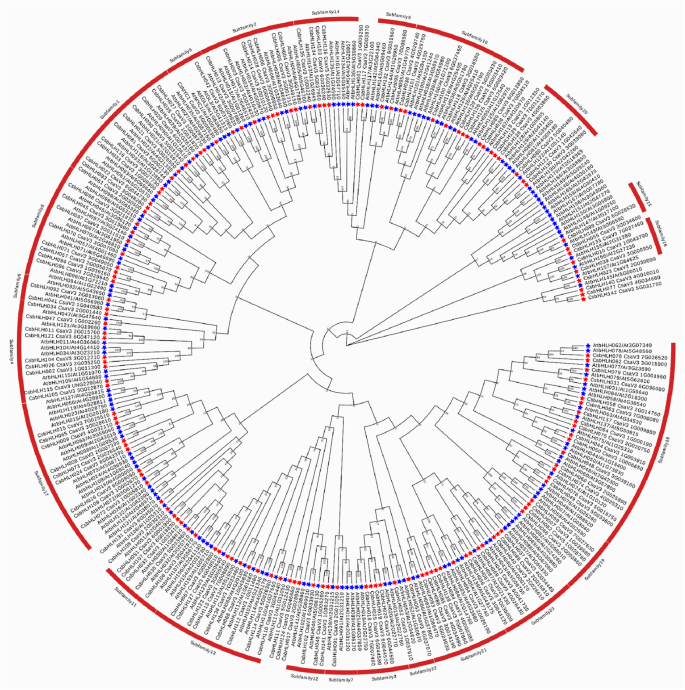
先前的研究已经确定并验证了许多BHLH蛋白的功能拟南芥[28.,29.].然而,CSBHLH的生物学功能在黄瓜中很少是已知的。在这项研究中,我们进行了166个atbhlHs和142个CsbhlHs蛋白的系统发育分析,以鉴定黄瓜中BHLH蛋白的遗传关系ArabidopsiS,以便初步探索CSBHLH蛋白的功能[2,10.] (图。4).
最后,我们将308个bHLH蛋白划分为23个亚家族,并根据其在同一亚家族中已验证的功能同源物预测csbhlh蛋白的功能(表S4)。如表S4所示,亚家族1、2、4、10、13、14和18的大部分蛋白对不同的生物和非生物胁迫有响应[30.,31.],如干旱[32.),冷(33.]和盐[34.].亚家族4和10中的一些蛋白质可能参与铁调节,调节铁稳态[35.].19和23亚家族的蛋白质已经被鉴定为调节花的发育[36.],而3、8、9、16和21亚科成员可能参与植物多个器官的发育[37.,38.,39.].在17亚家族中有PIFs,与光信号转导有关,保护植物的正常生长发育[15.].5亚家族成员调控根表皮类黄酮的生物合成和细胞分化[22.].表S4列出了CsbHLHs可能的详细功能。
通常,尽管对所有基因的功能无法清楚地破译进化关系,但分析是有意义的并且必要的。
表达分析CsbHLH不同胁迫条件下的基因和不同组织
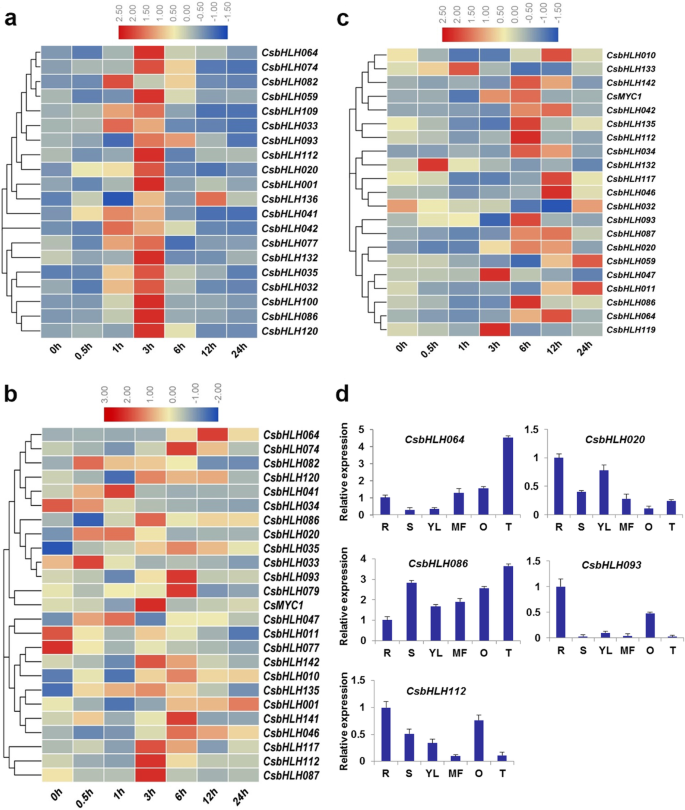
来确定的CsbHLH在非生物胁迫反应中发挥重要作用的基因,我们仔细筛选了21、20和25个bHLH基因CIS.- 分别含有低温,防御和应力响应性的元素,分别在BHLH基因的启动子中响应和脱落酸(ABA)元素,并检测其与低温(4℃),盐(NaCl)和ABA处理的转录变化,分别。正如预期的那样,所有的CsbHLH所筛选的基因对不同胁迫条件下的胁迫处理有响应(图1)。5).例如,表达式级别为20CsbHLHs对盐胁迫均呈阳性反应,其中许多表达量在盐处理1 h后上调,3 h后表达量最高,随后逐渐下降。的表达式csbhlh033.,CSBHLH041和csbhlh082在NaCl治疗中只有1小时,但表达水平最高CsbHLH13612 h后达到最大值。CSBHLH041最容易受到盐胁迫的影响(增加约37倍)(图。5一种)。根据ABA治疗,转录水平CsbHLH020,CSBHLH041和CSBHLH064比未经处理的水平高10倍(CsbHLH020:最高近61倍;CSBHLH041:最高的接近55倍;CSBHLH064:最高近19倍)。相比之下,四个的表达水平CsbHLHs基因在ABA处理下显著下调(CSBHLH011,csbhlh033.,CSBHLH034和CSBHLH077.),如图1中所见5湾21中的20个表达水平CsbHLH在4°C处理后在某个时间点上调,只有csbhlh032.减少(无花果。5C)。我们发现了CsbHLH020,CSBHLH064,CSBHLH086.,CSBHLH093和csbhlh112基因可以同时响应三种非生物应激(图。5).
不同条件下基因的表达模式通常与其功能有关。因此,我们使用QRT-PCR来检测表达式模式CsbHLH020,CSBHLH064,CSBHLH086.,CSBHLH093和csbhlh112非生物逆境应答CsbHLHS在不同的组织中。五种表达模式CsbHLH基因表现出不同的组织特异性(图。5d)。例如,CSBHLH093和csbhlh112在子房和根中表达量较高,在卷须和雄花中表达量较低(图。5d)。相反,两者都是CSBHLH064和CSBHLH086.在卷须和雄花中高度表达。表达水平CsbHLH020在幼叶和根中均高于其他组织(Fig。5d)。这些结果表明CsbHLH基因可能在植物发育和生理过程中发挥关键作用。
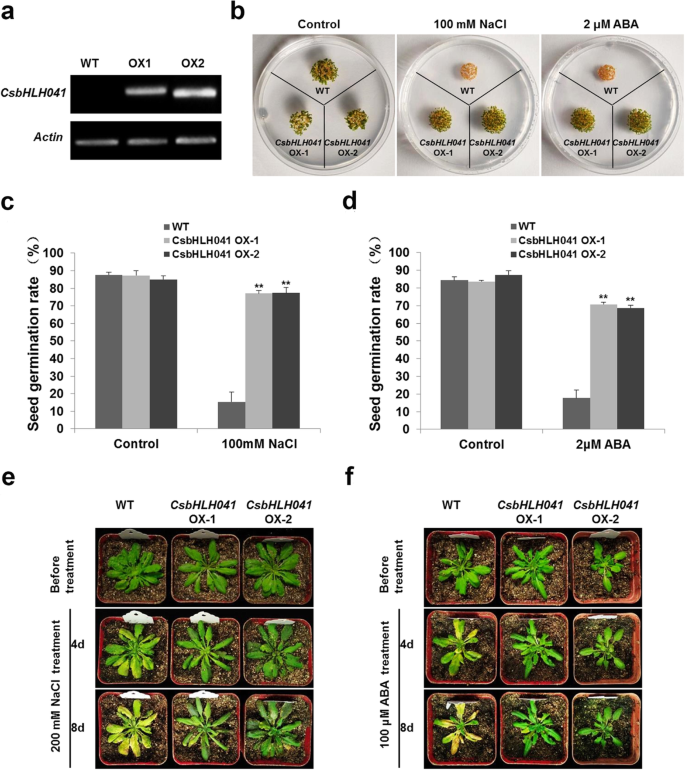
CSBHLH041提高了转基因植株对NaCl和ABA的耐受性拟南芥和黄瓜
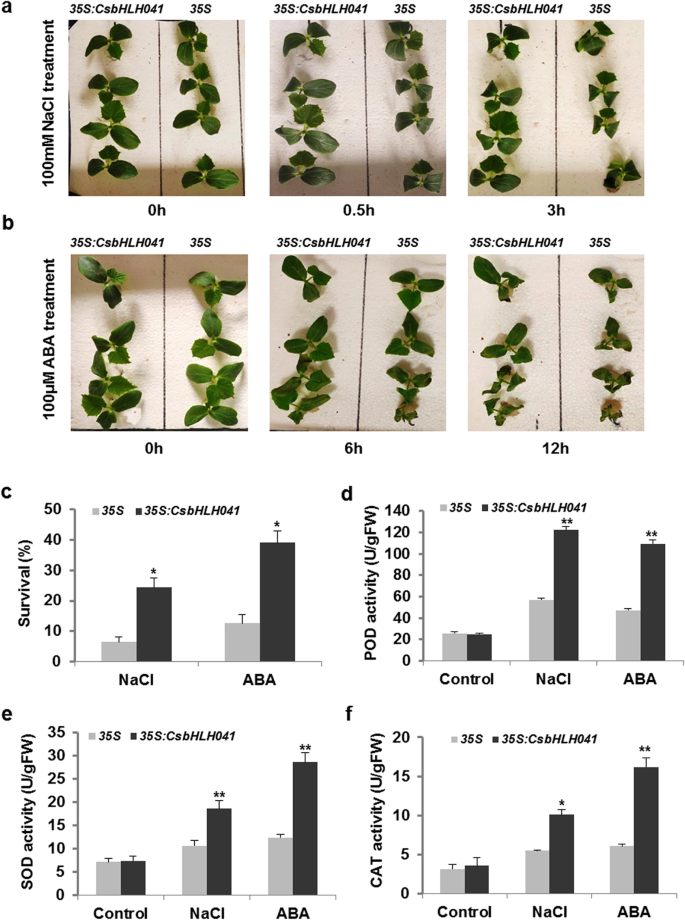
CSBHLH041在黄瓜中的盐和ABA显着诱导表达(图。5a - b)。因此,我们使用农杆菌介导的黄瓜子叶的瞬态转化澄清CSBHLH041对盐和aba的耐受性。在0.5小时的100mM NaCl处理后,幼苗过表现出的严重枯萎病35年代空的向量与过度表达相容CSBHLH041, NaCl处理3 h后凋萎差异更明显。6一种)。12小时后,转基因幼苗(24%)的存活率明显高于35年代空载体幼苗(6%),显示过表达CSBHLH041导致了显著的耐盐性(图。6c). ABA处理6 h后,转基因苗的活力大于35年代空载体幼苗(图。6b)。随着ABA治疗时间的延伸,35年代黄瓜幼苗表现出明显的干旱、萎蔫甚至死亡的症状,成活率仅为12%。虽然一些CSBHLH041转基因植物与膨胀的子叶仍然是绿色的,并且存活率高达约40%(图。6公元前)。
为了阐明增强NaCl和ABA抗性的可能因素,我们分别检测了NaCl和ABA处理下ROS清除系统中的酶活性。在不加NaCl和ABA处理的情况下,POD、SOD和CAT的酶活性均显著降低35年代和35年代:CSBHLH041转基因幼苗无显著差异(图。6D-F)。尽管如此,NACL治疗和ABA治疗都可以显着激活更多的酶促清除活动CSBHLH041转基因植物比在35年代空载体幼苗(图。6D-F)。
进一步探讨功能CSBHLH041植物对非生物胁迫的抗性,转基因拟南芥植物过表达CSBHLH041的推动下CaMV35S启动子是生成的。两个独立的纯合子系,具有较高的表达水平,CSBHLH041OX1和CSBHLH041选择ox2用于分析(图。7一种)。盐和aba容忍CSBHLH041对转基因植物进行了评估。野生型与野生型种子萌发率无显著差异CSBHLH041转基因拟南芥在1/2 ms(控制)上(图。7b)。然而,转基因植物种子的萌发比率明显高于含有100mM NaCl或2μmaba的1/2 ms培养基中的wt种子(图。7罪犯)。随后,秧苗3周大CSBHLH041用200 mM NaCl和100 μM ABA处理转基因株系和野生型株系。200 mM NaCl和100 μM ABA处理4 d后,WT植株叶片发生严重黄变CSBHLH041转基因株系仍然长着绿叶(图。7E-F)。经过8天后,WT植物之间的NaCl或ABA抗性的差异CSBHLH041转基因曲线更加明显,这表明了CSBHLH041转基因植株对盐胁迫和ABA胁迫的耐受性较野生型强。
CSBHLH041转基因拟南芥对盐和ABA的耐受性增强。(一个)相对表达CSBHLH041利用半定量PCR方法对Col-0 (WT)和2个T3代转基因株系进行了鉴定。的actin8基因被用作内部控制。原始的,未裁剪的凝胶图像作为附加文件提供9.(b) col0和col0的WT种子萌发CSBHLH041在22℃下培养7天后,在1/2 ms上补充有100mM NaCl和2μmaba的1/2 ms的转基因排液。(c)和(d)相应的种子萌发率(b),分别。进行了3次生物复制。星号表示差异显著**p < 0.01 compared with the corresponding controls. The growth of Col-0 (WT) andCSBHLH041200mm NaCl (e)和100 μM ABA (f)治疗
CsbHLH同源蛋白相互作用网络预测拟南芥这对非生物应激反应至关重要
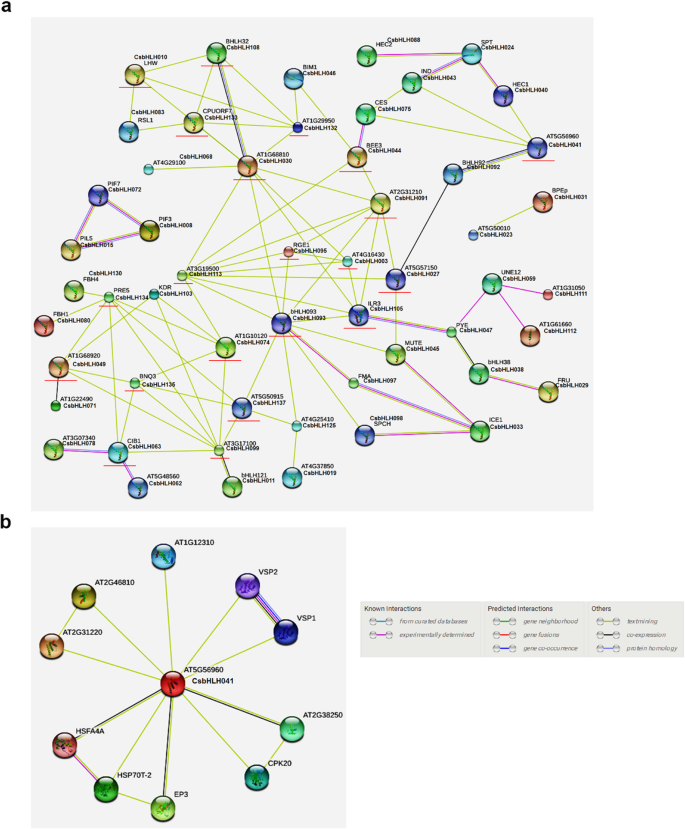
已经证明了网络交互分析是分析基因功能的有效方法[40].我们使用软件串10来预测142个CSBHLH蛋白中的蛋白质相互作用网络(图。8一种)。许多与多个CSBHLH相互作用的CSBHLH转录因子,与先前的报道一致,证明特定DNA序列的结合活性取决于通过BHLH蛋白的相互作用形成的同杂体或异二聚体[2].如图1所示。8A,有21种蛋白质与四个以上的其他BHLH蛋白质具有相关性,这可能使它们在调节植物应激反应和生长方面发挥重要作用,并且在表S6中显示了关于这些原脑道的详细信息。
在我们的研究中,CSBHLH041对盐和ABA处理的响应显著CSBHLH041可以增强对转基因的NaCl和ABA的耐受性拟南芥和黄瓜(图。5a - b;无花果。6;无花果。7).BHLH蛋白的功能主要通过与其他转录因子形成异二聚体或同型转录因子来实现,这对于它们与下游靶基因的结合至关重要[2].AT5G56960,CSBHLH041同源基因在蛋白质结合网络的中心,表明它在调节不同功能蛋白方面发挥了主要作用(图。8b;桌子S6).例如,EP3可能在正常植物生长和抗病抵抗中发挥作用[41.].VSP1和VSP2是抗昆虫蛋白,并响应茉莉酸甲酯和伤害,其中防御功能与其酸性磷酸酶活性相关[42.,43.].预测的基因关联网络为后续研究提供了有用的资源。
讨论
黄瓜的特性bHLH家庭
基本的螺旋环 - 螺旋(BHLH)转录因子家族是真核生物中的第二大家庭[10.,44.]和广泛的研究bHLH在各种植物中发现了家庭[2].例如,166bHLH基因已经在拟南芥[2,10.), 115年bHLH基因莲属椰子[45.],188bHLH苹果基因[40],167bHLH水稻基因[12.), 159年bHLH番茄中的基因[13.].bHLH转录因子参与了植物的多个生物过程,特别是在调节对生物和非生物胁迫的防御[46.].但是,我们很少了解bHLHs在黄瓜。在我们的研究中,142bHLH鉴定并表征了黄瓜基因。根据系统发育分析,将142个CSBHLH分为32个亚组(图。2a),多序列分析表明142个CsbHLH蛋白均存在保守的bHLH结构域(图1)。1).例如,两个氨基酸残基Leu-21和Leu-53在螺旋区中相对保守,对于形成二聚体至关重要。此外,保守序列分析表明,几乎所有142个CSBHLH蛋白质具有保守的1和2个图案。基因结构的分析和基序进一步支持142的系统发育关系CsbHLH基因(图。2公元前)。总而言之,这些结果表明所有142CsbHLHs有特点bHLH家庭,确认可靠性bHLH在黄瓜中发现的基因。
黄瓜的系统发育分析及演化bHLH基因
在模型工厂中拟南芥,BHLH基因家族已得到系统地分析[2,11.].目的探讨黄瓜142个CsbHLH蛋白与166个AtbHLH蛋白之间的进化关系拟南芥利用308个bHLHs蛋白构建系统发育树,聚类成23个亚家族(图1)。4).黄瓜和生理学的解剖和生理学存在差异拟南芥,所以某些演化支可能有不同的扩张模式bHLH黄瓜家族和拟南芥.如图1所示。4而表S4中,黄瓜的bHLH成员并非全部包含在这23个亚家族中,说明黄瓜和黄瓜之间存在差异拟南芥在进化过程中。
研究表明,基因重复事件在基因家族的快速扩张和进化中发挥了关键作用[26.].在黄瓜基因组中,我们鉴定了231个分段重复事件和1468个串联复制基因对(表S1)。七个分段重复事件和五个串联复制基因对CsbHLH家庭(图。3.一种)。通常,在不同的植物物种中,思工的基因功能在不同的植物物种之间进行高度保守,但它不是绝对的。因此,基于同时性分析,准确识别植物物种之间的真正正端性具有重要意义。结果表明,黄瓜基因组具有广泛的同步拟南芥和番茄基因组,和黄瓜之间的944和983个同义块拟南芥分别鉴定番茄基因组(表S5)。许多CsbHLH基因与番茄的关系呈线性关系拟南芥基因,分别(无花果。3.b;桌子S2).
以往的研究表明,同源基因通常分布在同一枝系中,具有相似的功能。在我们的研究中,许多CsbHLH蛋白被归为一些功能分支拟南芥,提供有价值的信息,用于研究职能CsbHLHs.将CSMYC1和CSBHLH042与ATGL3,ATEGL3,ATMYC1和ATTT分组,对这些蛋白质高度同源。在拟南芥,ATGL3,ATEGL3和ATTT8已被证明是花青素和PA生物合成的关键调节剂[22.].此外,AtGL3、atategl3和AtMYC1被证明调节毛状体形成和根毛模式[19.,47.].因此,CSMYC1和CSBHLH042可能可以控制黄瓜中的毛状体形成和PA生物合成。
黄瓜bHLH基因可能在非生物胁迫耐受中发挥重要作用
在植物响应非生物胁迫的过程中,bHLH转录因子作为调控基因,调控相关胁迫基因的表达变化,在胁迫响应中发挥重要作用。许多研究表明bHLH TFs可以对一系列的压力做出反应。例如,除了参与气孔的形态发生,TFs诱导剂的CBF EXPESSION1 (ICE1)和ICE2在拟南芥它们在其他物种中的同源基因在应对低温胁迫中发挥着关键作用[31.,46.].RERJ1在物理损伤和干旱压力对植物的情况下上调[48.].这些结果表明bHLH转录因子在应对非生物胁迫方面具有一定的作用。然而,人们对它的功能知之甚少bHLH在黄瓜的基因家庭。更好地分析蛋白质功能bHLH在黄瓜中的基因家族,我们对三个方面进行了初步分析,以揭示CsbHLH基因家族。
如何CIS.- 在启动子中的元素bHLH基因对环境的反应将影响它们在刺激和调节基因表达中的作用。CIS.-元素分析表明,基因启动子上存在多种元素CsbHLH对TCA-element、MBS和LTR等不同应力的响应。S3).许多c中存在参与干旱诱导的MYB结合位点bHLH基因启动子(表S3),表明MYB TFs可能调控cbHLHs干旱压力的表达。与ABA依赖性或独立应力耐受相关的富含TC和ABRE元素也出现在一些CS中bHLH基因启动子[49.].一般来说,根据CIS.- 促进剂中包含的元素,这些CSbHLH基因可能在黄瓜逆境响应中起着关键作用。此外,对50个CsbHLHs的功能进行了预测,这些功能主要与应激反应和发育过程有关(表S4)。第三方面,调控网络为142CsbHLH基因的预测表明,有一些基因可以对刺激做出反应(表S6)。例如,bHLH093和ICE1ABA信号通路是植物非生物胁迫响应的关键[49.,50].这些结果表明了bHLH基因家族也可能参与黄瓜对胁迫的响应、代谢调控和植株发育,这与前人的研究一致[10.,12.].随后,我们分析和筛选CsbHLH这些基因对提高黄瓜的抗逆性具有重要意义。根据CIS.-元素分析,启动子区60CsbHLH美国盛产TC-richCIS.-元素,提示它们可能参与应激反应和防御(图。S3).此外,启动子106CsbHLHs含ABA响应元件,响应ABA胁迫41CsbHLHs含有LTR元素,应对冷应力。之间的系统发育分析拟南芥而黄瓜则进一步显示25CsbHLHs可能会响应非生物胁迫,如ABA、盐、寒冷和干旱(表S4)。经过综合分析,我们仔细筛选了21、20和25bHLH可能响应低温(4℃),盐(NaCl)和ABA的基因。筛选CsbHLH基因所有响应于各自的应激条件下的应激处理(图。5).CSBHLH041被盐和aba诱发(图。5A-B),和35年代:CSBHLH041转基因拟南芥短暂转化的黄瓜子叶对盐和ABA的耐受性增强。6;无花果。7).通常,这些结果为进一步的功能研究提供了良好的参考CsbHLH在黄瓜的基因家庭。
结论
我们的研究调查bHLH在黄瓜细节的家庭基因。我们还在不同的应力处理下进行了所选基因的表达分析,以及以下功能CSBHLH041使用转基因方法。本研究为了解CsbHLH蛋白在黄瓜非生物胁迫耐受和生长发育中的功能和调控机制提供了新的思路。
方法
范围内识别CsbHLH基因黄瓜
识别CsbHLH来自整个黄瓜基因组数据库的基因家族成员,166个拟南芥使用BHLH蛋白作为查询序列和BLASTP针对预测的黄瓜蛋白搜索。此外,来自PFAM数据库的BHLH域(PF00010)的隐马尔可夫模型(HMM)配置文件(在线提供:http://pfam.janelia.org)也用作查询来搜索bHLH基因。我们进一步审查了所有候选人的BHLH域名bHLH如[24.].
系统发育分析和多序列比对
bHLHs的序列标识是通过将多个比对序列提交到网站(http://weblogo.berkeley.edu/logo.cgi.)[51].用142的对齐的完全预测的蛋白质序列构建了系统发育树bHLH使用MEGA7 (https://www.megasoftware.net/)[52].邻域连接(NJ)方法的参数如下:泊松校正、成对删除和bootstrap(1000次重复;随机种子)。系统发育树通过使用EvolView工具(http://www.evolgenius.info.).分类CsbHLH然后根据它们与相应基因的系统发育关系进行基因鉴定拟南芥bHLH基因。按照[26.].
保守的主题和基因结构分析
142年CsbHLH基因结构分析如[53].使用MEME确定CSBHLHS中的保守基序结构(http://meme-suite.org/index.html)[26.].
基因复制和染色体分布
基因重复事件被描述为[54].根据黄瓜基因组数据库中的物理位置信息,142CsbHLH如[型)所描述的那样映射到黄瓜染色体中的基因。26.],并且使用TBTOOLS完成了同期分析图[26.].
分析对bHLH黄瓜基因启动子
我们从黄瓜基因组数据库(Chinese Long 9930)中下载了整个黄瓜基因组序列,并提取了这142个转录起始位点上游的2kb长的序列CsbHLH基因。使用Plantcare分析这些基因的启动子区域上的顺式作用元素(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)软件(55].
植物材料和生长条件
黄瓜 (Cucumis巨大成功L. cv ' Xintaimici ')种子由山东农业大学曹晨兴教授提供,在湿润滤纸上28°C培养箱中发芽1天。在山东农业大学的一个普通照明培养箱中,发芽的种子被播种到土壤混合物中。10天后,将12株幼苗分批转移到一个塑料槽中,该塑料槽充满曝气营养液(pH 6.0-6.5),其中含有以下物质:Ca (NO3.)2:3.5毫米,kno3.: 7毫米,KH2宝4: 0.78 mM, MgSO4: 2mm, H3.薄3.: 29.6 μM, MnSO4: 10 μM, Fe-EDTA: 50 μM, ZnSO4: 1.0 μm, h2MoO4:0.05μm和cuso4: 0.95μM。实验如前所述进行[56].
RNA提取和QRT-PCR分析
从黄瓜中分离到总RNA拟南芥植物使用RNAPREP纯植物套件(天根,北京,中国),按照制造商的说明。随后,使用Primescript1st Strand cDNA合成试剂盒(Takara,Japan)逆转录。使用超薄混合物(用ROX I; CWBIOTECH)进行QRT-PCR反应与ICCLERE IQ5系统(Biorad,CA,USA)进行。结果被标准化为黄瓜的结果肌动蛋白基因。每次分析使用三种生物重复。本研究中使用的引物在表S7中提供。
过度表达矢量建筑,拟南芥黄瓜子叶中的转化和瞬态转化
的全长编码序列CSBHLH041重组到PCAMBIA1300载体中。构建体被转化为农杆菌肿瘤术LBA4404,用于转化拟南芥植物和8-D-alg黄瓜子叶[57].的拟南芥种子是哥伦比亚(Col-0),在我们的实验室中繁殖。纯合T3转基因拟南芥用300 mg/L的潮霉素筛选鉴定。
非生物胁迫耐受性测定和ABA敏感性分析
为拟南芥盐胁迫和aba治疗,种子CSBHLH041T3发电纯合线和COL-0(WT)在盆中的蛭石土中播种,并在22℃下在正常条件下培养3周。对于盐处理,每隔一天用3周龄幼苗用200mM NaCl溶液浇水,并且Col-0(WT)的生长和CSBHLH041每4天观察一次转基因株系。对3周龄的幼苗进行ABA处理,每隔一天用100 μM ABA溶液浇灌一次,每4天评估一次表型。检查种子发芽率应对盐胁迫和ABA处理、Col-0的种子(WT)和转基因线表面消毒和播种在1/2 MS培养基补充2μM氯化钠ABA或100毫米,分别在正常条件下生长箱22°C。在培养皿上培养7天后测定发芽率。
测定8 d龄黄瓜幼苗对盐胁迫的耐受性和ABA敏感性35年代和35年代:CSBHLH041,选择生长等效的幼苗移栽到6 L营养液中进行水培生长。采用Hoagland营养液进行培养,幼苗水培2 d后再进行盐和ABA处理。然后用盐和ABA处理,最终浓度分别为100 mM和100 μM。为保证试验的可靠性,黄瓜幼苗采用暂渗处理35年代和35年代:CSBHLH041在同一个水培箱中培养。观察了转基因和对照幼苗在不同时期的变化。
生理参数的测定
黄瓜的子叶35年代空的向量和35 s: CsbHLH041在盐和ABA应力处理期间在不同时间点收集幼苗,然后在液氮中冷冻以进行后续实验。如前所述确定超氧化物歧化酶(SOD),过氧化物酶(POD)和过氧化氢酶(猫)的活性[58].
功能注释和蛋白质关联网络预测
我们将142个CSBHLH蛋白序列提交给在线服务器(版本10.0版;http://string-db.org).有关详细信息如[40].
数据和材料的可用性
支持结果的数据包含在本文及其附加文件中。其他相关资料可向通讯作者提出合理要求。
缩写
- bHLH:
-
基本Helix-Loop-Helix
- 在:
-
拟南芥
- CS:
-
Cucumis巨大成功l
- 小姐:
-
Murashige和Skoog.
- 存在:
-
定量逆转录-PCR
- CD:
-
编码序列
- 阿坝:
-
脱盐酸
- pI:
-
等电点
- WT:
-
野生型
参考
- 1。
Riechmann JL,听到J,Martin G,Reuber L,Jiang C,Keddie J等人。拟南芥转录因子:真核生物中的基因组对比分析。科学。2000; 290:2105-10。
- 2。
cartero - paulet L, Galstyan A, rog - villanova I, Martinez-Garcia JF, Bilbao-Castro JR, Robertson DL。转录因子家族的全基因组分类与进化分析拟南芥,杨树,米,苔藓和藻类。植物理性。2010; 153:1398-412。
- 3。
Ferré-d'amaréar,Prendergast GC,Ziff Eb,Burley Sk。通过二聚体B / HLH / Z结构域通过其同源DNA的Max识别。自然。1993; 363:38-45。
- 4.
一种新的DNA结合和二聚基序的免疫球蛋白增强子结合,无子体,MyoD和myc蛋白。细胞。1989;56:777 - 83。
- 5.
Shimizu T,Toumoto A,Ihara K,Shimizu M,Kyogoku Y,Oogawa N,Oshima Y,哈科菊T.PHO4 BHLH结构域-DNA复合物的晶体结构:侧翼基础识别。Embo J. 1997; 16:4689-97。
- 6.
螺旋-环-螺旋蛋白:真核生物转录调控因子。《细胞生物学》2000;
- 7.
Nair Sk,Burley Sk。识别图书馆中的DNA。自然。2000; 404:715,717-8。
- 8.
Atchley WR,Terhalle W,衣服A.在BHLH蛋白质结构域中的位置依赖性,群体和预测基序。J Mol Evol。1999; 48:501-16。
- 9.
David C,Pierre K,Morgane TC,Gemma R,ValérieL,Elena S,Degnan BM,Michel V. Metazoans基本Helix-Loop-Helix基因家族的起源和多样化:来自比较基因组学的见解。BMC EVOL BIOL。2007; 7:33。
- 10。
托莱多 - ortiz g,huq e,鹌鹑pH。的拟南芥基本/螺旋-环-螺旋转录因子家族。植物细胞。2003;15(8):1749 - 70。
- 11.
Heim MA, Jakoby M, Werber M, Martin C, Weisshaar B, Bailey PC。植物中基本的螺旋-环-螺旋转录因子家族:蛋白质结构和功能多样性的全基因组研究。中国生物医学工程学报。2003;20(5):735-47。
- 12.
acta photonica sinica, 2011, 38(5): 732 - 736 .李鑫,段鑫,姜浩,孙勇,唐勇,袁卓,等。水稻基本/螺旋-环-螺旋转录因子家族的全基因组分析拟南芥.植物理性。2006; 141(4):1167-84。
- 13。
孙辉,范宏杰,凌汉平。番茄bHLH基因家族的全基因组鉴定与特性分析。BMC基因组学。2015;16:9。
- 14。
Ludwig SR,Habera LF,Dellaporta SL,Wessler SR。LC是负责组织特异性的花青素产生的玉米R基因家族的成员,编码类似于转录活化剂的蛋白质,含有Myc-Moarology地区。Proc Natl Acad Sci U S A. 1989; 86:7092-6。
- 15.
pak I, Kathare PK, Kim JI, Huq E.从多个过程扩展pif在信号集成中的作用。摩尔。2017;10(8):1035 - 46。
- 16.
Lee S, Lee S, Yang KY, Kim YM, Park SY, Kim SY,等。过表达PRE1及其同源基因激活赤霉素依赖的反应拟南芥.植物细胞生理。2006; 47(5):591-600。
- 17.
Feyissa DN,Lovdal T,Olsen Km,Slimestad R,Lillo C.内源GL3,但不是EGL3,基因是由氮耗尽诱导的花青素积累所必需的拟南芥玫瑰叶子。足底。2009;230(4):747 - 54。
- 18.
Appelhagen I,Jahns O,Bartelniewoehner L,Sagasser M,Weisshaar B,Stracke R. leucoanthocyanidin Dioxygenase拟南芥:突变等位基因和MYB-BHLH-TTG1转录因子复合物的调节。基因。2011; 484(1-2):61-8。
- 19.
Ramsay Na,Glover BJ。MYB-BHLH-WD40蛋白质复合物和细胞多样性的演变。趋势植物SCI。2005; 10(2):63-70。
- 20。
翟y,张l,夏c,富士,赵g,jia j等。小麦转录因子塔-39改善了转基因植物中的多个非生物胁迫源的耐受性。Biochem Biophys Res Communce。2016; 473(4):1321-7。
- 21。
Fernández-Calvo P, Chini A, Fernandez-Barbero G, Chico JM, Gimenez-Ibanez S, Geerinck J,等。的拟南芥bHLH转录因子MYC3和MYC4是JAZ阻遏子的靶标,在茉莉酸反应的激活中与MYC2共同作用。植物细胞。2011;23(2):701 - 15所示。
- 22。
李硕。类黄酮生物合成的转录调控。植物信号处理研究。2014;9:e27522。
- 23。
黄S,Li R,Zhang Z,Li L,GU X,FAN W等人。黄瓜的基因组,Cucumis巨大成功L. Nat Genet。2009; 41(12):1275-81。
- 24。
Letunic I, Doerks T, Bork P. SMART 6:最新更新和新发展。核酸研究2009;37(数据库期):D229-32。
- 25。
程晓,熊荣,刘慧,吴敏,陈芳,韩伟,向勇。毛竹基本的螺旋-环-螺旋基因家族的全基因组鉴定、系统发育和表达。植物生理学杂志。2018;132:104-19。
- 26。
孙浩,庞波,严军,王涛,王磊,陈超,等。黄瓜赤霉素氧化酶家族基因综合分析及CsGA20ox1在根发育中的功能特性拟南芥.int j mol sci。,2018; 19(10)。
- 27。
Babitha KC,Vemanna Rs,Nataraja Kn,Udayakumar M. eCBHLH57转录因子的过度表达Eleusine Coracana.L.在烟草中赋予盐,氧化和干旱胁迫的耐受性。Plos一个。2015; 10(9):e0137098。
- 28.
拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)在脱落酸信号转导中具有转录激活因子的作用。植物细胞。2003;15(1):63 - 78。
- 29.
Petridis A,Doll S,Nichelmann L,Bilger W,Mock HP。Arabidopsis Thaliana G2样黄酮调节剂和芸苔类固醇增强表达式是黄酮类化合物积聚的低温调节剂。新植物。2016; 211(3):912-25。
- 30.
Sasaki-Sekimoto Y,Saito H,Masuda S,Shirasu K,OHTA H. jaz蛋白和BHLH转录因子之间的蛋白质相互作用综合分析,所述jasmonate信号传导。植物信号表现。2014; 9(1):E27639。
- 31.
歌曲S,qi t,风扇m,张x,gao h,huang h等。BHLH亚组IIID因子负面调节茉莉植物防御和发展。Plos Genet。2013; 9(7):E1003653。
- 32.
Le Hir R, Castelain M, Chakraborti D, Moritz T, Dinant S, Bellini C. AtbHLH68转录因子参与ABA稳态调控和干旱胁迫耐受性拟南芥.physiol植物。2017; 160(3):312-27。
- 33.
秦努沙米V, Ohta M, Kanrar S, Lee BH, Hong X, Agarwal M, Zhu JK.。ICE1:一种冷诱导转录组和冻结耐受性的调节因子拟南芥.基因开发。2003; 17(8):1043-54。
- 34。
Ahmad A,Niwa Y,Goto S,Ogawa T,Shimizu M,Suzuki A等人。BHLH106通过其G盒整合多基因的功能,以赋予耐盐性拟南芥.Plos一个。2015; 10(5):E0126872。
- 35。
库尔特F,菲利兹E.全基因组和比较分析bhlh38.,BHLH39.,BHLH100.和Bhlh101基因拟南芥、番茄、水稻、大豆和玉米:铁(Fe)稳态的洞察力。Biometals。2018;31(4):489 - 504。
- 36。
短句来源Sharma N, Xin R, Kim DH, Sung S, Lange T, Huq E. NO flower IN SHORT DAY (NFL)是一种bHLH转录因子,在短日照条件下促进开花拟南芥.发展。2016;143(4):682 - 90。
- 37。
Karas B, Amyot L, Johansen C, Sato S, Tabata S, Kawaguchi M,等。保护荷花及拟南芥基本的螺旋环螺旋蛋白揭示了根发发育的新球员。植物理性。2009; 151(3):1175-85。
- 38。
杨牛,江米,王米,薛思,朱吕,王鹤,等。BHLH转录因子丝氨酸186的磷酸化语无无词语促进气孔发育拟南芥.摩尔。2015;8(5):783 - 95。
- 39。
Chakraborty M, Gangappa SN, Maurya JP, Sethi V, Srivastava AK, Singh A等。MYC2和HY5的功能相互关系在其中起着重要作用拟南芥幼苗发展。工厂J. 2019; 99(6):1080-97。
- 40。
毛泽东,董Q,李C,刘C,MA F.基因组鉴定与苹果BHLH转录因子的鉴定与表征,响应干旱和盐胁迫的表达分析。前植物SCI。2017; 8:480。
- 41。
parsarinho PA, Van Hengel AJ, Fransz PF, de Vries SC.表达模式Arabidopsis Thaliana Atep3 / Atchitivindochitinase基因。Planta。2001; 212(4):556-67。
- 42。
Berger S,Bell E,Mullet Je。两种茉满面不敏感突变体显示出ATVSP的改变响应于茉莉酸甲酯和伤害而改变的ATVSP表达。植物理性。1996; 111:525-31。
- 43。
Chi YH, Jing X, Lei J, Ahn JE, Koo YD, Yun DJ,等。AtVSP在昆虫消化道中的稳定性决定了它的防御能力。昆虫生理学杂志。2011;57(3):391-9。
- 44。
基本的螺旋-环-螺旋蛋白家族:比较基因组学和系统发育分析。基因组研究》2001;11:754 - 70。
- 45。
acta photonica sinica, 2011, 38(5): 689 - 693 .毛泰,刘玉英,朱焕红,张娟,杨建新,傅强,等。bHLH基因家族的全基因组分析揭示了水生植物的结构和功能特征莲属椰子.PeerJ。2019; 7: e7153。
- 46。
冯XM,赵Q,Zhao Ll,乔y,Xie XB,Li Hf等。冷诱导的基本螺旋环 - 螺旋转录因子基因MdCIbHLH1在苹果中编码一种类似ice的蛋白质。中国生物医学工程学报(英文版),2012;
- 47。
赵H,王X,朱D,崔S,Li X,Cao Y等。通过基本螺旋环 - 螺旋转录因子AtmyC1的IIIf亚家族中的单个氨基酸取代通过废除与合作蛋白的相互作用而导致滴毛组和根毛图案化缺陷拟南芥.中国生物医学工程学报,2012;
- 48。
Kiribuchi K, Jikumaru Y, Kaku H, Minami E, Hasegawa M, Kodama O等。基本螺旋-环-螺旋转录因子RERJ1参与水稻损伤和干旱胁迫反应。生物化学与生物技术。2005;69:1042-4。
- 49。
陈L,陈烨,江j,陈某,陈文,关z,方w.菊花冰冰冰的组成型表达Chrysanthemum Grandiflorum提高耐低温、耐盐、耐干旱水平。Plant Cell Rep. 2012;31(9): 1747-58。
- 50.
JP,张XW,BI SQ,You CX,Wang XF,Hao YJ。MDBHLH93是一种苹果活化剂调节叶片衰老,由ABA和MDBT2以拮抗方式调节。2019年新的Phytol 2019:222(2):735-751。
- 51.
Crooks GE, Hon G, Chandonia JM, Brenner SE。WebLogo:一个序列logo生成器。基因组研究》2004;14:1188 - 90。
- 52.
Kumar S, Stecher G, Tamura K. MEGA7:针对更大数据集的分子进化遗传学分析7.0版。中国生物医学工程学报。2016;33(7):1870-4。
- 53.
郭艾,朱QH,陈X,罗杰。GSD:基因结构显示服务器。易川。2007; 29:1023-6。
- 54.
王y,唐,debarry jd,tan x,li j,wang x等。McScanx:一种用于检测和进化分析的工具包,对基因同步和共线性分析。核酸RES。2012; 40:E49。
- 55.
Lescot M,Dehais P,Thijs G,Marchal K,Moreau Y,De Peer YV等。Plantcare,植物顺式动作调节元件和促进剂序列中硅分析的工具的门户网站。核酸RES。2002; 30:325-7。
- 56.
李Q,赵P,李杰,张C,王L,仁Z.Cucumber和拟南芥中WD重复蛋白家族的基因组分析。Mol Gen Genomics。2014; 289:103-24。
- 57.
刘敏,张超,段玲,栾青,李娟,杨安,等。CsMYB60是决定黄瓜果实刺颜色的黄酮醇和原花青素的关键调控因子。实验机器人。2019;70(1):69-84。
- 58。
张X,陈L,Shi Q,Ren Z.SLMYB102是一个r2r3型MYB基因,在转基因番茄中具有耐盐性。植物科学。2020;291:110356。
致谢
我们感谢山东农业大学园艺科学与工程学院Chenxing Cao博士,提供黄瓜(Cucumis巨大成功L. cv ' Xintaimici ')种子。
资金
山东省自然科学基金项目(no . JQ201309);山东省“双拔尖”项目(no . SYL2017YSTD06);山东省人民政府“泰山学者”基金项目(no . ts20130932)。关键词:岩石力学,应力-应变关系,应力-应变关系该基金在研究设计、数据分析和稿件准备方面没有发挥作用。
作者信息
隶属关系
贡献
JL和ZR构思并设计了实验。JL、TW和JH进行了实验。JL对数据进行分析并撰写稿件。ZR修改了手稿。所有作者均已阅读并批准本稿件。
相应的作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
额外的文件1。
补充无花果。S1 ~ S4。(图S1。142个CsbHLH蛋白的10个保守基序;图S2。142的基因组位置CsbHLH7条染色体上的基因;图S3。顺式元素分析CsbHLH基因启动子区;图。S4。共同表达网络CsbHLH基因)。
附加文件2:表S1。
串联重复和分段重复事件。
附加文件3:表S2。
同线性分析bHLH基因在黄瓜、Arabidpsis和番茄。
附加文件4:表S3。
CIS.-元素在142的发起人CsbHLH基因。
附加文件5:表S4。
预期的功能CsbHLHs用其同系物的功能进行验证拟南芥通过系统发育分析。
附加文件6:表S5。
同构块之间的黄瓜和拟南芥和番茄基因组。
附加文件7:表S6。
字符串蛋白质注释。
附加文件8:表S7。
用于QRT-PCR的引物。
额外的文件9。
凝胶图像。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
李军,王涛,韩军。等等。黄瓜全基因组的鉴定与鉴定bHLH家族基因和功能表征CSBHLH041在NaCl和Aba宽容拟南芥和黄瓜。BMC植物BIOL.20,272(2020)。https://doi.org/10.1186/s12870-020-02440-1
收到了:
接受:
发表:
关键词
- 非生物胁迫
- bHLH家庭
- 黄瓜
- CSBHLH041
- 表达式模式
- 监管网络