摘要
背景
儿茶素、咖啡因和茶氨酸是茶叶中的三种重要代谢物,在特定味道的形成中起着至关重要的作用,并对人类的健康有潜在的益处。然而,关于这些代谢物含量随季节的动态变化,以及候选的调控因素,目前仍未确定。
结果
采用转录组学和代谢组学相结合的方法分析了儿茶素、咖啡因和茶氨酸等三种主要代谢物的动态变化,并探讨了与这些动态变化相关的潜在影响因素。我们发现夏季儿茶素丰度高于春秋两季,茶氨酸丰度在春季显著高于夏秋两季,而咖啡因在三个季节间没有明显变化。转录组学分析表明,光合途径基因显著下调,这可能与不同季节茶叶中不同表型的形成和代谢产物含量有关。在儿茶素生物合成中检测到9个基因56个副本,咖啡因生物合成中检测到10个基因30个副本,茶氨酸生物合成中检测到6个基因12个副本。相关分析进一步表明,有8个基因受转录因子调控,且与茶叶代谢产物丰度的变化高度相关。
结论
日照强度作为影响茶树光合作用的关键因素,进而影响茶树中主要转录因子(TFs)和结构基因的表达,最终导致茶树三个季节中不同数量的儿茶素、咖啡因和茶碱。这些研究结果为研究茶在不同季节代谢产物的丰度及其影响因素提供了新的视角,并进一步加深了我们对茶叶风味、营养和药用功能形成的认识。
背景
茶产自茶树是一种重要的无酒精饮料,每天被全球160个国家的30多亿人消费[1].目前,据报道,茶树在100多个国家进行商业种植,每年生产超过500万吨茶饮料[2,3.,4].茶的故事始于公元前2737年的中国。中国仍然是最大的茶叶生产国,年产量190万吨[5,6]在15个省份拥有100多个官方认可的茶树品种[7,8].信阳毛尖茶是中国传统名茶之一,具有独特的风味。一些证据表明,这些特定的味道与特定的次生代谢产物的丰度高度相关,如多酚、茶氨酸、咖啡因、维生素、挥发油、多糖和矿物质[2,3.,6].在这些代谢物中,多酚类、咖啡因和茶氨酸通常被认为是具有独特功能的化合物,它们在特殊口味的形成以及营养和药用特性的形成中起着关键作用[6,9,10,11].
儿茶素是一种独特的多酚类物质,占茶叶干重的12-24% [8]以及绿茶中70-75%的苦味和涩味[12].茶叶中的儿茶素包括四种游离类型,包括(+)-儿茶素(C)、(-)-表儿茶素(EC)、(+)-没食子儿茶素(GC)、(-)-没食子儿茶素-3-没食子儿茶素(EGC)和四种没食子儿茶素-3-没食子儿茶素-3-没食子儿茶素(ECG)、(-)-没食子儿茶素-3-没食子儿茶素-3-没食子儿茶素-3-没食子儿茶素(EGCG)。其中,没食子酸儿茶素是造成苦味和涩味的主要因素[13].此外,临床研究显示儿茶素对人体的有益作用,如抗氧化活性,有助于心血管健康[14],抑制癌细胞生长,抑制血凝块形成,降低血小板聚集,调节血脂[15].
茶氨酸是茶叶中的另一种重要化合物,是非蛋白质氨基酸,占茶叶干重的1-2% [16]使一些茶饮料具有香甜可口的味道[11].茶氨酸最初是在茶根中生物合成的,然后通过韧皮部转移到生长的芽中,最后在发育中的叶子中积累。一些研究表明,茶树中茶氨酸的生物合成与阳光和热量等环境因素高度相关[11].茶氨酸可以水解回乙胺,并进一步作为儿茶素在长期阳光照射下生物合成的前体。另一方面,在阳光照射较少的条件下生长的茶树呈现出更高浓度的茶氨酸和更低数量的儿茶素。此外,茶氨酸还显示出对人类健康的潜在益处,如增强放松和免疫系统,提高注意力和学习能力,预防某些癌症,促进减肥[11].
咖啡因作为甲基黄嘌呤的重要成员,对茶叶干重的贡献为3%,一直被认为是评价茶叶嫩嫩程度的标志[17].在茶饮料中,咖啡因具有苦味,对茶的鲜度有显著的贡献[16].咖啡因还能刺激中枢神经系统,增强人体内的心理和生理活动。18].英国食品标准局强烈建议孕妇每天摄入的咖啡因应少于300毫克,因为咖啡因有可能导致自然流产或婴儿出生体重过低[19].
研究表明,儿茶素、咖啡因和茶氨酸的含量是由茶叶品种等因素决定的。6]、海拔[20.]、轧制方法及加工阶段[16].然而,有关这些化合物的季节变化的信息被低估了。因此,本研究采用转录组学和代谢组学相结合的方法,定量研究这些化合物在不同季节茶叶中的动态变化,并阐明与这些变化相关的主要基因和转录因子。
结果
茶叶样品的表型特征
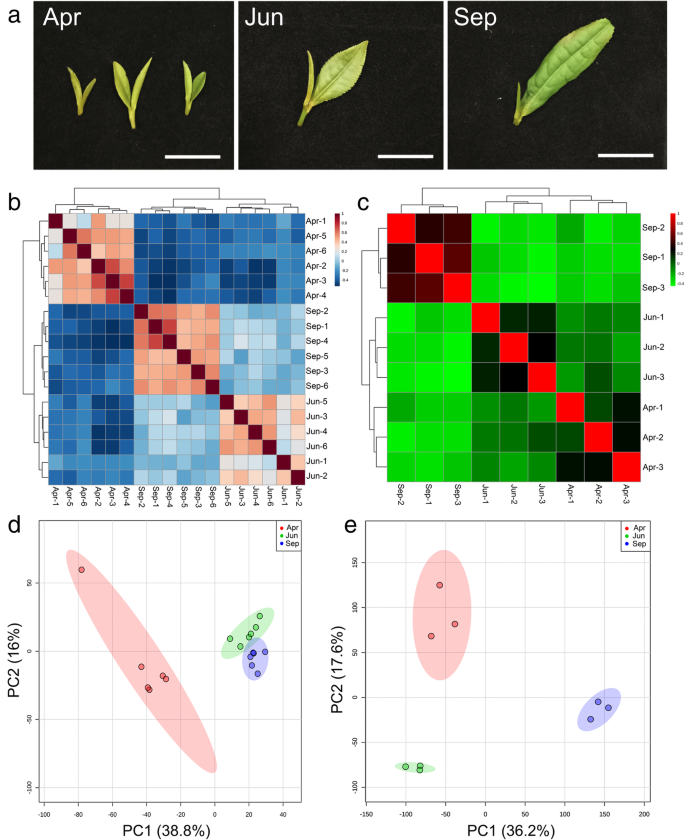
获得的茶叶组织在春、夏、秋三个季节表现出不同的表型。春季(4月)芽和初叶较夏季和秋季嫩。春、夏、秋茶叶组织颜色分别为浅绿色、绿色和浅黄色。此外,还计算了每个采集样品的初叶和初芽的长度,以及叶片与芽的比例。结果表明,秋季的长度比为4,高于夏季(1.6)和春季(0.8)。1).
代谢和遗传差异
采用非靶向超高效液相色谱/四极杆飞行时间质谱(UPLC/ Q-TOF-MS /MS)系统对不同季节茶叶样品进行代谢分析(每个季节6个重复)。在主要检测到的4840个峰中,通过检索人类代谢组数据库(HMDB)和茶叶代谢组数据库(http://pcsb.ahau.edu.cn:8080/TCDB/f).从每个样品中鉴定出的化合物中去除低质量数据(每组中空白数据超过60%,270个化合物)。过滤后,2813个确定的假定峰用于下游统计分析。
代谢组学数据的热图分析显示,18个样本明显分为三个组,分别对应三个季节(春、夏、秋)(图。1B),说明三个季节采集的茶叶样品具有不同的代谢特征。同样,转录组学数据也清楚地分为三组,表明三个季节的茶叶样品具有不同的遗传特征(图2)。1c).根据代谢组学和转录组学数据集的主成分分析(pca)确定了三个不同的组(图2)。1A和e)。
差异表达基因(DEG)的鉴定、分类及验证
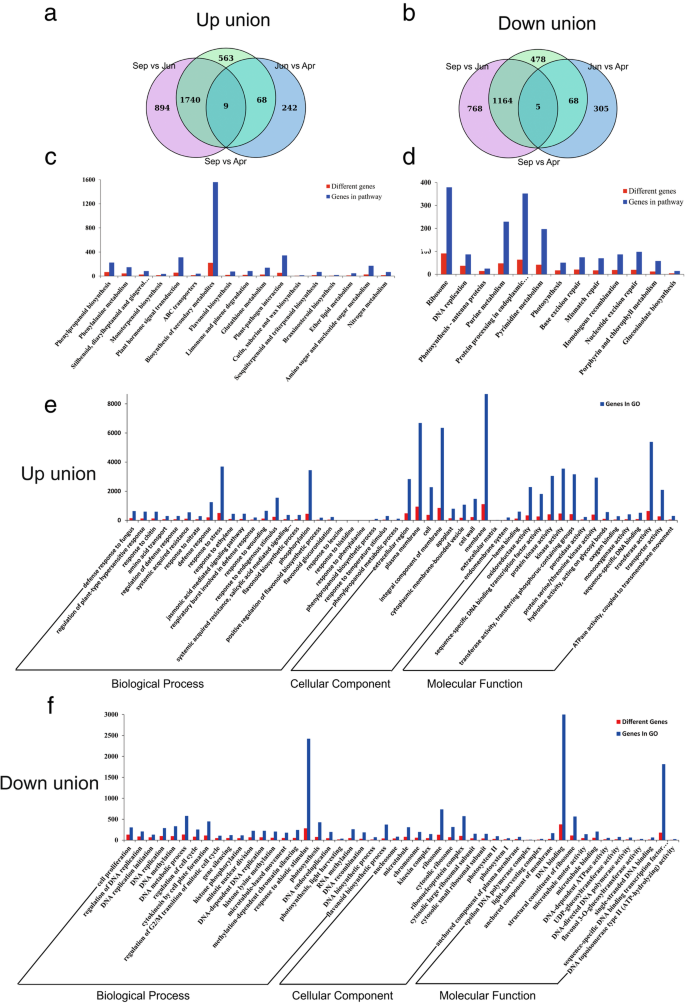
从转录组中获得了超过6gb的原始数据,每个样本的总阅读数为4180万到4990万。4月、6月和9月的茶叶基因组序列一致率分别为82.23、77.83和81.20% (表S1).在|log2FC| > 1和FDR < 0.05的标准下,进行两两比较分析,得到上调基因3516个,下调基因2788个(表S2).在不同季节采集的茶叶样品中,9月与6月、9月与4月、6月与4月的比较中,有894、242和563个上调的DEGs重叠(图2)。2a).在9月与6月、9月与4月、6月与4月的比较中,分别检测到768、305和478个下调基因并有重叠(图。2b).此外,在三个季节比较中均发现了9个上调基因和5个下调基因(图。2a、b)。
通路分析随后基于京都基因和基因组百科全书(KEGG)数据库(表S3).上调基因主要按照苯丙类生物合成、苯丙氨酸代谢、二苯乙烯类二芳基庚烷、姜辣素生物合成进行分组。还发现了与儿茶素生物合成相关的其他术语,包括类黄酮和次生代谢物生物合成(图2)。2c).在13个KEGG术语中,下调基因显著富集,这些术语大多与光合作用和核酸代谢有关,包括核糖体、DNA复制、光合作用-天线蛋白、光合作用、碱基切除修复、错配修复、同源重组、核苷酸切除修复(图)。2一个)。
基因本体论(GO)中的基因可分为三个主要类别:生物过程(BP)、分子功能(MF)和细胞成分(CC)类别(表S4).在BP类中,表达上调的基因在胁迫响应、磷酸化项上富集显著,富集最多的三个项分别是对真菌的防御反应、膜靶向蛋白、植物型超敏反应的调控(图2)。2e).丰富了黄酮类生物合成过程相关术语,包括黄酮类生物合成过程、黄酮类生物合成过程的正向调控、黄酮类葡萄糖醛酸化、对苯丙氨酸的响应、苯丙类生物合成过程、对温度刺激的响应、苯丙类代谢过程等(图。2e).下调基因对非生物刺激项的响应显著富集,相关度最高的6个相关项分别与DNA复制与细胞增殖、DNA复制调控、DNA复制启动、DNA复制、DNA甲基化、DNA代谢过程相关。与DNA生物合成相关的其他术语也被观察到(图。2f).在CC类中,基因上调的主要三个GO术语是胞外区域,包括血浆、膜和细胞(图。2e).观察到与细胞成分相关的其他术语,包括膜的整体成分、外质体、细胞壁与膜、内膜系统(图)。2e).下调基因最主要的三个术语是核小体、微管和染色体,这三个术语与核酸有关(图。2f).在MF类中,对于上调的基因,排名前三的是血红素结合、氧化还原酶活性和序列特异性DNA结合转录因子活性(图。2e).基因下调的前三个术语分别是DNA结合、核糖体结构组成和微管运动活性(图。2f)。
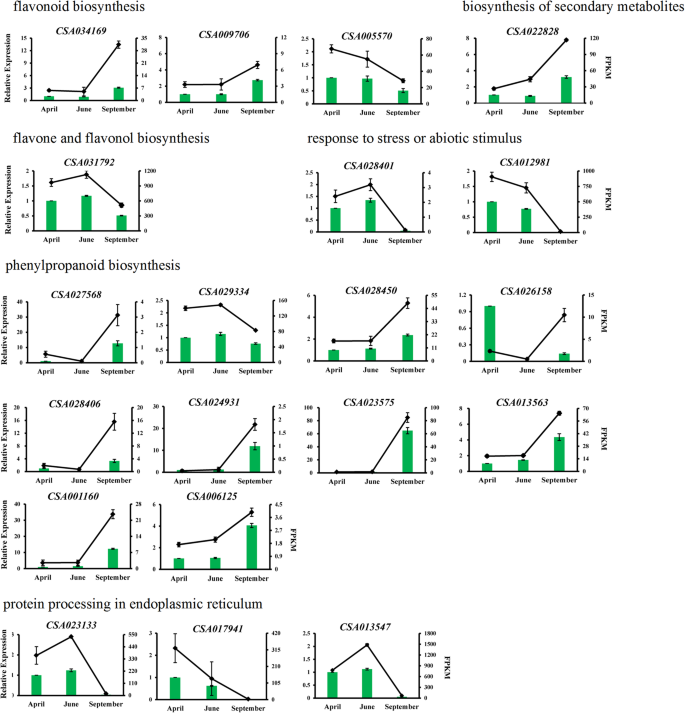
通过实时定量聚合酶链式反应(qRT-PCR)验证了RNA-Seq数据的可靠性。随机抽取20个DEGs进行qRT-PCR检测,预测这些DEGs与黄酮类生物合成(CSA034169、CSA009706、CSA005570)、黄酮和黄酮醇生物合成(CSA031792)、苯丙类生物合成(CSA029334、CSA028450、CSA028406、CSA027568、CSA026158、CSA024931、CSA023575、CSA013563、CSA001160、CSA006215)、次生代谢产物生物合成(CSA022828)、内质网蛋白加工(CSA023133、CSA017941、CSA013547)有关,对压力或非生物刺激的反应(CSA028401, CSA012981)。在所选的20个基因中,有1个基因(CSA026158)的表达与RNA-Seq数据不一致,其余19个基因(占20个基因的95%)与RNA-Seq数据一致。所观察到的感兴趣基因的表达模式与之前的RNA-Seq数据一致,证实了RNA-Seq结果的可靠性(图2)。3.).
儿茶素,咖啡因和茶氨酸的目标定量
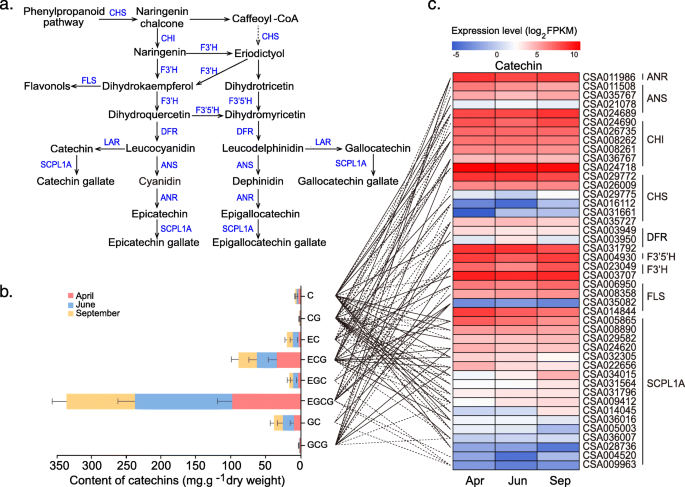
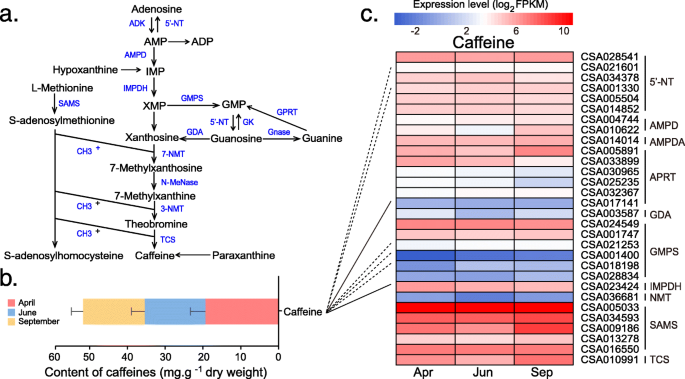
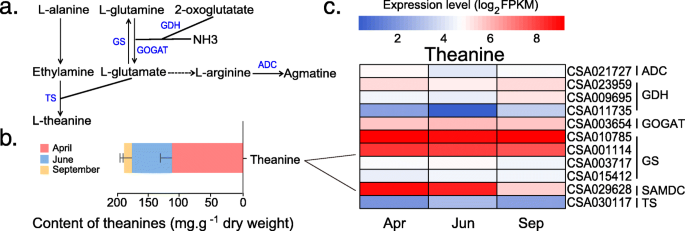
采用高效液相色谱法对三个季节茶叶样品中的儿茶素、咖啡因和茶氨酸进行定量分析。4 b,5Bband6 b).代谢物(咖啡因、儿茶素和茶氨酸)含量也在三个季节呈现动态变化。6月(夏季)茶叶中儿茶素总含量(203.44 mg/g)高于4月(春季)茶叶(151.88 mg/g)和9月(秋季)茶叶(153.19 mg/g)。茶叶中检测到C、EC、EGC、GC、CG、ECG、EGCG、GCG等8种儿茶素。在这些儿茶素中,EGCG的丰度在任何茶叶样品中都高于其他化合物。6月EGCG丰度(139.60 mg/g)高于4月(98.22 mg/g)和9月(97.97 mg/g)。ECG是第二丰富的化合物,在不同的季节范围为26.07 ~ 33.85 mg/g。4b).不同季节茶叶中咖啡因含量无显著差异(图2)。5b).此外,4月采集的茶叶中茶氨酸丰度为113.64 mg/g,分别高于6月(63.98 mg/g)和9月(11.68 mg/g)。6b)。
基因表达与代谢物丰度的相关性分析
转录组数据显示有14个基因参与儿茶素生物合成途径。儿茶素生物合成由苯丙素衍生,受10多个基因调控,合成4种儿茶素(命名为C、EC、EGC和GC),再经SCPL1A (1A型丝氨酸羧肽酶类酰基转移酶)催化合成没食子酸儿茶素(命名为CG、ECG、EGCG和GCG)(图。4a).在转录组数据中,我们检测到9个参与儿茶素生物合成的基因,分别是查尔酮合成酶(CHS, 6个副本)、查尔酮异构酶(CHI, 6个副本)、花青素还原酶(ANR)、F3’h(黄酮3-羟化酶,2个副本)、F3’5’h(类黄酮3’,5’-羟化酶)、DFR(二氢黄酮4-还原酶,2个副本)、FLS(黄酮醇合成酶,4个副本)、ANS(花青素合成酶,4个副本)和LCR(白花青素还原酶)。其中部分多拷贝基因在春、夏、秋季表现出不同的表达水平。此外,这些基因的表达与三个季节儿茶素浓度高度相关(Pearson相关检验> 0.9,p< 0.05) (表S5).
在咖啡因的生物合成过程中,腺苷(一种基本底物)在大约10种酶的催化下,经过10多个步骤最终形成咖啡因(图2)。5a).相关分析显示,5’-NT(5’-核苷酸酶)、GMP合成酶、基因与咖啡因丰度呈负相关;APRT(腺嘌呤磷酸核糖基转移酶)和IMPDH (IMP脱氢酶)基因与茶叶中咖啡因含量呈正相关(图2)。5c). l -茶氨酸是由l -丙氨酸、l -谷氨酰胺和2-氧戊二酸盐等底物从头合成的。咖啡因的生物合成由5个重要基因介导,包括TS(茶氨酸合成酶)、GS(谷氨酰胺合成酶)、GOGAT(谷氨酸合成酶)、GDH(谷氨酸脱氢酶)、SAMDC (s -腺苷甲硫氨酸脱羧酶)和ADC(精氨酸脱羧酶)(图5)。6a). ADC、GOGAT、SAMDC、TS基因为单拷贝,egdh、GS基因为多拷贝。相关分析表明,GS和SAMDC基因与茶叶中茶氨酸丰度呈正相关(图2)。6c)。
鉴定与主要代谢物含量变化相关的转录因子
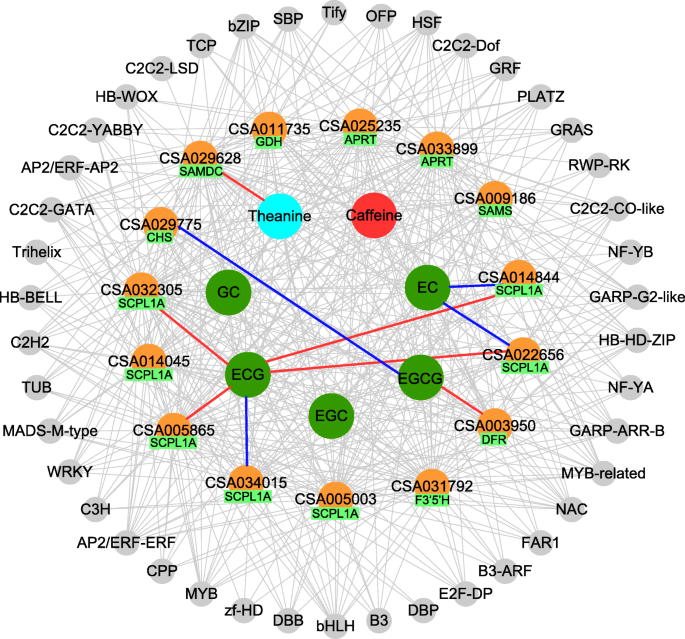
构建转录因子(TFs)-基因表达-代谢物网络,以识别可能与主要代谢物含量变化相关的重要转录因子(图2)。7,表S6).网络共包含42个TF科的76个TF。多复制转录因子分为NAC(6个)、AP2/ERF-ERF(4个)、WRKY(4个)和bHLH(3个)家族。这些转录因子与儿茶素(CHS、F3’5’h、SCPL和DFR)、咖啡因(APRT和SAMS)和茶氨酸(SAMDC和GDH)生物合成基因表达高度相关,表达质量为> 0.5。其中一些与代谢产物丰度高度相关的富集基因在三个季节发生了显著变化。儿茶素生物合成过程中,含量最高的儿茶素EGCG与DFR基因(CSA003950)的表达呈正相关,与CHS基因(CSA029775)的表达呈负相关。心电图与SCPL1A基因CSA032305、CSA005865、CSA022656、CSA014844呈正相关,与SCPL基因CSA034015呈负相关。在茶氨酸生物合成方面,SAMDC基因(CSA029628)与TFs高度相关,并与不同季节茶叶中茶氨酸丰度呈正相关。然而,咖啡因生物合成在不同季节间的变化要小于其他两种化合物。有4个基因(CSA011735、CAS025235、CSA033899、CSA009186)与TFs相关,与不同季节茶叶中咖啡因含量无显著相关性(图2)。7).
讨论
茶叶中儿茶素、咖啡因和茶氨酸这三种重要化合物的含量因季节而异,主要有助于茶叶的风味、营养和药用价值。然而,这些化合物在茶叶中的动态变化以及潜在的影响因素仍未确定。本研究采用转录组学和代谢组学相结合的方法,分析影响代谢物丰度变化的候选因素,并进一步阐明春(4月)、夏(6月)、秋(9月)鲜茶叶代谢物丰度、基因表达与TFs之间的相关性。
可想而知,不同季节生长的茶叶表现出不同的表型。例如,春季比夏季和秋季更嫩绿,叶芽比也更低(图2)。1),这可能与不同的养殖环境有关,如不同的温度、湿度和日照强度。此外,我们进一步证明了夏季儿茶素的含量高于春季和秋季(图2)。4b),而春季茶氨酸含量高于夏季和秋季(图2)。6b).同样,Chen等人。[20.]也证明了儿茶素的含量不仅在不同季节有差异,在同一山脉不同海拔也有差异。鲜茶叶中儿茶素含量与栽培海拔呈负相关。类似的结果在之前的工作中也得到了证实,EGCG作为茶叶中含量最多的儿茶素,在夏季的含量高于春季[21,22) . .迄今为止,大量研究证明阳光在茶叶代谢产物的生物合成中起着关键作用[23].夏季日照时间长,光合作用效率高,儿茶素含量高于春秋两季[22].同样,茶树中茶氨酸的生物合成受日照时间的调节和控制[11].在长时间的阳光照射下,茶芽中可转化为儿茶素。因此,茶氨酸在春秋两季较为丰富[11].而不同季节茶叶中咖啡因含量变化较小,可能是由于光合作用对咖啡因生物合成的影响不明显。在目前的分析中,我们发现大多数富集在KEGG途径中与代谢物生物合成相关的DEG(苯丙类、单萜类、次生代谢物、黄酮、倍半萜和三萜、角质、suberin和蜡)上调。而光合作用和光合天线蛋白富集的基因则下调。这些证据以及对三种代谢物的定量分析表明,光合作用可能在调节代谢物的产生以及根据季节变化形成不同的茶叶性状中起关键作用。
在茶树生长发育过程中,茶叶基因组是两轮全基因组复制的产物,产生大量次生代谢产物生物合成中重要基因的拷贝[8].也就是说,这些基因可能直接或间接地在茶叶代谢产物丰度的调控中起关键作用。此外,转录因子(transcription factors, TFs)也通过与DNA结合来调节基因的表达,从而影响酶的活性,进而调节茶树代谢产物的产生[24,25,26,27].结构基因与转录因子的相关性分析为识别重要转录因子提供了有效途径[27].到目前为止,许多研究表明tf参与了儿茶素(MYB, bHLH, MADS, R2R3-MYB家族)的调控[28]、咖啡因(bZIP、bHLH、GATA和MYB家族)和茶氨酸生物合成(AP2-EREBP、bHLH、C2H2和WRKY家族)[29].在我们的工作中也检测到这些tf中的大多数,并被证明在儿茶素(CHS, SCPL1A, F3 ' 5'H, DFR),咖啡因(APRT, SAMS)和茶碱(SAMDC和GDH)生物合成中的15个结构基因的调节中有效(图)。7).在茶树中,tf、结构基因和代谢物生物合成之间的相互作用是复杂的,因此还有许多其他重要的tf在调节儿茶素、咖啡因和茶氨酸生物合成方面仍未报道。在目前的工作中,除了前面提到的这些传统的tf,还发现TCP、SBP、CPP、GRF、FAR1家族的tf与儿茶素、咖啡因和茶氨酸的生物合成相关。然而,由于使用的样品数量较少,一些鉴定的tf可能在调节代谢物生物合成方面不是非常有效。需要更多的样品分析和功能分析来证明这些tf在代谢产物生物合成调节中的活性。此外,转录组数据显示,大多数参与儿茶素、咖啡因和茶氨酸生物合成的基因和tf都是多个副本,这些基因和tf与不同季节采集的茶叶中代谢物富集量存在差异,并高度相关。例如,我们发现有9个基因与TFs的表达和次生代谢产物的含量显著相关,这些次生代谢产物在不同季节茶叶口感和营养功能的形成中起着重要作用(图2)。7).这些基因包括茶氨酸生物合成基因SAMDC (CSA029628),儿茶素生物合成基因CHS (CSA029775), DFR (CSA003950), SCPL1A (CSA032305, CSA014045, CSA005865, CSA034015, CAS022656, CSA014844)。值得注意的是,SCPL1A是所有检测基因中最大的家族,有17个拷贝,它可以催化儿茶素生成相应的没食子儿茶素,如EGCG和ECG,这些儿茶素在茶涩味的形成中起着至关重要的作用。在这里,我们发现7个SCPL1A拷贝在不同季节与tf的表达和ECG、EGCG、EC的数量高度相关(图2)。7).其中两个拷贝(CSA014844、CSA022656)与ECG丰度呈正相关,与EC丰度呈负相关。另外两个基因(CSA032305, CSA005865)仅与心电图丰度呈正相关。这些结果表明,茶树中基因的不同拷贝、表达水平和日照、温度、湿度等环境因素直接或间接地调节了次生代谢产物的生物合成。
结论
在这项研究中,我们分析了春、夏、秋三季茶叶的转录组和代谢组。结果表明,光合作用可以调节重要基因的表达,并与代谢产物生物合成中的tf相关,从而导致三个季节茶叶中显着的表型变化和儿茶素、咖啡因和茶氨酸含量的变化。通过分析代谢产物、基因表达和代谢产物丰度之间的相互作用,确定了9个候选基因与代谢产物丰度和代谢产物表达高度相关。这些发现加深了我们对茶代谢因子、基因表达和代谢物富集之间相互作用的认识,为研究不同季节茶叶代谢物的丰度及其影响因素提供了新的思路。
方法
化学药剂
hplc级乙腈和甲醇购自Fisher Chemicals(美国新泽西州)。HPLC级甲酸购自Tedia (Lake Forest, CA, USA)。超纯水由Millipore - q Plus水净化系统(Millipore, Bedford, MA)生产。商业标准包括咖啡因、茶氨酸、(+)儿茶素(C),(−)表儿茶素(EC),(+)儿茶素(GC),(−)儿茶素(EGC),(−)儿茶素- 3-gallate (CG)、(−)-epicatechin-3-gallate(心电图),(−)-gallocatechin-3-gallate (GCG),(−)-epigallocatechin-3-gallate (EGCG)购买的σ(美国Sigma-Aldrich)和用于构建茶叶标准曲线定量分析。
茶叶组织收集
茶树生长在海拔710 m的中国河南省信阳市车云山(北:N32°11′56.03″,东:E113°46′36.95″)的一个花园中。当地茶树被鉴定为栽培品种c . sinensis“车云中”由河南省茶树树种委员会管理,由当地园丁管理。选取6株大小和培养环境相似的茶树进行转录组学和代谢组学分析。在茶园工人的许可下,分别于2017年4月、6月和9月12日上午8:30采摘每棵茶树的组织(一个芽和第一片新鲜叶子)。所有组织立即在液氮中冷冻,并转移到- 80°C以供进一步使用。
RNA提取,文库构建,测序
收集的组织在液氮中研磨,用于RNA提取。总RNA分别用Trizol试剂(Invitrogen)提取[30.,31].用安捷伦Bioanalyzer 2200 (Agilent)对提取的RNA进行完整性检测,RNA完整性数大于8可用于构建互补DNA文库。cDNA文库使用TruSeq搁浅mRNA文库准备试剂盒(Illumina, Inc.)根据制造商的说明构建。简而言之,用低聚(dT)磁珠纯化mRNA,用二价阳离子在94℃下裂解5 min,裂解长度为200-500 bp。通过逆转录酶和随机引物,将裂解的RNA片段用于第一链cDNA合成。用cDNA和dNTP混合合成第二链cDNA。这些产物通过PCR纯化和富集,获得最终的cDNA文库,并通过HiseqX10平台(Illumina, San Diego, CA)进行测序。最终生成150 bp的成对端读。
排序读取程序集和函数注释
为了获得干净的reads,转录组学的原始数据通过去除适配器序列、不明确的核苷酸(N)和低质量reads来纯化。干净的读数被映射到的基因组序列茶树(TPIA数据库,http://tpia.teaplant.org/)通过HiSAT2(转录本拼接对齐的分级索引)。所有映射reads的表达水平采用FPKM (fragments per kilobase of transcript per million mapped reads)方法归一化。分别计算4月、6月和9月每对小鼠的差异表达基因(DEGs)。假发现率(FDR) < 0.05的DEGs∣日志2足球俱乐部∣选择> 1作为差异显著的候选基因,进行进一步的功能分析。这些基因在基因本体论(Gene Ontology, GO)中进行功能注释,在KEGG数据库中进行通路分析[32,33].
实时聚合酶链反应定量分析
采用实时定量聚合酶链式反应(qRT-PCR)方法检测DEGs的表达水平。得到的cDNA产物用无核酸酶去离子水稀释20倍。PCR采用Bio-Rad iQ2 PCR系统(Bio Rad, USA),反应体积为20 μL。随机选取20个基因用于验证表达水平。引物使用Primer Premier 5.0程序(Palo Alto, CA, USA)设计。的β微管蛋白由于基因相对稳定,故以其作为参考[34].所有引物组在我们的测试中列出表S7.PCR条件为:95°C 1 min;95°C持续20秒,60°C持续20秒,72°C持续30秒,循环40次。选择的基因表达水平用2——ΔΔCt方法(35].
提取及UPLC-Q-TOF质谱分析
从三个季节收集的18个茶叶样品(每个季节6个重复)用于代谢组学分析。所有组织在液氮中研磨,并在−80°C下冻干24小时。干燥样品(~ 20 mg)再悬浮于360 μL冷甲醇中,分别涡旋2min和超音速30min。然后在每管中加入200 μL氯仿,旋流2 min。管内加入超纯水400 μL,涡旋2 min,超声30 min。所有样品在4℃下离心,14000 rpm离心10 min。上清液经0.22 μm过滤器过滤,转移到新的玻璃管中,用于后续分析。
代谢组学分析使用UPLC/ Q-TOF-MS /MS系统(Waters, USA)进行。质量控制(QC)样品是通过混合每个样品等量来制备的。在30℃条件下,采用Waters BEH Shield RP C18色谱柱(2.1 × 50 mm, 1.7 μm)分离产物。在测试中使用了两个流动相,包括相A(含0.1%甲酸的水)和相B(含0.1%甲酸的乙腈)。流速为0.3 mL/min。用梯度洗脱法测定代谢物:0 ~ 1 min, 2 ~ 5% B;1-6 min, 5-85% B;6-8 min, 85-100% B;8-9 min, 100-2% B;9-10 min, 2% B.在电喷雾电离(ESI) (ESI+)全扫描模式下收集数据m / z100 - 1000哒。优化后的ESI参数为:毛细管电压3.0 kV;圆锥电压,35 V;源温度,100℃;脱溶温度350°C。为精确测量质量,以亮氨酸脑啡肽为锁定喷雾标准品([M + H] + = 556.2771 M /z),浓度为200 ng/mL,流速为50 μL/min [36].
代谢组学数据分析
从UPLC/ Q-TOF-MS /MS获得的数据使用Progenesis QI软件(waters,版本2.1,非线性动力学,纽卡斯尔泰恩,英国)进行峰值对齐,归一化,信号积分和初始化合物分配。通过与人类代谢组数据库(HMDB)和茶叶代谢组数据库(http://pcsb.ahau.edu.cn:8080/TCDB/f) [37].采用SIMCA 14.1软件对茶叶样品中鉴定出的化合物进行统计分析[38].用投影变重要度(VIP)分析评价代谢物的显著性。三组间进行两两比较分析,每组代谢产物均为VIP > 1和P< 0.05被认为是具有显著差异的候选代谢物。
茶组织中儿茶素、咖啡因和茶氨酸的定量分析
从茶叶中提取儿茶素、咖啡因和茶氨酸,用HPLC设备(Primaide,日立,日本)进行分析。在咖啡因和儿茶素分析中,研磨样品(0.05 g)悬浮在2 mL乙醇(80%在水中,v/v)中,超声波在100 w下悬浮25分钟。溶液以12000转/分离心10分钟。上清液经0.22 μm过滤器过滤备用。HPLC色谱柱为LaChrom C18 (4.6 × 250 mm, 5 μm)。检测波长为276 nm,流速为1 mL/min。柱温为40℃。试验采用两种流动相,包括相A:水,相B:甲醇。梯度洗脱:0 ~ 40 min, 10 ~ 60% B;40-50分钟,60-100% B。
为了鉴别茶氨酸,将磨碎的样品(每个0.05 g)悬浮在0.75 ml水中,在100°C下浸泡5分钟。悬浮液以12000转/分离心10分钟。上清液经0.22 μm过滤器过滤,得到的溶液用于茶氨酸分析。HPLC色谱柱为LaChrom C18 (4.6 × 250 mm, 5 μm)。检测波长为210 nm,流速为1 mL/min。柱温为40℃。流动相A:乙腈,B:水。梯度洗脱:0 ~ 5 min, 10% A;5-10 min, 10-60% A, 10-20 min, 60-10% A,用上述方法测定儿茶素、咖啡因和茶氨酸的商业化合物。从茶叶组织中收集的每种化合物的定量是用商业化合物梯度稀释所构建的标准曲线进行的。
转录因子共表达网络,基因表达和代谢产物富集c . sinensis
为了定位茶树中的核心转录因子(TFs),构建了基于TFs、基因表达和代谢物富集的共表达网络。通过同源比对,在转录组数据中鉴定了涉及三种生物合成途径(儿茶素、咖啡因和茶氨酸)的tf和基因。用Pearson相关法分析代谢物含量与基因表达的相关性。系数大于0.9和P< 0.05为显著相关。利用与代谢物含量高度相关的相关基因检测三个季节间与tf的相关性。基于R (Version 3.5.1)的加权基因共表达网络分析(Weighted Gene Co-expression Network Analysis, WGCNA)构建相关性[39].系数的权重大于0.5和p< 0.05为显著相关[40,41]并用于通过Cytoscape(3.6.0版本)构建网络。
统计分析
转录组分析测试了3个独立的生物重复,代谢分析测试了6个独立的生物重复。代谢组学数据的PCA分析和Heatmap在metaboanalyst网站(https://www.metaboanalyst.ca/MetaboAnalyst/home.xhtml),以观察各组织间的内在代谢物差异[42].使用R包进行转录组学的Heatmap和PCA分析。使用R包进行相关分析,网络使用3.6.0版本的Cytoscape进行显示。
数据和材料的可用性
在本研究过程中产生或分析的所有数据都包含在本文及其补充信息文件中。茶叶的原始Illumina测序reads已存入NCBI Sequence Read Archive Database,编号为PRJNA631799。
缩写
- C:
-
(+)儿茶素
- 电子商务:
-
(−)表儿茶素
- GC:
-
(+)儿茶素
- EGC:
-
(−)儿茶素
- 重心:
-
(−)-catechin-3-gallate
- 心电图:
-
(−)-epicatechin-3-gallate
- GCG:
-
(−)-gallocatechin-3-gallate
- EGCG:
-
(−)-epigallocatechin-3-gallate
- Spr:
-
春天
- 总结:
-
夏天
- Aut:
-
秋天
- HMDB:
-
人体代谢组数据库
- UPLC / Q-TOF-MS /女士:
-
超高性能液相色谱/四极杆飞行时间质谱
- 度:
-
差异表达基因
- 走:
-
基因本体论
- KEGG:
-
京都基因和基因组百科全书
- 英国石油公司:
-
生物过程
- MF:
-
分子功能
- 答:
-
蜂窝组件
- SCPL1A:
-
1A型丝氨酸羧肽酶样酰基转移酶
- CHS:
-
查耳酮合酶
- 气:
-
查耳酮异构酶
- ANR:
-
花青素还原酶
- F3'H:
-
黄烷酮3-hydroxylase
- F3’5是什么:
-
类黄酮3 ',5 ' -羟化酶
- DFR:
-
dihydroflavonol 4-reductase
- 答:
-
花青素合成酶
- 电感电容电阻测量:
-
leucoanthocyanidin还原酶
- 5’- nt:
-
5 '核苷酸酶
- AMPD:
-
腺苷酸脱氨酶
- APRT:
-
腺嘌呤phosphoribosyltransferase
- GDA:
-
鸟嘌呤脱氨酶
- 达到:
-
GMP合酶
- IMPDH:
-
小鬼脱氢酶
- NMT:
-
N-methyltransferase
- 山姆:
-
S-adenosyl-L-methionine
- 塔塔:
-
咖啡因合酶
- TS:
-
茶氨酸合成酶
- g:
-
谷氨酰胺合成酶
- GOGAT:
-
谷氨酸合酶
- 国民幸福指数:
-
谷氨酸脱氢酶
- SAMDC:
-
S-adenosylmethionine脱羧酶
- ADC:
-
精氨酸脱羧酶
参考文献
- 1.
朱斌,陈丽玲,陆敏,张娟,韩娟,邓文文,张泽泽。低、中、高咖啡因浓度茶树中咖啡因代谢的新认识。农业食品化学学报,2019;67(12):3400-11。
- 2.
卡布雷拉C,阿塔乔R, Gimenez R.绿茶的有益作用——综述。南京大学学报(自然科学版)。2006;25(2):79-99。
- 3.
Chacko SM, Thambi PT, Kuttan R, Nishigaki I.绿茶的有益作用:文献综述。Chin Med. 2010;5:13。
- 4.
夏恩华,张海波,盛杰,李凯,张启杰,金超,张勇,刘勇,朱涛,李伟,黄红,童勇,南红,石超,蒋俊杰,毛玉玉,焦建勇,张东,赵玉军,张丽萍,刘玉玲,刘碧,余宇,邵顺丰,倪金杰,Eichler EE,高立忠。茶树基因组为了解茶的味道和咖啡因生物合成的独立进化提供了见解。植物学报,2017;10(6):866-77。
- 5.
林玉生,蔡永杰,蔡俊杰,林志强。影响茶叶中茶多酚和咖啡因含量的因素。农业食品化学学报,2003;51(7):1864-73。
- 6.
Fang R, Redfern SP, Kirkup D, Porter EA, Kite GC, Terry LA, Berry MJ, Simmonds ms茶树在不同的季节收获。食品化学,2017;220:517-26。
- 7.
杨玉军,钟刚,吴XX。茶树品中志。上海:上海科学技术出版社。2014。7页。
- 8.
基因组序列草图山茶花变种为茶叶基因组和茶叶品质的进化提供了见解。Proc Natl Acad Sciences美国。2018年;115年(18):E4151-8。
- 9.
Khalesi S, Sun J, Buys N, Jamshidi A, Nikbakht-Nasrabadi E, Khosravi-Boroujeni H.绿茶儿茶素与血压:随机对照试验的系统回顾和荟萃分析。中国生物医学工程学报,2014;29(6):344 - 344。
- 10.
Khokhar S, Magnusdottir SG。总酚,儿茶素和咖啡因含量在英国经常消费的茶。农业食品化学学报,2002;50(3):565-70。
- 11.
Vuong QV, Bowyer MC, Roach PD。茶氨酸的性质、合成及从茶叶中分离。食品农业科学,2011;91(11):1931-9。
- 12.
郑玉生,陈志明,程世杰,陈明明。茶的生物活性及治疗潜力。伦敦;纽约:Taylor Francis, 2002年。79页。
- 13.
李志强,李志强。红酒和模型溶液中(+)-儿茶素和(−)-表儿茶素苦味和涩味的评价。中国生物医学工程学报。1997;12(1):25-37。
- 14.
Suzuki- sugihara N, Kishimoto Y, Saita E, Taguchi C, Kobayashi M, Ichitani M, Ukawa Y, Sagesaka YM, Suzuki E, Kondo K.绿茶儿茶素通过在人体低密度脂蛋白颗粒中积累来防止低密度脂蛋白氧化。生态学报,2016;36(1):16-23。
- 15.
Sinija VR, Mishra HN。绿茶:有益健康。中华儿科杂志,2008;17(4):232-42。
- 16.
Sari F, Velioglu YS。不同碾压方式和加工阶段红茶中茶氨酸和咖啡因含量的变化中国食品科学,2013;26(2):344 - 344。
- 17.
Wan XC。茶树词生代谢。北京。克雪褚班她按。2015.
- 18.
Kato A, Crozier A, Ashihara H.茶中咖啡因生物合成中N-3甲基转移酶的亚细胞定位。48 Phytochem。1998;(5):777 - 9。
- 19.
影响茶饮料中儿茶素和咖啡因含量的因素:估计每日摄入量和抗氧化活性。中国食品农业科学,2005;85(12):2125-33。
- 20.
陈艳,姜艳,段杰,史俊,薛松,角田玉。儿茶素含量与黄芝香乌龙茶品质的关系(茶树)在不同的生长高度和季节。食品化学,2010;19(2):648-52。
- 21.
中川M, Torri H.茶叶中黄烷醇的研究。第二部分。茶叶发育过程中黄烷酸成分的变化。农业生物化学,1964;28:497-504。
- 22.
姚玲,Caffin N, D’arcy B,姜艳,史杰,辛格努松,刘旭,Datta N, Kakuda Y,徐勇。澳大利亚产茶中酚类化合物的季节变化(茶树).农学通报。2005;53(16):6477-83。
- 23.
你好我,巴伦丁检察官。茶的化学成分。植物科学学报,1997;16(4):415 - 80。
- 24.
徐春峰,刘海林,徐云云,赵建荣,郭玉伟,龙龙,高伟,宋晓平。棉花R2R3-MYB转录因子GbMYB60的异质表达增加转基因盐敏感性拟南芥.植物细胞与组织器官,2018;33(1):15-25。
- 25.
王鹏,杨超,陈辉,罗汉林,冷清良,李少生,韩志军,李小春,宋正大,张旭,王金杰。对转录因子的探索揭示了在不同的非生物胁迫中参与的关键成员和调控网络芸苔属植物显著中国生物医学工程学报。2018;18(1):202。
- 26.
韩玉军,吴敏,曹丽丽,袁文杰,董文敏,王晓辉,陈卫华,尚福德。转录因子OfWRKY3的鉴定,该转录因子正向调节类胡萝卜素切割双加氧酶基因OfCCD4桂花.植物分子生物学杂志,2016;41(4):485 - 496。
- 27.
郭淑莹,戴世杰,辛格PK,王海燕,王云云,谭金lh,韦文寅,伊藤涛。一种膜结合的nac样转录因子OsNTL5抑制植物开花栽培稻.植物科学,2018;9:555。
- 28.
郭飞,郭艳芳,王鹏,王勇,倪金杰。茶树叶片发育过程中儿茶素生物合成基因的转录谱分析。足底。2017;246(6):1139 - 52。
- 29.
李芳芳,朱勇,余勇,赵启勇,王世杰,王晓春,姚明哲,罗东,李霞,陈林,杨宇军。茶树次生代谢产物合成的全球转录组和基因调控网络(茶树).BMC Genomics. 2015;16(1):560。
- 30.
柴丽强,李文伟,王晓伟。红沼泽小龙虾中两种arasin样肽的鉴定与鉴定Procambarus clarkii.鱼类贝类免疫,2017;70:673-81。
- 31.
柴丽琴,孟金华,高洁,徐玉华,王晓文。甲壳动物β-1,3-葡聚糖酶相关蛋白作为抗菌反应模式识别蛋白的鉴定。鱼类贝类免疫,2018;80:155-64。
- 32.
Kumar Y, Zhang L, Panigrahi P, Dholakia BB, Dewangan V, Chavan SG, Kunjir SM, Wu X, Li N, Rajmohanan PR, Kadoo NY, Giri AP, Tang H, Gupta VS.鹰嘴豆根部镰刀菌介导系统代谢重编程的蛋白质组学和代谢组学研究中国生物工程学报,2016;14(7):1589-603。
- 33.
王德杰,杨春林,董林,朱建昌,王建平,张顺丰。抗旱和易感植物的比较转录组分析芸苔属植物显著利用RNA-Seq开发EST-SSR标记。中国生物工程学报,2015;36(4):339 - 339。
- 34.
龚德德,董飞飞,胡明梅,孔晓文,魏福峰,龚世杰,张玉梅,张建斌,吴斌,廖玉春。抗真菌活性挥发物释放肠杆菌属asburiaeVt-7反对黄曲霉和黄曲霉毒素。食品杂志2019;106:106718。
- 35.
龚德德,吴宁宁,孔晓文,张玉明,胡明杰,龚世杰,董飞,王金辉,赵志智,廖永春。抑制挥发物的释放粪产碱杆菌属N1-4上黄曲霉储存黄曲霉毒素。前沿微生物。2019;10:1419。
- 36.
李辉,夏鑫,李小文,纳仁温武,付强,王勇,吴明明,丁淑云,张世祥,蒋海燕,李继昌,沈建忠。耐氨霉素的非靶向代谢组学分析空肠弯曲杆菌采用超高效液相色谱-质谱联用。中国生物医学工程学报,2015;14(2):1060-8。
- 37.
岳勇,褚国祥,刘秀生,唐旭,王伟,刘国军,廷廷军,王小刚,张志忠,夏涛,万晓春,包海华。TMDB:从茶叶中发现的小分子化合物的文献数据库。BMC植物生物学2014;14:243。
- 38.
Farag MA, Gad HA, Heiss AG, Wessjohann LA。代谢组学驱动分析六大黑种草物种的种子通过UPLC-qTOF-MS和GC-MS结合化学计量学。食品化学,2014;151:333-42。
- 39.
黄志刚,张志刚,张志刚。植物胁迫响应基因的发现拟南芥通过加权基因共表达网络分析。公共科学学报。2015;10(3):e0118731。
- 40.
王丽娟,王丽娟,王丽娟。基于微阵列技术的基因表达优化分析。中华癌症杂志,2002;2(5):353-61。
- 41.
张玲,陈娟,周霞,陈霞,李强,谭宏,董霞,肖勇,陈玲,陈伟。茉莉酸甲酯处理板蓝根毛状根的动态代谢和转录组分析揭示了板蓝根木聚糖的合成特征和生物合成调控因子。中国生物工程学报,2016;14(12):2217-27。
- 42.
张晓明,张晓明,张晓明。基于metaboanalysis4.0的综合代谢组学数据分析。生物信息学学报。2019;68:e86。
致谢
在此,我们要特别感谢复旦大学王迎祥教授博士对实验设计的支持。感谢安徽农业大学蒋长军教授在茶树品种鉴定方面的帮助。
资金
河南省高等教育教学改革研究与实践项目(2017SJGLX092)、国家自然科学基金项目(31701740)、河南师范大学南湖青年学者奖励计划项目资助。资助者在研究设计、数据收集、分析和解释以及撰写手稿方面没有发挥作用。
作者信息
从属关系
贡献
ADG和HYY构想了研究并设计了实验。ADG、NNW和SQZ进行实验。SBL, LC, YJZ进行分析。ADG和LMZ共同撰写了手稿。我们确认稿件已被所有指定作者阅读和批准。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1表S1。
转录组测序数据摘要。
附加文件2表S2。
三个季节茶叶的DEGs两两比较均为log2足球俱乐部> 1, FDR < 0.05。AccID:茶叶基因组数据库中基因的ID号。FC:折叠变化。FDR:错误发现率
附加文件3表S3。
KEGG数据库中上调和下调联合基因的通路分析P< 0.05。FC:折叠变化。FDR:错误发现率
附加文件4表S4。
基因本体(GO)中上调和下调联合基因的功能分类,P < 0.05。FC:折叠变化。FDR:错误发现率
附加文件5表S5。
基因表达量与儿茶素、咖啡因和茶氨酸含量的相关性分析。
表S6.附加文件6
转录因子、基因表达量与儿茶素、咖啡因、茶氨酸含量分别进行相关权重分析。
附加文件7表S7。
所有引物均用于qRT-PCR分析。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
锣,广告。,Lian, SB., Wu, NN.et al。茶树儿茶素、咖啡因和茶氨酸生物合成的转录组学和代谢组学综合分析(茶树)。BMC植物生物学20.294(2020)。https://doi.org/10.1186/s12870-020-02443-y
收到了:
接受:
发表:
关键字
- 转录组
- 代谢组学
- 儿茶素
- 咖啡因
- 茶氨酸
- 季节