摘要
背景
水稻是一种对寒冷敏感的作物,会受到低温的严重损害。过度表达LSI1.基因(LSI1.-本研究表明,一种主要定位于内质网(ER)的丝氨酸羟甲基转移酶(OsSHMT)参与提高水稻的耐冷性。
结果
更高的转录水平OsSHMT在中检测到LSI1.-与野生型相比,牛稻更具优势。组蛋白H1和核酸结合蛋白被发现与基因启动子区结合OsSHMT并调节其表达,这些蛋白的转录水平也上调LSI1.-ox米。此外,OSSHMT与ATP合酶亚基α,热休克蛋白HSP70,线粒体底物载体家族蛋白,抗坏血酸过氧化物酶1和ATP合酶亚单位β相互作用。LSI1.-编码的蛋白OsNIP2;1也与ATP合酶β亚基相互作用,这些蛋白的协调作用似乎在还原活性氧物种,如H2O2转基因的内容OsSHMT拟南芥在低温处理下,低于非转基因品系。
结论
我们的结果表明er定位的OsSHMT在清除H2O2以提高耐冷性LSI1.ATP合酶β亚基是OsNIP2;1和OsSHMT之间的中间连接。
背景
植物的正常生长和发育需要一个特定的温度范围,温度的突然变化会导致生长抑制甚至死亡[1].晚春天的冷咒是在短时间内突然下降的例子,并且可能对大米的生长产生不利影响。一些品种的大米,主要是那些籼稻亚种,对低温特别敏感[2,3.].作物植物的持续低温已被证明会导致活性氧(ROS)和细胞膜的过氧化,并影响叶绿体基因的表达,抑制光合作用[4].这些RO包括o2−, H2O2哦−[5].
方等人[6研究表明,低温处理抑制了对温度敏感的双生稻叶绿素合成基因的表达,促进了蛋白酶体基因的表达(栽培稻ssp。籼稻),导致叶绿体损伤,叶绿素降解,绿色丧失和叶中RNA的部分降解。Cui等人。[7]发现Dular叶片的低温胁迫下的美白用该基因编码pentatricopeptide(LOC_Os09g29825.1)的序列的缺失有关,这是一种RNA结合蛋白,与基因编码序列错过相对于从日本晴8个碱基大米,导致蛋白功能的编码序列和去激活的移码突变。突变基因被命名为DUA1.在低温胁迫下,DUA1蛋白失活导致水稻RNA编辑能力的丧失,导致水稻幼苗表现出叶绿体发育缺陷和叶片褪绿。当硅吸收基因(LSI1.)在杜鹃水稻中过表达,转基因株系的耐冷性显著提高,叶片在低温处理下保持鲜绿色。在低温胁迫下,转基因水稻光合途径的基因表达增强,蛋白酶体相关基因表达下调。此外,编码丝氨酸羟甲基转移酶(serine hydroxymethyltransferase, SHMT)基因的转录水平,LOC_Os03g52840)在转基因水稻中上调,但在野生型中下调,并且其相应的miRNA的表达以相反的方式改变,表明OSSHMT可能参与调节DORAL的冷冻耐寒性[6].
SHMT广泛分布于植物中[8].该酶催化丝氨酸和甘氨酸之间的可逆交换(甘氨酸CH2-四氢呋喃2O↔丝氨酸四氢呋喃)[9,10,这两种氨基酸是叶绿素、色氨酸和乙醇胺的前体[11].因此,SHMT在植物的光呼吸过程中起着重要的作用[12].研究发现水稻线粒体丝氨酸羟甲基转移酶基因突变(osshm1)导致光呼吸通路的阻塞,从而影响卡尔文循环和光能的效率;叶绿体中过多的光会导致活性氧的积累,导致叶绿体发育中断,叶绿体越来越小,基粒越来越少[13].
此外,SHMT在调节植物的抗逆性方面也起着积极的作用。在拟南芥,低温抑制了NADH脱氢酶的表达,导致ROS的持续积累,抑制了冷应答基因的转录和对低温的超敏反应[14].SHMT活性有助于减少在叶绿体ROS积累并因此降低氧化性损伤[15];作为第二信使,ROS的减少也会阻止冷信号的传递,减少ROS造成的损伤。隐性突变Shmt1-1.在拟南芥导致细胞死亡的异常调节,导致各种环境条件下的褪蓝和坏死疾病,以及携带的突变体Shmt1-1.等位基因表现出更多的H2O2在盐胁迫下比野生型植物积累更多的叶绿素,导致更大的叶绿素损失[16].据我们所知,OsSHMT在水稻抗寒性调控中的具体作用尚未见报道。
在本研究中,一个OsSHMT基因(LOC_Os03g52840)的基因扩增,研究了OsSHMT的亚细胞定位,以及与启动子区结合的蛋白OsSHMT被获得。通过对与OsSHMT互作蛋白的研究,揭示了水稻在低温胁迫下OsSHMT的调控网络,揭示了OsSHMT可能在清除H中的作用2O2提高水稻的抗寒性。
结果
Dular的耐冷性和LSI1.-牛米
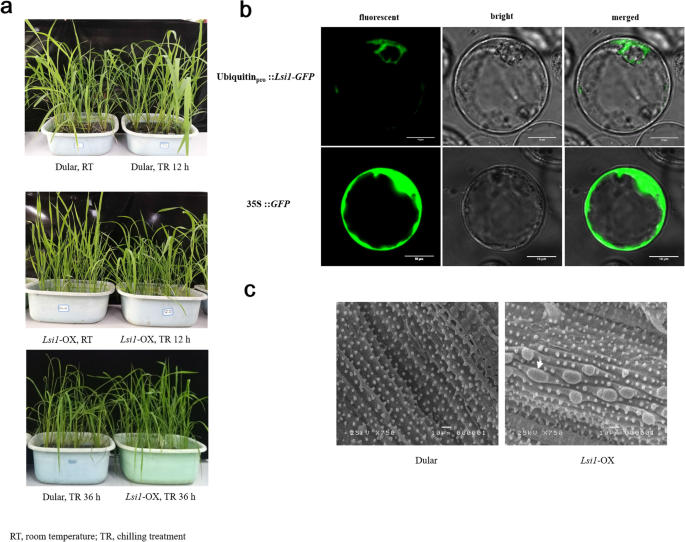
杜拉尔河LSI1.-OX转基因株系对4个品种的低温处理表现出不同的耐受性 摄氏36度 h、 杜拉尔水稻的大部分叶子变得更白,而LSI1.-OX系保持了对冷却的耐受性(图。1一种)。进一步的研究表明,LSI1.过表达载体由泛素启动子驱动,翻译OsNIP2;1定位于细胞质中(图。1B),它与细胞膜上最初的定位有显著的不同[17]这一结果表明OsNIP2;1可能比其初始功能具有更多的作用,它属于水通道蛋白家族,控制水稻中的硅积累[17].叶片的扫描电子显微镜(SEM)图像显示,叶片中含有二氧化硅体LSI1.-ox米叶比多木米饭大(图。1c)。
OsSHMT的亚细胞定位
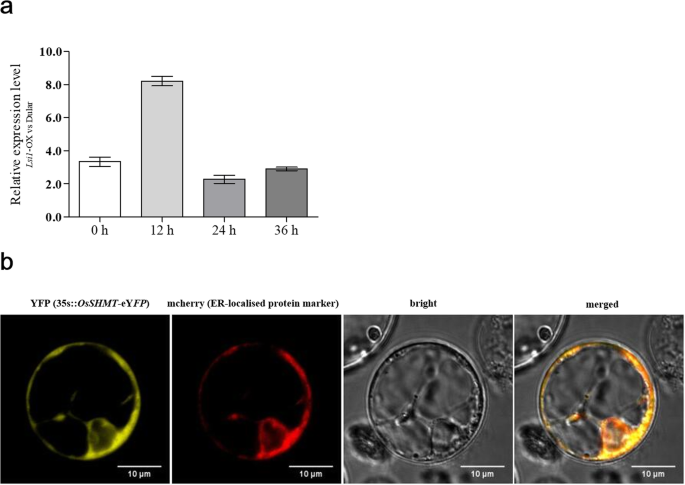
过表达LSI1.在双生稻中导致数千个基因表达的变化[6],包括OsSHMT基因。表达式OsSHMT在过去的十年中,这一点得到了提高LSI1.-OX稻与双粒稻的比较(图。2a).在水稻原生质体中,OsSHMT (LOC_Os03g52840)的亚细胞定位显示,黄色荧光集中在细胞核周围,未观察到明显的核内荧光,而在eYFP载体转化的水稻原生质体中,整个细胞核中均可见明显的黄色荧光(图S)1).这表明OSSHMT在内质网上定位在细胞核周围的内质网上。与麦克里的内质网状标记蛋白的进一步共定位表明,OSSHMT广泛分布在内质网中,因为来自与EYFP的OSSHMT的标记蛋白和黄色荧光的MCHERRY荧光完全重叠(图。2b). OsSHMT参与植物的光呼吸过程,已有研究表明该蛋白定位于线粒体、叶绿体和细胞质。这项研究的结果补充了这些发现。
启动子区域OsSHMT以及结合蛋白
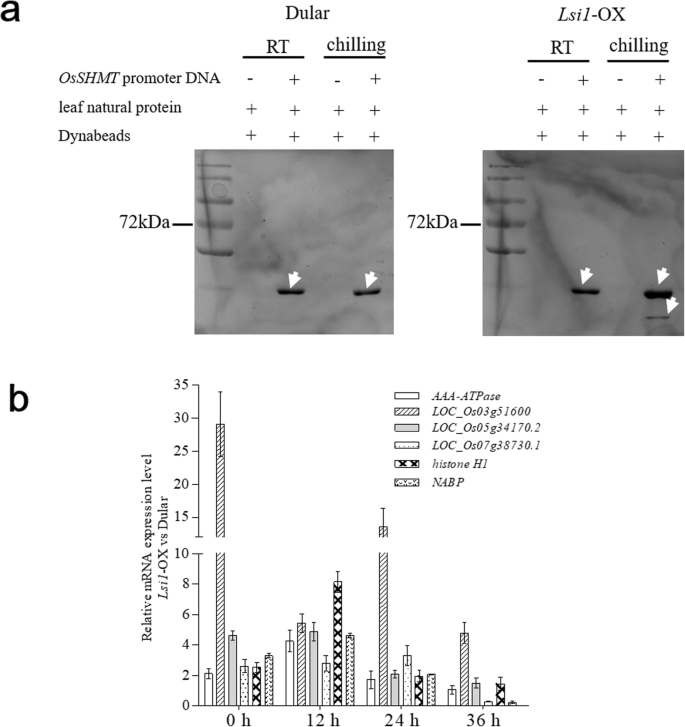
The promoter region 2597 bp upstream of the CDS of theOsSHMT本研究扩增了杜ular rice基因,并在该DNA片段的5 '侧翼区域进行了生物素标记(表S1).根据DNA的拉下结果,与对照组相比,在室温下,低温处理LSI1.-OX诱导多种蛋白以结合的启动子区OsSHMT.相比之下,低温处理对与启动子结合的蛋白质没有显著影响(图2)。3.a) 对蛋白质的鉴定表明,从这两种蛋白质中都鉴定出了逆转录转座子蛋白(Ty3-gypsy亚类)、甘油醛-3-磷酸脱氢酶和AT-hook基序蛋白LSI1.-OX和籼稻在低温或室温条件下;而部分蛋白如组蛋白H1、核酸结合蛋白(核酸结合蛋白)、微管蛋白/FtsZ结构域蛋白(loc_os03g5160.01)仅在冷冻处理后被鉴定LSI1.牛集团;另一个微管蛋白/FtsZ结构域蛋白(LOC_Os05g34170.2)在冷冻处理后被鉴定LSI1-OX和杜勒斯组,从杜勒斯组在室温。在室温Dular组中鉴定到3a型atp酶家族蛋白,而在低温Dular组中未鉴定到3a型atp酶家族蛋白,该蛋白在低温Dular组中被诱导LSI1.-OX组在室温下与对照组比较(表1)1).选择含有微管蛋白/FtsZ结构域的蛋白(loc_os03g5160.0.1, LOC_Os05g34170.2, LOC_Os07g38730.1)、组蛋白H1和NABP在两种水稻上的基因表达量进行分析。杜乐和杜乐基因转录水平的比较LSI1.-OX水稻经低温处理12、24和36 h后,与0 h相比,表现出相反的趋势,基因表达水平上调LSI1.同处理条件下,-OX稻与单株稻比较(图2)。3.b).结果表明,这些基因联合作用,在调控中发挥积极作用OsSHMT表情。
与OsSHMT相互作用的蛋白质
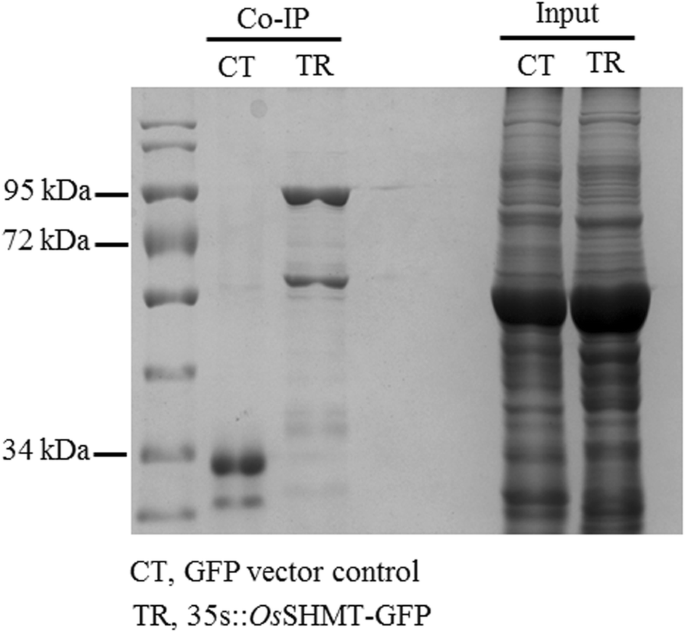
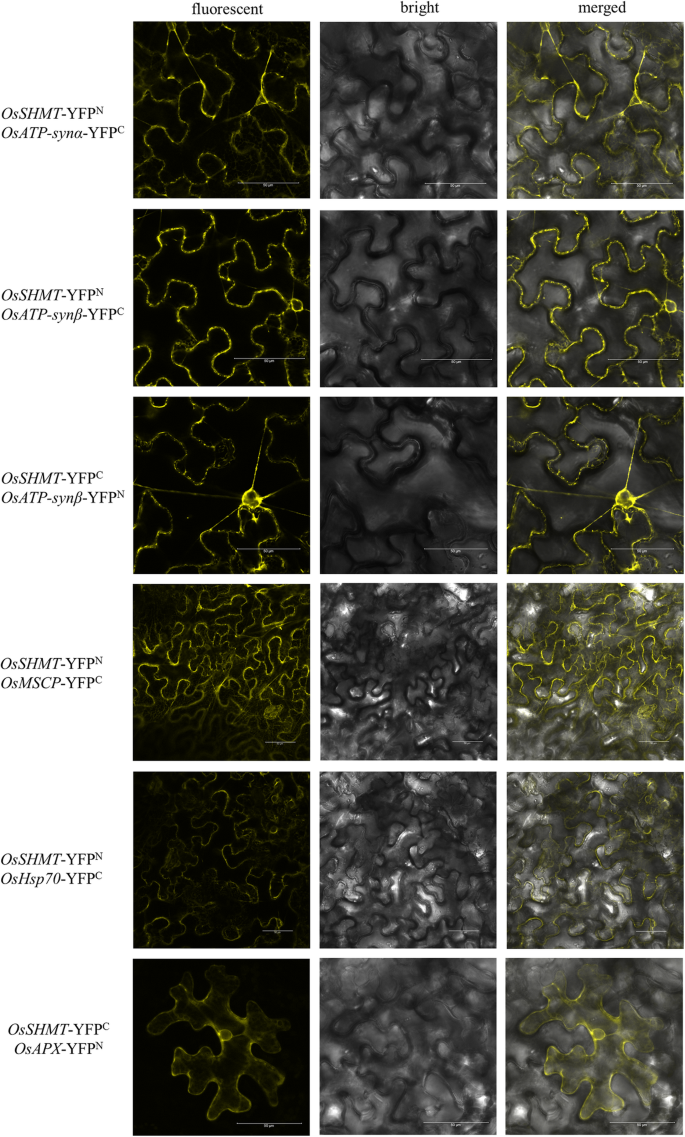
通过GFP-TRAP方法获得与OsSHMT相互作用的蛋白,发现有几种蛋白与OsSHMT共沉淀,与gfp载体对照的蛋白相比较(图)。4;表的年代2)其中一些蛋白质,包括ATP合酶α亚单位、ATP合酶β亚单位、热休克蛋白70、携带线粒体底物的家族蛋白E、抗坏血酸过氧化物酶1,是与OsSHMT蛋白相互作用的防御蛋白质(表1)2).进一步测定OsSHMT与ATP合成酶α亚基、ATP合成酶β亚基、Hsp70、MSCP和APX的相互作用,发现OsSHMT在侵染烟草叶片中均表现出黄色荧光。对照组未检测到荧光,表明OsSHMT与上述蛋白呈正相互作用(图。5).结果表明,OSSHMT与水稻中的防御相关蛋白质相互作用,包括APX,MSCP,HSP70和ATP合酶,共同调节冷却抗性。
双分子荧光互补验证水稻OsSHMT与ATP合酶亚基α、ATP合酶亚基β、Hsp70、MSCP和APX的生物相互作用为了验证OsSHMT与水稻ATP合酶α亚基(ATP- synthase α)、ATP合酶β亚基(ATP- synthase β)、热休克蛋白70、线粒体底物携带家族(mitochondrial substrate carrying family, MSCP)蛋白E和抗坏血酸过氧化物酶(APX)的正相互作用,将其基因分别注入YFP的n端或c端,构建YFPn- - - YFPc双分子荧光互补(BiFC)的重组载体,根据叶片的瞬态转化尼古利亚娜·宾夕法尼亚州。用激光共聚焦显微镜在488 nm激发光下检测YFP荧光
H2O2内容OsSHMT转基因答:芥和野生型
进一步表明奥斯赫姆在清除h中的功能2O2,野生型答:芥和阳性转基因t3.答:芥seedlings were exposed to a temperature of 4 °C for 12, 24 and 36 h. The leaves of the wild type showed more reddish-brown spots after Diaminobenzidine (DAB) staining. The transgenic line also showed reddish-brown spots, but the spots were small in size and number (Fig.6一种)。叶子H的测定2O2转基因株系和野生型的含量答:芥表明H2O2在转基因物种中答:芥经过冷冻处理后,显著低于经过相同处理的野生型(图。6b)。
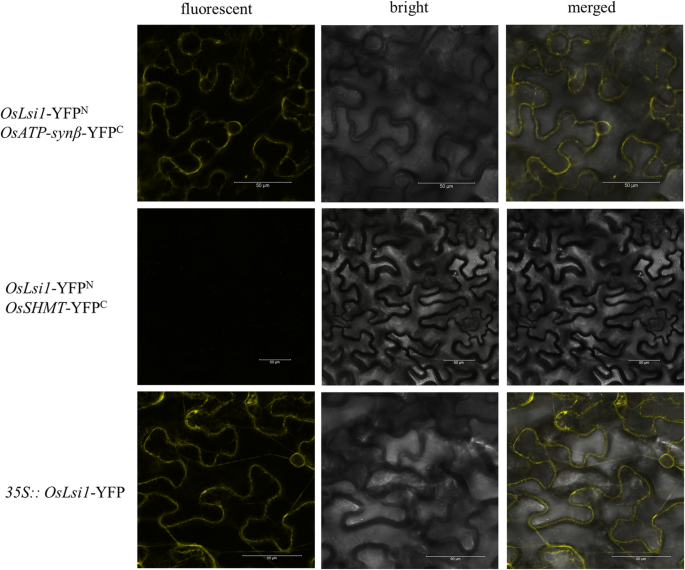
OsNIP2;1与来自水稻的ATP合酶亚基β相互作用
LSI1.编码水通道蛋白OsNIP2;1,这是一种结节蛋白26样内在蛋白(NIP),定位于细胞膜LSI1.在杜拉尔水稻中,使用泛素启动子导致该蛋白在细胞质中定位,使OsNIP2;1发挥多种作用。还研究了OsNIP2;1与OsSHMT之间的相互作用。结果表明OsNIR2;1与OsSHMT之间没有直接相互作用。然而,OsNIP2;1与同样相互作用的蛋白质ATP synβ相互作用结果表明,ATP合成β作为OsNIP2;1和OsSHMT之间的中间连接(图。7).
讨论
植物在低温条件下经常会产生ROS的积累,从而导致细胞膜脂质过氧化。我们的研究表明OsSHMT在清除H2O2在工厂。OsSHMT已被宣布在线粒体,叶绿体,细胞质,细胞核,细胞质膜和细胞溶质[本地化13,18,19],并参与光呼吸途径。此外,我们目前的研究表明,OsSHMT也定位于内质网,内质网是蛋白质和脂质合成、膜生物发生、外源性解毒和细胞钙储存的主要细胞器[20].OsSHMT清除H2O2被认为是突出的,当大米经历低温胁迫。
清除H2O2,发现OSSHMT与几种蛋白质相互作用。在这些相互作用的蛋白质中,APX是具有ROS-扫描活性的蛋白质。在拟南芥蒂利亚纳,胞质溶血物过氧化物酶1(APX1)是H的中心部件2O2-scavenging系统,不存在在敲除线APX1的导致叶绿体H的崩溃2O2通关系统,从而增加h的水平2O2和氧化蛋白[21].热休克蛋白HSP70也与OSSHMT相互作用。Hsp70是分子伴侣蛋白,在压力耐受中发挥关键作用[22];在水稻中,叶绿体定位的Hsp70对高温条件下的叶绿体发育至关重要,而水稻中线粒体Hsp70的过表达抑制了程序性细胞死亡[23,24]因此,Hsp70的多种功能有助于提高水稻的耐冷性。由于ATP是清除活性氧的催化反应所必需的,OsSHMT还与ATP合成酶的α亚单位和β亚单位相互作用。这些亚单位广泛分布于线粒体和叶绿体中,并且与亚单位在ADP产生的ATP中起作用,在膜上存在质子梯度,这是由呼吸链的电子传递复合物产生的[25],线粒体底物载体家族蛋白催化ADP/ATP等亲水性化合物通过线粒体内膜[26].这些蛋白质的协调出现了OsSHMT在清除H激活ATP提供2O2.
OsSHMT在清除H2O2,增加表达水平OsSHMT有助于提高其能力。基因表达OsSHMT是更高的LSI1.-OX水稻比野生型Dular [6].表达水平的不同OsSHMT来自这两个水稻品系主要归因于转录调节器将所述表达OsSHMTNABP和组蛋白H1是两种转录调节因子,它们与基因启动子结合OsSHMT.NABP具有在转录和转录后水平的基因表达的调节双重作用[27,28].真核生物中的组蛋白是一种结构蛋白,它与DNA结合形成染色质核小体。组蛋白H1通常被认为是一种转录抑制因子,因为它阻止转录因子和染色质重塑复合物进入DNA [29].其他一些蛋白,包括aaa - atp酶家族蛋白和含微管蛋白/FtsZ结构域蛋白,在这些dna结合蛋白中同时出现。微管蛋白是植物微管的主要成分,在调控抗逆性中起重要作用,从而对各种胞内和外界刺激作出反应[30,31,32].更高的转录水平LSI1.表明这些因子在调控-OX水稻的表达方面具有积极的作用OsSHMT基因。无论这些蛋白质是精确的还是间接的与OsSHMT基因启动子还有待进一步研究。
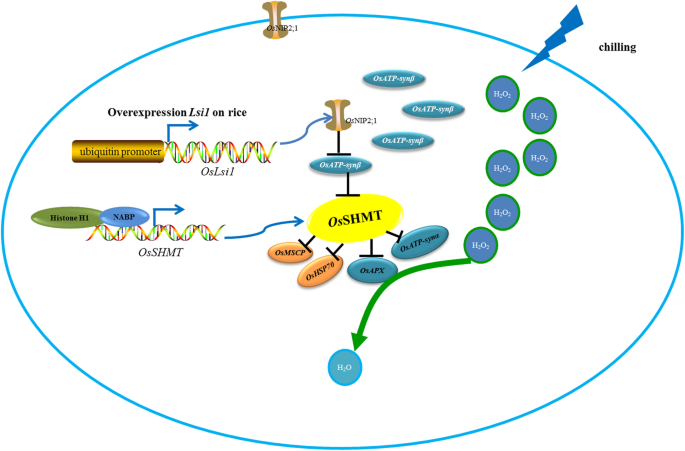
过表达LSI1.导致内质网的定位LSI1.-encoded Nod26-like intrinsic protein (OsNIP2;1)。由于OsSHMT也定位于内质网,ATP合酶β亚基分别与操作系统NIP2 1和OsSHMT,表明OsNIP2 1可以间接地通过ATP合酶β亚单位的OsSHMT合作,并OsSHMT与防御和抗氧化有关的蛋白相互作用调节水稻的抗冷性,并确保其正常生长发育。在OsSHMT表达的增加和清除^ h发挥建设性作用2O2提供部分援助,以挽救由于蛋白质失活导致的杜拉米抗冷性丧失DUA1.
结论
过表达LSI1.在寒冷敏感Dular大米导致质膜本地化OsNIP2; 1来执行多个角色; 1种蛋白在细胞质中,这将使OsNIP2表达。表达操作系统SHMT在LSI1.-OX线与双线比较。差异基因表达水平OsSHMT可能受NABP和组蛋白H1的转录调控。此外,OsSHMT与APX、Hsp70、ATP-synα、ATP-synβ和MSCP相互作用,清除H2O2.和ATP-synβ相互作用与OsNIP2; 1。甚至OsSHMT不直接相互作用与OsNIP2; 1,ATP合酶亚基β是OsNIP2之间的中间结; 1和OsSHMT(图8).
方法
植物材料及处理
在本研究中,双季稻(水稻亚种.籼稻)及其转基因系LSI1.超表达(LSI1.牛)使用;糙米被保存在福建农林大学(福州,中国)LSI1.-OX转duular转基因系在我们前期研究中萌发[33].拟南芥蒂利亚纳与依赖RNA的RNA聚合酶6基因突变(rdr6) [34),尼古利亚娜·宾夕法尼亚州[35[本研究也用于本研究。
杜拉尔河LSI1.-OX水稻种子用25%次氯酸钠溶液(W/V)消毒30分钟,用无菌水洗涤,以清除任何残留。无菌种子在30°C的培养箱中浸泡过夜。种子发芽后,在黑色的花盆里播种,花盆里装满了悬浮在聚乙烯网中的水培营养液。在人工气候室中放置10天,在26°C下保持14 h,在22°C下保持10 h黑暗。室内相对湿度保持在85%左右。营养液每周更换一次,整个实验过程pH保持在5.5 ~ 6.0之间。
当稻子长到三叶期时LSI1.-OX和野生型杜鹃为处理组,处理温度为12°C/10°C(昼/夜),对照组为置于另一室内,日/夜温度为26°C/22°C的2个水稻品系。每个品系处理和对照组均设4个重复,在同一生长室内重复3次。
蛋白质亚定位
编码的DNA序列OsSHMT(LOC_Os03g52840)被放大并融合eYFP在pCambia2300中构建重组35S:OsSHMT-eYFP矢量水稻原生质体转化。的亚细胞定位操作系统使用共聚焦激光扫描显微镜检测SHMT。将细胞器特异性蛋白质标记物(MCHERRY)与OSSHMT共定,以验证上述结果。同时,仅包含黄色荧光蛋白基因的空白载体分别转移到水稻原生质盒中以作为参考。将水稻原生质体在28℃下培养48小时。通过激光共聚焦显微镜观察原生质体中黄色荧光的分布,以确定OSSHMT蛋白的亚细胞定位。
DNA下拉鱼转录调控子与启动子的结合OsSHMT
4个重复的第2顶叶片分别在冷冻处理后48 h取样。这些水稻叶子很快就被冷冻在液氮中。杜仲和杜仲的天然叶片蛋白质LSI1.-OX用Pi-IP缓冲液(50 mM Tris·Cl, 150 mM NaCl, 1 mM EDTA pH 8.0, 1% Triton X-100, 1 mM PMSF, 1× EDTA-free蛋白酶抑制剂鸡尾酒,罗氏,默克)提取(方法S1)。启动子区(cd2上游2549 bp)OsSHMT)从杜拉尔的基因组DNA中克隆,启动子上的相互作用蛋白按照我们之前的研究方案获得[36].
定量PCR检测基因表达水平
杜拉尔和杜拉尔的总RNALSI1.-牛米exposed to a temperature of 15 °C for 12, 24 and 36 h was extracted using Trizol and reverse-transcribed into cDNA using TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix. The control groups were grown at 26 °C for 12, 24 and 36 h. Specific primers for tubulin/FtsZ domain containing protein (LOC_Os03g51600, LOC_Os05g34170, LOC_Os07g38730), histone H1 and nucleic acid binding protein (NABP) are listed in Table S3.以β-肌动蛋白基因为参照物,利用TransStart Tip Green qPCR SuperMix和Eppendorf realplex制备了qPCR反应体系4反应过程如下:在94℃预变性 摄氏30度 s、 94℃变性 摄氏度5 s、 55℃退火 摄氏15度 s、 72分机 摄氏10度 s、 42 扩增完成后,进行熔融曲线分析,并根据熔融曲线确定产物的特异性。每个候选mRNA设为四个独立的重复。通过2-△△Ct方法,计算对照组和测试样本中每个候选mRNA的阈值周期值(Ct) [37].
拟南芥蒂利亚纳转换
的CDOsSHMT被扩增并插入修饰的pcambia3301(用35升启动子)以构建重组载体拟南芥蒂利亚纳使用Clough和Bent描述的花浸协议进行转换[38].天然叶蛋白从叶甲中提取3.一代的结合体OsSHMT转基因答:芥并与GFP-Trap琼脂糖(Chromotek)孵育,以收集推定的相互作用蛋白。
双分子荧光互补(BiFC)验证了水稻与蛋白质的相互作用
BiFC用于验证OsSHMT与从Co IP结果中鉴定的蛋白质之间可能存在的相互作用。编码这些蛋白质的基因是从杜拉尔水稻中克隆的,我们先前的研究中提供了每个基因的重组载体的构建和BiFC的后续方案[36].
DAB染色与H的测定2O2内容
检测H2O2在叶中使用二氨基联苯胺(DAB)染色进行;OsSHMT转基因答:芥和野生型分别在4℃处理12、24和36 h。在同一生长室内重复三次。取这两个品系的叶片,抽真空浸泡在50 mg/L的DAB溶液中1 h,室温孵育过夜。用95%乙醇在80℃水浴中脱色,利用集成显微镜(尼康,SMZ18)观察转基因叶片和野生型叶片的红褐色斑点。H2O2转基因株系和野生型叶片在12 H处理后的含量用H2O2检测试剂盒(Solarbio Life Sciences)。
引物序列
引物清单见表S3..
数据和材料的可用性
本研究产生的所有数据均包含在本发表的文章及其补充信息文件中,本研究中使用或分析的原始数据可在合理要求下由通讯作者提供。
缩写
- APX型:
-
抗坏血酸盐过氧化物酶
- BiFC:
-
双分子荧光互补
- 轻拍:
-
Diaminobenzidine
- 呃:
-
内质网
- LSI1.:
-
低硅基因1
- 牛:
-
过度表达
- SHMT:
-
丝氨酸hydroxymethyltransferase
- 夹:
-
Nodulin 26样的内在蛋白质
- ROS:
-
反应性氧气
- NABP:
-
核酸结合蛋白
- HSP70:
-
热休克蛋白70
参考文献
- 1.
Hatfield JL,Prueger JH.《极端温度:对植物生长和发育的影响》《气候概况》,2015年;10:4-10。
- 2.
赵晓青,王文伟,张芳,张涛,赵伟,付斌,李志坤。低温胁迫下初级代谢物的时间分布及其与水稻幼苗耐冷性的关系(栽培稻赖斯,2013;6:23。
- 3.
王东,刘军,李超,康辉,王勇,谭旭,刘敏,邓勇,王智,刘勇,张东,肖勇,王国林。水稻苗期耐冷基因的全基因组关联定位。大米。2016;9:61。
- 4.
活性氧和抗氧化机制在植物抗非生物胁迫中的作用。植物生理与生物化学。2010;48:909-30。
- 5.
Glasauer A, Chandel NS。ROS。咕咕叫医学杂志。2013;23:R100-02。
- 6.
方春霞,张培雷,简旭,陈文生,林慧敏,李永忠,林文祥。过表达LSI1.在冷敏感水稻介导转录调控网络,提高对低温胁迫抗性。植物SCI。2017; 262:115-26。
- 7.
关键词:水稻,低温,叶绿体,RNA编辑因子,DUA 1新植醇。2019;221:834-49。
- 8.
Kopriva S,Bauwe H.丝氨酸羟甲基转移酶茄属植物tuberosum.植物杂志。1995;107:271。
- 9
奥利弗DJ。植物线粒体中的甘氨酸脱羧酶复合物。《植物学报》1994;45:323-37。
- 10
植物中丝氨酸和甘氨酸的代谢。印:辛格·BK,编辑。植物氨基酸:生物化学与生物技术。纽约:Marcel Dekker, Inc;1998.111 - 46页。
- 11
《甘氨酸脱羧的遗传操作》。实验机器人杂志,2003;54:1523–35。
- 12
Kisaki T, Imai A, Tolbert NE。绿叶光呼吸相关酶的胞内定位。《植物细胞生理》1971;12:267-73。
- 13
王d,刘H,李S,翟G,邵Ĵ,道Y.表征及的丝氨酸羟甲基转移1分子克隆(OsSHM1)在米饭中。J Intent Plant Biol。2015年; 57:745-56。
- 14
利B,利H,熊L.甲线粒体复合物I缺陷也妨碍冷调节的核基因的表达。植物细胞。2002; 14:1235年至1251年。
- 15.
周华,赵军,杨勇,陈超,刘艳,金鑫,陈磊,李昕,邓晓伟,舒梅克,郭玉玲。泛素特异性蛋白酶16通过调控Na调控拟南芥耐盐性+/H+反转运活性和丝氨酸羟甲基转移酶稳定性。植物细胞。2012;24:5106-22。
- 16.
Moreno JI, Martín R, Castresana C。拟南芥SHMT1,丝氨酸羟甲基转移,在生物和非生物胁迫的光呼吸通路影响电阻的功能。植物杂志2005; 41:451-63。
- 17.
MA JF,Tamai K,Yamaji N,Mitani N,Konishi S,Katsuhara M,Ishiguro M,Yoshiko M. Masahiro Ya Silicon Transporter在米饭中。自然。2006; 440:688。
- 18
Besson V,Neuburger M,Rebeille F,Douce R.绿叶细胞中三种丝氨酸羟甲基转移酶的证据.线粒体和叶绿体亚型的纯化和表征.植物生理生化.1995;33:665-73。
- 19
张玉霞,孙凯,孙凯。植物的单碳代谢:一种质粒丝氨酸羟甲基转移酶的研究。j . 2010; 430:97 - 105。
- 20。
内质网应激:蛋白质、脂质和信号稳态的控制。摩尔性。2013;27:384 - 93。
- 21。
Davletova S,Rizhsky L,Liang H,Shengqiang Z,Oliver DJ,Coutu J,Shulaev V,Schlauch K,Mittler R.细胞溶质抗坏血酸过氧化物酶1是反应性氧基因网络的中心分组分拟南芥.植物细胞。2005;17:268 - 81。
- 22
Rana RM,IQBAL A,Wattoo FM,Khan Ma,张H.HSP70介导的植物应激调节。在:ASEA AAA,Kaur P,编辑。热休克蛋白和应力。Cham:Springer;2018. p。281-90。
- 23
Kim SR,G.水稻叶绿体定位热休克蛋白70,操作系统Hsp70CP1是高温条件下叶绿体发育所必需的。acta botanica yunnanica(云南植物研究),2013;
- 24
齐勇,王浩,邹勇,刘超,刘勇,王勇,张伟。线粒体热休克蛋白70的过度表达对水稻细胞程序性死亡的抑制作用。2月。2011;585:231-39。
- 25
荣格W,莉儿H,恩格尔布雷希特S. ATP合酶:与旋转机械的电化学ransducer。趋势Biochem SCI。1997; 22:420-23。
- 26
黄志强,王志强,王志强,等。线粒体载体的进化、结构和功能:一项新见解的综述。植物j . 2011; 66:161 - 81。
- 27.
Wang L, Xu YY, Zhang C, Ma QB, Joo SH, Kim SK, Xu ZH, Chong K. OsLIC是一种具有转录激活的新型ccch型锌指蛋白,通过油菜素内酯信号介导水稻结构。《公共科学图书馆•综合》。2008;3:e3521。
- 28.
雷切尔M、廖Y、雷特尔M、拉甘C、埃弗斯M、阿莱奥姆A-M、霍罗斯R、亨茨MW、普雷斯特T、米勒AA。大鼠足底组织mRNA结合蛋白质组的测定拟南芥黄化幼苗。植物细胞。2016;28:2435-52。
- 29.
谢晓峰,李晓峰,李晓峰,等。真核生物中组蛋白样转录因子的研究进展。《当代观点结构生物学》1997;7:94-102。
- 30.
Goddard Rh,Wick SM,Silflow CD,Snustad DP。植物细胞细胞骨架的微管组分。植物理性。1994年; 104:1-6。
- 31。
Livanos P,Galatis B,Apostolakos P.植物中ROS和微管蛋白细胞骨架之间的相互作用。植物信号行为。2014;9:e28069。
- 32。
王超,张丽娟,黄东东。细胞骨架与植物耐盐性。植物信号行为。2011;6:29-31。
- 33。
方春霞,王启群,于勇,李启明,张海林,吴晓春,陈涛,林文祥。Lsi1的抑制和过表达诱导水稻在紫外线辐射下的差异表达。植物生长规律。2011;65:1-10。
- 34
Tantikanjana T, Rizvi N, Nasrallah ME, Nasrallah JB。s位点受体激酶在自交不亲和和雌蕊发育中的双重作用拟南芥RDR6突变。植物细胞。2009; 21:2642-54。
- 35
Goodin MM, Zaitlin D, Naidu RA, Lommel SA。尼古利亚娜·宾夕法尼亚州:它的历史和未来,作为植物病原体相互作用的模型。分子植物微生物中。2008; 8:1015年至1026年。
- 36
方春霞,杨立坤,陈文祥,李丽丽,张培雷,李玉珍,何海波,林文祥。MYB57转录调控MAPK11与PAL2、3互作,调控水稻化感作用。J Exp Bot. 2020; 71:2127-41。
- 37
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据-ΔΔct方法.方法.2001;25:402-08。
- 38
花浸:农杆菌介导的植物转化的一种简化方法拟南芥蒂利亚纳《植物杂志》,1998;16:735-43。
确认
我们感谢福建农林大学基础林业和蛋白质组学研究中心提供的种子拟南芥和本生烟草,以及植物生长的温室。
基金
国家自然科学基金(批准号31871556)资助中国福建农林大学杰出青年科学基金(批准号:XJQ201805),福建农林大学作物科学学院作物遗传育种与综合利用教育部重点实验室开放项目(批准号GBMUC-2018-001),闽台作物种质资源与栽培联合创新中心(FJ 2011项目,批准号2015-75)福建农林大学科技创新基金会(批准号:CXZX2017310、CXZX2017145、CXZX2018042)、现代种子工业工程研究所基金会,资助方在研究设计、数据收集与分析、数据解释、稿件撰写等方面没有任何作用。
作者信息
隶属关系
贡献
CF和WL设计了实验。PZ、LL和CF进行了大部分实验,并对数据进行了分析。LY、DM、XY、ZL协助实验并对结果进行讨论。CF和WL撰写了手稿。所有作者阅读并批准了最终的手稿。
通讯作者
道德宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1图S1
的亚细胞定位操作系统水稻原生质体中的SHMT蛋白
附加文件2
序列OsSHMT杜乐基因启动子。表S2蛋白与OsSHMT相互作用OsSHMT转基因答:芥使用GFP陷阱Co-IP.表S3本研究中使用的引物
附加文件3方法
稻叶蛋白的提取
附加文件4电子补充材料
.在duular中,全长凝胶显示蛋白结合在osshmt启动子上
附加文件5电子补充材料2。
全长凝胶呈现蛋白质结合在OsSHMT启动子上LSI1.牛转基因线
附加文件6电子补充材料3。
全长凝胶显示与OsSHMT的蛋白质相互作用拟南芥蒂利亚纳
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.知识共享公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
方超,张鹏,李丽。et al。定位于内质网的丝氨酸羟甲基转移酶在清除H2O2以提高水稻耐冷性。BMC植物杂志20,236 (2020). https://doi.org/10.1186/s12870-020-02446-9
已收到:
接受:
发表:
关键字
- 大米
- 令人心寒的
- 丝氨酸hydroxymethyltransferase
- 罗斯
- 蛋白质相互作用