- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发布:gydF4y2Ba
蛋白质组学分析表明,源库修饰影响小麦叶片衰老和籽粒质量gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba, 文章编号:gydF4y2Ba257gydF4y2Ba(gydF4y2Ba2020.gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
粮食产量是由源活性与库容量的协同作用决定的。然而,源-汇交互作用还远远没有被完全理解。为此,通过田间试验研究小麦旗叶和籽粒对库源调控的响应。gydF4y2Ba
结果gydF4y2Ba
半退化延迟而部分落叶加剧了叶片衰老。库源处理影响了脱叶植物旗叶(LDef)和籽粒(GDef)以及脱粒植物旗叶(LDG)和籽粒(GDG)中活性氧含量和细胞分裂素、吲哚乙酸和茉莉酸等植物激素的浓度。基于相对和绝对定量(iTRAQ)等压标签的定量蛋白质组分析表明,在操作后16天,与对照组相比,LDG组和LDef组中分别观察到97和59个不同功能类别的差异表达蛋白(DEPs)。GDG组和GDef组分别出现115和121个DEPs。DEPs的基因本体学注释术语主要包括:固定碳、过氧化氢分解代谢过程、叶绿体和细胞质、操纵植物叶片氧化还原酶和谷氨酸合酶活性、有机氮化合物代谢过程、细胞质、液泡膜、CoA羧化酶活性、操纵植株籽粒淀粉合酶活性和营养库活性。KEGG途径富集分析表明,光合作用、碳、氮、丙酮酸代谢和糖酵解/糖异生是受库源调控影响最大的过程。库源处理影响淀粉酶和蛋白酶的活性,最终改变每粒质量。gydF4y2Ba
结论gydF4y2Ba
操纵以改变水槽/源率影响激素水平;水解酶活性;碳,氮和其他主要化合物的代谢;抗胁迫;和叶片衰老,从而影响谷物质量。gydF4y2Ba
背景gydF4y2Ba
粮食产量是由源活性与库容量的协同作用决定的。源恢复并为水槽(开发谷物)提供储备。沉降强度由每根茎的谷物的数量和潜在尺寸决定,这取决于植物的能力积极获得其植物器官中的光合作用和储备并积累这些化合物。gydF4y2Ba
小麦(gydF4y2BaTriticum Aestivum.gydF4y2Ba在有利条件下,生产力通常被认为是受库限制的,粮食发育受同化能力的调节,而不受来源的限制[gydF4y2Ba1gydF4y2Ba,因为这种来源通常有能力为发育中的谷物提供足够的同化物。源汇比的增加并不影响粮食质量[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].面包小麦的旧种质脱落不会导致谷物填充的源限制[gydF4y2Ba4gydF4y2Ba].然而,也观察到不一致的结论。Kruk等[gydF4y2Ba4gydF4y2Ba和Beed等人(2007)[gydF4y2Ba5gydF4y2Ba]的报告指出,小麦的来源和库都限制了粮食产量。在灌浆过程中操纵同化物有效性的试验表明,小麦产量主要受库大小的限制[gydF4y2Ba6gydF4y2Ba].Slafer和Savin报告称,小麦的粮食产量要么受到库的限制,要么受到源和库的限制,但从不受到源的限制[gydF4y2Ba7gydF4y2Ba].然而,很难设计出直接的方法来确定源容量和库强度对小麦籽粒产量贡献的相对重要性[gydF4y2Ba8gydF4y2Ba].因此,更好地了解源汇相互作用将有助于使用遗传方法提出改善产量潜力的策略。gydF4y2Ba
许多植物激素作为信号分子在调控作物叶片衰老和籽粒灌浆过程中发挥着重要作用。植物激素在衰老过程中发挥着不同的作用:ABA诱导衰老,而细胞分裂素(CTKs)和生长素抑制衰老[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].在以前的研究中已经概述了各种激素之间的相互作用。激素可以直接参与衰老的调节,也可以起到拮抗作用。此外,植物激素与其他因素的相互作用,如参与氮态和糖信号转导的因素,在调节源库通讯中起着关键作用[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].因此,激素对衰老的调控是一个复杂的过程,需要深入研究。gydF4y2Ba
相对和绝对定量等压标签(iTRAQ)是一种常用的等压标记方法,用于识别来自不同来源的蛋白质,提供比传统蛋白质分析更可靠的定量变化[gydF4y2Ba14gydF4y2Ba].基于这些鉴定的蛋白质,可以构建代谢途径,并且可以进行蛋白质 - 蛋白质相互作用(PPI)分析[gydF4y2Ba15gydF4y2Ba].利用iTRAQ对小麦进行的蛋白质组学研究主要是为了研究蛋白质对干旱、活性氧(ROS)胁迫和营养缺乏等胁迫的响应,以评估环境因素对剖面特征和代谢途径的影响[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].然而,迄今为止,尚未报告基于ITRAQ分析小麦衰老和谷物发育的定量蛋白质组学研究尚未报告缺陷源源操纵。gydF4y2Ba
通过改变籽粒之间的竞争水平和/或同化可得性来改变源库关系,已被用于籽粒结实后的调控,以了解源库平衡对籽粒发育的影响,旨在提出提高小麦籽粒产量的策略[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]及大麦(gydF4y2Ba大麦芽gydF4y2Ba) [gydF4y2Ba19gydF4y2Ba].不幸的是,虽然已经做出了很多努力,但我们仍然远未完全了解源水槽互动[gydF4y2Ba9gydF4y2Ba].源-库相互作用是如何通过栽培方法和遗传操作来调控的尚不清楚。gydF4y2Ba
本研究旨在探讨控制源库比对旗叶和籽粒生理修饰和蛋白质表达的影响,旨在研究通过改变籽粒潜在同化物的有效性来调控叶片衰老和籽粒质量。这些结果可能有助于更好地理解源库关系在粮食发育中的作用,并有助于找到进一步提高粮食产量的有效途径,如育种过程中的遗传修饰。gydF4y2Ba
结果gydF4y2Ba
归一化植被指数(NDVI)、光化学反射率(PRI)和土壤与植物分析仪开发(SPAD)的值gydF4y2Ba
旗叶NDVI、PRI和SPAD值的变化趋势相似gydF4y2Ba1gydF4y2Ba).这些参数随着籽粒灌浆的进行而逐渐降低。PRI值对汇源变化的敏感性高于SPAD和NDVI值。3个处理和生长阶段的PRI值存在显著差异。然而,在处理后16天和24 d, NDVI值仅在半退化和落叶之间存在差异。在16 DAM时,SPAD值仅在半粒化和落叶化之间存在显著差异。在24 DAM时,半脱粒旗叶(LDG)组含量最高,随后对照(LC)组旗叶含量显著降低,而脱叶旗叶(LDef)组进一步降低(表)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
叶绿素荧光gydF4y2Ba
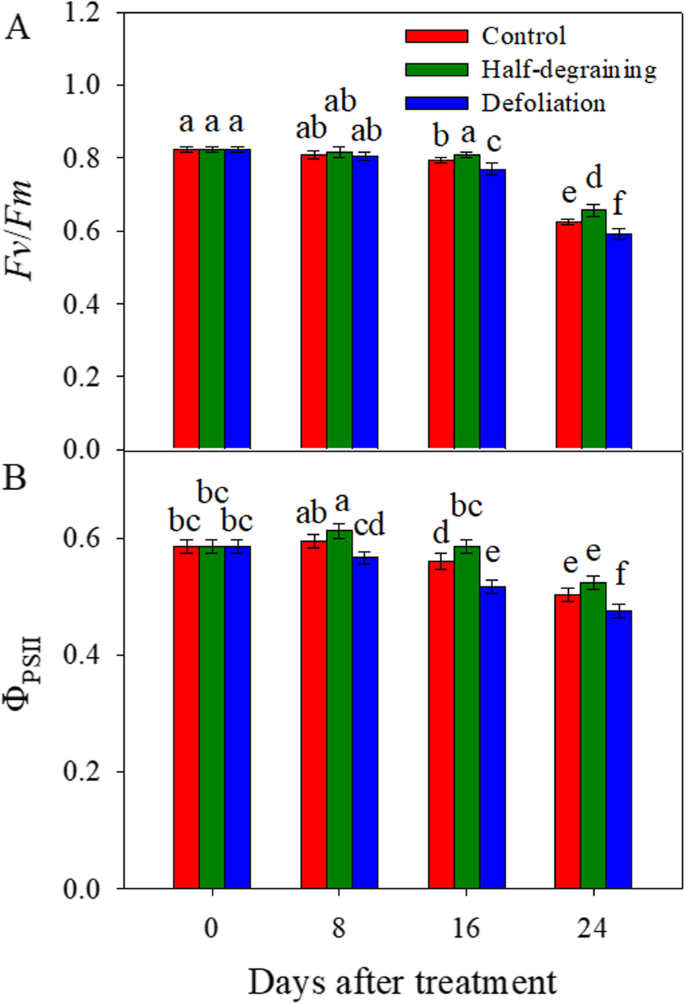
最大PSII量子产额(gydF4y2Ba艘渔船gydF4y2Ba/gydF4y2Ba调频gydF4y2Ba)和PSII有效量子产率(ΦgydF4y2BaPSIIgydF4y2Ba),于上午9时至11时测量。在16和24 DAM时,半降解处理后的这些值均高于正常对照。去叶显著降低gydF4y2Ba阵线/ FmgydF4y2Ba分别为16和24 DAM和ΦgydF4y2BaPSIIgydF4y2Ba值在8,16和24米(图。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
叶绿体结构gydF4y2Ba
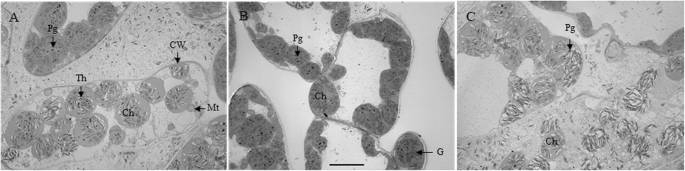
在16 am透射电子显微镜下观察到叶组织细胞超微结构的明显差异(图。gydF4y2Ba2gydF4y2Ba).叶片组织中的叶绿体在所有三种处理后都是球形的。在LDG细胞中(图。gydF4y2Ba2gydF4y2Baa),叶绿体含有较大数量的囊体,与对照相比,叶绿体的基质仍然致密(图。gydF4y2Ba2gydF4y2Bab)和去叶处理组(图。gydF4y2Ba2gydF4y2Bac).在LDef细胞中,胞质中可见大量小泡或膜样碎片(图2)。gydF4y2Ba2gydF4y2Bac).与对照组细胞相比,LDef细胞中组成类囊体的膜不明显,破坏严重。此外,LDef细胞内的类囊体结构表现为某些叶绿体失去了基粒片层的平行排列,部分类囊体肿胀。LDef细胞的叶绿体数量为9.80±0.80个/切片,显著低于LC和LDG细胞的12.60±1.39和13.67±1.40个/切片。gydF4y2Ba2gydF4y2Bac)分别。gydF4y2Ba
旗叶抗氧化酶活性gydF4y2Ba
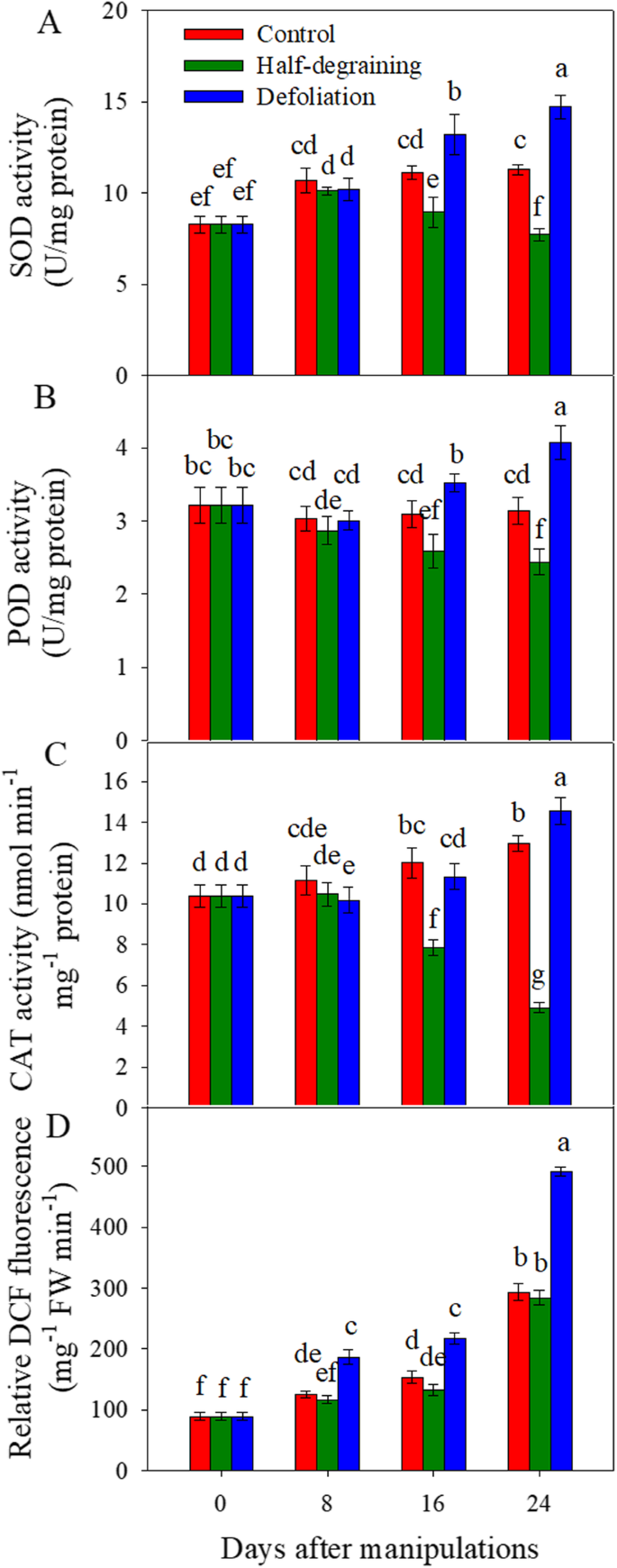
在8 DAM时,LDG组、LDef组和LC组之间超氧化物歧化酶(SOD)活性无显著差异。在16和24 DAM时,与对照相比,半降解显著降低了SOD活性(gydF4y2BaP
库源调控对旗叶和籽粒内源激素的影响gydF4y2Ba
利用内源激素浓度的叶粒比评价源强度和库容量平衡。用玉米素+玉米素核糖体+激动素总浓度评价操作后CTKs的变化。与对照相比,半降解处理显著增加了CTK浓度在3个时间点的叶粒比(gydF4y2BaP
库源修饰下旗叶和籽粒的蛋白质组分析gydF4y2Ba
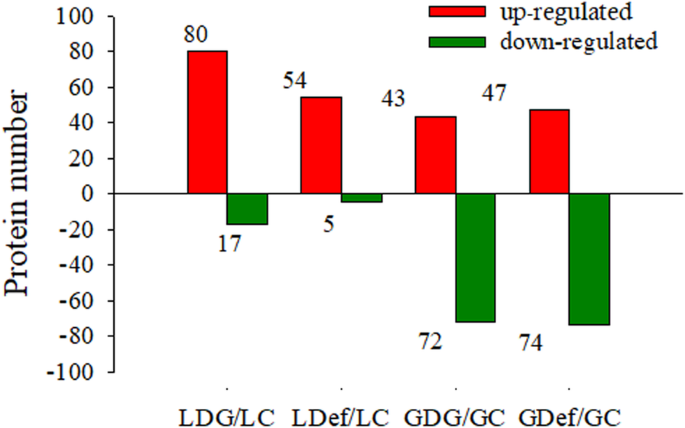
为了研究不同库源修饰对小麦旗叶和籽粒蛋白质组的影响,采用itraq定量蛋白质组学分析方法。旗叶中2821个蛋白质和籽粒中2467个蛋白质被可靠鉴定,全球错误发现率(FDR)为1%。与完整对照组相比,LDG组有97个蛋白表达差异,其中80个蛋白表达增加,17个蛋白表达减少。在LDef组中,与LC组相比,有59个蛋白被划分为差异表达,其中54个蛋白表达增加,5个蛋白表达减少。在半脱粒穗(GDG)组的剩余粒中,有115个蛋白与对照株(GC)粒中差异表达,其中43个蛋白表达增加,72个蛋白表达减少。在去叶粒组(GDef)中,有121个蛋白被指定为差异表达gydF4y2Ba年代gydF4y2Based与GC组相比,包括47个蛋白增加和74个蛋白减少(图。gydF4y2Ba4gydF4y2Ba;表格gydF4y2BaS1gydF4y2Ba).gydF4y2Ba
基因本体(GO)分析gydF4y2Ba
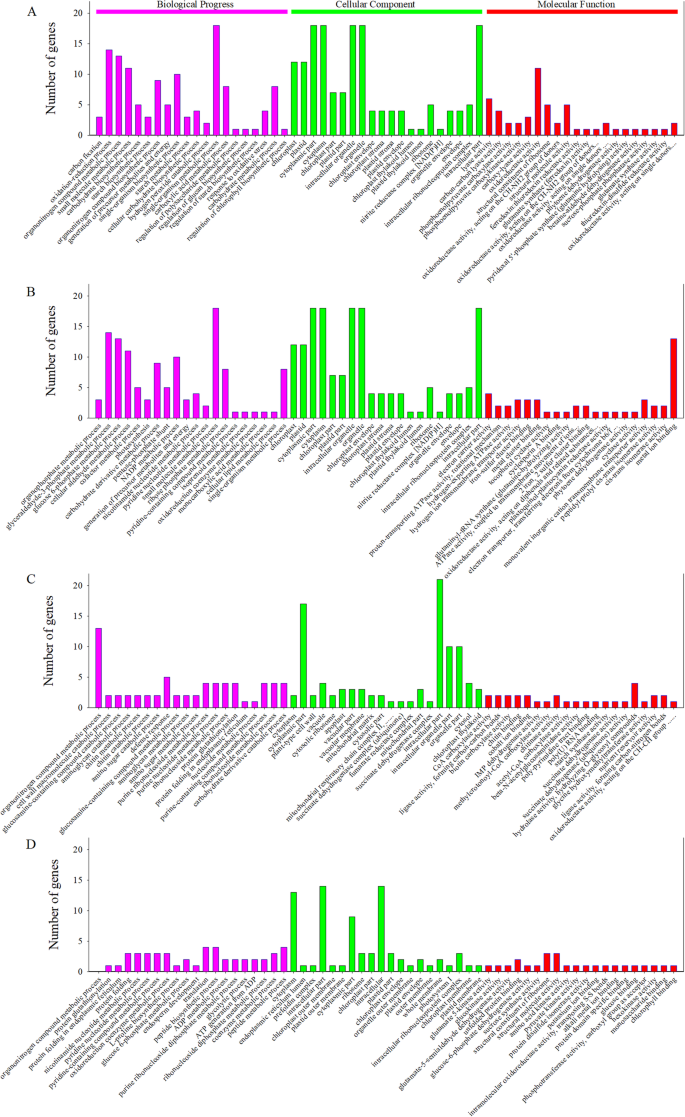
为阐明旗叶和籽粒中的主要响应过程,对GO注释进行了富集分析。通过GO分析,将差异表达蛋白(DEPs)聚类在生物过程(BP)、细胞组分(CC)和分子功能(MF)三类中,前20个GO项如图所示。gydF4y2Ba5gydF4y2Ba.gydF4y2Ba
BP分析表明,在LC基团的比较中鉴定的DEPs主要分为碳固定,氧化还原过程,有机腈复合代谢过程,碳水化合物生物合成过程,淀粉生物合成过程等。根据MF分析,DEPS被分为碳 - 碳裂解酶活性,氧化还原酶活性,核糖体的结构组分,富勒沙昔林:硫氧嘧啶还原酶活性,依赖于辛杂环蛋白依赖性谷氨酸合酶活性,谷氨酰胺水解活性,甜菜碱水解活性,甜菜碱 - 醛脱氢酶活性等。根据CC分析,半降解主要影响叶绿体,体层,细胞质部分,细胞质和细胞内细胞器(图。gydF4y2Ba5gydF4y2Ba一个;表格gydF4y2BaS2gydF4y2Ba).gydF4y2Ba
BP分析发现,与LDef和LC组比较,鉴定出的DEPs主要分为有机磷代谢过程、甘油醛-3-磷酸代谢过程、葡萄糖- 6-磷酸代谢过程、光合作用、碳水化合物衍生物代谢过程等。MF分析表明,脱叶反应主要包括电子载体、质子转运atp酶、氢输出atp酶、氢离子跨膜转运酶、铁硫簇结合酶、生育酚环化酶和谷氨酰基- trna合酶(谷氨酰胺水解)活性。脱叶主要影响叶绿体、质体、类囊体膜、叶绿体包膜、细胞器亚室和光系统II(图2)。gydF4y2Ba5gydF4y2Bab;表格gydF4y2BaS2gydF4y2Ba).gydF4y2Ba
BP分析表明,所鉴定的蛋白主要分为有机物代谢过程、细胞壁大分子分解代谢、氨基糖分解代谢、防御反应、氨基多糖代谢、氨基糖代谢、内质网(ER)的蛋白质折叠和核苷代谢过程。通过比较GDef/GC组,鉴定出的蛋白主要分为CoA羧化酶、连接酶、碳碳键形成酶、生物素羧化酶、甲基-辅酶a羧化酶、乙酰-辅酶a羧化酶、淀粉合酶等。根据CC分析,半降解主要影响细胞质、细胞质部分、液泡膜、线粒体、胞内部分和叶绿体类囊体(图。gydF4y2Ba5gydF4y2Bac;表格gydF4y2BaS2gydF4y2Ba).gydF4y2Ba
根据BP分析,对落叶的粒度反应主要包括有机核化合物代谢的过程,蛋白质谷胱甘肽,蛋白质折叠在ER中,氧化辅助辅酶代谢,L-脯氨酸生物合成,葡萄糖6-磷酸盐代谢,胚乳发育等。根据MF分析,对脱落的反应主要包括谷氨酸5-激酶,葡萄糖酮酶,谷氨酸-5-半醛脱氢酶,展开蛋白质结合,葡萄糖-6-磷酸脱氢酶,蔗糖合酶,核糖体,氨基酸激酶的结构,丙酮酸激酶,蛋白质结构域特异性结合和叶绿素结合。落叶主要影响细胞质,ER内腔,细胞质零部件,核糖体,叶绿体部件和细胞内核核蛋白络合物(图。gydF4y2Ba5gydF4y2Bad;表格gydF4y2BaS2gydF4y2Ba).gydF4y2Ba
京都基因和基因组百科全书(KEGG)路径分析gydF4y2Ba
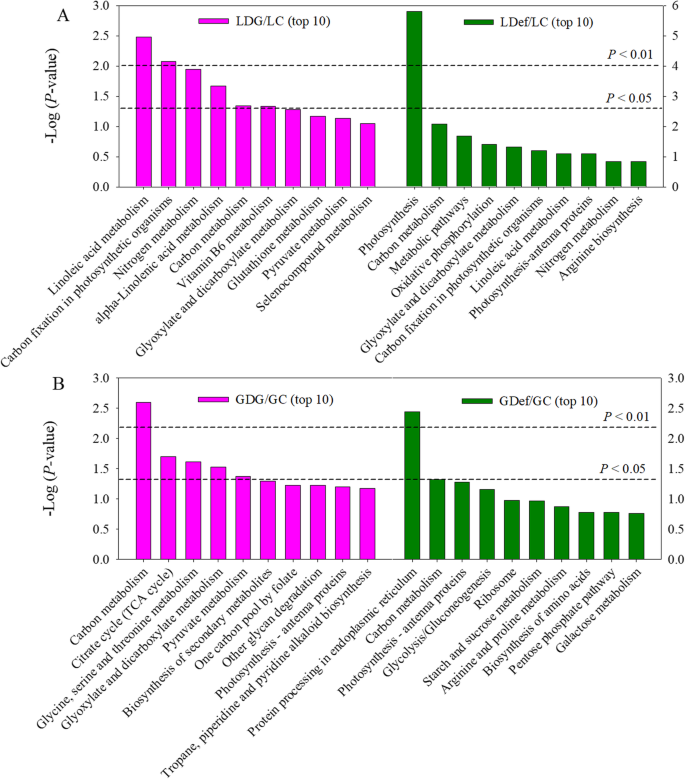
为了了解旗叶和籽粒中细胞过程对库源修饰的主要响应,我们基于大规模的分子数据集使用KEGG通路数据库。途径富集分析表明,LDG组DEPs在亚油酸代谢、α-亚麻酸代谢、光合生物固碳、氮代谢、碳代谢和维生素B等方面均显著富集gydF4y2Ba6gydF4y2Ba代谢。LDEF组的DEPS在光合作用,碳代谢,代谢途径,氧化磷酸化,乙醛酸和二羧酸酯和代谢中显着富集。gydF4y2Ba6gydF4y2Baa).与GC组相比,KEGG数据库中4个途径的dep显著富集:碳代谢途径最具代表性,其次是柠檬酸循环(TCA循环);甘氨酸、丝氨酸和苏氨酸代谢,乙醛酸盐和二羧酸盐代谢。这些途径中的大多数蛋白质都减少了。与GDef/GC组相比,dep仅在两个途径富集,包括ER中的蛋白质加工和碳代谢(图2)。gydF4y2Ba6gydF4y2Bab)综上所述,基于蛋白质组学数据的富集分析表明,光合作用、碳代谢和氮/氨基酸代谢是对库/源操纵响应最强烈的过程。gydF4y2Ba
酶活性gydF4y2Ba
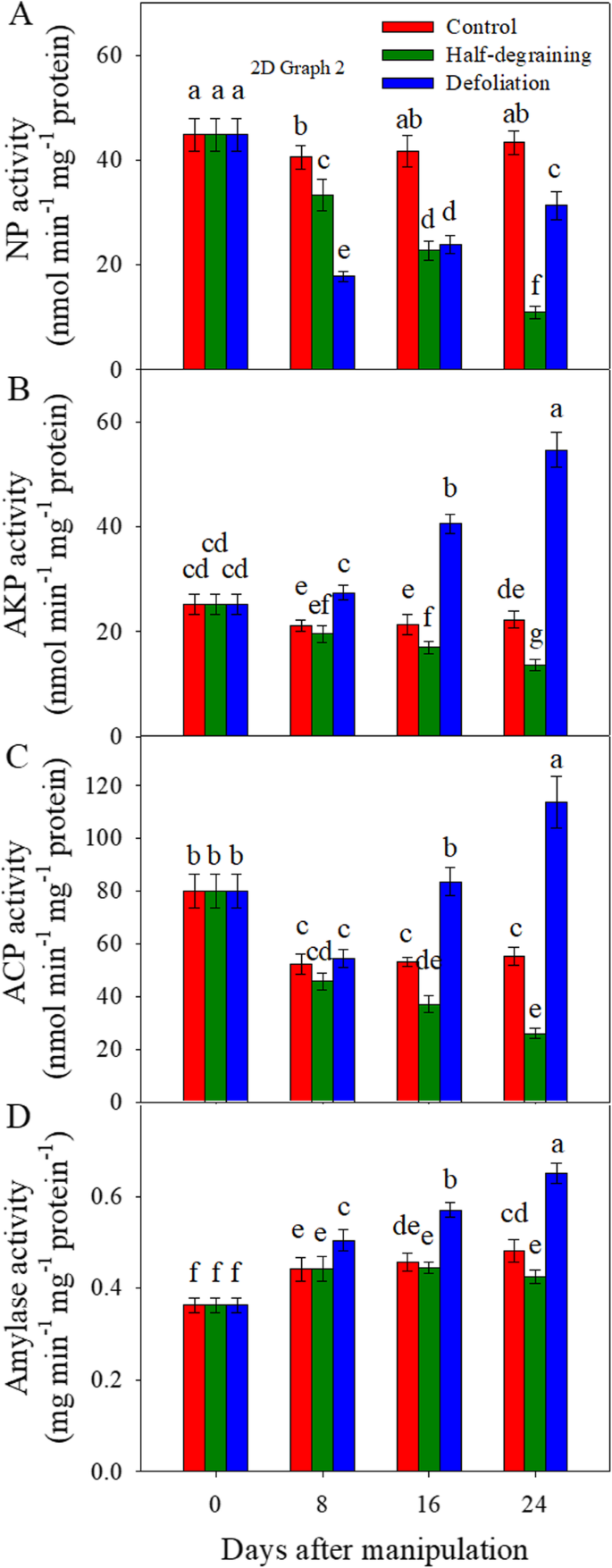
在实验期间,中性蛋白酶(NP),碱蛋白酶(AKP)和酸蛋白酶(ACP)的活性(图。gydF4y2Ba7gydF4y2Ba)在完整植株旗叶中的含量相对稳定。降解降低了NP(图。gydF4y2Ba7gydF4y2Ba), AKP(图。gydF4y2Ba7gydF4y2Bab)和ACP(图。gydF4y2Ba7gydF4y2Bac) 8、16和24 DAM的活性与完好植物的活性比较。落叶处理降低了8、16和24 DAM的NP活性,显著提高了8、16和24 DAM的AKP活性和16和24 DAM的ACP活性。gydF4y2Ba
总的来说,旗叶中的淀粉酶活性从8到24垫比0处的水坝更高,并且仍然恒定从8到24米。从8到24坝,与对照相比,抗液相显着增加了淀粉酶活性。在8和16米下观察到淀粉酶活性的差异。在24坝时,半降解处理显着降低了淀粉酶活性(图。gydF4y2Ba7gydF4y2Bad)。gydF4y2Ba
谷物质量回应来源和水槽操纵gydF4y2Ba
在尖刺的一侧去除尖峰并没有将谷物数量减半(表gydF4y2Ba3.gydF4y2Ba).半降解使每半穗粒数增加了10.49% (gydF4y2BapgydF4y2Ba < 0.05) and the single grain mass by 8.54% (pgydF4y2Ba < 0.05) compared with those of the control. As a consequence, half-degraining increased the grain mass per half-spike by 19.92%. Defoliation reduced the grain number per half-spike by 16.37% (pgydF4y2Ba< 0.05)。籽粒质量对落叶也有显著的响应,每半穗籽粒质量下降19.64% (gydF4y2BapgydF4y2Ba< 0.05)。这些数据表明,半降解降低了籽粒败育;因此,在所有处理中,半降解处理每半穗粒数最高,而落叶处理则相反。gydF4y2Ba
讨论gydF4y2Ba
源/水槽相互作用调节叶片衰老,光合效率[gydF4y2Ba20.gydF4y2Ba和籽粒灌浆能力,从而决定谷物产量[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].具有足够储备的强源对于谷物填充是必要的,并且高温下降能力促进从源到水槽的储备重新化[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].在本研究中,我们从单叶中测定了NDVI、PRI、SPAD和叶绿素荧光值,我们观察到,与完整对照相比,半降解增加了这些指标,而落叶降低了这些指标(表3)gydF4y2Ba1gydF4y2Ba;无花果。gydF4y2Ba1gydF4y2Ba).在16块坝上的标志叶片细胞的超微结构观察表明,在半降解后保持更好的叶绿体状态(图。gydF4y2Ba2gydF4y2Bab)落叶后较差(图。gydF4y2Ba2gydF4y2Bac). NDVI、PRI和SPAD是最常用的光谱指数,与高等植物的叶绿素含量和叶片衰老有关[gydF4y2Ba24gydF4y2Ba].叶绿素荧光和叶绿素降解也广泛用作衰老和光合作用进展的典型指标[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].这些指数的高值与粮食产量密切相关[gydF4y2Ba28gydF4y2Ba].因此,本研究的证据表明,半降解可能导致叶片衰老晚,而落叶可能导致叶片衰老早。gydF4y2Ba
众所周知,ROS会加速植物衰老,而抗氧化酶在清除过量ROS和减少ROS对细胞膜的有害影响方面发挥着重要作用[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].在小麦中,抗氧化防御系统的能力有助于延缓衰老[gydF4y2Ba31gydF4y2Ba].在本研究中,尽管落叶显著提高了SOD、POD和CAT活性,但LDef组的ROS含量高于LC组,特别是在24 DAM,表明抗氧化酶水平的升高可能是ROS水平升高的反应。在iTRAQ分析鉴定的DEPs中,LDef组在16 DAM处SOD(片段)上调(见表)gydF4y2BaS1gydF4y2Ba).这些结果表明,部分源头的去除可能引起更积极的生理反应,从而导致活性氧的爆发和膜氧化,从而导致小麦植株早衰。这些抗氧化酶活性的提高可能是保护植物免受更严重的损害,部分缓解早期衰老,并试图增加灌浆期和粒重的一种策略。LDG组SOD、POD和CAT活性降低,ROS含量略有下降(图2)。gydF4y2Ba3.gydF4y2Ba;表格gydF4y2BaS1gydF4y2Ba对于POD),表明半污水可能对旗叶上的“负担”施加较低的“负担”,从而导致ROS生产较低。gydF4y2Ba
植物激素和相关激素串扰与源库关系、库容量、灌浆速率的改变显著相关[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba]、膜稳定性、叶片衰老和光合效率,可能是通过作为信号清除活性氧或阻止活性氧形成[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].gydF4y2Ba
Cytokinins是调节叶片衰老的启动和时序的最重要的植物激素[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba]并且与留在温度突变体中的叶片衰老的进展密切相关gydF4y2Batasg1gydF4y2Ba小麦[gydF4y2Ba31gydF4y2Ba]并且在玉米的温度绿色型(gydF4y2Ba玉米gydF4y2Ba) [gydF4y2Ba40gydF4y2Ba].谷物CTK含量与最大粒度呈正相关[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].等主要谷类作物小麦、CTK更高浓度存在于谷物和函数的胚乳细胞分裂期间在粮食发展的早期阶段,这与生长素的功能相结合,积极和显著相关的细胞分裂和灌浆期(gydF4y2Ba11gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba],因为增强的下沉强度[gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba].gydF4y2Ba
玉米籽粒IAA浓度在灌浆早期迅速增加[gydF4y2Ba48gydF4y2Ba],从而产生“吸引力”,并导致谷物中CTK浓度增加[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba],这与向发育中的谷物输送同化物的增加有关[gydF4y2Ba48gydF4y2Ba].此外,植物蛋白与增强的水槽容量相关联,导致营养增量源营养素复合,细胞增大和籽粒灌装速度增加[gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba].gydF4y2Ba
在我们的研究中,落叶降低了叶粒比CTK和IAA浓度(表1)gydF4y2Ba2gydF4y2Ba).根据目前和以往的研究结果,我们假设,由于落叶造成的更高的来源竞争相对刺激了籽粒激素的生物合成,从而增加了库的强度,提高了它们从有限的来源吸收更多储备的潜力。与此同时,通过超微结构观察和植被指数测量发现,旗叶中相对较低的CTKs和IAA水平促进了籽粒灌浆大分子的降解,从而导致早期衰老(表)gydF4y2Ba1gydF4y2Ba;无花果。gydF4y2Ba2gydF4y2Ba).这种观点与表明在具有较大沉降比率的品种中的结果中,对源光合作用供应的竞争更大,以满足谷物填充,导致过早衰老[gydF4y2Ba21gydF4y2Ba].此外,本研究的数据表明,CTK和IAA浓度的叶粒比可能在调控小麦叶片衰老中起主导作用。gydF4y2Ba
半降解增加了CTK浓度的叶粒比(表gydF4y2Ba2gydF4y2Ba).基于这些结果,正如上面所讨论的,我们建议由于half-degraining源强度相对较高,因此较低的竞争压力源储备导致更高的ctk叶/谷物比和较慢的再活化的叶储备,造成延迟叶片衰老。gydF4y2Ba
CTKs和JA是对植物衰老具有拮抗信号作用的主要激素[gydF4y2Ba13gydF4y2Ba].ROS和JA的积累导致叶片早衰,光合效率低[gydF4y2Ba53gydF4y2Ba].对JA生物合成的特异性抑制导致水稻籽粒产量的增加[gydF4y2Ba54gydF4y2Ba].在我们的研究中,我们观察到半降解降低了8 DAM下JA浓度的叶粒比,而落叶降低了试验期间JA浓度的叶粒比(表2)gydF4y2Ba2gydF4y2Ba).考虑到JA对来源操纵的响应,我们假设较低的JA叶粒比可能有助于避免落叶植物的叶片过早衰老。gydF4y2Ba
叶片衰老与蛋白质组的基本变化有关。本研究采用基于iTRAQ的比较蛋白质组学分析方法,确定参与叶片衰老和籽粒灌浆的关键候选因子。BP、MF和CC类别中的GO项如图所示。gydF4y2Ba5gydF4y2Ba.还进行了这些基因的Kegg途径浓缩分析(图。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
叶绿体是产生ROS的中央细胞器,而ROS的积累可能导致氧化损伤并抑制光合作用[gydF4y2Ba55gydF4y2Ba].Ferredoxin:脑膜氧化辛还原酶是叶绿体开发所必需的gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba[gydF4y2Ba56gydF4y2Ba]并作为抗氧化防御系统的组成部分[gydF4y2Ba57gydF4y2Ba].氧化还原系统的破坏导致ROS的爆发,例如超氧化物(O.gydF4y2Ba2gydF4y2Ba·−gydF4y2Ba)和过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba),导致早期叶片衰老[gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba].谷胱甘肽通过氧化/还原过程循环,因此参与氧化应激;它的代谢在维持氧化还原平衡、消除氧化损伤方面发挥着重要作用[gydF4y2Ba60gydF4y2Ba].叶绿烯脱氢酶与类胡萝卜素的生物合成途径有关,类胡萝卜素是一种膜抗氧化剂[gydF4y2Ba61gydF4y2Ba].在LDG和LC基团之间进行比较,富勒氏蛋白酶:将硫氧嗪还原酶在MF中聚集,并在LDG组中上调。BP最普遍的GO术语参与ROS代谢过程,包括氧化还原过程,对氧化应激的反应H.gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba代谢过程和ogydF4y2Ba2gydF4y2Ba·−gydF4y2Ba删除(表gydF4y2BaS1gydF4y2Ba).在这些过程中,根据PAS_Zscore判断,LDG组氧化还原过程的稳态增强最强(见表)gydF4y2BaS2gydF4y2Ba).MF分析显示,两种氧化还原酶活性均受到显著影响,前10个KEGG通路中谷胱甘肽代谢均得到鉴定(图2)。gydF4y2Ba5gydF4y2Ba一种)。上调囊体染料过氧化物酶(APX)(碎片)和甜菜碱醛脱氢酶(BADH;甜菜碱生物合成的重要酶)(表gydF4y2BaS1gydF4y2Ba),并参与多种途径(图。gydF4y2BaS1gydF4y2Ba).APX和Betaine函数都作为ROS扫除者[gydF4y2Ba62gydF4y2Ba].这些结果表明,半降解可能通过促进活性氧清除活性来增强叶片的抗氧化能力,至少部分促进了叶片延缓衰老(表1)gydF4y2Ba1gydF4y2Ba;无花果。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
LDG / LC组的Kegg途径分析表明DEPS主要参与氮和碳代谢。相应地,MFS,包括谷氨酸合酶,富勒森蛋白依赖性谷氨酸合成酶(FD-Gogat; EC 1.4.7.1)和吡哆醛5'-磷酸合酶(谷氨酰胺水解)活性和碳代谢(图。gydF4y2Ba5gydF4y2Ba一个;表格gydF4y2BaS2gydF4y2Ba),受到影响。BP分析显示这些过程上调,表明LDG组的氮和碳代谢可能增强。事实上,根据CC分析,在蛋白质生物合成中发挥重要作用的类别,如胞浆核糖体和核糖体,在LDG组中具有高度代表性(图)。gydF4y2Ba5gydF4y2Ba一个;表格gydF4y2BaS2gydF4y2Ba).因此,上调了诸如60s核糖体和40℃的核糖体蛋白的DEP(表gydF4y2BaS1gydF4y2Ba).gydF4y2Ba
LDG组与LC组比较,与光合作用、前体代谢产物和能量产生相关的DEPs均上调(表)gydF4y2BaS1gydF4y2Ba)并且显示出与光合生物中的碳固定的显着相互作用(图。gydF4y2BaS1gydF4y2BaB). MFs,如磷酸烯醇丙酮酸羧激酶和蔗糖-磷酸磷酸酶的活性受到影响(表gydF4y2BaS1gydF4y2Ba).最重要的是,蔗糖磷酸磷酸酶与源活性相关,增强其产物蔗糖从叶向库的运输[gydF4y2Ba63gydF4y2Ba]并影响小麦叶片衰老的进展[gydF4y2Ba64gydF4y2Ba].gydF4y2Ba
在GDG组中,胺氧化酶,催化反应产生H.gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba[gydF4y2Ba65gydF4y2Ba]较GC组下调,而Cu-Zn SOD和脱氢抗坏血酸还原酶(DHAR)上调(表)gydF4y2BaS1gydF4y2Ba).SOD是一种重要的抗氧化酶,DHAR通过循环利用抗坏血酸(植物中的主要抗氧化剂)来降低叶片ROS的水平,从而影响叶片衰老的速率和光合活性[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].因此,氧化石墨烯分析表明,伯胺氧化酶和氧化还原酶活性受到影响。蛋白谷胱甘肽化,氧化还原调节和信号转导的机制[gydF4y2Ba66gydF4y2Ba],表达上调(表gydF4y2BaS2gydF4y2Ba).这些变化表明,在源库比较高的半脱粒植物中,剩余颗粒可能具有较高的清除ROS的能力。gydF4y2Ba
蛋白质二硫异构酶(pdi)主要存在于真核生物的内质网中,在蛋白质折叠过程中起着重要作用。pdi的水平与蛋白质生物合成活动有关[gydF4y2Ba67gydF4y2Ba,gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba]和非生物抗压力[gydF4y2Ba68gydF4y2Ba].在本研究中,GDG组的pdi水平上调(表)gydF4y2BaS1gydF4y2Ba), 60S核糖体蛋白L29、40S核糖体蛋白S12和真核翻译起始因子4B1也上调(表)gydF4y2BaS1gydF4y2Ba).这些变化表明除谷物可能会影响GDG组颗粒中的蛋白质合成。gydF4y2Ba
光合作用,包括光合作用和光反应,光收获和黑暗反应,也显着上调;另外,塑性粘蛋白和gydF4y2Ba:gydF4y2Ba基因产物(片段)在GDG组中上调,表明可能有更高的光利用效率。的gydF4y2Ba:gydF4y2Ba基因参与碳、乙醛酸盐和二羧酸盐代谢[gydF4y2Ba70gydF4y2Ba].这些变化表明,通过表达,半降解碳,甘油酯和二羧酸酯的代谢影响gydF4y2Ba:gydF4y2Ba如图所示。gydF4y2BaS1gydF4y2BaC。gydF4y2Ba
在植物中,乙酰辅酶a羧化酶通过乙酰辅酶a羧化成丙二酰辅酶a催化从头脂肪酸生物合成的第一步[gydF4y2Ba69gydF4y2Ba,gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba].在本研究中,GDG组乙酰辅酶A羧化酶、质体乙酰辅酶A羧化酶(片段)和乙酰辅酶A羧化酶(片段)下调;CoA羧化酶、乙酰CoA羧化酶和生物素羧化酶活性也受到影响。质体乙酰辅酶a羧化酶与许多其他DEPs有相互作用(图)。gydF4y2BaS1gydF4y2BaC).这些结果表明,在GDG组中脂肪酸的生物合成可能受到影响。gydF4y2Ba
在分析GDG/GC组的MF类别时,确定了与琥珀酸脱氢酶(泛素)活性相关的过程(图)。gydF4y2Ba5gydF4y2Bac;表格gydF4y2BaS2gydF4y2Ba),根据琥珀酸脱氢酶[泛素酮]黄蛋白亚基和线粒体上调,以线粒体电子传输等MF类为代表,琥珀酸转化为泛素酮(图。gydF4y2Ba5gydF4y2Bac)和柠檬酸循环(图。gydF4y2Ba6gydF4y2Bab).这些过程可能发生在CCs中,如线粒体基质、线粒体呼吸链复合物II和琥珀酸脱氢酶复合物(泛素)(图2)。gydF4y2Ba5gydF4y2BaC)。此外,GMP生物合成方法,GMP代谢过程,水解酶活性(水解O-糖基化合物),显着表示糖基化合物代谢过程和糖基化合物生物合成过程(表gydF4y2BaS2gydF4y2Ba).这些结果表明,半降解可能影响剩余晶粒的能量产生。在BP分析中,我们确实观察到与能量产生相关的类别上调,包括前体代谢物和能量的产生,以及电子传递偶联ATP合成偶联电子传递(表)gydF4y2BaS2gydF4y2Ba).gydF4y2Ba
在我们的研究中,LDEF组中的相对ROS含量增加(图。gydF4y2Ba3.gydF4y2Ba),这可能会抑制光合作用[gydF4y2Ba56gydF4y2Ba,如上所述。而谷胱甘肽s-转移酶、超氧化物歧化酶(片段)和氧化还原酶活性,作为受体作用于超氧化物自由基;SOD活性(图gydF4y2Ba3.gydF4y2Ba);氧化还原过程;氧化还原辅酶代谢过程;生育酚环化酶和谷胱甘肽s -转移酶gydF4y2BaS1gydF4y2Ba)上调生育酚环化酶活性(表gydF4y2BaS2gydF4y2Ba),表明在LDef组中,可能已经发展出一些帮助植物清除ROS和消除氧化损伤的策略[gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba].然而,活性氧代谢过程、超氧自由基的清除、细胞对超氧自由基的反应、细胞对氧自由基的反应、HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba代谢过程和细胞对ROS的反应下调(表)gydF4y2BaS2gydF4y2Ba).gydF4y2Ba
有趣的是,在LDEF组中,前20名明显代表的BPS(表gydF4y2BaS2gydF4y2Ba).与光合作用相关的术语是显着富集的,但显示出不同的变化趋势。例如,上调塑性组织和辅助因子代谢过程。还上调与光合作用 - 天线蛋白和碳代谢相关的DEPs(图。gydF4y2BaS1gydF4y2BaB).然而,叶绿素生物合成、叶绿素代谢和色素生物合成过程被下调(表)gydF4y2BaS2gydF4y2Ba).这些结果表明叶片光合作用可能受到影响(图。gydF4y2Ba5gydF4y2Bab).根据MF分析,铁硫团簇结合、2Fe-2S铁硫团簇结合和3Fe-4S铁硫团簇结合通过调节水稻的电子传递和叶绿素含量,在光合速率中发挥重要作用[gydF4y2Ba75gydF4y2Ba,受到了显著影响。因此,包括电子载体、质子转运atp酶、氢输出atp酶、氢离子跨膜转运酶和质体喹啉-质体青苷还原酶在内的许多MF类别的活性都发生了变化(图)。gydF4y2Ba5gydF4y2Bab;表格gydF4y2BaS2gydF4y2Ba),说明能量供应在LDef组中可能非常重要。事实上,主要与能量代谢相关的氧化石墨烯类别被上调,包括甘油醛-3-磷酸代谢过程,葡萄糖- 6-磷酸代谢过程,碳水化合物衍生物的代谢过程和前体代谢物的产生和能量通过戊糖-磷酸盐途径和戊糖-磷酸盐分流(表gydF4y2BaS2gydF4y2Ba).gydF4y2Ba
在LDef基团中,是肽基-脯氨酸gydF4y2Ba独联体gydF4y2Ba-gydF4y2Ba反式gydF4y2Ba异构酶和肽丙醇异构酶富集,影响蛋白质折叠,并与叶绿素a-b结合蛋白和细胞色素相互作用gydF4y2Bab-c1gydF4y2Ba配合亚基Rieske如图所示。gydF4y2BaS1gydF4y2BaB.脂质代谢方面,LDef组有机磷代谢、细胞脂质代谢、脂质生物合成和磷脂生物合成过程也上调。此外,蛋白谷胱甘肽化是氧化还原调节和信号转导的一种机制[gydF4y2Ba66gydF4y2Ba[和氧化还原过程是下调的,表明可以降低清除ROS的能力。gydF4y2Ba
在GDEF组的BP类别分析中,增强了有机腈复合代谢和细胞蛋白质代谢过程。然而,下调蛋白质折叠(表gydF4y2BaS2gydF4y2Ba);另外,下调翻译,肽生物合成,肽代谢和L-脯氨酸生物合成过程。结果,大量的低分子量谷丁蛋白(亚基)减少了(表gydF4y2BaS2gydF4y2Ba).这些过程可能发生在内质网腔、预折叠复合物和核糖体中,调控核糖体的结构成分gydF4y2BaS2gydF4y2Ba),特别是在内质网中,因为内质网中的蛋白质加工受到显著影响(图。gydF4y2Ba6gydF4y2Bab)。gydF4y2Ba
在GDEF组中,下调葡萄糖6-磷酸盐代谢过程和前体代谢物和能量的产生(表gydF4y2BaS2gydF4y2Ba).丙酮酸激酶降低,丙酮酸激酶活性降低(表gydF4y2BaS1gydF4y2Ba,gydF4y2BaS2gydF4y2Ba).同时,叶绿素a-b结合蛋白(叶绿体)也下调。光合作用、光收获和光反应也降低。这些结果表明,在落叶植物的籽粒中,光合效率和能量产生可能受到影响。gydF4y2Ba
根据以上结果,我们进一步推测落叶对胚乳发育和种子发育成熟有一定的阻碍作用,如表所示gydF4y2BaS2gydF4y2Ba.gydF4y2Ba
正常衰老叶片中的大量大分子被降解酶降解为小分子[gydF4y2Ba76gydF4y2Ba,这导致大量韧皮部可移动的营养物质从植物衰老的部分重新动员到正在发育的汇[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba77gydF4y2Ba].gydF4y2Ba
蛋白质组学分析结果表明,源库修饰主要影响氮、碳代谢和能量生产。在植物叶片衰老过程中,编码蛋白酶的基因过度表达[gydF4y2Ba78gydF4y2Ba,gydF4y2Ba79gydF4y2Ba,gydF4y2Ba80gydF4y2Ba,gydF4y2Ba81gydF4y2Ba].大量与衰老相关的蛋白酶上调,由此产生的分解代谢产物从叶片被动员到发育中的谷物中[gydF4y2Ba76gydF4y2Ba,gydF4y2Ba82gydF4y2Ba,gydF4y2Ba83gydF4y2Ba,gydF4y2Ba84gydF4y2Ba].淀粉酶的活性在淀粉降解和非结构性碳水化合物从营养器官转移到发育库中起着至关重要的作用,因此对籽粒灌浆至关重要[gydF4y2Ba85gydF4y2Ba,gydF4y2Ba86gydF4y2Ba].在本研究中,脱落增加了淀粉酶的活性(图。gydF4y2Ba7gydF4y2Ba)和酸性和碱性蛋白酶(图。gydF4y2Ba7gydF4y2Ba).在24块坝上在16和24坝和24个坝和淀粉酶活性下进行半降低蛋白酶活性。这些结果表明,脱落植物的较早衰老可能部分是由于这些水解酶的活性的增加和从脱落植物中的较小叶面积的较早的营养素重新染色,而半润泽植物中的延迟衰老可能部分地部分蛋白质和淀粉降低引起的。gydF4y2Ba
营养器官CTKs在调节衰老中发挥重要作用,这与延迟蛋白水解活性和氮再分配到发育中的粒体有关[gydF4y2Ba87gydF4y2Ba,gydF4y2Ba88gydF4y2Ba,gydF4y2Ba89gydF4y2Ba].因此,我们推测CTK浓度的降低可能与LDef组蛋白水解活性的增加有关。gydF4y2Ba
结论gydF4y2Ba
在这项研究中,降低了沉降/源比由于半减少的延迟小麦叶片衰老,而导致落叶引起的较高的水槽/源极率导致较高量的ROS生产,并促进叶绿素 - 蛋白复合物和碳水化合物的降解,从而促进植物衰老。CTKS,IAA和JA和这些激素之间的相互作用在调节源能力和沉降力方面发挥了重要作用,从而影响了叶片衰老的过程。水槽和源操作诱导了许多差异表达的蛋白质,主要涉及ROS清除,叶片光合作用,碳和氮代谢,前体代谢物和能量和籽粒发育的产生。通过水解酶活性的碳水化合物和蛋白质的降解在脱落植物的旗叶中促进了叶片,但在半缩短植物的植物中延迟,这反过来又受到谷物中的碳和氮代谢。半尖峰去除增强但落叶抑制的单粒生长,表明小麦的产量潜力受到水槽容量和源可用性的限制。我们的结果表明,通过强化繁殖期间的源和陷阱能力,可以实现未来的产量改善,以增加小麦的产量潜力。gydF4y2Ba
方法gydF4y2Ba
网站,实验和设计gydF4y2Ba
实验是在山东农业科学院的实验站(36°42'n,117°4'e;高度48米)的田野的一个领域的2017-2018种植季节。土壤是一种很好的壤土。在本实验中使用了由山东农业科学院作物研究所开发的小麦品种Jimai 23。Jimai 23是由于其高谷物产量而在中国北方各次种植的品种的代表。在2017年10月10日,种子播种,以225种种子mgydF4y2Ba−2gydF4y2Ba在三个墨水中(每个30米gydF4y2Ba2gydF4y2Ba).在种植之前施肥的地块有10克gydF4y2Ba−2gydF4y2BaPgydF4y2Ba2gydF4y2BaOgydF4y2Ba5gydF4y2Ba, 10g KgydF4y2Ba2gydF4y2Bao M.gydF4y2Ba−2gydF4y2Ba7.5 g N mgydF4y2Ba−2gydF4y2Ba.在拍摄阶段(Zadoks阶段31),15克氮米gydF4y2Ba−2gydF4y2Ba被尿素覆盖。2018年6月6日,成熟谷物收获。gydF4y2Ba
来源和水槽操纵gydF4y2Ba
库源处理方法如下:(1)人工去除穗一侧的所有小穗,使剩余籽粒的同化物有效性增加一倍;(2)除旗叶外,所有茎叶均被去除,以降低源同化物的有效性。在每个地块开花后的2天,在3行2米的切片上进行每次操作。选取3个2米长的切片作为对照。gydF4y2Ba
植被指数的测量gydF4y2Ba
NDVI和PRI是用PlantPen仪器(Photon Systems Instruments, Brno, Czech Republic)从每个地块的30片旗叶中测量的。采用叶绿素仪(SPAD-502 plus,日本柯尼卡美能达公司)在8、16和24 DAM时测定每个地块至少30个旗叶的SPAD指数。对每个地块的数据求平均值。gydF4y2Ba
叶绿素荧光测定和成像gydF4y2Ba
在不同阶段进行叶绿素荧光分析gydF4y2Ba艘渔船gydF4y2Ba/gydF4y2Ba调频gydF4y2Ba和ΦgydF4y2BaPSIIgydF4y2Ba在kong等人描述的情况下,在旗叶使用动力学成像荧光计(荧光粉,光子系统仪器有限公司,布尔诺,捷克共和国)。[gydF4y2Ba90gydF4y2Ba].gydF4y2Ba
透射电子显微镜gydF4y2Ba
TEM观察结果按照Kong等人先前报道的方法进行处理[gydF4y2Ba90gydF4y2Ba]使用透射电子显微镜(JEM-1200EX; JEOL Ltd.,Tokyo,Japan),在80 kV。gydF4y2Ba
激素分析gydF4y2Ba
从8,16和24大坝的三个生物重复中收集每次治疗的标志叶或尖峰。立即在液氮中冷冻;然后储存在-80°C。然后,将叶子和晶粒用于每个激素分析。gydF4y2Ba
根据Liu等人的研究,提取和纯化玉米素、玉米素核糖体、激动素和IAA [gydF4y2Ba34gydF4y2Ba].简单地说,样品(大约0.10 g旗叶或谷物)在预冷却的砂浆中研磨,其中包含5毫升80% (v/v)甲醇提取溶液,并加入1毫米丁基羟甲苯作为抗氧化剂。提取液4°C孵育过夜,12000×离心gydF4y2BaggydF4y2Ba4°C保存15分钟。上清液用N烘干gydF4y2Ba2gydF4y2Ba在40℃下溶解在200μl甲醇中并通过膜(0.45μm)过滤。使用高效液相色谱(HPLC; RIGOL L3000,北京,中国)使用Kromasil C18反向相柱测量激素浓度。通过以2:3(v / v)的比例将甲醇和超纯水混合来制备流动相。注射体积为10μL,流速为0.8ml / min,塔温为35℃,洗脱时间为60分钟,检测波长为254nm。进行三种独立的每个样品的生物学重复。gydF4y2Ba
对于JA分析,样品(约0.10 g)在液氮中研磨成细粉,并在4°C下用1.0 ml 90% (v/v)甲醇萃取过夜。粗提物在12000×离心gydF4y2BaggydF4y2Ba静置10 min,收集上清。然后用0.5 ml的90%甲醇重新提取沉淀2 h,再离心。2次提取后,将上清液混合,40℃孵育风干。用乙酸乙酯/环戊烷(1:1,v:v)和三氯乙酸(1mg /ml)分别溶解于1ml乙酸乙酯/环戊烷(1:1,v:v)和20 μl,旋转30 min, 8000×离心gydF4y2BaggydF4y2Ba10分钟。将顶部有机相干燥,溶解在流动相中,注入反相C18高效液相色谱柱中,采用荧光检测器进行JA分析。用甲醇和0.1%甲酸(65%:35%,v/v)混合制备流动相。进样量为10 μl,流速为0.8 ml/min,柱温为35℃,洗脱时间为30 min;230 nm监测。每个样品至少进行三个独立的生物学重复。gydF4y2Ba
蛋白质准备gydF4y2Ba
叶片(每个生物复制约0.1 g FW)在液氮中研磨成细粉,并彻底转移到Eppendorf管中。在试管中加入1 ml预冷苯酚提取缓冲液(100 mM Tris-HCl, 50 mM EDTA, 100 mM KCl, 2% (w/v) DTT, 30%蔗糖和2% SDS;加入pH 8.0),室温孵育10 min。然后,加入1 ml酚饱和的Tris-HCl (pH 8.0)。在4°C搅拌40分钟。在12000×以12000×离心后gydF4y2BaggydF4y2Ba在4℃下持续15分钟,收集上酚相,除去碎片,并用预冷却为100mM乙酸铵 - 甲醇溶液沉淀蛋白质在-20℃下沉淀。离心后,用冷丙酮洗涤颗粒三次,用冷却5分钟。在600μl裂解缓冲液中重悬浮(4%SDS,100mM Tris-HCl,1mM DTT,pH 7.6),在室温下温育60分钟并以12000×离心gydF4y2BaggydF4y2Ba室温下静置10分钟。样品被收集并储存在−80°C用于iTRAQ分析。蛋白浓度根据Bradford assay (Bradford, 1976)测定。gydF4y2Ba
胰蛋白酶消化和iTRAQ标记gydF4y2Ba
每种生物重复约100μg蛋白质用于消化。首先,通过在60℃下加入120μL缓冲液(10mM DTT,8M尿素,100mM四乙基溴化铵(Temb),pH 8.0),将蛋白质样品在60℃下加入1小时,然后使用50mM碘乙酰胺烷基化40 min at room temperature in the dark. Subsequently, the proteins (precisely 0.1 mg) were diluted with 100 μl 100 mM TEAB. Then, 2 μl sequencing-grade trypsin (1 μg/μl; Promega) was added for digestion at 37 °C for 12 h. After centrifugation at 12000×ggydF4y2Ba20分钟,收集上清液并冻干。将冻干样品解冻并在100μl100mM泡沫中重构。将100μLItraq试剂转移到样品管中并通过在室温下孵育2小时标记。加入200μl水以淬灭标记反应后,溶液冻干。gydF4y2Ba
质谱(MS)分析gydF4y2Ba
标记的多肽在纳米喷雾Flex源下使用Q-Exactive质谱仪(Thermo,美国)进行分析。以下分析是根据Xu等人所描述的程序进行的。[gydF4y2Ba91gydF4y2Ba和Xiong等[gydF4y2Ba92gydF4y2Ba].gydF4y2Ba
蛋白质识别和量化gydF4y2Ba
使用Sequest®搜索引擎使用Proteome Discover™1.3(Thermo,USA)软件分析了MS / MS谱数据文件,并被搜索到UniProtgydF4y2Ba小麦属植物aestivugydF4y2Ba.小麦的Fasta数据库为1%FDR。前体离子和片段离子的质量误差分别设定为10ppm和0.02da。gydF4y2Ba
可靠蛋白的筛选标准为:唯一肽≥1,剔除无效值和反文库数据,基于可靠蛋白筛选差异表达蛋白。筛选差异蛋白,学生的gydF4y2BatgydF4y2Ba-测试gydF4y2BapgydF4y2Ba对照籽粒样品中,旗叶样品< 0.05和折数变化> 1.3或< 0.77,或大于1.5倍或小于0.67倍,并在两个试验基础上应用两个处理。gydF4y2Ba
生物信息学分析gydF4y2Ba
数据库(gydF4y2Bahttp://www.omicsbean.com:88/gydF4y2Ba)及OmicsBean软件(gydF4y2Bahttp://www.ebi.ac.uk/Interpro/gydF4y2Ba)用于基因本体论(GO)注释。在OmicsBean软件中,每个蛋白质被分配到生物过程、细胞成分和分子功能。注释后,将蛋白质映射到京都基因和基因组百科全书(KEGG)数据库(gydF4y2Bahttp://www.kegg.jp/gydF4y2Ba).使用Cytoscape软件还进行PPI分析。gydF4y2Ba
酶化验gydF4y2Ba
对于总淀粉酶活性,从三次重复收集标志叶(约0.1g FW)并在预充电的砂浆和杵中均化,用1ml冷却的蒸馏水。加入另外9ml蒸馏水后,将混合物置于室温下20分钟以提取总淀粉酶。然后,将匀浆以12000×离心gydF4y2BaggydF4y2Ba4°C保存15分钟。将上清液分离,作为酶提取液。加入1 ml酶提取物,1 ml可溶性淀粉(1%,w/v)或1 ml蒸馏水(对照),40℃孵育5 min。随后,将2 ml 3,5-二硝基水杨酸试剂(1% (w/v) 3,5-二硝基水杨酸和100 mM磷酸盐缓冲液(pH 7.0)加入混合物中,然后在沸水浴中加热。用分光光度计在540 nm处测定吸光度。酶活性表示为每分钟每毫克蛋白质催化产生1毫克还原糖的酶的量。gydF4y2Ba
以酪蛋白为底物,分光光度法测定蛋白酶(EC 3.4.21.40)活性。旗叶(约0.1克FW)在臼中研磨。匀浆在12000×离心gydF4y2BaggydF4y2Ba4°C孵育15 min,上清转移至试管中测定蛋白酶活性。将含有1ml酶提取物和1ml酪蛋白(2%)的反应混合物在40°C下加热10分钟。在40℃下加入三氯乙酸溶液(2ml 5%),反应20分钟。离心后(12000×gydF4y2BaggydF4y2Ba,10分钟),含有1ml上清液,5ml Na的反应混合物gydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba(0.5μm)和1ml叶啉试剂制备,然后在680nm处度上测量其吸光度。酸蛋白酶,中性蛋白酶和碱性蛋白酶缓冲溶液的孵育培养基的pH分别为3.6,7.5和11。通过根据标准曲线测量从水解蛋白释放的酪氨酸和其他芳族氨基酸来估计蛋白酶的活性。活性表示为每分钟释放的Nmol酪氨酸,每Mg蛋白质释放。gydF4y2Ba
谷物质量gydF4y2Ba
每块地在成熟时收获80根秆,人工脱粒。谷物在60°C的烘箱中烘干至恒重。然后称重,计数粒数,得到单粒质量。籽粒质量和粒数根据半穗确定。gydF4y2Ba
统计分析gydF4y2Ba
对获得的生理指标使用数据处理系统(DPS)软件进行统计分析(v.14.10, Refine Information Tech. Co., Ltd, Hangzhou, Zhejiang, China)。采用邓肯多极差检验评价结果的统计学意义。gydF4y2Ba
可用性数据和材料gydF4y2Ba
本研究过程中生成和分析的数据集和本研究中使用的植物材料可在合理要求的情况下由通讯作者提供。gydF4y2Ba
缩写gydF4y2Ba
- ACP:gydF4y2Ba
-
酸蛋白酶gydF4y2Ba
- 自动增益控制:gydF4y2Ba
-
自动增益控制gydF4y2Ba
- 正义与发展党:gydF4y2Ba
-
碱蛋白酶gydF4y2Ba
- BADH:gydF4y2Ba
-
甜菜碱醛脱氢酶gydF4y2Ba
- BP:gydF4y2Ba
-
生物过程gydF4y2Ba
- 猫:gydF4y2Ba
-
过氧化氢酶gydF4y2Ba
- CC:gydF4y2Ba
-
电池组件gydF4y2Ba
- 与原:gydF4y2Ba
-
cytokinins.gydF4y2Ba
- 大坝:gydF4y2Ba
-
操作后的日子gydF4y2Ba
- 部:gydF4y2Ba
-
差异表达的蛋白质gydF4y2Ba
- 达尔:gydF4y2Ba
-
Dehydroascorbate还原酶gydF4y2Ba
- DPS:gydF4y2Ba
-
数据处理系统gydF4y2Ba
- 德勤:gydF4y2Ba
-
dithiothreitol.gydF4y2Ba
- EDTA:gydF4y2Ba
-
乙二胺四乙酸gydF4y2Ba
- FD-Gogat:gydF4y2Ba
-
Ferredoxin-dependent谷氨酸合酶gydF4y2Ba
- 罗斯福:gydF4y2Ba
-
错误发现率gydF4y2Ba
- 呃:gydF4y2Ba
-
内质网gydF4y2Ba
- 艘渔船gydF4y2Ba/gydF4y2Ba调频gydF4y2Ba:gydF4y2Ba
-
最大PSII量子产额gydF4y2Ba
- GC:gydF4y2Ba
-
控制植物的谷物gydF4y2Ba
- GDEF:gydF4y2Ba
-
落叶植物中的谷物gydF4y2Ba
- GDG:gydF4y2Ba
-
植物中的谷物gydF4y2Ba
- HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba:gydF4y2Ba
-
过氧化氢gydF4y2Ba
- HPLC:gydF4y2Ba
-
高效液相色谱gydF4y2Ba
- 国际宇航科学院:gydF4y2Ba
-
Indoleacetic 3-acidgydF4y2Ba
- ITRAQ:gydF4y2Ba
-
用于相对和绝对定量的Isobaric标签gydF4y2Ba
- JA:gydF4y2Ba
-
茉莉酸gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因和基因组百科全书gydF4y2Ba
- LC:gydF4y2Ba
-
叶子在控制植物中gydF4y2Ba
- 数值模拟:gydF4y2Ba
-
落叶植物中的叶子gydF4y2Ba
- 爬下:gydF4y2Ba
-
脱粒植物中的叶子gydF4y2Ba
- MF:gydF4y2Ba
-
分子功能gydF4y2Ba
- 女士:gydF4y2Ba
-
质谱分析gydF4y2Ba
- 归一化植被指数:gydF4y2Ba
-
归一化植被差指数gydF4y2Ba
- NP:gydF4y2Ba
-
中性蛋白酶gydF4y2Ba
- OgydF4y2Ba2gydF4y2Ba·−gydF4y2Ba:gydF4y2Ba
-
超氧化物gydF4y2Ba
- PDI:gydF4y2Ba
-
蛋白质二硫化物异构酶gydF4y2Ba
- 圆荚体:gydF4y2Ba
-
过氧化物酶gydF4y2Ba
- PPI:gydF4y2Ba
-
蛋白质相互作用gydF4y2Ba
- 革命制度党:gydF4y2Ba
-
光化学反射率指数gydF4y2Ba
- SDS:gydF4y2Ba
-
十二烷基硫酸钠gydF4y2Ba
- 草皮:gydF4y2Ba
-
超氧化物歧化酶gydF4y2Ba
- SPAD:gydF4y2Ba
-
土壤和植物分析仪的开发gydF4y2Ba
- 茶巾:gydF4y2Ba
-
四乙铵溴化gydF4y2Ba
- ΦgydF4y2BaPSIIgydF4y2Ba:gydF4y2Ba
-
有效PSII量子产额gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Foulkes Mj,Slafer Ga,Davies Wj,Berry Pm,Sylvester-Bradley R,Martre P,Calderini Df,Griffiths S,Reynolds MP。提高小麦的产量潜力。III。在保持覆盖性的同时优化粒度的分区。J Exp Bot。2011; 62:469-86。gydF4y2Ba
- 2.gydF4y2Ba
雷诺兹议员Calderini DF小麦合成六倍体品系花前和花后籽粒重的变化(gydF4y2BaTriticum杜伦姆gydF4y2Ba×gydF4y2BaT. Tauschii.gydF4y2Ba).acta botanica sinica . 2000; 27:183-91。gydF4y2Ba
- 3.gydF4y2Ba
Calderini DF, Reynolds MP, Slafer GA。源库效应对不同产地面包小麦、硬粒小麦和小黑麦粒重的影响。澳洲农业研究2006;57:27 7 - 33。gydF4y2Ba
- 4.gydF4y2Ba
Kruk B, Calderini DF, Slafer GA。现代小麦和老小麦品种的源库比。中国农业科学。1997;128:273-81。gydF4y2Ba
- 5.gydF4y2Ba
张志强,王志强,王志强,等。光照条件下小麦生长发育和产量的预测。中国农业科学(英文版);2007;gydF4y2Ba
- 6.gydF4y2Ba
Borrásl,斯特比尔,otegui me。种子干重对小麦,玉米和大豆源水槽操纵的反应:定量重新评估。现场作物RES。2004; 86:131-46。gydF4y2Ba
- 7.gydF4y2Ba
Slafer Ga,Savin R.源水槽的关系和小麦穗内不同位置的谷物质量。现场作物RES。1994年; 37:39-49。gydF4y2Ba
- 8.gydF4y2Ba
小麦籽粒灌浆受籽粒灌浆能力的限制,而不受旗叶光合作用持续时间的限制gydF4y2Ba纳姆gydF4y2BaRNAi植物。《公共科学图书馆•综合》。2015;10 (8):e0134947。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0134947gydF4y2Ba.gydF4y2Ba
- 9.gydF4y2Ba
张tg,朱克。源水槽互动:在现代分子系统生物学之光下的一个世纪旧概念。J Exp Bot。2017; 68:4417-31。gydF4y2Ba
- 10。gydF4y2Ba
Jan S,Abbas N,Ashraf M,Ahmad P.潜在植物激素和转录因子控制叶片衰老和耐旱性的转录因素。原生质。2019; 256:313-29。gydF4y2Ba
- 11.gydF4y2Ba
杨杰,彭某,visperas rm,sanico al,zhu qs,gu sl。粮食填充图案和水稻植物根系中的细胞素含量。植物生长调节。2000; 30:261-70。gydF4y2Ba
- 12.gydF4y2Ba
Paul MJ,Foyer Ch。沉没对光合作用的调节。J Exp Bot。2001; 52:1383-400。gydF4y2Ba
- 13.gydF4y2Ba
托马斯H,ougham h.留在绿色的特质。J Exp Bot。2014; 65:3889-900。gydF4y2Ba
- 14.gydF4y2Ba
Karp Na,Huber W,Sadowski PG,Charles Pd,Hseter SV,Lilley Ks。解决ITRAQ定量的准确性和精确问题。Mol细胞蛋白质组学。2010; 9:1885-97。gydF4y2Ba
- 15.gydF4y2Ba
杨米,东杰,赵W,高X. ITAQ患有小麦籽粒发育早期蛋白质的特征。J蛋白质组。2016; 136:157-66。gydF4y2Ba
- 16.gydF4y2Ba
福特KL,Cassin A,Bacic A.小麦品种的定量蛋白质组学分析,不同的干旱胁迫耐受性。前植物SCI。2011; 2:44。gydF4y2Ba
- 17.gydF4y2Ba
Ma YZ,Mackown CT,Van Sanford Da。部分小穗去除和脱落对小麦品种籽粒生长脱落的差异效应。现场作物RES。1996年; 47:201-9。gydF4y2Ba
- 18.gydF4y2Ba
Serrago RA, Alzueta I, Savin R, Slafer GA。了解不同灌浆环境下小麦和大麦籽粒源库比对产量的响应。田间作物Res. 2013; 150:42-51。gydF4y2Ba
- 19.gydF4y2Ba
Cartelle J, Pedró A, Savin R, Slafer GA。地中海条件下老小麦和现代小麦的粒重对花后小穗修剪的响应。欧洲农业杂志2006;25:365-71。gydF4y2Ba
- 20。gydF4y2Ba
王志强,王志强,王志强,等。小麦灌浆过程中光氮分配的动态变化。植物杂志。2008;148:1707-20。gydF4y2Ba
- 21。gydF4y2Ba
杨杰,张建生“超级”粮食灌浆问题。J Exp Bot。2010; 61:1-5。gydF4y2Ba
- 22。gydF4y2Ba
Camargo AV, Mott R, Gardner KA, Mackay IJ, Corke F, Doonan JH, Kim JT, Bentley AR.确定小麦MAGIC定位群体衰老发病相关的物候模式。植物学报2016;7:1540。gydF4y2Ba
- 23.gydF4y2Ba
付军,黄振华,王志强,杨建军,张建华。开花前茎秆非结构性碳水化合物储备增强了水稻灌浆过程中弱势小穗的库强度。农田作物学报2011;123:170-82。gydF4y2Ba
- 24.gydF4y2Ba
陈梅,毛泽卡·阿,周丽,阿里娥,王铮,姜玲gydF4y2Ba拟南芥gydF4y2Ba.植物科学。2014;219:26-34。gydF4y2Ba
- 25.gydF4y2Ba
康G,Peng X,Wang L,Yang Y,Shao R,谢Y,MA D,Wang C,Guo T,朱Y。叶片叶片暂时淀粉代谢中叶片细胞的超微结构观察和临时淀粉代谢中的时间表达谱在第七次后的小麦。physiol platararum。2015; 153:12-29。gydF4y2Ba
- 26.gydF4y2Ba
孔拉,谢勇,胡丽,司建,王志强。过量施氮对小麦抗氧化能力和籽粒灌浆的影响。Sci众议员2017;7:43363。gydF4y2Ba
- 27.gydF4y2Ba
Lyu Ji,Baek Sh,Jung S,Chu H,Nam Hg,Kim J,Lim Po。通过表情方法的叶片衰老的高通量和计算研究。前植物SCI。2017; 8:250。gydF4y2Ba
- 28.gydF4y2Ba
Vicente R, Vergara-Díaz O, Medina S, Chairi F, Kefauver SC, Bort J, Serret MD, Aparicio N, Araus JL。硬粒小麦穗在水分胁迫下表现优于旗叶:基因表达和生理证据。Environ Exp Bot. 2018; 153:271-85。gydF4y2Ba
- 29.gydF4y2Ba
脱氢抗坏血酸还原酶对叶片生长发育和功能的影响。植物杂志。2006;142:775 - 87。gydF4y2Ba
- 30.gydF4y2Ba
Semwal VK,Khanna-Chopra R.繁殖水槽增强的干旱诱导小麦肥沃系列的衰老与其CMS线相比,抗氧化能力的损失有关。physiolmol biol植物。2018; 24:591-604。gydF4y2Ba
- 31。gydF4y2Ba
惠智,田凤方,王刚,王桂平,王伟。小麦突变体抗氧化防御系统参与延缓衰老gydF4y2Batasg1gydF4y2Ba.Plant Cell rep 2012; 31:1073-84。gydF4y2Ba
- 32。gydF4y2Ba
杨建军,张建华,王志强,朱启清,王伟。灌浆期水分胁迫下水稻籽粒激素变化。植物杂志。2001;127(1):315 - 23所示。gydF4y2Ba
- 33。gydF4y2Ba
杨建军,张建华。土壤干燥下的谷物灌浆。新植醇。2006;169:223-36。gydF4y2Ba
- 34。gydF4y2Ba
刘燕,梁红,吕旭,刘东,温旭,廖玉玲。干旱胁迫下多胺对小麦籽粒灌浆的影响。植物生理学报。2016;100:113-29。gydF4y2Ba
- 35。gydF4y2Ba
杨建军,张建辉,黄志林,王志强,朱启群,刘丽娟。水稻胚乳发育过程中胚乳和根系细胞分裂素水平与细胞数量和细胞分裂活性的相关性安Bot(伦敦)。2002; 90:369 - 77。gydF4y2Ba
- 36.gydF4y2Ba
AFZAL I,Basra SMA,IQBAL A.种子浸泡与植物生长调节剂对盐度胁迫下小麦幼苗活力的影响。j应激生理生物卫生。2005; 1:6-14。gydF4y2Ba
- 37.gydF4y2Ba
水稻相关衰老与籽粒成熟、源库关系及产量的调控(gydF4y2Ba奥雅萨苜蓿gydF4y2Bal .)。植物生长调节。1986; 4(3):239-45。gydF4y2Ba
- 38.gydF4y2Ba
Reguera M,Peleg Z,Abdel-Tawab YM,Tumimbang EB,Delatorre Ca,Blumwald E.应激诱发的细胞蛋白合成通过在水稻中的碳和氮同化的协调调节增加耐旱性。植物理性。2013; 163:1609-22。gydF4y2Ba
- 39.gydF4y2Ba
徐GW,张杰,林·赫姆,王紫q,杨杰。荷尔蒙的变化与在非淹水和覆盖条件下培养的水稻劣质粒细胞的贫困颗粒填充有关。现场裁剪。2007; 101:53-61。gydF4y2Ba
- 40.gydF4y2Ba
陈志强,王志强,王志强,等。玉米衰老相关基因的表达与内源激素的关系。J Exp Bot. 2005; 56:1117-28。gydF4y2Ba
- 41.gydF4y2Ba
杨杰,曹益,张鹤,刘立珍,张杰。多胺参与多胺在水稻中劣质和优质尖峰后发育的发生。Planta。2008; 228:137-49。gydF4y2Ba
- 42。gydF4y2Ba
张浩,谭国良,杨林宁,杨建军,张建华,赵炳辉。籼粳杂交稻劣穗和优穗花后发育与籽粒和根系激素的关系。植物生理与生物化学。2009;47:195-204。gydF4y2Ba
- 43。gydF4y2Ba
Dietrich JT, Kaminek M, Blevins DG, Reinbott TM, Morris RO。玉米籽粒发育过程中细胞分裂素和细胞分裂素氧化酶活性的变化及外源细胞分裂素对籽粒发育的影响植物生理生化。1995;33:327-36。gydF4y2Ba
- 44。gydF4y2Ba
杨东,李艳,史勇,崔智,罗勇,郑明,陈杰,李艳,尹勇,王志强。外源细胞分裂素对高温胁迫下冬小麦保持绿特性的影响。《公共科学图书馆•综合》。2016;11 (5):e0155437。gydF4y2Ba
- 45。gydF4y2Ba
关键词:水稻,大粒突变体,灌浆特性,内源激素引用本文:《公共科学图书馆•综合》。2016;11 (10):e0165321。gydF4y2Ba
- 46。gydF4y2Ba
Rijavec T,Kovaik M,Kladnik A,Chourey PS,Dermastia M. Cytokinins在玉米小型1种子突变体及其野生型中Cytokinins在Caryopsis发育中的作用的比较研究。J Intent Plant Biol。2009; 51:840-9。gydF4y2Ba
- 47.gydF4y2Ba
余思敏,罗顺福,何鸿燊。源-库通信:由激素、营养和应激交叉信号调节。植物生态学报。2015;20:844-57。gydF4y2Ba
- 48.gydF4y2Ba
Lu HS,Setter TL。玉米缺陷内核(DEK)的胚乳开发。突变体。生长素和细胞蛋白水平。安Bot(伦敦)。1993年; 72:1-6。gydF4y2Ba
- 49.gydF4y2Ba
Seth AK,徒劳的PE。激素导向的代谢物运输及其在植物衰老中的可能作用。J Exp Bot。1967年; 18:65-77。gydF4y2Ba
- 50。gydF4y2Ba
辛格g,gerung sb。荷尔蒙在无菌问题中的作用gydF4y2Ba奥雅萨苜蓿gydF4y2Ba.植物生理与生物化学。1982;9:22-3。gydF4y2Ba
- 51。gydF4y2Ba
杜y,风扇L,天c,吴T.染养蛋白积极地调节黄瓜叶中的氮气。Hortic Environ Biotechnol。2018; 59:189。gydF4y2Ba
- 52。gydF4y2Ba
孔林,郭华,孙敏。小麦籽粒发育过程中的信号转导。足底。2015;241:789 - 801。gydF4y2Ba
- 53。gydF4y2Ba
Wang Z, Wang Y, Hong X, Hu D, Liu C, Yang J, Li Y, Huang Y, Feng Y, Gong H, Li Y, Fang G, Tang H, Li Y. UDP-的功能失活gydF4y2BaNgydF4y2Ba- 乙酰甘氨酸甘氨酸焦磷酸化酶1(UAP1)诱导水稻早期叶片衰老和防御反应。J Exp Bot。2015; 66:973-87。gydF4y2Ba
- 54。gydF4y2Ba
以激素相关途径为靶点以提高水稻产量:化学方法。《公共科学图书馆•综合》。2015;10 (6):e0131213。gydF4y2Ba
- 55。gydF4y2Ba
Exposo-Rodriguez M,Laissue PP,Yvon-Durocher G,Smirnoff N,Mullineaux PM。光合作用依赖性hgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba从叶绿体转移到核提供高光信号传导机构。NAT Communce。2017; 8:4。gydF4y2Ba
- 56。gydF4y2Ba
王P,刘J,刘B, Da Q,冯D,苏J,王张Y,王J, HB。硫氧还蛋白还原酶:硫氧还蛋白还原酶是叶绿体正常发育所必需的,参与叶绿体基因表达的调控gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.摩尔。2014;7:1586 - 90。gydF4y2Ba
- 57。gydF4y2Ba
Geigenberger P, Thormählen I, Daloso DM, Fernie AR。植物科学(英文版)2017;gydF4y2Ba
- 58。gydF4y2Ba
Li H, Wang G, Liu S, An Q, Zheng Q, Li B, Li Z. early and正常衰老小麦近等基因系旗叶抗氧化系统的比较变化gydF4y2BaTriticum Aestivum.gydF4y2Bal .)。植物细胞代表2014;33:1109-20。gydF4y2Ba
- 59。gydF4y2Ba
Parihar P, Singh S, Singh R, Singh VP, Prasad SM。盐胁迫对植物的影响及其耐盐策略研究进展environment Sci Pollut R. 2015; 22:4056-75。gydF4y2Ba
- 60.gydF4y2Ba
HICKS LM,CAHOON RE,BONNER ER,RIVARD RS,谢菲尔德J,JEZ JM。基于硫醇的氧化还原活性谷氨酸 - 半胱氨酸酶的调节gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.植物细胞。2007;19:2653 - 61。gydF4y2Ba
- 61.gydF4y2Ba
刘晓霞,盖志,陶峰,唐华,徐平。类胡萝卜素在杂环化合物降解中的作用gydF4y2BaSphingobium yanoikuyaegydF4y2Ba.《公共科学图书馆•综合》。2012;7 (6):e39522。gydF4y2Ba
- 62.gydF4y2Ba
Golestan Hashemi FS, Ismail MR, rafi MY, Aslani F, Miah G, Muharam FM。关键的多功能作用gydF4y2Ba甜菜碱醛脱氢酶gydF4y2Ba基因在植物。Biotech Biotech Eq. 2018; 32:815-29。gydF4y2Ba
- 63.gydF4y2Ba
Maloney VJ,Park Jy,Unda F,Mansfield SD。蔗糖磷酸合成酶和蔗糖磷酸磷酸酶相互作用gydF4y2Ba在足底gydF4y2Ba促进植物生长和生物量积累。J Exp Bot. 2015; 66:4383-94。gydF4y2Ba
- 64.gydF4y2Ba
王东,刘华,翟国刚,王磊,邵杰,陶玉玲。gydF4y2BaOsptac2.gydF4y2Ba编码五戊肽重复蛋白并调节水稻叶绿体发育。J Genet Genom。2016; 43:601-8。gydF4y2Ba
- 65.gydF4y2Ba
拟南芥铜胺氧化酶基因家族4个成员的发育、激素和胁迫调控表达谱研究植物生理学。2020;147:141-60。gydF4y2Ba
- 66。gydF4y2Ba
Gallogly MM,Mieyal JJ。氧化还原信号传导和氧化应激的可逆蛋白谷胱甘肽化机制。Currop Pharmacol。2007; 7:381-91。gydF4y2Ba
- 67。gydF4y2Ba
Hayano T, Hirose M, Kikuchi M.蛋白二硫异构酶突变缺乏其异构酶活性加速细胞折叠。2月。1995;377:505-11。gydF4y2Ba
- 68。gydF4y2Ba
Kayum MA, Park JI, Nath UK, Saha G, Biswas MK, Kim HT, Nou IS。PDI家族基因的全基因组特征和表达谱揭示了大白菜对非生物和生物胁迫的耐受性(gydF4y2Ba芸苔属植物拉伯gydF4y2BaSSP。gydF4y2Bapekinensis.gydF4y2Ba).BMC基因组学。2017;18:885。gydF4y2Ba
- 69。gydF4y2Ba
LV Y,张某,王J,胡Y.使用异源串联标签标记的人工老化和引发期间的小麦种子定量蛋白质组学分析。Plos一个。2016; 11(9):E0162851。gydF4y2Ba
- 70.gydF4y2Ba
杨XB,孟WL,赵MJ,张斧,刘W,徐泽,王YP,MA J.蛋白质组学分析鉴定蛋白质蛋白和途径,鉴定蛋白质和途径与基于ITRAQ的策略的新型病变模拟突变体E40。int j mol sci。2019; 20:1294。gydF4y2Ba
- 71。gydF4y2Ba
Fazli是,Abdin MZ,贾马斯A,Ahmad S.硫和氮的互动效果对油脂作物显影种子的脂质积累,乙酰-Co浓度和乙酰-CoA羧化酶活性(gydF4y2Ba芸苔属植物compestrisgydF4y2Bal .,gydF4y2Ba毛虫的可能gydF4y2Ba磨。)。植物SCI。2005; 168:29-36。gydF4y2Ba
- 72。gydF4y2Ba
刘W,哈里森DK,Chalupska D,Gornicki P,O'Donnell CC,Adkins SW,Haselkorn R,Williams RR。羧基转移酶在体积乙酰基-CoA羧化酶的羧基转移域中的单位突变赋予基于草草特异性除草剂。PROC NATL ACAD SCI。2007; 104:3627-32。gydF4y2Ba
- 73。gydF4y2Ba
Kanwischer M,Porfirova S,Bergmüllere,达尔曼··本伊普酚环酚环化酶活性在拟南芥转基因和突变植物中的改变影响生育酚含量,生育酚组合物和氧化应激。植物理性。2005; 137:713-23。gydF4y2Ba
- 74。gydF4y2Ba
梁丹,高峰,倪志林,邓强,唐勇,王昕,罗昕,夏海霞。褪黑素促进猕猴桃幼苗抗氧化酶活性和谷胱甘肽s -转移酶的转录。分子。2018;23:584。gydF4y2Ba
- 75。gydF4y2Ba
赵杰,邱Z,阮b,康S,他,张某,等。推定光合电子受体融合素C2(FDC2)的功能失活诱导延迟标题日期并降低水稻的光合速率。Plos一个。2015; 10(11):E0143361。gydF4y2Ba
- 76。gydF4y2Ba
布坎安沃顿V,Earl S,哈里森E,Mathas E,Navabpour S,Page T,Pink D.叶片衰老的分子分析 - 基因组学方法。植物生物科技J. 2003; 1:3-22。gydF4y2Ba
- 77。gydF4y2Ba
Smith AM, Zeeman SC, Smith SM。淀粉降解。植物学报2005;56:73-98。gydF4y2Ba
- 78。gydF4y2Ba
Desclos M, Etienne P, Coquet L, Jouenne T, Bonnefoy J, Segura R, Reze S, Ourry A, Avice JC。一个组合gydF4y2Ba15gydF4y2Ban追踪/蛋白质组学研究gydF4y2Ba芸苔栗鸟gydF4y2Ba揭示了由硝酸盐限制或饥饿诱导的叶片衰老过程中与N再动员相关的蛋白质组学事件的时间序列。蛋白质组学。2009;9:3580 - 608。gydF4y2Ba
- 79。gydF4y2Ba
关键词:田间大麦,衰老,氮素转化,调控基因J Exp Bot. 2014; 65:3963-73。gydF4y2Ba
- 80.gydF4y2Ba
刘杰,吴永红,杨建军,刘亚东,沈芳芳。叶片衰老过程中蛋白质的降解和氮的再分配。acta botanica yunnanica(云南植物研究). 2008;51:11-9。gydF4y2Ba
- 81.gydF4y2Ba
王志强,李志强,李志强,等。结合转录组学和代谢组学分析了解向日葵叶片自然衰老。植物科学学报,2016;14:719-34gydF4y2Ba
- 82.gydF4y2Ba
Carrión CA, Costa ML, Martínez DE, Mohr C, Humbeck K, Guiamet JJ。gydF4y2Ba体内gydF4y2Ba半胱氨酸蛋白酶的抑制为烟草叶片暗诱导衰老过程中叶绿体蛋白降解中的“衰老相关液泡”的参与提供了证据。J Exp Bot. 2013; 64:4967-80。gydF4y2Ba
- 83.gydF4y2Ba
关键词:番茄,叶片衰老,半胱氨酸蛋白酶,基因工程,基因工程abstract:植物学报1996;30:755-67。gydF4y2Ba
- 84.gydF4y2Ba
李克,潘九,崔克,元M,胡Q,王W,Mohapatra PK,Nie L,Huang J,Peng S.卸载在开发谷物中的限制是负责低茎非结构碳水化合物易位的可能原因通过重组自交系验证米米籽粒产量形成差。前植物SCI。2017; 8:1369。gydF4y2Ba
- 85.gydF4y2Ba
关键词:烟草,叶片衰老,营养物质恢复,综合代谢组学,转录组学Sci众议员2017;7:12126。gydF4y2Ba
- 86.gydF4y2Ba
李Z,王F,林W,赵Q,刘继,程F.籽粒灌装阶段叶护套碳储备和在叶片早期衰老中的叶子鞘中的复发。acta physiol植物。2017; 39:10。gydF4y2Ba
- 87.gydF4y2Ba
Gregersen Pl,糖A,Boschian L,Krupinska K.植物衰老和作物生产力。植物mol biol。2013; 82:603-22。gydF4y2Ba
- 88.gydF4y2Ba
NoodénLD,GuiamétJJ,John I.衰老机制。physiol植物。1997年; 101:746-53。gydF4y2Ba
- 89.gydF4y2Ba
Roberts IN, Caputo C, Kade M, Criado MV, Barneix AJ。小麦灌浆过程中参与氮素再动员的枯草菌素样丝氨酸蛋白酶。植物学报。2011;33:1997-2001。gydF4y2Ba
- 90。gydF4y2Ba
孔L,王F,冯B,李S,Si J,张B.小麦暴露的花梗的结构和光合特性(gydF4y2BaTriticum Aestivum.gydF4y2Ba籽粒灌浆的重要光合产物来源。BMC Plant Biol. 2010;10:141。gydF4y2Ba
- 91。gydF4y2Ba
徐宁,董敏,杨勇,王勇,常勇,万军,朱伟,王军,刘伟。蓖麻毒素对人肺上皮细胞损伤机制的综合转录组学、蛋白质组学和代谢组学分析。体外毒性物质。2019;60:160-72。gydF4y2Ba
- 92.gydF4y2Ba
熊强,钟磊,沈涛,曹超,何华,陈旭。基于itraq的水稻缺氮响应及补偿效应的定量蛋白质组学和生理分析。BMC基因组学。2019;20:681。gydF4y2Ba
致谢gydF4y2Ba
感谢上海路明生物技术有限公司在蛋白质组学分析方面提供的技术支持。gydF4y2Ba
资金gydF4y2Ba
本工作得到了中国国家重点研发计划(2016YFD0300403,2017YFD03002),中国国家自然科学基金(31801282),山东现代农业技术和行业体系(SDAIT-01-06)和国家专门标准现代农业工业技术研究体系基金(Cars-3-1-21)。资金用于实验实施,采样,蛋白质组学分析和数据诠释。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
LK构思和设计了实验;XL和YZ进行了实验;YXZ和SF对数据进行了分析;XL和LK写了手稿。所有的作者阅读并批准了最终的手稿。LK同意作为作者负责联系并确保沟通。所有的作者阅读并批准了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
作者声明他们没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1gydF4y2Ba
与LC组比较,以及与GC组比较,LDG和LDef组比较,iTRAQ确定的dep的详细信息。GC:对照植株的谷物;GDef:落叶植物中的谷粒;GDG:脱粒植物中的颗粒;LC:对照植物的叶片;LDef:落叶植物的叶子;LDG:脱粒植物中的叶片gydF4y2Ba
附加文件2表S2。gydF4y2Ba
两种处理相关的DEP,并分为三个水平:生物过程(BP),细胞组分(CC)和分子功能(MF)gydF4y2Ba
附加文件3gydF4y2Ba
比较LDG/LC (A)、LDef/LC (B)、GDG/GC (C)和GDef/GC (D)的差异表达蛋白的相互作用网络。GDef:落叶植物中的谷粒;GDG:脱粒植物中的颗粒;LC:对照植物的叶片;LDef:落叶植物的叶子;LDG:脱粒植物中的叶片。圆形节点表示差异表达的蛋白质(基因),彩色矩形表示KEGG通路。采用Cytoscape软件进行PPI分析,当潜在PPI的置信得分较高时,用实线或虚线表示,阈值(confidence cutoff)设为400。两个蛋白质之间的实线表示数据库中注释的已知相互作用;蛋白质之间的虚线表示潜在的相互作用gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
吕雪梅,张玉英,张玉英。gydF4y2Baet al。gydF4y2Ba蛋白质组学分析表明,源库修饰影响小麦叶片衰老和籽粒质量。gydF4y2BaBMC植物杂志gydF4y2Ba20,gydF4y2Ba257(2020)。https://doi.org/10.1186/s12870-020-02447-8gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02447-8gydF4y2Ba
关键字gydF4y2Ba
- 落叶gydF4y2Ba
- Half-degraininggydF4y2Ba
- iTRAQgydF4y2Ba
- 叶子衰老gydF4y2Ba
- 光合作用gydF4y2Ba
- Triticum Aestivum.gydF4y2Ba