抽象的
背景
茶厂(茶树)是全球最受欢迎的非酒精饮料之一。在茶叶中,侧根(LRS)是负责土壤吸收水分和矿物质营养素的主要器官。横向根部形成和发育由氮气和养肝信号传导途径调节。为了了解蟾蜍蛋白和氮信令在LRS形成和发育中的作用,使用转录组分析来研究用吲哚-3-丁酸(IBA)处理的茶植物侧面侧面的差异表达基因,N-1-萘酞酸(NPA),低浓度和高浓度的氮。
结果
共鉴定出296个共同差异表达基因,并注释到4个信号通路,包括氮代谢、植物激素信号转导、谷胱甘肽代谢和转录因子。rna测序结果表明,大多数差异表达基因在氮代谢和激素信号转导中发挥重要作用。低氮条件诱导生长素的生物合成和转录本的积累,从而调控侧根的形成。此外,细胞分裂素的代谢和乙烯的生物合成也参与侧根的发育。转录因子等my基因还通过次级细胞壁生物合成造成茶叶植物的横向根。逆相超级性能液相色谱(RP-UPLC)结果表明,在侧面根中的氮水平下降增加,延长素浓度增加。因此,可以通过唾液生物合成和积累通过低氮浓度诱导茶树横向根部。
结论
本研究揭示了氮和生长素信号通路在茶树LRs形成中的相关机制,并在遗传水平上为茶树氮的有效利用提供了信息。
背景
植物探索土壤环境中水分和养分的能力高度依赖于其根系的结构[1那2].外侧根(LRS)具有高生理活性,并使植物适应各种营养,温度和土壤条件[3.那4.那5.].
横向根部形成受若干因素的影响,其中氮和生长素是突出因素。氮是合成大多数生物化合物如DNA,氨基酸,蛋白质和植物激素的关键组分[6.].植物根系可以吸收有机(氨基酸和多肽)和无机(硝酸盐和铵态氮)形式的氮[7.].侧根的可塑性对不同的氮素供给者很敏感[8.那9.].据报道,硝酸盐的过量施用可以抑制LRS发育,而降低的硝酸盐水平增强了LRS的生长[9.].相反,在Supra-Optimal N供应中可以抑制LRS增长[10.那11.].据报道,硝酸盐转运体基因(NRTs)与高亲和力NO有关3.−运输系统,反过来诱发LRS增长[12.].有趣的是,冈本等人(2003)发现nrt1.1.和NRT2.1用高水平的NO3.[13.].根据Remans等人。(2006),nrt1.1.能调节主根和侧根的生长;NRT2.1在NO的吸收中起主要作用3.−在Arabisopsis,并通过控制LRS形成来确定根体系结构[14].的ANR1(第一个3.−- 拟拟合拟南芥基因是第一个参与信号转导的鉴定基因,其与NO相关联3.,从而影响lr的发育[15].氨转运基因AtAmt1.1还发现在N-STARVATION下重组LRS架构时发挥着关键作用[16].Vidal等。(2010)鉴定了由悬垂受体助体素信号传导F型盒3(AFB3)和MicroRNA 393(miRNA 393)组成的被动前馈机制,这导致助长素3.−通路(12.].蟾蜍蛋白生物合成基因tar2.(色氨酸氨基转移酶相关2)还报告在低氮气条件下重新编程根系结构[17].因此,氮素供应与生长素的合成代谢具有很强的相关性。这些报道为进一步探讨氮代谢相关基因与植物LRs生长的调控关系提供了明确的基础。然而,这些研究大多集中在模型植物上拟南芥蒂利亚纳只有,很少包括木质植物。
植物激素信号参与各种植物生长和发育阶段,包括胚胎发生,种子萌发,营养生长,果实成熟和叶片衰老。因此,已广泛报道了对植物激素的探索及其在LRS生长和发展中的调节作用。研究报道,在原发性根系和激发LRS分子的激发之前,脱离酸(ABA)抑制LRS原始后的LRS发育[18].生长素通过刺激多种内源性和环境信号调节LRs的形成[19].细胞分裂素也影响初级和lr起始,器官分化。细胞分裂素在根形成中的作用是细胞分裂素与生长素比值的一个因素。高的细胞分裂素与生长素比值抑制根的形成,反之亦然[20.].Gibberellins与其他激素组合(ABA,乙烯和养肝剂)控制LRS形成[21].LRS形成的植物激素受累由复杂信号串扰控制。然而,LRS形成的激素受累的潜在分子机制仍然尚不清楚。
茶厂[茶树(L.)O. Kuntze]是全球最受欢迎的非酒精天然饮料之一。它是一种具有良好开发的LRS的常见常年木质植物。氮肥对茶叶的增加和质量至关重要。LRS是用于吸收土壤养分和水的茶厂的主要器官。因此,LRS开发对茶厂的产量和质量产生了直接影响。开发的LRS增加了茶厂对土壤氮的吸收能力。尚未探讨氮气与氮素关系对LRS形成的影响。由于这一点,该研究旨在在氮缺陷,氮毒性,IBA(吲哚-3-丁酸,根部发育增强)下,依附于在茶叶植物中形成LRS的差异表达基因,NPA(N−1-naphthylphthalamic酸,根部发育抑制)治疗。还研究了LRS表型变化的植物素,机制,其对茶叶植物中对不同氮浓度的反应。该研究还提出了LRS中的信号通路和氮气和养肝调节网络。
结果
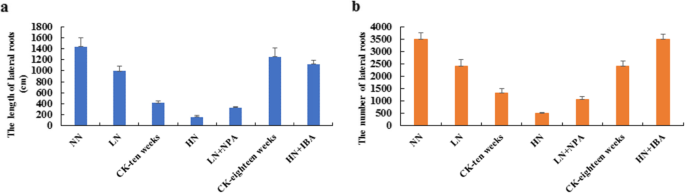
不同氮水平和生长素对茶树生长性能的影响
茶叶在水培培养中的各种氮气处理下呈正常留下生长。所有幼苗在10周后显示出变化的生长条件,导致N处理导致显着变化(图。1).幼苗的初级根部较薄,含有较低的氮处理。幼苗表现为绿色叶片,横向根长度缩短,并且随着N浓度的显着降低。用NN(无氮气),LN(低氮气)和HN(高氮)处理的幼苗上述部分短于对照(图。1).然而,随着氮浓度的增加,侧根的数量和长度显著减少(图。3.).这些结果表明,低氮浓度促进茶叶的形成和发育,而高氮浓度抑制LRS生长。此外,当用激素治疗幼苗时,LR的生长受到显着影响。的results showed that HN + IBA treatment (2.5 mM nitrogen for 10 weeks, and then cultured with 2.5 mM nitrogen + 10 μM IBA for 8 weeks) restored seedlings’ LRs development, and the number and length of LRs were increased after 8 weeks (Fig.2A,图。3.).与LN处理相比,LN + NPA处理(0.25 mM氮处理10周,然后0.25 mM氮+ 10 μM NPA培养4周)抑制并明显降低了幼苗LRs的发育。幼苗的叶子也呈现出褐色(如图。2C,图。3.).这表明外源性养羊酸可以避免茶叶中HN治疗抑制LRS生长。因此,由于HN处理抑制了养蛋白积累和生产,因此LRS生长将受到外源性疾病(IBA)的抑制。
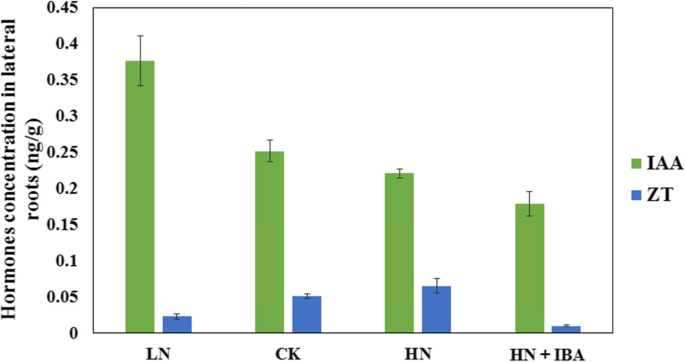
氮素和IBA供应对LRs中生长素和玉米素浓度的影响
经HN浓度处理后,LRs的生长素浓度显著降低(图2)。4.).这表明HN可以抑制生长素的产生,而低氮气可以诱导LRS中的养蛋白产生。它还表明,当外源性促进素浓度增加时,LR中的植物素浓度降低。扎因素浓度与LRS的氮浓度之间存在正相关性。因此,当用HN浓度处理幼苗时,LRS中的Zeepin浓度也增加。此外,高外源性助长浓度降低了LRS中的氮素浓度。
转录om数据分析
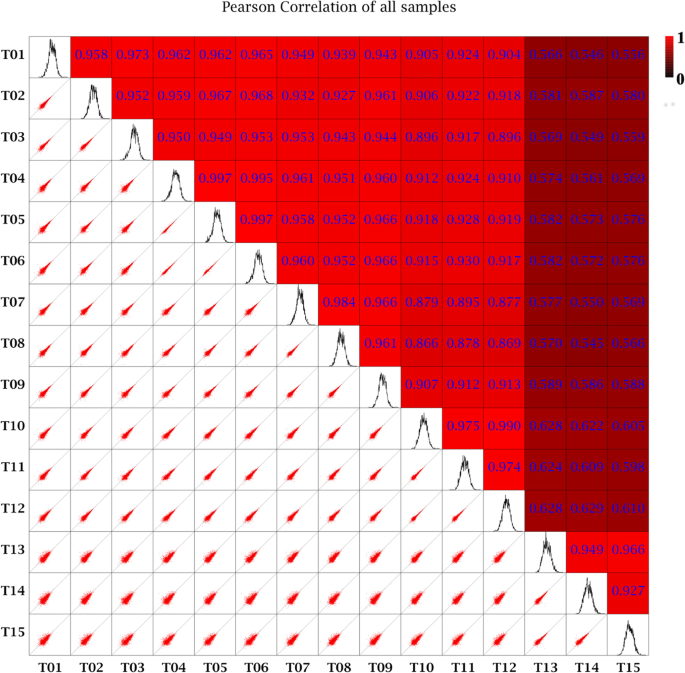
总共136.13 GB清洁数据,最低Q30为92.83%(表1).将每个样本的clean reads与指定的参考基因组进行序列比对,比对效率大于76.06%。所获得数据的样本相关系数显示,测序的吞吐量和质量足够高,可以进行进一步分析(图。5.).
茶叶LRs转录组的功能注释
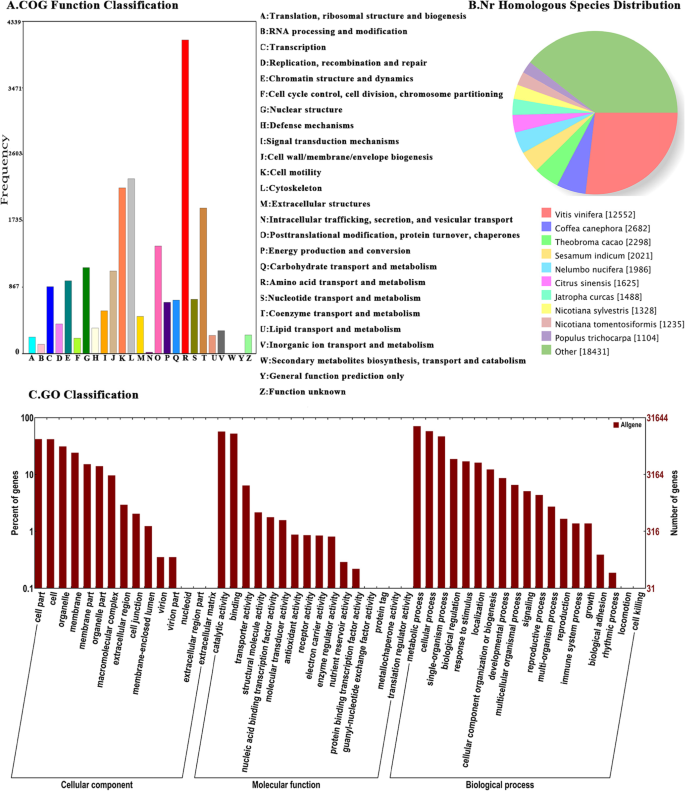
使用NR,NT,瑞士端口,KEGG,COG和GO数据库注释组装的unigenes。向NR数据库的注释显示,12,552个NR注释的未经人显示出高度的高度葡萄,这比其他物种更类似(图。6.).这些组合的基因与“代谢过程”有关,“单一有机体过程”和“细胞过程”代表了大多数GO分类。在细胞组分中,分别在细胞部分、细胞和细胞器中注释了13249、13180和9876条unigenes。在分子功能上,催化活性上注释的unigenes共17987个,结合作用上注释的unigenes共16499个。在生物过程中,代谢过程、细胞过程和单生物过程中分别注释了22,439、18,248和14,766个unigenes。COG功能分类分析也显示,大多数unigenes注释为“氨基酸运输和代谢”、细胞骨架和细胞运动。
差异表达基因GO和KEGG分析
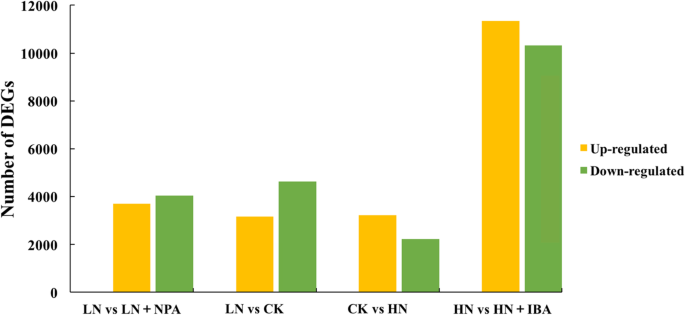
从LN和CK处理的幼苗的LRs中共鉴定出7784个DEGs,其中上调和下调的unigenes分别为3164和4622个。经HN处理的幼苗LRs中差异表达的ungene共5432个,其中上调的ungene 3216个,下调的ungene 2219个。此外,在NPA存在或不存在的情况下,LN处理幼苗的LRs中共获得7756个DEGs(上调3709个,下调4047个)。在IBA存在或不存在的情况下,HN处理幼苗之间的LRs中有21,671个DEGs,其中11338个和10333个表达上调和下调(表1)2,无花果。7.).
基于功能性注释,将两种文库(LN和CK,HN和CK,LN + NPA和LN,HN和HN + IBA)之间所识别的DEG分为三种基因本体(GO)类别:生物过程,分子功能和细胞组分。GO细胞成分分析表明,两种文库之间的次数涉及细胞,细胞部分和细胞器。分子函数分析显示,鉴定的大多数均参与催化活性,结合和转运蛋白活性。所识别的Degs导致代谢过程,细胞过程和单生体过程(图S1-4.).
在LN和CK处理之间的LRS鉴定的DEG中,将387℃分配给72 kegg途径。在这些途径中,参与碳水化合物代谢(76个基因)的次数是最丰富的,其次是翻译(65个基因)和“折叠,短路和降解”(42基因)(图S5.).在从HN和CK处理之间的幼苗的LRS鉴定的DEG中,分配了279只DE1GGG途径。其中,参与碳水化合物代谢(62个基因)的含量是最丰富的,其次是翻译(39个基因)和“折叠,短路和降解”(30个基因)(图S6.).此外,在存在或不存在NPA的情况下,总共499℃分配给在LN的LR的LR之间的116kegg途径。其中,101,60和42只分别参与了其他氨基酸的碳水化合物代谢的代谢,分别在氨基酸代谢中(图。7.).最后,在含或不含IBA的HN处理幼苗的132个KEGG通路中发现了1606个DEGs。这些deg中最多的是参与碳水化合物代谢(274个),其次是翻译(176个)、氨基酸代谢(176个)、脂类代谢(171个)和参与‘折叠、分类和降解’的171个deg(图S)8.).
与氮素和生长素处理相关的DEGs
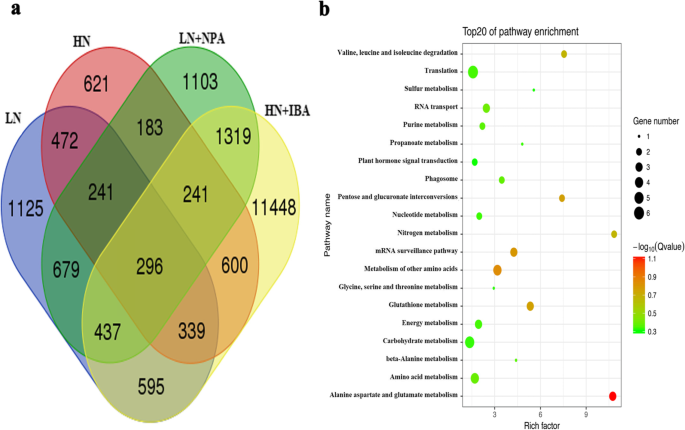
最后,从所有处理的幼苗的LRs中共鉴定出296个共同的DEGs(图1)。8.一种)。Kegg富集分析表明,这些基因涉及各种代谢途径。大多数DEG在氮代谢中注释,植物激素信号转导,谷胱甘肽代谢和翻译(图。8.b)。在氮代谢中,DEGS包括高亲和力硝酸盐转运蛋白(NRT.)基因,铵转运蛋白(amt.)基因(表3.)和NRT1 / PTR家族(NPF.)蛋白质基因(表S2).在植物激素信号转导中,生长素响应因子2 (ARF2.基因(表3.),辅助/ IAA那GH3.(吲哚-3-乙酸 - 氨基酰基合成酶)基因(表S2)在生长素代谢中鉴定出来。腺苷异戊烯基转移酶,细胞胆素蛋白羟基酶和细胞素蛋白脱氢酶基因涉及细胞蛋白代谢,而乙烯生物合成过程基因参与乙烯代谢(表3.,表2).在转录因子中,鉴定了编码p型R2R3 MYB蛋白(表3),MAD-BOX,NAC和WRKY系列的注释基因(表S2).谷胱甘肽S-transferases (消费税)调节谷胱甘肽代谢的基因(表S2)和参与F-box蛋白代谢的F-box/kelch基因在处理后的植物中也得到注释(表)3.).
差异表达基因的相对表达
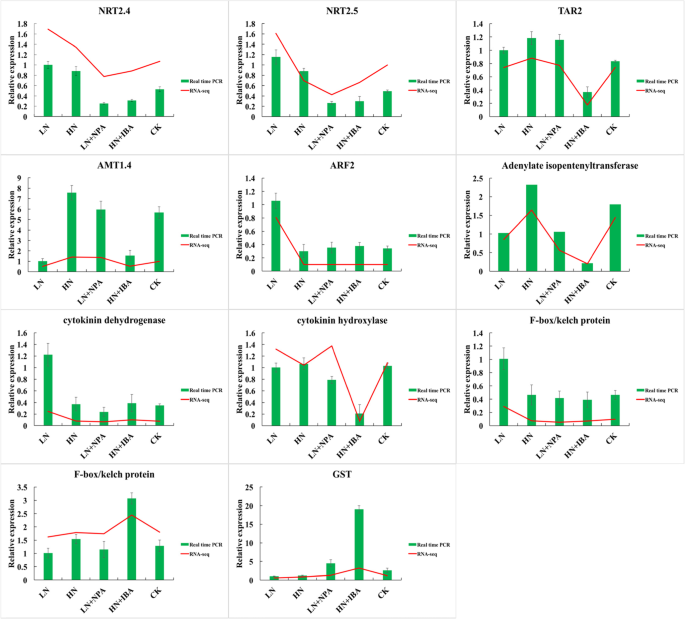
通过11个基因的qRT-PCR验证RNA-Seq数据的可靠性。这些基因参与调控氮和生长素信号通路。在这些基因中,有三个与氮代谢有关;一种与色氨酸转氨酶有关;一个与生长素反应因子有关;两种参与细胞分裂素的生物合成;两种与F-box/kelch蛋白有关;一种与谷胱甘肽代谢有关(表S1).基因表达分析显示,qRT-PCR结果与RNA-Seq分析结果一致,说明RNA-Seq数据可靠(图1)。9.).
讨论
氮代谢基因负责不同的氮水平和生长素
氮和生长素通过N信号显著影响LRs的发育,并调节ABA、GA和IAA等激素的生物合成和转运。在以往的研究中,氮缺乏诱导了高亲和力的硝酸盐转运体nrt1.1.那NRT2.1那NRT2.4和NRT2.5的根拟南芥蒂利亚纳植物 [22].还有报告说NRT2.1那NRT2.2那NRT2.4和NRT2.5可以协同授予适应低N病症的能力[23].nrt1.和nrt2.不仅是没有3.−运输,但也用于低氮气条件下的植金病运输。在低氮环境下,nrt1.和nrt2.通过诱导生长素的积累和转运来调控LRs的形成[24].同样,在这项研究中,两个常见的参数(CSA011051; MSTRG.51865)NRT2.4和NRT2.5在所有处理下的lr中都被发现。NRT2.4和NRT2.5LN和LN + NPA处理下幼苗的LRs分别上调和下调。推测缺氮可提高侧根生长素含量。因此,LN治疗可诱发NRT.S表达,从而增加了生长素的生产和积累,可以通过氮浓度和养肝剂处理来调节,从而有助于茶植物LRS形成。
养羊酸和氮信号可以控制LR发育。Arabidopsis1(TAA1)的色氨酸(TRP)氨基转移酶是一种重要的酶,其在TRP转化中起重要功能,进入吲哚-3-丙酮酸(IPYA),一种生长素生物合成途径(IPYAPATHWAY)[25].最近的研究表明,TAR调节植物的根和芽的发育:色氨酸转氨酶相关基因(tar1-4)参与IPyA途径[26],而色氨酸氨基转移酶相关2(tar2.)基因被N缺乏诱导,可改善生长素生物合成拟南芥蒂利亚纳,并提高lr发展中的IAA水平[27那28].tar2.在低氮气条件下涉及在LRS中的SUXIN在SUNIN和积累。在本研究中,在HN + IBA处理下,将一个色氨酸氨基转移酶相关的2基因(CSA015778)下调,表明LN治疗可以诱导tar2.生长素积累的表达。然而,在过量的外源生长素处理下,tar2.将被下调以平衡LRS毒素浓度。色氨酸氨基转移酶相关4(塔尔4.)基因在低氮条件下表达上调拟南芥蒂利亚纳[27].同样的,塔尔4.(CSA001598)在LN处理下表达上调。这表明,塔尔4.参与低氮条件下LRs的开发。氮素水平降低,幼苗生长素浓度增加。综上所述,低氮浓度可通过生长素的合成和积累诱导茶树LRs的形成。
拟南芥有六种AMT型铵转运蛋白,包括AMT1.1.来AMT1.5和AMT2.1[29].以往的报道表明,铵的供应可以诱导LRs的引发和分支拟南芥蒂利亚纳.这可能是由于铵通过与硝酸盐的互补反应调控LRs的形成,而该反应是以amt依赖的方式发生的[30.].阮等。(2016)据报道,氨水改善了茶树的硝酸盐,然而,目前的研究显示amt.基因表达与径向相反NRT.LN和HN + IBA治疗中的基因[31].在模型植物中鉴定的六种AMT型铵转运蛋白中拟南芥那AMT1.4在花粉中表达了[29然而,在本研究中,AMT1.4(CSA018499)在茶树侧根中表达。AMT1.4在LN和HN + IBA治疗下的LRS下调,并在LN + NPA治疗中调节。结果提示amt.基因在低氮气条件和唾液酸中进行下调,它们的表达可能抑制LRS形成。此外,表达分析NRT.那amt.和NPF.家族基因揭示了蟾蜍素和氮信号对LR发育的协同关系。这些基因有助于N利用效率探索,并为选择高氮效茶叶植物提供基因参考。这也可以有助于通过调节氮和养肝信号通路来探索LRS形成调节。
植物激素新陈代谢和信号通路
植物激素,养肝对于植物生长和开发过程至关重要,并主要通过诱导包括早期疾病响应基因的表达,包括辅助/ IAA那GH3.和阿富汗二月.GH3.将游离的生长素与不同的酸结合;因此,过度的GH3.会导致严重生长素缺陷表型的表达[32那33].在本研究中,一个GH3.LN + NPA处理下基因表达上调,LN + NPA处理下下调,HN + IBA处理下下调GH3.基因。此外,Aux / IAA蛋白通过与疾病响应因子(ARF)转录因子的异二聚化作用转录压缩机的作用,而ARF家族则作为根瘤的关键调节器[34那35].在较低的生长素浓度下,Aux/IAA蛋白可以抑制ARF蛋白的转录激活;从而阻止生长素反应基因的转录。但较高的生长素浓度可诱导东盟地区论坛基因表达,然后促进LRs发育[35].在LN处理下,奥克斯/ IAA蛋白基因(CSA031541,MSTRG.7473)进行了下调,而服型响应因子2(ARF2.)基因(CSA011327)上调。结果表明,在LN条件下,LRS的唾液浓度将增加,然后抑制辅助/ IAA基因表达和改善东盟地区论坛基因表达诱导LRS发育。此外,在Ln + NPA治疗下,ARF2.基因(CSA011327)下调,而ARF2.基因(CSA012843)在HN + IBA处理下上调。这一切;因此,表明低氮和生长素处理可改善东盟地区论坛表达和增强LRS形成。
细胞分裂素在植物增殖、细胞分裂、次生代谢和调控植物茎、根发育等方面具有重要作用[36].其他研究人员表明,一些氮气信号被细胞分裂素作为局部和长距离信号代替;因此,各种基因受这些植物激素调节,包括代谢,生长发育和营养吸收[37].据报道,据报道高细胞蛋白含量,以改善拍摄发育,而高毒素含量增强根部形成[38].因此,氮素、生长素和细胞分裂素在调控植物发育过程中存在重要的信号通路。本研究鉴定了参与细胞分裂素代谢的deg。LN处理下,诱导细胞分裂素生物合成的1个腺苷酸异戊烯基转移酶(CAS006753)基因下调,抑制细胞分裂素生物合成的2个细胞分裂素脱氢酶基因上调。LN + NPA处理下,细胞分裂素脱氢酶基因CAS011288表达下调,LN处理下CAS011288表达下调。在HN + IBA处理下,诱导细胞分裂素生物合成的细胞分裂素羟化酶基因(CAS017731)下调,7个细胞分裂素脱氢酶基因上调。RP-UPLC技术显示,细胞分裂素浓度随氮浓度的增加而增加,随生长素浓度的增加而降低。说明LN处理和生长素处理抑制了茶树细胞分裂素的合成,而高生长素处理诱导了LRs的形成。
乙烯与植物的生理和形态反应与氮缺乏症和硝酸盐转运蛋白相连nrt1.1.和NRT2.1对乙烯也敏感[39那40].当外界硝酸盐浓度较低时,NRT2.1诱导和促进乙烯生物合成和信号传导活动[41].养羊酸和乙烯信号传导途径显示植物生长和发育的具体调节,如根伸长率和根毛形成[42].研究还表明,乙烯可能刺激局部化毒素生物合成[43].在本研究中,乙烯的生物合成随氮处理水平的不同而不同。LN处理下乙烯生物合成基因表达上调,HN处理下乙烯生物合成基因表达下调。LN + NPA处理下3个乙烯生物合成基因表达下调,HN + IBA处理下14个基因表达上调。这一切;因此,LN处理可促进乙烯生物合成;从而促进生长素反应基因的表达和LRs的形成,而HN则下调乙烯生物合成;从而抑制lr的形成。通过比较HN + IBA和LN + NPA处理,发现生长素能促进乙烯的生物合成,促进LRs的形成。这些结果; therefore, clearly indicates that auxin and nitrogen could regulate tea plant LRs formation through ethylene biosynthesis pathway.
转录因素
转录因子(TFs)控制抗逆性基因的表达[44].许多TF家庭,如南汽那my那疯了和WRKY已被探讨[45],这些科可以调节细胞的分裂和扩张、侧根的发育和次级细胞壁的生物合成。几种转录因子已经在暴露于缺氮环境的植物中表达[46那47].
据报道,R2R3-MYB是最丰富的MYB蛋白。MYBs46/83可能是二级细胞壁生物合成的主要调控因子,而MYBs46/83可能是二级细胞壁生物合成的主要调控因子atmyb58特别激活木质素生物合成,如atmyb46[48].因此,MyBS表达将增厚二次细胞壁并抑制细胞分裂和伸长率[49那50].在本研究中,p型R2R3 MYB蛋白(MYB83)同源基因在LN和HN + IBA处理下表达下调,而在NPA处理下表达上调。说明LN处理具有抑制作用my基因表达和抑制次生细胞壁生物合成,从而调控根的发育。生长素处理也可作出类似的推论。这也证实了低氮条件下茶树LRs促进生长素积累的假说。
南汽转录因子对于植物生长而言是重要的,因为它们调节植物细胞分裂,侧根发育和二次细胞壁生物合成[51那52].一些南汽在直接影响LRS发育的过程中,基因已被鉴定为疾病信号通路中的关键和有效调控因子[53那54].在本研究中,7南汽DEG在治疗下表达;43南汽DEG在HN + IBA治疗下表达,大多数是上调的。同样地,会面南汽在LN + NPA处理下也有上调。与之前的报告一致,本研究;因此,揭示了这一点南汽氮处理和生长素处理可诱导调控茶树LRs形成的基因;但具体的信号通路仍需进一步探索。
Mads-Box TFS控制植物根,花卉和水果开发[55那56].以前的研究表明AGL21由n-剥夺诱导,植物蛋白也促进AGL21,而All21蛋白质与ANR1(AGL44)相互作用,以介导LRS开发[57那58].在本研究中,在LN处理下,12个疯狂箱蛋白基因下调。在HN + IBA治疗下,有19次。还,榴弹炮基因在LN + NPA处理下进行上调。因此,可以表明茶叶厂的疯子箱蛋白基因的表达可能与之不同拟南芥蒂利亚纳.
腕骨转录因子参与各种植物发育过程,如生物和非生物胁迫,种子萌发和休眠[59].WRKY TF是植物天生的免疫系统的主要球员。据报道BEET囊肿线虫调节腕骨TF基因表达,以增强根部发育拟南芥蒂利亚纳[60.].在先前的研究中,在n缺陷条件下诱导Wrky TF系列[61.].在目前的研究中,通过各种水平的氮气治疗诱导Wrky TF家族基因(表S.2).这表明腕带的TF家族基因可以通过助长信号传导显着诱导;因此,在各种氮气条件下参与氮代谢。它还可以推断出TFS在茶厂LRS形成中的氮气和养阴网络中起重要作用。它提供了探讨WRS在茶叶植物中的氮气和养肝信号通路途径探讨Wrky TF家族基因的参与。
谷胱甘肽新陈代谢
Kegg分析显示所有治疗中谷胱甘肽代谢的显着变化。GSH依赖性发育途径诱导和维持根部发育期间的细胞分裂,并调节养鑫运输和进化[61.那62.].谷胱甘肽也作为硫醇/二硫化物缓冲液。GSH通过活性氧氧化,GSSG通过谷胱甘肽还原酶还原,调节还原型GSH和氧化型GSSG之间的平衡[62.].外源GSSG在正常条件下不能诱导根系,但在生长素处理下可以促进根系发育[63.];因此,生长素和GSSG的互作对植物根系发育具有调控作用。有报道称,在生长素存在的情况下,GSH/GSSG的还原比例抑制侧根[64.].谷胱甘肽S-转移酶(GSTS)将GSH转化为GSSG,而谷胱甘肽还原酶(GR)诱导GSSG的降低[65.].在本研究中,有8个GST基因表达上调,12个GST基因表达下调。在HN条件下,14个GSTs基因表达下调,5个GSTs基因表达上调。IBA处理上调了5个谷胱甘肽还原酶基因和65个GSTs基因。最后,有37个GSTs基因在NPA处理下表达上调。氮素和生长素处理在茶树谷胱甘肽代谢中发现了许多DEGs,这两种处理都可以通过影响GSH/GSSG比值来调控LRs的形成;但具体的调节机制尚不明确,需要进一步研究。
F箱蛋白质
F-box蛋白是蛋白酶体途径的重要组成部分,参与细胞功能,如生长素受体(TIR1),它介导了F-box蛋白对生长素的转录反应[66.].许多研究表明,不定根的形成伴随着可溶性和不溶性碳水化合物的积累At1g23390显示与此类新陈代谢有关[67.那68.].当用IBA处理茶树时,一种F-box/kelch基因类似于AT1g23390被识别出来,这表明在不定名的根源发展中复杂的监管网络[64.].在目前的研究中,AT1g23390(CAS036587)由HN + IBA治疗上调,其均质基因受LN + NPA处理下调,但通过LN处理上调。它描绘了该基因可以通过氮处理诱导,其功能与根部发育中的生长素治疗类似。它还表明LN治疗可以诱导茶厂LRS中的养蛋白产生。因此,该基因的推定作用可能是通过茶叶植物中的N和毒素信号通路调节LRS形成。
结论
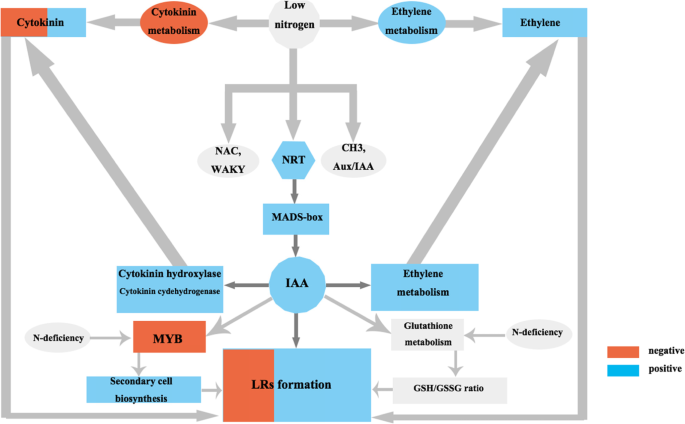
在本研究中,茶树(茶树)、吲哚-3-丁酸(IBA)处理N−1-naphthylphthalamic研究了生长素和氮在LRs形成和发育中的作用。氮素缺乏诱导表达NRT.因此,增加生长素的生产和积累,促进侧根的形成。在细胞分裂素合成过程中,缺氮抑制细胞分裂素的产生,生长素的积累和合成通过促进细胞分裂素羟化酶和细胞分裂素脱氢酶来控制细胞分裂素的产生,提高生长素/细胞分裂素比值,进而促进LRs的形成和发育。氮缺乏和生长素积累合成也通过促进乙烯代谢合成来调控侧根的生长发育。生长素和缺氮通过抑制次生细胞壁生物合成而抑制次生细胞壁生物合成my促进侧根发育的基因表达。生长素和缺氮也通过影响谷胱甘肽代谢而协同控制GSH/GSSG比值。TF家庭喜欢南汽那WRKY和疯盒子基因受氮气和生长素处理的影响,并且在早期的疾病响应基因中观察到类似的效果,包括辅助/ IAA和GH3.(图。10.).这项研究的结果对构建一个整体的调控网络具有重要意义,但需要额外的遗传和生理数据来实现这一点。本研究将为进一步研究茶树LRs的形成奠定基础,同时也将加快茶树基因组研究的进程。
方法
植物材料
纯种茶籽(茶树简历。福建省福建省联峰茶有限公司收集了福鼎大巴。在液体培养基中被表面灭菌和预先种植6周。生长培养基含有0.75毫米(NH4)2所以4., 0.25 mM Ca (NO3.)2•4(H.2O)3.,0.05 mm kh2阿宝4.,0.35 mm k2所以4., 0.395 mM2,0.21 mm mgso4.,35.0μmnafeedta,46.1μmh3.博3., 2.0 μM MnSO4.,0.3μmcuso4.,2.0μmznso4.和0.5μmna2摩尔摩4..基础氮营养液设4个梯度氮浓度水平,分别为0 mM(标记为无氮,NN)、0.25 mM(标记为低氮,LN)、1 mM(标记为对照,CK)和2.5 mM(标记为高氮,HN)。对照试验(1 mM)添加0.75 mM铵和0.25 mM硝酸铵4.)2所以4.和ca(没有3.)2•4(H.2O),其中N浓度组合对幼苗生长最有利。
在28/25℃(日/夜),75%相对湿度,16 / 8h(光/暗)光周期和300μmol中,幼苗在生长室中生长。−2年代−1光强度。每3-5天用相同的新鲜液体培养基取代生长培养基。治疗10周后,当幼苗生长LRS时,分别用高(2.5mm)和低(0.25mm)氮浓度的生长培养基分别含有0.4mm IBA和20μm的NPA。然后在24小时后,收获用0.25,1,2.5mM氮,2.5mM氮+ 0.4mM IBA和0.25mM氮+20μmNPA处理的LRS,并在液氮中冷冻以进行RNA提取。要从茶叶中获取LRS,分别将幼苗分别用0.25mm,1mm和2.5mm氮气处理10周,然后用2.5mm氮培养的茶叶用10μm的Iba进一步处理8周收获侧面根。最后,使用从收集的样品获得的四种LRS用于测量使用RP-UPLC检查和表型观察的激素。用0.25mm氮培养的茶幼苗再处理10μmnPa4周,仅用于表型观察。
侧根数和长度分析
每棵茶树的侧根都被砍下来,平铺在一个平板上。采用WinRHIZO根系分析系统(Regent Instruments, Inc., Canada)对茶树侧根进行扫描,记录每株茶树侧根的总数和长度。每个样品使用3个生物重复,每个测量重复3次。
RNA分离、文库构建和RNA测序
根据制造商的议定书,使用植物RNA提取试剂盒从植物RNA提取试剂盒中分离出总RNA从茶幼苗的LRS中分离出来。通过使用Nanodrop2000分光光度计(Thermo Fisher Sciencific,USA),1.2%琼脂糖凝胶电泳和Agilent 2100生物分析仪(Agilent Technologies,Inc.,Santa Clara,Ca,Ca,Ca,USA)测定RNA样品的数量和质量。使用Illumina Hiseq平台使用PE150使用PE150来用于图书馆施工和测序。构建和测序总共18个库。实验复制了三次。在GenBank登录号SRA号码SUB6669244下,所有测序数据都已沉积到NCBI的序列读取存档中。
测序数据分析
Raw reads were cleaned by removing adaptor sequence, ambiguous reads (‘N’>10%), and low-quality reads (i.e., where more than 50% of bases in a read had a quality value Q ≤ 5) using an in-house perl script. High-quality clean reads were mapped to the latest version (CAS institute of Botany, Kunming) of tea plant reference genome (http://www.plantkingdomgdb.com/tea_tree.)使用HISAT2软件[69.那70].
功能辅助和途径分析
本研究中获得的所有映射基因和未映射基因使用包括NR数据库()的公共数据库注释(http://www.ncbi.nlm.nih.gov/),瑞士 - prot数据库(http://www.expasy.ch/sprot),COG(http://www.ncbi.nlm.nih.gov/COG/)和pfam数据库(http://pfam.xfam.org/)使用BLASTX (http://blast.ncbi.nlm.nih.gov/blast.cgi.).使用Wego软件进行分析所有注释基因的基因本体(GO)功能分类[71.].Python脚本用于检索来自BLAST结果的基因和基因组(KEGG)注释的京都百科全书。使用单数富集分析(SEA)方法进行DEG的富集分析P. < 0.01 and FDR < 0.05 by agriGO. The hypergeometric Fisher exact test (P. < 0.01) and Benjamini (FDR < 0.05) were performed to detect statistically significant enrichments of KEGG pathway. GO and KEGG enrichment analyses were performed using the whole tea tree transcriptome setting as reference.
皮尔森相关分析
根据样本中基因表达量,计算样本之间的相关系数,确定样本相关性。在生物复制项目中,生物复制的成功是通过样品的相关性来评估的。采用Pearson相关系数R (Pearson相关系数)作为样本间相关性的评价指标[72.].“R”越接近1,两个样本之间的相关性越强。本研究对5个样本进行转录组分析,每个样本重复3次(T1-T15)。
差异表达分析
每百万千克读数(FPKM)方法的片段用于量化转录物的表达水平。DESEQ2包用于识别DEGS [73.].FDR≤0.01和log的绝对值2比值≥1为两个样本之间显著差异基因表达的阈值。
反相超高效液相色谱(RP-UPLC)分析
用甲醇萃取外侧根,用于养蛋白浓度测定。使用RP-UPLC分析提取的样品,下列条件:Hypersil ODS C18柱(250mm×4.0mm,5μm);甲醇和超纯水(0.5%冰醋酸)作为流动相和梯度洗脱;柱温35℃,注射体积为15μl,流速为1ml / min,检测波长为254nm。采用外部标准校准曲线法用于定量分析。对于标准制备和标准曲线结构,将标准IAA和ZT溶解在50%色谱甲醇中。峰面积(Y)用作质量(X,Nmol)的线性回归曲线,以获得回归方程,标准曲线和检测限的线性范围。浓度梯度为12.5,25,50,100和200ng / ml。每次测量都被复制三次。
定量RT-PCR(QRT-PCR)分析
总RNA提取采用DNase植物RNA提取试剂盒(TIANDZ公司,北京,中国),按照制造商的方案进行。2 μg总RNA用Prime Script RT Reagent Kit (Takara, Japan)合成第一链cDNA。使用Bio-Rad Real-time热循环仪CFX96和SYBR Premix ExTaq™试剂盒(Takara, Dalian, China)在96孔板上进行qRT-PCR反应。甘油醛-3-磷酸脱氢酶基因(GAPDH) 和肌动蛋白茶厂用作参考基因。使用2计算相对mRNA表达水平-ΔΔct方法 [74.].每个样品进行3个生物重复。使用Microsoft Excel 2016和Sigmaplot 13.0 (Systat Software, canada)进行统计分析。两个样本之间的差异使用学生t检验方法进行评估,P. < 0.05 was considered as significantly different in content. The qPCR primers of differentially expressed genes were designed using NCBI primer-BLAST (https://www.ncbi.nlm.nih.gov/tools/primer-blast/).本研究使用的基因及引物序列信息如表S所示1.
数据和材料的可用性
所有数据维持本研究中的结果都包含在本文中或其信息文件中。本研究期间生成的其他数据集可在相应作者(兴惠LI)的合理要求时获得。
缩写
- LRS:
-
横向根
- IBA:
-
indole-3-butyric酸
- NPA:
-
N-1-萘酞酸
- RP-UPLC:
-
反相超高效液相色谱法
- 神经网络:
-
没有氮
- LN:
-
低氮
- HN:
-
高氮
- nrts:
-
硝酸盐转运体基因
- AFB3:
-
AUXIN SIGNALING F-BOX 3
- tar2:
-
色氨酸氨基转移酶相关2
- 阿巴:
-
脱盐酸
- AMT:
-
铵转运蛋白
- ARF2:
-
助线响应因子2
- 消费税:
-
谷胱甘肽S转移酶
- Trp:
-
色氨酸
- Taa1:
-
Arabidopsis的色氨酸氨基转移酶1
- tar4:
-
色氨酸氨基转移酶相关4
- TFS:
-
转录因素
- 南京:
-
NAM,ATAF1 / 2和CUC2
参考
- 1。
霍奇,黄志强,黄志强,黄志强。植物根系生长、结构与功能。土壤植物。2009;321(1 - 2):153 - 87。
- 2.
Varney GT,Canny MJ。玉米植物成熟根系的水吸收率。新植物。1993年; 123(4):775-86。
- 3.
Seiler GJ。温度对向日葵幼苗初级和侧根生长的影响。Environ Exp Bot。1998年; 40(2):135-46。
- 4.
李HB,XIA M,WU P.磷缺乏胁迫对水稻侧向根生长和营养吸收的影响。Acta Bot Sin。2001; 43(11):1154-60。
- 5.
Khan Ma,Gemenet DC,Villordon A.根系系统架构和非生物应力耐受性:根和块茎作物中的当前知识。前植物SCI。2016; 7:1584。
- 6。
Crawford nm,forde bg。无机氮营养的分子与发育生物学。拟南芥书。2002; 1:E0011。
- 7。
Gruffman L,Jamtgard S,Nasholm T.植物氮气现状和有机和无机氮源的共生发生影响苏格兰松树幼苗的根起吸收。树生理。2014; 34(2):205-13。
- 8。
林基jp。陡峭,廉价和深:一种玉米根系系统优化水和N采集的意识式。安乐伦敦。2013; 112(2):347-57。
- 9。
关键词:拟南芥,盐胁迫,内胚层ABA信号通路,侧根沉默植物细胞。2013;25(1):324 - 41。
- 10。
郭毅,陈FJ,张FS,MI GH。从射击到根的植物素转运涉及横向根系生长对玉米局部硝酸盐供应的响应。植物SCI。2005; 169(5):894-900。
- 11.
张志强,张志强,张志强,等。营养缺乏条件下拟南芥根系的可塑性研究。植物杂志。2013;163(1):161 - 79。
- 12.
Vidal EA, Araus V, Lu C, Parry G, Green PJ, Coruzzi GM, Gutierrez RA。硝酸盐响应miR393/AFB3调节模块控制拟南芥根系结构。中国科学院院刊2010;107(9):4477-82。
- 13.
Okamoto M,Vidmar JJ,玻璃广告。拟南芥NRT1和NRT2基因家族的调节:对硝酸盐提供的反应。植物细胞生理。2003; 44(3):304-17。
- 14.
在拟南芥中,硝酸盐转运体NRT2.1在根系对氮素限制的综合形态和生理响应中的核心作用。植物杂志。2006;140(3):909 - 21所示。
- 15.
张·赫姆,Forde BG。一种拟南芥的疯子盒基因,控制营养引起的根系结构变化。科学。1998年; 279(5349):407-9。
- 16。
工程师CB, Kranz RG。AtAmt1.1叶片和根系的交互表达和根系构型的变化对氮饥饿的响应。植物杂志。2007;143(1):236 - 50。
- 17。
生长素介导的早期侧根起始细胞周期激活。植物细胞。2002;14(10):2339 - 51。
- 18。
De Smet I, Signora L, Beeckman T, Inze D, Foyer CH, Zhang HM。拟南芥侧根发育中的脱落酸敏感检查点。植物j . 2003; 33(3): 543 - 55。
- 19。
Lavenus J,Goh T,Roberts I,GuyoMarc'h S,Lucas M,De Smet I,Fukaki H,Beeckman T,Bennett M,Laplaze L.拟南芥的侧根发育:五十岁的养肝症。趋势植物SCI。2013; 18(8):455-63。
- 20.
Chandler JW,WERR W.细胞蛋白 - 蟾蜍串联串联规格。趋势植物SCI。2015; 20(5):291-300。
- 21.
Gou JQ,施特劳斯SH,Tsai CJ,Fang K,Chen Yr,Jiang XN,Busov VB。吉布林素通过与蟾蜍素和其他激素的相互作用调节杨树的横向根部形成。植物细胞。2010; 22(3):623-39。
- 22.
太阳Ch,Yu JQ,Hu DG。硝酸盐:侧面侧面发育过程中的重要信号。前植物SCI。2017; 8。
- 23.
拟南芥硝酸盐转运体NRT2.5在缺氮植物硝酸盐获取和转运中起重要作用。植物j . 2014; 80(2): 230 - 41。
- 24.
Krouk G,Lacombe B,Bielach A,Perrine-Walker F,Malinska K,Mounier E,Hoyerova K,Tillard P,Leon S,Ljung K,等。NRT1.1的硝酸盐调节的植物素运输定义了植物中营养感测的机制。DEV细胞。2010; 18(6):927-37。
- 25.
Stepanova An,Robertson-Hoyt J,Yun J,Benavente Lm,谢Dolezal K,Schlereth A,Jurgens G,Alonso JM。Taa1介导的养肝生物合成对于激素串扰和植物发育至关重要。细胞。2008; 133(1):177-91。
- 26.
何文瑞,Brumos J,李慧娟,季永山,柯明,龚晓强,曾清良,李文英,张学勇,安凤英,等。小分子筛选鉴定L-Kynurenine是拟南芥乙烯定向生长素生物合成和根生长中TAA1/TAR活性的竞争性抑制剂。植物细胞。2011;23(11):3944 - 60。
- 27.
赵yd。生长素生物合成:一种简单的两步途径将色氨酸转化为植物中的吲哚-3-乙酸。莫尔植物。2012; 5(2):334-8。
- 28.
Tao Y, Ferrer JL, Ljung K, Pojer F, Hong FX, Long JA, Li L, Moreno JE, Bowman ME, ivan LJ,等。通过新的色氨酸依赖途径快速合成生长素是植物避阴的必要条件。细胞。2008;133(1):164 - 76。
- 29.
4、拟南芥花粉质膜的高亲和铵转运体。植物生理学报。2009;50(1):13-25。
- 30。
铵对拟南芥侧根分枝的影响。植物细胞。2010;22(11):3621 - 33所示。
- 31。
阮湖,魏克,王丽,程h,张f,吴丽,白px,张cc。通过扫描离子选择性电极技术测量的茶叶(山茶花Sinensis)根中NH4 +和NO3-助条的特征。SCI Rep-UK。2016; 6。
- 32。
关键词:水稻,TLD1/OsGH3.13,吲哚-3-乙酸,结构调控,抗旱性植物杂志。2009;151(4):1889 - 901。
- 33。
泥炭Ts,瓶装c,纽曼j,朗讯d,牛森n,戴维斯c.吲哚-3-醋酸中的晶体结构来自植物稳态的葡萄葡萄树。植物细胞。2012; 24(11):4525-38。
- 34。
Ulmasov T,Murfett J,Hagen G,Guilfoyle TJ。Aux / IAA蛋白抑制了含有天然和高活性合成的植物响应元素的报告基因的表达。植物细胞。1997; 9(11):1963-71。
- 35。
Kumar R,Tyagi Ak,Sharma Ak。番茄中植物响应因子(ARF)基因家族的基因组分析及其在花卉果实开发中的作用分析。Mol Gen Genomics。2011; 285(3):245-60。
- 36.
Krouk G, Ruffel S, Gutierrez RA, Gojon A, Crawford NM, Coruzzil GM, Lacombe B.一种植物生长与激素和营养成分结合的框架。植物科学进展。2011;16(4):178-82。
- 37.
通过全基因组表达谱鉴定的拟南芥细胞分裂素即时早期和延迟响应基因揭示了新的细胞分裂素敏感过程,并提示细胞分裂素通过转录级联作用。植物j . 2005; 44(2): 314 - 33所示。
- 38.
Moubayidin L,Di Mambro R,Sabatini S. cytokinin-auxin-auxin串扰。趋势植物SCI。2009; 14(10):557-62。
- 39.
Schmelz EA, Alborn HT, Engelberth J, Tumlinson JH。缺氮增加了玉米挥发性物质的释放、茉莉酸的积累和乙烯的敏感性。植物杂志。2003;133(1):295 - 306。
- 40.
田Qy,Sun P,张WH。乙烯参与亚硝酸依赖性的根生长和拟南芥的分支。新植物。2009; 184(4):918-31。
- 41.
郑直流,汉X,y,gu hw,xia xl,yin wl。硝酸盐转运蛋白NRT2.1在乙烯反应中的亚硝酸盐缺乏症状的作用。植物细胞环境。2013; 36(7):1328-37。
- 42.
Muday GK, Rahman A, Binder BM。生长素与乙烯:合作还是竞争?植物科学进展,2012;17(4):181-95。
- 43.
乙烯通过影响生长素的合成和转运依赖性生长素的分配来调控根系生长。植物细胞。2007;19(7):2197 - 212。
- 44.
蔡光光,王国栋,王磊,潘建文,刘勇,李迪强。ZmMKK1是玉米中一个新的丝裂原活化蛋白激酶激酶基因,具有抗寒性,并参与转基因烟草的病原菌防御。植物科学。2014;214:57 - 73。
- 45.
Le Henanff G,Profizi C,Contexux B,Rabenoelina F,Gerard C,Clement C,Baillieul F,Cordelier S,Dhondt-Cordelier S.葡萄园NAC1转录因子作为发育过程,非生物胁迫和虚营养/生物营养素/生物营养素的收敛节点宽容。J Exp Bot。2013; 64(16):4877-93。
- 46.
彭ms,毕玉梅,朱涛,罗斯坦SJ。拟南芥对氮限制反应的全基因组分析及其泛素连接酶基因NLA的调控植物学报。2007;65(6):775-97。
- 47.
全晓燕,曾剑波,叶立忠,陈刚,韩志刚,沙建明,张桂平。两种西藏野生大麦基因型对低氮响应的转录组分析BMC Plant Biol. 2016;16。
- 48.
周俊,李晨,钟锐,叶振华。MYB58和MYB63是拟南芥次生细胞壁形成过程中木质素生物合成途径的转录激活子。植物细胞。2009;21(1):248 - 66。
- 49.
陈志强,陈志强,陈志强,等。miR858和MYB83在线虫寄生过程中的协同调控作用。植物杂志。2017;174(3):1897 - 912。
- 50.
钟雷克,李C,麦卡锡,RAE,琼斯,琼斯,耶和华。水稻和玉米NAC和MYB转录因子中次壁生物合成的转录激活。植物细胞生理。2011; 52(10):1856-71。
- 51.
Bollhoner B,Prestele J,Tuominen H. Xylem细胞死亡:新兴了解监管和功能。J Exp Bot。2012; 63(3):1081-94。
- 52。
NAC转录因子在植物非生物胁迫反应中的作用。acta optica sinica, 2012; 29(2): 349 - 354。
- 53。
谢Q,Frugis G,Colgan D,Chua NH。Arabidopsis NaC1在下游转化TIR1下游的毒素信号,以促进横向根部发育。基因开发。2000; 14(23):3024-36。
- 54。
何晓军,穆瑞林,曹文辉,张志刚,张建军,陈世英。AtNAC2是乙烯和生长素信号通路下游的转录因子,参与盐胁迫反应和侧根发育。植物j . 2005; 44(6): 903 - 16。
- 55。
GU Q,Ferrandiz C,Yanofsky MF,Martienssen R. Fruitfull Mads-Box基因在拟南芥果实开发期间介导细胞分化。发展。1998年; 125(8):1509-17。
- 56。
Ratcliffe OJ, Nadzan GC, Reuber TL, Riechmann JL。FLC同源物对拟南芥开花的调控。植物杂志。2001;126(1):122 - 32。
- 57。
于丽华,苗志强,齐发,吴杰,蔡新涛,毛建林,向世邦。MADS-box转录因子AGL21调控侧根的发育,并对多种外部和生理信号作出响应。摩尔。2014;(11):1653 - 69。
- 58。
孙晨,于建强,温立忠,郭玉华,孙旭,郝玉杰,胡德东,郑春生。菊花MADS-box转录因子CmANR1通过homo - /heterodimerization调控侧根发育,影响拟南芥生长素的积累。植物科学。2018;266:27-36。
- 59。
沈庆杰。WRKY转录因子。植物科学进展,2010;15(5):247-58。
- 60.
马志强,李志强,李志强。甜菜包囊线虫的研究进展异皮线虫属schachtii调节拟南芥合胞体中WRKY转录因子的表达以促进其在拟南芥根中的发育。《公共科学图书馆•综合》。2014;9:7。
- 61.
杨维兹,玉姬,崔H,风扇Y1,陈RM,大豆氮饥饿反应基因的转录组分析。BMC植物BIOL。2015; 15。
- 62.
Bashandy T,Guilleminot J,Vernoux T,Caparros-Ruiz D,Ljung K,Meyer Y,Reichheld JP。在拟南芥植物素信号传导中的NADP连接的硫蛋白和谷胱甘肽系统之间的相互作用。植物细胞。2010; 22(2):376-91。
- 63.
Tyburski J,Tretyn A.谷胱甘肽和谷胱甘肽二硫化物影响番茄幼苗切割中的不定根形成和生长。acta physiol植物。2010; 32(2):411-7。
- 64.
魏凯,王丽丽,程辉,张春成,马春林,张立强,龚文英,吴丽丽。吲哚-3-丁酸诱导茶树节段不定根形成的抑制消减杂交相关基因的鉴定。基因。2013;514(2):91 - 8。
- 65.
江鹤,刘MJ,陈IC,黄驰,赵丽,HSIEH HL。由光和激素调节的谷胱甘肽S-转移酶参与拟南芥幼苗发育的调节。植物理性。2010; 154(4):1646-58。
- 66.
拟南芥F-box蛋白TIR1是一种生长素受体。大自然。2005;435(7041):446 - 51。
- 67.
Ahkami AH, Lischewski S, Haensch KT, Porfirova S, Hofmann J, Rolletschek H, Melzer M, Franken P, house B, Druege U, et al.;矮牵牛花扦插不定根形成的分子生理:创伤反应和初级代谢的参与。新植醇。2009;181(3):613 - 25所示。
- 68.
Rapaka vk,faust je,dole jm,runkle es。内源性碳水化合物状况影响了对叶片衰老和颅骨切割中的叶片衰老和不定根形成的前列乙烯敏感性。Postharvest Biol Tec。2008; 48(2):272-82。
- 69.
夏娥,张赫勃,盛俊,李克,张QJ,金,张y,刘y,zhu t,li w等。茶树基因组在茶叶和咖啡因生物合成的独立演化中提供了见解。莫尔植物。2017; 10(6):866-77。
- 70。
Kim D,Landmead B,Salzberg SL。Hisat:一种快速拼接对齐器,内存要求低。NAT方法。2015; 12(4):357-U121。
- 71.
叶伙子,方禄,郑香港,张义,陈继,张宫,王家,李斯特,李雷克,博尔德L等。Wego:用于绘制GO注释的Web工具。核酸RES。2006; 34:W293-7。
- 72.
舒尔茨·斯特尔,坎瓦尔·斯特尔,高zenleuchter M, Therneau TM, Beutler AS。SERE: RNA-Seq的单参数质量控制和样品比较。BMC基因组学。2012;13:1-9。
- 73.
Anders S,Huber W.序列计数数据的差异表达分析。基因组Biol。2010; 11:10。
- 74.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(T)(−Delta Delta C)方法分析相对基因表达数据。方法。2001;25(4):402 - 8。
确认
不适用。
资金
国家现代农业产业技术研究体系专项资金(no . CARS-19);学生创新研究与创业训练计划资助项目(no . 201910307016Z);江苏省高校拔尖人才培养计划资助项目(no . PPZY2015B156)。关键词:农业产业技术体系,创新研究,创业训练资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有发挥作用。
作者信息
从属关系
贡献
SH, WX和XL构思了这项研究。SH, YY, MM进行了生物信息学数据分析。ZZ、EA、YC进行qPCR分析并参与序列比对。手稿由SH和XL撰写。QM, AJ, XC对手稿进行了严格的审查。所有作者阅读并批准了最终的手稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1图S1
.对照(CK)与低氮(LN)处理的DEGS分析。图S2.GO分析高氮(HN)和对照(CK)处理间的差异。图S3.低氮(LN)和LN + NPA治疗之间的DEGs分析。图S4.高氮(HN)和HN + IBA治疗之间的DEGS分析。图S5.对照(CK)和低氮(LN)处理间的DEGs的KEGG分析图S6.高氮(HN)处理与对照(CK)处理间差异的KEGG分析。图S7.低氮(LN)和LN + NPA治疗之间的DEGS的KEGG分析。图S8.Kegg分析高氮(HN)和HN + IBA治疗之间的DEG。
附加文件2表S1。
通过QRT-PCR验证基因的注释和引物。表S2a。与氮代谢,植物激素信号转导,谷胱甘肽代谢和转录因子(TFS)与氮素代谢,植物激素代谢和转录因子(TFS)相关,低氮(LN)。表开通。与氮代谢,植物激素信号转导,对照(CK)和高氮(HN)之间的植物激素信号转导,谷胱甘肽代谢和转录因子(TFS)有关。表S2c。与氮代谢,植物激素信号转导,谷胱甘肽代谢和转录因子(TFS)之间有关的DEGS与LN和LN + NPA之间的转录因子(TFS)。表S2d。与HN和HN + IBA之间的氮代谢、植物激素信号转导、谷胱甘肽代谢和转录因子(TFs)相关的DEGs。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
胡,S.,张,M.,杨,Y.et al。对茶叶侧根部形成氮气和养肝信号传导的新颖洞察力[茶树(L.)O. Kuntze].BMC植物杂志20.232(2020)。https://doi.org/10.1186/s12870-020-02448-7
已收到:
公认:
发表:
关键字
- 氮
- 生长素
- 横向根
- 信号通路
- 茶树