摘要
背景
低温是影响红枣生长发育的主要因素(Ziziphus jujuba在寒冷的冬天和春天。对于使枣树能够应对不同冰冻胁迫条件的分子机制,我们所知甚少。为了阐明与冰冻相关的分子机制,我们利用RNA-Seq对“东早”(低耐寒品种)和“金丝小早”(高耐寒品种)进行了转录组比较分析。
结果
在低温(4°C)和冷冻(- 10°C, - 20°C, - 30°C和- 40°C)胁迫下,两个品种之间检测到超过20,000个基因。5个处理的差异表达基因数分别为1831、2030、1993、1845和2137。功能富集分析表明,在较强的冷冻胁迫下,代谢途径、对刺激的反应和催化活性显著富集。在deg中,有9人参加了Ca2 +其中32个参与蔗糖代谢,另有32个参与ROS、植物激素和抗冻蛋白的调控。此外,重要的转录因子(WRKY,AP2/小块土地,南汽而且bZIP)在不同程度的冻结胁迫下均被激活。
结论
我们的研究首次在转录组水平上对冻结胁迫中的DEGs提供了更全面的理解z jujuba耐冻性不同的品种。这些结果有助于阐明红枣抗冻性的分子机制,并为基因增强红枣抗冻性提供新的思路和候选基因。
背景
低温作为一种非生物胁迫,每年不仅影响许多重要作物的地理分布,而且对作物的产量和品质也有负面影响[1,2].冷胁迫分为冷害(0 - 15°C)和冻害(< 0°C),对植物的生存和地理分布影响较大[3.].大量的植物种类生长在热带和亚热带地区,这些地区大多对寒冷敏感。然而,植物可以通过冷的驯化来提高它们的耐寒性[4,5].
在之前的研究中,研究人员揭示了冷暴露会导致生理和基因表达模式的各种变化,甚至发现了数千个基因对冷的反应是上调或下调的,包括碳水化合物的代谢、分子伴侣、抗冻蛋白、信号转导(受体激酶、蛋白激酶/磷酸酶、钙2 +结合蛋白)及调节蛋白[6,7,8,9,10].此外,转录因子可调节基因表达,在不利生长条件下提高产量[7,11].部分助教(WRKYs而且MYBs)参与植物的寒冷反应[12,13,14].过度的CBF基因增强了对冷胁迫的耐受性[15,16,17,18,19,20.,21,22,23的过度表达TaCBF基因可增强大麦抗冻性24].此外,过氧化氢(H2O2)、超氧阴离子(O2−),以及羟基自由基(HO·)[25,26,27,28,29,30.]因为ROS信号可以激活氧化还原反应蛋白,如蛋白激酶和转录因子,如MAPK级联[10],并激活ZAT12 [31].他等人。32]的研究发现,pesz1可以通过直接调控ROS的清除来提高抗冻性PeAPX2在胡杨.
大枣(Ziziphus jujuba是中国最重要的水果作物之一,也被引进到韩国、美国等许多国家[33].近年来,可能由于全球气温升高,极端寒冷天气等异常极端天气在全球范围内均有所增加[34,35].冷胁迫也严重阻碍了枣产业的发展;例如,当暴露在低温下时,水果的质量和产量会受到负面影响。就木本植物而言,研究多集中在生理生化因素方面,对其抗冻性的分子机制知之甚少[36,37].Saadati等人。[37]通过测定7个橄榄品种的生化和生理参数,分析了其抗冻性。Nui等。[38]发现了一些可能与抗冻性有关的候选基因碧桃通过高通量RNA测序。高通量RNA测序(RNA-seq)技术有助于在转录水平上全面分析基因功能和代谢途径。然而,目前尚不清楚枣的转录组如何应对冰冻胁迫,涉及不同抗冻性的重要基因也很少报道。我们发现,‘金丝小枣’的耐冻性比‘东枣’高得多,这为研究枣耐冻性机制提供了模型(图S .)1).因此,我们利用RNA-seq技术研究了两个品种在不同程度冷冻胁迫下的转录组差异。本研究为了解两个抗冻性不同品种在抗冻性下的分子调控提供了有用的信息,为进一步研究枣等木本植物的抗冻性提供了丰富的遗传资源。
结果
RNA-seq数据的质量分析和序列组装
采用Illumina High-Seq测序系统,提取枣枝条木质部总RNA构建表达文库进行测序。我们获得了30个图书馆的阅读量,每个图书馆大约有8900万阅读量。经过过滤,干净的阅读数在8700万~ 8800万之间,平均占所有图书馆总阅读数的97.47%(表2)1).所有样品Q30值均大于86%,GC含量为43%。基因组图谱率占73%以上,基因图谱率达到72.93 ~ 76.32%。在每个文库中检测到大约2万个基因的表达。此外,在DZD和JSD中检测到更多的新转录本。然后,关于替代剪接,每个样本都有类似数量的事件。其中,JSD评分最高,显著高于DZC。3个生物重复间Pearson相关系数较高(γ = 0.91 ~ 0.98)。
通过比较两个品种得到的DEGs
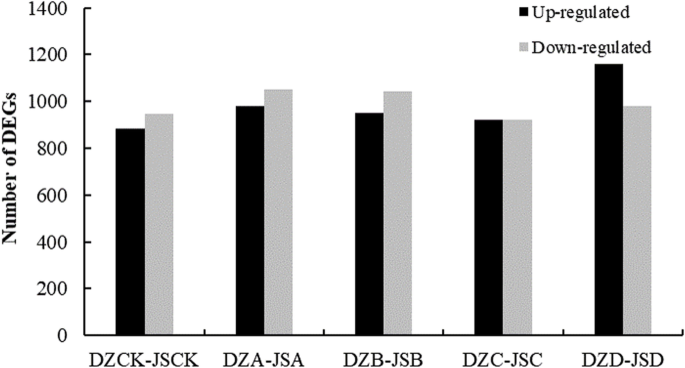
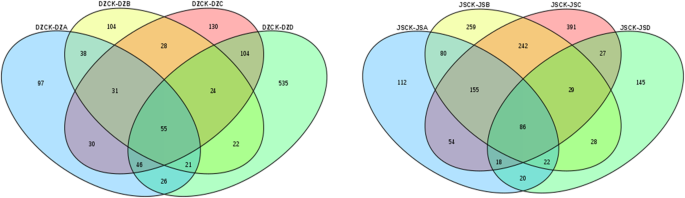
为了解不同品种对冰冻胁迫的响应差异,通过FPKM值进一步分析了‘东早’和‘金丝小早’在相同冰冻胁迫水平下的基因表达谱。详细的统计数据见附加文件2.我们通过比较“东藻”和“金丝小藻”来研究每种冷冻应力下的特异性DEGs。在4°C、−10°C、−20°C、−30°C和−40°C条件下,分别鉴定出1831个(885个上调基因和946个下调基因)、2030个(979个上调基因和1051个下调基因)、1993个(949个上调基因和1044个下调基因)、1845个(923个上调基因和922个下调基因)和2137个(1158个上调基因和979个下调基因)deg,表明这些基因对冰冻和抗寒性的响应性(图)。1和附加文件3.).
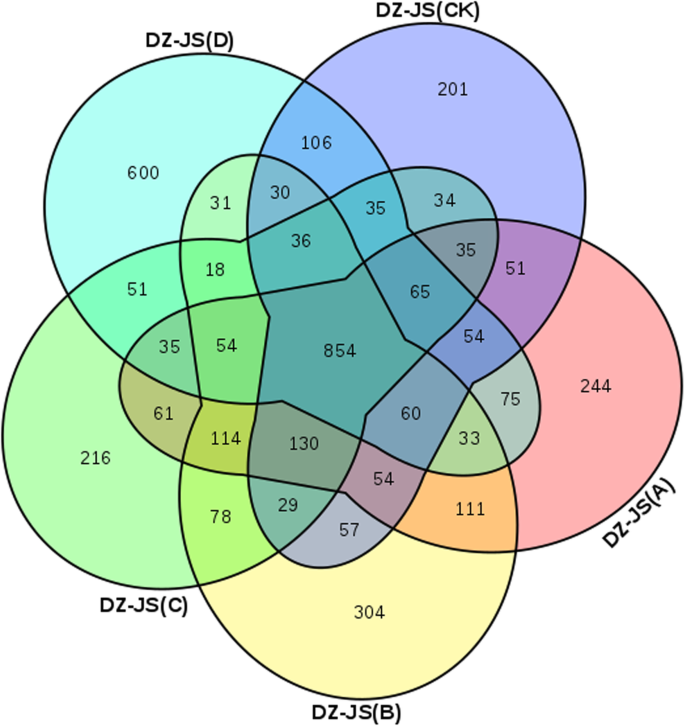
在五种不同程度的冷应力下,如图。2在两个品种中共检测到854个常见的DEGs,这可能表明这些DEGs在不同低温条件下参与了低温处理过程,并且参与了相同的冰冻胁迫响应途径。此外,在−40℃时,独特的DEGs数量(600)显著高于其他组,表明这些基因可能与“东造”和“金丝小造”的耐寒性差异有关。
本研究采用分枝总RNA进行qRT-PCR验证。如图S所示2, 6个deg在qRT-PCR数据与RNA-seq结果之间表达模式相似,说明RNA-seq数据具有较高的可靠性,可用于进一步分析。
DEGs的功能标注及富集分析
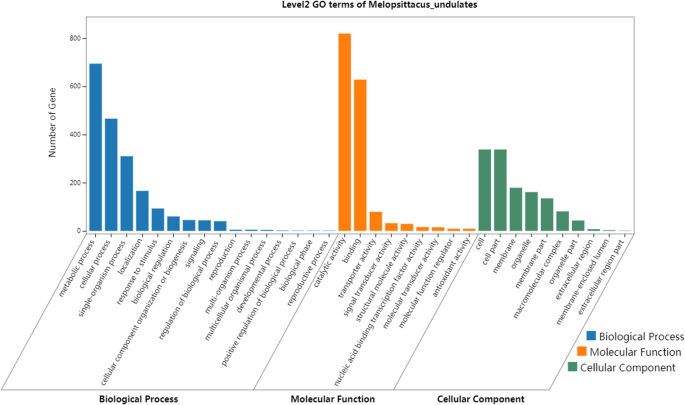
为了了解两个品种之间所发现的DEGs的功能,将所有的DEGs在蛋白质数据库中进行检索,然后通过基因本体(GO)分析来评估这些基因的假定功能。各处理GO项中,冻结应力越强,DEGs的比例越大,代谢过程被修饰和改变的越多(图。3.).在五组的比较分析中,这些GO术语的deg分为“代谢过程”、“细胞过程”和“刺激反应”;细胞成分中的“细胞”、“细胞部分”和“膜”;分子功能中的“催化活性”,“结合”,“转运蛋白活性”。
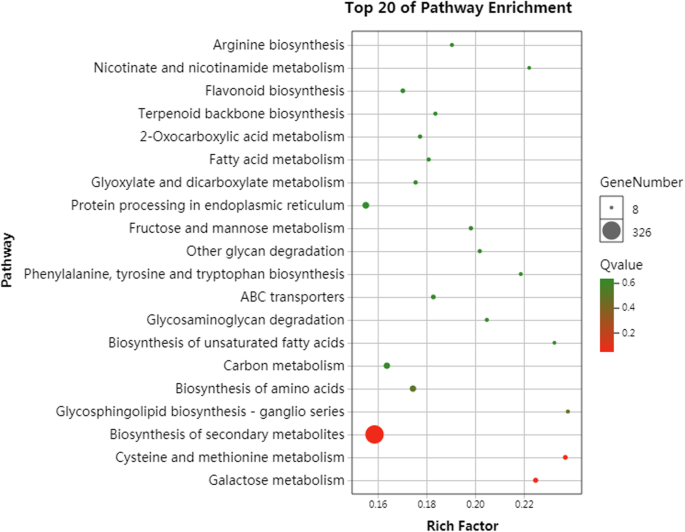
此外,为了阐明冰冻胁迫所涉及的代谢途径,在这两个品种中,20种常见的代谢过程在五种冰冻处理中最为丰富(图2)。4).其中,碳水化合物代谢途径、半乳糖代谢途径、果糖代谢途径和甘露糖代谢途径与许多上调/下调基因相关。此外,在五组的比较中,“金丝小枣”在较强的冰冻胁迫下存在一些途径的富集,如代谢途径的过氧化物,仅在−30℃时显著富集,ABC转运蛋白过程在−40℃时富集。综上所述,许多不同代谢途径的基因参与了红枣冰冻胁迫的调控,进一步研究这些途径的差异表达模式对揭示红枣抗寒性具有重要意义。
为了进一步分析极端温度下红枣的差异,我们对−30°C和−40°C的两个品种进行了比较分析。相比之下,我们发现在更强的冻结应力下,DEGs的含量更显著。过氧化物酶体途径在DZC和JSC中富集,ABC转运体途径在DZD和JSD中富集。此外,107,430,353,注释到WRKY在较低的温度下,家族发生了显著变化。在ABC家族中,一些成员(如107,429,561,107,408,533,107,404,223,107,414,655和107,416,457)同时表现出显著的上调。在强冻结胁迫下,与激酶活性和碳水化合物代谢相关的DEGs的比例也比弱冻结胁迫下增加。
“东枣”与“金丝小枣”不同冻结应力程度的比较分析
为了解不同程度冷冻胁迫对红枣的不同影响,我们还比较了“东枣”和“金丝小枣”的4种冷冻胁迫。在“东藻”中,使用DZCK作为对照,在不同程度的冻结应力下鉴定出1291个deg,尽管在所有冻结应力下仅鉴定出55个常见的deg(图3)。5,图S3.和附加文件4).然后对这些DEGs进行进一步筛选,筛选出327个显著DEGs (PPEE< 0.05, |Log2|≥1)。在这些显著的差异基因中,部分基因与Ca有关2 +信号通路,包括上调基因(107413690)和下调基因(107,404,917,107,423,107,107,425,924,107,417,689,107,4211,107,107,4222,102,107,430,853和107,424,939)。在这四组中,部分与蔗糖代谢相关的DEGs被划分为生物过程,其中上调的有7个,下调的有25个。此外,在转录因子方面,通过对DEGs的分析,我们发现这些基因属于南汽,WRKY,MYB,AP2/小块土地而且bHLH所有家庭都表现出显著的上调或下调。与葡萄同源的基因(107424282)MYB转录因子在低温胁迫下显著下调,可能负向调控了枣树的抗寒性。此外,南汽转录因子(107435293)在−30℃时具有更高的倍数变化,表明该转录因子可能调控了枣树在冰冻胁迫下的抗寒性。
在“金丝小造”四组比较中,以JSCK为对照,共鉴定出1668个deg(图。5,图S4和附加文件5),所有比较中均存在86种常见的deg。然后重点分析显着的DEGs (PPEE< 0.05, |Log2|≥1)。在−10°C下共鉴定出71个显著的deg, 39个基因上调,32个基因下调。在−20°C的条件下,鉴定出108个deg,包括31个上调基因和77个下调基因。−30℃时,随着温度的降低,31个基因上调,70个基因下调。在−40°C时,只有43个基因有较大变化。与“东早”的结果相似,“金丝小早”也注释了许多与非生物胁迫相关的基因,如蔗糖代谢和Ca2 +信号通路。有趣的是,在这些DEGs中,“金丝小造”的107,422102在−10℃时显著下调,而“东造”的107,422102在−40℃时才发生变化。这一发现可能是由于两个品种对冰冻胁迫的调节机制不同,从而反映出不同的抗寒性。
与冰冻胁迫相关的关键转录因子
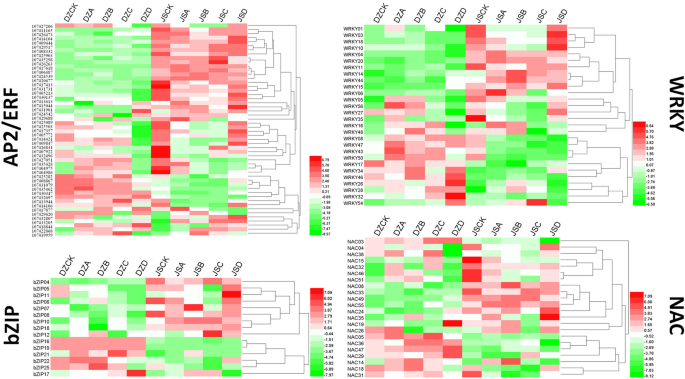
在本研究中,我们进一步分析了关键转录因子(AP2/小块土地,WRKY,南汽而且bZIP),据报道,它们与冻结压力有关。这些基因的所有FPKM值都列在附加文件中6.在所有图书馆中,我们一共发现了28个WRKY成员,52岁AP2/小块土地成员,22南汽成员及15名bZIP两个栽培品种的成员(图;6).比较所鉴定的两个品种间这些性状的表达WRKY成员;有的在“东造”中高度表达,有的在“金丝小造”中高度表达。的表达水平WRKY04(107417519),WRKY11(107414569)WRKY20(107419756)“金丝小造”与“东造”完全不同。在AP2 /小块土地吉恩家族,52个成员AP2/小块土地在低温胁迫下,‘东早’的107、418、844、107、4328、807和107、4228、868个成员在低温胁迫下上调,而在低温胁迫下‘金丝小早’开始发生变化。在这方面南汽而且bZIP,NAC19在DZD中表达量高于其他样品,而在‘金丝小造’中,5种温度下表达量均高于其他样品;bZIP成员通常分为两个表达式模式。这些转录因子在两个品种间的表达差异表明,转录因子可能在红枣对不同冷冻胁迫的响应中发挥重要作用。
枣的表达谱AP2/小块土地,WRKY,bZIP而且南汽两个栽培品种的基因。DZCK, 4℃处理的‘东藻’;DZA:−10°C处理的‘东藻’;DZB: - 20°C处理的‘东藻’;DZC: - 30°C处理的‘东藻’;DZD: - 40°C处理的‘东藻’;JSCK: 4℃处理的‘金丝小枣’;JSA: - 10°C处理的‘金丝小枣’;JSB:−20°C处理的‘金丝小枣’;JSC:经- 30°C处理的‘金丝小枣’; JSD: ‘Jinsixiaozao’ treated at − 40 °C.Data were normalized based on the mean expression value of each gene in all samples analysed. Red and green boxes indicate high and low expression levels, respectively, for each gene
半乳糖代谢途径中的关键DEGs
水苏糖的积累在植物抗低温胁迫中起着重要作用,α-半乳糖苷酶在水苏糖的分解过程中起着重要作用。在五组比较中,各温度条件下半乳糖代谢通路均显著富集。因此,我们进一步鉴定了参与半乳糖代谢的DEGs。在半乳糖代谢过程中,与半乳糖、水苏糖、棉子糖和蔗糖通路相关的基因在应对冰冻胁迫方面表现出显著差异。如表S所示2在这些基因中,107,411,641是udp -半乳糖过程中的关键基因,在较强的冰冻胁迫下,该基因显著上调,会增强水苏糖的合成途径。但是,在水苏糖分解成半乳糖和棉子糖的途径中,基因(107,425,264,107,430,302,107,414,011和107,428,511)的FPKM值降低,水苏糖分解降低(图S .)5).
讨论
近年来,极端天气频繁发生,气候的变化影响了枣树的生长发育,甚至造成枣树死亡。据报道,许多植物物种对冷胁迫有多种反应,反映在转录或代谢的变化上[39].近年来,植物冷信号的感知和转导研究取得了重大进展;然而,我们仍远未完全了解植物冷信号感知和转导的分子机制[40,41,42].在我们的研究中,我们报道了“金丝小早”和“东早”之间的转录组谱的比较,以确定与抗冻有关的基因。我们首先对枣中重要代谢途径和转录因子的变化进行了更全面的分析。本研究也可为其他木本植物提供参考,为今后枣树抗寒性改良品种的选育提供参考。
两个栽培品种DEGs的鉴定
在两个品种中,研究了一些DEGs,并在30个枣分支文库中鉴定了数百个冷冻相关基因(在“东枣”和“金丝小枣”中约有8700万个reads)。在不同冰冻胁迫条件下,在‘东早’中差异表达了362个显著表达基因(其中‘金丝小早’中有323个)。与对照组相比,大多数显著的DEGs下调。这一结果与Kou等人相似。[43],这表明不同品种对抗寒性的反应相似。然而,这一发现与Niu等人的研究结果不同[38在…学习碧桃具有抗冻性,其中上调基因数量大于下调基因数量。比较了“东藻”和“金丝小藻”的GO分类,丰富了“催化活性”、“代谢过程”、“细胞部分”和“结合”等功能类别。KEGG通路分析表明,植物激素信号转导通路、代谢通路、核糖体通路和次生代谢通路是主要富集通路。通过对两个对照枣品种的综合分析,进一步鉴定了更多与冷冻胁迫相关的重要deg,有助于进一步理解z jujuba.
冰冻胁迫下的生理反应相关基因
一些研究表明,在这些条件下,植物可以通过合成大量的保护性物质和蛋白质来提高它们的耐受性[44,45,46,47].棉子糖家族低聚糖(RFOs)是植物特有的一类功能性低聚糖,主要有棉子糖、水苏糖和毛蕊糖。有研究发现RFO可以提高植物应对逆境的能力[46,48].RFOs积累得越多,植物暴露在低温下的能力就越强。半乳糖及相关酶参与RFO代谢途径[48].在我们的研究中,半乳糖代谢显著富集,该通路相关基因上调或下调以应对冷应激。其中,“金丝小枣”在较强的冷冻处理下,107426117(水苏糖合成酶)、107415484(棉子糖合成酶)和107411641(肌醇3- α -半乳糖转移酶)基因表达显著上调,而在较弱的冷冻胁迫下,部分基因表达不显著上调。这一发现可能表明,这些基因在半乳糖代谢中发挥着更重要的作用,以应对寒冷,特别是在更强的冰冻压力下。此外,胚胎发生后期丰富蛋白(LEA)可以响应低温和干旱等非生物胁迫[49].在我们的研究中,上调LEA“Gene(107409127)”表示LEA基因与“金丝小造”(- 40°C)的耐寒性有关。LEA蛋白在本研究中的作用作为冷冻反应的调控机制,还有待进一步研究。
冰冻胁迫下冷信号转导相关基因的研究
已知信号转导通路在冰冻胁迫响应中起着至关重要的作用;其中,Ca2 +是植物中重要的第二信使2,50].富集钙2 +信号通路基因在与冰冻胁迫响应相关的信号通路中发挥关键作用[38].在我们的研究中,有34个deg被鉴定为与钙结合蛋白、钙调蛋白和钙相关2 +信号。其中,基因107413690在‘东早’中表达显著上调,说明这些基因在枣树抗冻胁迫中发挥着重要作用,其功能有待进一步研究。
除了Ca2 +, ROS也发挥重要作用[51].一方面,它们诱导基因表达和蛋白质合成,以保护细胞免受压力;另一方面,它们会诱导氧化应激[52,53].ROS还可以直接刺激激活应激相关通路的基因表达,如MAPK级联通路、激素信号通路和钙信号通路。在我们的研究中,一些具有抗氧化活性的基因参与了冰冻胁迫。在这些基因中,有6个基因(1个上调基因和5个下调基因)参与氧化还原信号传导,如基因107,403,552在‘金丝小早’中在4度冰冻胁迫下差异表达,表明它们在冰冻胁迫下的低温信号转导中发挥了不同的作用。
冷冻胁迫下转录调控相关基因的研究
转录因子在植物抗非生物胁迫中发挥着多种重要作用。一些研究表明,大多数冷调控的转录因子基因在响应冷胁迫时受损拟南芥[54,55,56].许多研究表明,一些转录因子在植物抗冻性中起着重要作用[57,58,59].例如,AP2/小块土地因素RAP21。,RAP2.6和C2H2型锌指STZ/ZAT10属于CBF调节子(60,61].此外,南汽在枇杷果实冷却过程中也显示出增强表达;然而,它不能直接结合木质素生物合成基因的启动子[62].许多myb型转录因子,如AtMYB85[63),AtMYB88[64,65],通过cbf依赖和cbf不依赖途径增强苹果抗寒能力。在其他物种中,OsMYB4转基因品系拟南芥具有矮秆表型,表现出更好的耐寒性和抗冻性[66].在本研究中,表达模式AP2/小块土地,WRKY,南汽而且bZIP对基因家族进行了分析,发现不同成员在两个品种中所起的作用不同。例如,在AP2/小块土地家庭,不同的家庭成员都参与了对低温的反应。在这些基因中,107,414,104个基因的表达在−10℃时发生了显著变化;基因107,432,697和107,433,390在−20℃;107,426,263和107,433,390在−30°C;但是,107,414,104,107,432,697和107,433,390在最低温度下变化显著。类似地,其他TF成员通常分为两个表达式模式。这些差异表明两个品种对低温胁迫的反应不同,甚至对不同程度的冰冻胁迫也有不同的反应。我们没有进一步验证这些基因的功能,但列出了这项工作的显著差异。因此,未来研究的重点可以集中在这些基因在代谢途径中的作用,了解基因的调控机制。
此外,一些研究发现,选择性剪接(alternative splicing, AS)事件是重要的转录后调节因子,在环境压力下对基因表达进行重编程是必需的。先前的研究表明,当植物暴露在不同的胁迫,特别是低温下时,AS事件的数量明显高于对照植物[67].为了分析冷胁迫下AS的变异,在本研究中,我们检测到所有含内含子的基因在冷胁迫下都发生了交替剪接(图S6).一方面,与对照相比,随着温度的降低,AS事件的数量略有增加,我们假设植物可以通过AS事件对基因表达进行微调,以应对温度的变化。另一方面,大多数AS基因没有受到胁迫的差异调控,这表明AS可能是一个独立的基因调控层,对冷胁迫作出反应。
冷冻胁迫下翻译后调控相关基因的研究
此外,翻译后修饰对植物的冷反应也很重要。董等。[68]的研究发现,在低温胁迫下,HOS1可以通过泛素化降解ICE1,并负调控CBFs和下游冷反应基因。在本研究中,同源基因(107429115)被显著上调。此外,随着冰冻胁迫的增强,苯丙类化合物和黄酮类化合物的生物合成途径也得到加强。在显着的DEGs中,基因(107,429,115和107,415,362)为糖基转移酶相关基因,前者在−40℃时显著上调,后者下调,这可能意味着它们是调节枣抗寒性过程中的正调控因子和负调控因子,参与不同的调控信号通路。此外,MLO蛋白是植物中一个独特的蛋白家族,许多MLO基因的表达受到各种生物和非生物胁迫的影响[69].在MLO蛋白的c端存在一个钙调素结合区,使MLO蛋白能够作为第二信使与钙调素结合,将信号传递到下游通路。CaM蛋白与MLO蛋白的CaMBD结合,增加MLO蛋白的活性。在我们的数据中,我们发现编码MLO蛋白的基因107,409,553在“金丝小造”在−40°C时表达显著上调,而在“东造”中表达下调。这一发现可能表明,钙调控的基因在两个品种中对冰冻胁迫的反应存在差异。
一些研究表明,冷胁迫可以在不同水平上限制植物的生长发育,如细胞和组织水平。根和树枝都是冷胁迫反应中主要感知和转导冷信号的组织[38,40,在组织水平上对红枣枝条进行了综合分析,为改善红枣冷胁迫提供了有价值的信息和遗传资源。此外,在较高冰冻胁迫下,我们还发现了一些显著的DEGs,这可能表明两个品种在不同程度的冰冻胁迫下,半乳糖的代谢途径和生物合成有不同的反应。枣通过膜硬化和细胞变化感知冰冻胁迫,导致钙的流入2 +活性氧(ROS)和植物激素发生变化。信号通路激活蛋白激酶,改变下游多种转录因子家族蛋白,如WRKY、AP2/ERF、NAC和bZIP。tf的激活触发了下游对胁迫处理的响应基因的表达,以及导致抗冻性的生化反应的诱导。这些结果可能为“金丝小造”比“东造”具有更高的抗冻性提供了证据。我们对其调控机制的认识可为进一步研究不同组织在冰冻胁迫和其他非生物胁迫中的作用提供参考。
结论
本研究首次通过转录组测序对两个中国枣品种(“东枣”和“金丝小枣”)在冰冻胁迫下进行了全面分析。参与信号转导、转录和翻译后调控的重要基因在这两个品种间表达差异较大。一些不同的成员AP2 /小块土地,WRKY,南汽而且bZIP基因家族在两个品种中均显著上调或下调。此外,“金丝小早”的107、426,117和107,411,641等参与半乳糖代谢的DEGs在较高程度冷冻处理下明显高于“东早”,这进一步凸显了糖代谢参与植物耐寒性的重要性。本研究结果可以解释“金丝小造”的抗冻性明显高于“东造”的原因,并阐明其抗冻性的分子机制。本研究发现的重要的DEGs可能有助于进一步研究枣和其他木本植物的抗冻机制。
方法
植物材料和冷处理
寒敏枣品种“东枣”(DZ)和耐寒枣品种“金丝小枣”(JS)的当年度枝条采自沧州国家枣品种重点基地。收集到的枝条在4℃下放置10 h,作为对照(DZCK和JSCK),其余枝条在冷冻温度下处理并保持10 h: -10℃(DZA和JSA), - 20℃(DZB和JSB), - 30℃(DZC和JSC)和- 40℃(DZD和JSD)。然后收集树枝的木质部并在液氮中快速冷冻。每个处理设3个重复。
RNA-seq文库构建与测序
根据制造商的说明,使用植物RNA试剂盒(Omega)从30个样品中提取总RNA。每个处理使用3个生物重复来分析转录组。这些文库产品已于2018年在北京基因组研究所(中国深圳)使用Illumina基因组分析仪进行测序分析。首先通过内部perl脚本对fastq格式的原始数据进行处理,去除包含适配器、ploy-N和低质量读取的读取,得到干净的数据。所有后续的分析都是基于干净的数据。参考基因组和基因模型注释文件Ziziphus jujuba(组装ZizJuj_1.1)在NCBI。Z-score方法使用p-value作为统计显著性指标[70]用于鉴别差异表达基因。
DEGs鉴定、GO和KEGG富集分析
根据Eisen等进行聚类分析[71]:用每个基因TPM的log2进行层次聚类分析。基因本体论分类分为分子功能、生物过程和细胞成分。我们使用KOBAS软件测试KEGG通路中差异表达基因的统计富集(http://www.genome.jp/kegg/).使用TopHat识别了四种类型的AS事件,包括外显子跳过、内含子保留、替代5 '剪接位点和替代3 '剪接位点[72].
实时定量PCR
随机选取6个deg进行实时定量PCR (qRT-PCR)验证。引物对序列(使用Beacon Designer 7.2设计)列在表S中1.实时PCR在TB Green Premix Ex Taq II (Tli RNaseH Plus) (TaKaRa,大连,中国)存在下进行,并在IQ5实时PCR仪(Bio-Rad, Hercules, CA, USA)上读取。扩增按先前报道进行[73],所有实验均为生物重复三份。转录水平被标准化相对于平均表达Zjactin基因(GenBank: EU916201)
数据和材料的可用性
使用和/或分析的数据集已存放在NCBI, ID: PRJNA624182。
缩写
- 度:
-
差异表达基因
- 存在:
-
实时定量PCR
- TF:
-
转录因子
- MAPK:
-
丝裂原活化蛋白激酶
- FPKM:
-
每千碱基每百万映射读取片段
- 为:
-
可变剪接
参考文献
- 1.
朱镕基JK。植物的非生物胁迫信号及其响应。细胞。2016;167:313-24。
- 2.
郭晓霞,刘东峰,冲坤。植物冷信号的机制与调控。中国植物学报,2018;60(9):745-56。
- 3.
Jan N, Andrabi KI。植物的抗寒性:未解之谜。电子学报。2009;12:14-5。
- 4.
贾YX,丁YL,史yt,张晓霞,龚泽忠,杨帅cbf三突变体揭示了CBF在冷驯化中的基本功能,并允许定义CBF的规则拟南芥.New Phytol. 2016; 212:345-53。
- 5.
钦努沙米五世,朱军,朱建科。冷胁迫对植物基因表达调控的趋势。中国植物科学,2007;12:444-51。
- 6.
托马斯休曼氏金融。植物低温驯化:耐冻基因及其调控机制。植物化学学报,1999;50:531 - 531。
- 7.
吉尔莫SJ,福勒SG,托马斯how MF。拟南芥转录激活因子CBF1、CBF2和CBF3具有匹配的功能活性。植物分子生物学杂志,2004;54:767-81。
- 8.
秦努沙米V,舒梅克K,朱建科。植物非生物胁迫信号传递中串扰和特异性的分子遗传学研究。中国科学(d辑),2004;
- 9.
陈晓明,陈晓明,陈晓明。抗坏血酸诱导菠菜原位耐寒性的代谢组学研究(菠菜oleraceal .)。植物导刊。2020;4(2):e00202。
- 10.
张志刚,张志刚。拟南芥MAPKs:涉及多种生物过程的复杂信号网络。生物化学学报(英文版);2008;
- 11.
李文杰,李志强,李志强,李志强。小麦对低温胁迫响应的转录组分析。中国生物技术学报,2010;8:449 - 449。
- 12.
Mare C, Mazzucotelli E, Crosatti C, Francia E, Stanca AM, Cattivelli L. HvWRKY38:一个参与大麦寒冷和干旱响应的新转录因子。植物分子生物学杂志,2004;
- 13.
安建平,李锐,曲芳杰,游彩霞,王晓峰,郝玉军。R2R3-MYB转录因子MdMYB23参与了苹果的耐寒性和原花青素积累。植物J. 2018; 96:562-77。
- 14.
安建平,王晓峰,张晓文,徐海峰,毕淑芳,游彩霞,郝玉军。苹果MYB转录因子调节耐寒性和花青素积累,并经历miel1介导的降解。中国生物工程学报(英文版);
- 15.
蒋广斌,史燕婷,张晓阳,辛晓阳,齐丽娟,郭宏伟,李建刚,杨世华。PIF3是一种CBF通路和抗冻性的负调节因子拟南芥.中国生物医学工程学报,2017;29(2):366 - 366。
- 16.
刘志颖,贾玉霞,丁丽丽,史玉婷,李铮,郭勇,龚泽泽,杨世生。冷反应中质膜crpk1介导的核导入蛋白磷酸化调控CBF信号通路。Mol Cell, 2017; 66:1-12。
- 17.
Fiust A、Rapacz M.三个新候选基因的下调对大田和实验室冷驯化大麦的耐寒性具有重要意义。中国植物物理学报。2020;244:153049。
- 18.
Dubouzet JG, Sakuma Y, Ito Y, Kasuga M, Dubouzet EG, Miura S, Seki M, Shinozaki K, Yamaguchi-Shinozaki K.水稻OsDREB基因,栽培稻L,编码转录激活因子,在干旱,高盐和冷响应基因表达中起作用。植物学报2003;33:751-63。
- 19.
马勇,戴鑫,徐勇,罗伟,郑旭,曾东,潘勇,林霞,刘辉,张东,肖杰,郭鑫,徐松,牛勇,金杰,张辉,徐鑫,李磊,王伟,钱青,葛松,冲坤。COLD1赋予水稻的耐冷性。细胞。2015;160:1209-21。
- 20.
沈永刚,张伟坤,何世杰,张建军,刘强,陈世永。EREBP/ ap2型蛋白小麦是低温、脱水和ABA胁迫诱导的dre结合转录因子。应用理论,2003;106:923-30。
- 21.
张建忠,Creelman RA,朱建科。从实验室到现场使用的信息拟南芥培育作物的耐盐、耐寒和耐旱能力。植物物理学报。2004;135:615-21。
- 22.
彭志强,郑辉,杨强,李世英,Stockinger EJ。在经历基因复制、缺失和重排的基因组环境中,低温响应的茄属CBF1基因在上游区域保持高度的一致性。植物分子生物学杂志,2008;
- 23.
彭丽萍,郑海华,薛景杰。比较基因组序列和表达分析Medicago truncatula和紫花苜蓿镰形亚种COLD-ACCLIMATIONSPECIFIC基因。植物物理学报。2008;146:1242-54。
- 24.
Soltesz A, Smedley M, Vashegyi I, Galiba G, Harwood W, Vagujfalvi A.转基因大麦系证明TaCBF14和TaCBF15参与了冷驯化过程和抗冻性。中国科学(d辑),2013;
- 25.
氧化应激生物化学研究。生物化学学报,2007;35:1147-50。
- 26.
洪帅,于长泉,林春春。过氧化氢在植物胁迫信号中的作用。《机器人学院》2005;46:1-10。
- 27.
Mittler R, Vanderauwera S, Gollery M, Van BF。植物活性氧基因网络。植物科学进展2004;9:489 - 489。
- 28.
Dat J, Vandenabeele S, Vranova E, Van MM, Inze D, Van BF。活性氧在植物胁迫反应中的双重作用。细胞生物学与生命科学,2000;
- 29.
朱军,董超,朱建科。植物冷驯化过程中冷反应基因调控、代谢与RNA加工的相互作用植物学报。2007;10:290-5。
- 30.
非生物应激信号通路:特异性和串扰。植物科学进展2001;6:262-7。
- 31.
杨晓明,张晓明,张晓明,等。锌指蛋白Zat12在植物活性氧和非生物胁迫信号转导中的作用拟南芥.植物科学进展。2005;39(4):349 - 349。
- 32.
何峰,李宏辉,王俊杰,苏友友,王海林,冯春春,杨玉玲,牛MX,刘超,尹伟林,夏晓玲。PeSTZ1, c2h2型锌指转录因子胡杨,通过直接调节调节ROS的清除来增强抗冻性PeAPX2.中国生物工程学报,2019;17(4):369 - 369。
- 33.
刘明杰,王俊仁。新中国70年水果科学研究:大枣。果树学报,2019;36(10):1369-81。
- 34.
Gupta R, Deswal R.抗冻蛋白使植物在冰冻条件下存活。生物科学进展。2014;39:931-44。
- 35.
Horton DE, Johnson NC, Singh D, Swain DL, Rajaratnam B, Diffenbaugh NS。大气环流模式变化对极端温度趋势的贡献。大自然。2015;522:465-9。
- 36.
Nasrabadi M, Ramezanian A, Eshghi S, KamgarHaghighi AA, Vazifeshenas MR, Valero D.石榴的生化变化与冬季抗寒性(石榴l)亏灌下生长的树木。科学通报。2019;251:39-47。
- 37.
Saadati S, Baninasab B, Mobli M, Gholami M. 7个橄榄品种抗冻性的测定及其与某些生化生理参数的关系。植物学报。2019;41:51。
- 38.
牛瑞霞,赵小明,王文斌,王福林。植物转录组分析碧桃分支揭示了可能与耐寒性有关的候选基因。科学通报。2019;259:108775。
- 39.
史燕婷,丁丽丽,杨双生。冷驯化中CBF信号的分子调控。植物科学进展,2018;23:7。
- 40.
洪俊华,Savina M,杜娟,Devendran A, Ramakanth KK,田欣,Sim WS, Mironova VV,徐娟。低温胁迫下根系干细胞生态位的牺牲生存机制。细胞。2017;170:26。
- 41.
张震,李娟,李峰,刘华,杨伟,冲坤,徐勇。OsMAPK3磷酸化OsbHLH002/OsICE1,抑制其泛素化激活OsTPP1,提高水稻耐冷性。开发细胞。2017;43:731-43。
- 42.
丁丽丽,贾勇,史玉婷,张旭,宋晨,龚志,杨松。ost1介导的BTF3L磷酸化正向调控植物冷响应中的CBFs。EMBO J. 2018;37:e98228。
- 43.
柯山,陈琳,杜伟,Federico S,王玉梅,刘娟,Fernie AR,宋波,谢春春。通过转录组和代谢组分析,发现精氨酸脱羧酶基因ADC1在马铃薯耐冷适应性中起重要作用。植物J. 2018; 96:1283-98。
- 44.
Steponkus PL, Uemura M, Joseph RA, Gilmour SJ, Thomashow MF。COR15a基因对玉米抗冻性的作用方式拟南芥.中国科学:自然科学,1998;
- 45.
卡普兰F,盖伊CL。麦芽糖对温度冲击中b -淀粉酶的诱导及保护作用。植物物理学报。2004;135:1674-84。
- 46.
卡普兰F,盖伊CL。RNA干扰拟南芥β -淀粉酶8防止麦芽糖在冷休克时的积累,增加PSII光化学效率对冷冻胁迫的敏感性。植物学报(英文版);2005;
- 47.
Kaplan F, Kopka J, Sung DY,赵w, Popp M, Porat R, Guy CL。冷驯化过程中的转录物和代谢物分析拟南芥揭示了冷调节基因表达与代谢物含量变化的复杂关系。植物J. 2007; 50:967-81。
- 48.
Dai N, Petreikov M, Portnoy V, Katzir N, Pharr DM, Schaffer AA。甜瓜果实中一种半乳糖/葡萄糖焦磷酸化酶的克隆和表达分析为棉子糖低聚糖代谢植物半乳糖代谢的主要代谢途径提供了证据。植物物理学报。2006;142:294-304。
- 49.
Kosovã K, Vitamvas P, Ilja P.小麦和大麦在寒冷,干旱和盐碱地下的脱氢酶——LEA-II蛋白能告诉我们关于植物胁迫反应的什么?植物科学进展(英文版);
- 50.
杨涛,Chaudhuri S,杨林,杜林,普瓦雅BW。受体激酶家族中钙/钙调素调节的成员赋予植物耐寒性。中国生物化学杂志,2010;
- 51.
光系统的光抑制2。中国生物医学工程学报,2013;
- 52.
李志强,李志强,李志强,等。低温胁迫下鹰嘴豆的生理生化和蛋白质组学分析。中国植物科学,2013;
- 53.
戚建军,宋春平,王保民,周建民,Kangasjarvi J,朱建科,龚宗泽。植物对干旱胁迫和病原侵袭响应中的活性氧信号和气孔运动。中国生物医学工程学报,2018;
- 54.
李雪峰,李美美,金世杰,李世杰,李世杰。水稻非生物胁迫诱导脱氢酶基因OsDhn1的鉴定(栽培稻L). Mol Cells, 2005; 19:212-8。
- 55.
李国宝,戴恒胜,朱建科。的拟南芥冷响应转录组及其ICE1的调控。《植物科学》2005;17:3155-75。
- 56.
赵超,王鹏,司涛,徐春春,王林,扎耶德,于珍,朱勇,董杰,陶华,朱建科。MAP激酶级联通过调节ICE1蛋白的稳定性来调节冷反应。开发细胞。2017;43:618-29。
- 57.
丁丽丽,史宜涛,杨世华。植物耐寒调控机制研究进展与挑战。新植醇,2019。https://doi.org/10.1111/nph15696.
- 58.
李慧,丁艳,石艳,张晓霞,张松,龚志,杨松。MPK3和mpk6介导的ICE1磷酸化负向调控ICE1的稳定性和耐寒性拟南芥.Dev Cell. 2017; 43:630-42。
- 59.
安建平,李锐,曲芳杰,游彩霞,王晓峰,郝玉军。苹果NAC转录因子通过CBF依赖通路负向调控耐寒性。中国生物医学工程学报,2018;
- 60.
Fowler S, Thomashow MF。拟南芥转录组分析表明,在冷驯化过程中,除了CBF冷反应途径外,还有多种调控途径被激活。《植物科学》2002;14(2):366 - 366。
- 61.
Vogel JT, Zarka DG, Van BA, Fowler SG, Thomashow MF。CBF2和ZAT12转录因子在植物低温转录组配置中的作用拟南芥.植物学报(英文版);2005;
- 62.
徐强,王文俊,曾建科,张杰,Grierson D,李霞,尹小荣,陈克胜。NAC转录因子EjNAC1通过调控木质素影响枇杷果实的木质化。生物技术,2015;102:25-31。
- 63.
钟锐,李超,周杰,McCarthy RL,叶志华。一组转录因子参与调控次生细胞壁生物合成拟南芥.《植物科学》2008;20:2763-82。
- 64.
谢震,李东,王磊,谢震,等。叶片气孔发育调控因子FLP/MYB88在非生物胁迫响应中的作用。植物J. 2010; 64:731-9。
- 65.
谢玉萍,陈小萍,闫燕,包超,李小文,王丽萍,沈XX,李海燕,刘晓峰,牛晓峰,朱超,方宁,邵勇,赵涛,于俊涛,朱金辉,徐丽玲,Steven N,马伟伟,管庆明。非典型R2R3 MYB转录因子通过cbf依赖和cbf不依赖途径增强苹果的抗寒性。新植物,2018;218:201-18。
- 66.
Vannini C, Locatelli F, Bracale M, Magnani E, Marsoni M, ossnato M, Mattana M, Baldoni E, Coraggio i拟南芥植物。植物学报(英文版);2004;
- 67.
James AB, Syed NH, Bordage S, Marshall J, Nimmo GA, Jenkins GI, Herzyk P, Brown JWS, Nimmo HG拟南芥生物钟与温度的变化有关。植物学报。2012;24:961-81。
- 68.
董超,Agarwal M,张勇,谢强,朱建科。植物冷反应的负调控因子HOS1是一种RING E3连接酶,介导ICE1的泛素化和降解。美国国家科学研究院。2006; 103:8281-6。
- 69.
王文辉,何爱敏,郭勇,童庆霞,郑海林。叶绿体钙和ROS信号网络可能促进多种胁迫下气孔关闭的启动状态。环境实验机器人,2016;122:85-93。
- 70.
Kale AJ, Zonneveld AJ, Benes V, Berg MD, Koerkamp MG, Albermann K, Strack N, Ruijter JM, Richter A, Dujon B, Ansorge W, Tabak AHF, Botstein D.通过对两种不同碳源生长酵母的基因表达谱进行序列分析,揭示了基因表达的动态。Mol生物细胞,1999;10(6):1859-72。
- 71.
艾森MB,斯佩曼PT,布朗PO, Botstein D.全基因组表达模式的聚类分析和显示。自然科学进展,1998;26(3):344 - 344。
- 72.
Trapnell C, Pachter L, Salzberg SL. TopHat:发现RNA-Seq剪接连接。生物信息学,2009,25(9):1105 - 11所示。
- 73.
周海燕,贾建平,孔志东,张志东,宋松,李友友,庞小明。大枣DREB基因在非生物胁迫下的全基因组鉴定及表达分析(Ziziphus jujuba机)。中国科学通报,2019;30(4):1277-87。
确认
作者感谢国家枣品种改良重点基地(中国沧州)提供的植物材料。
资金
国家重点研发计划项目(2018YFD1000607)、国家自然科学基金项目(31372019)、北京林业大学(2018BLRD)资助。资助机构没有参与研究的设计、数据的收集、分析和解释,也没有参与撰写手稿。
作者信息
从属关系
贡献
XMP和HYZ构思并设计了研究;HYZ和YH进行实验;HYZ和MYL收集并分析了数据。HYZ撰写了手稿;SS和YSZ对稿件提出了宝贵的意见;XMP、WHB、YYL对稿件进行了修改;XMP获得了资助,并对本文负责。所有作者都阅读并批准了手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1-S6和表S1-S2。图S1。
不同品种冷驯化后的半致死温度(LT50,°C)。图S2.“东藻”和“金丝小藻”不同样品deg的qRT-PCR验证。图S3。不同低温胁迫下‘东藻’DEGs的GO分析。X轴和Y轴分别对应GO项和deg数。图S4。金丝小造不同程度冷胁迫下DEGs的GO分析。X轴和Y轴分别对应GO项和deg数。图S5。半乳糖代谢中的DEGs。不同的方框代表半乳糖代谢的不同基因。红框代表上调基因,绿框代表下调基因。图S6。两个品种在相同低温胁迫下的选择性剪接事件和基因数量。表S1。qRT-PCR引物。表S2。DEGs参与半乳糖代谢途径。
附加文件2。
FPKM值在“东造”和“金丝小造”中。
附加文件3。
在相同的冻结应力下,“东枣”和“金丝小枣”之间的差异。
附加文件4。
冬藻不同冰冻胁迫下的DEGs。
附加文件5。
“金丝小造”中不同程度冷冻胁迫下的DEGs。
附加文件6。
关键转录因子的FPKM值。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
周,H,何,Y,朱,Y。et al。比较转录组分析揭示了两个不同中国枣品种的冷胁迫反应性。BMC植物生物学20.240(2020)。https://doi.org/10.1186/s12870-020-02450-z
收到了:
接受:
发表:
关键字
- Ziziphus jujuba
- “冬枣”
- “Jinsixiaozao”
- 冻结压力
- RNA-seq
- 度