- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
MYB44gydF4y2Ba竞争性抑制的形成gydF4y2BaMYB340gydF4y2Ba-gydF4y2BabHLH2gydF4y2Ba-gydF4y2BaNAC56gydF4y2Ba调节紫肉甘薯花色苷生物合成的复合物gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba、物品编号:gydF4y2Ba258gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
花青素具有重要的生物学功能,对人体健康有益,是红薯块根色素沉着的重要原因。已经确定了花青素生物合成的个别调节因子;然而,紫肉甘薯花色苷生物合成的调控网络尚不清楚。gydF4y2Ba
结果gydF4y2Ba
我们从功能上确定了这一点gydF4y2BaIbMYB340gydF4y2Bacotransformed与gydF4y2BaIbbHLH2gydF4y2Ba在烟草和草莓花青素的花青素积累诱导和添加gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba导致色素沉着增加。此外,我们通过酵母双杂交和萤火虫荧光素酶互补实验证实了IbMYB340与IbbHLH2和IbNAC56a或IbNAC56b的相互作用;这些蛋白可形成MYB340-bHLH2-NAC56a或MYB340-bHLH2-NAC56b转录复合物,通过与花青素的结合来调控花青素的生物合成gydF4y2Ba伊班人gydF4y2Ba启动子而不是gydF4y2BaIbUFGTgydF4y2Ba启动子。此外,通过烟草叶片的瞬时表达系统发现gydF4y2BaIbMYB44gydF4y2Ba可以减少花青素的积累。此外,还验证了IbMYB44与IbMYB340、IbNAC56a或IbNAC56b的相互作用。这个结果表明gydF4y2BaIbMYB44gydF4y2Ba甘薯中花青素的抑制因子。gydF4y2Ba
结论gydF4y2Ba
的抑制因子gydF4y2BaIbMYB44gydF4y2Ba通过竞争性抑制花青素的合成来影响花青素的生物合成gydF4y2BaIbMYB340gydF4y2Ba-gydF4y2BaIbbHLH2gydF4y2Ba-gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbMYB340gydF4y2Ba-gydF4y2BaIbbHLH2gydF4y2Ba-gydF4y2BaIbNAC56bgydF4y2Ba调控复合体的形成。总的来说,本研究提出了一个新的调控网络,其中几个重要的tf在调节花青素的生物合成中发挥关键作用,并为紫色甘薯块根花青素生物合成的潜在机制提供了强有力的见解。gydF4y2Ba
背景gydF4y2Ba
红薯(gydF4y2Ba番薯甘薯gydF4y2Ba)以其丰富的营养价值而闻名,是中国第四重要的作物品种[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba]。其储藏根的颜色主要有白色、黄色、橙色和紫色。在不同颜色的红薯品种中,紫瓤红薯因其贮藏根中花青素含量高而广受欢迎。花青素是目前公认的植物中最重要的次生代谢产物,具有重要的生物学功能,包括抗病、防紫外线、防御食草动物和病原体[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba]。此外,在人类食谱中添加花青素对预防癌症和糖尿病以及心血管和神经疾病有有益的作用[gydF4y2Ba5gydF4y2Ba]。gydF4y2Ba
花青素生物合成途径在不同植物物种中已被广泛报道,包括几个关键的结构基因,如苯丙氨酸解氨酶(PAL)、黄酮3-羟化酶(F3H)、二氢黄酮醇4-还原酶(DFR)、花青素合成酶(ANS)、udp -葡萄糖类黄酮3- o -葡萄糖基转移酶(UFGT)和谷胱甘肽s -转移酶(GST) [qh]gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba]。转录因子,特别是MBW复合物,已被证实参与协同调节花青素合成[gydF4y2Ba9gydF4y2Ba]。其中,R2R3-MYBs对花青素的生物合成尤其有重要贡献[gydF4y2Ba10gydF4y2Ba]。例如,gydF4y2BaAtMYB75gydF4y2Ba,gydF4y2BaAtMYB113gydF4y2Ba和gydF4y2BaAtMYB114gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba11gydF4y2Ba];gydF4y2BaMdMYB10gydF4y2Ba和gydF4y2BaMdMYB110agydF4y2Ba在apple [gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba];gydF4y2BaPyMYB10gydF4y2Ba和gydF4y2BaPyMYB114gydF4y2Ba在梨[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba];gydF4y2BaLcMYB5gydF4y2Ba在荔枝中[gydF4y2Ba16gydF4y2Ba];gydF4y2BaPaMYB10gydF4y2Ba在杏[gydF4y2Ba17gydF4y2Ba];和gydF4y2BaFaMYB10gydF4y2Ba在草莓里[gydF4y2Ba18gydF4y2Ba]作为活化剂参与了花青素的生物合成。除MYB激活剂外,还有R3-MYB和一些R2R3-MYB抑制剂,包括菊花gydF4y2BaCmMYB # 7gydF4y2Ba(一个R3-MYB),草莓gydF4y2BaFaMYB1gydF4y2Ba和gydF4y2BaFaMYB44.1gydF4y2Ba、桃子gydF4y2BaPpMYB18gydF4y2Ba和土豆gydF4y2BaStMYB44gydF4y2Ba(R2R3-MYBs),也被鉴定为参与类黄酮生物合成途径[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba]。gydF4y2Ba
除了MYB TFs外,其他TFs也参与花青素的生物合成。NAC (NAM、ATAF1/2和CUC2) TFs也被广泛报道参与多种生物过程,如植物发育、抗病和非生物胁迫响应[qh]gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba]。对于次级代谢,许多NAC TFs已被证实参与苯丙素途径,从而调节木质素的生物合成[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba];据报道gydF4y2BaANAC032gydF4y2Ba作为花青素积累的抑制gydF4y2Ba拟南芥gydF4y2Ba在应力条件下[gydF4y2Ba24gydF4y2Ba]。此外,gydF4y2BaANAC078gydF4y2Ba和gydF4y2BaPpBLgydF4y2Ba在一定条件下被认为是花青素生物合成的活化剂[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba]。gydF4y2Ba
在紫肉甘薯中,花青素生物合成的个体调节因子已经确定[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba]。gydF4y2BaIbMYB1gydF4y2Ba能特异性促进紫肉甘薯花青素相关基因的表达[gydF4y2Ba30.gydF4y2Ba]。另一个因素,gydF4y2BaIbWD40gydF4y2Ba,与不同甘薯品种花青素含量呈正相关,说明gydF4y2BaIbWD40gydF4y2Ba在紫肉甘薯花青素生物合成中起关键作用[gydF4y2Ba29gydF4y2Ba]。然而,由于甘薯基因组的复杂性带来的缓慢过程(六倍体(2n = 6x = 90)和高度多态性),无法提供额外的证据[gydF4y2Ba31gydF4y2Ba]。因此,其他NAC TFs和抑制因子MYBs是否以及如何参与花青素的生物合成尚不清楚,紫肉根茎花青素生物合成的分子调控网络也鲜有报道。gydF4y2Ba
在这项研究中,四个候选tf,gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbMYB44, IbNAC56agydF4y2Ba和gydF4y2BaIbNAC56b,gydF4y2Ba通过生物信息学和RT-qPCR技术在不同颜色的红薯中筛选到该基因,并通过烟草和草莓花托中的瞬时表达实验鉴定了该基因的功能。进一步的分析表明gydF4y2BaIbMYB340gydF4y2Ba极大地促进了花青素的积累,也可以与辅助因子形成调节复合体gydF4y2BaIbbHLH2gydF4y2Ba,gydF4y2BaIbNAC56agydF4y2Ba和gydF4y2BaIbNAC56bgydF4y2Ba通过与花青素结合来调节花青素的生物合成gydF4y2Ba伊班人gydF4y2Ba而不是发起人gydF4y2BaIbUFGTgydF4y2Ba子,而gydF4y2BaIbMYB44gydF4y2Ba作为一个负调节者,可以与gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或与gydF4y2BaIbNAC56bgydF4y2Ba酵母双杂交和萤火虫荧光素酶互补实验对红薯花青素合成的调控作用。本研究揭示了紫肉甘薯花色苷生物合成的潜在机制,为我们了解不同颜色甘薯根系的调控网络提供了可能的依据。gydF4y2Ba
结果gydF4y2Ba
描述的gydF4y2BaIbMYBgydF4y2Ba和gydF4y2BaIbNACgydF4y2Ba甘薯花青素相关基因gydF4y2Ba
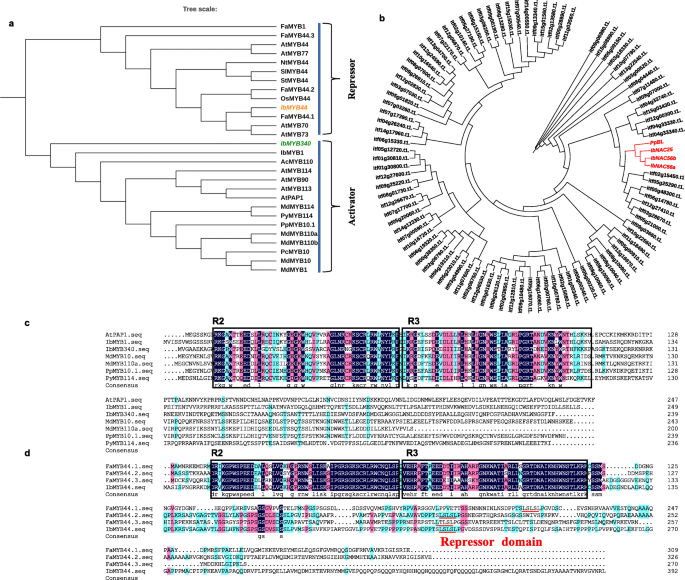
在以前的报告中,TFsgydF4y2BaAtMYB75gydF4y2Ba(gydF4y2BaAtPAP1gydF4y2Ba)gydF4y2Ba拟南芥gydF4y2Ba和gydF4y2BaMdMYB10gydF4y2Ba(DQ267897)和gydF4y2BaPyMYB114gydF4y2Ba(ASY06612.1)在非模式物种中被发现是r2r3型MYBs,它可能与其他tf一起调节花青素的生物合成[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba15gydF4y2Ba]。在这里,我们发现Itf12g05820。T1基因高度同源gydF4y2BaAtPAP1gydF4y2Ba(AT1G56650)通过BLAST比对甘薯基因组数据库。它被命名为gydF4y2BaIbMYB340gydF4y2Ba经多次序列比对,发现其与其他物种的典型R2R3-MYB TFs具有相似性。此外,gydF4y2BaIbMYB44gydF4y2Ba是从gydF4y2BaFaMYB44.1gydF4y2Ba同源序列比对;gydF4y2BaFaMYB44gydF4y2Ba是否有一种转录抑制因子通过相互作用负向调节草莓花托中的蔗糖积累gydF4y2BaFaMYB10gydF4y2Ba[gydF4y2Ba19gydF4y2Ba]。系统发育分析表明gydF4y2BaIbMYB340gydF4y2Ba与其他已知的具有R2R3结构域的MYB转录因子一起属于激活子分支(图2)。gydF4y2Ba1gydF4y2Baa).相比之下,TFgydF4y2BaIbMYB44gydF4y2Ba,其中包含转录抑制结构域LxLxL(图2)。gydF4y2Ba1gydF4y2BaD,在系统发育上与…相关gydF4y2BaFaMYB44.1gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2BaA),在草莓中起转录抑制作用[gydF4y2Ba19gydF4y2Ba]。因此,我们推测这两种MYB TFs可能调节甘薯花青素的生物合成。gydF4y2Ba
NACs和myb的系统发育分析及多序列比对。gydF4y2Ba一个gydF4y2Ba甘薯和其他物种R2R3-MYBs氨基酸序列的系统发育树。gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbMYB44gydF4y2Ba分别用橙色或绿色字母标记。利用mega7对邻接法推断的进化史进行分析。gydF4y2BabgydF4y2Ba98 .系统发育分析gydF4y2BaIbNACgydF4y2Ba甘薯和其他物种的基因。此外,gydF4y2BaIbNAC25gydF4y2Ba,gydF4y2BaIbNAC56agydF4y2Ba,gydF4y2BaIbNAC56bgydF4y2Ba和gydF4y2BaPpBLgydF4y2Ba用红色字母突出显示。gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba利用甘薯和其他物种的R2R3-MYBs蛋白序列进行序列比对。此外,R2和R3结构域被标记,LxLxL负阻遏子基序用红色下划线突出显示gydF4y2Ba
我们从甘薯基因组数据库中检索到含有n端NAC结构域的98个NAC TFs的序列信息。甘薯和桃子NACs的氨基酸序列gydF4y2BaPpBLgydF4y2Ba(ALK27819.1),能促进gydF4y2BaPpMYB10.1gydF4y2Ba作为异二聚体gydF4y2BaPpNAC1gydF4y2Ba,导致烟叶中花青素的积累[gydF4y2Ba28gydF4y2Ba],构建系统发育树(图2)。gydF4y2Ba1gydF4y2Bab) 3个NAC基因;gydF4y2BaIbNAC56agydF4y2Ba,gydF4y2BaIbNAC56b,gydF4y2Ba和gydF4y2BaIbNAC25gydF4y2Ba,根据系统发育分析结果为候选品种。gydF4y2Ba
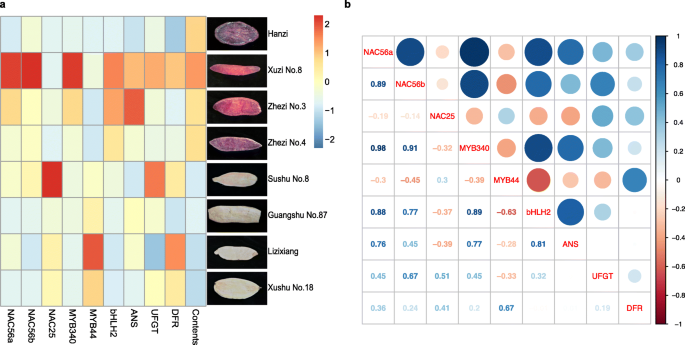
然后,我们量化了不同甘薯品种块茎根中候选基因的转录丰度,不同品种甘薯块茎根剖面图如图所示。gydF4y2Ba2gydF4y2Ba一。gydF4y2BaIbNAC56agydF4y2Ba和gydF4y2BaIbNAC56bgydF4y2Ba紫肉甘薯‘徐子8号’和‘浙子3号’的表达量显著高于黄肉甘薯‘苏薯8号’和‘广薯87号’,也显著高于白肉甘薯‘栗子香’和‘徐树18号’gydF4y2BaIbNAC25gydF4y2Ba恰恰相反。因此,gydF4y2BaIbNAC56agydF4y2Ba和gydF4y2BaIbNAC56bgydF4y2Ba进行后续实验(图2)。gydF4y2Ba2gydF4y2Ba一个)。gydF4y2Ba
一个gydF4y2Ba的表达水平gydF4y2BaIbNAC56agydF4y2Ba,gydF4y2BaIbNAC56bgydF4y2Ba,gydF4y2BaIbNAC25gydF4y2Ba,gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbMYB44gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba,gydF4y2Ba伊班人gydF4y2Ba,gydF4y2BaIbUFGTgydF4y2Ba和gydF4y2BaIbDFRgydF4y2Ba不同甘薯品种(‘汉子’、‘徐子8号’、‘哲子3号’、‘哲子4号’、‘苏薯8号’、‘广薯87号’和‘栗子香’、‘徐薯18号’)块根中花青素含量的变化。gydF4y2BabgydF4y2Ba基因表达水平的相关性分析gydF4y2BaIbNAC56agydF4y2Ba,gydF4y2BaIbNAC56bgydF4y2Ba,gydF4y2BaIbNAC25gydF4y2Ba,gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbMYB44gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba,gydF4y2Ba伊班人gydF4y2Ba,gydF4y2BaIbUFGTgydF4y2Ba和gydF4y2BaIbDFRgydF4y2Ba.使用R脚本分析数据的Pearson相关系数gydF4y2Ba
此外,转录丰度gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbbHLH2gydF4y2Ba在‘徐子8号’和‘哲子3号’上的表达量显著高于其他品种,而gydF4y2BaIbMYB44gydF4y2Ba在紫肉甘薯中保持较低水平,而在黄/白肉甘薯中保持较低水平。此外,“栗子香”和“徐蜀18号”的转录水平较高gydF4y2BaIbMYB44gydF4y2Ba其次是“苏书8号”和“广书87号”。的表达水平gydF4y2Ba伊班人gydF4y2Ba除“汉子”外,紫色肉质品种的基因表达量也较高,而黄色/白色肉质品种的基因表达量相对较低。然而,的表达gydF4y2BaIbUFGTgydF4y2Ba和gydF4y2BaIbDFRgydF4y2Ba无明显差异(图2)。gydF4y2Ba2gydF4y2Ba一个)。gydF4y2Ba
进一步分析了不同甘薯品种花青素生物合成相关基因表达水平的相关性。如图所示。gydF4y2Ba2gydF4y2BaC,的表达式gydF4y2BaIbNAC56a, IbNAC56b, IbbHLH2gydF4y2Ba和gydF4y2Ba伊班人gydF4y2Ba呈显著正相关gydF4y2BaIbMYB340gydF4y2Ba表达,相关系数为0.77 ~ 0.98。然而,的表达gydF4y2BaIbMYB44gydF4y2Ba与的表达负相关gydF4y2BaIbMYB340, IbNAC56a, IbNAC56b, IbbHLH2, IbANSgydF4y2Ba和gydF4y2BaIbUFGTgydF4y2Ba这表明可能会有相反的效果gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbMYB44。gydF4y2Ba此外,gydF4y2BaIbNAC25gydF4y2Ba与其他因素负相关(除gydF4y2BaIbMYB44gydF4y2Ba,gydF4y2BaIbDFRgydF4y2Ba和gydF4y2BaIbUFGTgydF4y2Ba).gydF4y2Ba
共转化诱导花青素gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba在烟叶中gydF4y2Ba
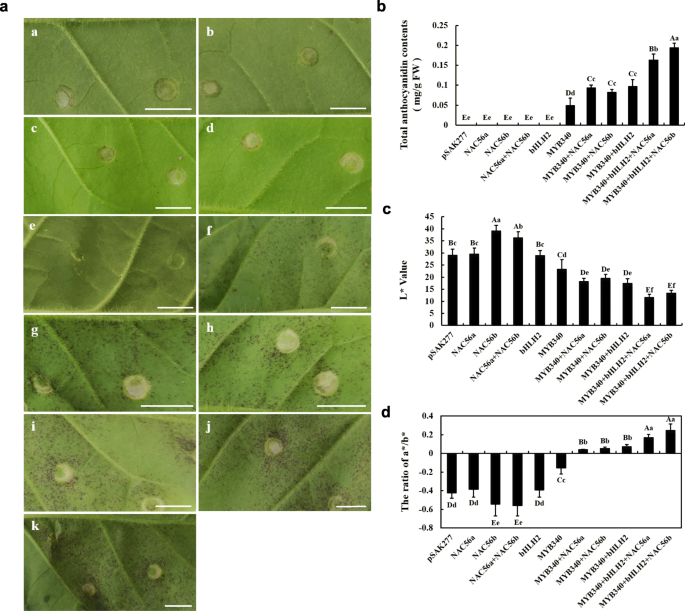
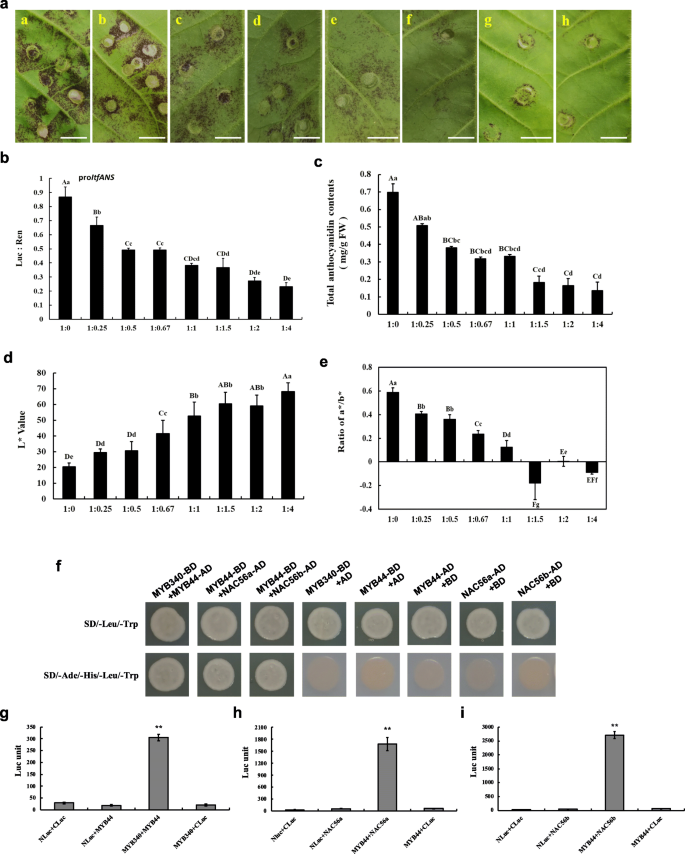
的功能分析结果gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba在烟叶中使用瞬时表达试验的结果如图所示。gydF4y2Ba3.gydF4y2Baa.转化后烟叶注射区未检测到花青素积累gydF4y2BaIbNAC56agydF4y2Ba,gydF4y2BaIbNAC56bgydF4y2Ba或gydF4y2BaIbbHLH2gydF4y2Ba单独使用时,出现轻微的色素沉着gydF4y2BaIbMYB340gydF4y2Ba单独注射。然而,在两者转化后7天,在注射区域可以看到增强的颜色gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbNAC56a / IbNAC56bgydF4y2Ba或gydF4y2BaIbbHLH2gydF4y2Ba.当gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba与gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbbHLH2gydF4y2Ba,可见明显的强烈色素沉着。总花青素含量测定结果表明,3种TFs共转化诱导了花青素的合成,比2种TFs共转化诱导的花青素合成量要大gydF4y2BaIbMYB340gydF4y2Ba而用空载体转化或用基因载体转化后,烟叶花青素积累不明显gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba(图。gydF4y2Ba3.gydF4y2Bab).接下来我们分析了烟叶的颜色。当色素沉着出现时,L*值明显下降;相比之下,a*/b*比值显著增加(图2)。gydF4y2Ba3.gydF4y2Bac - d)。gydF4y2Ba
功能分析gydF4y2BaIbMYB340, IbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba烟草叶片基因瞬时表达试验。gydF4y2Ba一个gydF4y2Ba浸渍后第7天烟叶表型:a, pSAK277;b,gydF4y2BaIbNAC56agydF4y2Ba;c,gydF4y2BaIbNAC56bgydF4y2Ba;d,gydF4y2BaIbNAC56agydF4y2Ba+gydF4y2BaIbNAC56bgydF4y2Ba;e,gydF4y2BaIbbHLH2gydF4y2Ba;f,gydF4y2BaIbMYB340gydF4y2Ba;克,gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbNAC56agydF4y2Ba;h,gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbNAC56bgydF4y2Ba;我,gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbbHLH2gydF4y2Ba;j,gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbbHLH2gydF4y2Ba+gydF4y2BaIbNAC56agydF4y2Ba;和k,gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbbHLH2gydF4y2Ba+gydF4y2BaIbNAC56bgydF4y2Ba.比例尺= 1厘米。gydF4y2BabgydF4y2Ba烟草转化叶片中总花青素含量。FW,新鲜的重量。gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba用美能达色度仪测量颜色参数L*和a*/b*比值值,用于指示表型变化。数值以均数±标准差(gydF4y2BangydF4y2Ba= 3),大写字母和小写字母在gydF4y2BaPgydF4y2Ba< 0.01或gydF4y2BaPgydF4y2Ba< 0.05,分别gydF4y2Ba
的异源过表达gydF4y2BaIbMYB340, IbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba诱导草莓花青素的生物合成gydF4y2Ba
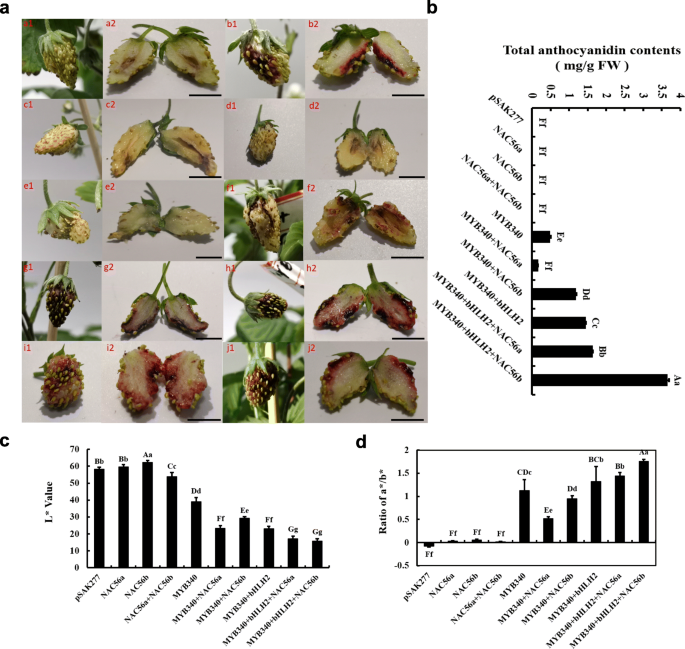
进一步确认的作用gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba在花青素生物合成中,我们共同转化gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba在草莓花托中通过农业渗透,二倍体草莓(gydF4y2Ba草莓属vescagydF4y2Ba)用‘Yellow Wonder’5AF7进行瞬态转变实验。在草莓容器中的瞬时表达试验表明gydF4y2BaIbMYB340gydF4y2Ba与任何其他候选tf共同浸润,在转化后7天出现明显的色素积累,而3个tf共浸润比2个tf或共浸润引起更深的红色色素沉积gydF4y2BaIbMYB340gydF4y2Ba一个人。空载体浸润后未见色素沉着;gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba分别浸润;或gydF4y2BaIbNAC56agydF4y2Ba和gydF4y2BaIbNAC56bgydF4y2Bacoinfiltrated。此外,注射区也可见色素沉着gydF4y2BaIbMYB340gydF4y2Ba(图。gydF4y2Ba4gydF4y2Baa).诱导花青素的测量结果如图所示。gydF4y2Ba4gydF4y2Bab.共转化3种TF的总花青素含量显著高于2种TF或单独共转化1种TF的总花青素含量。草莓花托注射区L*和a*/b*值在色素沉着出现时分别急剧下降或急剧上升,并保持在显著的相对较低或较高水平(图2)。gydF4y2Ba4gydF4y2Bac - d)。在本研究中,草莓花托的异源过表达系统表现出与烟草叶片相似的表型变化。我们观察到大量的花青素色素沉着gydF4y2BaIbMYB340gydF4y2Ba与gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba在一起。gydF4y2Ba
的瞬态表达式gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbNACsgydF4y2Ba在草莓容器里。gydF4y2Ba一个gydF4y2Ba草莓花托表型:a, pSAK277;b,gydF4y2BaIbMYB340gydF4y2Ba;c,gydF4y2BaIbNAC56agydF4y2Ba;d,gydF4y2BaIbNAC56bgydF4y2Ba;e,gydF4y2BaIbNAC56agydF4y2Ba+gydF4y2BaIbNAC56bgydF4y2Ba;f,gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbNAC56agydF4y2Ba;克,gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbNAC56bgydF4y2Ba;h,gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbbHLH2gydF4y2Ba;我,gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbbHLH2gydF4y2Ba+gydF4y2BaIbNAC56agydF4y2Ba;和j,gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbbHLH2gydF4y2Ba+gydF4y2BaIbNAC56bgydF4y2Ba.比例尺= 1.5 cm。gydF4y2BabgydF4y2Ba转化草莓果实花青素含量。FW,新鲜的重量。gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba颜色参数L*和a*/b*比值值表示表型变化。数值以均数±标准差(n = 3)表示,大写字母和小写字母表示在gydF4y2BaPgydF4y2Ba< 0.01或gydF4y2BaPgydF4y2Ba< 0.05,分别gydF4y2Ba
草莓花青素相关基因的表达模式gydF4y2Ba
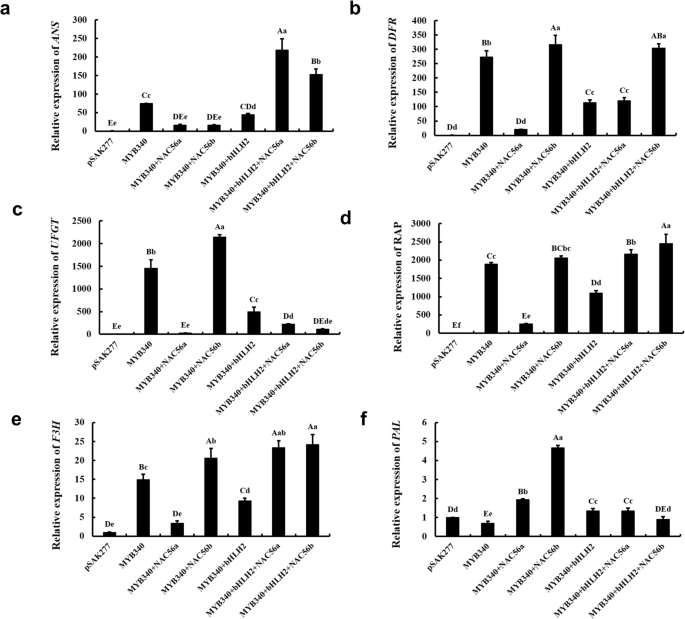
探索信托基金的监管模式gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba几个关键的花青素相关基因,gydF4y2BaFvPALgydF4y2Ba,gydF4y2BaFvF3HgydF4y2Ba,gydF4y2BaFvANSgydF4y2Ba,gydF4y2BaFvDFRgydF4y2Ba,gydF4y2BaFvUFGTgydF4y2Ba和gydF4y2BaFvRAPgydF4y2Ba采用RT-qPCR技术对诱导色草莓花托中的基因进行分析。gydF4y2BaFvANSgydF4y2Ba表达量大大增加时gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba共变换(gydF4y2BaPgydF4y2Ba< 0.01,图。gydF4y2Ba5gydF4y2Baa).有趣的是gydF4y2BaIbMYB340gydF4y2Ba单独显示出更高的gydF4y2BaFvANSgydF4y2Ba表达水平高于共变换gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba(gydF4y2BaPgydF4y2Ba< 0.01或gydF4y2BaPgydF4y2Ba< 0.05)。为gydF4y2BaFvDFRgydF4y2Ba, tf的变换,包括gydF4y2BaIbNAC56bgydF4y2Ba或gydF4y2BaIbMYB340gydF4y2Ba,导致基因表达水平明显高于其他TF组合(gydF4y2BaPgydF4y2Ba< 0.01),而gydF4y2BaIbbHLH2gydF4y2Ba与gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba共转化引起的gydF4y2BaFvDFRgydF4y2Ba表达水平(gydF4y2BaPgydF4y2Ba< 0.01,图。gydF4y2Ba5gydF4y2Bab)。gydF4y2Ba5gydF4y2BaD-e显示了gydF4y2BaFvRAPgydF4y2Ba和gydF4y2BaFvF3HgydF4y2Ba;这两个基因在与不同tf或tf的共转化中均有高表达gydF4y2BaIbMYB340gydF4y2Ba独自一人,除了gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbNAC56agydF4y2Ba(gydF4y2BaPgydF4y2Ba< 0.01)。除了…之外gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbNAC56agydF4y2Ba,gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbbHLH2gydF4y2Ba也保持了较低的表达水平gydF4y2BaFvRAPgydF4y2Ba和gydF4y2BaFvF3HgydF4y2Ba与其他共变换类型相比,除了空向量pSAK277 (gydF4y2BaPgydF4y2Ba< 0.01)。从无花果。gydF4y2Ba5gydF4y2BaC,我们可以看到gydF4y2BaFvUFGTgydF4y2Ba的共转化显著表达gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbNAC56bgydF4y2Ba或gydF4y2BaIbMYB340gydF4y2Ba独自一人(gydF4y2BaPgydF4y2Ba< 0.01),而其他共转化类型似乎没有激活gydF4y2BaFvUFGTgydF4y2Ba.此外,似乎gydF4y2BaFvPALgydF4y2Ba不能被不同的共变换类型激活除了的共变换gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbNAC56bgydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Baf).如上所述,几乎所有参与花青素生物合成途径和液泡运输的基因在上述共转化草莓中都有高表达,特别是当gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2,gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Bacotransformed。这一结果表明gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba基因可能通过形成调控复合体来调控或协同调控花青素的合成。gydF4y2Ba
花色苷生物合成及空泡运输相关基因在草莓诱导色花托中的表达水平。gydF4y2Ba4gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba-gydF4y2BafgydF4y2Ba:gydF4y2BaFvANSgydF4y2Ba,gydF4y2BaFvDFRgydF4y2Ba,gydF4y2BaFvUFGTgydF4y2Ba,gydF4y2BaFvRAPgydF4y2Ba,gydF4y2BaFvF3HgydF4y2Ba,gydF4y2BaFvPAL。gydF4y2Ba数值以均数±标准差(n = 3)表示,大写字母和小写字母表示在gydF4y2BaPgydF4y2Ba< 0.01或gydF4y2BaPgydF4y2Ba< 0.05,分别gydF4y2Ba
调节复合体gydF4y2BaMYB340-bHLH2-NAC56gydF4y2Ba通过结合促进花青素的生物合成gydF4y2Ba伊班人gydF4y2Ba启动子gydF4y2Ba
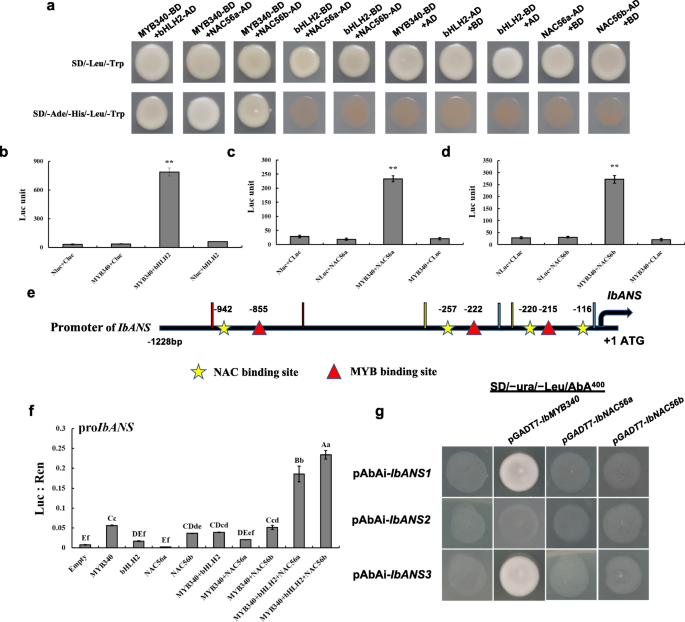
我们推测产品的gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2, IbNAC56agydF4y2Ba和gydF4y2BaIbNAC56bgydF4y2Ba基因可能形成调控复合物来调控花青素的合成。因此,可能的相互作用gydF4y2BaIbMYB340gydF4y2Ba与gydF4y2BaIbbHLH2gydF4y2Ba,gydF4y2BaIbNAC56agydF4y2Ba和gydF4y2BaIbNAC56bgydF4y2Ba通过Y2H试验研究。首先,我们发现共转化酵母细胞中含有pGADT7和gydF4y2BaIbMYB340gydF4y2Ba在SD−Trp/−Leu/−His/−Ade培养基上生长失败,说明gydF4y2BaIbMYB340gydF4y2Ba不能单独激活酵母中下游基因的表达。结果表明,共转化的氨基酸序列在SD-Trp-Leu-His-Ade + AbA培养基上生长强劲gydF4y2BaIbMYB340gydF4y2Ba与gydF4y2BaIbbHLH2, IbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba.然而,Y2H分析显示,两者之间没有相互作用gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Baa).这些结果表明gydF4y2BaIbMYB340gydF4y2Ba能与酵母相互作用吗gydF4y2BaIbbHLH2gydF4y2Ba,gydF4y2BaIbNAC56agydF4y2Ba和gydF4y2BaIbNAC56bgydF4y2Ba.gydF4y2Ba
IbMYB340与IbbHLH2、IbNAC56a或IbNAC56b的互作验证及调控位点评价gydF4y2Ba伊班人gydF4y2Ba启动子。gydF4y2Ba一个gydF4y2Ba通过Y2H法验证IbMYB340与IbbHLH2、IbNAC56aor IbNAC56b的相互作用。gydF4y2BabgydF4y2Ba-gydF4y2BadgydF4y2Ba通过萤火虫荧光素酶互补实验验证IbMYB340与IbNAC56aor IbNAC56b之间的相互作用。**表示有显著差异gydF4y2BaPgydF4y2Ba< 0.01水平。gydF4y2BaegydF4y2Ba原理图gydF4y2Ba伊班人gydF4y2Ba启动子。1228bp启动子区顺式作用元件的预测gydF4y2Ba伊班人gydF4y2Ba使用PlantCare数据库[gydF4y2Ba32gydF4y2Ba]。gydF4y2BafgydF4y2Ba的共变换对活化效果的验证gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2,gydF4y2Ba和gydF4y2BaIbNAC56gydF4y2Ba在gydF4y2Ba伊班人gydF4y2Ba烟草叶片双荧光素酶测定启动子。Luc与Ren的比值表明tf激活了gydF4y2Ba伊班人gydF4y2Ba.gydF4y2BaggydF4y2BaY1H测定gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbNAC56agydF4y2Ba,gydF4y2BaIbNAC56bgydF4y2Ba为gydF4y2Ba伊班人gydF4y2Ba启动子。猎物载体pGADT7-gydF4y2BaIbMYB340gydF4y2Ba/gydF4y2BaIbNAC56agydF4y2Ba/gydF4y2BaIbNAC56bgydF4y2Ba转化为含有pAbAi-gydF4y2BaIbANS1/2/3gydF4y2Ba然后检测SD/−Ura/−Leu/AbAgydF4y2Ba400gydF4y2Ba盘子gydF4y2Ba
此外,我们进一步验证了在酵母中获得的结果,通过萤火虫荧光素酶在烟草中的互补试验。NLuc-的共表达gydF4y2BaIbMYB340gydF4y2Ba和CLuc -gydF4y2BaIbbHLH2gydF4y2Ba或gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba载体逆转了强烈的荧光素酶活性。相比之下,我们在任何对照组(包括Nluc-组)均未检测到明显的荧光素酶活性gydF4y2BaIbMYB340gydF4y2Ba有CLuc和CLuc-gydF4y2BaIbbHLH2gydF4y2Ba/−gydF4y2BaIbNAC56agydF4y2Ba/−gydF4y2BaIbNAC56bgydF4y2Ba与NLuc(图1)gydF4y2Ba6gydF4y2Ba罪犯)。综上所述,这些结果表明gydF4y2BaIbMYB340gydF4y2Ba能与…互动gydF4y2BaIbNAC56agydF4y2Ba和gydF4y2BaIbNAC56bgydF4y2Ba在烟叶中。这些结果与酵母双杂交试验的结果一致。gydF4y2Ba
接下来,我们用gydF4y2Ba伊班人gydF4y2Ba通过双荧光素酶报告基因检测启动子(图2)。gydF4y2Ba6gydF4y2Baf).的共变换gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba显示出更多的交互作用gydF4y2Ba伊班人gydF4y2Ba启动器比gydF4y2BaIbMYB340gydF4y2Ba并发转化与gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba.然而,似乎的共变换gydF4y2BaIbMYB340gydF4y2Ba和任何其他tf或gydF4y2BaIbMYB340gydF4y2Ba单独没有区别,而变换gydF4y2BaIbbHLH2gydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba略微提升了活动(图2)。gydF4y2Ba6gydF4y2Baf).此外,进行Y1H测定以证明gydF4y2Ba伊班人gydF4y2Ba启动子区域直接由gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56b。gydF4y2Ba启动子结构分析揭示了多个顺式调控元件,包括MYB基序(T/CAACCA)和nac结合位点(CACG)。gydF4y2Ba6gydF4y2Bae).在本实验中,我们转化了pGADT7-gydF4y2BaIbMYB340 / IbNAC56a / IbNAC56bgydF4y2Ba猎物载体进入含有pAbAi-的Y1H Gold细胞gydF4y2BaIbANS1/2/3gydF4y2Ba诱饵载体,在SD/−Ura/−Leu/AbA板上检测。转化子共表达猎物载体pGADT7-gydF4y2BaIbMYB340gydF4y2Ba和pAbAi -gydF4y2BaIbANS1/3gydF4y2Ba在SD/−Ura/−Leu/AbAgydF4y2Ba400gydF4y2Ba盘子,而pAbAi-gydF4y2BaIbANS1/2/3gydF4y2Ba诱饵载体在SD/−Ura/AbA上不能生长gydF4y2Ba400gydF4y2Ba盘子,这表明gydF4y2BaIbMYB340gydF4y2Ba能够与1号(- 956 bp至- 755 bp)和3号(- 310 bp至- 105 bp)结合。gydF4y2Ba伊班人gydF4y2Ba启动子片段而不是第二个gydF4y2Ba伊班人gydF4y2Ba启动子片段(图2)gydF4y2Ba6gydF4y2Ba然而,我们发现……之间没有直接的联系gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba的启动子gydF4y2Ba伊班人gydF4y2Ba,尽管几个nac结合位点位于不同的单个启动子区域(图2)。gydF4y2Ba6gydF4y2Bag)。综上所述,这些结果表明不同的调节复合物(gydF4y2BaMYB340-bHLH2-NAC56agydF4y2Ba和gydF4y2BaMYB340-bHLH2-NAC56bgydF4y2Ba)直接激活了的表达gydF4y2Ba伊班人gydF4y2Ba通过绑定到MYB motif元素。gydF4y2Ba
IbMYB44gydF4y2Ba通过竞争性抑制调控复合物的形成抑制花青素积累gydF4y2BaIbMYB340-IbbHLH2-IbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba
研究…的作用gydF4y2BaIbMYB44gydF4y2Ba在花青素生物合成中,我们共同转化gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbMYB44gydF4y2Ba以不同的比例注入烟草叶片背面,以测试转录抑制效果gydF4y2BaIbMYB44gydF4y2Ba.如图所示。gydF4y2Ba7gydF4y2BaA、烟叶色素沉着随着添加比例的增加而逐渐减少gydF4y2BaIbMYB44gydF4y2Ba.使用双荧光素酶报告试验,我们随后研究了该基因的转激活活性gydF4y2Ba伊班人gydF4y2Ba启动子的时候gydF4y2BaIbMYB44gydF4y2Ba和gydF4y2BaIbMYB340gydF4y2Ba在烟叶中共转化。结果表明,这一比例在稳步下降gydF4y2Ba伊班人gydF4y2Ba启动子活动发生时gydF4y2BaIbMYB340gydF4y2Ba:gydF4y2BaIbMYB44gydF4y2Ba比例由1:0降至1:4。然而,几个比率之间似乎没有变化gydF4y2BaIbMYB340gydF4y2Ba:gydF4y2BaIbMYB44gydF4y2Ba: 1:0.5, 1:0.67, 1:1, 1:1.5(图1)gydF4y2Ba7gydF4y2Bab).总花青素含量和a*/b*值在不同比例下均显著下降,其变化与上述烟叶表型一致,L*值明显升高(图2)。gydF4y2Ba7gydF4y2Ba一部)。因此,当与gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbMYB44gydF4y2Ba可以减少花青素的生物合成。gydF4y2Ba
功能分析gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbMYB44gydF4y2Ba烟草叶片瞬时基因表达测定及互作验证gydF4y2BaIbMYB44gydF4y2Ba与gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba体内。gydF4y2Ba一个gydF4y2Ba浸渍后第7天烟叶表型;字母“a”~“h”表示农杆菌的比例gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbMYB44gydF4y2Ba在烟草幼叶中共浸润的结构体。比例尺= 1厘米。gydF4y2BabgydF4y2Ba共渗的转录效应gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbMYB44gydF4y2Ba以不同的比例gydF4y2Ba伊班人gydF4y2Ba启动子活动。gydF4y2BacgydF4y2Ba烟草转化叶片花青素含量。FW,新鲜的重量。gydF4y2BadgydF4y2Ba-gydF4y2BaegydF4y2Ba用颜色参数L*和a*/b*比值值表示表型变化。数值以均数±标准差(n = 3)表示,大写字母和小写字母表示在比率上的显著差异gydF4y2BaPgydF4y2Ba< 0.01或gydF4y2BaPgydF4y2Ba< 0.05。gydF4y2BafgydF4y2Ba验证之间的交互作用gydF4y2BaIbMYB44gydF4y2Ba和gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbNAC56agydF4y2Ba,或gydF4y2BaIbNAC56bgydF4y2Ba通过Y2H测定。gydF4y2BaggydF4y2Ba验证之间的交互作用gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbMYB44gydF4y2Ba通过萤火虫荧光素酶互补试验。gydF4y2BahgydF4y2Ba-gydF4y2Ba我gydF4y2Ba验证之间的交互作用gydF4y2BaIbMYB44gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba通过萤火虫荧光素酶互补试验gydF4y2Ba
我们进一步验证了gydF4y2BaIbMYB44gydF4y2Ba与gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba.Y2H分析显示细胞与gydF4y2BaIbMYB44gydF4y2Ba与gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba可以在SD-Trp-Leu-His-Ade + AbA板上生长(图2)。gydF4y2Ba7gydF4y2Baf).此外,被浸润的对照物恢复了标记的荧光素酶活性gydF4y2BaIbMYB340gydF4y2Ba+gydF4y2BaIbMYB44gydF4y2Ba,gydF4y2BaIbMYB44gydF4y2Ba+gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbMYB44gydF4y2Ba+gydF4y2BaIbNAC56bgydF4y2Ba;相反,是gydF4y2BaIbMYB340 / IbMYB44gydF4y2Ba与CLuc或CLuc-共渗gydF4y2BaIbMYB44 / IbNAC56a / IbNAC56bgydF4y2Ba与Nluc共浸润没有导致足够水平的荧光素酶活性(图2)。gydF4y2Ba7gydF4y2Ba胃肠道)。总的来说,gydF4y2BaIbMYB44gydF4y2Ba可以相互作用gydF4y2BaIbMYB340, IbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba这表明gydF4y2BaIbMYB44gydF4y2Ba抑制花青素积累可能是通过竞争性抑制gydF4y2BaIbMYB340, IbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba.gydF4y2Ba
讨论gydF4y2Ba
花青素是一种与植物红色或紫色色素沉着有关的常见类黄酮化合物,近年来受到广泛关注。gydF4y2Ba33gydF4y2Ba]。目前已知植物中参与花青素途径的结构基因受MYB-bHLH-WD40复合物调控,其中R2R3-MYBs对花青素积累的贡献尤为显著;在不同的植物物种中已广泛研究了TFs,包括gydF4y2BaAtMYB114gydF4y2Ba在gydF4y2Ba拟南芥,PpMYB10.1gydF4y2Ba在桃子,gydF4y2BaPyMYB114gydF4y2Ba在梨,gydF4y2BaMdMYB110agydF4y2Ba在苹果,和gydF4y2BaIbMYB1gydF4y2Ba在红薯[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba]。的共表达gydF4y2BaPpMYB10.1gydF4y2Ba和gydF4y2BaPpbHLH3/33gydF4y2Ba能促进桃花青素的生物合成[gydF4y2Ba9gydF4y2Ba]。此外,myb的两种激活剂,gydF4y2BaPyMYB114gydF4y2Ba和gydF4y2BaPyMYB10gydF4y2Ba,可以相互作用促进红梨花青素的生物合成[gydF4y2Ba15gydF4y2Ba]。在这项研究中,TFgydF4y2BaIbMYB340gydF4y2Ba,高度同源于gydF4y2BaAtPAP1gydF4y2Ba在gydF4y2Ba拟南芥,gydF4y2Ba可以诱导高水平的花青素色素沉着,特别是当与其他TFs共转化时,在烟叶和草莓花托中(图2)。gydF4y2Ba3.gydF4y2Ba一个,gydF4y2Ba4gydF4y2Baa).我们进一步论证了gydF4y2BaIbMYB340gydF4y2Ba与gydF4y2BaIbbHLH2gydF4y2Ba,gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba通过形成调节复合物来调节花青素的合成然而,我们没有发现相互作用gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Baa).这些结果表明gydF4y2BaIbMYB340gydF4y2Ba作为一种转录激活剂,对花青素的积累有很大的贡献。然而,的关系gydF4y2BaIbMYB1gydF4y2Ba[gydF4y2Ba30.gydF4y2Ba)与gydF4y2BaIbMYB340gydF4y2Ba等TFs对紫肉甘薯花青素生物合成的调控作用尚不清楚,对颜色形成的协同调控有待进一步研究。gydF4y2Ba
近年来,MYB抑制因子逐渐被证明参与调节类黄酮生物合成途径。阻遏子通常包含位于c端区域的LxLxL负阻遏子基序,这是抑制作用的原因[gydF4y2Ba22gydF4y2Ba]。据最近报道,肉特异性的gydF4y2BaStMYB44gydF4y2Ba马铃薯果肉中花青素含量降低的原因[gydF4y2Ba22gydF4y2Ba]。gydF4y2BaCmMYB # 7gydF4y2Ba是菊花中R3-MYB负调控因子,可竞争性抑制gydF4y2BaCmMYB6gydF4y2Ba进行互动gydF4y2BaCmbHLH2gydF4y2Ba,导致花青素含量下降[gydF4y2Ba20.gydF4y2Ba]。在桃子里,gydF4y2BaPpMYB18gydF4y2Ba蛋白质可以通过竞争性地抑制MYB激活剂与bHLHs的相互作用来抑制花青素的积累[gydF4y2Ba21gydF4y2Ba]。这里是R2R3-MYBgydF4y2BaIbMYB44gydF4y2Ba使烟草在注射区色素沉着逐渐减少(图2)。gydF4y2Ba7gydF4y2Baa).这与先前的研究结果一致,含有LxLxL基序的MYB抑制因子导致花青素生物合成减少。然后,我们获得了相互作用的证据gydF4y2BaIbMYB44gydF4y2Ba和gydF4y2BaIbMYB340gydF4y2Ba和之间的gydF4y2BaIbMYB44gydF4y2Ba与gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba通过Y2H和萤火虫荧光素酶互补实验(图2)。gydF4y2Ba7gydF4y2Ba外:我)。结果表明gydF4y2BaIbMYB44gydF4y2Ba-gydF4y2BaIbMYB340, IbMYB44-IbNAC56agydF4y2Ba或gydF4y2BaIbMYB44-IbNAC56bgydF4y2Ba配合物可能抑制调节配合物的形成gydF4y2BaMYB340gydF4y2Ba-gydF4y2BabHLH2gydF4y2Ba-gydF4y2BaNAC56agydF4y2Ba或gydF4y2BaMYB340gydF4y2Ba-gydF4y2BabHLH2gydF4y2Ba-gydF4y2BaNAC56bgydF4y2Ba.综合来看,结果表明gydF4y2BaIbMYB44gydF4y2Ba负向调节甘薯花青素的生物合成。gydF4y2Ba
MBW复合物被普遍认为是在转录水平上影响花青素生物合成的调节因子。除MBW复合物外,许多TFs,包括WRKYs、NACs、ERFs、COP1、SPL9、DELLA蛋白等,已被证明在确定花青素生物合成或间接影响MBW复合物活性方面有确证作用[qh]gydF4y2Ba15gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba]。对于NAC TF家族,据报道,NAC TF指定的BLOOD (BL)作为异二聚体与gydF4y2BaPpNAC1gydF4y2Ba促进:促进…的转录活性gydF4y2BaPpMYB10.1gydF4y2Ba,导致花青素积累[gydF4y2Ba28gydF4y2Ba]。此外,负面影响gydF4y2BaANAC032gydF4y2Ba对花青素的积累进行了研究gydF4y2Ba拟南芥gydF4y2Ba在应激条件下[gydF4y2Ba24gydF4y2Ba]。在这项研究中,三个NAC基因,gydF4y2BaIbNAC56agydF4y2Ba,gydF4y2BaIbNAC56b,gydF4y2Ba和gydF4y2BaIbNAC25gydF4y2Ba,是根据98个品种的系统发育分析结果鉴定出来的gydF4y2BaIbgydF4y2Ba北亚和gydF4y2BaPpBLgydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Baa). RT-qPCR分析显示gydF4y2BaIbNAC56a / IbNAC56bgydF4y2Ba在花青素含量丰富的‘徐子8号’和‘浙子3号’中显著表达。gydF4y2Ba2gydF4y2BaA),表明它们可能是甘薯块根花青素生物合成的积极调节因子。当我们共转化时,更明显地检测到色素沉着gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba与gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbbHLH2gydF4y2Ba在异源过表达系统中(图2)。gydF4y2Ba3.gydF4y2Ba一个,gydF4y2Ba4gydF4y2BaA,暗示gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba对功能完备的产品有附加效应吗gydF4y2BaMYB340gydF4y2Ba-gydF4y2BabHLH2gydF4y2Ba伙伴关系。调控模式与在桃子中报道的相似[gydF4y2Ba28gydF4y2Ba]。此外,尽管gydF4y2BaIbNAC25gydF4y2Ba是同源的gydF4y2BaPpBLgydF4y2Ba,表达模式与gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba在紫瓤红薯中,相关分析也表明gydF4y2BaIbNAC25gydF4y2Ba与其他因素负相关,除了gydF4y2BaIbMYB44gydF4y2Ba,gydF4y2BaIbDFRgydF4y2Ba和gydF4y2BaIbUFGTgydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Bab).因此,我们推测gydF4y2BaIbNAC25gydF4y2Ba可能负向调节花青素的生物合成;然而,该基因的功能还有待进一步研究。gydF4y2Ba
据报道,紫肉甘薯品种“山川村”的贮藏根中表达量显著高于其他品种gydF4y2Ba伊班人gydF4y2Ba比白肉品种“玉北白”要多gydF4y2BaIbDFRgydF4y2Ba或gydF4y2BaIbUFGTgydF4y2Ba无明显差异[gydF4y2Ba29gydF4y2Ba]。在本研究中,我们发现了类似的结果:黄肉/白肉品种的叶绿素含量较低gydF4y2Ba伊班人gydF4y2Ba表达量高于紫色肉质品种,而gydF4y2BaIbUFGTgydF4y2Ba和gydF4y2BaIbDFRgydF4y2Ba在这些品种中无明显相关性(图2)。gydF4y2Ba2gydF4y2Baa).在本研究中gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba诱导烟叶和草莓花青素的明显积累(图2)。gydF4y2Ba3.gydF4y2Ba一个,gydF4y2Ba4gydF4y2Baa).此外,RT-qPCR分析显示gydF4y2BaFvANSgydF4y2Ba与上述tf的共转化高度上调(图2)。gydF4y2Ba5gydF4y2Baa). Y1H实验表明gydF4y2BaIbMYB340gydF4y2Ba可以直接绑定到吗gydF4y2Ba伊班人gydF4y2Ba发起人,以及gydF4y2Ba伊班人gydF4y2Ba启动子活性最强gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba共转化,通过双荧光素酶报告试验反映出来(图2)。gydF4y2Ba6gydF4y2BaB-c),这表明gydF4y2Ba伊班人gydF4y2Ba基因可能在不同甘薯品种花青素合成调控网络中发挥重要作用。gydF4y2Ba
结论gydF4y2Ba
总之,通过Y2H、萤火虫荧光素酶互补和双荧光素酶报告基因检测,我们研究了不同的调控复合物(gydF4y2BaMYB340gydF4y2Ba-gydF4y2BabHLH2gydF4y2Ba-gydF4y2BaNAC56agydF4y2Ba或gydF4y2BaMYB340gydF4y2Ba-gydF4y2BabHLH2gydF4y2Ba-gydF4y2BaNAC56bgydF4y2Ba)可以通过与花青素的结合形成促进花青素的生物合成gydF4y2Ba伊班人gydF4y2Ba启动子和上调其他花青素相关基因的表达。此外,我们的研究结果表明gydF4y2BaIbMYB44gydF4y2Ba甘薯中花青素合成的抑制因子gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbNAC56agydF4y2Ba或gydF4y2BaIbNAC56bgydF4y2Ba基因的功能还是通过间接影响的gydF4y2BaMYB340gydF4y2Ba-gydF4y2BabHLH2gydF4y2Ba-gydF4y2BaNAC56agydF4y2Ba或gydF4y2BaMYB340gydF4y2Ba-gydF4y2BabHLH2gydF4y2Ba-gydF4y2BaNAC56bgydF4y2Ba复杂,可以增强gydF4y2Ba伊班人gydF4y2Ba启动子活动。这些结果可以帮助我们对紫肉甘薯中花青素生物合成的可能潜在机制有更深入的了解,尽管还需要进一步的科学研究来全面而深入地解释。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
2018年10月10日,在国家甘薯改良中心(中国江苏省徐州市),‘汉子’、‘徐子8号’、‘哲子3号’、‘哲子4号’、‘苏舒8号’、‘广舒87号’、‘栗子香’和‘徐舒18号’红薯出芽120天后的贮藏根被采集。gydF4y2Ba
烟草种子(gydF4y2Ba烟草gydF4y2Ba“NC89”和gydF4y2Ba烟草benthamianagydF4y2Ba)保存在合肥工业大学食品与生物工程学院(合肥,安徽省,中国),在24°C的温室中人工辐照(日光,16小时)下生长。见面gydF4y2Ba烟草gydF4y2Ba“NC89”叶片用于瞬时转化实验和双荧光素酶报告系统试验,烟草(gydF4y2Ba烟草benthamianagydF4y2Ba)用六片叶子的植物进行萤火虫荧光素酶的互补测定。gydF4y2Ba
“黄色奇迹”5AF7 (YW5AF7)的种子由中国南京农业大学吴军教授提供,是一种二倍体草莓(gydF4y2Baf . vescagydF4y2Ba黄白色果实的栽培品种。在光照12 h的温室中生长,白天温度保持在25℃,夜间温度保持在20℃。花后2周用花托进行瞬时表达测定。gydF4y2Ba
RNA提取及qPCR分析gydF4y2Ba
采用植物总RNA分离试剂盒(Plant total RNA Isolation Kit, Foregene)提取0.8 g甘薯块根和0.5 g草莓样品的总RNA。用Prime Script™RT Master Mix (Takara)从总RNA合成第一链cDNA。qRT-PCR采用SYBR®Premix Ex Taq™II (Takara),总反应体积为20 μl,其中模板cDNA为150 ng,每个引物为0.2 μM, SYBR®Premix Ex Taq™II为10 μl,扩增程序为:1循环95°C, 10 s, 40循环95°C, 5 s, 60°C, 34 s。草莓基因,gydF4y2BaFvTubulingydF4y2Ba(基因11892)和甘薯基因,gydF4y2BaIbTubulingydF4y2Ba(gydF4y2BaItfgydF4y2Ba04g29110),作为内部控制。用于RT-qPCR的引物在附加文件中列出gydF4y2Ba1gydF4y2Ba表S1。gydF4y2Ba
烟草和草莓的瞬态测定gydF4y2Ba
为了进行瞬时表达分析,使用Phanta®Super-Fidelity DNA Polymerase (Vazyme)进行PCR扩增,并获得gydF4y2BaIbMYB340gydF4y2Ba(gydF4y2BaItfgydF4y2Ba12 g05820.t1),gydF4y2BaIbbHLH2gydF4y2Ba(gydF4y2BaItfgydF4y2Ba14 g18730.t2),gydF4y2BaIbNAC56agydF4y2Ba(gydF4y2BaItfgydF4y2Ba02 g15460.t1)和gydF4y2BaIbNAC56bgydF4y2Ba(gydF4y2BaItfgydF4y2Ba在35S启动子的控制下,将01g19290.t1)插入pSAK277载体中gydF4y2BaEcoRgydF4y2Ba我和gydF4y2BaXbagydF4y2Ba1 .用于表达载体构建的引物序列在附加文件中列出gydF4y2Ba1gydF4y2Ba表S2。将重组载体分别转化为菌株GV3101gydF4y2Ba根癌土壤杆菌gydF4y2Ba用化学方法。将携带重组pSAK277载体的农杆菌细胞重悬于注射液中gydF4y2Ba600gydF4y2Ba= 1.0),注射前4-5小时,在25℃60 rpm下孵育。gydF4y2Ba
的功能分析gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbNAC56gydF4y2Ba含有上述tf的农杆菌培养物均匀混合。此外,农杆菌细胞窝藏gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbMYB44gydF4y2Ba以不同的比例混合,以测试gydF4y2BaIbMYB44gydF4y2Ba.将混合的农杆菌细胞注射到幼仔体内gydF4y2Ban .烟草gydF4y2Ba根据Zhou等人描述的方法提取草莓叶片和草莓花托。[gydF4y2Ba21gydF4y2Ba]。将植株在黑暗中孵育24 h,然后移入人工辐照(16 h日长)的温室。注射后7 d拍照,收集花青素进行定量,必要时收集总RNA进行提取。gydF4y2Ba
烟草和草莓中花青素的提取及含量测定gydF4y2Ba
花青素按照Yao等的方法提取并定量。gydF4y2Ba15gydF4y2Ba]。简而言之,我们将0.2 g烟叶组织或0.2 g草莓托组织浸泡在注射区周围,在液氮中完全研磨,在1 ml含0.1% HCl的冷甲醇中,在4℃下浸泡24 h。在12000 g下离心15分钟后收集上清。根据式(A = (A))估算甲醇提取物中花青素的含量gydF4y2Ba530gydF4y2Ba——一个gydF4y2Ba620gydF4y2Ba) - 0.1 (agydF4y2Ba650gydF4y2Ba——一个gydF4y2Ba620gydF4y2Ba),并使用Multiskan光谱设备(Thermo Scientific Multiskan GO 1510,芬兰)测量吸光度。gydF4y2Ba
酵母单杂交试验gydF4y2Ba
使用Matchmaker®金酵母单杂交系统进行酵母单杂交(Y1H)测定。简单地说,有三种放大gydF4y2Ba伊班人gydF4y2Ba将启动子片段(- 956 bp ~ - 755 bp, - 396 bp ~ - 224 bp, - 310 bp ~ - 105 bp)克隆到一个pAbAi载体上gydF4y2Ba后gydF4y2Ba三世和gydF4y2BaXhogydF4y2Ba的完整序列gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbNAC56agydF4y2Ba和gydF4y2BaIbNAC56bgydF4y2Ba克隆到pGADT7载体上gydF4y2BaEcoRgydF4y2Ba我和gydF4y2BaXhogydF4y2Ba然后,我们将猎物载体转化为含有pabai诱饵的Y1H Gold细胞,并在SD/−Ura/−Leu/AbA板上进行检测。用于载体构建的引物序列在附加文件中列出gydF4y2Ba1gydF4y2Ba表S2。gydF4y2Ba
烟草叶片双荧光素酶报告基因测定gydF4y2Ba
为了构建双荧光素酶报告载体,将基因的1.9 kb上游启动子区域gydF4y2Ba伊班人gydF4y2Ba(gydF4y2BaItfgydF4y2Ba从甘薯栽培品种‘徐子8号’块根的基因组DNA中扩增出13g04110.t1(来自ATG起始密码子),并插入pGreen II 0800-LUC二元载体中。此外,农杆菌转化和注射制备与烟叶和草莓瞬时转化试验的方法相同。gydF4y2Ba
农杆菌细胞携带pGreen II 0800-LUC重组载体,pSAK277载体,gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2,gydF4y2Ba和gydF4y2BaIbNAC56gydF4y2Ba按1:3:3:3的比例混合。将混合的农杆菌细胞注射到幼体中gydF4y2Ban .烟草gydF4y2Ba两周的叶子。在浸润后48-72 h,用E1910双荧光素酶报告基因检测系统(Promega)检测LUC和Ren活性。gydF4y2Ba
酵母双杂交试验gydF4y2Ba
使用Matchmaker®金酵母双杂交系统进行酵母双杂交(Y2H)测定。的全长编码序列gydF4y2BaIbMYB340gydF4y2Ba,gydF4y2BaIbbHLH2gydF4y2Ba和gydF4y2BaIbMYB44gydF4y2Ba扩增并克隆到pGBKT7载体中gydF4y2Ba濒死经历gydF4y2Ba我和gydF4y2Ba太平洋标准时间gydF4y2Ba我;的完备序列gydF4y2BaIbbHLH2gydF4y2Ba,gydF4y2BaIbNAC56agydF4y2Ba,gydF4y2BaIbNAC56bgydF4y2Ba和gydF4y2BaIbMYB44gydF4y2Ba克隆到pGADT7中gydF4y2BaEcoRgydF4y2Ba我和gydF4y2BaXhogydF4y2Ba1 .然后,我们根据制造商的说明,用LiCl-PEG法将整合载体共转化到Y2H Gold细胞中,并在SD/−Leu/−Trp/−His/−Ade + AbA板上检测蛋白-蛋白相互作用。gydF4y2Ba
萤火虫荧光素酶互补试验gydF4y2Ba
萤火虫荧光素酶互补实验参照Chen等人报道的方法进行。[gydF4y2Ba38gydF4y2Ba]。的全长编码序列gydF4y2BaIbMYB340gydF4y2Ba和gydF4y2BaIbMYB44gydF4y2Ba将无停止密码子的pCambia1300-NLuc二值载体克隆到pCambia1300-NLuc二值载体上,得到了pCambia1300-NLuc的完整序列gydF4y2BaIbNAC56gydF4y2Ba和gydF4y2BaIbMYB44gydF4y2Ba克隆到pCambia1300-CLuc二进制载体中。农杆菌转化和注射制备按照先前描述的瞬时转化试验进行。然后,用Steady-Glo®荧光素酶测定系统(Promega)测定48-72 h萤火虫荧光素酶的活性。gydF4y2Ba
统计分析gydF4y2Ba
所有样本均独立重复至少三次,所有数据均以均数±标准差表示。采用Student 's进行统计分析gydF4y2BatgydF4y2Ba-测试嵌入Excel 2013软件。使用R脚本分析Pearson相关系数(R值)和构建的热图。重要性以* (gydF4y2BaPgydF4y2Ba< 0.05)或** (gydF4y2BaPgydF4y2Ba< 0.01)或不同的字母。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在当前研究中使用和/或分析的数据集可根据通讯作者的合理要求提供。gydF4y2Ba
缩写gydF4y2Ba
- TF:gydF4y2Ba
-
转录因子gydF4y2Ba
- 朋友:gydF4y2Ba
-
苯丙氨酸解氨酶gydF4y2Ba
- F3H:gydF4y2Ba
-
黄烷酮3-hydroxylasegydF4y2Ba
- DFR:gydF4y2Ba
-
Dihydroflavonol 4-reductasegydF4y2Ba
- 答:gydF4y2Ba
-
花青素合成酶gydF4y2Ba
- UFGT:gydF4y2Ba
-
葡萄糖类黄酮3- o -葡萄糖基转移酶gydF4y2Ba
- 销售税:gydF4y2Ba
-
谷胱甘肽S-transferasegydF4y2Ba
- Y2H:gydF4y2Ba
-
酵母2台混合动力gydF4y2Ba
- Y1H:gydF4y2Ba
-
酵母一个杂化gydF4y2Ba
- MBW:gydF4y2Ba
-
MYB-bHLH-WD40gydF4y2Ba
参考文献gydF4y2Ba
Munoz-Rodriguez P, Carruthers T, Wood JRI, Williams BRM, Weitemier K, Kronmiller B, Ellis D, Anglin NL, Longway L, Harris SA, Rausher MD, Kelly S, Liston A, Scotland RW。调和甘薯起源和传播到波利尼西亚的冲突系统发生。当代生物学,2018;28(8):1246-56。gydF4y2Ba
Ghasemzadeh A, Talei D, Jaafar HZE, Juraimi AS, Mohamed MTM, Puteh A, Halim MRA。植物生长调节剂改变甘薯的植物化学成分和药物品质(gydF4y2Ba番薯甘薯gydF4y2Bal .)。生物医学工程学报,2016;16(1):152。gydF4y2Ba
孔建明,贾立林,高立民,贾福峰,Brouillard R.花青素分析及其生物活性。植物化学。2003;64(5):923 - 33所示。gydF4y2Ba
李晓明,李晓明,李晓明,等。苹果黄酮类化合物对人结肠癌细胞HT29生长的抑制作用及其调控基因的表达。中华癌症杂志,2006;45(3):164-74。gydF4y2Ba
杨玲,凌伟,杜志,陈艳,李丹,邓森,刘志,杨玲。花青素对心脏代谢健康的影响:随机对照试验的系统回顾和meta分析。植物学报,2017;8(5):684-93。gydF4y2Ba
杨建军,李建军,李建军,李建军,等。生物合成中MYB基因的克隆与表达。植物学报,2000;12(12):2383-94。gydF4y2Ba
叶国华。植物色素的遗传与生物化学研究。植物学报,2006;37(5):761 - 761。gydF4y2Ba
冈萨雷斯,赵M,莱维特JM,劳埃德。TTG1/bHLH/Myb转录复合物对花青素生物合成途径的调控gydF4y2Ba拟南芥gydF4y2Ba幼苗。植物学报,2008;33(5):814 - 827。gydF4y2Ba
Cavallini E, Matus JT, Finezzo L, Zenoni S, Loyola R, Guzzo F, Schlechter R, Ageorges A, Arce-Johnson P, Tornielli GB。在葡萄藤中,苯丙素途径在不同的分支上受到一组R2R3-MYB C2抑制因子的控制。植物生理学报,2015,32(4):448 - 456。gydF4y2Ba
马建军,李建军,李建军,等。桃果实花青素合成调控研究进展。足底。2014;240(5):913 - 29。gydF4y2Ba
Dubos C, Stracke R, Grotewold E, Weisshaar B, Martin C, Lepiniec L. MYB转录因子gydF4y2Ba拟南芥gydF4y2Ba.植物科学进展,2010;15(10):573-81。gydF4y2Ba
Espley RV, Hellens RP, Putterill J, Stevenson DE, kuty - amma S, Allan AC.苹果果实的红色是由于MYB转录因子的活性。gydF4y2BaMdMYB10gydF4y2Ba.植物学报,2007;49(3):414 - 427。gydF4y2Ba
Chagne D, Kui LW, Espley RV, Volz RK, How NM, Rouse S, Brendolise C, Carlisle CM, Kumar S, De Silva N, Micheletti D, Mcghie T, Crowhurst RN, Storey RD, Velasco R, Hellens RP, Gardiner SE, Allan AC。苹果MYB转录因子的古老重复与红色果肉新表型的关系。植物生理学报,2013,31(1):229 - 229。gydF4y2Ba
冯思齐,王玉玲,杨生,徐玉涛,陈新祥。梨花青素的生物合成受R2R3-MYB转录因子的调控gydF4y2BaPyMYB10gydF4y2Ba.足底。2010;232(1):245 - 55。gydF4y2Ba
姚广锋,明明林,Allan AC,顾春春,李立林,吴霞,王荣忠,常玉杰,祁克军,张世林,吴军。梨MYB114基因的图谱克隆及其与其他转录因子的相互作用,协调调节果实花青素的生物合成。植物学报,2017;39(3):437-51。gydF4y2Ba
赖波,杜琳,胡波,王东,黄晓明,赵金涛,王和和,胡国光。一个新的荔枝R2R3-MYB转录因子参与花青素生物合成和组织酸化的表征。植物学报,2019;19(6):662。gydF4y2Ba
席文华,冯军,刘勇,张世胜,赵光华。R2R3-MYB转录因子gydF4y2BaPaMYB10gydF4y2Ba参与杏子中花青素的生物合成并决定红皮。植物学报,2019;19(2):287。gydF4y2Ba
Medina-Puche L, Cumplido-Laso G, Amil-Ruiz F, Hoffmann T, Ring L, Rodriguez-Franco A, Caballero JL, Schwab W, Munoz-Blanco J, Blanco-Portales R。gydF4y2BaMYB10gydF4y2Ba在黄酮类/苯丙类代谢调控中起主要作用gydF4y2Ba草莓属ananassagydF4y2Ba水果。实验学报,2014;65(2):401-17。gydF4y2Ba
魏立忠,毛伟文,贾先生,邢世生,阿里宇,赵云云,陈美婷,曹明林,戴志荣,张凯,窦志成,贾文伟,李宝宝。gydF4y2BaFaMYB44.2gydF4y2Ba是一种转录抑制因子,通过与草莓花托的相互作用负向调节蔗糖积累gydF4y2BaFaMYB10gydF4y2Ba.实验学报,2018;69(20):4805-20。gydF4y2Ba
向丽,刘霞,李红,尹霞,Grierson D,李峰,陈凯。cmmyb# 7和R3 MYB转录因子在花青素合成中的负调控作用gydF4y2Ba菊花gydF4y2Ba.J Exp Bot. 2019;70(12): 3111 - 23所示。gydF4y2Ba
周慧,林王凯,王峰,Espley RV,任峰,赵军,Ogutu C,何宏,姜青,Allan AC.激活型R2R3-MYB基因诱导抑制型R2R3-MYB基因平衡花青素和原花青素积累。植物学报,2019;21(4):1190 - 1190。gydF4y2Ba
刘永华,林王凯,Espley RV,王磊,李彦明,刘志,周鹏,曾丽华,张晓军,张建林,Allan AC。gydF4y2BaStMYB44gydF4y2Ba负调控马铃薯块茎肉高温下花青素的生物合成。[J] .生物工程学报,2019;70(15):3809-24。gydF4y2Ba
李松,徐鹏军,李海军,朴志明。NAC转录因子NTL4在干旱诱导的叶片衰老过程中促进活性氧的产生gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2012;37(5):831 - 831。gydF4y2Ba
马茂德,徐铮,El-Kereamy A, Casaretto JA, Rothstein SJ。的gydF4y2Ba拟南芥gydF4y2Ba转录因子gydF4y2BaANAC032gydF4y2Ba在高蔗糖、氧化和非生物胁迫下抑制花青素的生物合成。植物学报,2016;7:1548。gydF4y2Ba
钟荣清,李超,周建林,Mccarthy RL,叶铮。参与调节次生细胞壁生物合成的一系列转录因子gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2008;20(10):2763-82。gydF4y2Ba
王东明,田玉英,福田H。gydF4y2Ba拟南芥gydF4y2Ba维管相关的nac结构域6直接调控木质部分化过程中控制细胞程序性死亡和次生壁形成的基因。植物学报,2010;22(10):3461-73。gydF4y2Ba
Morishita T, Kojima Y, Maruta T, Nishizawa-Yokoi A, Yabuta Y, Shigeoka S.拟南芥NAC转录因子ANAC078调控黄酮类化合物的生物合成。植物生理学报,2009;50(12):2210-22。gydF4y2Ba
周海,奎立文,王海林,顾超,Dare AP, Espley RV,何惠平,Allan AC,韩玉萍。血肉桃NAC转录因子激活花色苷生物合成的分子遗传学研究。植物学报,2015;32(1):105-21。gydF4y2Ba
董伟,牛丽丽,顾建军,高峰。紫肉甘薯贮藏根花青素合成调控基因WD40-repeat的分离。植物物理学报,2014;36(5):1123-32。gydF4y2Ba
马野,王晓明,王晓明,等。紫肉甘薯块根花青素合成调控基因的克隆。植物生理学报,2007;43(3):1252-68。gydF4y2Ba
杨军,Moeinzadeh MH, Kuhl H, Helmuth J,肖鹏,Haas S,刘国良,郑建林,孙志,范文杰,邓国锋,王海霞,胡方华,赵世生,Fernie AR, Boerno S, Timmermann B,张鹏,Vingron M.甘薯单倍型解析基因组的六倍化历史植物学报,2017;3(9):696-703。gydF4y2Ba
Lescot M, Dehais P, Thijs G, Marchal K, Moreau Y, Van De Peer Y, Rouze P, Rombauts S. PlantCARE,植物顺式调控元件数据库和启动子序列分析工具门户网站。核酸学报,2002;30(1):325-7。gydF4y2Ba
多酚:影响其感官特性的因素及其对食品和饮料偏好的影响。中华临床医学杂志,2005;31(1):391 - 391。gydF4y2Ba
李超,吴军,胡kd,魏文生,孙海燕,胡丽丽,韩志,姚国锋,张辉。gydF4y2BaPyWRKY26gydF4y2Ba和gydF4y2BaPybHLH3gydF4y2Bacotargeted的gydF4y2BaPyMYB114gydF4y2Ba调控红皮梨花青素合成和转运的启动子。植物学报,2020;37(7):1-12。gydF4y2Ba
Maier A, Schrader A, Kokkelink L, Falke C, Welter B, Iniesto E, Rubio V, Uhrig JF, Hulskamp M, Hoecker U.光和E3泛素连接酶COP1/SPA调控MYB转录因子PAP1和PAP2参与花青素积累的蛋白稳定性gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2013;34(4):638 - 651。gydF4y2Ba
苟建勇,filippes FF,刘俊杰,Weigel D,王建伟。花青素生物合成的负调控gydF4y2Ba拟南芥gydF4y2Ba靶向mir156的SPL转录因子植物学报,2011;23(4):1512-22。gydF4y2Ba
谢艳,谭红军,马志新,黄晓杰。DELLA蛋白通过抑制MYB/bHLH/WD40复合体MYBL2和JAZ抑制子促进花青素合成gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2016;9(5):711-21。gydF4y2Ba
陈慧明,邹勇,尚玉玲,林总部,王玉军,蔡锐,唐学祥,周建民。植物蛋白相互作用萤火虫荧光素酶互补成像试验。植物生理学报,2008;36(2):368 - 376。gydF4y2Ba
致谢gydF4y2Ba
我们感谢Andrew C. Allan博士、Lin-Wang Kui博士和Richard Espley博士在新西兰奥克兰的新西兰植物与食品研究有限公司提供的双载体pGreen II 0800-LUC。gydF4y2Ba
资金gydF4y2Ba
国家重点研发计划项目(2019YFD1001303, 2019YFD1001300),国家自然科学基金项目(31901993,31970312,31970200,31670278),安徽省自然科学基金项目(1908085MC72),安徽省重点研发计划项目(201904a06020031),中央高校基本科研业务费项目(JZ2018HGTB0241)资助。资助者在实验设计、数据收集和分析或撰写手稿方面没有任何作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
Z.Z.W, G.F.Y, K.D.H. d.l.z和H.Z.构思并设计了实验;Z.Z.W, g.f.y负责实验;j.t.、Z.Q.H.、D.L.Z.提供实验材料;Z.H Y.H.L。,j.t., P.J。H.L.Y.分析数据;Z.Z.W, G.F.Y.撰写论文;k.d.h., G.F.Y, Z.Q.H.和H.Z.解释了数据并修改了手稿。所有作者都阅读并认可了这份手稿的最终版本。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
氨基酸序列比对gydF4y2BaIbNACsgydF4y2Ba和NAC转录因子gydF4y2BaPpBLgydF4y2Ba(ALK27819.1)桃(gydF4y2Ba碧桃gydF4y2Ba).gydF4y2Ba表S1。gydF4y2Ba用于RT-qPCR的引物列表。gydF4y2Ba表S2。gydF4y2Ba用于构建这些结构的引物列表。gydF4y2Ba表S3。gydF4y2Ba经过系统发育分析和多序列比对的蛋白质序列。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Wei, ZZ., Hu, KD.。赵,DL。gydF4y2Baet al。gydF4y2BaMYB44gydF4y2Ba竞争性抑制的形成gydF4y2BaMYB340gydF4y2Ba-gydF4y2BabHLH2gydF4y2Ba-gydF4y2BaNAC56gydF4y2Ba调节紫肉甘薯花色苷生物合成的复合物。gydF4y2BaBMC Plant BiolgydF4y2Ba20.gydF4y2Ba258(2020)。https://doi.org/10.1186/s12870-020-02451-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02451-ygydF4y2Ba
关键字gydF4y2Ba
- 红薯(gydF4y2Ba番薯甘薯gydF4y2Ba)gydF4y2Ba
- 花青素生物合成gydF4y2Ba
- IbMYB340gydF4y2Ba
- IbMYB44gydF4y2Ba
- IbNAC56gydF4y2Ba
- 监管复杂gydF4y2Ba
- 抑制因子gydF4y2Ba