抽象的
背景
扩展蛋白(EXP)促进在植物生长和发育的几个阶段的非酶促细胞壁松动,包括果实生长,节间膨胀,花粉管生长,叶和根部发育,以及在非生物应激反应期间。在这项研究中,空间和时间表达模式C. Annuumα-扩展蛋白(CaEXPA)基因的特征。另外,具体果实CaEXPA表达与甜椒果实发育过程中的细胞膨胀率相关。
结果
空间表达模式揭示了这一点CAEXPA13.在植物组织和花中上调,成熟叶子中最丰富的表达。表达式CaEXPA4与茎和根有关。CaEXPA3在花中大量表达,表明CaEXPA3在花发育中起作用。时间表达分析表明,21个基因中有9个在果实发育过程中高表达。其中六个基因的表达,CaEXPA5那CaEXPA7那CaExpa12.那CAEXPA14 CAELPA17.和CAEXPA19在第七(DAA)后7至21天的丰富,而且CaEXPA6在14至28岁之间强烈表达。此外,该研究表明,在整个叶胡椒发育中发生果实生长和细胞膨胀,直至成熟,果实生长和细胞膨胀率最高,发生在7到14个DAA之间。表达CAEXPA14.和CAEXPA19与细胞扩张率呈正相关,表明它们在丝毫细胞后延伸介导的甜椒果实介导的生长中的作用。在这项研究中,成熟特异性经验值成绩单,CaEXPA9被鉴定,暗示在成熟期间在细胞壁拆卸中的作用。
结论
这是第一个基因组的研究CaEXPA果实生长和发展期间的表达。鉴定果实特异性expas表明他们在甜椒中逐渐松动过程中促进细胞扩张的重要性。这些的扩张基因可能是未来控制果实大小和成熟特性的重要靶标。
背景
扩展蛋白是在细胞扩大介导的植物中介导的细胞壁松动的蛋白质[1那2].此外,它们涉及在水果软化,根生长,花粉管生长和非生物应激响应期间的细胞壁改性[2那3.那4.那5.那6.那7.].扩展蛋白属于一个基因超家族,根据序列分析主要分为4个家族;α-扩展素(的扩张),β-扩展素(EXPB),expansin a-like(探索) 和expansin b样(expl)[8.那9.].在这些家族中,EXPA构成了最大的家族,在细胞壁扩张中发挥了充分的作用[10.] (桌子1).EXPB家族成员还展示细胞壁松弛活性,这个家庭包括第1组草花粉过敏原,促进花粉管侵袭[9.那20.那21.].EXLA和EXLB蛋白属于较小的家庭,并没有清楚地理解其生物学功能[9.].
EXPAs已被证明在黄瓜的下胚轴延伸中发挥作用[22.那23.番茄中的叶片开始[24.].两者的表达expas.和expbs.与深水水稻的节间伸长有关[20.那25.那26.].某些成员的扩张家族调控拟南芥、水稻和大豆根毛的起始和伸长[5.那27.那28.].表达的扩张果实发展过程中的基因表明果实膨胀和番茄,梨和桃子等几种水果作物中的角色作用[3.那4.那12.那29.那30.那31.].
Expas通常由250-275个氨基酸组成,主要含有三个结构域:N-末端20-30氨基酸信号肽;结构域1,由双PSIβ筒(DPBB)结构域制成,其在结构上类似于糖基水解酶45(GH45);和具有β-三明治折叠的结构域2,并被分类为碳水化合物结合模块系列63(CBM63)[9.那21.].尽管对GH45酶相似,但EXPE不会表现出水解活性。事实上,empa介导以pH依赖性方式松动的非酶促细胞壁壁,以使细胞扩张进行膨胀[10.那32.].虽然没有完全阐明的精确作用机制,但EXPES涉及破坏纤维素微纤维和木葡聚糖之间的非共价键[9.那10.].
果实开发,在许多物种,包括辣椒(C. annuum.),主要分为四个阶段:坐果期、细胞分裂期、细胞膨胀期和成熟期[33.].其中,果实生长主要发生在细胞分裂和细胞膨胀相期间,在后阶段期间发生绝大多数生长。在番茄中,丝分裂细胞膨胀导致细胞体积的总体增加超过30,000折[34.].然而,在辣椒中,几乎所有细胞分裂都会发生前波动前,并且在开花后仅注意到后临床细胞扩张[35.那36.].尚未评估特定EXPES在调节甜椒后细胞膨胀和果实生长方面的潜在作用。
在这项研究中,Exps.是从甜椒和空间表达模式中识别的CaEXPA测定幼苗,根,茎,叶片和果实的转录物。此外,时间表达模式CaEXPA在果实生长和发育过程中测定转录物。最后,模式的模式CaEXPA转录性丰度与果实生长和发育过程中细胞膨胀相对率的变化有关。这是第一个基因组的范围内识别经验值甜椒果实膨大和成熟过程中的基因。
结果
表征卡基因家族
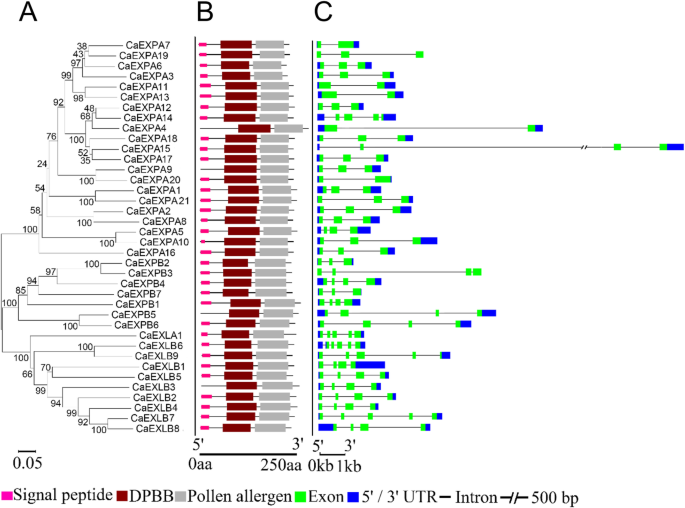
共计40名卡从中鉴定基因C. annuum.简历。从NCBI数据库中检索Zunla-1基因组和序列[37.] (桌子2).预测的蛋白质序列长度范围为239 ~ 298个氨基酸2).每个EXP家族都有一个保守的半胱氨酸和色氨酸残基的特征序列,EXPA和EXPB也包含保守的HFD基序[21.].基于特定exp家族的保守氨基酸特征,21CaEXPA7CaEXPB,1Caexla.和9Caexlb.确定基因(表2;附加图1).先前鉴定和描述的所有保守氨基酸都存在于婴儿呼吁中存在一些例外[21.].在CaExpa5和CaExpa10和HLV的情况下,Expa和ExpB系列中的特征HFD主题是HFV,在CAExpb3的情况下(附图)。1).虽然大多数色氨酸残留物在CaExpa中保存,但它们在CAEXPB中并未完全保守(附加图。1).接下来,进行系统发育分析,表明成员在家族内比家庭更密切相关(图。1一种)。所有的Caexps都存在所有三个结构域,N末端信号肽结构域,双末端信号肽结构域,双psiβ肽结构域,双psiβ-筒(DPBB)结构域和CBM63结构域(在草地上对2组花粉过敏原)存在在CaExpa4,CaExpa9,CaExpb5和Caex1b3中不存在信号肽(图。1B).基因结构分析表明曹克斯有1-5内含子(图。1C)CaEXPA家庭成员包含1-2个内含子,一些例外;CAEXPA15和CaEXPA5有3个内含子CAEXPA14.有4个内含子(图。1C)。全部CaEXPB包含3个内含子,除CA除外Expb2.和CaEXPB7每个内含子有2个内含者。Caexla1.有4个内含子和Caexlb.内含子可变,范围为2至5(图。1C)。
空间和时间记录丰富模式CaEXPA基因
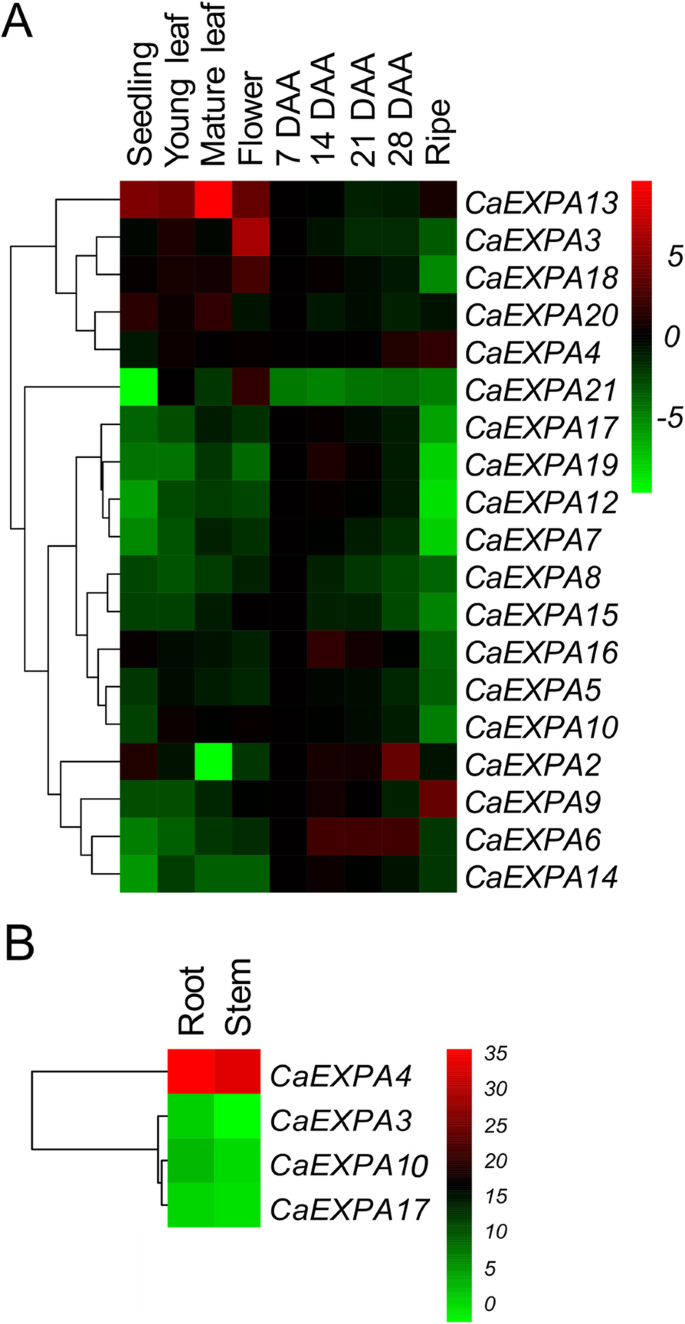
表格丰富模式21CaEXPA在幼苗,年轻和成熟的叶子中测定基因,在花序中的花朵,以及7,14,21,28daa和成熟阶段的果实(图。2一种)。21.CaEXPA其中19个基因在分析的组织中表达。的成绩单CaEXPA1和CAEXPA11.没有可检测到的。在19个可检测的转录物中,CAEXPA13.呈现成熟叶中的最高表达,与果实相比,营养组织和花朵通常更高(图。2一种)。CaEXPA3, CaEXPA13那CAEXPA18.和CaEXPA21与其他组织相比,在鲜花中显示最高的转录物丰度(图。2一种)。在例如水果组织的情况下,CAEXPA17.那CAEXPA19那CaExpa12.那caexpa7,和CAEXPA10.结果表明,7 ~ 28 DAA的丰度较高,成熟果实的丰度较低。2A). On the other hand另一方面;CaEXPA9和CaEXPA4成熟果汁阶段的转录性丰度最高(图。2一种)。21中只有4个CaEXPA基因,CaEXPA3那CaEXPA4那CAEXPA10.和CAEXPA17.在根和干组织中表达(图。2B)。其中,CaEXPA4与其他基因相比,表达量明显提高(图。2b)。
时间记录丰度模式CaExpas.在果实增长和发展期间
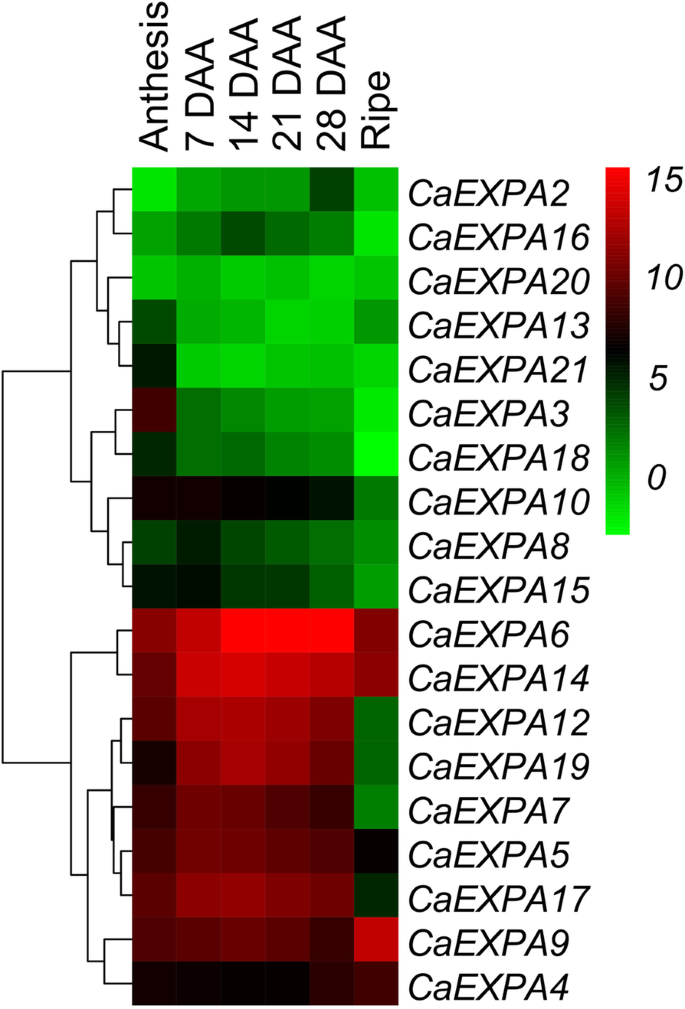
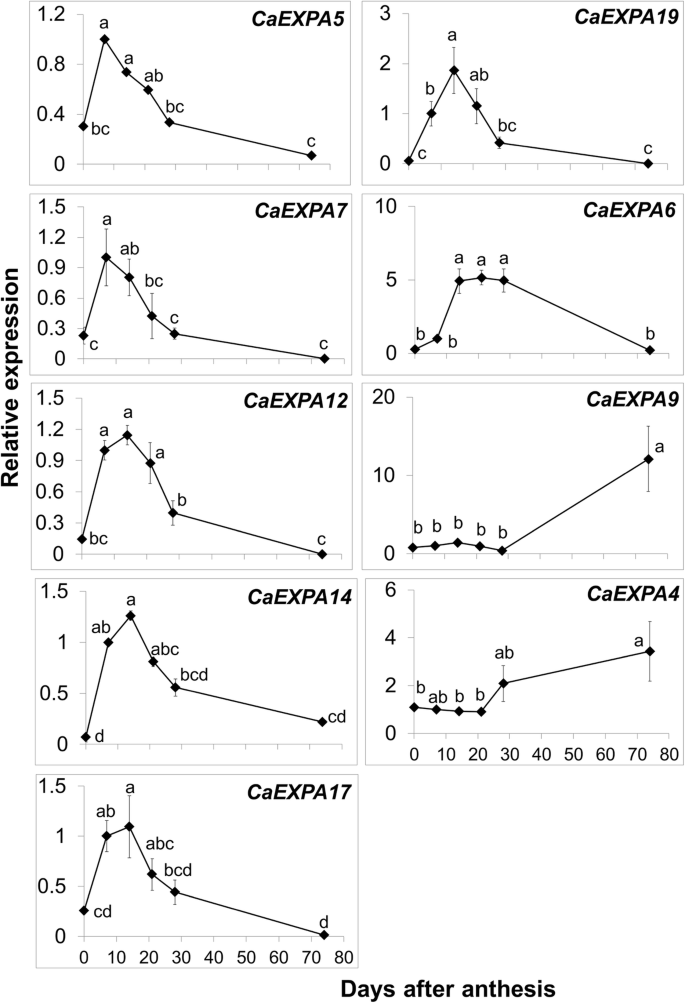
确定丰富的表达CaEXPA在水果样本内转录本,转录本的丰度水平各不相同CaExpas.花和果实的组织归一化为CaEXPA21在7 daa(图。3.).最初,分离的转录物丰度数据的聚类CaEXPA基因分为2组,与其他组相比,含有九个基因的九个基因,10个基因在果实发育过程中显示出较低的表达(图。3.).后10个基因,CaEXPA3在花期高表达(图。3.;附加图2).在剩下的九个高度丰富的转录本中,有几个模式是的扩张在水果发育过程中表达明显。表达CaEXPA5那CAEXPA7,CAELPA12.那CAEXPA14.和CAEXPA17.从开花到7 daa显着增加,仍然高,直到21 daa,其中逐渐减少;这五种基因的表达彼此正相关(图。3.和4.;桌子3.).表达CAEXPA19从开花到第7 DAA,表达量均显著增加,但在第14 DAA处达到峰值,之后逐渐降低,与第7 DAA呈正相关CaExpa12.那CAEXPA14.和CAEXPA17..CaEXPA6表达高于14至28daa(图。3.和4.;桌子3.).CaEXPA9与先前阶段相比,转录物丰度仅在成熟的果实中高于成熟的果实增加13.2倍(平直为28 daa;图。4.).CaEXPA4在果实早期发育过程中,这一特性并未发生明显变化,但其转录本丰度从28 DAA到成熟增加了3.8倍,与果实丰度呈负相关CaEXPA5那CaExpa12.那CAEXPA14.和CAEXPA17.(图。4.;桌子3.).
相对转录性丰富的九个CaEXPA花卉和水果开发的基因。这九CaEXPA基因在图1中显示了相对较高的转录物丰度。3..值是手段和标准误差至少三个重复。采用Tukey’s HSD进行均值分离,采用方差分析进行显著性检验(α = 0.05)。意味着不同的字母显着不同
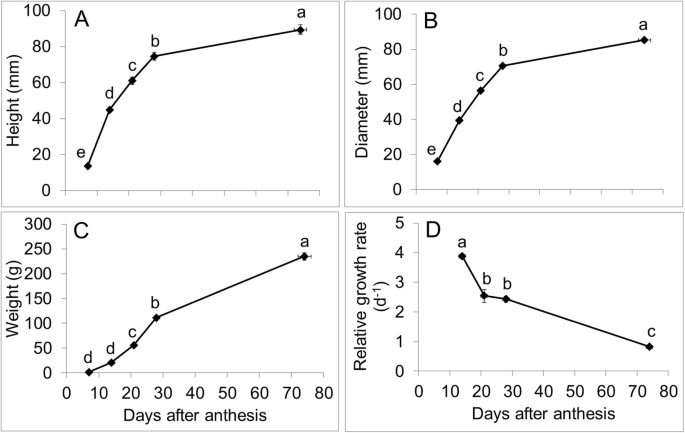
甜椒果实生长规律研究
果实高度增加了3.3倍,介于7到14个DAA之间。随后分别在14至21-28 DAA和28-21-28aa和28da-ripe之间增加1.4-,1.2-和1.2倍(图。5.一种)。果实直径的增加在7到14 daa之间为2.4倍,并且其他发育时间点的折叠变化与果实高度相似(图。5.b)。果子重量增加了14.7倍,介于7到14个DAA之间。随后,它分别在14至21-28aa和28da-ripe之间增加了2.7-,2-和2.1倍(图。5.C). 7 ~ 14 DAA之间果实相对生长量最高;与14 ~ 21 DAA、21 ~ 28 DAA和28 DAA成熟相比,分别提高了1.5倍、1.6倍和4.8倍。5.D)。
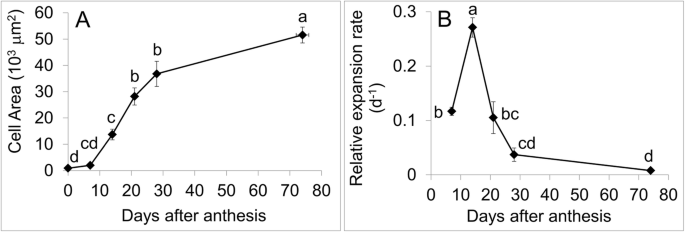
果实发育过程中细胞的膨胀率及其与CaEXPA转录物丰富
在果实发育过程中,细胞面积逐渐增大,7 ~ 28daa期间尤为明显。在发育过程中,果皮细胞面积增加了约60倍。6.一种)。相对细胞膨胀率在7到14 daa之间最高,随后在其余的水果发育中下降(图。6.b)。
进行了转录物丰度与果实生长期间的相对细胞膨胀率之间的相关性。在高度表达中的扩张水果中的基因,只有成绩单丰富CAEXPA14.和CAEXPA19与相对细胞扩展速率显着相关(表4.).
讨论
这CaEXPA家庭是最丰富的家庭Exps.在甜椒中,与在其他茄科烟草等作物(36expas.)[11.),番茄(25expas.,附加图。3.)[12.土豆(24expas.)[13.].其他物种也是如此,包括拟南芥,葡萄,苹果,大豆,杨树和米饭中最多的经验值基因属于的扩张家庭(表1)[14.那15.那16.那17.那18.那19.].Caexps含有239至298氨基酸残基,类似于在烟草和番茄中观察到的内容[11.那12.].CAEXP系列的分类基于每个家庭内的保守氨基酸和特征域的鉴定[21.].系统发育分析证实了CaEXP家族的聚类。在番茄、土豆和葡萄的EXP基因家族中也发现了辣椒CaEXPAs中保守色氨酸残基的出现与某些CaEXPAs中HDF基序缺乏保守的不一致[12.那15.那38.].保守氨基酸残基的差异可以提示底物特异性和细胞壁松动活性的差异[12.].Caexp系列的蛋白质结构域和外显子脉结构与其他物种如甘蔗相似[39.]和烟草[11.].
空间转录物丰富模式显示CAEXPA13.是最表达的的扩张在蔬菜组织如幼苗,年轻和成熟的叶子中,与果实相比,表明叶片发育中的作用。实际上,转基因方法表明,某些expas在叶片启动和发展中发挥作用拟南芥[40]和烟草[41.].在这项研究中,与...相比CAEXPA13.那CAEXPA18.和CaEXPA21,成绩单丰富CaEXPA3与其他组织相比,鲜花中更大,因此CaExpa3可能在花发育中发挥作用。在其他几项研究中,表达经验值已经与花粉,柱头和卵巢有关,在那里它可以通过松开耻辱细胞壁来促进花粉管生长[2那42.那43.].更多expas.也被证明可以调节喇叭花的花瓣发育并玫瑰[44.那45.].然而,由于整个花组织在本研究中合并在一起,因此有花式器官特异性表达模式CaEXPA3无法确定。在这项研究中,21人中只有4人的扩张基因在茎和根组织中表达CaEXPA4表现出显着更高的表达。因此,CaExpa4可能与茎伸长和根生长有关。EXP in茎伸长率的某些成员在水稻中的作用是很好的[20.]和拟南芥根系发育[5.].
果实增长是发展阶段的最长阶段之一。在番茄中,虽然在成熟的绿色阶段发生成熟的绿色阶段后果实生长不会显着增加,但果皮组织内的细胞膨胀可能持续到成熟[46.那47.].番茄细胞扩增率在4 DAA时最高[46.].结果表明,在柿子椒中,果实生长和细胞扩张贯穿果实发育直至成熟。在果实发育后期更频繁的取样是必要的,以确认这些过程是否在成熟期间继续。果实生长和细胞扩张的最高速率发生在果实生长早期,特别是在7 - 14 DAA之间,这从果实生长和细胞扩张的相对速率分析中可以清楚地看出。这些数据表明,这一时期果实生长的增加很大程度上是由细胞的扩张促进的。
有丝分裂后细胞扩张介导的生长很大程度上是由细胞膨压驱动的,通常与进入细胞空泡的吸水有关。在膨胀介导的生长过程中,细胞壁应力松弛导致细胞壁松动[48.].已显示扩展蛋白诱导细胞壁松动以通过破坏纤维素微纤维和木瓜葡聚糖之间的非共价键来促进细胞壁膨胀[9.那10.].在这项研究中,分析颞转录性丰度模式显示出高度表达的九个CaEXPA水果中的基因。这些基因显示出与不同果实发育阶段相关的不同模式。虽然表达了六种基因,CaEXPA5那CaEXPA7那CaExpa12.那CAEXPA14 CAELPA17.和CAEXPA19在果实增长的早期阶段增加,只有记录性丰富CAEXPA14.和CAEXPA19与细胞膨胀的相对速率有显着和呈正相关。这些数据至少表明至少CAEXPA14.和CAEXPA19与丝毫细胞后乳蛋白蛋白质的延伸介导的生长有关。此外,转录物丰富模式CAEXPA14.和CAEXPA19强烈而且明显相关CAExpa5,CAExpa7,CAEXPA12和CAEXPA17.,所有这些在果实生长的早期阶段都被上调,这表明它们可能与果实生长期间的细胞扩张有关。大量的文字记录CaEXPA6CaEXPA6在14 ~ 28 DAA之间最高,因此CaEXPA6可能在果实发育后期促进细胞扩张。这些数据表明,在柿子椒果实生长过程中,多种EXPAs可能在介导细胞扩增中起重要作用。类似的,数的表达式经验值基因与番茄和马铃薯块茎在番茄和块茎的膨胀有关[12.那13.那29.那38.].
成熟是水果发育的最后阶段,其中发生多种纹理变化和果实软化,部分通过Exps介导[29.那33.].Ripening-specificExps.已在几个水果中识别,如番茄,香蕉,梨和草莓[3.那31.那49.那50.].在expas.在本研究中,CaEXPA4和CaEXPA9在甜椒的果实发育后期阶段显示高记录性丰富。这些基因在早期果实开发期间,转录性丰富的似乎并未进行大量变化;CaEXPA4增加了3.8倍CaEXPA9从21 daa直到成熟时显示出戏剧性的增加超过12倍。因此,很可能CaEXPA9在甜椒成熟过程中对果实的软化起着重要作用。
结论
本研究提出了第一个全面的时空表达模式的全基因报告的扩张甜椒的基因。表达七CaEXPA基因,CaEXPA5那CAEXPA6,CAEXPA7.那CaExpa12.那CAEXPA14 CAELPA17.和CAEXPA19与细胞膨胀和果实生长有关。这些结果表明了特定的作用CaEXPA促进果实生长期间促进细胞扩张的基因。果实开发期间的细胞扩张阶段对于甜椒中的最终果实大小是重要的。此外,在细胞膨胀期间引发诸如开花末端腐蚀的生理疾病,具有更高的细胞膨胀率,导致可能更大的易感性。这些功能表征这些CaEXPA基因可能有助于评估其在调节果实生长和叶片腐烂发病时的直接作用。这项研究也揭示了CaEXPA9作为一种果实成熟特异性基因,可能在甜椒果实成熟相关的软化过程中发挥作用。因此,CaEXPA9在成熟和采后储存期间,可以成为减速细胞壁拆卸的潜在目标。
方法
植物材料
甜椒简历。亚里士多德是一种甜辣椒(美国密苏里州圣路易斯的塞米尼斯),从2017年12月到2018年5月在佐治亚州雅典的温室中种植。最初,种子在低温培养箱中的插式苗圃托盘中发芽(Model 2015;VWR国际,Randor, PA, USA) 25°C, 12小时的明暗。随后,将幼苗移栽于11 L塑料苗木容器中,移栽于Fafard 3B Mix metromix 830 (Sun Gro Horticulture, Agawam, MA, USA)。试验期间,温室最低温度和最高温度分别设置为15℃和26℃,相对湿度为66%。
实验设计和组织收集
采用完全随机设计,在4个重复中收集植物组织样本。组织来自五个发育阶段的幼苗、根、茎、叶、花和果实。幼苗(地上组织)在萌发后15天收获,那时大约有4片真叶。根、茎、幼叶和成熟叶在开花前分别从同一株植物上收获。幼叶为顶端展开叶,而成熟叶为基部完全展开叶。茎组织从顶端收集大约3个节间。完全开放的花在开花期收获。花后7天、花后14天、花后21天、花后28天和成熟期采集果实样品。当水果从绿色变成完全的红色时,就被认为是成熟了。
鉴定和命名卡基因家庭
所有CAExpa序列都是从国家生物技术信息(NCBI)和唯一的唯一组织数据库中获得的。在两个数据库和每个数据库内比较所有序列以消除相同的序列。CaExpb,Caexpla和Caexplb的序列是从NCBI数据库获得的,并使用Clustal X进行比较(http://www.clustal.org/)来确定每个基因家族内的独特序列。三件卡基因,CaEXPA21那CaEXPB6,Caexlb6.,在NCBI检测到两种转录物变体(表2);在随后的所有分析中均使用较长的转录变体X1。所有的命名卡基因家族内的基因序列是最近出版日期的顺序,然后是来自NCBI的染色体位置信息。从所有这一切经验值序列来自C. annuum.简历。Zunla-1 [37.基于它们各自的染色体位置(表2).
系统发育分析,蛋白质结构域鉴定和基因结构预测
CaExp序列使用克林尔X对齐(http://www.clustal.org/).使用Mega 7上的肌肉选项验证对齐[51.].使用P距离模型的Mega 7上的邻近加入方法生成系统发育树,部分删除缺失数据处理和1000个引导复制。为了鉴定蛋白质结构域,从软件智能获得信号肽,双PSIβ桶DPBB_1和花粉过敏原区域的位置(http://smart.embl-heidelberg.de/)与pfam一起(https://pfam.xfam.org/).对于基因结构预测,CaEXPAs的外显子、内含子、5 ' UTR和3 ' UTR的位置从NCBI数据库中获得。随后,使用GSDS 2.0 (http://gsds.cbi.pku.edu.cn/).
底漆设计
底漆CaExpas.利用ApE- A质粒编辑器(http://jorgensen.biology.utah.edu/wayned/ape/)软件(附加表格1).三个参考基因,UBIQUITIN-CONJUGATING酶(ube2.,NCBI加入:DQ924970),甘油醛-3-磷酸脱氢酶-(GAPDH, NCBI加入:XM_016722738.1),18s核糖体RNA(18 s rRNA, NCBI的加入,EF564281.1)CaEXPA基因[52.].其中,两个参考基因ube2.和GAPDH用于幼苗,叶,花和水果组织,和GAPDH和18 s rRNA对于根和干组织。18 s rRNA表达方式是ube2.在根和茎组织中未检测到。使用NCBI引物blast (https://www.ncbi.nlm.nih.gov/tools/primer-blast/).
RNA提取,cDNA合成,QRT-PCR和热爱的产生
对于基因表达分析,所有组织共使用4个重复。对于每个重复,为了确保有足够的材料提取RNA,收集了不同数量的器官。一个重复由4株幼苗、10株花、10株果实和14、21、28和成熟阶段的4株果实组成。就一次复制而言,如前所述,从一株单株上收获4个幼叶和成熟叶、整个根和约3个节间的茎段。所有组织样本立即在液态氮中冷冻2并储存在-80°C直到进一步分析。使用[中描述的方案,提取来自根,茎和水果组织的RNA,提取53.].然而,该方案没有产生幼苗,叶和花的RNA,因此使用E.Z.A分离来自这些组织的RNA。在制造商的说明书中概述的“困难样品协议”中概述的总RNA套件I(Omega Bio Tek,Norcross)。在最终步骤中,将RNA重悬于30-40μl二乙基氟碳酸酯(DEPC)处理的水中。使用Nanodrop(Thermo Scientific Nanodrop 8000分光光度计,Waltham,MA)和所有样品的吸光度评估RNA质量,并且260/280吸光度为2.0至2.1。RNA的完整性在1.2%琼脂糖凝胶上,具有0.5x Tris-Borate-Edta(EMD Chemicals Inc.,Gibbstown,NJ,USA)缓冲液。根据制造商协议(Promega,Madison,Wi,USA)后1μgRNA制备cDNA,并稀释至100μL[53.].
正向和反向引物(0.2 μM)和cDNA (1 μl)与PowerUP SYBR Green PCR Master Mix (Applied Biosystems, CA, USA)结合,使用Stratagene MX 3005P qRT-PCR系统(Agilent Technologies, CA)进行qRT-PCR反应,如下所示:50°C 2 min, 95°C 5 min,然后95°C 15 s, 60°C 1 min,重复40个循环。然后进行熔化曲线分析,95°C 1 min, 55°C 30 s, 95°C 30 s。采用LinRegPCR (v. 11.0)检测PCR反应效率。根据[]进行效率修正,确定基因相对表达量53.].要生成Heatmap,请使用以下操作:日志进行转换2(x + 0.001)其中“x”是折叠变化值,等式中的0.001占在某些组织或发育时间点中没有表达的基因。最后,使用Pheatmap-package v.1.0.12在R-3.5.3中创建了Heatmap [54.]
水果生长测量
从收获的水果中进行基因表达和显微镜分析(见下文)。4个重复采集样品,每个重复包含多个果实:7 DAA 14个,14 ~ 28 DAA 8个,成熟果实3个。用数字千分尺测量果实直径、高度和重量。果实相对生长的计算公式如下:\(x = \ frac {\ ln(w2) - \ ln(w1)} {t2-t1} \)哪里w2 = final fruit weight, w1=初始果实重,t2 = final time in days and t1 = initial time in days.
显微镜分析
对于显微镜分析,对于每次重复,每个复制,两种花朵和两个来自上述发育阶段(7-28Aa)和成熟水果的两种果实。收集的样品的每个阶段使用共复制总共四个重复。将各种发育阶段的花和果组织收获到由铬酸(0.3%),乙酸(2%)和甲醛(10%)(10%)(CRAF III)组成的固定溶液中,用于随后的显微镜分析。对于7DAA的花和果实,在最佳切削温度(OCT)中嵌入固定组织中,使用低温恒温器(Leica Jung Figocut 2800N)制备20-30μm厚度约20-30μm的截面。在14 daa,21 daa和28 daa的果实首先切成〜0.5厘米2部分。随后,使用vibriaTome 3000加分切系统(TED Pella,Inc,Redding,Ca,USA)获得约60至120μm厚度的截面。所有部分染色,用0.1%甲苯胺蓝,用BX51显微镜(Olympus,Shinjuku,Tokio,Japan)捕获图像。使用imagej软件分析图像以测量每个部分30个单元格的平均小区区域。用公式计算相对细胞膨胀率:(x=\ frc {\ln (a2)-\ln (a1)}{t2-t1} \)哪里A.2 = final cell area, a1=初始单元面积t2 = final time in days and t1 = initial time in days.
统计与相关分析
使用JMP Pro 14(SAS Institute,Cary,NC,USA)进行统计分析(完全随机设计方差的单向分析)。手段使用Tukey的诚实显着差异(HSD)测试(α= 0.05)分开。细胞膨胀率与经验值使用JMP Pro 14(SAS Institute,Cary,NC,USA)使用成对相关性测定水果中的基因转录物丰度。
数据和材料的可用性
目前研究中使用的数据集可以从相应的作者获得合理的请求。
缩写
- 18 s rRNA:
-
18s核糖体RNA
- C. annuum.:
-
甜椒
- CBM63:
-
碳水化合物装订模块系列63
- CRAF III:
-
铬酸(0.3%),乙酸(2%)和甲醛(10%)
- DAA:
-
在空白发生后的几天
- DEPC:
-
二乙基氟碳酯
- DPBB:
-
双psi beta-barrel
- EXPS:
-
突出
- 探索:
-
expansin a-like
- expl:
-
expansin b样
- GAPD:
-
GLYCERALDEHYDE-3-PHOSPHATE脱氢酶
- GH45:
-
糖基水解酶家庭45
- NCBI:
-
国家生物技术信息中心
- 十四:
-
最佳切削温度
- ube2.:
-
UBIQUITIN-CONJUGATING酶
- 的扩张:
-
α-扩展素
- EXPB:
-
β-扩展素
参考
- 1。
Cosgrove DJ,Li Lc,Cho Ht,Hoffmann-班宁S,摩尔·克朗,泽泽D.展望越来越多的世界。植物细胞生理。2002; 43:1436-44。
- 2。
丁安,孔勇。膨胀素在植物生长中的作用及在作物改良中的应用。植物细胞代表2016;35:949-65。
- 3。
罗斯jkc,李hh,贝内特阿。发散扩展素基因的表达是果实特异性和熟化调节的。Proc Natl Acad Sci U S A. 1997; 94:5955-60。
- 4。
Brummell da,Harpster Mh,Civello PM,Palys JM,Bennett Ab,Dunsmuir P.番茄果实中扩展蛋白蛋白质的改变改变了在成熟过程中软化和细胞壁聚合物代谢。植物细胞。1999; 11:2203-16。
- 5。
cho ht,cosgrove dj。拟南芥根发引发和扩张基因表达的调节。植物细胞。2002; 14:3237-53。
- 6。
李F,兴S,Guo Q,Zhao M,Zhang J,Gao Q等。通过过分扩展基因的过度表达耐旱性TaEXPB23在转基因烟草中。J植物理性。2011; 168:960-6。
- 7。
valdivia er,Stephenson AG,Durachko DM,Cosgrove D.花粉分离和耻辱渗透所需的B级β-扩展蛋白。性植物团体。2009; 22:141-52。
- 8。
Kende H,Bradford Kj,Brummell da,Cho Ht,Cosgrove DJ,Fleming AJ,等。用于基因和蛋白质的扩展蛋白超家族成员的命名。植物mol biol。2004; 55:311-4。
- 9。
Cosgrove DJ。植物扩展素:与植物细胞壁的多样性和相互作用。CurrOp植物BIOL。2015; 25:162-72。
- 10.
Sampedro J,Cosgrove DJ。膨胀蛋白超家族。基因组Biol。2005; 6:1-11。
- 11.
烟草扩张蛋白基因家族的全基因组鉴定(烟草).Mol Gen Genomics。2016; 291:1891-907。
- 12.
[10]吕勇,刘玲,王鑫,韩卓,欧阳斌,张杰,等。番茄扩张蛋白基因家族的全基因组鉴定与表达分析。Mol Gen Genomics. 2016; 291:597-608。
- 13。
陈y,张b,李c,雷卡,kong c,杨y等。薯片扩张素基因家族的综合表达分析(茄属植物tuberosum)公开了用于干旱和散热性的应激响应性扩展素样B基因。Plos一个。2019; 14:1-21。
- 14。
Lee Y,Choi D,Kende H. Expansins:不断扩大的数字和功能。CurrOp植物BIOL。2001; 4:527-32。
- 15.
Dal Santo S,Vannozzi A,Tornielli GB,Fasoli M,Venturini L,Pezzotti M等。扩大素基因超细的基因组分析揭示了葡萄种特异性结构和功能特性。Plos一个。2013; 8。
- 16。
张某,徐河,高Z,陈建,姜Z,舒H.扩展素基因的基因组宽分析Malus×Divelsa..Mol Gen Genomics. 2014; 289:225-36。
- 17。
朱y,吴n,歌曲w,yin g,qin y,yan y等。大豆(大豆)扩展蛋白基因超级家族起源:分段和串联复制事件,然后在亚属之间进行分歧。BMC植物BIOL。2014; 14:1-19。
- 18。
Sampedro J,Carey Re,Cosgrove DJ。基因组历史澄清了扩展素超自食的演变:来自杨树基因组和松树的新见解。j植物res。2006; 119:11-21。
- 19。
Sampedro J,Lee Y,Carey Re,Depamphilis C,Cosgrove DJ。基因组史的使用改善基因家族的系统发育和对出生和死亡的理解。工厂J. 2005; 44:409-19。
- 20.
Lee Y,Kende H.β-扩展素的表达与深水水稻中的胫骨伸长率相关。植物理性。2001; 127:645-54。
- 21.
Choi D,Kim Jh,Lee Y.植物开发中的扩展局。ADV BOT RES。2008; 47:47-97。
- 22.
McQueen-Mason S,Durachko DM,Cosgrove DJ。两个内源性蛋白质诱导植物中的细胞壁延伸。植物细胞。1992年; 4:1425-33。
- 23。
Cosgrove DJ,Durachko DM。生长黄瓜胚囊中分离墙的自水解和延伸。J Exp Bot。1994年; 45:1711-9。
- 24。
Fleming AJ,McQueen-Mason S,Mandel T,Kuhlemeier C.细胞壁蛋白扩展蛋白的叶原序诱导。科学。1997年; 276:1415-8。
- 25。
Cho HT,Kende H.扩展素基因的表达与深水水稻的生长相关。植物细胞。1997年; 9:1661-71。
- 26。
李亚平,李建平,李建平。深水水稻α-扩张蛋白和扩张蛋白样基因的表达。植物杂志。2002;130:1396 - 405。
- 27。
李德坤,安建辉,宋士奇,杜淑珍,李俊生。一个扩张蛋白基因的表达与大豆根系伸长有关。植物杂志。2003;131:985 - 97。
- 28。
yu z,kang b,他x,lv s,bai y,ding w等。根发特异性扩张素调节水稻中的根毛伸长率。工厂J1111; 66:725-34。
- 29。
Brummell da,Harpster MH,Dunsmuir P.番茄果实中扩展素基因家族成员的差异表达。植物mol biol。1999年; 39:161-9。
- 30.
Hayama H,Shimada T,Haji T,Ito A,Kashimura Y,Yoshioka H.桃子中熟化相关扩展蛋白cDNA的分子克隆:储存期间含有突出蛋白积累和果实的变化之间的关系。J植物理性。2000; 157:567-73。
- 31.
7个α-扩张蛋白基因在梨果实生长和成熟过程中的差异表达。杂志。2003;117:564 - 72。
- 32.
Cosgrove DJ。膨胀蛋白松动的细胞壁。植物理性。1998年:333-9。
- 33.
《水果:一个发展的视角》。植物细胞。1993;5:1439。
- 34.
关键词:核复制,番茄,核质比,果实生长实验机器人。2014;65:2731-46。
- 35。
MICENTION AJ。开发花卉和果实甜椒L. Acta Bot Neerl。1974年8月23日:415-432。
- 36。
Bosland P,Votava E. Peppers:蔬菜和香料辣椒。第2版。Cab International,Oxfordshire,U.K;2012年。
- 37。
acta photonica sinica, 2011, 38(5): 732 - 736 .秦超,于超,沈勇,方鑫,陈磊,闵杰,等。栽培和野生辣椒的全基因组测序提供了洞见辣椒驯化和专业化。Proc Natl Acad Sci U S A. 2014; 111:5135-40。
- 38。
Jung J,O'Donoghue Em,Dijkwel PP,Brummell Da。多种扩展基因的表达与马铃薯器官中的细胞膨胀有关。植物SCI。2010; 179:77-85。
- 39。
Santiago Tr,Pereira VM,De Souza WR,Steindorff As,Cunha Badb,Gaspar M等。甘蔗膨胀蛋白基因家族的基因组鉴定,表征及表达谱分析(糖果SPP。)。Plos一个。2018; 13:1-18。
- 40。
cho ht,cosgrove dj。扩展蛋白的改变表达调节叶片生长和PEPICEL脱落拟南芥.Proc Natl Acad Sci U S A. 2000; 97:9783-8。
- 41.
Kuluev BR, Safiullina MG, Knyazev AV, Chemeris AV.异位表达的影响NtEXPA5基因对转基因烟草植物的细胞大小和生长的基因。Russ J Dev Biol。2013; 44:28-34。
- 42.
花粉管生长过程中细胞壁的组成、生物合成和重塑。植物。2013;2:107-47。
- 43.
草花粉致敏原作为细胞壁松解剂的研究。美国国家科学研究院1997;94:659 - 64。
- 44.
Zenoni S,Reale L,Tornielli GB,Lanfaloni L,Porcenddu A,Ferrarini A等。下调矮牵牛织布达α-扩展蛋白基因PhEXP1减少细胞壁中的结晶纤维素的量,导致花瓣肢体的表型变化。植物细胞。2004; 16:295-308。
- 45.
戴F,张C,江X,康M,Yin X,Lüp等。RhNAC2和Rhexpa4.参与调节玫瑰花瓣膨胀过程中的脱水耐受性。植物理性。2012; 160:2064-82。
- 46.
Renaudin JP,Deluche C,Cheniclet C,Chevalier C,Chegne N.细胞层特异性细胞分裂细胞层和细胞膨胀在番茄果皮中的果实组和果实生长期间。J Exp Bot。2017; 68:1613-23。
- 47。
Cheniclet C, Rong WY, Causse M, Frangne N, Bolling L, Carde JP等。细胞扩张和核内复制在果皮中表现出较大的遗传变异,对番茄果实的生长起着重要的作用。植物杂志。2005;139:1984 - 94。
- 48。
Cosgrove DJ。弥漫性植物细胞壁的生长。植物理性。2018; 176:16-27。
- 49。
在成熟草莓果实中表达扩张蛋白基因。植物杂志。1999;121:1273-9。
- 50。
Trivedi PK, Nath P。MaExp1,一种乙烯诱导的氨基醛蛋白果实。植物SCI。2004; 167:1351-8。
- 51。
Kumar S,SteCher G,Tamura K. Mega7:用于更大数据集的分子进化遗传学分析版本7.0。mol Biol Evol。2016; 33:1870-4。
- 52。
程y,pang x,wan h,ahammed gj,yu j,yao z等。肽果实发育中QPCR分析正常化最优参考基因的鉴定。前植物SCI。2017; 8:1-14。
- 53.
一种高效的蓝莓RNA分离方法及其内参基因的鉴定。植物细胞代表2011;30:2167-76。
- 54.
Kolde R. Package的图。2019年,1 - 8。
致谢
我们感谢John Doyle帮助温室的实验设置。我们感谢Anish Malladi和Dayton Wilde批评稿件。
脚注
不适用
资金
本出版物由美国农业部(USDA)农业营销服务部提供支持,通过授予16SCGPGA0010。其内容完全是作者的责任,不一定代表美国农业部的官方意见。
作者信息
从属关系
贡献
AM-G和Sun构思了该研究并设计了实验。AM-G参与了用于显微镜和基因表达的样品的数据收集和处理。AM-G和Sun参与了数据分析,编写数字和准备稿件。作者读并批准了最终的稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表1。
底漆CaExpas.和参考基因。
附加文件3:图2。
相对记录性丰度为10CaEXPA花卉和水果开发的基因。这10CaEXPA基因在图2中的果实显影期间显示了相对较低的转录性丰度。3..值是手段和标准误差至少三个重复。采用Tukey’s HSD进行均值分离,采用方差分析进行显著性检验(α = 0.05)。意味着不同的字母显着不同。
附加文件4:图3。
甜椒,番茄,拟南芥和稻米膨胀蛋白的系统发育分析。使用emga 7.0中的邻居加入方法进行系统发育树,具有1000个引导模型。番茄序列是从[12.],来自Tair的拟南芥(https://www.arabidopesis.org/browse/genefamily/expansin.jsp.)[14.];和大米(http://personal.psu.edu/fsl/expcentral / shrot_species.htm#rice%20序列)[18.].
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Mayorga-gómez,A.,Nambeesan,S.u。果实表达模式的果实特异性α-扩展蛋白在甜椒中的细胞扩张期间(甜椒L.)。BMC植物BIOL.20.241(2020)。https://doi.org/10.1186/s12870-020-02452-020-02452-020-02452-020-02452-020-02452-0.
关键字
- 细胞壁松动
- 基因表达
- 果实增长和发展
- 水果成熟
- 灯笼椒