摘要
背景
从理论上讲,通过全基因组重复产生的副骨基因应由于其相同的序列和染色质环境而享有相同的表达水平。然而,由于进化的选择性压力,出现了功能性分歧和表达差异。需要综合对各种应力响应各种应力和表达水平与寄生虫葡萄球序列之间的相关性的表达模式的综合研究。
结果
在本研究中,我们分析了不同胁迫条件下拟同源基因的表达模式,并探讨了拟同源基因的表达水平与序列差异之间的关系。我们分析了四种不同胁迫(干旱、寒冷、感染和草食)下拟南芥的差异表达模式,并根据其表达模式将其分为三种主要类型。进一步分析了不同胁迫下的差异表达模式,并构建了相应的差异表达同源基因与转录因子的共表达网络。最后,我们研究了拟对数的表达水平与序列分化度之间的相关性,发现了拟对数的表达水平与序列分化度之间的正相关关系。在序列分化方面,我们发现了选择压力与系统发育关系之间的相关性。
结论
这些结果揭示了拟对数在环境胁迫下的不同表达模式,有助于理解表达水平与序列差异之间的关系。
背景
几项研究发现,大多数植物都经历了多次全基因组复制(WGD) [1那2那3.,它长期以来被认为是一种重要的进化力量。在被子植物进化中单子叶和双子叶分化之前,至少有一个古老的WGD发生。例如,拟南芥最近经历了两次WGD事件,最近一次发生在大约2300万年前(Mya) [4.].大豆(大豆)亦经历了两次世界发展大会[5.,大约发生在米亚59年,然后是米亚13年。WGDs可以复制整个染色体,从而产生大量重复基因。这些重复基因被认为在增强生物体对环境的适应和促进物种多样化方面发挥着重要作用[6.那7.那8.那9.].在整个进化过程中,复制基因的功能有显著的差异,尽管大多数复制基因已经丢失[10.那11.].
虽然许多机制可以解释重复基因的功能差异,但通过WGDs产生的副同源基因最初应该共享相同的序列和染色质环境,并具有比其他重复类型更强的表达相关性[12.].理论上,在没有选择压力和压力的情况下,拟对数应该具有相同的表达水平[13.,因为它们有相同的序列。经过数亿年的进化,由于选择压力和恶劣的环境,产生了功能差异和表达差异[14.].基因调控区域的差异可能改变了它们的表达模式,而编码区域的变化可能导致了新的功能的获得[15.那16.那17.].因此,基因表达差异是拟对数的重要进化动力。
几项研究检测了序列和表达分歧的关系[17.那18.那19.那20.那21.].Warnefors和Kaessmann研究了哺乳动物中基因和蛋白质表达的分歧与鉴定了几个正相关性之间的相关性[22.].然而,一项关于向日葵的研究表明两者之间没有相关性。相反,这项研究描述了基因表达和序列差异之间的解耦[23.],在捕蝇器种中报告的类似结果[24.].此外,许多研究已经证实,高表达水平的基因比低表达水平的基因进化得慢[25.[还报道了表达分歧和选择性压力之间的相关性。例如,研究果蝇表明正向选择与表达分歧密切相关[26.],而其他人报告说净化选择是表达和序列中分歧的主要驱动力[27.].因此,重要的是要知道是否表达旁曲甙的发散性之间存在相关性,这可能是植物中的选择性压力所产生的。
我们调查了四种不同类型的压力(两个生物学应力和两种非生物胁迫)下常规表达模式和表达分歧拟南芥.此外,我们还发现了层序散度与选择压力之间的相关性。最后,我们构建了不同表达模式和相关转录因子的拟对数共表达网络。图S显示了本研究中不同步骤的流程图1.
结果
同源物识别和Parayog表达分类
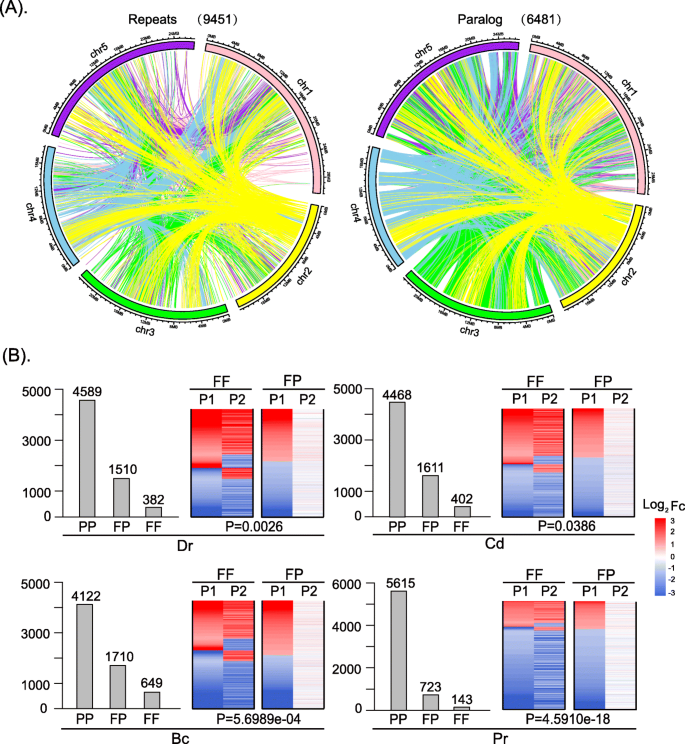
我们在模式植物中鉴定了6481个同源基因对拟南芥基于同源性分析,涉及使用inparanoid 8软件的20种其他物种(参见方法章节详情)[28.].表S列出了6481条平行对数1.21个物种的系统发育关系来源于Lian et al.和Ren et al. [2那29.].随后,我们分别分析了平行对数和重复序列在染色体中的相互作用和分布(图。1一种)。相应的交互信息呈现在表S中2和表年代3..重复拟南芥使用RepeatMasker和HashRepeatFinder工具进行识别(在方法部分)。这些结果表明,拟对数和重复序列在位置和相互作用方面具有高度的一致性,对应的符合率为82.4%。这进一步证实了副同源基因对大多是通过基因组复制产生的,包括WGDs和小规模复制(ssd) [2那30.].
接下来,我们将谬误分类为三种类型(FF, FP或PP)(参见方法的表达模式,包括两种生物胁迫(坏死营养真菌感染)葡萄孢菌那公元前;和食草性,通过咀嚼幼虫地区rapae那公关)和两种非生物胁迫(干旱[博士]和冷[光盘])。我们鉴定了382、1510和4589对FF、FP和PP的差异表达对博士压力;402,1611和4468差异表达对FF,FP和PP Paralogs对光盘压力;649、1710和4122对FF、FP和PP的差异表达对公元前压力;和143,723,5615对FF, FP, PP的差异表达对公关压力,分别(无花果。1b).四种不同应力下的FF、FP、PP副对数列表见表S4..采用Mann-Whitney软件检测4种胁迫下FF和FP基因表达差异的统计学意义你以及(无花果。1b)。当他们的时候被认为是显着的P.-value小于0.05。四种不同应力下FF和FP并行对数的log2|FC|值见表S5..通过计算,我们还研究了四种不同应力类型下共同表达的FF平行对数皮尔森系数R..共表达FF谬误的比例为77.4%博士压力,84.3%光盘压力,79%公元前压力,93%公关压力(图。1b).阈值皮尔森系数是r >0.5.
这些结果表明:(1)大多数并行基因不表达或差异表达,只有一小部分并行基因同时存在差异表达,表明大多数并行基因不参与胁迫响应机制;(2)应激反应中不同拟合基因的表达模式存在显著差异,特别是FF和FP拟合基因,说明这些差异拟合基因(DEPs)在应激反应中存在显著差异;(3)在四种不同的环境胁迫下,大多数具有FF表达模式的拟对数的表达模式趋于相似。
在生物和非生物胁迫下的同源基因的差异表达模式
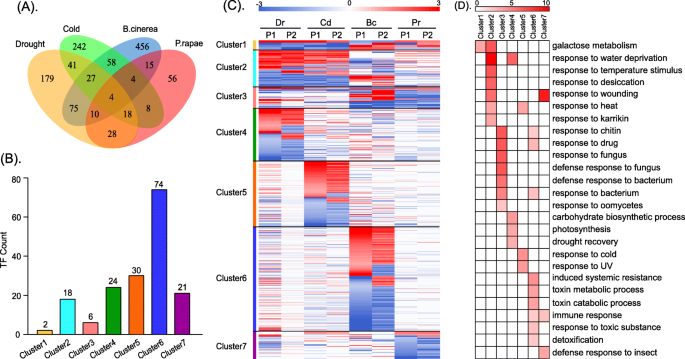
为了研究FF和FP在四种不同胁迫下的差异表达模式,我们生成了它们重叠的Venny图(图2)。2FF,图S2《外交政策》)。首先,我们根据1052个FF和2703个FP在不同胁迫下的不同表达模式,将其聚类为7个表达模块。7个FF和FP表达簇的log2|FC|值见表S6.和表年代7.,分别。对应的热图和FF和FP副对数的具体功能如图所示。2和S2,分别。此外,我们还鉴定了每个簇中的转录因子(TFs)。在四种不同应激类型中,属于前三簇的FF和FP平行对数均有差异表达。属于后四簇的平行对数仅在一种应力类型中有差异表达。我们还对FF并行对数进行了功能富集和KEGG分析,为每个模块分配功能类别(图)。2d)。
聚类1包含4个dep,其中2个是TFs,所有四种应激类型共享(图)。2a - c)。功能富集分析表明,这4个副logs主要参与半乳糖代谢,其中2个为TFsbHLH转录因子。这些结果表明,植物需要更多的能量来应对恶劣的环境,这已被最近的一项研究证实[31.].聚类2包含90个差异表达的同源基因,其中18个是转录因子,它们被非生物胁迫共享(博士和光盘) (图。2a - c)。簇2中的DEPS的功能主要涉及对各种非生物应激的响应,例如水剥夺,温度波动和KARRIKIN(图。2d).研究证实,这些基因参与了脱落酸的生物合成,提高了植物的非生物耐受性拟南芥当过表达(32.那33.].卡里基因是一种信号分子,发现来自燃烧植被的烟雾,并且触发了许多高昂的种子萌发[34.].这可能是植物在对干旱、寒冷和高盐度等恶劣环境条件作出反应时所使用的一种保护机制[35.].聚类3包含33个差异表达的同源基因,其中6个是生物胁迫共享的转录因子(图3)。2a - c)。相应的功能主要涉及对各种生物胁迫的响应,如抵御真菌、细菌和卵菌的攻击以及免疫过程。我们确定了5个差异表达WRKYTFs (WRKY6那WRKY40那WRKY54那WRKY70和WRKY18),反映了重要作用WRKYTFs对生物应激的反应。例如,WRKY70和WRK54参与基础防御机制Hyaloperonospora parasitica以及拟南芥的抗病能力[36.].另一方面,WRKY6和WRKY40在转换中发挥重要作用依照-hexenal perception,是一种绿叶挥发物(GLV),在受到伤害、食草性或病原体感染时产生[37.].
关于簇4至7,我们鉴定了179(含有24个TF),242(含有30个TF),456(含有74个TF)和56个常见性(含有21个TF)的差异表达博士那光盘那公元前, 和公关压力,分别。以下共表达谬误的比例分别为6.9、6.6、8.6和20.4%博士那光盘那公元前和公关压力,分别(无花果。2a - c)。聚类4的功能富集表明,179个副对数主要富集于碳水化合物的生物合成、光合作用和干旱恢复。此外,bHLH负调节茉莉酸酯信号,并提高对干旱胁迫的耐受性[38.].聚类5的功能主要集中在对寒冷和紫外光的响应上。如前所述,这些基因参与了昼夜振荡和β -淀粉酶生物合成,这增加了拟南芥PSII光化学反应对冰冻和环境胁迫的敏感性[39.那40].聚类6和7的功能主要富集于系统抗性、毒素代谢、免疫应答和保护昆虫(图。2d)。
这些结果表明,具有不同表达群集的副葡萄糖参与不同的生物学过程并具有不同的生物学功能;(2)在暴露于不同类型的应力期间,具有功能冗余的副胆基基因差异表达,(3)副基因基因的表达模式可以在不同的应力条件下变化。
同一类型应力不同程度下副对数的不同表达模式
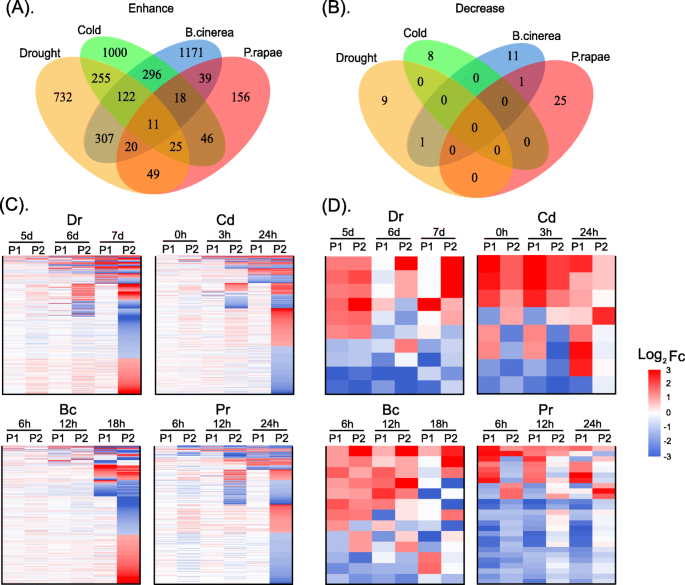
我们接下来研究的影响,不同程度的强调假字的表达模式和分类根据表达水平的假字分为两类,我们定义为增强表达式模式(PP→FP→FF)和减少表达式模式(FF→FP→页)(无花果。3.).我们确定了1521和10,1773和8,1985和13,以及364和26,增强和减少伞病博士那光盘那公元前, 和公关压力,分别(无花果。3.a, b).四种应力下副对数的log2|FC|值随增强和减小的规律见表S8.和表年代9..
在增强表达模式方面,在不同应力开始时,拟对数不表达或有差异表达。随着压力的延长或增加,更多的副对数出现了差异表达(图。3.a, c).在最强的阶段博士那光盘那公元前和公关压力,Deps的比例均达到100%。帕拉洛的功能富集表明,那些响应的人博士胁迫主要涉及与水分剥夺和光合作用相关的过程[41.,那些对光盘应力主要涉及与温度波动和冷相关的过程[42.,那些对公元前应激主要参与与保护细菌感染相关的过程[43.,以及那些对公关压力主要参与与防御反应和免疫事件有关的过程[44.].此外,我们还发现,在至少两种不同类型的应力中,某些增强的杂合态同时存在差异表达,且杂合态在应力中上调的比例博士那光盘那公元前和公关用另一种类型的应力共同增强分别为22.1,22.6,14.5和20.1%(图。3.c).这些结果表明,大多数副对数可以对几种类型的压力作出反应或被激活。255个对两者都有响应的谬误的功能富集分析博士和光盘应力证实了在缺水和温度波动方面的功能冗余。11条平行对数的函数(图。3.A)四种胁迫的共同特点主要是富集离子稳态和生长素转运[45.,据报道,它们与各种各样的压力反应有关[46.那47.].
对于减少表达模式,在不同类型的应力的发作中显着表达旁系蛋白酶。随着延长的应力,没有表达或差异表达更多的副葡萄(图。3.B,D)。副病毒的功能富集表明,那些响应的人博士和光盘胁迫主要参与单羧酸和羧酸生物合成过程。最近的研究报告称,这些小分子可以帮助植物适应极端的压力条件[48.那49.].
这些结果表明,在不同的应力类型和不同的应力程度下,拟对数的表达模式是不同的,表明拟对数的表达水平不仅与应力类型有关,而且与应力的严重程度有关。这些结果也揭示了大多数平行链在响应多种胁迫时的差异表达,表明平行链的功能冗余是植物在进化过程中适应不同胁迫环境的一种保护机制。
不同类型压力下的副帕拉洛和转录因子的共表达网络
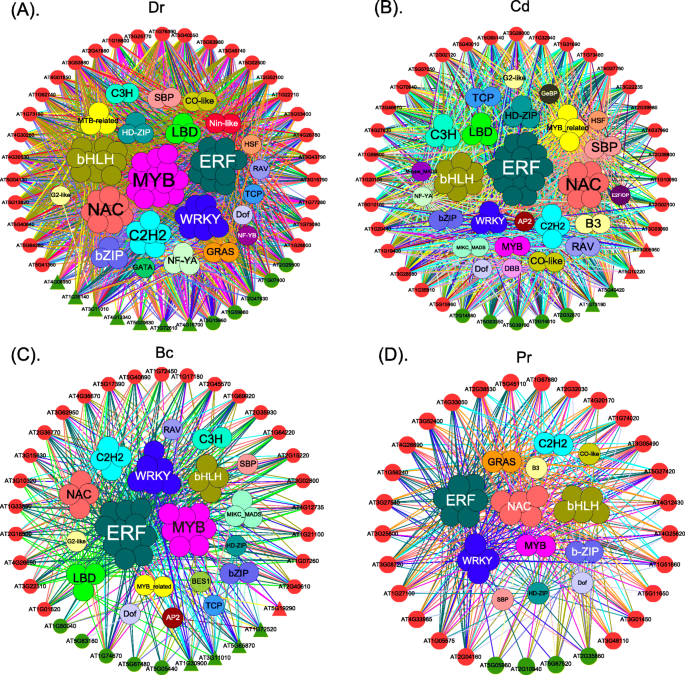
为了了解转录因子(TFs)如何在应激条件下调控DEPs的表达,我们构建了DEPs的共表达网络博士那光盘那公元前和公关压力(图。4.).
共表达网络揭示了几个重要的见解。首先,在增强和降低下调的DEPS的表达模式中博士那光盘那公元前和公关在胁迫下,除DEPs呈下降和增强两种表达方式外,DEPs均呈低表达博士压力。其次,与DEPs共同表达的前三名TFs为MYB那小块土地和bHLH下博士压力(图。4.一个);小块土地那bHLH和南汽下光盘压力(图。4.b);小块土地那MYB和WRKY下公元前压力(图。4.c);和小块土地那南汽和MYB下公关压力(图。4.d).先前的研究报道小块土地在对生物和非生物胁迫的反应中起重要作用[50.那51.那52.].例如,ERF9保护拟南芥免受虚构真菌的拟南芥,以及厌氧雷诺治疗 - 植物的主要防御机制[53.)是由ERF96[54.].一项研究也证实了这一点bHLH可以调节拟南芥中非生物和生物分子模式触发免疫之间的权衡[55.那56.].然而,MYB主要是对生物压力的反应[57.那58.].第三,我们识别了不同应激类型下的特定转录因子。例如,NIN-LIKE是拟南芥反应的主要调控因子吗博士压力(59.].E2FD / DEL2控制拟南芥细胞的增殖光盘压力(60.].BES1促进油菜素内酯信号传导和发育拟南芥在接触公元前压力(61.].最后,表达模式增强的dep与转录因子之间的相互作用比表达模式减少的dep与转录因子之间的相互作用更多(图)。4.).相互作用的数量增加表明,更多的TFS调节副病毒对增强压力严重程度的反应。这些结果对于了解TFS关于副葡萄球对压力的反应的监管机制非常有帮助。
表达分歧与序列分歧呈正相关
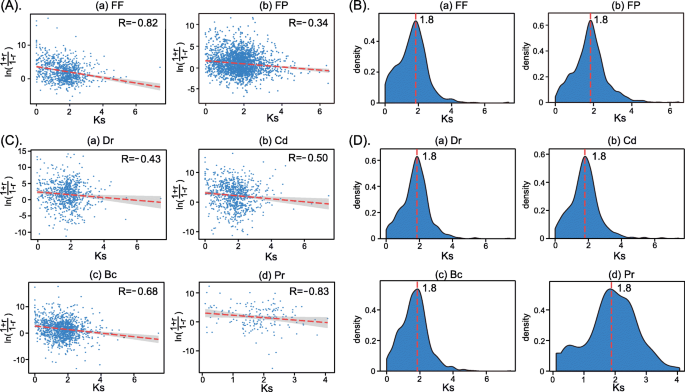
我们继续我们的研究,调查表达差异和序列差异之间是否存在正相关或负相关[62.].首先,研究了具有FF和FP表达模式的ParaLoGS。为了估算帕拉洛之间的序列分歧,我们计算了同义词(Ks)替代率,其被认为是序列发散时间的代理。根据以前的研究[21.那62.,我们使用重新标度的皮尔逊相关系数R.'执行线性回归分析(见方法详细信息部分)。FF和FP Paralogs表达水平的回归结果和Ks速率如图所示。5..
我们发现重新标度的结果之间存在显著的负相关R.”,KsFF和FP基因对的值(P. < 0.001,你以及,无花果。5.A). The negative correlation between TheR.”,Ks值表明表达差异与序列差异呈正相关。这些结果表明,FF和FP基因对的表达差异与序列差异呈正相关。此外,我们还研究了分布KsFF和FP平行对数的值,并在密度图中识别出一个值为1.8的峰值(图。5.这些结果表明,起源于1.8的基因对经历了大量的同义替换。超过80%的FF和FP谬误都有Ks大于1.0的值,表明它们持续存在相对较长的进化持续时间并且具有高度分歧。此外,基因对附近Ks峰值可能经历了更大的表达差异[63.].
我们还调查了DEPS与增强和减少表达模式的相关性的相关性博士,Cd, Bc和公关压力。我们发现表达散度与Ks所有四种压力的值(P. < 0.001,你以及,无花果。5.C).这些结果表明DEPs在胁迫下的表达差异与序列差异呈正相关。此外,相应的密度图卡和Ks值有一个Ks峰值1.8(图。5.D),表明这些基因在相对较长的进化过程中一直存在,并且高度分化。
综上所述,本研究揭示了副同源基因表达差异与序列差异之间的新相关性,为当前植物逆境适应的进化机制提供了新的认识。
选择性压力与Paralogs的表达分歧相关联
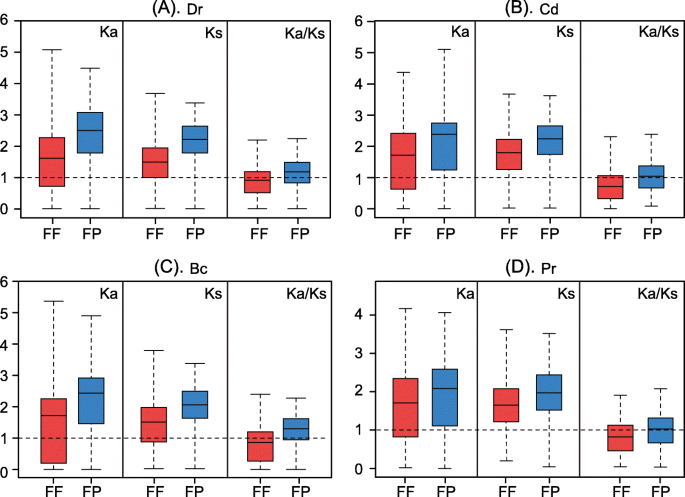
接下来,我们研究了表达差异与副同源基因的选择压力之间是否存在相关性。为了推断选择压力,我们使用FF和FP DEPs博士那光盘那公元前和公关强调计算它们的非同义/同义替换率比率(卡/Ks).的箱线图卡和Ks价值观,以及ka / ks.四种应力下FF和FP DEPs的比值如图所示。6..
这些结果揭示了两个重要的见解。首先,中位数ka / ks.4种胁迫下,FP基因对的比例均大于1.0,FF基因对的比例均小于1.0,说明FP基因对发生了正向选择,而FF基因对发生了净化/负向选择。第二,卡和Ks所有四种胁迫下的FP值均大于FF,表明FP基因对经历了更多的非同义/同义替换,且进化年龄大于FF基因对。为了确保我们观察到的现象不是由于偶然,我们将我们的结果与包含相同数量的随机基因对的随机实验进行了比较(图S3.那方法),发现了ka / ks.FF的比值始终小于1.0,而随机试验的比值[29.],但是ka / ks.FP的比率始终大于1.0,随机实验(P.< 10-4).通过10,000个随机比较确定统计学意义。
这些结果表明,FF副同源对的选择约束较为宽松,保留了功能冗余,而FP副同源对的正向选择较强,序列差异较大,导致了功能差异。这些发现表明,不同表达模式的拟象可能经历了不同的选择约束。
讨论
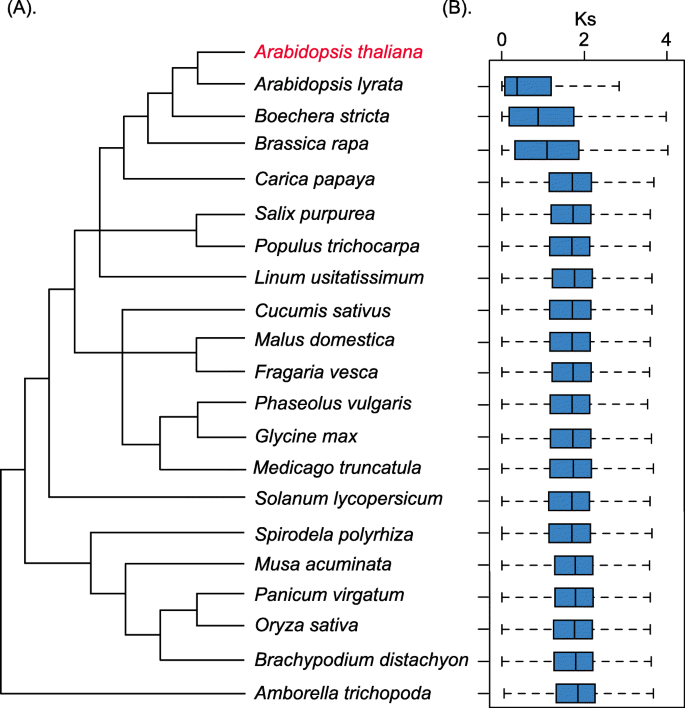
寄生虫的序列分歧支持物种之间的系统发育关系
为了探讨序列分歧和系统发育关系之间的相关性,我们研究了同义替代率(Ks)之间的副病拟南芥和20种其他物种(图。7.a).对应的箱线图Ks值如图所示。7.b。一般来说,小Ks值表明较少的同义替换和分歧以及强大的系统发育关系。图2中的结果。7.这三个物种,拟南芥lyrata那Boechera stricta., 和Brassica Rapa.,有更小的Ks值(分别为0.3707、0.878和0.905)拟南芥,与17种其他物种(大于1.0大)相比。这表明这三种种类的基因组显示出较少的发散和更紧密的系统发育关系拟南芥,这与被子植物的系统发育结果一致[64.].此外,我们确定了物种保护和家庭大小之间的成反比度相关(图。4.).随着物种的发生增加,帕拉洛的家庭大小明显减少。最近的一项研究提出了随着时间的推移对指数减少的模型[2].物种保护和家族大小之间的关系是否符合指数衰减模型还需要进一步的研究,因为这些结果可能会提高我们对重复基因进化的理解。
保守域和顺式元素
最近的一份报告证实,复制基因的表达差异主要归因于顺式元件的改变[65.]已经提出了介导大米中基因的表达分歧[66.].为了进一步评估顺式元素对表达分歧的影响,我们在所有21种中调查了常规蛋白酶的保守结构域和CIS-元素。
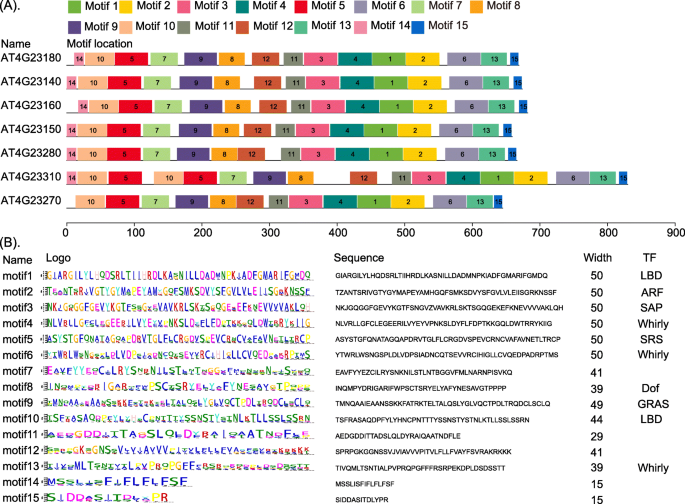
我们在所有21个物种中鉴定了一个具有7个基因的副同源基因家族,并使用CDD数据库鉴定了它们的保守结构域。最保守的蛋白结构域是丝氨酸/苏氨酸激酶(STKs)、白细胞介素-1受体相关激酶和相关STKs (STKc-IRAK)的催化结构域(图)。8.).STKs催化-磷酸化基从ATP转移到蛋白质底物上的丝氨酸/苏氨酸残基。IRAKs参与toll样受体(TLR)和白细胞介素-1 (IL-1)信号通路。因此,它们调节先天免疫反应和炎症[67.那68.].利用MEME软件,我们鉴定了STKc-IRAK的15个保守motif,发现大多数motif在转录因子中广泛存在,如的小黑裙那ARF.那树液那小旋风那SRS那景深和肝(图。9.a,b)。此外,所有21种中的七种基因共有类似的基因结构和基因长度。
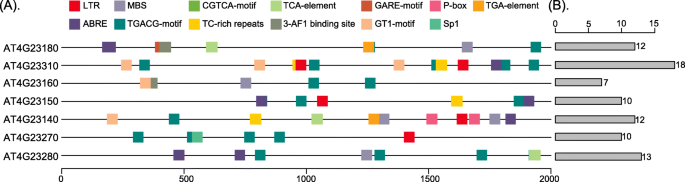
我们使用PlantCARE预测了STKc-IRAK基因家族的顺式元件变化,并在该副同源基因家族的2000 bp启动子序列中鉴定了13个与胁迫相关的顺式元件(图)。10.).前十名的组件如图所示。10.A,它们包括一个低温响应组件(LTR.),MYB参与干旱诱导的结合位点(MBS)、MeJA反应组分(CGTCA-motif)、水杨酸反应组分(TCA-element),赤霉素反应组分(GARE-motif和P-box.)、生长素反应元件(TGA元素)、脱落酸反应组分(ab)、MeJA元素(TGACG-motif),应力响应元素(TC-rich重复)及光学响应元件(3-AF1结合位点,gt1基序, 和Sp1).每个基因中确定的顺式元件的数量如图所示。10.湾其中,前两个元素是CGTCA-motif和TGACG-motif,占所有元素的25%。这些顺式元件都与应激有关,这表明它们可能参与了非生物应激和激素反应的转录控制[69.].
结论
在本研究中,我们分析了不同胁迫条件下拟合基因的表达模式,并探讨了拟合基因表达差异与序列之间的关系。首先,我们分析了四种不同应力(博士,Cd, Bc和公关),并根据其表达模式将其分为三种类型。其次,分析了它们在不同胁迫程度下的差异表达模式,构建了相应的差异拟合词与转录因子的共表达网络。再次,我们研究了表达散度与序列间的相关性,发现表达散度与序列散度之间存在正相关关系。最后,我们发现不同表达模式的拟合词可能经历了不同的选择约束。FF副同源对可能经历了宽松的选择约束,而FP副同源对经历了强烈的正向选择。这些结果表明,经历过放松选择的平行组在功能上往往是冗余的,而经历过强烈正向选择的平行组在功能上往往表现出更多的序列发散。这些结果提供了新的见解,以应对环境压力的不同表达模式,以及这些表达模式如何与序列差异相关。
方法
同源物识别和类比分类
我们使用带有默认参数的同系物分析软件InParanoid 8来识别之间的同源基因对拟南芥和20个其他物种,根据它们的系统发育关系(图。7.一种) [28.].拟南芥的基因组和注释文件和20种其他物种都从集团中下载(http://plants.ensembl.org)及UniProt (https://www.uniprot.org/)数据库。详细版本信息,详细版本信息请参见附件表S10..在20个原子性同源性比较结果中,将对应于一个正牙基因的多种拟南芥基因被筛选为候选寄生虫。为了分析一对基因之间的表达差异,我们选择了前两个ParaLoGS基因对,每个家庭中的最高相似性作为初步识别并除去冗余重复。通过使用全长氨基酸通过喷射对准验证最初鉴定的同源物对。根据E值和相似性,选择具有E值<10E-5和相似性的同源基因对≥50%。在Ensemblplant数据库中使用Paralogs进一步验证筛选结果(表S.1).去除相同基因对后,剩余6481对同源基因对。然后,根据在不同胁迫条件下是否有差异表达,我们将每个副同源基因对分为三种类型(FF、FP或PP)。FF同源基因是指在一对同源基因中,两个基因都有差异表达。FP同源基因是指一对基因中一个基因差异表达而另一个基因不表达或差异表达的同源基因对。PP同源基因是指一对同源基因中两个基因都不表达或差异表达。
转录组分析
的转录组数据拟南芥在干旱胁迫下,感冒压力,感染死神养殖真菌Botrytis cinerea,和食草性,通过咀嚼幼虫地区rapae从中国科学院获得生物项目加入号PRJNA525452获得(https://www.ncbi.nlm.nih.gov/bioproject/525452)[70].每个应激条件选取3个时间点,每个时间点都有单独的对照。见表年代11.转录组数据。在每个时间点,对每个单一和连续胁迫的转录反应与未处理对照或模拟处理对照进行比较。我们首先使用Trimmomatic-0.36软件删除低质量的rna测序reads,然后使用HISAT (Hierarchical Indexing for Spliced Alignment of Transcripts) 2-2.0.4绘制干净的reads以参考基因组,并使用默认参数生成bam文件。所有mapping reads的表达水平采用FPKM (Fragments Per Kilobase of transcript Per map reads)方法归一化。然后使用Cufflinks (V2.2.0)软件为每个基因生成FPKM值。利用EdgeR鉴定4种胁迫下差异表达基因(DEGs),参数分别为padj< 0.05和|log2FC| > 1 [71.].为了确定应力响应的最大动态范围,我们根据应力响应的发展速度,在三个时间点的不同时间框架内监测了四种应力的响应。在每个时间点,对每个单一和连续胁迫的转录反应与未经处理的对照(对于不涉及的治疗)进行比较B. Cinerea)或模拟处理的控制(100%的相对湿度条件,如在B. Cinerea治疗)进行比较。对照植物与应激处理的植物同时进行取样[70].对于差异表达模式,我们使用7_d的转录组数据博士压力,24 _h光盘压力,18 _h公元前压力和24小时公关压力。为了加强和减少表达模式分析,我们使用了5_d, 6_d和7_d的转录组数据博士压力,0_h, 3_h和24_h光盘Stress, 6_h, 12_h和18_h代表公元前压力,6_h, 12_h和24_h公关压力。
相互作用和分配分析
我们使用了RepeatMasker和HashRepeatFinder工具来识别重复序列拟南芥.将相似重复序列的阈值设置为85%,并去除小于150个核苷酸的重复序列。我们利用注释数据确定了重复序列和副对数在染色体上的位置,并使用R包GlobalOptions和Circlize确定了染色体上的相互作用和分布。
加权基因共表达网络分析
R内的加权基因共表达网络分析(WGCNA)封装总结并标准化了共表达网络分析的方法和功能[72.].利用WGCNA网络构建工具,通过计算表达值之间的相关性,生成基因的节点和边。节点与基因相对应,边缘由基因表达水平之间的成对相关性确定。R包中相应的调用函数是' blockwisemodule '。参数设置如下:powers = 10, minModuleSize = 30, mergeCutHeight = 0.25。其他参数保持默认设置。具有相关性的节点R. < 0.5 and edges with a weighted threshold of < 0.3 were removed. Afterwards, the Cytoscape tool (https://cytoscape.org/),利用保守基因的节点和边缘绘制相互作用图。
表达和序列差异分析
非同义(卡)和同义词(Ks)使用“的每个副病的替换dnds.'Matlab中的功能。ka / ks. > 1 indicates that the gene experienced positive selection,ka / ks.< 1表示该基因经历了负选择ka / ks.= 1表示基因经历了选择[73.].的箱线图卡和Ks值是使用“ggplot2.'R中的功能。Pearson系数R.的表达水平,使用'相关系数'函数在MATLAB中使用下列方程:
在哪里X和y表示不同时间点的两个基因的表达数据。
表达发散度用标度皮尔逊系数测量R.'[36.那62.,更适合于线性回归分析。
使用“lm'r内的功能,重新定位R.'。之间的负回归系数R.”,Ks(或卡)表示表达水平与Ks(或卡)值。
随机试验
我们模拟随机实验来测试统计显着性卡和Ks对于ff和fp pararogs [29.].当选择压力不是FF和FP基因对的特征时,随机试验结果与实际数据相似。为了实现这一目标,我们从6481个平行对数中随机生成了每个胁迫条件下相同数量的FF和FP基因对。我们重复随机实验10,000次,以评估这些随机配对的染色体内共定位。例如,测试的重要性Ks值为382 FF博士在压力下,我们从6481个平行对数中随机生成382个基因对,并计算它们Ks值,有10,000个副本。的频率分布卡和Ks比率,以及ka / ks.0.1步长如图S所示3..
统计方法
的Mann-Whitney你-test(功能'Matlab'R2016B中的功能'Ranksum')用于检查两个样本之间的统计显着性,默认意义水平为0.05。Mann-Whitney U-Test是一个非参数测试,适用于两个独立样本的群体中位等平等。该测试的主要优点是,它没有假设样品来自正常分布。
顺式元素和保守域分析
在线平台PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html.)用于顺式元素分析,利用7个拟对数的2000 bp启动子区域[74.].MOTIF elicitation(MEME)软件的多个EM(http://meme-suite.org/tools/meme.)用于motif发现。基序数为15,基序宽度为50个氨基酸。保守域数据库(CCD,https://www.ncbi.nlm.nih.gov/cdd/)用于分析保守的域序列[75.].使用Metascape工具实现功能丰富[76.],并产生的P.值经benjaminii - hochberg校正为Q值,错误发现率为5%。
数据和材料的可用性
21种植物的遗传资料见图。7.a,包括CDS序列和注释数据,从EnsemblPlants (http://plants.ensembl.org/)及UniProt (https://www.uniprot.org/)数据库。2296个转录因子(1717个位点)拟南芥下载自植物转录因子数据库(http://planttfdb.cbi.pku.edu.cn/index.php.).
缩写
- WGD:
-
全基因组复制
- 固态硬盘:
-
小规模的重复
- FF:
-
FF同源基因是指在一对同源基因中,两个基因都有差异表达
- 外交政策:
-
FP同源基因是指一对基因中一个基因差异表达而另一个基因不表达或差异表达的同源基因对
- PP:
-
PP同源基因是指一对同源基因中两个基因都不表达或差异表达
- 博士:
-
干旱
- 光盘:
-
寒冷的
- 公元前:
-
葡萄孢菌
- 公关:
-
地区rapae
- DEP:
-
差异表达假字
- KEGG:
-
京都基因和基因组百科全书
- TF:
-
转录因子
- Ks:
-
同义的
- 卡:
-
非同义词
- 度:
-
差异表达基因
- 舰队指挥官:
-
褶皱变化
- WGCNA:
-
加权基因共表达网络分析
参考
- 1。
梁Z, Schnable JC。全基因组复制后亚基因组和基因对的功能差异。摩尔。2018;11(3)。https://doi.org/10.1016/j.molp.2017.12.010.
- 2。
任瑞,王华,郭超,张宁,曾玲,陈勇,马辉,齐建军。被子植物全基因组重复对基因组复杂性和物种多样性的影响。摩尔。2018;11(3):414 - 28。https://doi.org/10.1016/j.molp.2018.01.002.
- 3.
Christenhusz MJM, Byng JW。世界上已知植物种类的数量及其每年的增长。Phytotaxa。2016;261(3):201。https://doi.org/10.11646/phytotaxa.261.3.1.
- 4.
巴克迈克尔S,海科V,埃里克SM。十字花科的古多倍性:Cleome转录组的分析阐明了拟南芥和其他十字花科基因组复制的历史。基因组生物学进展。2009;1(1):391-9。https://doi.org/10.1093/gbe/evp040.
- 5。
Roulin A, Auer PL, Libault M, Schlueter J, Farmer A, May G, Stacey G, Doerge RW, Jackson SA。多倍体植物基因组中复制基因的命运。植物j . 2013; 73(1): 143 - 53年。https://doi.org/10.1111/tpj.12026.
- 6。
Hegarty MJ,Hercock SJ。基因组线索与多倍体植物进化成功的基因组线索。Curr Biol。2008; 18(10)。https://doi.org/10.1016/j.cub.2008.03.043.
- 7。
Sémon M, Wolfe KH。四齿鱼和斑马鱼在其祖先全基因组复制后的互反基因丢失。趋势麝猫。2007;23(3):108 - 12所示。https://doi.org/10.1016/j.tig.2007.01.003.
- 8。
Yuannian J,Wickett Norman J,Saravanaraj A,ChanderbaliAndrés,Lena L,Ralph Paula E,Tomsho Lynn P,Hu Y,Liang H,Soltis Pamela S,Soltis Douglas E,Clifton Sandra W,Schlarbaum Scott E,Schuster Stephan C.那Ma H, Jim L-M, dePamphilis CW. Ancestral polyploidy in seed plants and angiosperms. Nature. 2011;473(7345):97–100.https://doi.org/10.1038/nature09916.
- 9.
Zhenzhen Y, Wafula Eric K, Honaas Loren A, Huiting Z, Malay D, Monica F-A, Kan H, Bandaranayake Pradeepa CG, Biao W, Der Joshua P, Clarke Christopher R, Ralph Paula E, Lena L, Altman Naomi S, Timko Michael P, Yoder John I, Westwood James H, dePamphilis Claude W. Comparative transcriptome analyses reveal core parasitism genes and suggest gene duplication and repurposing as sources of structural novelty. Mol Biol Evol. 2015;32(3):767–90.https://doi.org/10.1093/molbev/msu343.
- 10。
张恩,曾L,山H,MA H.高度保守的低拷贝核基因作为有效标志物的有效标志物在血管发育分析中。新植物。2012; 195(4):923-37。https://doi.org/10.1111/j.1469-8137.2012.04212.x.
- 11.
林奇M,Conery JS。作用的进化命运和二份基因的后果。科学。2000; 290(5494):1151-5。https://doi.org/10.1126/science.290.5494.1151.
- 12.
魏玉鹏,魏西银,田海宝,徐涛,菲克林SP, Alex FF。基因复制模式对遗传新颖性和冗余性的贡献不同,但在不同被子植物中表现相似。《公共科学图书馆•综合》。2011;6 (12):e28150。https://doi.org/10.1371/journal.pone.0028150.
- 13。
通过剂量亚功能化的重复基因的维持和丢失。分子生物学和进化。2015年,32(8):2141 - 8。https://doi.org/10.1093/molbev/msv095..
- 14。
Ho-Huu J,Ronfort J,De Mita S,Bataillon T,Hochu I,Weber A,Chantret N.在药用血糖酰胺(L.)中的三个近三个副寄生基因对中的选择性压力对比模式。BMC EVOL BIOL。2012年。https://doi.org/10.1186/1471-2148-12-195.
- 15。
李文辉,杨静,顾欣。重复基因的表达差异。趋势麝猫。2005;21(11):602 - 7。https://doi.org/10.1016/j.tig.2005.08.006.
- 16。
基因复制的进化:模型的分类和区分。李志刚。2010;11(2)。https://doi.org/10.1038/nrg2689.
- 17。
王颖,王旭,王志强。基因组和基因复制与基因表达差异:来自植物的观点。中国农业科学。2012;1256(1):1 - 14。https://doi.org/10.1111/j.1749-6632.2011.06384.x.
- 18。
Nadeem K,Hu C-M,Waleed Ak,Emal N,Han K,Dong H,Xilin H.在多种非生物和植物激素胁迫下E2基因家族的演化和表达分歧Brassica Rapa..BioMed Res Int. 2018;https://doi.org/10.1155/2018/5206758.
- 19。
在针叶树中,表达差异与序列进化相关,但与正向选择无关。中国生物医学工程学报。2016;33(6):1502-16。https://doi.org/10.1093/molbev/msw032.
- 20.
蛋白质进化的生物物理模型:理解进化序列差异的模式。Ann Rev Biophys. 2017;46。https://doi.org/10.1146/annurev-biophys-070816-033819.
- 21.
高D,KO DC,天X,杨G,王L,王L.太平洋牡蛎蛋白激酶超家族中的重复基因的表达分歧。Evol Bioinforma。2015; 2015(4):57-65。https://doi.org/10.4137/ebo.s30230.
- 22.
哺乳动物表达差异与蛋白质差异相关的进化。基因组生物学进展。2013;5(7):1324-35。https://doi.org/10.1093/gbe/evt093.
- 23.
Moyers BT, Rieseberg LH。在次生木本向日葵中,基因表达的差异与编码序列的差异是分离的。acta botanica yunnanica(云南植物研究). 2013;74(7):1079-89。https://doi.org/10.1086/671197.
- 24.
Uebbing S, Künstner A, Mäkinen H, Backström N, Bolivar P, Burri R, Dutoit L, Mugal CF, Nater A, Aken B, Flicek P, Martin FJ, Searle SMJ, Ellegren H.基因表达的差异。摩尔生态。2016;25(9):2015 - 28。https://doi.org/10.1111/mec.13596..
- 25.
Eduardo PC。Rocha。寻求蛋白质进化的祖先。趋势类型。2006; 22(8):412-6。https://doi.org/10.1016/j.tig.2006.06.004.
- 26.
Nuzhdin SV。果蝇基因表达水平和蛋白序列的共同进化模式。中国生物医学工程学报。2004;21(7):1308-17。https://doi.org/10.1093/molbev/msh128.
- 27.
廖时序。在哺乳动物进化过程中,高表达基因和组织特异性基因的表达谱差异率低。生物医学进展。2006;23(6):1119-28。https://doi.org/10.1093/molbev/msj119..
- 28.
Gabriel O, Thomas S, Kristoffer F, Tina K, Messina David N, Sanjit R, Oliver F, Sonnhammer Erik LL。真核生物orthology分析的新算法和工具。核酸Res. 2009;38(数据库i): D196-203。https://doi.org/10.1093/nar/gkp931..
- 29.
连胜,刘涛,景胜,袁华,张志强,林志强。染色体共定位增强相邻基因的共表达、共修饰和进化保守性。BMC基因组学。2018;19:455。https://doi.org/10.1186/s12864-018-484.1..
- 30.
陈志强,陈志强,陈志强,等。拟南芥遗传多样性研究进展。科学。2007;317(5836):338 - 42。https://doi.org/10.1126/science.1138632.
- 31.
副y,上Y,康香港,金苏,金班,Nam Kh。Arabidopsis Holactinol合成1(Atgols1)负调节种子萌发。植物SCI。2018; 267:94-101。https://doi.org/10.1016/j.plantsci.2017.11.010.
- 32。
Jui-Hung C,Han-Wei J,En-Jung H,Hsing-Yu C,Ching-Te C,Hsu-Liang H,Lin T-P。拟南芥谷胱甘肽S-转移酶U17敲除突变体的干旱和盐胁迫耐受性归因于谷胱甘肽和脱落酸的综合作用。植物理性。2012; 158(1):340-51。https://doi.org/10.1104/pp.111.181875.
- 33。
Lee SY, Boon NJ, Webb AAR, Tanaka RJ。盐胁迫与脱落酸整合对RD29A的协同激活拟南芥.植物生理学杂志。2016;57(10):2147-60。https://doi.org/10.1093/pcp/pcw132.
- 34。
wmt, scaffold A, Sun YK, Flematti GR, Smith SM。拟南芥的卡瑞金反应系统。植物j . 2014:79(4)。https://doi.org/10.1111/tpj.12430.
- 35。
Lee S,SEO PJ,Lee H-J,Park C-M。NAC转录因子NTL4在拟南芥中促进干旱诱导的叶片衰老期间的活性氧物种产生。工厂J. 2012; 70(5)。https://doi.org/10.1111/j.1365-313X.2012.04932.x.
- 36。
WRKY54对拟南芥细胞壁相关防御机制的调控作用。《公共科学图书馆•综合》。2017;12 (8):e0183731。https://doi.org/10.1371/journal.pone.0183731..
- 37。
Rossana M, Han R, Silke A, Alessandra S, Spyropoulou Eleni A, de Vries M, Boersma Maaike R, Breit Timo M, Haring Michel A, Schuurink Robert C. WRKY40和WRKY6作用于拟南芥绿叶挥发性e -2-己烯醛的下游。acta botanica sinica(云南植物学报). 2015;33(6):1082 - 1086。https://doi.org/10.1111/tpj.12953.
- 38。
Masaru N,Nobutaka M,Marco H,Koo Abraham JK,Moreno Javier E,Kaoru S,Howe Gregg A,Masaru O-T。BHLH型转录因子,ABA-INDIBLE BHLH型转录因子/ JA-相关的MYC2样1,充当阻遏物,以在拟南芥中负面调节茉莉酸字信号传导。植物细胞。2013; 25(5):1641-56。https://doi.org/10.1105/tpc.113.111112.
- 39。
拟南芥中昼夜振荡基因和激素响应基因的比较转录组:植物对常见环境胁迫的昼夜节律时钟控制的日常反应。植物生理学报。2008;49(3):481-7。https://doi.org/10.1093/pcp/pcn008.
- 40.
卡普兰F,盖伊CL。拟南芥β -淀粉酶8的RNA干扰阻止了麦芽糖在冷休克时的积累,提高了PSII光化学效率对冷冻胁迫的敏感性。植物j . 2005; 44(5): 14。https://doi.org/10.1111/j.1365-313x.2005.02565.x.
- 41.
李俊丽,李志兵,李志军,李志军,张艳红。拟南芥PAL基因家族在植物生长发育和环境胁迫响应中的功能分析。植物杂志。2010;153(4):1526 - 38。https://doi.org/10.1104/pp.110.157370.
- 42.
Cuevas JC, López-Cobollo R, Alcázar R, Zarza X, Koncz C, Altabella T, Salinas J, Tiburcio AF, Ferrando A.腐胺参与拟南芥低温响应中脱落酸水平的调节和冷驯化。植物杂志。2008;148(3):1094 - 105。https://doi.org/10.4161/psb.4.3.7861.
- 43.
在拟南芥中,碳/氮调节剂ARABIDOPSIS TOXICOS EN LEVADURA31通过与PLANTS121的SYNTAXIN相互作用,控制白粉病真菌渗透对乳突的形成。植物杂志。2014;164(2):879 - 87。https://doi.org/10.1104/pp.113.230995.
- 44.
Raksha S,Seonghee L,Laura O,Elison B.两种叶绿体局部蛋白质:ATNHR2A和ATNHR2B,有助于拟南芥抗性疾病抗性期间的呼应。mol plantmicrobe相互作用。2018:MPMI-04-18-0094-R。https://doi.org/10.1094/MPMI-04-18-0094-R.
- 45.
Esmat有定位。不同铜胁迫下拟南芥叶绿体色素异构体对光合作用和铜稳态的贡献足底。2009;229(4):767 - 79。https://doi.org/10.2307/23390386.
- 46.
Gao H, Xie W, Yang C ., Xu J, Jingjun L ., Wang H., Xi C ., chafeng H. NRAMP2是一种跨高尔基网络定位的锰转运体。新植醇。2018;217(1):179。https://doi.org/10.1111/nph.14783.
- 47.
在拟南芥中,植物生长素极性运输和干旱胁迫的耐受性中,主要促进因子超家族转运体起着双重作用。植物细胞。2013;25(3):901 - 26所示。https://doi.org/10.1105/tpc.113.110353.
- 48.
在拟南芥mlo2突变体中,色氨酸衍生代谢物是抗真菌防御所必需的。植物杂志。2010;152(3):1544 - 61。https://doi.org/10.2307/25680756.
- 49.
Hartmann M,Zeier T,Bernsdorff F,Reichel-Deland V,Kim D,Hohmann M,Scholten N,Schuck S,BräutigamA,Hölzelt,Ganter C,Zeier J.Flavin单氧基酶产生的N-羟基己酸是关键元素植物全身免疫。细胞。2018:173(2)。https://doi.org/10.1016/j.cell.2018.02.049.
- 50.
Maruyama Y, Yamoto N, Suzuki Y, Chiba Y, Yamazaki K-i, Sato T, Yamaguchi J.拟南芥转录抑制因子ERF9参与了对坏死营养真菌的抗性。植物科学。2013;213:79 - 87。https://doi.org/10.1016/j.plantsci.2013.08.008.
- 51.
Jin J,Chuloh C,RHA LM,Nguyen VB,Jungmook K. cytokinin响应因子2(CRF2)和CRF3调节伴随拟南芥冷应激的横向根系。植物细胞。2016; 28(8):1828。https://doi.org/10.1105/tpc.15.00909.
- 52.
保罗·J,康普顿·玛格丽特·A,亚当斯·卡米·I,拉肖特·AM细胞分裂素反应因子4 (Cytokinin response factor 4, CRF4)是由寒冷诱导的,参与了抗冻性。植物学报。2016;35(3):573-84。https://doi.org/10.1007/s00299-015-1904-8.
- 53.
Tsai KJ,Chou Sj,Shih Mc。乙烯在厌食症后雷诺治疗期间在拟南芥的回收中起重要作用。植物细胞环境。2014; 37(10)。https://doi.org/10.1111/pce.12292.
- 54.
王雪梅,王雪梅,金桂。拟南芥叶片脱落酸对乙烯的影响。6.植物科学学报2015;https://doi.org/10.3389/fpls.2015.01064.
- 55.
minf, Ming-Yi B, chung - gun K, Wang T, Eunkyoo O, Lawrence C, Ho PC, cheng - hyun S, Seong-Ki K, Beth MM, Zhi-Yong W.拟南芥bHLH转录因子HBI1在拟南芥生长和病原相关分子模式触发免疫之间的平衡。植物细胞,2014,26(2):828 - 41。https://doi.org/10.1105/TPC.113.121111.
- 56。
吴恩奎,张佳英,B名益,奥古斯托,于胜,智勇。在拟南芥的下胚轴中,细胞伸长是通过一个相互作用的转录因子的中心回路来调控的。eLife。2014:3。https://doi.org/10.7554/eLife.03031.
- 57。
bHLH05是MYB51的相互作用伙伴,也是拟南芥中硫代葡萄糖苷生物合成的新调控因子。植物杂志。2014;166(1):349 - 69。https://doi.org/10.1104/pp.114.240887.
- 58。
Yang M. The FOUR LIPS (FLP) and MYB88基因有条件地抑制拟南芥子叶非气孔表皮细胞的产生。[J] .中国生物医学工程学报,2016;https://doi.org/10.3732/AJB.1600238.
- 59。
Yan D,Easwaran V,Chau V,Okamoto M,Ierullo M,Kimura M. lib样蛋白8是拟南芥中硝酸盐促进的种子萌发的主调节因子。NAT Communce。2016; 7:13179。https://doi.org/10.1038/ncomms13179.
- 60.
Rosangela S, Caterina M, Roberta G, Elisabetta U, Trinidad a - ij, Linda H-B, Catherine B, Rino C, Diego a。acta botanica sinica(云南植物学报),2010;40(4):457 - 461。https://doi.org/10.1007/S11103-009-9577-8..
- 61.
关键词:油菜素内酯,转录因子BES1,信号转导,发育拟南芥.植物细胞。2015;27(2)。https://doi.org/10.1105/tpc.114.133678.
- 62.
Liao X,BaO H,Meng Y,Plastow G,Moore S.牛基因组中的二份基因的序列,结构和表达分歧。Plos一个。2014; 9(7):E102868。https://doi.org/10.1371/journal.pone.0102868.
- 63.
李W-h,杨j,xun g.重复基因之间的表达分歧。趋势麝猫。2005;21(11):602 - 7。https://doi.org/10.1016/j.tig.2005.08.006.
- 64.
曾玲,张强,孙瑞,孔辉,张宁,马辉。基于保守核基因的被子植物系统发育的早期分化时间估算。Nat Commun。2014;5:4956。https://doi.org/10.1038/ncomms5956.
- 65.
Senda J-D,Juan P-A,Jordi G-F。重复的CIS-SCOUNDATION元素在美氮菜人演进中的影响:DDI模型或简单的新奇。简短的Funct基因组蛋白质组学。2009; 8(4):266-75。https://doi.org/10.1093/bfgp/elp029.
- 66.
Zhenhui Z,Lin L,Meilian C,Lin L,Xiaofeeng C,Lin Y,Xi C,王Z,正义N,Zheng H.表达分解作为稻瘟病稻瘟病两种稻亚种采用的进化替代机制。米饭(纽约,N.Y.)。2019; 12(1)。https://doi.org/10.1186/s12284-019-0270-5.
- 67.
Vijayakumar G, Shaherin B, Prasannavenkatesh D, Sangdun C, Uversky VN。IRAK家族成员的分子进化和结构特征。7。2012;(11):e49771。https://doi.org/10.1371/journal.pone.0049771..
- 68.
李晓明,邹,郑,花田,寇介,邵新汉。植物类受体激酶/小秋基因的进化历史和胁迫调控。植物杂志。2009;150(1):12-26。https://doi.org/10.1104/pp.108.134353.
- 69.
Hanada K, Kuromori T, Myouga F, Toyoda T, Shinozaki K, Walsh B.增加表达和蛋白差异与形态多样化相关。公共科学图书馆麝猫。2009;5 (12):e1000781。https://doi.org/10.1371/journal.pgen.1000781.
- 70.
Coolen S, Proietti S, Hickman R, Davila NH, Olivas P-PH, Van Verk MC, Van Pelt JA, Wittenberg AHJ, De Vos M, Prins M, Van Loon JJA, Aarts MGM, Dicke M, Pieterse CMJ, Van威斯SCM。拟南芥在连续的生物和非生物胁迫中的转录组动态。植物j . 2016; 86(3): 249 - 67。https://doi.org/10.1111/tpj.13167.
- 71.
基于负二项分布的差异基因表达分析。海洋技术与环境学报;2009; 2(2)。https://doi.org/10.1016/j.tig.2007.01.003.
- 72.
加权相关网络分析的R包。BMC生物信息学。2008;9(1):559。https://doi.org/10.1186/1471-2105-9-559..
- 73.
Yang Zh,Nielsen R,Goldman N,Pedersen Amk。氨基酸位点在异质选择压力的密码子替代模型。遗传学。2000; 155(1):431-49。https://doi.org/10.1002/1526 - 968 x (200005) 27:1 < 32: AID-GENE50 > 3.0.CO; 2 t.
- 74.
Lescot M,DéhaisP,Thijs G,Marchal K,Moreau Y,Peer YVD,RouzéP,RomzéP,rombauts S. Plantcare,植物CIS作用调节元件数据库和用于启动子序列的硅分析的工具的门户网站。核酸RES。2002; 30:325-7。https://doi.org/10.1093/nar/30.1.325.
- 75.
GE, Hon G, Chandonia JM, Brenner SE。WebLogo:一个序列logo生成器。基因组研究》2004;14:1188 - 90。https://doi.org/10.1101/gr.849004.
- 76.
Zhou Y, Zhou B, Pache L, Chang M, Khodabakhshi AH, Tanaseichuk O, Benner C, Chanda SK. meta - scape为系统级数据集分析提供了一个面向生物学家的资源。Nat Commun。2019;10(1):1523。https://doi.org/10.1038/s41467-019-09234-6.
致谢
作者感谢匿名审稿人对手稿的评论。感谢TopEdit有限责任公司在本手稿编写过程中提供的语言编辑和校对。
资金
国家自然科学基金面上项目(no . 61501392, no . U1604112, no . 31701740);西安农业大学南湖青年学者资助项目。关键词:岩石力学,应力应变,数值模拟,数值模拟国家自然科学基金在研究的设计和数据的收集、分析和解释中发挥了作用。论文由西安师范大学“南湖青年学者计划”资助。
作者信息
从属关系
贡献
SL和YZ实现了算法并进行了实验。SL和LC起草了手稿。SL、YZ、ZZ和LC设计并分析了研究结果。LC、AG参与分析讨论。SL和TL贡献相同。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明没有存在竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
6481个同源基因。
附加文件2:表S2。
副对数的相互作用信息。
附加文件3:表S3。
重复的交互信息。
附加文件4:表S4。
在四种不同应力下,FF、FP和PP的列表是相似的。
附加文件5:表S5。
FF和FP在四种不同应力下的log2FC值均为平行对数。
附加文件6:表S6。
7个FF谬误表达簇的log2FC值。
附加文件7:表S7。
7个FP副对数表达簇的log2FC值。
附加文件8:表S8。
四应力增强模式下副对数的log2FC值。
附加文件9:表S9。
在四种应力作用下,副对数的log2FC值呈递减趋势。
附加文件10:表S10。
21个物种的版本信息。
附加文件11:表S11。
四种胁迫的转录组信息。
附加文件12:图S1。
显示本研究中进行的不同步骤的工作流程图。
附加文件13:图S2。
在四种不同的胁迫下,FP副对数的差异表达模式。(A)在四种不同类型的应力下,FP副对数的维恩图。(B).每一簇FP拟对数中转录因子的数量。(C).在四种不同类型的应力下,FP副对数的七个表达模块的热图。
附加文件14:图S3。
10,000次重复的随机实验的频率分布,以确定卡和Ks价值观,以及ka / ks.FF和FP DEP的比例在四种不同类型的应力下。海军蓝色对应于随机实验,而红色虚线对应于实际值。
附加文件15:图S4。
副同源基因对的物种保护与家族规模成反比关系。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
连,S.,Zhou,Y.,Liu,Z.et al。持续应力响应副病毒的差异表达模式表明表达和序列分歧。BMC植物BIOL.20.277(2020)。https://doi.org/10.1186/s12870-020-02460- 020-02460-x.
已收到:
公认:
发表:
关键字
- 副吡咯基因对
- 差异表达基因
- 全基因组复制