摘要
背景
热应激因子(Hsfs)在响应环境应激的信号转导通路中起着至关重要的作用。然而,Hsf茶树中基因家族的研究尚未深入(茶树l .)。
结果
在这项研究中,我们确定了25个CsHsf基因在c . sinensis通过系统发育分析将其分为A、B、C 3个亚家族。基因结构、保守结构域和基序分析表明,每个类的CsHsf成员相对保守。各种各样的独联体参与植物生长调控、激素反应、胁迫反应和光反应的启动子区CsHsfs.此外,降解体测序分析显示7CsHsfs可被9种miRNAs靶向。每个的表达模式CsHsf基因在8个组织中存在显著差异。许多CsHsfs干旱、盐胁迫和热胁迫以及外源脱落酸(ABA)和钙2 +.此外,CsHsfA2位于细胞核内。异源表达CsHsfA2转基因酵母耐热性提高,提示其在调节热应激反应中的潜在作用。
结论
Hsf的全基因组分析c . sinensis给出了全局识别和功能预测CsHsfs.其中大多数与茶树中控制各种非生物胁迫反应和信号转导途径的复杂基因调控网络有关。此外,的异源表达CsHsfA2转基因酵母耐热性增强。这些发现为研究脑功能分化提供了新的视角CsHsfs为进一步研究CsHsfs函数奠定了基础。
背景
多年来,随着两种主要茶树品种的基因组序列的公布:山茶花变种而且山茶花变种[1],一些转录因子家族已被确定,如侧器官边界(LBD) [2],同域亮氨酸拉链(HD-Zip) [3.]、赤霉素酸不敏感(GAI)、GA1抑制因子(RGA)、稻草人(SCR) (GRAS) [4], SQUAMOSA启动子结合蛋白样(SPL) [5,6],核因子y (NF-Y) [7],以及ccaat结合因子(CBF) [8].Hsfs是植物基因组中最大的转录因子家族之一,是信号网的组成部分,调节许多生物过程,特别是热应激(HS) [9,10].它们能特异性地识别HS元素(HSE;5 ' -AGAAnnTTCT-3 ')在hs诱导基因启动子中保守[11].虽然已从中国白梨中鉴定出许多Hsf家族成员(Pyrus bretschneideri) [12]、大白菜(芸苔属植物拉伯) [13),芸苔属植物oleracea[14),小麦[15),柳树suchowensis[16],以及五种模式被子植物(拟南芥,Cucumis巨大成功,栽培稻,杨树trichocarpa,葡萄) [17,18],没有系统的鉴定Hsf科中有茶树。说明CsHsfs茶树的功能和调控将为进一步的功能研究提供基础Hsf常绿木本作物的基因。
Hsf转录因子在植物对盐度、干旱、渗透胁迫、寒冷和HS等非生物胁迫的响应调节中起着至关重要的作用[9,19,20.].例如,HsfA2是植物的典型代表hsf,为hs诱导基因,调控下游应激反应基因亚群[19].过度的HsfA2从答:芥,玉米,百合longiflorum,或o .漂白亚麻纤维卷,赋予转基因拟南芥耐热性[21,22,23,24].GmHsfA1过表达也增强了HS下转基因大豆的耐热性[25].干旱和高温胁迫诱导表达HsfA3依赖于脱水响应元件结合蛋白2A (DREB2A) [26,27].虽然O. sativa HsfB2b热、盐、ABA (ABA)和聚乙二醇(PEG)处理诱导表达较强,冷胁迫不诱导表达;OsHsfB2b过表达增加了水稻的干旱和盐敏感性[28].然而,普通Hordeum hfb2c对大麦抗旱性有正向调控作用[29),而CmHSFA4而且AtHSFA7b分别正向调节菊花和拟南芥的耐盐性[30.,31].此外,OsHsfC1b而且T. aestivum HsfC2a过表达提高了转基因的耐盐性和耐热性o .漂白亚麻纤维卷小麦,分别是[32,33].除了其在应激反应中的作用外,值得注意的是向日葵的过度表达HsfA9转基因烟草提高种子寿命[34].因而,功能独特,具体Hsf来自不同种类的植物仍有待阐明。
茶树[茶树(l)O.昆子]是中国和世界上最重要的商业多年生常绿叶作物之一,用于生产无酒精饮料[35].大多数茶树品种是二倍体,基因组大小为30条染色体[36].作为无梗生物,茶树已经进化出一系列复杂的机制来应对波动的环境压力,如极端温度[37],干旱[38,39]、土壤酸化[40,41],以及重金属[42,43].长期炎热的夏季阻碍茶树生长发育,严重影响来年春茶的产量和质量[44].因此,有必要对茶树的耐高温机理进行研究,为今后茶树的耐高温栽培和育种提供依据。我们以前曾尝试使用抑制消减杂交方法发现关键的hs响应基因[45].然而,由于抑制消减杂交技术的限制和当时茶树基因组的不可得性,仅鉴定出12个差异表达的热响应基因,其中包括1个Hsf基因(45].尽管16CsHsfs已从c . sinensisRNA-seq数据[46],很少有关于全基因组鉴定的信息CsHsf基因是可用的。的潜在价值hsf在抗HS方面,有必要进行鉴别Hsf茶树基因组中的基因。在本研究中,我们开始了对C. sinensis Hsf假定的基因家族和表达模式CsHsfs对各种压力治疗的反应。我们还研究了热阻函数CsHsfA2使用酵母异源表达系统。这些发现为研究脑功能分化提供了新的视角CsHsf基因和植物物种遗传工程育种的基础。
结果
的识别Hsf基因家族c . sinensis
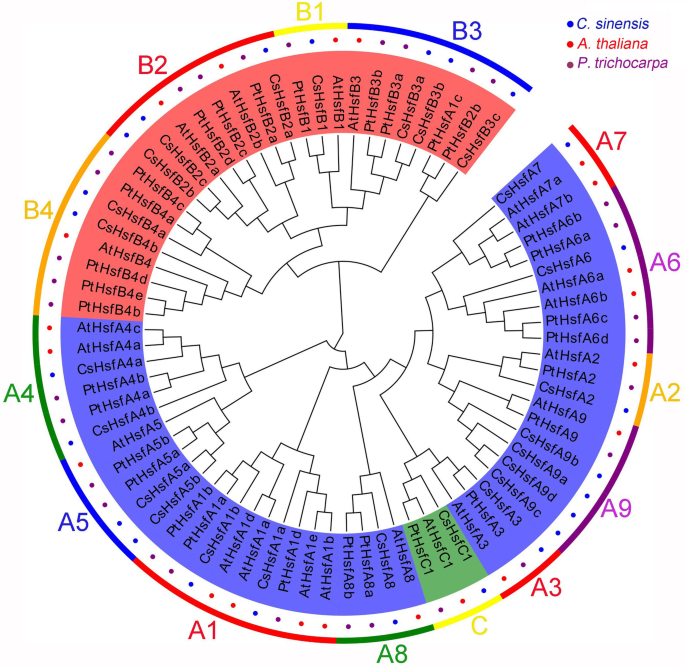
估计总共有25个Hsf基因是从c . sinensis品种‘疏茶早’基因组。委员会成员CsHsf根据HR-A/B区A、B部分柔性连接子长度的不同,将基因家族细分为A、B、C类,共15个CsHsfA基因,9CsHsfB基因和1CsHsfC基因(表1).的长度CsHsfs编码序列从624 bp (CsHsfA5a)至一九九八年bp (CsHsfA4b),含有207-665个氨基酸残基。CsHsfs的分子质量变化很大,从23.56 kDa (CsHsfA5a)到74.98 kDa (CsHsfA4b),计算的理论等电点从4.71 (CsHsfA9b)到10.01 (CsHsfB3c),亲水性的大平均(GRAVY)在−1.01 (CsHsfB3c)到−0.34 (CsHsfA9c)之间。此外,亚细胞定位预测表明,大部分CsHsf蛋白被预测位于细胞核中,而CsHsfA5a和CsHsfA8分别靶向于细胞质和叶绿体。详细信息见表1.
CsHsfs中保守基序和结构域的鉴定
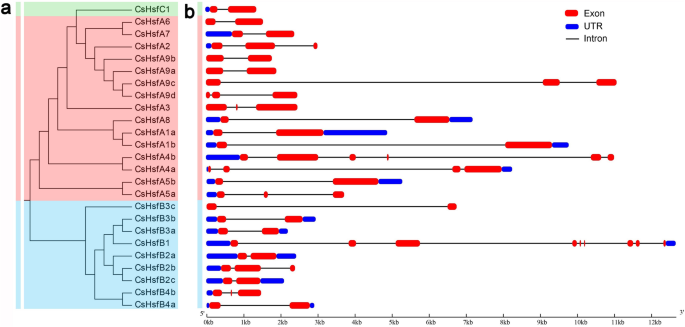
从CsHsfs中鉴定出25个保守基序[49].motif 1和3在所有的CsHsfs中都被发现,而motif 13只存在于A类CsHsfs(附加文件1:图S1)。此外,CsHsfBs和cshsfc中的基序数量均少于cshsfa,尤其是CsHsfB3c中仅有2个基序。
为了更好地了解CsHsf家族的结构特征,我们利用SMART方法鉴定了6个保守结构域,包括dnd结合结构域(DBD)、寡聚结构域(HR-A/B)、核定位信号(NLS)、核输出信号(NES)、激活子motif (AHA)和抑制子结构域(RD)。50], Pfam [51], NLStradamus [52]及NetNES [53)(表2).DBD是最保守的结构域,由3个α-螺旋和4个β-薄片组成,结构形式为α1-β1-β2-α2-α3-β3-β4。1).但CsHsfA5a、CsHsfA9c、CsHsfA9d和CsHsfB4b的DBD结构域未检测到完整的α3、β3和β4,这可能导致其序列较其他CsHsfs短。除了CsHsfA5a、CsHsfA5b、CsHsfA8、CsHsfA9c、CsHsfB3c、CsHsfB4a和CsHsfB4b外,大多数CsHsfs中也存在以线圈-线圈结构(coil-coil structure)为特征的HR-A/B2).此外,在大多数CsHsfs中检测到NES和NLS结构域,这些结构域对于CsHsfs在细胞核和细胞质之间的穿梭至关重要。此外,AHA和RD结构域是每个类所特有的。仅在A类CsHsfs中检测到AHA基序(CsHsfA5a和CsHsfA5b除外),在A2、A3和A4亚类中有4个蛋白具有2个AHA基序。除CsHsfB3c外,所有CsHsfB成员中均鉴定出四肽基序LFGV作为RD的核心。有趣的是,在CsHsfA5a和CsHsfB3c中只鉴定出一个DBD结构域。
CsHsfs的系统发育分析
为了评估Hsf家族之间的进化关系,使用25个蛋白质的Hsf序列生成了系统发育树c . sinensis, 21岁答:芥, 30个来自p . trichocarpa(无花果。2).根据该树可将cshsffs分为A、B、C三个主要类,其中A类包括来自9个子类(A1-A9)的15个成员,B类分为B1、B2、B3、B4子类,C类仅包含1个成员(CsHsfC1)。有趣的是,两个p . trichocarpaHsfs(即PtHsfA1c和PtHsfB2b)没有与其对应的子类聚类,但更接近于HsfA3子类。此外,与答:芥,p . trichocarpaHsfs更接近c . sinensisHsf蛋白质。
基因结构和独联体元素分析
的结构CsHsf通过比较其cDNA序列和基因组DNA序列,对基因进行分析。一般来说,大多数的CsHsf基因含有一个或两个内含子,而CsHsfA4b而且CsHsfB1分别由5个和8个内含子组成(图;3.).
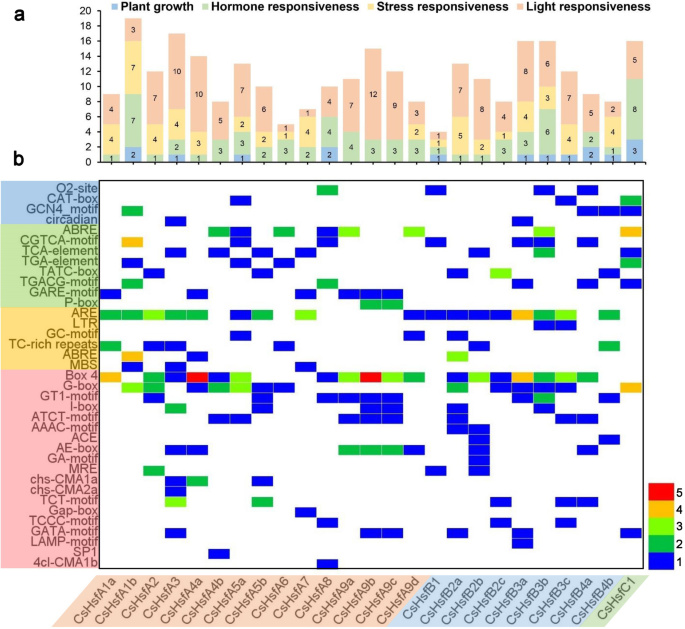
为了进一步研究潜在的调控网络CsHsf家族基因独联体-翻译起始位点上游2kb序列中的元素25CsHsf基因分析使用PlantCARE [54](附加文件2:表S1)。一共有37种独联体发现-元素,包括4个植物生长调控元素,8个激素响应元素,6个胁迫响应元素,19个光响应元素(图2)。4).其中与植物生长有关独联体-作用元件,4CsHsfs有o2位和CAT-box元素,5CsHsfs含GCN4基序CsHsfs有昼夜节律相关的元素。在激素响应性类别中,在8、8、7、4和11的启动子区域共检测到19个脱落酸响应元件(ABRE)、17个meja响应元件(CGTCA-motif和TGACG-motif)、8个水杨酸响应元件(TCA-element)、5个生长素响应元件(TGA-element)和17个赤霉素响应元件(GARE-motif、TATC-box和P-box)CsHsfs,分别。此外,许多人对压力敏感独联体-元素包括ARE(厌氧诱导元件)、LTR(低温响应性)、TC-rich repeats(防御和应激响应性)、GC-motif(缺氧特异性诱导性)和MBS(干旱诱导性)。光响应元件占了所有元件中最大的一部分独联体-元素,特别是Box 4元素,共有48个分布在25个CsHsf启动子区域。此外,G-box(23)、AE-box(11)和GT1-motif(10)参与光响应。总的来说,这些结果表明CsHsfs在激素处理,低温和干旱胁迫下茶树的反应。有趣的是,在这些样品中没有检测到HSE元素CsHsf启动子区域。因此,尚不清楚是否表达CsHsf基因受热应激条件的调控。
分析独联体的启动子区域中的-元素CsHsf基因。一个的和独联体-每个中的元素CsHsf在四个类别中,用不同颜色的直方图表示。b热图的个数独联体-每个中的元素CsHsf.植物关怀计划(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行分析。不同的颜色表示的数字独联体-元素,白色表示no独联体元。的启动子序列(翻译起始位点上游2000 bp)CsHsf基因在附加文件中列出2:表S1
MiRNA靶点预测
茶树降解文库(未发表的数据)被用来预测目标转录候选CsHsfs.如附加文件所示3.:表S2, 7 .CsHsfs被9个miRNAs靶向。CsHsfB3c有4个目标地点,CsHsfA4a而且CsHsfA4b有两个目标位点,而其他四个CsHsfs(即CsHsfA1a,CsHsfA1b,CsHsfB1,CsHsfA9d)只有一个目标地点。因此,我们推测单个miRNA可以调节多个miRNACsHsfs还有一个CsHsf可以被多种miRNAs调控。
表达谱CsHsf不同组织中的基因
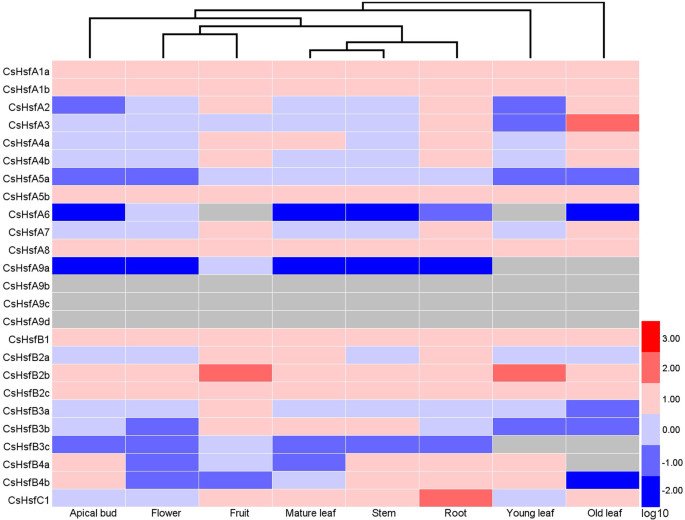
的表达模式CsHsf根据从茶树基因组数据库下载的转录组数据绘制了8个组织的基因热图[55].每个的表达模式CsHsf基因在8个组织中均有显著差异(图;5;额外的文件4:表S3)。CsHsfA3在老叶中高表达(值> 2),CsHsfB2b在果实和幼叶中高度表达,且CsHsfC1在根中高度表达。相比之下,CsHsfA6,CsHsfB3c,CsHsfB4a只在某些特定组织中表达。然而,表达CsHsfA9b,CsHsfA9c,CsHsfA9d在所有组织中都检测不到。
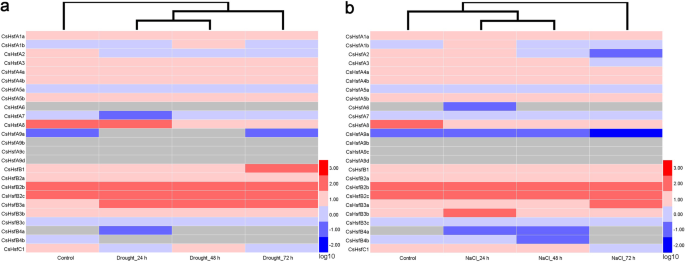
表达谱CsHsf基因对干旱和盐处理的反应
检查…的作用CsHsf基因对干旱和盐胁迫的响应,分析了这些基因的转录组数据。转录水平变化大于1.5倍的基因被认为受到显著调控。在经历了干旱和盐的压力后,大多数CsHsfs上调了,为什么CsHsfA1a而且CsHsfB4a下调(图;6;额外的文件5:表S4)。CsHsfB3a在干旱胁迫下显著上调(图;6一个),CsHsfA3,CsHsfA7,CsHsfB3a,CsHsfB3b,CsHsfB3c,CsHsfB4b在盐胁迫下显著上调(图;6b).有趣的是,的表达水平CsHsfA5a,CsHsfA7,CsHsfA9a,CsHsfB2c,CsHsfB4b在两种非生物胁迫下表现出相反的趋势,表明它们在茶树对干旱和盐胁迫的响应中可能具有不同的作用。
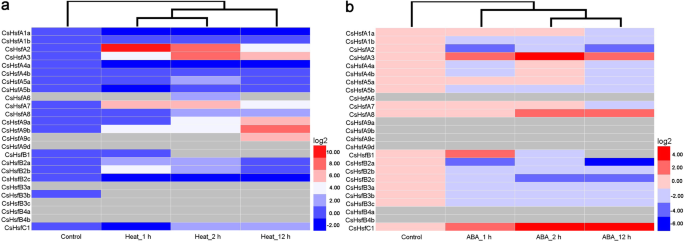
表达谱CsHsf基因对热和外源ABA处理的响应
为了进一步调查的反应CsHsf基因对加热和外源ABA处理的影响,我们分析了基因的表达谱CsHsfqRT-PCR检测基因。当暴露在热应激条件下,大多数CsHsfs有显著的上调,特别是CsHsfA2而且CsHsfA9b(无花果。7一个;额外的文件6:表S5)。相比之下,CsHsfA1a而且CsHsfB3b被抑制;然而,成绩单丰盈CsHsfA9d,CsHsfB3a,CsHsfB3c,CsHsfB4a,CsHsfB4b浓度太低,检测不出来。外源ABA处理后CsHsfA3,CsHsfA7,CsHsfA8,CsHsfB1,CsHsfC1显著增加,而其他9CsHsfs(例如,CsHsfA1b,CsHsfA2,CsHsfA5b,CsHsfB2a,CsHsfB2b,CsHsfB2c,CsHsfB3a,CsHsfB3b,CsHsfB3c)下调(图;7b;额外的文件6:表S5)。此外,还有抄本CsHsfA6,CsHsfA9a,CsHsfA9b,CsHsfA9c,CsHsfA9d,CsHsfB4a,CsHsfB4b是无法觉察的。
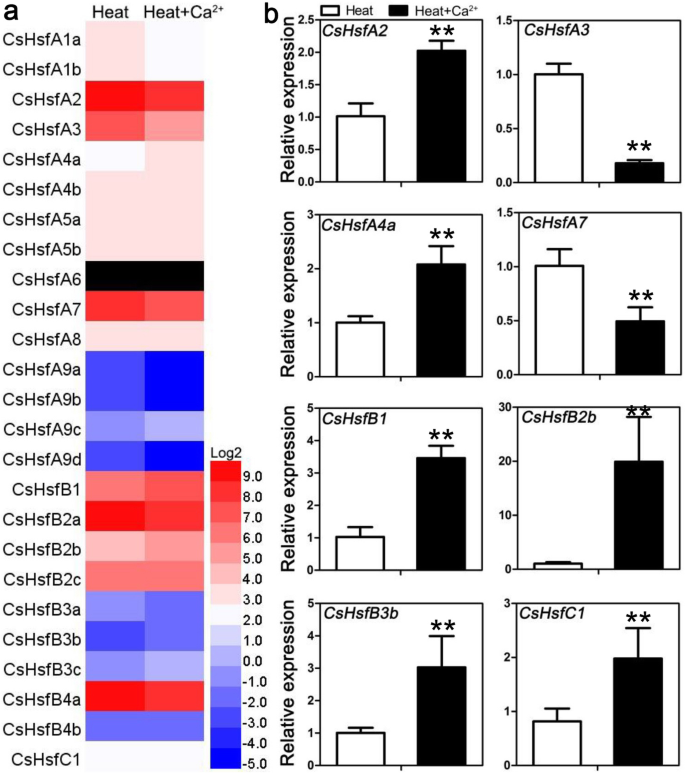
表达谱CsHsf外源钙处理基因
探究钙离子(Ca2 +)参与Hsf-介导的热应激反应,我们分析了CsHsf外源Ca对茶树叶片的影响2 +.根据RNA测序数据,的折叠变化CsHsfs超过1.3倍被认为是显著调控。当暴露于外源性Ca2 +,抄本丰富的CsHsfA4a显著上调;以及其他四种基因的转录水平CsHsfs(例如,CsHsfA4b,CsHsfB1,CsHsfB2b,CsHsfB2c)略有增加(图;8一个;额外的文件7:表S6)。有趣的是,剩下的表达式CsHsfs被抑制。这些结果表明,Ca2 +似乎与Hsf-介导茶树对热应激的反应。为了进一步确认RNA-seq结果的可靠性,4个上调,4个下调CsHsf用qRT-PCR方法检测同一茶树品种的基因(图;8b;额外的文件8:表S7)。结果表明,所选的表达方式有六种CsHsfs与RNA-seq数据有良好的相关性,而CsHsfA2而且CsHsfC1rna测序结果显示出相反的趋势。
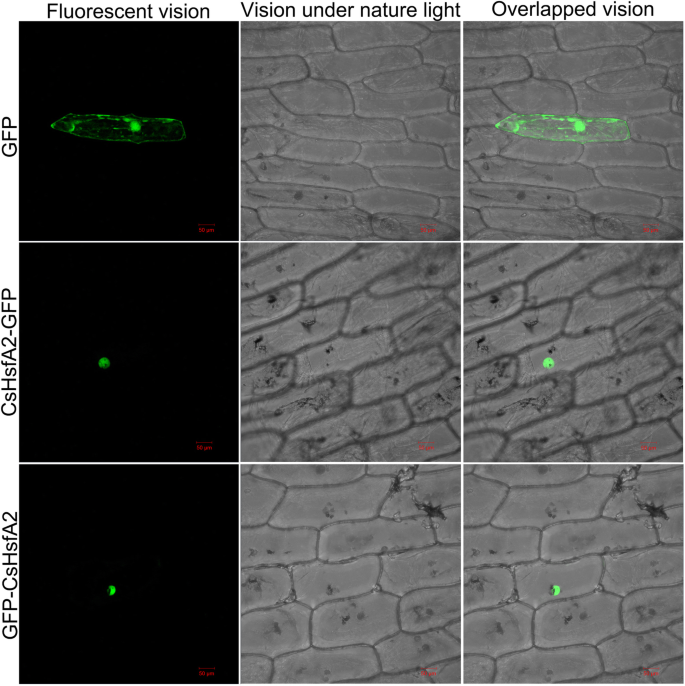
CsHsfA2在洋葱表皮细胞中定位于细胞核
CsHsfA2亚细胞定位分析选择热应激强烈上调。如图所示。9而CsHsfA2-GFP和GFP- cshsfa2信号弥散分布在洋葱表皮细胞的细胞核内。因此,CsHsfA2是一种核蛋白,可能是一种转录因子。
异源表达CsHsfA2赋予转基因酵母耐热性
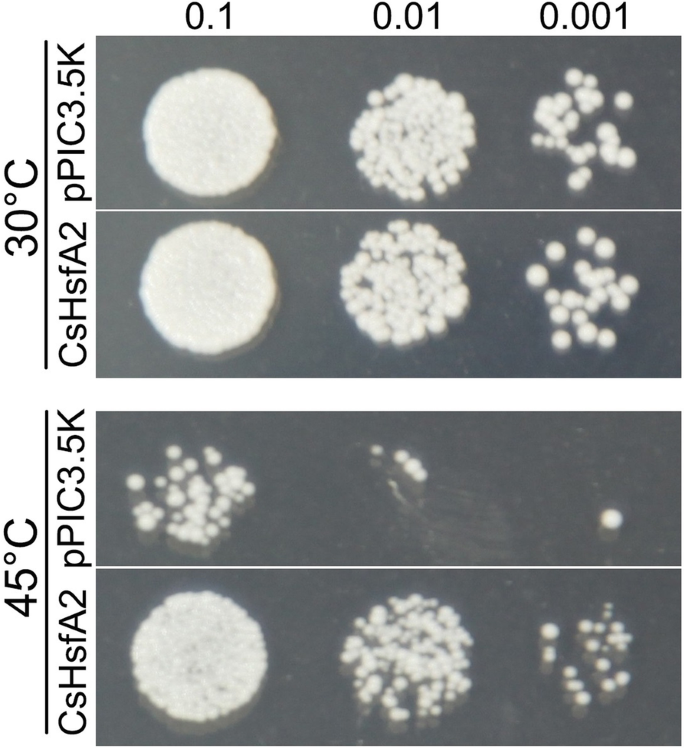
由于其在耐热性方面的主导作用[9]和强烈上调的表达,我们构建了酵母表达载体,并将其转化到酵母细胞中,以评估其可能的作用CsHsfA2这是对热应激的反应。在常温条件下(30℃),酵母细胞表达无明显差异CsHsfA2与空载体细胞(即pPIC3.5 K)相比(图;10).然而,当暴露于热应激时,酵母细胞的生长表达CsHsfA2比对照细胞好。这些结果表明CsHsfA2转基因酵母耐热性的提高。
讨论
茶树是一种多年生常绿木本作物,在其生命周期中必须应对各种非生物胁迫[57,58].之前的研究表明Hsf家族基因在应对非生物胁迫,特别是高温胁迫中起着至关重要的作用[59].因此,有必要对茶树中的Hsf家族进行研究。C. sinensis HsfLiu等根据RNA-seq数据首次鉴定出基因家族[46].然而,由于转录组数据的限制,没有参考基因组,只有16个CsHsfs被确定。在这里,我们利用了高质量的茶树参考基因组[60识别和描述CsHsfs家庭信息角度。
不同植物中Hsf家族的数量不同,有25个hsf胡椒、白梨29粒、芝麻30粒、大豆26粒、面包小麦78粒[12,61,62,63,64),分别。在这项研究中,我们确定了25个CsHsfs并根据它们之间的结构和系统发育关系将其分为A、B、C亚家族c . sinensis,答:芥,p . trichocarpa.子类的个数HsfA9茶树的成员由原来的1个成员增加到4个成员答:芥和番茄(餐桌1),提示进化过程中可能存在基因复制事件。可能是子类HsfA9在胡椒中也有四个成员[64].然而,扩张的原因CsHsfA9基因有待进一步的研究来阐明。CsHsfB3c的理论等电点为10.011),说明它是一种碱性蛋白,而其他CsHsfs为酸性蛋白,说明它们可能在不同的微环境中发挥作用[65].GRAVY结果均为阴性(表1),表明它们都是亲水蛋白,这与马铃薯的结果一致[66],康乃馨[67]、大白菜[68].
高度保守的DBD结构域由各种植物中约100个氨基酸残基组成[10].然而,值得注意的是,CsHsfA5a、CsHsfA9c、CsHsfA9d和CsHsfB4b的DBD比其他CsHsfs短(图2)。1;表格2),这可能是由于茶树基因组组装不完全所致。AHA结构域是HsfA亚群特有的,对于激活热休克蛋白(HSPs)的转录必不可少,但在CsHsfA5a和CsHsfA5b中未检测到,提示其可能通过与其他HsfA结合形成异质低聚物来发挥作用[69].系统发育分析表明,CsHsfs可分为三个主要类,与类相对应答:芥而且p . trichocarpa(无花果。2),与先前的报告一致[9,61,70].内含子长度有一定程度的变化(图;3.),与马铃薯等其他植物的蛋白质含量相似[66]和康乃馨[67].此外,一些同源基因在内含子数量、内含子长度和内含子位置上存在差异,这意味着它们的功能可能存在分化。
启动子分析表明,在数量和品种上独联体-每个中的元素CsHsf基因差异明显(图;4),这大概表明CsHsfs可由响应元件组合进行差异调节。此外,在这些样品中未检测到HSE元素CsHsf启动子区域,这暗示了这些与热有关的表达CsHsf基因可能不是由热应激直接诱导的[66,67].基因表达的确切机制有待进一步研究。进一步分析茶树降解数据表明,7CsHsfs预测被9个miRNAs靶向(附加文件3.:表S2),意味着CsHsfs可以在转录后水平进行调控,miRNAs与其靶标不是一一对应的[71],但这一假设需要实验验证。
基因表达模式的探索有助于理解它们的生物学功能[72].在本研究中,每一个表达谱CsHsf在8种不同的胁迫(即干旱、盐、热和外源ABA)下,研究了8种组织中的基因。几个CsHsfs显示组织特异性表达模式,如CsHsfA3在老叶里,CsHsfB2b在果实和嫩叶中CsHsfC1在根(图;5),表明这些CsHsfs可能与各种器官和组织的发育有关。然而,表达CsHsfA9b,CsHsfA9c,CsHsfA9d在茶树的根尖芽和幼叶等组织中均未检测到,对照样品(1个芽2个叶)的qRT-PCR分析证实了这一点,说明这3个成员在茶树中可能存在功能冗余。之前的研究表明hsf可受各种非生物应激,特别是热应激的调节[22,33,73].AtHsfA2该基因是一个关键的热诱导基因,也可在盐胁迫和渗透胁迫下诱导答:芥[74].有可能的是,LlHsfA2在百合中,热休克可诱导表达,而盐处理不诱导表达(百合longiflorum) [23].此外,CmHsfA4盐胁迫对菊花的诱导作用很强[30.].在这项研究中,转录CsHsfA2受到热、盐和干旱胁迫的高度上调(图;6,7),但被外源ABA下调,表明其在不同胁迫下的响应作用不同。AtHsfA3参与热和氧化应激反应[26,75),而CsHsfA3热、盐、干旱和外源ABA均可诱导。CsHsfA7发现热休克应激上调,这与我们之前的发现一致[45].过度的OsHsfA7转基因水稻耐盐耐旱能力增强[76),而AtHsfA7b正向调节植物耐盐性答:芥[31].因此,的特定功能CsHsfA7对热应激的反应仍有待阐明。TaHsfC2a-B通过aba依赖通路在小麦籽粒发育中发挥重要作用,以响应热胁迫[33].除了HS,CsHsf基因也受到ABA的调控(图;7b)。CsHsfA3,CsHsfA8,CsHsfB1,CsHsfC1的表达上调,而CsHsfA2,CsHsfB2a,CsHsfB2c被下调了,这意味着这些CsHsfs在aba介导的调控通路中发挥不同的作用。
Ca2 +是一种无处不在的二级信使,在应对各种环境压力中起着至关重要的作用[77,78].这里,外生Ca2 +预处理诱导CsHsfA4a在热冲击应力下(图;8),暗示其在Ca热胁迫响应中的潜在作用2 +信号通路,但验证这一假设需要进一步的研究。过度的AtHsfA4A对盐胁迫的耐受性答:芥[79].此外,异位过度表达BnHSFA4a增强了耐干燥性答:芥种子(80].然而,向日葵表达过度HaHsfA4a转基因烟草不具有耐热性[81].这些结果表明HsfA4s对不同的非生物压力的反应。有趣的是,的qRT-PCR结果CsHsfA2而且CsHsfC1表达与RNA-seq结果显示相反的趋势(图。8),这在其他研究中属正常现象[46,61,64],可能是由于FPKM和qRT-PCR的归一化方法不同。
以往的研究表明,大多数Hsfs定位于细胞核[64].在我们的研究中,CsHsfA5a和CsHsfA8被预测分别定位于细胞质和叶绿体,而其他23个CsHsfs则定位于细胞核(表2)1).为了进一步证实亚细胞定位预测,选择CsHsfA2、CsHsfA5a和CsHsfA8在洋葱表皮细胞中瞬时表达。有趣的是,CsHsfA2、CsHsfA5a和CsHsfA8融合蛋白定位于洋葱表皮细胞的细胞核(图5)。9;额外的文件9:图S2)。因此,亚细胞定位预测结果不能反映靶蛋白的真实位置,需要实验验证。值得注意的是HsfA2是抵抗热应激的关键热反应基因[9,22,82].由于茶树没有遗传转化系统,我们进行了异源表达CsHsfA2在真核模式生物酵母解剖的生物学功能CsHsfA2这是对热应激的反应。耐热性实验表明CsHsfA2改善酵母对高温的抵抗力(图;10).目的进一步阐明其功能及调控机制CsHsfA2在茶树中通过病毒诱导的基因沉默,正如我们实验室正在进行的那样,我们将能够解释茶树的特定分子机制CsHsfA2调节茶树的热反应。
结论
本研究对25株全长茶树进行了鉴定和比较分析hsf在编码序列和基因表达谱中,以及它们对非生物应激反应的表达模式中。值得注意的是,Ca2 +信号和ABA通路似乎参与了CsHsf-介导热反应。此外,CsHsfA2位于细胞核。此外,CsHsfA2当异源基因在转基因酵母中表达时,具有耐热性。所有这些结果为详细的研究提供了有用的信息Hsf茶树和其他植物的应激反应系统。
方法
的鉴定和序列分析Hsf基因c . sinensis
氨基酸序列为21A. thaliana Hsf基因从美国国家生物技术信息中心(NCBI)数据库(https://www.ncbi.nlm.nih.gov/)作为查询来搜索c . sinensisvar。中国基因组(60].此外,对所有获得的CsHsf蛋白进行分析,通过SMART检测DBD结构域和线圈结构。50]和CCD程序(https://www.ncbi.nlm.nih.gov/cdd/).最后,为了验证这些序列的准确性,BLASTN相似度搜索针对发表的数据c . sinensise值阈值小于1.0E−90。
利用ExPASy程序计算CsHsf蛋白的理化参数(http://web.expasy.org/compute_pi/) [47使用默认参数。狼PSORT (https://wolfpsort.hgc.jp/) [48]用于预测CsHsf蛋白的亚细胞定位。典型功能结构域分析采用SMART [50], Pfam (http://pfam.xfam.org/search) [51], NLStradamus [52]及netnet1.1服务器[53].使用MultAlin分析了CsHsf dna结合域(DBD)的多个对准[83].模因(http://meme-suite.org/tools/meme) [49]及WebLogo (http://weblogo.berkeley.edu/logo.cgi) [84]程序对CsHsf保守基序进行了分析和可视化,最佳基序宽度≥6 bp和≤200 bp,最大基序数= 25个。在MEGA (version 7.0)软件中使用邻域连接法构建系统发育树,自举试验重复数设置为1000 [85].的结构CsHsf基因分析使用在线基因结构显示服务器[86].此外,独联体的2000 bp启动子区域的调控元件CsHsf在PlantCARE项目中分析基因[54],并可视化的数字独联体-每个中的元素CsHsf在HemI软件上[56].此外,psRNATarget在线工具[87]用于预测靶向的miRNAsCsHsf根据我们实验室构建的降解文库的基因(未发表的数据)。
表达谱CsHsf基于转录组数据的基因
研究…的表达CsHsf叶尖芽、花、老叶、幼叶、果实、成熟叶、茎和根等8个组织的基因及其对干旱和盐胁迫的响应,是影响植物生长的重要因素c . sinensis表达数据从茶树信息档案下载[55].TPM(每百万抄本)对每一个的值CsHsf基因鉴定,log10转化。
每一个的转录CsHsf在高温下c . sinensis利用RNA测序数据计算外源钙处理的叶片[37].每个的表达式配置文件CsHsf使用HemI软件进行可视化[56].
植物材料及处理
茶树一年生扦插苗[茶树(l)o . Ktze。“鄂查10号”;在处理前,在华中农业大学(中国武汉)的生长室中光照12 h(24±1°C)/暗12 h(20±1°C)的光周期下培养22天。为了模拟热胁迫,将植株置于光照培养箱(38°C)中。对于ABA处理,如Wang等所述,用50 μM ABA处理植株。[58].在每个处理后0、1、2和12小时收获幼芽(一个芽和两片叶子),立即浸泡在液氮中,并在−70°C保存,然后提取RNA。此外,外生Ca2 +预处理(20mm氯化钙2)按上文所述进行[37],热应激4 h后采集样品。将三株植物合并为一个生物重复,使用三个生物重复。
定量RT-PCR分析CsHsf基因在c . sinensis
使用Quick RNA Isolation Kit (huayuyang, Beijing, China)提取总RNA。用DNase I处理所有样品中等量的总RNA (1 μg)以消除基因组DNA污染,然后用a合成cDNATransScript®II All-in-One -in- First-strand cDNA Synthesis SuperMix for qPCR (One-Step gDNA) Kit (TransGen, Beijing, China)将得到的cDNA在去离子水中稀释25倍,进行qRT-PCR检测。qRT-PCR检测如Wang等所述[88]用于StepOne Plus™实时PCR系统(应用生物系统公司,福斯特城,CA,美国)。基因特异性引物(附加文件10:表S8)根据实时荧光定量PCR实验发布的最小信息指南设计[89].C. sinensis β-actin(Genbank登录号HQ420251)作为qRT-PCR归一化分析的内参基因CsHsf基因计算使用2——ΔΔCT方法(90].所有试验均进行了3个生物重复和3个技术重复。
CsHsfA2, CsHsfA5a和CsHsfA8的亚细胞定位
的编码区域CsHsfA2,CsHsfA5a,CsHsfA8首先利用无缝组装克隆试剂盒(Aidlab, Beijing, China)分别将无终止密码子的pCAMBIA2300-C-GFP和pCAMBIA2300-N-GFP融合到植物表达载体上。然后,按照Wang等的描述,对洋葱表皮细胞进行转化和检测。[58].
转基因酵母的耐热性分析
的ORFCsHsfA2将重组质粒插入pPIC3.5 K酵母表达载体(Invitrogen, Carlsbad, CA),将重组质粒转化为毕赤酵母属pastorisSMD1168感受态细胞(Invitrogen)采用冻融法。耐热性试验如Jiang等所述。[91稍加修改。简单地说,p . pastoris含有重组质粒(OD600= 1.0)或pPIC3.5 K在45°C的水浴中孵育30分钟,然后在10倍稀释后将酵母细胞标记在YEPD培养基上。在常温条件下(30℃)培养3 d后拍照。
数据和材料的可用性
在本研究过程中产生或分析的所有数据均包含在本文及其补充信息文件中。
缩写
- 阿坝:
-
脱落酸
- ABRE:
-
脱落酸反应元件
- 是:
-
厌氧诱导元件
- 答:芥:
-
拟南芥
- Ca2 +:
-
钙离子
- 互补脱氧核糖核酸:
-
互补脱氧核糖核酸
- c . sinensis:
-
茶树
- DBD:
-
dna结合域
- 背景:
-
脱氧核糖核酸
- DREB2A:
-
脱水反应元件结合蛋白2A
- FPKM:
-
每千碱基中转录本的片段数
- gDNA:
-
基因组DNA
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 汤:
-
亲水性的大平均
- 海关:
-
热应力
- HSE:
-
HS元素
- hsf:
-
热应激因素
- 热休克:
-
热休克蛋白
- LTR:
-
低温反应
- microrna的:
-
微
- 子:
-
开放阅读框
- 挂钩:
-
聚乙二醇
- p . pastoris:
-
毕赤酵母属pastoris
- p . trichocarpa:
-
杨树trichocarpa
- qPCR:
-
定量聚合酶链反应
- 存在:
-
实时定量PCR
- TPIA:
-
茶树资料档案
- TPM:
-
百万分转录率
- YEPD:
-
酵母提取物蛋白胨葡萄糖培养基
参考文献
- 1.
夏恩华,童伟,吴强,魏生,赵杰,张泽忠,魏成林,万晓春。茶树基因组学:成就、挑战与展望。Hortic Res. 2020;7:7https://doi.org/10.1038/s41438-019-0225-4.
- 2.
张旭,何勇,何伟,苏红,王勇,洪刚,徐平。非生物胁迫和类黄酮合成酶参与的LBD家族结构和功能研究茶树.科学通报2019;9(1):15651。
- 3.
沈伟,李辉,滕瑞敏,王玉玉,王丽玲,庄娟。茶树HD-zip家族转录因子的基因组和转录组分析及其对非生物胁迫的响应(茶树).基因组学。2019;111(5):1142 - 51。
- 4.
王燕燕,刘忠文,吴志军,李慧,王丽玲,崔霞,庄娟。茶树GRAS家族转录因子的全基因组鉴定与表达分析(茶树).科学通报2018;8(1):3949。
- 5.
王普军,陈东,郑玉春,金松,杨建峰,叶恩霞。茶树SBP-box基因的鉴定和表达分析表明,SBP-box基因参与茶树的非生物胁迫和激素反应(茶树).国际分子化学杂志,2018;19(11):3404。
- 6.
张东,韩忠,李娟,秦宏,周玲,王勇,朱鑫,文斌,马勇,方伟。茶叶SBP-box基因家族转录因子的全基因组分析及其对非生物胁迫的响应(茶树).基因组学,2019;https://doi.org/10.1016/j.ygeno.2019.12.015.
- 7.
王普军,郑玉春,郭玉春,陈晓军,孙勇,杨建峰,叶恩霞。茶树核因子- y (NF-Y)转录因子的鉴定、表达及目标基因分析(茶树).足底。2019;250(5):1671 - 86。
- 8.
王培军,陈晓军,郭玉春,郑玉春,岳超,杨建峰,叶恩霞。低温条件下茶树CBF转录因子的鉴定及潜在CBF靶基因的研究国际分子生物学杂志,2019;20(20):5137。
- 9.
冯晓明,王晓明,王晓明,等。植物热胁迫转录因子的多样性研究。植物科学进展,2007;12(10):452-7。
- 10.
Scharf KD, Berberich T, Ebersberger I, Nover L.植物热胁迫转录因子家族:结构、功能与进化。生物化学学报,2012;1819(2):104-19。
- 11.
大滨N,佐藤H, Shinozaki K, Yamaguchi-Shinozaki K.植物热胁迫应答的转录调控网络。植物科学进展,2017;22(1):53-65。
- 12.
乔霞,李敏,李铁龙,尹辉,吴建勇,张世林。中国白梨热休克转录因子家族的全基因组鉴定与比较分析(Pyrus bretschneideri)和其他五种蔷薇科植物。BMC植物生物学2015;15:12。
- 13.
马俊,徐志生,王峰,谭广发,李美美,熊亚西。两个大白菜品种HSF家族转录因子的全基因组分析及其对非生物胁迫的响应。植物物理学报,2014;36(2):513-23。
- 14.
Lohani N, Golicz AA, Singh MB, Bhalla PL.全基因组分析Hsf基因家族芸苔属植物oleracea并进行了比较分析Hsf基因家族b . oleracea,b·拉伯而且显著.中国生物医学工程学报,2019;19(3):515-31。
- 15.
薛国平,薛国强,薛国强。热休克因子家族由小麦在响应热和其他主要非生物应激及其在调节热休克蛋白基因中的作用。中国生物医学工程学报,2014;26(2):539-57。
- 16.
张洁,李勇,贾海霞,李建彪,黄军,陆明志,胡俊杰。热休克因子基因家族在柳树suchowensis:在发育和非生物胁迫期间进行全基因组调查和表达分析。植物科学进展(英文版);
- 17.
朱艳霞,闫宏伟,王云云,冯玲,陈震,向勇。四种模式被子植物热休克转录因子(HSF)基因家族的基因组复制和进化。植物生长学报,2016;35(4):903-20。
- 18.
周世杰,张鹏,景志刚,史建林。黄瓜热休克转录因子家族的全基因组鉴定与分析(Cucumis巨大成功l .)。植物组学。2013;6(6):449-55。
- 19.
Schramm F, Ganguli A, Kiehlmann E, Englich G, Walch D, von Koskull-Doring P.热胁迫转录因子HsfA2在拟南芥热胁迫应答中的调控放大。植物分子生物学杂志,2006;60(5):759-72。
- 20.
Hahn A, Bublak D, Schleiff E, Scharf KD。番茄Hsp90和Hsp70伴侣蛋白与热胁迫转录因子之间的串扰。植物学报。2011;23(2):741-55。
- 21.
Banti V, Mafessoni F, Loreti E, Alpi A, Perata P.热诱导转录因子HsfA2增强拟南芥耐缺氧能力。中国生物医学工程学报。2010;29(3):344 - 344。
- 22.
李桂兰,张海恩,邵海波,王桂云,张玉娟,赵丽兰,郭晓玲,Sheteiwy MS. ZmHsf05,一种新的热休克转录因子玉米L.提高耐热性拟南芥并挽救了其耐热性缺陷athsfa2突变体。植物科学通报2019;283:375-84。
- 23.
辛海波,张宏,陈林,李xx,连清廉,袁X,胡晓霞,曹林,何小林,易明明。克隆和表征HsfA2来自莉莉(百合longiflorum).植物细胞学报,2010;29(8):875-85。
- 24.
Yokotani N, Ichikawa T, Kondou Y, Matsui M, Hirochika H, Iwabuchi M, Oda K.水稻热胁迫转录因子OsHsfA2e的表达增强了转基因拟南芥对环境胁迫的耐受力。足底。2008;227(5):957 - 67。
- 25.
陈朱BG,你们CJ,卢H, XJ,柴G,陈约王c .识别和描述小说热休克转录因子的基因,GmHsfA1,以大豆(大豆).中国植物学报,2006;26(3):357 - 357。
- 26.
Schramm F, Larkindale J, Kiehlmann E, Ganguli A, Englich G, Vierling E, von Koskull-Doring P.转录因子DREB2A和热胁迫转录因子HsfA3级联调控拟南芥热胁迫反应植物学报,2008;32(2):344 - 344。
- 27.
陈华,黄俊杰,林佳杰,金东元,李雪雪,林科。拟南芥DREB2C在热胁迫应答中HsfA3转录激活子的作用。生物化学学报。2010;39(2):344 - 344。
- 28.
向建华,冉娟,邹娟,周晓宇,刘爱玲,张小文,彭燕,唐楠,罗光宇,陈小斌。热激因子OsHsfB2b负向调控水稻抗旱耐盐性。植物学报,2013;32(11):1795-806。
- 29.
Reddy PS, Kishor PBK, Seiler C, Kuhlmann M, Eschen-Lippold L, Lee J, Reddy MK, Sreenivasulu N.热激因子HvHsfB2c对大麦小热激蛋白调控及其在干旱胁迫响应和种子发育中的意义。PLoS One. 2014;9(3):e89125。
- 30.
李峰,张海荣,赵海生,高文伟,宋爱普,蒋建峰,陈福德,陈明明。菊花CmHSFA4基因正向调控转基因菊花的耐盐性。中国生物工程学报,2018;16(7):1311-21。
- 31.
臧丹东,王建新,张旭,刘志军,王永春。拟南芥热休克转录因子HSFA7b通过与e -box样基序结合调节基因表达正向调节盐胁迫耐受性。中国生物医学工程学报,2019;40(19):539 - 544。
- 32.
Schmidt R, Schippers JHM, Welker A, Mieulet D, Guiderdoni E, Mueller-Roeber B.转录因子OsHsfC1b调节盐耐受性和发育水稻。粳稻.AoB Plants. 2012;2012:pls011。
- 33.
胡晓军,陈丹丹,Mclntyre CL, Dreccer MF,张志波,Drenth J, Kalaipandian S,常hp,薛gp。热休克因子C2a在小麦籽粒发育过程中起着积极的热保护作用通过aba介导的调节途径。植物细胞环境,2018;41(1):79-98。
- 34.
王晓明,王晓明,王晓明,等。转基因种子抗逆性研究进展。植物科学进展。2006;42(3):339 - 344。
- 35.
朱新军,廖俊杰,夏晓林,熊峰,李勇,沈建忠,文波,马玉春,王永华,方伟平。基于生理学和itraq的蛋白质组学分析揭示了外源γ-氨基丁酸(GABA)在改善茶树(茶树l)低温耐受性。BMC植物生物学,2019;19(1):43。
- 36.
张启杰,李伟,李凯,南红,石超,张勇,戴志勇,林玉玲,杨晓玲,童燕,等。SMRT测序得到茶树染色体尺度的参考基因组,山茶花变种.bioRxiv。2020;https://doi.org/10.1101/2020.01.02.892430.
- 37.
王明明,张晓霞,李庆华,陈霞,李晓辉。比较转录组分析以阐明茶树的耐热性增强(茶树)用外源性钙处理。足底。2019;249(3):775 - 86。
- 38.
周玲,徐辉,Mischke S, Meinhardt LW,张德平,朱新军,李晓辉,方伟平。外源脱落酸显著影响茶树蛋白质组(茶树)暴露在干旱胁迫下。Hortic Res. 2014;1:14029。
- 39.
刘顺生,金建强,马建强,姚明智,马春林,李芳芳,丁志涛,陈琳。茶树对干旱胁迫响应和恢复的转录组分析。PLoS One. 2016;11(1):e0147306。
- 40.
王慧,徐荣科,王楠,李晓辉。茶叶种植对中国东部土壤酸性的影响。土壤圈。2010;20(6):799 - 806。
- 41.
李淑云,李海霞,杨春林,王永德,薛辉,牛玉峰。茶园土壤酸化率及其可能原因。农业生态环境学报。2016;233:60-6。
- 42.
金长武,郑世杰,何玉峰,狄周刚,周志祥。茶园土壤铅污染及其生物利用度的影响因素臭氧层。2005;59(8):1151 - 9。
- 43.
张明凯,方丽萍。茶园诱导的土壤重金属活化。土壤科学通报。2007;38(11-12):1467-78。
- 44.
王燕燕,刘忠文,李辉,王文玲,崔霞,庄娟。茶树对热胁迫的响应及其适应机制研究。见:茶叶在气候变化下的应激生理,第25卷。新加坡:施普林格;2018.25-37页。
- 45.
王明明,邹志伟,李广华,辛海辉,朱新军,陈霞,李晓辉。三种异体表达茶树热休克蛋白的小基因使酵母具有耐温度胁迫能力拟南芥.植物细胞学报,2017;36(7):1125-35。
- 46.
刘志伟,吴志军,李晓华,黄艳,李辉,王彦宇,庄杰。茶树热休克转录因子的鉴定、分类及表达谱(茶树)在温度压力下。基因。2016;576(1):52-9。
- 47.
Artimo P, Jonnalagedda M, Arnold K, Baratin D, Csardi G, de Castro E, Duvaud S, Flegel V, Fortier A, Gasteiger E,等。ExPASy: SIB生物信息学资源门户。核酸研究,2012;40:W597-603。
- 48.
Horton P, Park KJ, Obayashi T, Obayashi T, Fujita N, Harada H, Adams-Collier CJ, Nakai K. WoLF PSORT:蛋白质定位预测器。核酸研究,2007;35:W585-7。
- 49.
Bailey TL, Boden M, Buske FA, Frith M, Grant CE, Clementi L, Ren J, Li WW, Noble WS。MEME SUITE: motif发现和搜索的工具。核酸研究,2009;37:W202-8。
- 50.
Letunic I, Bork P. 20年的SMART蛋白域注释资源。核酸学报2018;46(D1): D493-6。
- 51.
El-Gebali S, Mistry J, Bateman A, Eddy SR, Luciani A, Potter SC, Qureshi M, Richardson LJ, Salazar GA,等。2019年Pfam蛋白家族数据库。核酸学报2019;47(D1): D427-32。
- 52.
Ba ANN, Pogoutse A, Provart N, Moses AM。NLStradamus:一种用于核定位信号预测的隐马尔可夫模型。生物信息学。2009;10:202。
- 53.
la Cour T, Kiemer L, Mølgaard A, Gupta R, Skriver K, Brunak S.富亮氨酸核输出信号的分析与预测。蛋白质工程学报,2004;17(6):527-36。
- 54.
Lescot M, Dehais P, Thijs G, Marchal K, Moreau Y, Van de Peer Y, Rouze P, Rombauts S. PlantCARE,植物数据库独联体-作用调控元件和启动子序列硅片分析工具的入口。中国生物工程学报,2002;30(1):325-7。
- 55.
夏恩华,李福发,童伟,李福平,吴强,赵海军,葛荣荣,李瑞荣,李元宇,张泽忠,等。茶树信息档案:茶树基因组学和生物信息学的综合平台。中国生物工程学报,2019;17(10):1938-53。
- 56.
邓伟科,王亚波,刘志祥,程宏,薛勇。热图绘制工具箱。PLoS One. 2014;9(11):e111988。
- 57.
Duncan J, Saikia S, Gupta N, Biggs E.观察气候对印度阿萨姆邦茶叶产量的影响。应用地理,2016;77:64-71。
- 58.
王明明,邹志伟,李广华,孙凯,陈霞,李晓辉。CsHSP17.2分子伴侣在耐热性方面是必不可少的茶树.科学通报2017;7(1):1237。
- 59.
王小明,石霞,陈淑云,马超,徐顺生。植物进化过程中热休克因子基因家族的进化起源、逐渐积累及功能分化。中国植物科学,2018;9:71。
- 60.
魏春林,杨华,王素生,赵娟,刘超,高丽萍,夏恩华,卢勇,邰玉玲,佘国宝,等。基因组序列草图茶树var。中国为茶叶基因组和茶叶品质的进化提供了见解。中国科学院学报(自然科学版),2018;29(3):344 - 344。
- 61.
周敏,郑国光,刘瑞,陆杰,卢磊,张春华,刘志华,罗春平,张磊,鄢林,等。面包小麦热休克转录因子家族的全基因组鉴定、系统发育及表达分析(小麦l .)。BMC基因组学。2019;20(1):505。
- 62.
郑娥,金敏,李俊华。热休克转录因子家族的全基因组分析和分子特征大豆.中国基因工程学报。2013;40(3):127-35。
- 63.
张志强,李志强,张志强,等Hsf芝麻基因在干旱胁迫响应中表现出区段复制扩增和积极作用。前沿植物学报2016;7:1522。
- 64.
郭敏,陆建平,翟云峰,柴伟军,龚志华,陆明明。辣椒热休克因子基因家族(CaHsfs)的全基因组分析、表达谱及CaHsfA2的鉴定(甜椒l .)。BMC植物生物学。2015;15:151。
- 65.
Kiraga J, Mackiewicz P, Mackiewicz D, Kowalczuk M, Biecek P, Polak N, Smolarczyk K, Dudek MR, Cebrat S.等电点与蛋白质长度、生物分类和生态学的关系。BMC基因组学,2007;8:163。
- 66.
唐蓉,朱伟,宋霞,林霞,蔡娟,王敏,杨强。马铃薯热休克转录因子的全基因组鉴定与功能分析。前沿植物科学,2016;7:490。
- 67.
李伟,万小玲,于建勇,王克林,张娟Hsf康乃馨基因家族(石竹类植物caryophyllus).中华分子生物学杂志,2019;20(20):5233。
- 68.
宋旭,刘刚,段伟,刘涛,黄忠,任军,李勇,侯霞。大白菜热休克转录因子家族的全基因组鉴定、分类及表达分析。中国生物医学工程学报。2014;29(4):541 - 551。
- 69.
Kotak S, Port M, Ganguli A, Bicker F, Von Koskull-Döring P.拟南芥热胁迫转录因子(Hsfs) c端结构域的鉴定和植物A类Hsfs与AHA和NES基元的新签名组合,对激活因子功能和细胞内定位至关重要。植物学报,2004;39(1):98-112。
- 70.
陈世生,姜娟,韩晓军,张玉霞,卓瑞瑞。植物中Hsf家族的鉴定、表达分析及A4类的特征景天属植物alfredii汉斯在镉胁迫下。国际分子化学杂志,2018;19(4):1216。
- 71.
张勇,朱新军,陈霞,宋椿镛,邹志伟,王永华,王明明,方伟平,李晓辉。茶树低温响应microrna的鉴定与鉴定(茶树)和它们的目标,使用高通量测序和降解分析。中国生物医学工程学报。2014;
- 72.
Maheswari U, Jabbari K, Petit JL, Porcel BM, Allen AE, Cadoret JP, De Martino A, Heijde M, Kaas R, La Roche J,等。新型硅藻转录物的数字表达分析提供了深入了解其生物学功能的方法。中国生物医学工程学报,2010;11(8):R85。
- 73.
边晓红,李伟,牛芳芳,魏伟,胡勇,韩建青,陆旭,陶俊杰,金敏,秦辉,等。在大豆驯化过程中选择的B类热休克因子通过促进类黄酮的生物合成来促进耐盐性。中国植物学报,2020;25(1):379 - 379。
- 74.
小川D,山口K, Nishiuchi T.拟南芥高水平过表达HsfA2基因不仅增强了愈伤组织的耐热性,还增强了其耐盐/渗透胁迫和愈伤组织的生长。中国机械工程学报,2007;32(12):339 - 344。
- 75.
宋超,钟文伟,林志强。热休克因子基因的过表达HsfA3提高拟南芥半乳糖醇水平和氧化应激耐受性。中国生物医学工程学报。2016;39(6):477-83。
- 76.
刘爱安,邹杰,刘芳芳,周晓宇,张小文,罗光宇,陈小斌。表达的OsHsfA7转基因水稻耐盐耐旱能力增强。BMB代表2013;46(1):31-6。
- 77.
谭伟,孟QW, Brestic M, Olsovska K,杨晓华。外源钙对热胁迫烟草植株光合作用有促进作用。中国植物科学,2011;29(3):344 - 344。
- 78.
林克勤,黄珊珊,吴长武,张玉生。水杨酸和氯化钙对一品红耐热性的影响。54 Hortscience。2019;(3):499 - 504。
- 79.
Perez-Salamo I, Papdi C, Rigo G, Zsigmond L, Vilela B, Lumbreras V, Nagy I, Horvath B, Domoki M, Darula Z,等。热休克因子A4A具有耐盐性,并受氧化应激和丝裂原活化蛋白激酶MPK3和MPK6的调节。中国生物医学工程学报,2014;26(1):319 - 324。
- 80.
郎绍荣,刘xx,薛辉,李霞,王晓峰。BnHSFA4a作为热休克转录因子在控制种子脱水耐性重建中的功能表征中国生物医学工程学报,2017;29(3):344 - 344。
- 81.
Personat JM, Tejedor-Cano J, Prieto-Dapena P, Almoguera C, Jordano J.两个热休克因子的共表达提高了种子寿命,并对幼苗对严重脱水和氧化应激的耐受性产生协同作用。BMC植物生物学。2014;14:56。
- 82.
充YY,刘慧慧,刘妮妮,迟文涛,王成中,常硕,王婷婷。热诱导转录因子HsfA2是延长拟南芥获得性耐热性所必需的。植物科学进展。2007;43(1):344 - 344。
- 83.
多序列对齐与层次聚类。中国生物医学工程学报。1988;16(22):10881-90。
- 84.
Crooks GE, Hon G, Chandonia JM, Brenner SE。WebLogo:一个序列logo生成器。基因组学报,2004;14(6):1188-90。
- 85.
Kumar S, Stecher G, Tamura K. MEGA7:更大数据集的分子进化遗传学分析版本7.0。分子生物学杂志,2016;33(7):1870-4。
- 86.
胡斌,金建平,郭爱英,张华,罗建昌,高光。GSDS 2.0:一种升级版的基因特征可视化服务器。生物信息学,2015,31(8):1296 - 7。
- 87.
戴小波,庄志华,赵鹏程。psRNATarget:植物小RNA靶标分析服务器(2017年发布)。核酸研究,2018;46(W1): W49-54。
- 88.
王明明,李庆华,辛海辉,陈旭,朱新军,李晓辉。茶树基因表达数据规范化的可靠参考基因(茶树)暴露在金属应力下。公共科学学报,2017;12(4):e0175863。
- 89.
Bustin SA, Benes V, Garson JA, Hellemans J, Huggett J, Kubista M, Mueller R, Nolan T, Pfaffl MW, Shipley GL,等。MIQE指南:定量实时PCR实验发表的最少信息。临床化学杂志,2009;55(4):611-22。
- 90.
Livak KJ, Schmittgen TD。相关基因表达数据的分析采用实时定量PCR和2——ΔΔCT方法。方法。2001;25(4):402 - 8。
- 91.
蒋超,徐建勇,张宏,张霞,石建林,李明,明峰。一种细胞质I类小热休克蛋白RcHSP17.8罗莎对赋予抵抗各种压力的能力大肠杆菌,酵母和拟南芥.植物细胞环境学报。2009;32(8):1046-59。
确认
我们非常感谢李庆辉(华中农业大学)在酵母耐热性测定方面的帮助。
资金
国家自然科学基金项目(31902078)、中央高校基本科研业务费项目(2662017QD036)、河南省豫南茶树综合利用重点实验室开放基金项目(HNKLTOF2018003)资助。资助者在实验设计、数据分析、发表决定或手稿准备中没有任何作用。
作者信息
从属关系
贡献
MLW构想并设计了这个实验。XYZ、WLX和MLW执行实验并编写草案。DJN, GYG, MLW对论文的语言进行了修改。所有作者都阅读并批准了手稿的最终版本。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:
图S1。CsHsf蛋白保守基序的分布及其对应的序列标识。一个用模因分析了CsHsf蛋白的25个保守基序(http://meme-suite.org/tools/meme).b25个保守图案的序列标志。
附加文件2:表S1。
CsHsf基因的启动子序列(翻译起始位点上游2000 bp)。
附加文件3:表S2。
的预测miRNA靶点列表CsHsf基因。
附加文件4:表S3。
每百万份成绩单(TPM)值[47]的CsHsf基因c . sinensis简历。“舒cha早”不同的组织。
附加文件5:表S4。
每百万份成绩单(TPM)值[47在干旱(25%聚乙二醇6000)和盐(200 mM NaCl)处理下,CsHsf基因的突变率显著降低c . sinensis简历。“铁观音”。
附加文件6:表S5。
高温和ABA处理下CsHsf基因的转录水平。实验选用茶树品种“埃茶10号”,qRT-PCR数据为3个生物和技术重复的平均值±标准差。
附加文件7:表S6。
每千碱基转录本每百万片段映射(FPKM)值[37]在热胁迫条件下茶树CsHsf基因的表达(c . sinensis简历。“龙井昌叶茶”)叶片经外源钙预处理。
附加文件8:表S7。
8个CsHsf基因在茶树热胁迫下的表达(c . sinensis简历。“龙井长叶”)叶片经外源钙预处理。柱状表示平均值的标准差(SD)n= 3)。每个生物复制包含三个技术复制。
附加文件9:图S2。
CsHsfA5a和CsHsfA8在洋葱表皮细胞中的亚细胞定位。CsHsfA5a-GFP和CsHsfA8-GFP表示CsHsfA5a和CsHsfA8在c端与GFP融合,GFP-CsHsfA5a和GFP-CsHsfA8表示CsHsfA5a和CsHsfA8在n端与GFP融合。使用蔡司LSM700共聚焦激光扫描显微镜(卡尔蔡司公司,美国)在488 nm处检测到GFP信号。Bars = 50 μm。
附加文件10:表S8。
CsHsf基因qRT-PCR引物。这些引物是特定的c . sinensis简历。“Echa 10”。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
张鑫,徐伟,倪伟,倪东。et al。茶树的全基因组特征(茶树) Hsf转录因子家族及其作用CsHsfA2耐热性。BMC植物生物学20.244(2020)。https://doi.org/10.1186/s12870-020-02462-9
收到了:
接受:
发表:
关键字
- Hsf家庭
- 非生物胁迫
- 表达模式
- CsHsfA2
- 耐热性