摘要
背景
块茎颜色是马铃薯的一个重要性状菊芋l .(洋姜)。紫色块茎通常花青素含量高,比白色块茎更有营养。但是,它背后的分子机制尚不清楚。
结果
在目前的研究中,高通量RNA测序被用来比较具有红色或白色表皮的块茎植物的转录组。与QY3白皮块茎相比,QY1红皮块茎中花青素生物合成结构基因表达量较大,说明QY1红皮块茎中花青素生物合成途径被激活;定量PCR证实了这种表达差异。HTMLB2型(Unigene44371_All)是‘QY1’红块茎表皮中唯一表达的MYB转录因子,与调控花青素生物合成的MYB转录因子同源。‘QY1’根、茎、叶、花和块茎表皮的花青素含量均高于‘QY3’,尤其是块茎表皮。相应地,HTMLB2型' QY1 '在这些组织中的表达高于' QY3 '。的表达HTMLB2型与花青素在不同组织中的积累有关。过表达HTMLB2型激活了花青素生物合成途径,积累了转基因烟草叶片中的色素,支持了这一模型HTMLB2型监管花青素生物合成。进一步的实验发现HTMLB2型' QY1 '和' QY3 '的编码序列和基因组序列相同,但在两个等位基因之间的启动子区存在多个单核苷酸多态性和21个核苷酸的插入缺失(indel)突变。三个核苷酸“AAA”的缺失使得“QY1”的启动子预计多包含一个可能的启动子区域。基于indel的引物可以区分块茎表皮为红色或白色的栽培品种。遗传变异HTMLB2型与自然种群中块茎的肤色有关。
结论
RNA-seq可以成功分离候选基因(HTMLB2型)菊芋紫色表皮花青素合成的调控。HTMLB2型能调节植物花青素的生物合成,与块茎紫色表型的形成密切相关。本研究有助于了解不同块茎表皮颜色的遗传机制,并有助于培育新品种h . helianthus tuberosus品种用不同的块茎肤色。
背景
菊芋菊芋属菊科植物,原产于北美[1]. 马铃薯块茎h . helianthus tuberosus富含果聚糖,是菊粉的良好来源[2],生物乙醇[3.和动物饲料[4].通常,块茎的皮肤颜色为h . helianthus tuberosus白色,尽管有些品种的块茎表皮有粉红色、紫色或红色。块茎颜色是区分不同品种的重要参数h . helianthus tuberosus,色差主要是由于花色苷在质和量上的差异[5,6].
花青素是植物中主要的水溶性色素,属于黄酮类多酚[7]. 这个metabolic pathway of anthocyanin is relatively well documented in model plants [8,9]. 花青素生物合成的结构基因包括查耳酮合酶(CHS.),Chalcone异构酶(ch),flavonoid-3-hydroxylase(F3H型),黄酮-3'-羟化酶(F3'H.),类黄酮-3′,5′-羟化酶(F3'5'高),和二氢烷醇4-还原酶(DFR),花色素合成酶(答案) [10].
通常,花青素生物合成结构基因的表达通过转录因子,即WD40,BHLH和R2R3-MYB蛋白调节。转录因子通过形成三聚体络合物和与结构基因的启动子结合来调节结构基因的表达[11]. 转录因子基因的等位变异与花青素生物合成相关的表型变异有关。由基因编码的转录因子R3MYB大丽花是菊科的另一个成员,其基因具有一个典型的MYB基因域,该基因在色彩丰富的大丽花品种中表达,可以激活花青素合成途径[12]. 这个CtMYB13红花(Asteraceae成员)的转录因子是调节红花类黄酮生物合成途径结构基因的重要转录因子[13]. 这个genetic mechanism of anthocyanin pigment formation has been studied thoroughly in a number of plants, but little is known of the mechanisms involved inH块茎。
高通量测序(RNA-Seq)技术已成为一种低成本、高效率的工具,可用于快速获得各种植物的转录本[14,15].由于植物花青素生物合成途径的信息丰富,即使没有相应的基因组序列,通过植物转录组分析,也可以快速识别出与花青素生物合成相关的基因。通过转录组测序,得到编码MYB转录因子的基因爱尔兰2是独立于枸杞编码bHLH转录因子的TaMYC1和ThMYC4E从小麦没有基因组序列信息中分离出来,进一步的实验证实,它们是负责相应物种中的黑色果实,紫色晶粒和蓝粒状性状的关键基因[16,17,18].
为了h . helianthus tuberosus目前,对花青素生物合成相关性状的关键基因的鉴定尚未见报道,只有少数与花青素生物合成相关的基因通过同源克隆获得。本研究利用RNA-Seq技术比较了白、红薯表皮不同品种间的转录差异,分离出候选关键基因进行功能验证,了解等位基因与表型变异的关系。
结果
两种转录组分析h . helianthus tuberosus品种
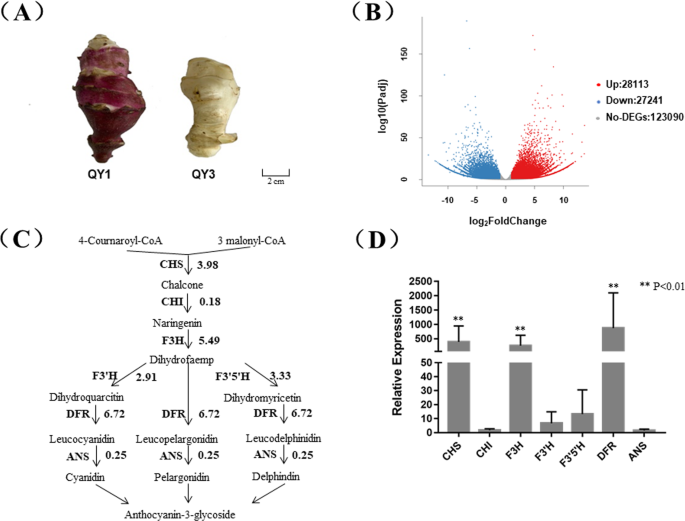
基于Hiseq 2000平台,对QY1和QY3块茎表皮的RNA进行了序列测定(图。1a) 是的。过滤后,从两个品种的三个样品中获得总共50 Gb的清洁数据(表S)1). 利用Trinity软件,共组装了197769个单基因。共有55354个单基因表达差异,其中28113个单基因表达上调,27241个单基因表达下调(图。1b) 是的。选择与花青素合成相关基因同源的单基因,并对每个品种的FPKM值进行聚合。没有一个花青素生物合成结构基因在‘QY1’中的表达水平低于‘QY3’(图。1c) 以及关键结构基因的转录水平CHS.,ch,F3H型,F3'H.,F3'5'高,DFR和答案“QY1”高于“QY3”。“QY1”结构基因相对于“QY3”的折叠调节分别达到3.98、0.18、5.49、2.91、3.33、6.71和0.25(表S)2). 选择Unigene33222、CL2784.Contig1、CL9203.Contig4、CL13771.Contig2、CL13771.Contig1、CL9517.Contig40、CL13383.Contig1四种引物,设计引物,用于玉米qPCR试验CHS.,ch,F3H型,F3'H.,F3'5'高,DFR和答案.qPCR的结果也证实了这些发现,尽管一些基因的数值有所不同(图1)。1d) 是的。因此,花青素生物合成结构基因的激活可能是QY1红薯性状的原因,而不是QY3红薯性状的原因。与‘QY1’结构基因表达上调一样,编码转录因子MYB和bHLH的基因在‘QY1’中的表达水平高于‘QY3’(表S)2). 认为结构基因受转录因子调控,MYB转录因子可诱导bHLH转录因子的表达[19].HTMLB2型(Unigene44371_All)应该是负责红块茎皮肤性状的关键基因h . helianthus tuberosus.
成绩单的比较h . helianthus tuberosusQY1和QY3,块茎表皮呈紫色和白色。一个QY1和QY3块茎的表型。' QY1 '和' QY3 '是h . helianthus tuberosus青海省农林科学院培育的品种(西宁810000)。‘QY1’的块茎表皮为红色,而‘QY3’的块茎表皮为白色。bRNA-seq实验中QY1和QY3块茎表皮差异表达基因的火山分布图。这些基因被分为三类。如果QY1块茎表皮的基因表达大于QY3,则红色基因表达上调。蓝色基因表达下调,QY3基因表达量大于QY1。灰色基因没有差异表达。X轴表示Log2(折叠变化)。Y轴表示-log10(Padj)的值。c基于RNA-seq实验的花青素生物合成途径结构基因表达差异。箭头表示代谢流,缩写左箭头或向上箭头表示催化过程的基因,数字表示QY1与QY3块茎表皮转录水平的平均对数2倍变化。d基于qPCR的QY1和QY3块茎表皮花青素合成结构基因的相对转录水平比较。选择Unigene33222、CL2784.Contig1、CL9203.Contig4、CL13771.Contig2、CL13771.Contig1、CL9517.Contig40、CL13383.Contig1四种引物,设计引物,用于玉米qPCR实验CHS.,ch,F3H型,F3'H.,F3'5'高,DFR和答案
HtMYB2的分子特征
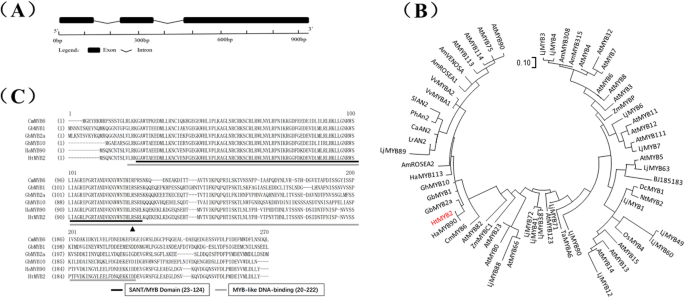
以转录组信息为基础,研究其基因组和编码序列(CDSs)HTMLB2型从‘QY1’和‘QY3’中分离得到。基因组序列HTMLB2型从‘QY1’和‘QY3’中分别得到1066 bp和1068 bp,编码序列长度相同。HTMLB2型包含三个内含子和两个外显子(图。2a).虽然“QY1”和“QY3”CDSs的第三外显子存在两个核苷酸差异,但在翻译序列中只发现一个氨基酸差异(图)。2C)。MYB转录因子的系统发育树表明,HTMYB2类似于控制与同一物种中的花青素生物合成相关的性状的MYB转录因子,包括包括的成员菊科,Solanaceae.,十字花科(无花果。2b) 是的。与最相似的MYB转录因子CmMYB6(来自菊花,菊科),GbMYB1,GbMYB2a(来自Gynura二色的,菊科),GhMYB10(来自棉花,锦葵科)和HaMYB90(来自向日葵HTMYB2包含完整的MYB样结合域(图。2c) 这对于实现MYB转录因子在花青素生物合成调控中的作用具有重要意义。这意味着HTMLB2型应具有调节花青素生物合成的功能。
分子特征HTMLB2型.一个基因结构HTMLB2型. 黑色正方形代表外显子,黑色线条代表内含子。b调节花青素生物合成的MYB蛋白的系统发育树。GbMYB2a: BAP47698.1;GbMYB1: BAJ17661.1;GhMYB10: AAK19615.1;HaMYB113: XP_022033329.1;AmROSEA2: ABB83827.1;LjMYB89: AFK35838.1;LrAN2: QCS14086.1;CaAN2: NP_001311547.1;PhAN2: AB982128.1; SlAN2:FJ705319.1; VvMYBA1:ABD72954.1; VvMYBA2:BAD18978.1; AmROSEA1:ABB83826.1; AmVENOSA:ABB83828.1; AtMYB113:NM_105308.2; AtMYB114:NM_001334235.1; AtMYB75: ABB03879.1; AtMYB90:NP_176813.1; LjMYB3:ALU11262.1; LjMYB4:ALU11258.1; AmMYB308:ABI26190.1; AmMYB315:AAV70655.1; AtMYB4:NP_195574.1; AtMYB32:NP_195225.1; AtMYB7:OAP08362.1; AtMYB6:NP_192684.1; AtMYB8:BAE99960.1; AtMYB3:NP_564176.2; ZmMYBP:AAL90641.1; LjMYB6:E5L8F7.1; AtMYB11:NP_191820.1; AtMYB12:ABB03913.1; AtMYB111:EFH41988.1; LjMYB7:AKV17427.1; AtMYB5:NP_187963.1; LjMYB63:ALU11252.1; BJ185183:XP_024388078.1; DcMYB1:XP_017224603.1; NtMYB2:XP_009629052.1; LjMYB1:AFK36130.1; LjMYB49:ALU11251.1; LjMYB60:XP_019055104.1; OsMYB4:XP_015633465.1; AtMYB15:NP_188966.1; AtMYB13:NP_172108.1; AtMYB14:XP_002881162.1; LjMYB12:3760052; LjMYB90:ALU11257.1; TaMYBA6:BAH36890.1; LjMYB71:ALU11256.1; AtMYB123:ABK28720.1; LjMYB38:BAG12893.1; LjMYB41:BAG12894.2; LjMYB72:BAG12893.1; AtMYB66:NP_196979.1; LjMYB88:ALU11254.1; AtMYB0:AAL01241.1;AtMYB23:CDY44571.1; ZmMYC1:1613412E; AtMYB82:AAF14064.1; CmMYB6:AKP06190.1; HaMYB90:XP_022033410.1;cHtMYB2与最接近的花青素相关MYB转录因子的氨基酸比对。CmMYB6:AKP06190.1;GbMYB1:BAJ17661.1;GbMYB2a:BAP47698.1;GhMYB10:AAK19615.1;HaMYB90:XP\u 022033410.1。该三角形重复了QY1和QY3中HtMYB2不同氨基酸的位置。QY1中的氨基酸R是QY3中的氨基酸K
HtMYB2过表达诱导烟草花青素生物合成
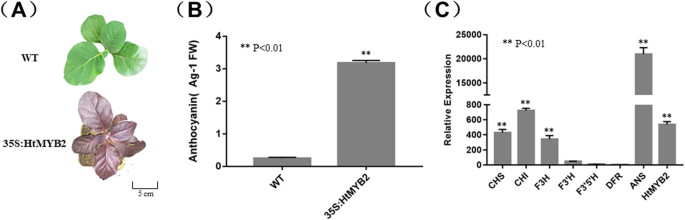
转染pJAM1502:HtMYB2质粒根癌农杆菌冻融法分离菌株LBA4404。这个农杆菌-采用介导叶盘转化法获得转基因烟草。为了进一步的实验,使用了未经分离的携带目的基因的T3家系。转基因阳性株系叶片呈深紫色(图1)。3.a),转基因素的相对花青素浓度远高于野生型的浓度(图。3.b) 是的。qPCR实验结果表明,花青素合成相关结构基因的表达水平和花青素合成相关结构基因的表达水平明显高于对照组HTMLB2型在转基因株系中表达上调(图。3.c) 是的。这些结果表明HTMLB2型在烟草中作为MYB转录因子可以激活花青素的生物合成。
记录丰度与HTMLB2型不同组织中花青素的含量
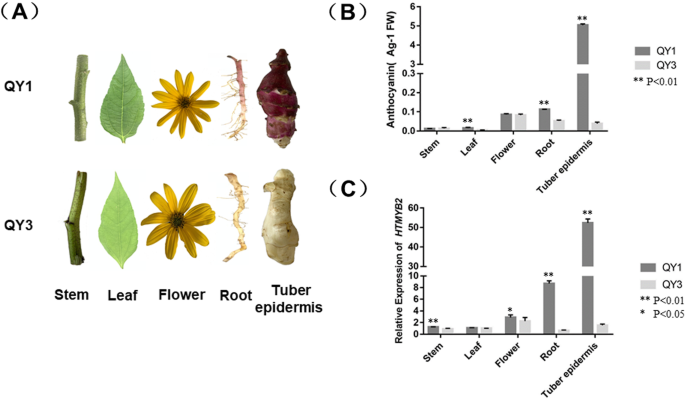
从外观上看,‘QY1’的根表皮和块茎表皮明显红于‘QY3’,而两个品种的茎、叶和花之间的表型差异不大(图1)。4a).相应的,‘QY1’块茎和根的花青素浓度显著高于‘QY3’,而两个品种茎、叶和花的花青素浓度差异不显著(图5)。4b).表达HTMLB2型与花青素浓度一致。最高温度的组织HTMLB2型表达量依次为QY1的块茎表皮,其次为QY1的根。4b) QY1的其他组织和QY3的所有组织中均未出现表达HTMLB2型.每次治疗重复三次。
水稻自然群体中HtMYB2的等位变异菊芋l
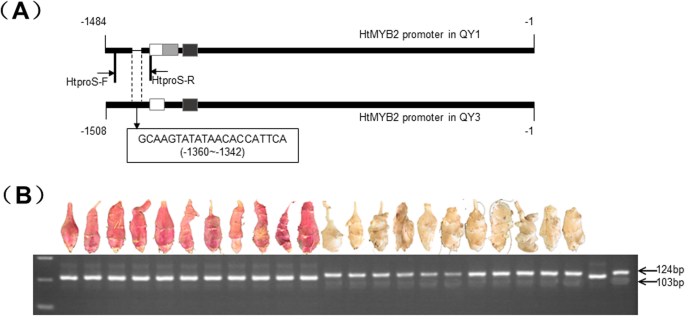
HTMLB2型在“QY1”和“QY3”之间的块茎表达中表达水平的明显差异。启动子被隔离HTMLB2型利用TAIL-PCR,试图解释不同品种在表达上的差异HTMLB2型在两个品种之间。基于启动子预测软件BDPG,‘QY1’的启动子有三个可能的启动子区域,而‘QY3’只包含两个(表S3.).‘QY1’中三个核苷酸AAA的缺失导致了两个品种启动子的差异。
与QY3的启动子相比,在QY1启动子的区域 - 1360至-1342中删除21bp(图。5a) 是的。根据两个启动子之间的indel差异,设计了诊断引物HtproS来区分两个启动子HTMLB2型从'QY1'和'QY3'开始。QY1扩增片段长度为103 而QY3扩增片段为124 血压(图。5a) 是的。这对引物能有效区分HTMLB2型-QY1来自HTMLB2型-QY3(图S1). 在180个选定的单株中,90个红皮块茎的单株携带该基因型HtMY23格式-QY1,而90个白皮块茎个体携带基因型HTMLB2型-qy3(图。5b) (表S)4).结果表明,该基因存在等位变异HTMLB2型与块茎皮肤颜色一致吗h . helianthus tuberosus.
讨论
在这项研究中,我们分离了一个MYB转录因子,HTMLB2型,来自h . helianthus tuberosus并探讨其与花青素生物合成和红薯肤色性状的关系。
HtMYB2是一个功能性MYB转录因子基因调控子操作花青素生物合成
HTMLB2型具有功能性MYB转录因子的特征。它有两个内含子和三个外显子。HtMYB2编码的蛋白质含有完整的MYB样DNA结合结构域和SANT结构域,在花青素合成的调控中起重要作用。在系统发育树中,HtMYB2最接近MYB转录因子GbMYB2和CmMYB6[20]. GbMYB2编码一个r2r3myb转录因子并调节植物叶片中花青素的生物合成g .二色的菊科的另一成员[21].cmmyb6从c . morifoium同时也是菊科的一员,可以诱导基因转录增加约34倍CMDFR.,在MrbHLH[22]. 最重要的是外源基因的过度表达HTMLB2型烟草中花青素合成相关的内源结构基因表达被激活,提高了烟叶中花青素的含量。QY1与转基因烟草花青素生物合成的结构基因存在差异,主要表现为上调。这可能与不同物种结构基因启动子的遗传变异有关。所有这些结果都暗示HTMLB2型是一种调节花青素生物合成的功能性MYB转录因子。
HtMYB2函数与t相关块茎表皮颜色性状
在转录组分析中,花色素苷生物合成的结构基因在‘QY1’块茎表皮中被激活,这一发现也被qPCR证实。众所周知,花青素结构基因的表达受MYB和bHLH转录因子的调控,MYB转录因子诱导bHLH转录因子的表达。事实上,HTMLB2型是调节花青素生物合成的唯一MYB转录因子,在高水平中表达h . helianthus tuberosus‘QY1’块茎表皮,花青素积累处,表明HTMLB2型参与了‘QY1’块茎表皮花青素的生物合成。此外,转录本HTMLB2型与不同组织中的花青素浓度一致。仅在“QY1”的根和块茎器官中检测到花青素,该曲调器也包含了更高的转录性丰度HTMLB2型而不是其他器官。在这两个等位基因的启动子中,虽然HtMYB2promoter-QY3插入21 bp序列。然而,在启动子功能区的预测结果中,HtMYB2promoter-QY1有多个功能区,得分为0.83 bp至–1250 这些差异很可能导致HTMLB2型未能在白种中激活花青素生物合成途径。两位等位基因,HTMLB2型-QY1和HTMLB2型-问题3,出现在h . helianthus tuberosus品种‘QY1’和‘QY3’。等位基因变异与马铃薯自然群体块茎表皮颜色有关h . helianthus tuberosus块茎肤色性状的分离;HTMLB2型-QY1与红薯表皮性状相关,而QY1与红薯表皮性状相关HTMLB2型-QY3与白薯表皮性状有关。总而言之,HTMLB2型似乎是关键基因负责的红薯表皮性状h . helianthus tuberosus.
结论
在本研究中,HTMLB2型是独立于h . helianthus tuberosus通过RNA序列。它与其它MYB转录因子具有相同的内含子和外显子数目及相同的功能域,而MYB转录因子在其它植物中已被证明能调节花青素的生物合成。HTMLB2型在系统发育树中与这些功能性MYB转录因子很接近。过表达HTMLB2型诱导烟草花青素生物合成。不过HTMLB2型在品种QY1中具有类似的编码序列,用红皮茎和斑纹QY3,带有白皙的块茎,肿块块状物质丰富HTMLB2型’QY1’的块茎表皮显著高于‘QY3’。HTMLB2型仅在QY1的根和块茎表皮中检测到转录本。启动子的差异与转录本丰度的差异有关HTMLB2型在'qy1'和'qy3'之间。等位基因变异HTMLB2型该基因与自然群体块茎颜色密切相关。所有结果都暗示HTMLB2型是调节花青素生物合成的功能性MYB转录因子吗h . helianthus tuberosus,并在确定红色块茎表皮特征方面发挥重要作用,这应该是育种新品种的有用信息h . helianthus tuberosus用不同的块茎色。
方法
植物材料
' QY1 '和' QY3 '是h . helianthus tuberosus青海省农林科学院培育的品种(西宁810000)。‘QY1’的块茎表皮为红色,而‘QY3’的块茎表皮为白色(图。1a).所有材料种植储存在青海省农林科学院园艺研究所(E101°45′08.15″,N36°43′32.06″)。这些样品的库标记录在表S中4.的烟草选择三阳为转化植株。烟草(Samsun)由John Innes中心Cathie Martin教授赠送,现保存于中国科学院西北高原生物研究所。收集这些植物不需要获得许可。在本研究中,袁宗负责这些样品的种植和鉴定。
转录组分析
“QY1”和“QY3”的块茎表皮样品以3个重复的方式收集,作为转录组生成的源材料。这三个转录组都来自不同的‘QY1’和‘QY3’样本。根据rna - seq样品制备仪器要求(Illumina Inc., San Diego, CA, USA)描述建立块茎表皮cDNA文库。cDNA文库产物采用Illumina对端测序技术进行测序,测序长度为150 bp,在Illumina HiSeq 2000平台上用Novogene进行3个重复序列测序。在组装之前,对原始读取进行过滤,以获得高质量的干净读取。去掉碱基有二义性的序列(序列迹中以> 5% ' N '表示)、低质量读取(质量值≤10的读取率大于20%)和带有适配器的读取。对所有reads进行纯化后,使用Trinity对高质量reads进行组装,使用默认参数构建唯一的共识序列[23]. 每个单基因的表达水平是基于FPKM(每千碱基转录物片段数/100万个映射读次数)值计算的。利用IDEG6软件,通过卡方检验确定紫色和白色样本转录本之间的单基因差异[24]. 这个False Discovery Rate (FDR) method was introduced to determine the thresholdp-value at FDR≤0.001,以绝对值|log2Ratio|≥1为阈值,确定unigenes差异表达的显著性[25]. 收集京都基因百科全书(KEGG)和基因组(GO)中与花青素生物合成相关的所有单基因,并使用e值<1e-5的BlastX与转录组的单基因对齐[26]. 为了比较单基因的相对表达水平,将与花青素生物合成途径相关的单基因的FPKM值累加在一起。
DNA和cDNA制备
从1克鲜重的菊芋块茎中提取菊芋基因组DNA [27].采用Trizol法从菊芋不同器官的根、茎、叶、花和块茎表皮中提取总RNA [28]. 根据Fastking gDNA祛除RT SuperMix(中国北京天根)第一链合成试剂盒的制造商说明书进行cDNA第一链的合成。将DNA和合成的cDNA分别保存在不同的培养基中− 20 °C之后进行基因克隆和qPCR分析。
PCR和qPCR分析
引物由美国加州帕洛阿尔托的引物6.0设计,北京华大基因生物技术有限公司合成。50岁 μl反应体积25 μl 2×独特的HiQTM PCR缓冲液,0.5 μl Pfu DNA聚合酶(赛默飞世尔科学公司,中国北京),0.5 20微升 各pmol底漆,0.5 μl cDNA,并用dd-H定容2O。PCR方法为:98 2°C 最小值,98 °C持续10分钟 s、 53岁 30°C s、 72个 2°C 最少30分钟 循环,然后是72 °C持续10分钟 分钟,然后在4点储存 摄氏度。PCR产物用1%琼脂糖凝胶电泳检测,并用凝胶成像分析仪(中国上海塔农)拍照。表S列出了本研究中使用的所有引物5.
为了分析花青素合成相关基因的转录水平,在Applied Biosystems QuantStudio®3实时PCR系统(Thermo Fisher Company,Beijing,China)上进行实时荧光定量PCR(qPCR)。分析融合曲线以确定扩增的特异性。反应混合物(20 μL):2×SYBR绿10 微升,ddH2O 7.8级 μ 五十、 底漆0.6 各μl,cDNA模板1 μL(约100 纳克/微升)。PCR热循环包括四个步骤:95℃预变性 °C持续15分钟 最小值,95变性 °C持续10分钟 s、 60℃退火 °C持续20分钟 s、 延伸到72 30°C s、 40岁 循环总数。在60℃下采集荧光信号 °C退火阶段,以获得循环CT不同基因的价值。数据采用2- ΔΔCT方法[29].
生物信息学分析
ExPASY在线翻译软件(https://web.expasy.org/translate/)用来预测蛋白质。爆炸(https://blast.ncbi.nlm.nih.gov/blast.cgi)NCBI用于预测蛋白质保守区。在MEGA6软件平台上,采用邻接法构建了带有默认参数的系统发育树(http://www.megasoftware.net/mega6/faq.html) [30].BDPG (http://www.fruitfly.org/seq_tools/promoter.html)用于预测启动子的功能域。
HtMYB2在烟草中的过表达
烟草转化过表达载体为pJAM1502双载体,该双载体含有CaMV35S双启动子[31]. 这个pJAM1502: HtMYB2 construct was achieved using the Gateway cloning Kit (Invitrogen, Carlsbad, CA, USA). Binary vectors were electroporated into根癌农杆菌菌株GV3101。烟草(烟草)使用叶片转换方法进行转化[32]. 转基因苗在含3%(w/v)蔗糖、0.7%(w/v)MS(Murashige和Skoog)、0.7%(w/v)琼脂、1.0%蔗糖的选择性培养基上生长 mg/mL 6-苄基氨基嘌呤(6-BA),1.0 毫克/毫升1-萘乙酸(NAA),300 mg/L潮霉素和150 毫克/升卡那霉素。这些转基因苗在长日照条件下移栽到温室(16 h灯/8 h)1个月后。使用方差分析(ANOVA)和Tukey诚实显著性差异(HSD)检验确定显著性差异,其中P< 0.05被认为是显著的。所有数据均采用美国IBM公司的SPSS软件进行统计分析。
花青素测量
通过“果汁,饮料,自然色彩和葡萄酒的总单体青少年素颜料含量”(AOAC官方方法2005.02)来提取花青素。在530nm和657nm处的吸光度(a)(表示为Δag− 1.鲜重用分光光度计测定(北京综合分析公司,中国北京)。提取液中花青素的相对含量计算为[ΔA = A530– (0.25 × A.657)]校正了叶绿素及其降解产物对吸光度结果的影响[33,34].
自然种群的基因分型菊芋
基因启动子序列HTMLB2型基于热不对称交错(TAIL)-PCR方法从‘QY1’和‘QY3’中分离得到[35].根据启动子的核苷酸序列差异HTMLB2型在“QY1”和“QY3”中,设计了一个多态性PCR标记HtproS来区分“QY1”和“QY3”(表S)5). 等位基因变异HTMLB2型是在h . helianthus tuberosus.来自不同地区的180份菊芋材料,并提取DNA进行备份(表S4).
可用性数据和材料
HTMLB2型已上传至NCBI,Genebank:MN887536(于2020年5月11日发布)。转录组数据已成功上传至NCBI(http://www.ncbi.nlm.nih.gov/bioproject/605502),提交ID:SUB6924386;生物项目编号:PRJNA605502。本研究中生成或分析的所有数据都包含在文章及其附加文件中。
缩写
- 社区卫生服务:
-
查尔酮合酶
- 气:
-
查耳酮异构酶
- 第三层:
-
类黄酮-3-羟化酶
- F3'H:
-
类黄酮− 3′-羟化酶
- F3'5'高:
-
Flavonoid-3 ', 5 ' -羟化酶
- DFR公司:
-
二氢黄酮醇4-还原酶
- 答案:
-
花青素合成酶
- 客户尽职调查:
-
编码序列
- 重量:
-
野生型
- 罗斯福:
-
错误发现率
- bHLH公司:
-
基本螺旋环螺旋
- 质量控制要求:
-
定量实时聚合酶链反应。
参考文献
- 1.
陈福杰、龙晓华、李娥。植物抗真菌酚类化合物的评价菊芋L叶片对辣椒疫霉菌的化学计量学分析。分子。2019;24(23):4300.
- 2.
Saengkanuk A、Nuchadomrong S、Jogloy S、Patanothai A、Srijaranai S。分光光度法测定菊芋块茎中菊粉的含量。欧洲食品技术研究所。2011;233(4):609–16.
- 3.
Song Y、Wi SG、Kim HM、Bae HJ。过氧化氢-醋酸预处理菊芋生产纤维素生物乙醇的研究。生物酸技术。2016;214:30–6.
- 4.
Khuenpet K、Jittanit W、Sirisansaneaneyakul S、Srichamnong W。菊芋菊粉的生产(菊芋l .)块茎粉及其在商品食品中的应用。食品加工学报2017;41(4):e13097。
- 5.
金慧君、金hm、李kg、申建生、安慧君、郑成杰、权玉、南JH、李kt、张德成。从马铃薯块茎表皮中提取的p -香豆素类花青素。化学学报。2014;35(8):2529-32。
- 6.
哈穆兹K、拉赫曼J、帕兹德鲁K、托马塞克J、赫特曼科娃K、皮耶克V。不同肉色马铃薯块茎花青素含量及抗氧化活性的差异。植物土壤环境。2011;57(10):478–85.
- 7.
Mottaghipisheh J、Ayanmanesh M、Babadayei-Samani R、Javid A、sanaifard M、Vitalini S、Iriti M.测定伊朗7个石榴品种的总花青素、类黄酮、多酚和单宁含量。石油化工学报。2018;17(3):211-7。
- 8.
周LL,曾HN,施MZ,谢迪.高表达拟南芥PAP1/MYB75转录因子的烟草愈伤组织培养及花青素生物合成特性研究。足底。2008;229(1):37–51.
- 9.
关键词:小苍兰,拟南芥,bHLH蛋白,花青素,原花青素合成植物生理学与生物化学,2019;
- 10
徐祚立,黄勇,王飞,宋鑫,王国良,熊阿斯。紫色与非紫色胡萝卜花青素生物合成相关结构基因的转录谱(胡萝卜胡萝卜L.)品种揭示了明显的模式。BMC植物BIOL。2014; 14:262。
- 11
赵力,高力,王H,陈X,王Y,杨H,魏C,万X,夏T。类黄酮生物合成中的R2R3-MYB、bHLH、WD40及相关转录因子。功能整合基因组学。2013;13(1):75–98.
- 12
Ohno S,Hosokawa M,Hoshino A,Kitamura Y,Morita Y,Park Ki,Nakashima A,Deguchi A,Tatsuzawa F,Doi M,Iida S,Yazawa S. A BHLH转录因子,DVIVS参与了花青素综合的调节在大丽花(大丽花瓦尔贝利亚)。J Exp Bot。2011; 62(14):5105-16。
- 13
Pahlavani MH、Mirlohi AF、Saeidi G。红花花色和多刺性的遗传。杰瑞德。2004;95(3):265–7.
- 14
Goyer A、Hamlin L、Crosslin JM、Buchanan A、Chang JH。马铃薯Y病毒侵染早期抗感品种的RNA序列分析。Bmc基因组学。2015;16(1):472.
- 15.
王毅,孙马,白美联社。基于RNA序列的trext转录结构分析。方法分子生物学。1751;2018:89–99.
- 16.
宗Y,Zhu X,Liu Z,席X,Li G,曹,Wei L,李杰,Liu B.功能性MYB转录因子编码基因AN2与黑枸杞花青素生物合成相关。BMC植物生物学。2019;19(1):169.
- 17.
宗Y,席X,李S,Chen W,Zhang B,Liu D,Liu B,王D,Zhang H.小麦TaMYC1基因调控果皮花青素合成的等位变异及转录亚型。前植物科学。1645;2017:8.
- 18.
关键词:蓝色糊粉素1,相关性状,候选基因,ThMYC4E小麦.《公共科学图书馆•综合》。2017;12 (7):e0181116。
- 19.
宗仪,李氏,席X,曹D,王Z,Wang R,Liu B.调节花青素生物合成的MYB转录子过表达对烟叶转录组和代谢组的综合影响。国际分子科学杂志。2019; 20(20):E5123。
- 20
Yan H,Mengling L,Silan D.多菊花的异位表达(菊花)R2R3-MYB转录因子基因调控烟草花青素的积累。基因。2019;10(10):777.
- 21
花青素相关MYB基因的分离GbMYB2标准,来自Gynura二色的树叶。植物生物技术。2010;27(5):481–7.
- 22
MYB转录因子CmMYB7在菊花花青素合成中起负调控作用。关键词:菊花,MYB,转录因子,CmMYB7实验机器人。2019;70(12):3111-23。
- 23
Haas BJ、Papanicolaou A、Yassour M、Grabherr M、Blood PD、Bowden J、Couger MB、Eccles D、Li B、Lieber M、MacManes MD、Ott M、Orvis J、Pochet N、Strozzi F、Weeks N、Westerman R、William T、Dewey CN、Henschel R、Leduc路、Friedman N、Regev A。利用trinity平台从RNA-seq重建从头转录物序列,用于参考生成和分析。Nat协议。2013;8(8):1494–512.
- 24
Romualdi C, Bortoluzzi S, D'Alessi F, Danieli GA。IDEG6:一个在多个标签取样实验中检测差异表达基因的web工具。基因组学杂志。2003;12(2):159 - 62。
- 25
朱德、敖英雄、秦ZS、施华洛普A。高通量筛选具有受控错误发现率(FDR)和最小可接受强度(MAS)的共表达基因对。计算机生物学杂志。2005;12(7):1029–45.
- 26
Altermann E,Klaenhammer TR.PathwayVoyager:使用京都基因和基因组百科全书(KEGG)数据库的路径图。BMC基因组学。2005;6:60.https://doi.org/10.1186/1471-2164-6-60.
- 27.
Cota Sanchez JH、Remarchuk K、Ubayasena K。即用DNA提取CTAB法适用于标本室标本和粘液植物组织。植物分子生物学报告2006;24(2):161–7.
- 28.
罗德里格斯别墅E、伊巴拉·加梅兹C、德洛斯·桑托斯·维拉洛博斯S。用溶菌酶预处理和Trizol法从枯草芽孢杆菌中提取高质量RNA。微生物学方法。2018;147:14–6.
- 29.
Nassuth A、Pollari E、Helmeczy K、Stewart S、Kofalvi SA。改进的RNA提取和单管RT-PCR同时检测对照植物RNA和几种病毒的方法。维罗尔方法杂志。2000;90(1):37–49.
- 30
Kumar S、Stecher G、Tamura K。分子进化遗传学分析7.0版,用于更大的数据集。分子生物学。2016;33(7):1870–4.
- 31
Keadtidumrongkul P、Suttangkakul A、Pinmanee P、Pattana K、Kittiwongwattana C、Apisitwanich S、Vuttipongchaikij S。AtEXP4和CaMV35S启动子调控下CBM2a对拟南芥、烟草和赤桉生长的调控作用。转基因研究,2017年;26(4):447–63.
- 32
Mayo KJ,Gonzales BJ,Mason HS。根癌农杆菌对烟草NT1细胞的遗传转化。Nat协议。2006;1(3):1105–11.
- 33
Weiss D, Van Der Luit A, Knegt E, Vermeer E, Mol J, Kooter JM。矮牵牛花内源赤霉素的鉴定(花青素合成基因的诱导表达和脱落酸的拮抗作用)。植物杂志。1995;107(3):695 - 702。
- 34
萌XC,邢T,王XJ。光在非洲菊杂交菌中花青素积累调控的作用。植物生长调节。2004; 44(3):243-50。
- 35
Thanh T,Chi VT,阿卜杜拉议员,Omar H,Napis S。连接介导PCR和TAIL-PCR方法分离绿色微藻红细胞启动子序列的效率卷曲长尾蛇. 分子生物学(Mosk)。2012;46(1):64–70.
确认
感谢《BMC植物生物学杂志》的两位审稿人和编辑对我们的稿件进行了认真的审稿,并提出了一些有价值的建议。我们要感谢青海大学和西北高原生物研究所的支持。
基金
国家自然科学基金项目(no . 31660588);中国科学院西部之光计划项目;青海省创新平台建设项目。资助项目负责人孙雪梅主要为本研究提供思路和温室条件。资助机构并没有在研究的设计、收集、分析和解释数据以及撰写手稿中发挥作用,而只是提供资金支持。
作者信息
从属关系
贡献
BL设计了实验。JG、YZ和XS进行了实验。SY和LW收集材料,管理培养室种植,拍摄实验照片。JG, YZ, XS, BL对数据进行分析并撰写论文。所有作者阅读并批准最终稿件。
通讯作者
道德宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
附加信息
出版商说明
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充资料
附加文件1:图1。
用于扩增HTMYB2两个不同等位基因(QY1和QY3)的诊断引物HTproS的研制。标记产生的片段为124个 血压或103 bp,分别表示QY1和QY3的启动子。
附加文件2:表S1。
转录组分析中测序、筛选和组装的统计。
附加文件3:表S2。
花青素生物合成途径中结构和调控基因的表达水平。
附加文件4:表S3。
HtMYB2启动子预测。
附加文件5:表S4。
的起源菊芋及其使用HTPROS标记检查的MYB基因型。
附加文件6:表S5。
本研究中使用的寡核苷酸引物。
权利和权限
开放存取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用本文
高,J.,孙,X.,宗,Y。等等。功能性MyB转录因子基因HTMLB2型与花青素生物合成有关吗菊芋LBMC植物杂志20,247(2020)。https://doi.org/10.1186/s12870-020-02463-8
收到:
接受:
发表:
关键词
- 菊芋L
- 块茎表皮颜色
- 花青素
- MYB