摘要
背景
植物转录因子(TF)是关键转录调节来操纵宿主免疫的调控网络。然而,植物TF家庭的响应病原体,特别是耐和易感宿主植物的转录全球重新编程,在很大程度上仍然未知。
结果
在这里,我们在攻击时从抗性胡椒线CM334和易感辣椒线EC01进行了时间序列RNA-SEQPhytophthora Capsici,富集分析表明WRKY家族在CM334和EC01中富集最显著。有趣的是,我们发现近一半的WRKY家族成员显著上调,而在这两个系中没有一个下调。这些诱导的WRKY基因在CM334和EC01之间有很大的重叠。更值得注意的是,这些诱导的WRKY基因大多以时间顺序表达,主要分为3个亚群:早期应答(3个hup)、中期应答(24个hup)和中晚期应答(ML-up)基因。此外,在EC01中发现这些ML-up基因的响应延迟数小时。通过病毒诱导基因沉默,筛选出19个WRKY诱导基因进行功能鉴定。结果表明,沉默Cawrky03-6,Cawrky03-7,Cawrky06-5或Cawrky10-4显着提高易感性P. Capsici.在CM334和EC01中均有表达,表明它们可能参与辣椒的基础防御P. Capsici.;虽然沉默了CaWRKY08-4和CaWRKY01-10显着损害了CM334的抗病抗性,但在EC01中,表明这两个腕基因是特异性在耐药辣椒植物中的突出调节剂。
结论
这些结果在很大程度上扩展了我们对WRKY基因家族在辣椒抗病中的理解P. Capsici.为疫病的遗传改良提供了潜在的应用价值。
背景
在与多种病原体的共同进化过程中,植物进化出了一种高度复杂和有效的先天免疫系统来保护自己免受病原菌入侵。该系统由两个主要层组成[1,2[通过植物图案识别受体(PRRS)对高度保守的病原体相关分子模式(PAMPS)感知,触发第一植物免疫层,并称为PAMP触发的免疫(PTI)。通过一些适应的病原体,PTI可以通过分泌到宿主细胞中的效应器来衰减或阻塞。这种相容相互作用期间的剩余削弱的植物免疫定义为基础防御,其在易感植物中也被激活;但是,预防疾病繁殖是不足的[3.].植物免疫的第二层是由电阻(R)的编码宿主受体基因在直接或间接地识别病原体递送效应触发和被称为作为效应触发免疫(ETI),这带来了更健壮的防御反应,往往伴有过敏性反应[2].尽管具有免疫应答的幅度和持续时间的变化,但PTI和ETI共享一些常见的信号传导组分,例如反应性氧物种(ROS),MAPK级联,植物激素[4,5,6,7].这些防御信号通常通过各种转录因子(TFS)的作用来整合和转发到适当的免疫输出中。
PTI和ETI都在转录水平上受到很大的调控,这是由构成转录网络的各种植物转录因子作用的[8].在过去的几十年中,大量植物TFS,特别是在模型植物中拟南芥和米饭,在功能上表现为调制防御反应中的重要作用[9,10.].积累的数据表明,一些植物TF家族,如AP2/ERF、bHLH、bZIP、NAC和WRKY是防御过程中的关键调控因子[4,9].然而,以往的研究主要集中在单个TF在宿主免疫应答中的功能特征,对某些植物TF家族,特别是抗病和易感宿主植物之间的全基因组和系统比较分析,将对阐明它们在病原体感染过程中的调控关系有价值。
胡椒(甜椒)是全球经济上重要的作物。Phytophthora枯萎辣椒是由oomycete病原体引起的毁灭性疾病Phytophthora Capsici[11.,12.].这种病原体可以感染辣椒植株的所有部位,包括根、叶和果实[11.,13.].该病害经常达到流行水平,在辣椒产区造成巨大的产量损失。在植物- - - - - -疫霉互动系统,最近已经确定了几个WRKY TFS在植物防御中发挥重要作用疫霉物种。例如,来自的WRKY TFS尼古利亚娜·宾夕法尼亚州可以被MAPK磷酸化并调节免疫P. Infestans.由RBOHB依赖的ROS突发介导的[14.].在甘氨酸最大, GmWRKY31和GmWRKY40在抗P. sojae.[15.,16.].在茄属植物tuberosum,STWRKY1和STWRKY8调节苯丙烷丙烷和苄基异喹啉生物碱途径赋予抵抗力P. Infestans.,分别[17.,18.].在Solanum pimpinellifolium., 8个WRKY转录因子被确定参与响应P. Infestans.通过转录组分析发现SpWRKY3在抗晚疫病中起正调节作用[19.].SpWRKY1在烟草和番茄中过表达,抗性增强p . nicotianae和P. Infestans.,分别[20.,21.,22.].功能分析的损失和增益还表明,SPWRKY6作为番茄抗性的阳性调节剂P. Infestans.感染[23.].重要的是,这些结果还表明,WRKY转录因子的一个子集可能参与了对单一病原体感染的反应。在甜椒,虽然由疫霉菌引起的疫病P. Capsici.是世界范围内最重要的疾病之一,WRKY家族成员在防御该病原体方面的全球转录重编程和功能鉴定尚不清楚。
在此,我们对抗性辣椒CM334和敏感辣椒EC01进行了时间序列rna测序P. Capsici..本研究的目的是确定参与辣椒防御的关键TF家族及其家族成员P. Capsici.为植物防御信号调控提供了新的思路。
结果
高通量RNA测序和DEG分析
在全基因组范围内研究辣椒的转录调控机制P. Capsici.分析了来自抗性线CM334的时间序列RNA-SEQ数据和0,3,6,12,24,48和72小时的易感线EC01和接种后(HPI)。如图1所示。1a,敏感品系EC01接种强毒辣椒后,出现严重的病害症状(枯萎表型)P. Capsici.染色JX1,但不在耐药线CM334中,这与上一份报告的结果一致[24.].基于illumina的下一代测序从辣椒根感染P. Capsici..收集了总共42个样品(2种基因型×7时间点×3生物重复),用于图书馆建设。从CM334和EC01的每个样本产生约8020万和8460万原始读取(附加文件1:DataSet S1)。在用低质量读数过滤后,分别从CM334和EC01的每个样本获得约7960万和84.0万清洁读数。平均而言,来自CM334和EC01的每个样本的6990万(87.8%)和68.0百万(80.1%)分别与辣椒CM334基因组PEP(V1.6)排列。在对每个基因模型的对齐之后,我们将映射的数量标准化为每公斤百万(FPKM)的片段。在接种和模拟接种的样品之间,我们鉴定了差异表达基因(DEGS,折叠变化> 2和FDR≤0.01)。在CM334中鉴定了大约4075次,具有2530个上调和1545个下调基因。相比之下,在EC01中鉴定了5962只具有3732个上调和2230个下调基因的℃(图。1b)。
辣椒系CM334和EC01之后的表型表征和参见肽鉴定P. Capsici.感染。一个2个辣椒品系CM334和EC01接种后3 d的发病症状P. Capsici..b总共,从CM334和EC01鉴定了5298和7107差异表达基因(DEGS),并且在两条线中通常鉴定2746℃。c在所有转录因子(TFS)中,分别从CM334和ECO1鉴定258和437个TF DEG,并且在两条线中通常鉴定161个TF次数。d在所有WRKY转录因子中,从CM334和EC01中分别鉴定出36和34个WRKY DEGs,其中2个CaWRKY基因在CM334中特异性上调。向上的箭头表示上调的表达式。向下箭头表示向下调整的表达式
辣椒响应中TF家族的整体分析P. Capsici.感染
随着TFS在植物防御信号中发挥重要作用,我们调查了所有辣椒TF家族的转录变化P. Capsici.感染。在甜椒基因组,根据PlantTFDB v5.0确定并分为58个家族的基因组,分为58个家族[25.].售P. Capsici.在抗性辣椒品种CM334中,有258个TF基因(其中137个表达上调,121个表达下调)差异表达,约占鉴定到的所有TF基因的15.5%;而在敏感品系EC01中,有437个TF基因(其中上调基因249个,下调基因188个)在侵染过程中发生了显著改变,约占所有已鉴定TF基因的26.2%(图2)。1c).这些结果表明,在转录过程中,CM334和EC01都发生了显著的变化P. Capsici.感染,而更度的视角和差异表达的转录因子的EC01。
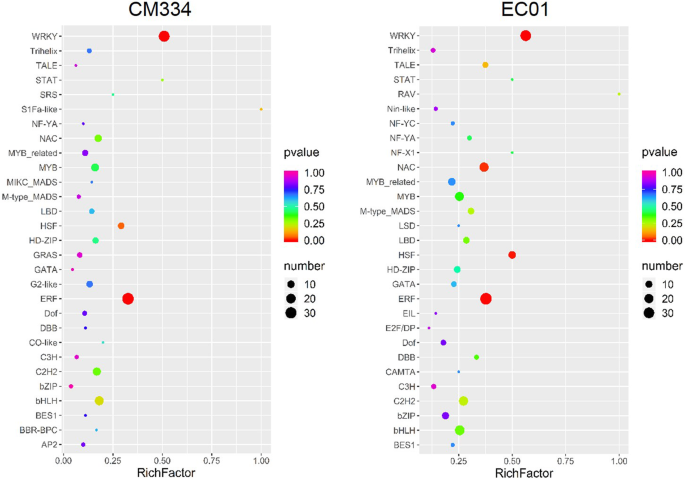
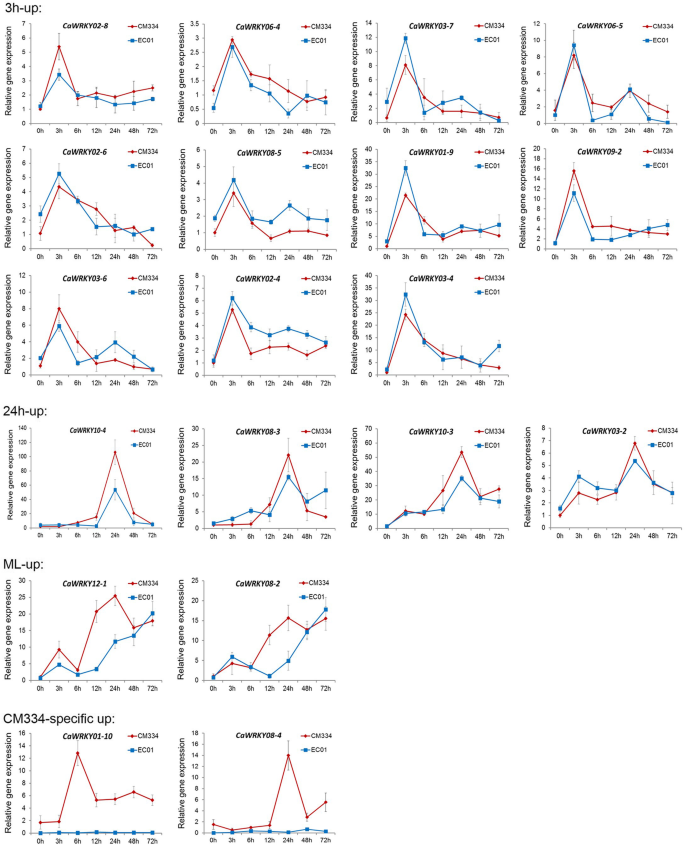
先前的报道表明,一些植物TF家族如AP2 / ERF,bHLH结构,bZIP类,NAC和WRKY是防御反应的关键调节[4,9].为了深入了解58个TF家庭P. Capsici.感染,我们使用两条线中所识别的TF次进行富集分析。在所有这些TF家庭中,发现WRKY家族中最具显着富集CM334和EC01(图。2和附加文件2:图S1)。深入分析表明,在抗性线CM334(36,〜50.0%)和敏感线EC01(34,〜〜47.2%)中,近一半的腕部基因显着诱导。在感染期间,在两条线上都没有更令人惊讶的是,没有任何腕子基因在两条线上显着下调(表格1和图。1d)。我们的比较转录组分析表明wrky可能在调节宿主转录免疫应答方面发挥更大的作用P. Capsici.,因此我们在后续的研究中主要关注WRKY家族。
辣椒品系CM334和EC01后TF DEGs的富集分析P. Capsici.感染。为了深入了解58个TF家庭P. Capsici.感染后,用两个品系中所有上调的TF DEGs进行富集分析。在所有TF家族中,WRKY家族在CM334和EC01中富集最为显著。富集分析采用ggplot2包(http://had.co.nz/ggplot2/)
辣椒中棘手家族成员的转录体分析P. Capsici.感染
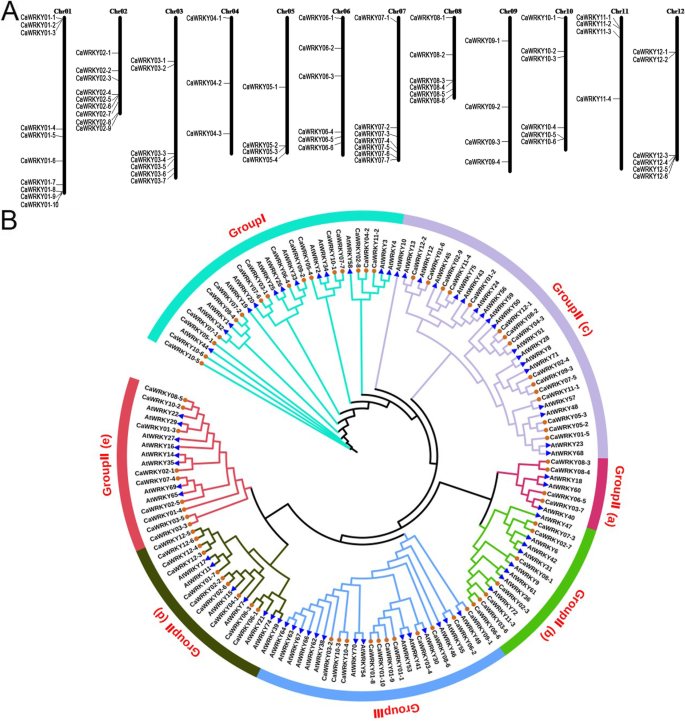
根据辣椒CM334基因组版本PEP (v1.6),共鉴定出72个含有保守WRKY结构域的CaWRKY基因。由于它们与来自拟南芥还要避免命名混乱[26,27[我们根据染色体的位置指定从Cawrky01-1到Cawrky12-6的所有这些Cawrky基因。这些Cawrky基因的染色体分布如图2所示。3..关于PEP(v1.6)中的这些Cawrky基因的详细信息,包括PEPE座(V1.6),WrkyGok eptapeptide拉伸,锌手指基肽类型和基因分类中的基因座位数3.:DataSet S2。Cawrky成员的核苷酸和蛋白质序列列于额外的文件中4:DataSet S3。通过多个序列比对分析这些72 Cawrky和71 Atwrkys之间的系统发育关系(图。3.).结果表明,只有15个Cawrkys与他们的相似性很高拟南芥WRKY直接同源。
染色体位置和CaWRKY家庭成员的进化树分析。一个所有识别出72个姓名甜椒(Cawrkys)使用BLASTN映射到辣椒基因组数据库中的“CM334”染色体。MapInspect软件(http://mapinspect.software.informer.com/)来绘制染色体上的基因位点。b72个cawrky和71个atwrky的多重排列拟南芥蒂利亚纳使用Clustalx2进行(http://www.clustal.org/clustal2/).对准结果用于使用PHYML软件的邻接方法构建系统发育树(http://www.atgc-montpellier.fr/phyml/)
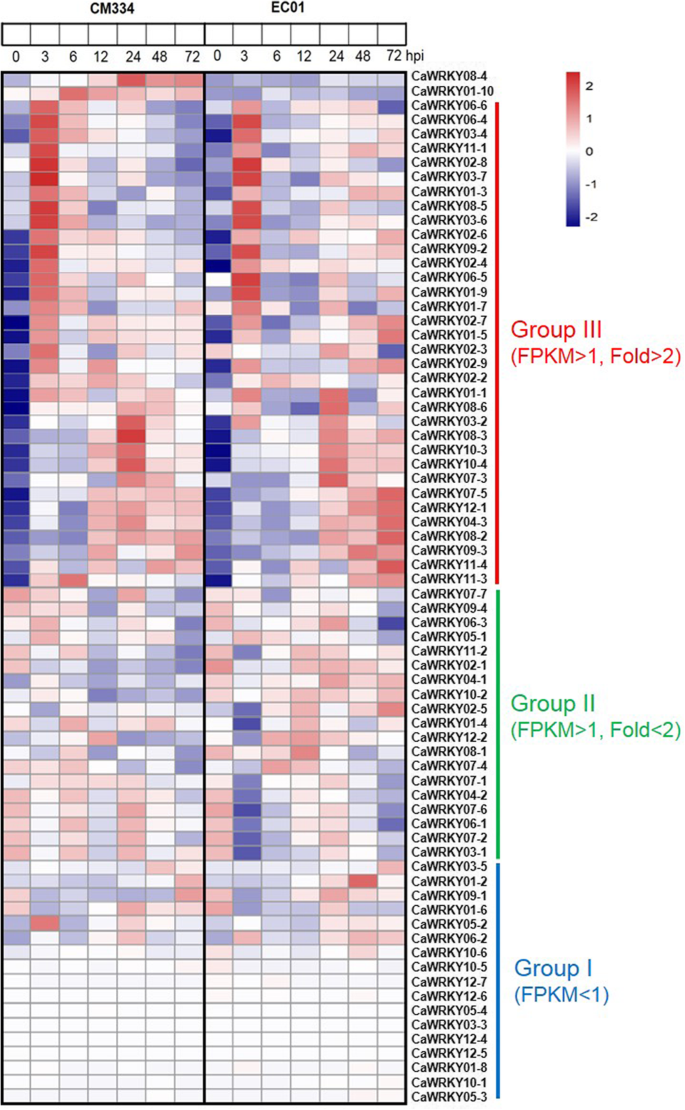
根据转录本丰度和基因表达的动态变化,这些CaWRKY家族成员可分为三组(fig . 2)。4和5a、b);第1组CaWRKY基因在CM334和EC01中分别有17个和19个不表达或极低表达(FPKM < 1.0);第二组包含两个品系19个CaWRKY基因,接种与模拟接种植株之间的转录水平基本一致;ⅲ组,CM334和EC01中分别有36和34个CaWRKY基因在感染过程中显著上调。值得注意的是,这些CaWRKY诱导基因在CM334和EC01中有很大的重叠,但有两个CaWRKY基因(CaWRKY08-4和CaWRKY01-10)是抗性系特异性上调的。
WRKY家族成员在辣椒响应中的热图P. Capsici.感染。基于转录性丰富和基因表达的动态变化,72个Cawrky家族成员主要分为三组:I族,表达(FPKM <1);II组,均为或更少的组成型表达(FPKM> 1,折叠<2);III组在感染期间显着上调(FPKM> 1,折叠> 2)。使用GGPLOT2封装的RNA-SEQ数据集的Z分数用于分析基因表达模式(https://cran.r-project.org/web/packages/ggplot2/)使用Pheatmap包构建热图(https://cran.r-project.org/web/packages/pheatmap/)
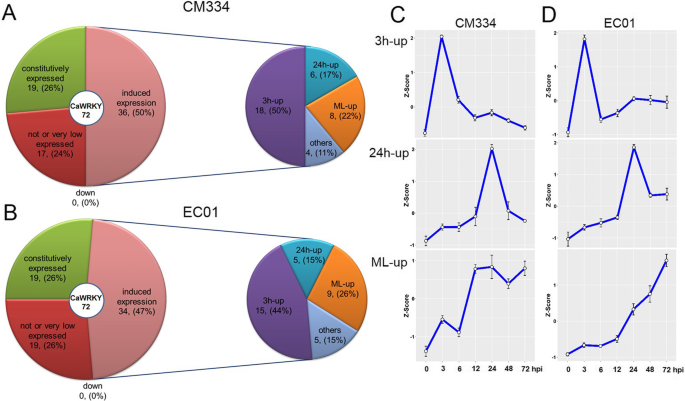
辣椒中诱导腕骨的转录模式P. Capsici.感染。这些上调的CaWRKY基因主要可以分为三个亚组:早期反应(3个hup)、中期反应(24个hup)和中晚期反应(ML-up)基因在(一个) CM334及(b) EC01。CM334和EC01中三个WRKY亚群成员的转录模式显示在(c)和(d)分别。使用GGPLOT2封装的RNA-SEQ数据集的Z分数用于分析基因表达模式(https://cran.r-project.org/web/packages/ggplot2/)
更有趣的是,这些诱导的CaWRKY基因主要可以分为三个亚组:早期应答(3个h-up)、中期应答(24个h-up)和中晚期应答(ML-up)基因(图1)。5c, d和附加文件5:数据集S4)。在CM334 CaWRKY表达36上调的基因中,这是发现其中18山峰的转录诱导3居民,其中6显示最高记录现病史在24级,8年中都响应基因转录诱导维持在12 ~ 72居民。EC01中上调CaWRKY的34个基因中,有15个在3 hpi水平上转录量最高,5个在24 hpi水平上转录量最高,9个是ML-up基因,但有几小时延迟。我们的时间分辨转录组分析表明,3 hpi和24 hpi是辣椒响应WRKY家族成员转录重编程的两个关键时间点P. Capsici.感染。
辣椒防守棘手家庭成员的功能识别P. Capsici.
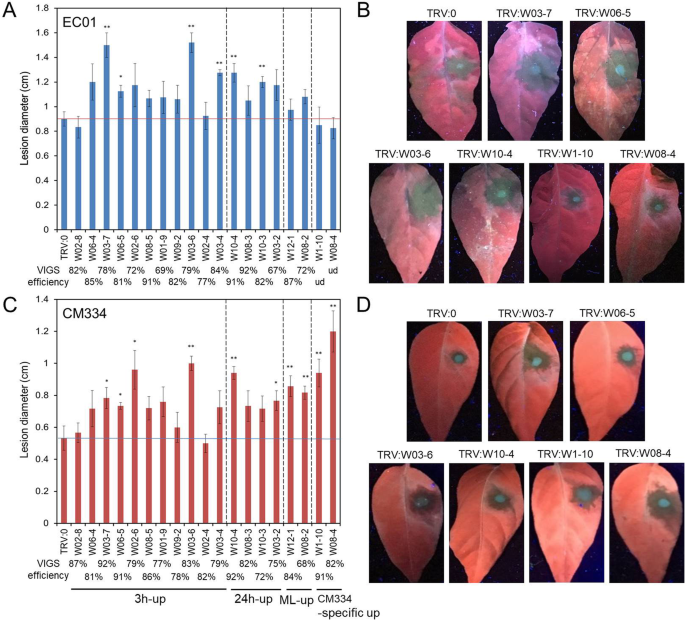
进一步表征他们对辣椒防守的贡献P. Capsici.选择感染,这些诱导的Cawrky基因具有差异表达模式的功能鉴定。如图1所示。6中,所有通过qRT-PCR分析验证测试的基因是与RNA-SEQ数据的结果最一致。然后我们进行敲低实验既在易感线EC01和使用烟草脆裂病毒(TRV)诱导的基因沉默系统[耐线CM33428,29].每个CaWRKY TF的基因沉默效率通过qRT-PCR分析在其最高感应的时间点之后,确定P. Capsici.接种。结果表明,EC01和CM334中所有测试基因的沉默效率大于65%,除外CaWRKY08-4和CaWRKY01-10(图。7A,C和附加文件6:图S2)。由于特别是在CM334的上调P. Capsici.感染,复制丰富CaWRKY08-4和CaWRKY01-10在基因沉默后,在EC01中对于EC01可检测到太低。
WRKY家族成员在辣椒的防御功能鉴定P. Capsici.被VIGS系统感染。选择其中19个差异表达CaWRKY基因进行病毒诱导基因沉默(VIGS)。在其最高诱导时间点之后,QRT-PCR分析测定了Vigs效率P. Capsici.接种(一个) EC01及(c) CM334。表达水平用CaActin,表示为相对于TRV:0处理叶片的平均倍数变化,设为1。从离体叶片(n= 5)接种后2.5天(b) EC01及(d) CM334。星号表示通过最小显著差异(LSD)检验与TRV:0空载体对照相比有统计学意义的差异(*P < 0.05; **P < 0.01). This experiment was repeated twice with similar results
接种后P. Capsici.,病原体仅限于TRV:0处理CM334叶子上的小,局部病变(无萎缩);然而,它在TRV:0处理的EC01叶上大大扩展并显示出大量损害,并且大多数接种的EC01叶在接种后3天内显示枯萎的表型。对于这些TRV处理的叶片,靶向所选的Cawrky基因,我们发现大多数重叠诱导的Cawrky TFS贡献了各种程度的辣椒防御P. Capsici.(图。7b, d和附加文件7:图S3)。其中,沉默的Cawrky03-6,Cawrky03-7,Cawrky06-5和Cawrky10-4在CM334和ECO1中显着损害了抗病抗性。而对于CaWRKY08-4和CaWRKY01-10然而,它们的沉默显着损害了它们对CM334的病原体的抵抗力,但不在EC01中,表明这两种腕部是特别是在耐药辣椒植物中的突出调节剂。
讨论
有人认为,植物对病原体攻击的防御主要是由复杂的转录网络调控的[30.],和植物转录因子可能是植物免疫反应的关键调节剂[9,10.].近日,来自不同植物物种的几个WRKY转录因子已被证实参与植物防御疫霉SPP。[14.,15.,16.,17.,18.,19.,20.,21.,22.,23.].然而,尽管植物症枯萎经常引起辣椒的生产严重损失,但我们对Cawrky TFS在胡椒免疫力的作用的知识P. Capsici.是非常有限的。本研究比较分析了耐药品系CM334和易感品系EC01之间的WRKY家族基因动态谱,发现这些CaWRKY家族基因显著上调抗性品系CM334和易感品系EC01之间的WRKY家族基因P. Capsici.在功能研究。
辣椒基因组中分为58个家族的大约1665个转录因子[25.],共258个437 TF DEGS在本研究中鉴定到在它们的转录物水平在抗性系CM334和易感线EC01经被改变P. Capsici.分别感染(无花果。1c)。从富集分析数据表明,WRKY家族最为富集都CM334和EC01(图2),暗示Wrky TFS可能在调制宿主转录免疫中可能发挥更重要的作用P. Capsici.感染。More in-depth analysis indicated that 36 CaWRKY genes in CM334 (~ 50.0%) and 34 in EC01 (~ 47.2%) were up-regulated, whereas none of them were down-regulated during the defense response (Table1和图。1d)。同样,前一项研究表明,阿克德基基因的27个来自拟南芥在治疗后2小时诱导FLG22诱导后,虽然下调两种ATWRKY基因是下调的[31].Naveed等也发现,Carrizo citrange的大部分转录因子,如ERF、bZIP和DOF,在转录过程中都表现出了上升和下降的混合趋势,而WRKY的大部分转录因子在转录过程中都是上调的P. Parasitica.感染[32].为了我们的知识,只有两份关于Cawrkys的回应的报告P. Capsici.目前感染情况[24.,26].lu等。选择的七个Cawrky基因(其中4个属于3个H-Up基因,一个是组成型表达的,在CM334和EC01中表达一个非常低;并且一个属于EC01中的ML-UP基因,并在CM334中诱导6 HPI我们的RNA-SEQ数据)并鉴定其表达水平以响应P. Capsici.通过QRT-PCR分析接种后1天。本报告显示,六个Cawrky基因之后诱导P. Capsici.接种,而一个Cawrky基因没有显示CM334的任何显着变化。在欧共体,之后P. Capsici.接种后,1个CaWRKY基因表达上调,其余6个CaWRKY基因保持不变或轻微下调。近期,郑等研究表明,在辣椒品种尊拉1中,至少有10个CaWRKY基因被诱导P. Capsici.使用具有四个时间点的RNA-SEQ数据接种(接种后的0,1,2和3天),而在感染期间三个Cawrky基因被下调。总的来说,这些报告显示了Cawrky TFS的相似趋势P. Capsici.感染我们的发现,但也显示出轻微的尊重,这可能是由于使用不同的辣椒线,P. Capsici.菌株,不同时间点采集样本。此外,我们的数据显示,这些诱导的CaWRKY基因在CM334和EC01之间高度重叠。与先前的几项研究一致[4,5,6[表明,抗性和易感植物均为大量WRKY TFS作为常见的信号传导组分以调节免疫应答。
根据转录模式的差异,这些诱导的腕骨基因主要分为三个亚组:早期反应(3 H-UP),中响应(24 H-Up)和中期反应(ML-UP)基因(图.5).这种时序表达模式表明,3和24 HPI是辣椒对棘手的复制重新编程中的两个关键时间点。P. Capsici..与透水研究一致[11.,33,34]我们推测这可能与致病过程密切相关P. Capsici.在殖民。在2-4 hpi时,P. Capsici.他们的鞭毛,否定并坚持植物表面;在此时间点,鞋面可能被植物膜局部化的PRR感知到触发PTI或基础防御,导致第一轮WRKY TFS诱导[11.,31].在~ 24hpi时,菌丝能穿透植物宿主细胞,形成吸器结构;此时,病原体衍生的效应子可能被传递到植物宿主细胞中,并被一些进化较低的细胞内宿主受体感知,触发防御信号,导致第二轮WRKY转录因子诱导[11.,35,36].在进一步侵入时,由于在易感寄主植物中缺乏相应的细胞内高级寄主受体(这里称为R蛋白),菌丝在大量易感寄主细胞中扩散并到达维管组织,导致枯萎表型。而在抗性寄主植物中,效应剂可以被R蛋白识别,菌丝在表皮细胞中的扩张受到限制,维管组织定植缺失[6,11.,33,34],这是根据我们对CM334和EC01中疾病表型的观察结果接种的P. Capsici.(图。1A和7).
虽然这些诱导的CaWRKY基因在抗病和感病寄主之间存在很大的重叠,但也有一些CaWRKY基因在CM334和EC01之间表达谱不同。比较转录组分析表明,ML-up CaWRKY基因在抗性寄主中的响应比敏感寄主早数小时(图2)。5C和D)。特别是CaWRKY08-4和CaWRKY01-10仅在CM334中表达上调,而在EC01中表达极低(图3)。4和6).我们的敲除实验表明,大部分重叠诱导的WRKY转录因子在辣椒抗病和感病植株中起到基础防御作用P. Capsici.(图。7).虽然其中一些诱导了CaWRKY基因,如CaWRKY02-4和CaWRKY02-8,对抗病无显著贡献,不能排除其在防御信号中功能冗余的可能性。沉默的CaWRKY08-4或CaWRKY01-10其对CM334的病原体的抗性显着损害,但不在EC01中,表明这两个Cawrky基因在抗性辣椒植物中特别是突出的调节剂。事实上,一些病原体可以提供效应器来定位多个防御促进WRKY转录因子,导致WRKY-DNA的损失结合和需要防御基因表达和抗病性[反式激活功能37,38,39].是否疫霉利用这种特殊的策略来抑制敏感寄主植物中WRKY转录因子(如CaWRKY08-4和CaWRKY01-10)的转录或功能,需要进一步研究。值得注意的是,包括wrky在内的应对病原体感染的大量转录因子可能在一个复杂的调控网络中发挥作用,而不是以线性方式[31,40,41].对其上游信号元件(如顺式元件和反式元件)和下游靶基因的进一步鉴定,可能为深入了解辣椒抗病的分子机制提供新的思路P. Capsici..
结论
在这项研究中,我们在攻击时从抗性和易感辣椒厂进行了时间系列RNA-SEQP. Capsici.,揭示了WRKY家族成员在应对病原菌时的转录相似性和差异。我们还用VIGS进行了敲除实验,从功能上研究了它们在抗病中的作用。总体而言,本文提供的数据极大地扩展了我们对WRKY家族成员在植物防御反应中的认识,也为防治疫病的遗传改良提供了潜在的应用价值。
方法
植物材料,病原体和培养条件
种子的P. Capsici.-resistant pepper landrace line ‘Criollo de Morelos 334’ (CM334) and susceptible cultivar ‘Early Calwonder 01’ (EC01) were sown in a soil mix [peat moss: perlite, 2:1 (v/v)] in plastic pots, and were placed in a growth room under a condition of 25 °C, 60–70 mmol photons m−2 s−1,相对湿度为70%,以及16-H光/ 8-H黑色光周期[29].一个高度的毒性P. Capsici.JX1染色由我们实验室分离培养,如前所述[42].简单来讲,P. Capsici.染色在10% (v/v) V8琼脂培养基上培养,然后转移到10% (v/v) V8液体培养基中,25℃黑暗培养3天。的菌丝P. Capsici.采用消毒H2o三次诱发Zoospore释放[42].
转录组分析
获得RNA-SEQ数据P. Capsici.- 辣椒组织,4周龄(5真叶阶段)在25℃下在接种之前,在16-H光/ 8-H黑色循环下在16-H光/ 8-H暗循环下在25℃下在25℃下在25℃下培养无土培养辣椒系CM334和EC01。使用血细胞计数计数血细胞计数,将它们的密度调节至约5×105游动孢子/毫升。将游动孢子悬浮液浸泡辣椒根,以确保根表面能附着足够的游动孢子,分别在接种病原菌后0、3、6、12、24、48、72 h收获。从每个处理的三个生物复制中提取的RNA样本用于文库构建。这些构建的文库(PE150)然后由Illumina HiSeq2000测序(Illumina Inc., San Diego, USA)。经过BBTools低质量读取过滤后(https://jgi.doe.gov/data-and-tools/bbtools.)然后将清洁读数与辣椒CM334基因组(V1.6)对齐(http://peppergenome.snu.ac.kr/),使用HISAT2程序(https://github.com/DaehwanKimLab/hisat2).继对准每个基因模型,标准化的短片段来FPKM数。使用GGPLOT2封装的RNA-SEQ数据集的Z分数用于分析基因表达模式(https://cran.r-project.org/web/packages/ggplot2/)使用Pheatmap包构建热图(https://cran.r-project.org/web/packages/pheatmap/).富集分析由GGPLOT2包进行(http://had.co.nz/ggplot2/).
鉴定Cawrky家庭成员
辣椒注释的基因组和蛋白质序列从CM334基因组版本PEP (v1.6) (http://peppergenome.snu.ac.kr/).WRKY域(PF03106)是从PFAM数据库获得的(http://pfam.sanger.ac.uk/)中,并使用HMMER 3.0软件程序来鉴定推定的CaWRKY蛋白(http://hmmer.janelia.org/)根据HMMR用户指南。使用智能程序进一步确认非冗余Cawrky蛋白序列(http://smart.embl-heidelberg.de/).
染色体定位和进化树分析
利用BLASTn将所有鉴定的cawrky染色体定位到辣椒基因组数据库中的“CM334”染色体上。MapInspect软件(http://mapinspect.software.informer.com/)来绘制染色体上的基因位点。拟南芥蒂利亚纳WRKY(ATWRKY)蛋白序列从TAIR下载(https://www.arabidopsis.org/browse/genefamily/WRKY.jsp).我们使用ClustalX2对72 CaWRKY和71 AtWRKY全长蛋白序列进行了多重比对(http://www.clustal.org/clustal2/).对准结果用于使用PHYML软件的邻接方法构建系统发育树(http://www.atgc-montpellier.fr/phyml/).
RNA提取和QRT-PCR分析
总RNA提取P. Capsici.如前所述的指示时间点的辣椒组织[42].简而言之,用PureLink RNA迷你试剂盒(Invitrogen, Carlsbad, CA, USA)提取总RNA,并用RNase-free DNase I (Takara Bio, Kusatsu, Japan)处理。然后用上标II逆转录酶(Invitrogen)反转录cDNA第一链。为确定所选基因的相对转录水平,采用特异性引物进行实时PCR(附加文件)8根据BIO-RAD Real-time PCR系统(Foster City, CA, USA)和SYBR Premix Ex Taq II系统(TaKaRa)的制造商说明。每个处理进行三个独立的生物重复。采用Livak方法分析数据,计算归一化相对表达水平(2-ΔΔct)[43].辣椒家政基因CaActin作为内源性控制[44].
VIGS矢量构建
为了构建选定CaWRKY基因的病毒诱导基因沉默(VIGS)载体,使用Sol基因组网络(SGN)网站上的VIGS工具,通过BLAST分析确定每个特定的沉默片段[45],在辣椒基因组cDNA数据库中未检测到脱靶基因(匹配片段不超过19 bp)。利用PrimeSTAR GXL DNA聚合酶(Takara Bio Inc., Otsu, Japan)对CM334的cDNA进行PCR扩增,引物列于附加文件8:表S1。将纯化的片段克隆到进入载体pDONR207中,然后通过Gateway®技术(Invitrogen)克隆到TRV沉默载体PTRV2中。
辣椒CaWRKY基因的VIGS分析
对于辣椒植株各CaWRKY基因沉默,我们采用根据我们以往的研究[基于TRV-VIGS系统28,29].简单来讲,A. Tumefaciens.含有PTRV1和PTRV2的菌株GV3101:Cawrky.重新悬浮于诱导培养基(OD600 = 0.8),并在1:1(v / v)的比例下彻底混合,然后渗透到2周龄辣椒植物的两个子叶中。PTRV2:0(空向量)被切断为阴性控制。PTRV2:李,沉默胡椒植物去饱和酶(PDS)基因用于诱导光漂白表型,用作指示控制(附加文件9:图S4)。将浸种辣椒植株置于16°C黑暗培养箱中保存56 h,然后在上述正常条件下生长3-4周[28,29,46].
P. Capsici.感染测定
在侵染试验中,将TRV处理的辣椒植株的第3和第4片离体叶片接种高毒力菌株P. Capsici.分别染色JX1动物孢子[42].为了区分不同VIGS植株的病害表型,特别是对敏感品系EC01,每个离体叶片接种~ 100P. Capsici.低疾病压力条件下的动物孢子(相对低浓度)。之后P. Capsici.接种CaWRKY后,在每个CaWRKY基因的最高诱导时间点,利用第4离体叶片进行qRT-PCR分析,并在检测病斑前,将第3离体叶片在25℃、高湿、黑暗条件下保存2-3天。实验重复2次,每次5个重复。
可用性数据和材料
本研究产生的所有数据均包含在论文和支持信息文件中。本研究中使用的RNA-Seq数据可在NCBI Sequence Read Archive (SRA)中获得,登录号为:PRJNA627546 (https://www.ncbi.nlm.nih.gov/sra/prjna627546).
缩写
- 度:
-
差异表达基因
- 罗斯福:
-
错误发现率
- FPKM:
-
每公斤百万零件
- HPI:
-
接种后的小时
- 存在:
-
定量实时聚合酶链反应
- TFs:
-
转录因子
- TRV:
-
烟草使病毒
- 中收取:
-
病毒诱导的基因沉默
参考
- 1。
Jones JD, Dangl JL。植物的免疫系统。大自然。2006;444(7117):323 - 9。
- 2。
Dangl JL,Horvath DM,Staskawicz BJ。将植物免疫系统枢转从解剖到部署。科学。2013; 341(6147):746-51。
- 3.
Bhattarai Kk,Atamian HS,Kaloshian I,Eulgem T. Wrky72型转录因子有助于番茄和拟南芥的基础免疫以及由番茄R基因Mi-1介导的基因抗性。工厂J.2010; 63(2):229-40。
- 4.
Tsuda K, somsich IE。植物免疫的转录网络。新植醇。2015;206(3):932 - 47岁。
- 5.
Tsuda K, Katagiri F.比较模式触发和效应触发免疫的信号机制。植物学报。2010;13(4):459-65。
- 6。
Buscaill P,Rivas S.植物防御反应的转录控制。CurrOp植物BIOL。2014; 20:35-46。
- 7。
彭YJ,面包车Wersch R,张YL。收敛和发散的PAMP触发的免疫功能和效应触发的免疫信号。分子植物微生物中。2018; 31(4):403-9。
- 8。
表达自己:植物固有免疫的转录调控。Semin Cell Dev Biol. 2016; 56:150-62。
- 9。
刘志强,刘志强,杨志强。定义植物免疫反应的转录事件。植物学报。2017;38:1-9。
- 10。
陈飞,胡勇,Vannozzi A,吴克强,蔡海英,秦勇,Mullis A,林志刚,张林生。模式植物和作物中的WRKY转录因子家族。植物学报。2017;36(5-6):311-35。
- 11.
辣椒疫霉(Phytophthora capsici)是一种广泛寄主的卵菌。植物学报。2012;13(4):329-37。
- 12.
Kamoun S, Furzer O, Jones JDG, Judelson HS, Ali GS, Dalio RJD, Roy SG, Schena L, Zambounis A, Panabieres F,等。植物分子病理学中卵菌的十大病原体。植物学报。2015;16(4):413-34。
- 13.
Babadoost M,Pabon C,伊斯兰SZ,田D.植物植物枯萎病(植物藻苜蓿)辣椒及其管理。Acta Hortic。2015; 1105(1105):61-6。
- 14.
Adachi H,Nakano T,Miyagawa N,Ishihama N,Yoshioka M,Katou Y,Yaeno T,Shirasu K,Yoshioka H. wrky转录因子通过MAPK磷酸化调节尼古利亚纳·斯坦姆亚纳的植物免疫NADPH氧化酶。植物细胞。2015; 27(9):2645-63。
- 15.
樊胜,董磊,韩东,张飞,吴军,姜磊,程强,李锐,卢伟,孟F,等。GmWRKY31和GmHDL56通过调控大豆疫霉菌防御相关基因的表达增强大豆对疫霉菌的抗性。植物学报,2017;
- 16。
崔X,严Q,甘S,薛d,王H,邢辉,赵Ĵ,郭N. GmWRKY40,从确定的WRKY转录因子的基因中的一员甘氨酸最大增强了对大豆疫霉的抗性。植物学报。2019;19(1):598。
- 17。
Yogendra Kn,Kumar A,Sarkar K,Li Y,Pushpa D,Mosa Ka,Duggavathi R,Kushalappa AC。转录因子STWRKY1调节苯丙烷代谢物在马铃薯赋予晚期枯萎病变。J Exp Bot。2015; 66(22):7377-89。
- 18。
Yogendra Kn,Dhokane D,Kushalappa AC,Sarmiento F,Rodriguez E,Mosquera T.Stwrky8转录因子调节马铃薯的苄基异喹啉生物碱途径赋予耐期枯萎病。植物SCI。2017; 256:208-16。
- 19。
崔J,徐P,萌杰,李继,江n,植物植物染发剂诱导的番茄叶的转录组特征及转录因子Spwrky3的功能鉴定。Al Appl Genet。2018; 131(4):787-800。
- 20.
刘志强,刘玉生,刘志强。SpWRKY1基因在番茄抗疫、耐盐和干旱胁迫中的调控作用。acta botanica yunnanica(云南植物研究),2015;
- 21.
J-B1中,Y-S L,SpWRKY1的柳Z.过表达促进到烟草疫霉抗性和耐受性的盐和干旱胁迫在转基因烟草。植物生理学。2015; 155(3):248-66。
- 22。
崔建军,姜宁,刘伟,杨国平,马宁,侯晓霞,栾艳。WRKY1基因在番茄疫病菌互作中的表达。植物j . 2019; 97(5): 933 - 46所示。
- 23。
关键词:番茄,SpWRKY6,抗疫霉菌,基因工程abstract:Biochem Bioph Res Co. 2018;506(4): 787-92。
- 24。
路Ĵ,郭男,翟Y,龚Z,路M.微分响应辣椒抗性和易感种质之间的热和辣椒疫霉感染的组合应力(甜椒)。Ĵ植物生长雷古尔。2017; 36(1):161-73。
- 25.
田F,杨立德,孟YQ,金吉,高G. PlantRegmap:植物中的职能监管地图。核酸RES。2020; 48(D1):D1104-13。
- 26.
郑建勇,刘芳,朱超,李晓峰,戴晓泽,杨宝柱,邹xx,马玉强。辣椒WRKY基因家族对生物和非生物胁迫响应的鉴定、表达、选择性剪接及功能分析《公共科学图书馆•综合》。2019;14 (7):e0219775。
- 27.
刁WP,王某SB,刘JB,PAN BG,GUO GJ,GE W.辣椒腕骨转录因子家庭的基因组宽分析。Acta Hortic Sin。2015; 42(11):2183-96。
- 28。
党锋,王亚宁,于磊,Eulgem T,赖勇,刘志强,王旭,邱爱玲,张天祥,林杰,等。辣椒WRKY蛋白CaWRKY40在辣椒对热胁迫的耐受性和对茄科Ralstonia solanacearum侵染的抗性调控中发挥重要作用。植物学报。2013;36(4):757-74。
- 29。
程W,萧泽,蔡清,王cq,胡y,肖yp,zheng yx,shen l,杨s,刘zq等。一种新型富含亮氨酸的重复蛋白Calrr51,充当辣椒对兰斯顿菌氏菌感染的阳性调节剂。莫尔植物途径。2017; 18(8):1089-100。
- 30.
田志强,张志强,张志强,等。植物免疫网络特性的研究进展。公共科学图书馆麝猫。2009;5 (12):e1000772。
- 31。
Birkenbihl RP, Kracher B, Ross A, Kramer K, Finkemeier I, somsich IE。拟南芥WRKY调控网络在mamp引发早期免疫中的原理和特点植物j . 2018; 96(3): 487 - 502。
- 32.
Naveed Za,Huguet-Tapia JC,Ali GS。Carrizo Citrange Roots响应于植物胰岛素寄生虫感染的转录组谱。J工厂互动。2019; 14(1):187-204。
- 33.
Kebdani N,Pieuchot L,Deleury E,Panabieres女,乐BERRE JY,Gourgues M.细胞与寄生疫霉附着胞介导的渗透分子表征。新植物。2010; 185(1):248-57。
- 34。
Jupe J,STAM R,Howden AJM,Morris Ja,张Rx,Hedley Pe,Huitema E.植物E.植物E.植物科辣椒瘤番茄族相互作用在与Hemi-Biotrophic Lifestyle相关的基因表达中的戏剧性变化。基因组Biol。2013; 14(6):R63。
- 35。
陈XR,邢yp,李yp,童毅,xujy。RNA-SEQ揭示了植物藻藻辣椒藻的感染相关的基因表达变化。Plos一个。2013; 8(9):E74588。
- 36。
辣椒疫霉菌CRN效应体的鉴定与表征表现出模块化和功能多样性。《公共科学图书馆•综合》。2013;8 (3):e59517。
- 37.
沉QH,Saijo Y,Mauch S,Biskup C,Bieri S,Keller B,Seki H,Ulker B,SomssiCh IE,Schulze-Lefert P.MLA免疫受体的核动物活动连接分离物特异性和基础疾病性反应。科学。2007; 315(5815):1098-103。
- 38.
xu H, xu H, xu H, et al., et al., et al., et al., et al.。结合诱骗物的受体对将病原体转录因子的致残转化为免疫。细胞。2015;161(5):1074 - 88。
- 39.
徐志刚,张志强,张志强,等。植物免疫受体检测以WRKY转录因子为靶点的病原体效应体。细胞。2015;161(5):1089 - 100。
- 40。
eulgem t,somssish IE。防御信令中腕表转录因子网络。CurrOp植物BIOL。2007; 10(4):366-71。
- 41。
Berri S,Abbruscato P,Faivre-Rampant O,Brasileiro AC,Fumasoni I,Satoh K,Kikuchi S,Mizzi L,Morandini P,Pe Me,等。稻草和拟南芥腕骨共同监管网络的特征。BMC植物BIOL。2009; 9:120。
- 42。
程W,林ML,邱M,KONG L,XU YP,LI YN,Wang Y,YE WW,DONG SM,HE SL,等。甲壳素合成酶参与营养生长,植物繁殖和植物植物钙肠和植物育藻的发病机制。环境微生物。2019; 21(12):4537-47。
- 43。
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相对基因表达数据。方法。2001;25(4):402 - 8。
- 44.
王某,刘吉,刁WP,Zhi L,Chen JF。用定量实时PCR评估辣椒基因表达研究的适当参考基因。mol繁殖。2012; 30(3):1393-400。
- 45.
费尔南德斯 - 波索N,罗斯利HG,马丁GB,穆勒LA。该SGN VIGS工具:人性化的软件设计病毒诱导的基因沉默(VIGS)构建了功能基因组学。分子植物。2015; 8(3):486-8。
- 46。
Senthil-Kumar M,Mysore Ks。基于烟草的病毒诱导基因尼累累的尼古拉姆·南亚纳。NAT PROTOC。2014; 9(7):1549-62。
致谢
我们要感谢Northwest A&F大学的振辉龚教授,请携带辣椒种系Cm334和EC01。我们还感谢耶鲁大学的S. P. Dinesh-Kumar博士提供PTRV1和PTRV2向量。
同意出版
不适用。
资金
国家自然科学基金项目(no . 31601761);福建省自然科学基金项目(no . 2018j01710);福建农林大学优秀青年基金项目(no . xjq201725);国家大学生创新训练计划项目(no . 201910389006)。资助方仅提供资金支持,不参与实验设计、数据收集、解读分析和稿件起草。
作者信息
从属关系
贡献
WC和SH构思和设计了研究;WC,YJ,ML,JG和CJ进行了实验;WC,YJ,JP,WT,JH,DG和SH分析了数据;WC和SH写了这篇论文。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:数据集S1。
感染辣椒样品RNA-seq文库的研究进展P. Capsici..
附加文件2:图S1。
补充富集分析CM334与EC01后TF DEGsP. Capsici.感染.(A)使用CM334和EC01中所有鉴定的TF DEGs进行富集分析。(B)使用下调TF DEGs进行富集分析。富集分析采用ggplot2包(http://had.co.nz/ggplot2/).
附加文件3数据集S2。
Cawrky家族成员的特点。
附加文件4:DataSet S3。
Cawrky家族成员的核苷酸和蛋白质序列。
附加文件5:DataSet S4。
WRKY家族成员在辣椒反应中的分类P. Capsici.感染。
附加文件6:图S2。
伟大的辣椒植物中所选Cawrky基因的沉默效率概述。在其最高诱导时间点之后,QRT-PCR分析测定了Vigs效率P. Capsici.接种于(A) EC01和(B) CM334。表达水平用CaActin,表示为相对于TRV:0处理叶片的平均倍数变化,设为1。
附加文件7:图S3。
代表分离的叶子从其他叶片的表型cawrkys.- 辣椒植物。辣椒系(A)EC01和(B)CM334的疾病症状在接种后2.5天内的CM334P. Capsici..
附加文件8:表S1。
本研究使用的引物。
附加文件9:图S4。
一个PDS.-silenced控制在VIGS实验中。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
成,W.,江,Y.,彭,J.等等。Pepper对辣椒的反应腕骨家庭成员的转录重新编程和功能识别Phytophthora Capsici感染。BMC植物杂志20.256(2020)。https://doi.org/10.1186/s12870-020-02464-7
收到了:
接受:
发表:
关键词
- 胡椒
- 疫霉
- WRKY
- 转录因子
- 转录组
- 转录重新编程
- 抗病性