摘要
背景
利用重组糖酶基因生产具有改良表型性状的转基因木本植物。然而,由于许多问题,在露天栽培这类植物是具有挑战性的。因此,需要更多的研究来缓解它们。
结果
转基因杨树的成功栽培结果(杨树tremula)携带重组木葡聚糖酶基因(sp-Xeg)青霉菌canescens本文在半自然条件下首次报道了这一结果。研究了转基因白杨木材碳水化合物组成的变化sp-Xeg基因。转基因株系Xeg-2-1b与对照的未转化株系Pt相比,在温室和室外生长的树木中,生长速度加快,木材中纤维素含量增加。转基因株系Xeg-1-1c生长速度加快。这两个转基因株系细胞壁较厚,木质部纤维较长。前面所描述的转基因白杨茎的木材分解率在转化的转基因系中也有显著降低。转基因株系Xeg-2-3b的分解率约为对照未转化株系Pt的两倍。
结论
表型和生化性状直接依赖于重组基因的表达sp-Xeg是证明。的水平越高sp-Xeg基因表达方面,表型和生化性状的变化较为明显。所有株系的叶片性状均发生了表型变化。我们的结果表明,植物携带重组sp-Xeg基因在半自然条件下生长参数没有下降。在一些转基因品系中,观察到木材碳水化合物组成的变化、细胞壁厚度的增加和木材分解率的降低。
背景
森林作为木材和多种原材料的来源,在经济中发挥着巨大的作用。世界范围内的砍伐每年都在增长[1].硬木树因其树脂和木质素含量较低而特别受关注,是各种工业的方便原料来源[2,3.,4].阿斯彭(杨树tremula)是目前最有前途的硬木树种之一,生长迅速,分布范围广。白杨木材越来越多地用于纸浆、造纸和粘胶工业,以及容器、定向刨花板和生物乙醇生产[5].然而,由于目前硬木种,特别是白杨的砍伐率很高,预计会出现原料短缺。因此,不仅要提高木材利用的效率和合理性,而且要以新的、改良的树种和品种为基础,建立生产力更高的人工林。通过传统育种培育它们是一个漫长且效率不高的过程[6],而基因工程方法被认为是获得具有所需特性的树木的有前途的方法之一[7].
植物细胞大小的增加可能是通过酶软化细胞壁,然后由于细胞内压力增加而膨胀[8].木糖葡聚糖参与了强细胞框架的形成,这是一种植物细胞壁半纤维素多糖,与附近的纤维素微纤维交联[9].其分裂导致细胞壁软化[10].这已被用于创造高产量木本植物与过表达木葡聚糖分解酶。在温室条件下观察到预期的植物生长增长和木材生化成分的变化[11,12].然而,户外测试也非常需要,我们在这里提出的研究有助于填补我们在这方面的知识空白。例如,Park等人[12]在气候室试验中表明,白杨的茎长和叶片变色增加(杨树阿尔巴)与木葡聚糖酶基因转化AaXEG2从曲霉属真菌aculeatus与对照组相比。转基因树木中纤维素含量增加,半纤维素含量减少[12].然而,转基因树在田间的生长速度低于野生型对照树[13].
通过对世界经验的分析表明,利用重组糖酶和木葡聚糖酶来提高白杨木的生长速度和质量是成功的杨树).然而,并不是这一领域的所有问题都得到了完全解决,特别是对于野外生长的树木。因此,本研究的目的是分析携带重组木葡聚糖酶的木材特性发生改变的白杨sp-Xeg基因青霉菌canescens在半自然条件下作为实地试验前的初步阶段。
这篇文章报道了携带重组木葡聚糖酶基因的转基因白杨树的成功试验sp-Xeg在半自然条件下生长。讨论了木葡聚糖酶基因掺入对生长参数、化学木材成分和木材分解速率的影响。
结果
木葡聚糖酶的表达
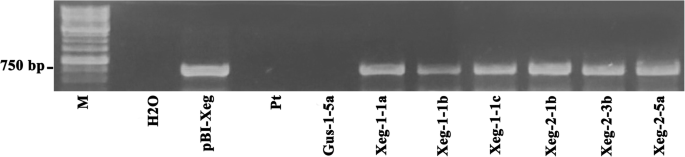
重组基因的表达sp-Xeg通过逆转录PCR (RT-PCR)和实时定量PCR (RT-qPCR)对半自然条件下生长的植物进行了鉴定。在所选插入木葡聚糖酶基因的转基因株系中,发现了预期大小的PCR扩增产物(762 bp),证实了重组产物的存在sp-Xeg基因(图。1,附加文件1:图S1)。重组基因和原生基因表达数据见表1.
RT-PCR分析sp-Xeg基因在转基因白杨植物中的表达(预期扩增子大小为762 bp)。M标准分子标记1 Kb (SibEnzyme Ltd., Russia), Н2О -阴性反应对照,pBI-Xeg -质粒DNA(阳性对照),Pt -非转基因对照,Gus-1-5a -转基因对照。全长凝胶见补充图S1
计算重组基因相对于Xeg-2-5a的表达量sp-Xeg基因。的最大级别sp-Xeg基因表达量在Xeg-2-1b中(比Xeg-2-5a高6.7倍),显著高于其他株系。重组基因在Xeg-1-1c系中表达量也非常高(表达量比Xeg-2-5a高4.7倍),而在其他系中表达量则低得多。
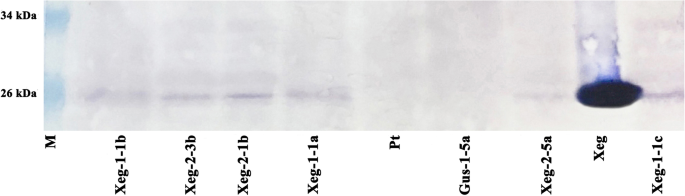
Western blotting证实,在所有6个选择的携带该基因的转基因白杨株系中都存在适当大小(25 kDa)的重组XegA蛋白sp-Xeg木葡聚糖酶基因(图;2,附加文件1:图S2)。重组蛋白在所有重复的分析中均能稳定检测到。
Western blot分析携带重组基因的转基因白杨的蛋白质提取物sp-Xeg.M -标准蛋白分子标记、Xeg-真菌提取物、Pt -非转基因对照、Gus-1-5a -转基因阴性对照、Xeg-1-1a、Xeg-1-1b、Xeg-1-1c、Xeg-2-1b、Xeg-2-3b、Xeg-2-5a均为转基因株系。完整的印迹显示在补充图S中2
增长速度
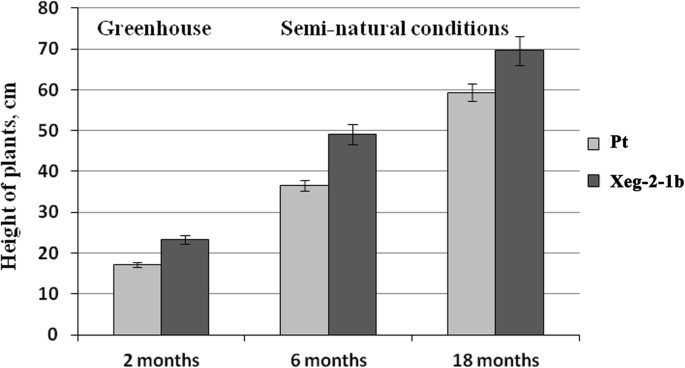
早些时候,我们注意到在温室环境中,一些转基因株系的生长速度有所提高[14].将转基因和对照白杨植物从温室条件转移到露天,在半自然条件下生长至18个月龄。为了进行分析,选择了6个表明重组蛋白存在的细胞系。2个月后,4个品种在温室条件下株高比铂对照株高分别提高24.6% (Xeg-1-1a)、15.7% (Xeg-1-1b)、26.6% (Xeg-2-3b)和15.3% (Xeg-2-3b).其他两组(Xeg-1-1c和Xeg-2-5a)与对照无差异(附加文件1补充信息:表S2)。还需要指出的是,虽然在半自然条件下,大多数转基因树的树高都有增加的趋势,但只有Xeg-2-1b株系的树高、茎粗和体积出现了统计学上的显著增加(表2)2,无花果。3.).在温室中,植被生长2个月后,这条线比非转基因Pt对照高26.6%,在露天中,植被生长6个月后,这条线比非转基因Pt对照高25.4%,18个月后,这条线比非转基因Pt对照高14.6%(图4)。4).
木葡聚糖酶基因的整合对转基因植株的叶面积影响不大。与对照植株相比,只有两个白杨品系的面积显著减少——Xeg-1-1b减少了28%,Xeg-2-3b减少了17%3.).
然而,几乎所有的转基因株系都改变了叶片的形状——它们显著降低了圆形。这是由于转基因植物叶片的长度增加而宽度减小所致。结果,与对照植株相比,所有转基因株系的叶片长宽比都发生了显著变化,变化幅度达14-23%。5).对于所有转基因植物,都有增加叶片数量的趋势,但统计上不显著(表2)2).
木材中的纤维素含量
测定了6个转基因株系的木材中纤维素含量。只有在Xeg-1-1c和Xeg-2-1b细胞系中观察到纤维素含量显著增加2).其他品系的纤维素含量均在对照水平。转基因株系中未检测到纤维素含量的降低。因此,就纤维素含量而言,除了Xeg-2-1b系,Xeg-1-1c系也可以被认为是一个有前景的系。
木质部的碳水化合物组成
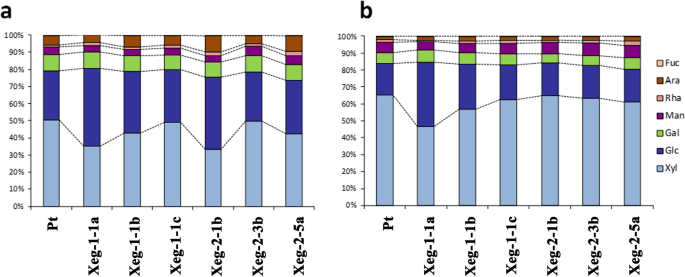
木葡聚糖酶促进木葡聚糖的裂解,从而影响碳水化合物的组成。所有温室植物的戊聚糖(半纤维素的主要成分)含量均有所下降[14].在半自然条件下的植物中,与对照相比,所有转基因株系中茎最年轻部分的戊聚糖含量也有所下降(表2)4).在茎的较老部分(18个月)观察到的差异较小,6个品系中有4个表现出戊聚糖含量的增加。然而,所有的变化在统计上都不显著。
半纤维素组分的比例在转基因系中也受到影响(图。6).在植株最年轻的部分,在大多数品系中观察到木糖含量显著下降,伴随着葡萄糖和阿拉伯糖含量的增加(图1)。6a).半乳糖和甘露糖含量变化不显著。在最成熟的木材中,木糖和葡萄糖的比例与对照差异不显著,但阿拉伯糖和甘露糖的含量略有差异,但显著增加(图2)。6b).杨木中鼠李糖和焦子的相对含量较低,鼠李糖的相对含量为1.5-2%,与木龄无关,幼木和老木中鼠李糖的相对含量分别为0.2-0.5%和0.1-0.2%。
纤维分析
在六个研究品种的木材样品中测定的纤维的直径和长度见表5.在转基因植株中,纤维直径略有增加。Xeg-2-1b和Xeg-2-3b两组的纤维长度均显著高于对照组(表25).
木质部镜检
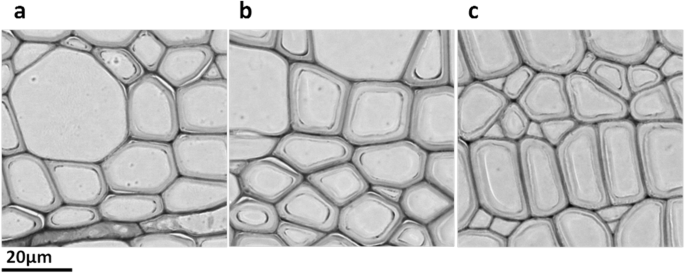
对18月龄白杨木质部的电镜观察显示,与非转基因对照(1.16 μm)相比,植被元年木质部细胞中Xeg-2-1b(平均1.80 μm)和Xeg-1-1c(平均1.47 μm)的细胞壁厚度均有所增加(图4)。7;额外的文件1:图S3)。
分解率
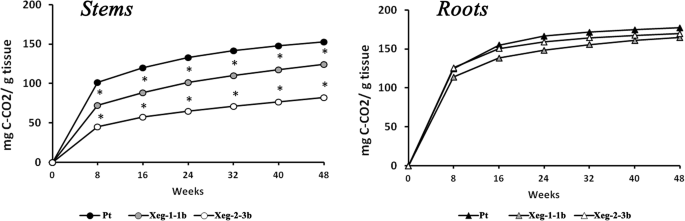
用转基因系Xeg-1-1b、Xeg-2-3b和对照Pt进行分解实验。这两个转基因株系在形态和生化上与Pt最相似。对植物材料分解过程中二氧化碳排放的分析表明,转基因植株茎部的分解速率低于对照,尤其是Xeg-2-3b,其分解速率约为对照Pt的2倍(图1)。8).然而,在根系分解过程中,转基因植株和对照植株的二氧化碳排放量没有显著差异。
与对照相比,转基因植株茎部氮含量显著下降,而根部氮含量没有变化。转基因株系与对照株系相比,根和茎的碳含量均未发生变化6).
讨论
对引入重组结构在转基因木本植物中的效果的研究通常是基于从生成的转基因系的整个面板中选择的分析系的小样本。因此,在我们的研究中,25个转基因品系中只有6个被选作进一步的露天土壤条件分析。例如,在类似的重组研究中GS1杨树杂种基因表达(白杨),在田间试验中只分析了8个转基因品系[15]从22个最初生成的转基因株系中选出,这些株系首先在温室条件下生长[16].而且,对重组基因的详细研究仅基于一行[17].在另一个类似的研究中PIP1水通道蛋白基因的初始面板PIP1缺乏转基因白杨杨树杂交种包括22个品系,但只选择了6个品系在温室进行初步试验[18],然后选取其中的5个进行详细研究[19].在异戊二烯合酶基因的初步研究中互联网服务提供商29株转基因灰杨(杨树·×canescens)行生成[20.],但在进一步的半自然研究中只使用了一行[21].因此,按照转基因木本植物分析的常用做法,我们前期研究中产生的25个转基因温室株系中有6个[14]被选择在半自然条件下进行这项研究。
一些研究认为,通过增加木葡聚糖的裂解来培育具有改变木材特性的高产木本植物是最有前途的方向[12,22].然而,在气候室和温室中获得的成功结果并不总是在田间得到证实[13].我们测试了重组的转基因白杨株系sp-Xeg半自然条件下的基因:它们有一个封闭的根系,在整个植被期生长在露天。我们测定了重组植物的各种生化和表型参数sp-Xeg基因。最重要的表型指标之一是植株生长较快。在许多与选择生长较快的植物有关的类似研究中,高度的增加被认为是快速生长的主要指标[11,12,17,23].对它们高度的测量表明,并非所有之前确定的有前途的线条[14保持了较高的株高。观察到转基因系与对照系间表型性状的趋同。在整个研究过程中,与对照组相比,Xeg-2-1b系是唯一一个保持高度生产力的系。这可能是由于重组基因的表达水平最高。这一行的表达量增加最多(6.7倍),而其他一行的表达量增加较少。与其他研究人员发表的数据相比,Xeg-2-1b系的生长速度增长相对较高[12].木糖葡聚糖酶来源的转基因白杨答:aculeatus也倾向于增加生长速度,但它们是在气候室中生长的[12].当这些植物在温室条件下生长时,生长速度并无差异[24].进一步的田间试验表明,两株转基因白杨株系trg300-1和trg300-2均有过表达重组木葡聚糖酶答:aculeatus与非转基因对照相比,生长速度和总生物量下降,而在气候室中先前显示生产力增加。研究发现,生长速率的恶化是由于蒸腾过程的改变。在转基因植物中观察到气孔功能障碍[13].的xyloglucanaseXegA的木糖葡聚糖酶结构相同答:aculeatus(AaXEG2)为70.46%。因此,重组木葡聚糖酶效果相似XegA和xyloglucanaseAaXEG2在植物上观察。我们获得的转基因植株Xeg-2-1b在所有实验条件下都保持了生长速率增加的趋势。据观察,激素控制或转录因子基因的掺入会影响植物器官的大小[25].在我们的研究中,木葡聚糖酶基因的白杨也有类似的作用。我们观察了所有转基因株系叶片形状的变化——长宽比增加了,主要是由于叶宽的减少3.).植物器官(如叶子)的最终大小由两个过程控制——细胞分裂和细胞膨胀[26].尺寸的变化不能同时发生在两个维度上,而只能发生在一个维度上。例如,细胞色素P450基因的过表达拟南芥增加了叶子的长度而不改变它们的宽度[27].叶片大小的减小可能与细胞数量和/或大小的减少有关[28].所有转基因株系的叶片性状参数均发生了变化。我们发现,在转基因株系中,木材纤维的长度显著增加,而直径没有任何变化(表2)4).由于木糖葡聚糖参与改变生长和分化区的细胞形状[29],木糖葡聚糖酶基因的表达也可以改变叶片细胞的壁延伸性,从而改变细胞的形状,进而改变叶片的形状。此外,我们在研究中观察到转基因植物叶片数量增加的趋势,可能对这些植物的生长特性具有代偿作用[14].
重组木葡聚糖酶基因的预期效果是改变所有转基因株系的木材单体糖的组成。木葡聚糖属的主要结构基序杨树是XXXG型的重复块状物,由三个含有木糖取代基(X)的葡萄糖残基和一个未取代的葡萄糖残基(G)组成[30.].对照白杨2年生木木糖含量绝对值和木糖含量比均为3.6,与该指标相当。但在嫩木区,由于木糖含量同时减少,纤维素含量同时增加,这一比例急剧下降至1.8。木葡聚糖酶基因的加入改变了多糖基质的组成,这主要导致葡萄糖的增加和木糖的减少,从而导致木聚糖的形成缺陷。它在幼苗中最显著,但在更成熟的木材中也观察到,尽管程度较低(最显著的是在Xeg-1-1a和Xeg-1-1b系)。这表明,木葡聚糖酶基因的加入促进了半纤维素的形成,这是植物发育早期的特征。在较成熟的木材中,木葡聚糖酶基因的影响最小,主要成分的含量与对照相差不大,但次要成分——甘露糖和阿拉伯糖的份额略有增加。第三种成分,半乳糖,几乎没有变化。然而,我们注意到其他半纤维素多糖的相对含量发生了显著变化,这可能是由于对次生细胞壁生物合成的间接影响。我们的数据部分符合Baba等人的结果。31],由此可见,含有木葡聚糖酶基因的杨树多糖基质减少10%,而由于半乳糖和阿拉伯糖的存在,木糖含量略有下降。不幸的是,在这项工作中,植物的年龄没有被指定。木糖含量显著下降摘要通过干扰RNA抑制糖基转移酶基因的系[32],它是由半乳糖和甘露糖引起的,但葡萄糖没有变化。相反的效果出现了杨树euramericana其中木糖大幅增加,葡萄糖减少,而其他半纤维素糖——甘露糖、半乳糖、阿拉伯糖、鼠李糖和焦糖保持不变[33].我们发现,木葡聚糖酶基因的加入导致幼木半纤维素含量的降低。此外,基因木糖葡聚糖酶改变了木糖葡聚糖的组成,使其更具有早期的特征。我们还发现,这种效应随着树龄的增加而减弱,在第二年生木中几乎不存在。半纤维素形成的补偿性机制可能随着年龄的增长而被放大,此外,在半自然条件下生长的植物也可能促进这种机制的形成。
早前研究表明,纤维素的形成可以间接影响木糖葡聚糖丝与微原纤维的结合,因此木糖葡聚糖丝的裂解可能对纤维素的生物合成有刺激作用[34].在植株中,Xeg-2-1b和Xeg-1-1c的纤维素含量分别增加了7.4和11.3%。我们的纤维素含量数据与转基因植物木质部的电镜观察数据以及libriform测量数据一致。重组蛋白的最高表达sp-Xeg在这些细胞系中也检测到基因。部分转基因株系的纤维长度有所增加。这是由于木葡聚糖酶与细胞壁的特异性相互作用导致纤维素微原纤维分离,细胞内压力增加导致细胞大小增大[8].纤维素含量的增加可能与细胞壁厚度的增加有关,特别是当凝胶层增加时[35].结果表明,转基因植株木质部细胞壁厚度超过对照,平均为1.63 μm,而对照植株为1.16 μm。这与这些植物中纤维素含量的增加相当。
木材成分的变化也会影响生态系统中的生物地球化学过程。在我们早期的研究中,我们用质量损失法测量了符合木葡聚糖酶基因的白杨木材的分解速率[36].转基因植株与对照植株的分解速率在转基因植株的根部有显著差异,但在茎部没有显著差异。然而,这种方法不够准确,因为它没有考虑微生物转化系数,其中包括微生物在分解过程中生物量的增加[37].为了更准确地测定植物的分解速率,建议测量CO的强度2发射(38].在我们的研究中,我们在茎和根中使用了这种方法,这在分解实验中很少使用。根据张等人。[39],绝大多数的分解实验是用树叶或针进行的,而树枝和根只是偶尔使用。同时,叶和根在全年凋落物中占很大比例,其内置基因对木材的成分有影响。虽然我们的主要实验进行了2年,但我们使用6个月大的样本来研究分解,因为它们更能代表自然条件下凋落物的结构。根据Freschet et al. [40], 41%的年度森林凋落物由树叶组成,11%的树枝有多达5毫米在直径和48%的根与多达2毫米直径。一氧化碳强度的测量2结果表明,转基因植物茎部木材的分解速率显著降低。这种变化可能是由于这些植物的氮含量平均减少了15%。多项研究报告显示,氮含量与植物残体的分解速率直接相关[39,41,42].氮含量越高,分解速度越快,氮含量越低,分解速度越慢。也许,出于同样的原因,我们没有检测到转基因植物根系分解过程中二氧化碳排放的差异。细胞壁厚度的增加很可能也会影响木材分解的速度[43].
我们在半自然条件下对6个转基因株系的分析表明,重组基因的效果在所有转基因株系中均可见。因此,根据半自然条件下的白杨试验结果,可以得出重组sp-Xeg基因对植物有机体具有复杂的影响。重组基因不仅影响转基因植物的生长参数,而且影响纤维素含量、植物纤维含量和木材的分解速率。值得注意的是,表型表达与重组木葡聚糖酶的表达水平相关sp-Xeg基因。重组基因表达量最高的转基因系为Xeg-2-1b。在各种条件下,木质部纤维的纤维素含量较高,细胞壁较厚,生长速度较快。多性状差异的Xeg-1-1c系在基因表达水平上位居第二sp-Xeg基因的表达。木质部纤维的纤维素含量和细胞壁厚度也显著增加。在木材分解率的实验中,这两个转基因株系与对照株系的差异有统计学意义,但变化最大的是重组基因表达量也较大的Xeg-2-3b株系。总的来说,所有研究的转基因株系均表现出表型和生化变化,但其表现直接取决于该基因的表达水平sp-Xeg重组基因。
通过遗传转化对植物特性的修饰应始终评估其对环境的影响。特别是,转基因白杨如何影响森林生态系统和土壤。Xeg-2-1b系被定义为最有前途的白杨系,生长最快,产量最高。早期利用EFIMOD模拟模型对由Xeg-2-1b系和非转基因植物组成的虚拟人工林进行了计算机模拟,该模型可以预测土壤和林分之间具有强反馈机制的森林生态系统中的碳氮流动[44].该模型试验表明,种植转基因白杨对碳氮流动的影响与对照非转基因植株没有差异。
结论
重组木葡聚糖酶基因组成表达的转基因白杨株系代表图谱sp-Xeg从青霉菌canescens进行了分析。证明了的表达式sp-Xeg重组木葡聚糖酶导致木材纤维厚度的变化和植物生长。电镜显示转基因细胞株细胞壁厚度增加。Libriform分析还显示转基因植物维管纤维的长度和宽度都有所增加。木纤维参数的增加可能会影响生长。首次表明,在接近田间(半自然条件)的试验条件下,带有真菌来源的重组木葡聚糖酶基因的转基因白杨植株没有表现出生长下降。在转基因植物中,sp-Xeg重组木葡聚糖酶改变了木材中含碳水化合物物质的组成。木质部单体糖组成分析数据证实了纤维素和半纤维素含量的变化。表型和生化表达直接依赖于重组基因的表达水平。的表达水平越高sp-Xeg基因方面,表型表达更为显著。这是第一次对植物材料分解过程中的二氧化碳排放进行分析。结果表明,转基因植株茎的分解速率低于对照植株。这是一项初步研究,基于获得的转基因系的一个相对较小的面板。尽管这项研究与许多类似的转基因木本植物的研究是一致的,这些研究也是基于从大量生成转基因中选择的少量转基因系(例如,[15,18,23]),我们认为需要进行更多的研究。然而,本研究获得了关于转基因品系在开放地面条件(半自然和田间栽培条件)下的性能和重组木葡聚糖酶的影响的重要实际数据sp-Xeg不仅影响生产力,还影响其他参数。该研究支持重组木葡聚糖酶的作用趋势sp-Xeg早前在温室条件下观察到的情况[14].我们计划继续对选定的6个转基因品系进行田间试验监测,并在半自然栽培条件下对其余品系进行分析。
方法
转基因杨树
引入重组的转基因白杨株系sp-Xeg木糖葡聚糖酶基因来自真菌青霉菌canescens在35S启动子和诺帕林合酶终止子的转录控制下进行分析。的sp-Xeg基因编码嵌合木葡聚糖酶XegA白杨纤维素酶信号肽[45].原离体植物材料杨树tremulaL. (Pt基因型)由白俄罗斯国家科学院林业研究所(Dr. V. E. Padutov, Gomel,白俄罗斯共和国)提供,并用作遗传转化的起始材料。该无性系为白杨的二倍体,具有生长迅速和抗腐的特点。基于该无性系的转基因植物在俄罗斯联邦普什奇诺市Shemyakin-Ovchinnikov生物有机化学研究所分所产生[45,所有的植物材料都在那里繁殖。体外实验-衍生的树木在气候室中适应体内条件一个月,然后在温室中再生长一个月。共25个转基因系,2个对照系——非转基因野生型系(Pt)和1个插入基因的转基因系β-葡糖苷酸酶(Gus-1-5a)。
每品系(基因型)代表50株(分株)。这些植物分别生长在体积为1升的塑料容器中(泥炭与珍珠岩的比例为3:1),在温室中生长2个月后,转移到露天的半自然环境中,并额外浇水和喂食。半自然条件是指在温室外种植盆栽植物[46].这样的生长条件接近田地,使我们能够估计植物对各种生物和非生物因素的抗性。在露天条件下进行的试验时间长且耗时,因此,通常从获得的转化子的整个面板上取一小部分样本,来研究引入重组结构在木本植物转化中的效果[47,48,49].按照在转基因木本植物研究中使用的这一常见做法,我们从25个之前转化的温室植物中选择了6个转基因系,用于我们在半自然条件下的分析[14].选定的行进行了重命名,旧名称和新名称显示在表S中1(附加文件1在补充信息)。样本系包括Xeg-1-1a、Xeg-1-1b、Xeg-1-1c、Xeg-2-1b、Xeg-2-3b和Xeg-2-5a。选择的依据是2个月温室植物的生长速率数据(高度),如表S所示2(附加文件1在补充信息)。排除有缺陷的Xeg-2-1c系,纳入生长指标显著高于对照(Pt)的系(Xeg-1-1a, Xeg-2-1b)或相近(Xeg-1-1b, Xeg-1-1c, Xeg-2-3b, Xeg-2-5a)。
半自然条件下植被生长4个月后,选取6个转基因株系和1个非转基因对照株系(Pt)进行进一步分析。选定的细胞株移植到容积为2 l的塑料容器中。非转基因对照白杨(天然变种)与转基因系白杨随机对照,在相同条件下并排生长。在这种条件下,植物生长到一岁半,并在自然条件下过冬。
在温室生长2个月后,在转移到半自然条件之前,测量叶片的高度和数量。植被再生长4个月后,测定生长,取样品进行分子分析和碳水化合物组成测定,并利用部分植物分析茎木的分解速率。第二部分过冬继续生长1年,在18月龄时测定生长、纤维素和戊聚糖含量,并取样品进行碳水化合物组成、镜检和libriform,评估每年的分解实验结果。
6个转基因株系均证实了重组基因的存在和蛋白的表达。除生长参数外,还对这6个转基因株系和对照株系进行了木质部纤维素含量、戊聚糖含量、碳水化合物组成的分析和lib form含量的测定。对植株中纤维素含量差异最大的Xeg-3和Xeg-6进行了电镜观察。测定了Xeg-1-1b、Xeg-2-3b和Pt系植株的分解速率。为了进行分解分析,我们在测量温室植物的生物特征指标的基础上,通过Duncan’s ANOVA-1秩检验,选择了与对照植株同组的这2个株系,它们之间仅存在戊聚糖含量的差异[14].
我们的实验研究符合机构、国家或国际的指导方针。我们没有使用任何濒危物种,并遵守《濒危野生动植物种贸易公约》。
逆转录PCR (RT-PCR)分析
通过添加TRIzol®试剂(Invitrogen, USA),按照制造商的协议,从半自然条件下生长的所有6个月的转基因和对照系的叶片中提取植物总RNA (http://www.invitrogen.com).Vidyagina等人详细描述了RNA的纯化、cDNA的合成和RT-PCR参数。[14].然而,与之前的研究不同的是,本研究中使用了500 ng的总RNA用于cDNA合成。使用Nanodrop 2000 (Thermo Scientific, USA)微量分光光度计测定RNA浓度。
实时定量PCR (RT-qPCR)分析
Kovalitskaya等人详细描述了RT-qPCR方法和对获得的数据的分析。[50].本研究以肌动蛋白和泛素作为内参基因。RT-qPCR实验所用引物见表7.
定性免疫印迹分析
通过添加提取缓冲液[0.175 M Tris / HCl (pH 8.8), 5% SDS (w/v), 15%甘油(v/v), 0.3 M巯基乙醇],从6月龄转基因植株和对照植株的叶片中体外提取总蛋白。51].用Pierce测定蛋白质浓度TMBSA蛋白检测试剂盒(Thermo Scientific, USA):每孔加总蛋白120 μg,对照孔加木葡聚糖酶2 μg。电泳分离蛋白质按Laemmli [52在12%的聚丙烯酰胺凝胶中。分子量为20、26、34、50、90和120 kDa的蛋白质被用作分子量标记(Thermo Scientific,立陶宛),并将含有这些标记的5 μl混合物添加到凝胶中。作为阳性对照,木糖葡聚糖酶制剂p . canescens经过三个阶段的纯化(U / mg罗望子籽木葡聚糖= 18)后使用,由IBPM RAS (Pushchino, Russia)提供。凝胶分离多肽的电转移在硝化纤维素膜(Bio-Rad,德国)上进行,使用TE70PWR translotter (Amersham,美国)上的半干转移(40 mA, 2 h)。为了放大信号,皮尔斯TM根据制造商的协议使用Western Blot信号增强剂(Thermo Scientific, USA)。兔多克隆抗体由俄罗斯科学院理论和实验生物物理研究所(Pushchino, Russia)制备。与兔原代抗体(1:200)在8°C杂交18 h。与碱性磷酸酶偶联的山羊抗兔抗体(Sigma, USA)在室温下杂交2 h,按规程稀释。使用BCIP/NBT即食底物检测免疫复合物(Serva, Germany)。
经济增长指标
为了研究每个品系,使用了40株植物。茎的长度从根颈到顶芽测量。在根颈基部测量茎粗。卷(V, cm3.)的计算公式为:v = sd2×H,其中SD -茎径(cm),H-植株高度(厘米)[11].从顶芽到根颈处计算叶片数量。采用LAMINA软件对叶片参数进行测量[53]在植物生长的第二年。在2、6和18月龄测量身高,并使用Statistica 7.0软件(https://www.tibco.com/products/tibco-statistica).
具体纤维素含量分析
采用Kurschner-Hanak氮醇法测定纤维素含量[54].考虑到绝对干燥样品的重量,重新计算了含量。
戊聚糖比含量分析
采用改良Tollens法测定木材中戊聚糖的比含量[55,56在HCl存在的蒸馏过程中将它们转化为糠醛。干物质戊聚糖含量由Vidyagina等人计算。[14].对于这个分析,2个10厘米从18个月大的植株上取长茎,分别代表生长树木的第一年和第二年。
半纤维素单糖的分析
半纤维素(阿拉伯糖、焦糖、半乳糖、葡萄糖、甘露糖、鼠李糖和木糖)的单体糖用标准醋酸醛醇法测定[57,58].用于单糖组成的分析,两10厘米从18个月大的植物中取每株无树皮的长茎,分别代表生长第1年(6个月)和第2年(18个月)的木材。5个样本毫克用2 M三氟乙酸(TFA)在100℃水解5 h。将中性单糖的混合物转化为乙酰醛醇酯,并使用GCMSQP 2010 Plus色谱仪(Shimadzu Corporation, Japan)和HP-5MS柱(60毫克ydF4y2Ba×0.32毫米× 0.25 μm)。肌醇作为内标。氦气被用作载气。注入器温度为150℃。以2℃/min的速率将柱温从60℃提高到250℃,然后保持10 min [59].
显微镜
为了显微镜分析,在3个重复中,从18个月大的植株的茎下部(栽培第二年的木材)提取样本。把茎的所有组织都切掉。为了制备横截面,样品被嵌入含有DER-332, DER-732, DDSA和dpmp -30的环氧树脂混合物中[60].横切面使用超显微仪Reichert Om U2 (Reichert Optische Werke AG, Austria)和玻璃刀获得,用亚甲基蓝、天蓝色- ii和碱性紫红染色[61,并用AxioImager M1光学显微镜(德国卡尔蔡司公司)拍摄。扫描切片,使用AxioVision 4.8.1软件包(德国卡尔蔡司)估算细胞壁厚度。
测定脂状纤维
为了测量libriform纤维,在三个重复中从18个月大的植株的茎底部取去树皮(栽培第二年的木材)。用醋酸和亚氯酸钠浸渍样品,测量其libriform纤维的长度和直径[62].
白杨分解速率的测量
通过分析植物物质分解过程中二氧化碳的排放来估计分解速率[63].实验中,用0.5 mm细筛进行筛分,用洗净灭菌的砂子作为基质。将6个月大的植株的植物组织(茎和根)放入瓷臼中研磨,然后在65°C下干燥3天,将100 mg干燥后的植物组织放入含2g沙子的玻璃管中,用橡胶塞子密封。为了确保在试管中分解,添加了森林植物凋落物的水提取物。蒸馏水也被添加到管道中,数量为沙子总水分容量的50%(同时考虑到恢复植物组织初始质量所需的水)。然后,这些试管被放置在22°C的恒温器中48周。每8周从管道中取样空气样本,并使用crystux 4000 M气相色谱仪(俄罗斯yoshka - ola研究和生产公司«Meta-chrom»)分析其二氧化碳气体。所有样品还使用欧洲EA-CHNSO元素分析仪(HEKAtech GmbH, Wegberg, Germany)气相色谱法分析C和N含量。
数据和材料的可用性
在当前研究中使用和/或分析的数据集可根据要求从通讯作者处获得。
缩写
- AaXEG2:
-
木葡聚糖酶2曲霉属真菌aculeatus
- 方差分析:
-
方差分析
- 英国石油公司:
-
碱基对
- 互补脱氧核糖核酸:
-
互补脱氧核糖核酸
- cel1:
-
纤维素酶基因1
- 背景:
-
脱氧核糖核酸
- DNase:
-
脱氧核糖核酸酶
- 气相:
-
气相色谱-质谱联用
- GS1:
-
谷氨酰胺合成酶1
- 互联网服务提供商:
-
异戊二烯合酶
- kDa:
-
Kilodalton
- P:
-
概率
- 聚合酶链反应:
-
聚合酶链反应
- PIP1:
-
水通道蛋白1
- Pt:
-
杨树tremula
- RNA:
-
核糖核酸
- 核糖核酸酶:
-
核糖核酸酶
- rt - pcr:
-
逆转录聚合酶链反应
- RT-qPCR:
-
实时定量聚合酶链反应
- SD:
-
标准偏差
- SDS:
-
十二烷基硫酸钠
- sp-Xeg:
-
重组木葡聚糖酶青霉菌canescens
- 组织:
-
三氟乙酸
- 三:
-
三(羟甲基)-aminomethan
- Xeg:
-
Xyloglucanase
参考文献
- 1.
Carle J, Holmgren P.人工林木材:2005-2030年全球展望。2008; 58:6-18。
- 2.
Azarov VI, Burov AV, Obolenskaya A.V.木材和合成聚合物化学。圣彼得堡林业学院,圣彼得堡,俄罗斯联邦;1999.p。629。
- 3.
Ramage MH, Burridge H, Busse-Wicher M, Fereday G, Reynolds T, Shah DU, Wud G, Yuc L, Fleminga P, Densley-Tingleye D, Allwoode J, Dupreec P, Lindenb PF, Scherman O.树木的木材:木材在建筑中的使用。更新Sust能源版本2017;68:333-59。
- 4.
Bosbeer S, Denman H, Hawe JD, Purser HP, Walsh P.为遗产委员会审查森林政策。一个Chomhairle Oidhreachta。文化遗产委员会;2008.
- 5.
弗瑞森兆瓦。萨斯喀彻温省白杨实木产品的战略分析,第2卷。温哥华,不列颠哥伦比亚省:FPInnovations;2011.24页。
- 6.
Chaix G, Monteuuis O.林业部门的生物技术。林业生物技术,包括基因改造的初步审查。罗马:森林遗传资源工作文件FGR/59E。森林资源司森林资源开发处;2004.116 - 8页。
- 7.
Costanza MS.森林生物技术及其负责任的使用:森林生物技术研究所的生物技术树底漆。罗利:森林生物技术研究所;2011.
- 8.
木葡聚糖:树木的分子肌肉。生物学报2008;102(5):659-65。
- 9.
Bauman MJ, Eklo G, Michel M, Kallas АМ, Teeri TT, Czjzek М, Brumer H.木糖葡聚糖内切转糖基化酶活性进化的结构证据:对细胞壁代谢的生物学意义。植物细胞。2007;19:47 - 63。
- 10.
武田T,古田Y, Awano T, Mizuno K, Mitsuishi Y, Hayashi T。木葡聚糖整合抑制和加速豌豆茎段细胞伸长。中国科学(d辑:自然科学版)2002;29(3):369 - 369。
- 11.
张丽娟,张丽娟,张丽娟,等。转基因杨树基因的表达及其对植株生长的影响拟南芥endo-1, 4 -в葡聚糖酶(cel1).Mol Breed. 2004; 14:21 - 30。
- 12.
Park YW, Baba K, Furutab Y, Iidab I, Sameshimac K, Araid M, Hayashi t过表达木葡聚糖酶促进杨树生长和纤维素积累。FEBS Lett. 2004; 564:183-7。
- 13.
Funahashi F, Ohta S, Taniguchi T, Kurita M, Konagaya K, Hayashi T.过表达木葡聚糖酶抑制杨树生长的建筑和生理特性的田间研究。树木。2014;28(1):65 - 76。
- 14.
Vidyagina EО, Kovalitskaya YA, Loginov DS, Koroleva OV, Shestibratov KA。木葡聚糖酶的表达sp-Xeg基因青霉菌canescens加速转基因白杨植物的生长和生根。应用生物化学与微生物学,2014;50(7):701-8。
- 15.
Jing ZP, Gallardo F, Pascual MB, Sampalo R, Romero J, Navarra AT, Cánovas FM。过表达谷氨酰胺合成酶的转基因杂交杨树田间生长改善试验。新植物醇。2004;164:137-45。
- 16.
加勒多,傅杰,Cantón FR, García-Gutiérrez A, Cánovas FM,柯比EG。一种针叶树谷氨酰胺合成酶基因在转基因杨树中的表达。足底。1999;210:19-26。
- 17.
Castro-Rodríguez V, García-Gutiérrez A, Canales J, Cañas RA, Kirby EG, Avila C, Cánovas FM。杨树对高浓度硝酸盐的植物修复及其在生物能源中的应用。植物工程学报(英文版)2016;
- 18.
塞奇F, Zwieniecki MA。生理反应杨树tremulax阿尔巴叶子要调低的PIP1无水胁迫下水通道蛋白基因表达。植物学报,2013;13(4):507-16。
- 19.
塞奇F, Zwieniecki MA。杨树血浆固有蛋白1水通道蛋白的下调不利于栓塞的恢复。植物生理学报,2014;32(4):369 - 369。
- 20.
本克K, Ehlting B, Teuber M, Bauerfeind M, Louis S, Hänsch R, Polle A, Bohlmann J, Schnitzler JP。转基因的、不散发异戊二烯的杨树不喜欢高温。植物学报,2007;51:485-99。
- 21.
本克K, Kleist E, Uerlings R, Wildt J, Rennenberg H, Schnitzler JP。rnai介导的异戊二烯生物合成抑制影响杂交杨树的臭氧耐性。植物学报,2009;29(5):725-36。
- 22.
朴yw,富永R,杉山J,古田Y,谷本E, Samejima M,酒井F, Hayashi t拟南芥.植物学报。2003;33(6):1099-106。
- 23.
引用本文金玉林,唐荣军,王和宏,蒋春明,鲍燕,杨燕,梁mx,孙志才,孔福军,李斌,张海霞。过度的杨树trichocarpaCYP85A3促进转基因树木的生长和生物量生产。植物学报,2017;15(10):1309-21。
- 24.
谷口T,大宫Y,栗田M, Tsubomura M,近藤T, Park YW, Baba K, Hayashi T转基因过表达木葡聚糖酶(AaXEG2)的杨树田间试验前生物安全性评价。木材科学学报2008;54(5):408-13。
- 25.
布索夫VB,布鲁纳AM,施特劳斯SH。植物身高和形态控制基因。植物学报,2008;27(3):589-607。
- 26.
Gonzalez N, Bodt SD, Sulpice R, Jikumaru Y, Chae E, Dhondt S, Daele TV, Milde LD, Weigel D, Kamiya Y, Stitt M, Beemster GTS, Inzé D。植物物理学报2010;153:1261-79。
- 27.
金G-T,筑谷H,斋藤Y,内宫H。树叶和花朵形状的变化细胞色素P450过表达拟南芥.美国国家科学与技术研究所1999;96:9433-7。
- 28.
李晓燕,李晓燕,李晓燕。植物叶片大小与细胞增殖和细胞膨胀的关系拟南芥.植物学报,2006;59(3):499-508。
- 29.
王晓燕,王晓燕。木糖葡聚糖在植物细胞中的作用。植物学报,2011;4(1):17-24。
- 30.
Saura-Valls M, Faure R, Brumer H, Teeri TT, Cottaz S, Driguez H, Planas a杨树木糖葡聚糖内切转糖基化酶与木糖低聚糖文库。中国生物医学工程学报,2008;29(4):369 - 369。
- 31.
Baba K, Park YW, Kaku T, Kaida R, Takeuchi M, Yoshida M, Hosoo Y, Ojio Y, Okuyama T, Taniguchi T, Ohmiya Y, konuyama T, Shani Z, Shoseyov O, Awano T, Serada S, Norioka N, Norioka S, Hayashi T。植物学报,2009;2(5):893-903。
- 32.
Biswal AK, Hao Z, Pattathil S, Yang X, Winkeler K, Collins C, Mohanty SS, Richardson EA, Gelineo-Albersheim I, Hunt K, Ryno D, Sykes RW, Turner GB, Ziebell A, Gjersing E, Lukowitz W, Davis MF, Decker SR, Hahn MG, Mohnen D.调低GAUT12在杨树三角肌通过RNA沉默,在木质生物燃料原料中减少了顽固性,增加了生长,减少了木聚糖和果胶。生物技术生物燃料,2015;8:41。
- 33.
于玲,陈红,孙娟,李磊。杨树次生细胞壁纤维素生物合成需要PtrKOR1。植物学报,2014;34(11):1289-300。
- 34.
Bourquin V, Nishikubo N, Abe H, Brumer H, Denman S, Eklund M, Christiernin M, Teeri TT, Sundberg B, Mellerowicz EJ。木糖葡聚糖内转糖基化酶在维管组织次生细胞壁的形成过程中起作用。植物细胞,2002;14:3073-88。
- 35.
阿吉耶娃MV,阿梅尼茨基SI,戈尔什科娃TA,古里亚诺夫OP,伊布拉吉莫娃NN,米克什娜PV,莫克什娜NE,萨尔尼科夫VV,斯涅热约娃AV, chemickosova SB,切尔诺娃ТЕ。植物纤维的生物发生。俄罗斯联邦喀山俄罗斯科学院喀山科学中心喀山生物化学和生物物理研究所;2009.6 - 264页。
- 36.
列别捷夫VG, Vidyagina EO, Larionova AA, Shestibratov KA。木葡聚糖酶对转基因白杨叶、茎、根的分解作用(sp-Xeg)基因在实验室显微条件下。环境。2017;4(1):4。
- 37.
贝克尔我。植物原料的微生物生物转化及其应用前景。苏联。1983; 6:1-6。
- 38.
杨超,Schaefer DA,刘伟,Popescu VD,杨超,王旭,吴超,于德伟。真菌多样性越高,CO含量越低2自然森林中枯木的排放物。Sci代表2016;6:31066。
- 39.
张东,惠东,罗燕,周刚。陆地生态系统凋落物分解速率的全球格局及其控制因素。植物生态学报2008;1(2):85-93。
- 40.
Freschet GT, Aerts R, Cornelissen JHC。凋落物分解能力的植物经济学谱。功能生态学报,2012;26(1):56-65。
- 41.
Weedon JT, Cornwell WK, Cornelissen JHC, Zanne AE, Wirth C, Coomes DA。木材分解率的全球元分析:树种间性状变异的作用?生态学杂志,2009;12(1):45-56。
- 42.
Kvitkina AK, Larionova AA, Bykhovets SS.外源和内源氮对玉米植物残体矿化速率的影响。农业化学。2014;9:48-57。
- 43.
Geffen KG, Poorter L, Sass-Klaassen U, logtestjn RS, Cornelissen JH。15种新热带树种的性状对木材分解速率的贡献。生态。2010;91(12):3686 - 97。
- 44.
科马罗夫AS,切尔托夫OG, Bykhovets SS,普里普蒂娜IV,沙宁VN,维德贾吉娜EO,列别捷夫VG,谢斯蒂布拉托夫KA。短轮作人工林对北方针叶林碳氮循环的影响:模型试验数学与生物学报。2015;10(2):398-415。
- 45.
Shestibratov KA, Podresov AS, Salmova MA, Kovalitskaya YA, Vidyagina EO, Miroshnikov AI, Loginov DS, Koroleva OV。木糖葡聚糖酶基因表达的表型表现青霉菌canescens在转基因白杨植物中。植物生理学报,2012;59(5):618-25。
- 46.
阿克塞尔松EP, Hjältén J,勒罗伊CJ。抗虫性能苏云金杆菌(英国电信在半自然的野外条件下,包括瑞典的天然草甸条件下,表达白杨。Ecol Manag. 2012; 264:167-71。
- 47.
杨树清,张志强,张志强,等。转基因杨树对aba依赖性盐胁迫和干旱胁迫的适应性研究。植物科学学报2016;7:1337-56。
- 48.
李丽,周勇,程旭,孙杰,Marita JM, Ralph J, Chiang VL。多基因共转化对树木木质素多重性状的组合修饰。中国科学(d辑:自然科学版)2003;30(4):369 - 369。
- 49.
Acker RV, Leplé J-C, Aerts D, Storme V, Goeminne G, Ivens B, Légée F, Lapierre C, Piens K, Montagu MCEV, Santoro N, Foster CE, Ralph J, Soetaert W, Pilate G, Boerjan W利用田间种植的转褐酰基辅酶a还原酶缺陷杨树改善糖化和乙醇产量中国生物医学工程学报(自然科学版),2014;38(2):449 - 451。
- 50.
Kovalitskaya YA, Kovalenko NP, Shestibratov KA。杨树tremula4-香豆酸辅酶连接酶基因表达量降低的植物根系发生存在缺陷。IJET。2018; 7(4.36): 1139 - 44。
- 51.
卡斯特罗-罗德里格斯V,加西亚-古铁雷斯A,卡纳莱斯J,阿维拉C,柯比EG,卡诺瓦斯FM。谷氨酰胺合成酶基因家族杨树.BMC Plant Biol. 2011;11:119。
- 52.
Laemmli英国。T4噬菌体头部组装过程中结构蛋白的裂解。大自然。1970;227:680-5。
- 53.
Bylesjö M, Segura V, Soolanayakanahally RY, Rae AM, Trygg J, Gustafsson P, Jansson S, Street NR. LAMINA:快速量化叶片大小和形状参数的工具。BMC Plant Biol. 2008;8:82。
- 54.
纤维素的测定。zutersuch Lebensm, 1930; 59:48 - 85。
- 55.
Obolenskaya AV, Elnitskaya ZP, Leonovich AA。关于木材化学的实验室工作。莫斯科:Ekologiya;1991.p。320。
- 56.
戊聚糖的测定。中国科学(d辑:自然科学版)。
- 57.
福斯特CE,马丁TM,保利M.植物细胞壁(木质纤维素生物量)的综合成分分析。第二部分:碳水化合物。中华医学杂志2010;37(e1837): 1-4。
- 58.
蔡勇,张凯,金辉,侯刚,张旭,杨辉,冯辉,Miller L, Ralph J,刘cj。提高乙醇的消化率和收率杨树通过表达一种工程单木酚4- o甲基转移酶。科学通报。2016;7(11989):1-14。
- 59.
植物细胞壁和细胞壁成分的分离和表征。1986; 118:3-40。
- 60.
洛克伍德的车手。一种可靠、易分割的环氧包埋介质。Anat Rec 1964; 150:129-40。
- 61.
汉弗莱CD,皮特曼FE。一种简单的亚甲基蓝-保证II -碱性紫红染色法用于环氧包埋组织切片。染色技术。1974;49(1):9-14。
- 62.
斯皮尔林,伊森伯格。用醋酸和亚氯酸钠浸渍木质组织。科学。1947;105(2721):214。
- 63.
库兹涅佐娃电视台,图丽娜AS,塞门诺夫VM,库德雅罗夫VN。土壤中碳氮代谢的共轭过程。土壤科学,1998;7:832-9。
致谢
作者非常感谢编辑和两位匿名审稿人的建议,他们帮助我们改进了手稿。
资金
本工作包括数据的研究和收集、分析和解释,并撰写稿件,由俄罗斯联邦科学和教育部国家项目“植物分子生物学和生物技术:它们的培养、病原和胁迫保护(BIBCH)”资助,项目编号为(0101-2019-0037)。
作者信息
从属关系
贡献
EOV、VGL和KAS构思并设计了实验。EOV、NMS、VAB和VGL进行了实验并对数据进行了分析。KAS获得了资金,监督和管理了这项研究。KVK提供科学支持和咨询。EOV起草了手稿。EOV, VGL, KVK, KAS对手稿进行了修改。所有作者阅读并批准提交的稿件的最终版本。
相应的作者
道德声明
伦理批准和同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:表S1
本研究中使用的转基因白杨株系的命名。表S2温室条件下2月龄转基因植株和对照植株的高度(±SD),半自然条件下6月龄转基因植株和对照植株的高度(±SD)。图S1。原始的,未经加工和裁剪的版本的图。1.RT-PCR分析sp-Xeg基因在转基因白杨植物中的表达(预期扩增子大小为762 bp)。M标准分子标记1 kb (SibEnzyme), Н2О -阴性反应对照,pBI-Xeg -质粒DNA(阳性对照),Pt -非转基因对照,Gus-1-5a -转基因对照。图S2原始的,未经加工和裁剪的版本的图。2.Western blot分析携带重组基因的转基因白杨的蛋白质提取物sp-Xeg.M -标准蛋白分子标记、Xeg-真菌提取物、Pt -非转基因对照、Gus-1-5a -转基因阴性对照、Xeg-1-1a、Xeg-1-1b、Xeg-1-1c、Xeg-2-1b、Xeg-2-3b、Xeg-2-5a均为转基因株系。图S3。转基因和对照植物的Libriform木纤维。
权利与权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
维德亚吉娜,e。o。Subbotina, n.m., Belyi,退伍军人et al。木糖葡聚糖酶基因表达的各种影响青霉菌canescens半自然条件下的转基因白杨。植物生物学20.251(2020)。https://doi.org/10.1186/s12870-020-02469-2
收到了:
接受:
发表:
关键字
- 阿斯彭
- 基因表达水平
- Xyloglucanase
- 青霉菌canescens
- 杨树tremula
- 转基因