- 研究文章
- 开放访问
- 发布:
揭示异源二倍体x的生物量杂种优势Brassicoraphanus,杂交之间Brassica Rapa.和Raphanus Sativus,通过整合转录组和代谢物分析
BMC植物生物学体积20.文章编号:252.(2020)
摘要
背景
杂种优势在生物学上是重要的,但这种现象的分子基础尚不清楚。我们描述了属间杂交种B. Rapa.简历。Chiifu和R. Sativus简历。WK10039是杂种优势的一个极端例子。利用明显的杂种优势表型和亲本间的遗传距离,通过转录组分析和代谢物分析,解读杂种优势的分子基础。
结果
杂种优势在田间表现为鲜重,在玻璃房表现为花序茎长。开花时间呈正常分离群体分布,从一个亲本开花早到另一个开花晚,而典型F1群体的开花时间均相同,表明等位基因互作不稳定。转录组和代谢组均显示糖代谢发生改变,说明糖代谢的变化与杂种优势有关。由于杂交基因组之间没有共享等位基因,经典模型只能部分解释这种杂种优势,这表明还有其他机制参与其中。
结论
基因对初级和次生代谢的差异表达以及改变的代谢物谱表明,杂种优势可能涉及初级和次生新陈代谢之间平衡的变化。
背景
杂种优势,杂种比父母更好的趋势,可以在诸如生物量,种子数,植物高度等中的表型观察到许多这些杂种表型提高产量和其他农艺上的重要特征,因此在各种各样的中被利用育种计划。杂种体也发生在许多其他生物中,包括植物和动物,表明一个基本的机制是杂种物的下潜。然而,尽管已经提出了许多解释,但杂种优势的机制仍然待阐明。
一些经典的杂种优势模型是基于等位基因互作的。显性模型将杂种优势解释为显性等位基因之和[1],而过度大陆模型假设一些杂合的基因座比纯合子锁上更有益[2],上位性模型强调位点间的相互作用[3.].最近提出的杂种优势的分子机制包括蛋白质代谢、能量利用效率和表观遗传因素[综述于[4.那5.那6.那7.那8.那9.].一种广泛接受的概念是,杂种的程度与遗传距离正相关。首先由东部和海耶斯建议[10.]这个概念是基于具有间隙和代际杂种的观察结果[11.].然而,在有限的遗传多样性范围内,已经报道了相反的关系[12.那13.].因此,搜索仍然是一种可能的统一模型,其能够解释植物和动物中的杂种物机制。
合成属xBrassicoraphanus是交叉之间的互动杂交Brassica Rapa.土地Raphanus SativusL.通常被称为父母之间的遗传距离的杂种优势的极端例子[5.那11.].自从1826年Segeret第一次生产这种杂交产品以来,这种杂交产品一直在重复生产[14.].格子[15.和卡普琴科[16.介绍了众所周知的巨大植物。虽然其杂种优势的表型具有明显的优势,但从父母的生产中的F1杂交工具芸苔和raphanus.由于混合不相容,很难。因此,使用x尚未对杂种优势进行系统性调查Brassicoraphanus,即使生产这种混合动力车的努力是连续的[17.那18.那19.].
在这项研究中,我们在合成的Allodiploid x中表征了杂种优势的各个方面Brassicoraphanus——经典的巨型杂种优势模型,并利用转录组和代谢组分析研究了杂种优势相关的生物学机制。我们的结果显示了初级代谢的改变,并提示了杂种优势在进化中的重要性。
结果
F1杂交种在营养阶段展示射击生长和生物质的杂交活力
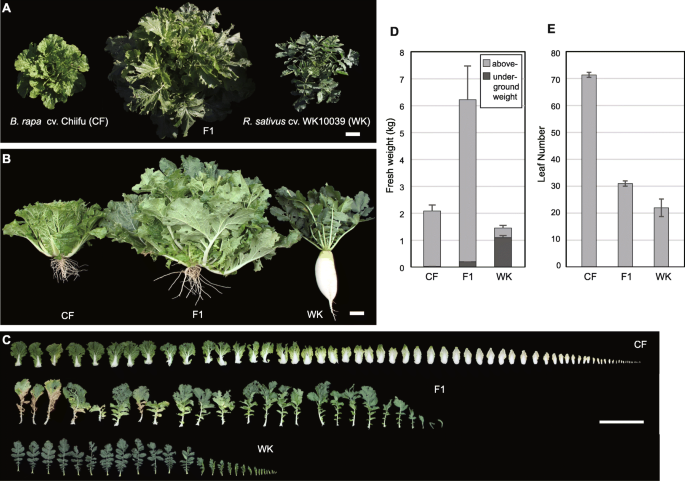
我们对杂交组合F1杂种的表型进行了杂种优势分析B. Rapa.简历。Chiifu (CF)R. Sativus简历。WK10039(WK)整个开发。从2周龄单位中获救的小型未发育的F1种子开始在体外3天开始发芽,幼苗比正常父母幼苗小得多。考虑到种子开发持续时间,在移植到土壤之前,我们将杂交植物在MS培养基上延长20天比B. Rapa.和R. Sativus在将土壤移植到父母对照中时,植物在体外发芽。由于F1杂交种子从未完全发育的单片机救出,评估杂交表型相对于父母在早期发育阶段,包括子叶大小,叶片尺寸和叶片启动率等特征是不可行的。
杂种及其亲本于2016年9月上旬在田间移栽,1个月后杂种F1的活力表型明显(图。1).我们在生长季节结束时2个月测量了植物新鲜重量。F1杂交种比母体和父母父母(2.02±0.28和1.36±0.13千克)分别为3-倍和4倍)(6.21±1.29千克)(表1;如图。1F1的叶片颜色介于WK植株的深绿色和CF植株的浅绿色之间(图1)。1一种)。杂种的叶片数(31.0±1.0)是中间体,与母体(71.3±0.9)和父母(22.0±3.3)父母的父母(MPV,46.7)相比是中间体的中间体。杂种的冠层(直径114.3±5.1厘米)分别比母体(41.6±1.5cm)和父母(51.4±1.5cm)父母大的2.7-和2.2倍)(表1;如图。1一种)。
CF叶子的特征在于大型静脉和圆形,而WK植物具有大的末端叶和朝向基部的小圆角叶片的拉特劳特叶(图。1c和S1).F1杂交植物产生更多的横向叶片,叶片较少,其形式是父母的形式(图S1)。值得注意的是,F1杂交种产生比父母更大的叶子(图。1C)。叶子和花粉形状类似地显示了表型的分布(图。1和S2).由于冬天的方法,我们无法观察到该领域的生殖阶段的表型。
在该领域中,WK的根生长大于CF和F1植物的生长,并且CF的总重量的较高重量的比例为0.8%,F1的3%和WK的75%。对于WK植物,我们认为整个根茎作为地下组织,即使底部的一部分在地上和从下胚轴下降[20.].CF植株次生根多,有一个主根;WK植株次生根少,有一个主根;F1植株次生根多,有一个主根生长情况与CF植株相似(图1)。1b)。
在生殖阶段的杂交种植中的杂种生长的杂种
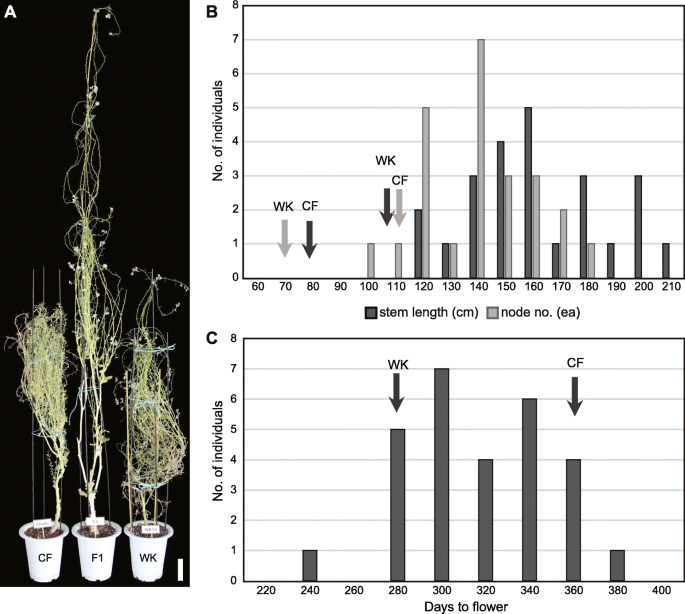
我们还观察到玻璃屋生长F1植物中花序茎长和节点数量的杂种优势(表1).F1杂交物与父母相比,具有细长的花序茎的不确定开花图案,而增殖的花序茎的数量和长度在CF和WK植物中受到限制。对于在玻璃房子的罐中生长的F1植物,增长活力的差异并不像该领域那样明显。部分原因可以解释这一结果,因为较旧的叶子经常在玻璃房病症下生长的盆中捕获。我们在田间种植的植物之间观察到的生长活力的差异表明杂种需要额外的生长营养素。
在玻璃房子里的28个f1杂交种中(表S1),所有的花序茎都比父母更长,分布相当正常(表1;如图。2a、b)。节点平均长度(1.17±0.20厘米)的混合动力车的父母之间(0.61±0.05,1.90±0.12厘米)非常接近MPV(1.26厘米),这表明株高的增加是由于生产更多的鲜花和植物分生组织(表的保养周期长1).父母双方都是自我兼容的;因此,鲜花全部未能设置种子,对于无菌F1杂交机来观察到相同的种子。因此,生育能力无法解释F1杂种中的花卉公司持久性的延长时期。F1杂种的开花时间(312.0±28.1)接近MPV(311),通常从早期开花WK(272.7±4.5)的时间分布到晚开花CF(349.3±4.1)(表1;如图。2c).通过计数减数分裂时花粉母细胞的染色体数,证实了F1杂种的异源二倍体性(图S3.).值得注意的是,F1杂种的开花时间是异步的,这表明F1杂种的开花是在随机调节下,这可能涉及代肾上腺杂交之间的父母等位基因之间的不稳定相互作用。
F1杂种显示代谢物型材的变化
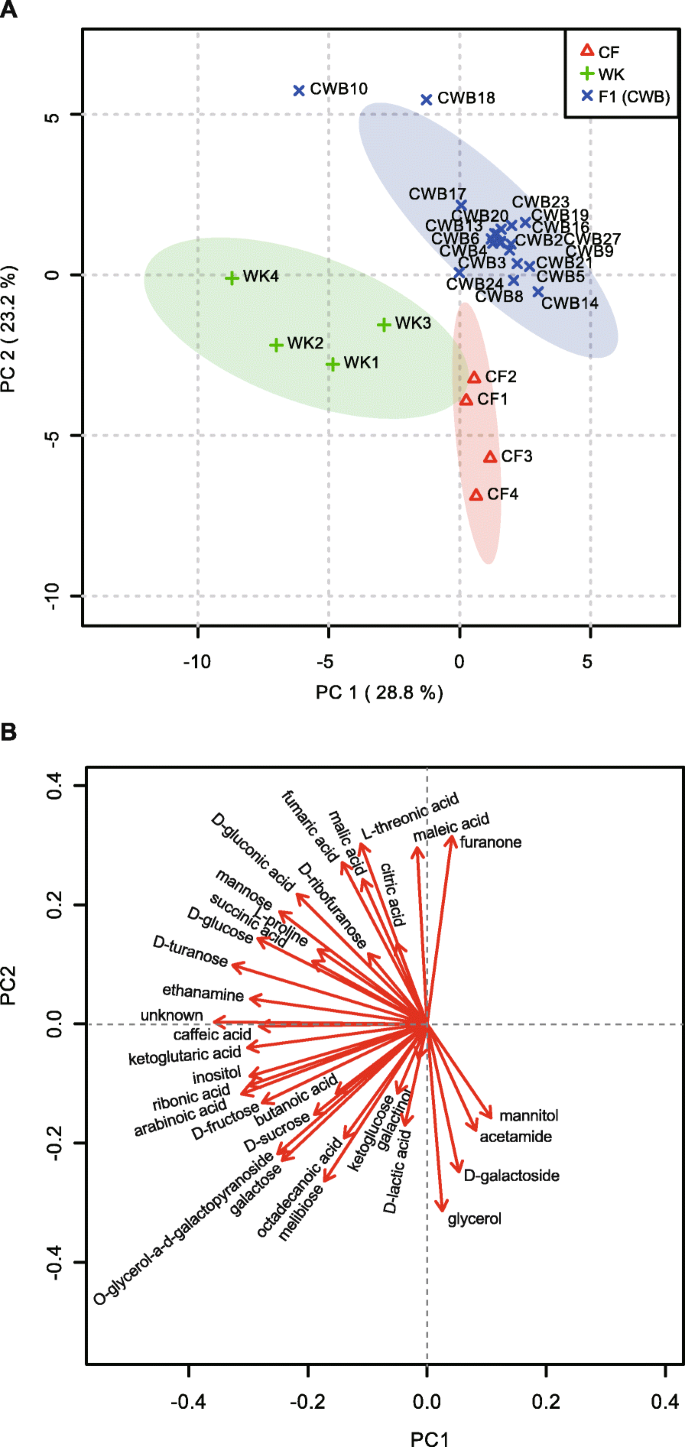
为了了解在F1植物中观察到的异细表型的原因,我们分析了来自叶子的33种代谢物,包括10次糖,13个糖酸和一种脂肪酸等。CF植物具有更多的3C多糖,例如甘油和D-乳酸,而不是WK或F1(图S4.).WK植物比CF植物含有更多的单糖,包括甘露糖、果糖、葡萄糖和肌醇,以及更多的5C糖酸,如酮戊二酸、核糖酸和阿拉伯糖酸(图S4.).而F1植株比CF和WK植株含有更多的4C多糖,如马来酸、苹果酸、反丁烯二酸和l -苏氨酸。与亲本相比,大部分F1杂种具有更多的呋喃糖和呋喃酮,而较少的果糖和红苷。我们在WK中检测到D-turanose,但在CF中没有检测到,而大约一半的F1植株含有D-turanose。这些数据表明在xBrassicoraphanusF1植物与父母相比。
主成分(PC)分析结果显示,F1株与亲本具有不同的代谢物谱。3.).PC1和PC2解释了52%的方差。CF和WK样品分别位于对角线上的第四象限和第三象限(图。3.一种)。除了CWB10和CWB18之外的所有F1样本(以下称为CWB),围绕着地块的中心或附近放置,其中CF和WK植物的95%的置信限制重叠。这种分布表明,尽管CF和WK样品在特定代谢物的样品中可变,但F1植物的代谢谱通常是父母的中间体(图。3.一种)。这些结果表明,改变的糖代谢可能有助于X中的异丙疮表型Brassicoraphanus植物和生殖阶段的F1植物,即使特异性代谢物的量没有显着增加或降低。
F1代的转录组表现出初级和次级代谢的变化
评估X中的异丙疮表型之间的关系和X代谢物简介的变化Brassicoraphanus我们从3个生物复制的F1植株中制备了RNA文库B. Rapa.(CF)和R. Sativus(WK)和20个f1杂种的个体和进行转录组分析(表S.2).过滤原始读取后,将序列从CF,WK和F1植物映射到参考基因组上B. Rapa.(一个基因组21.),),R. Sativus(R基因(22.];)和X的假设基因组BrassicoraphanusF1,其中A和R基因组合在一起。用QPCR验证CF,WK和F1杂种中若干基因的表达水平,并显示与FPKM值类似的模式(图。5.和S6.).
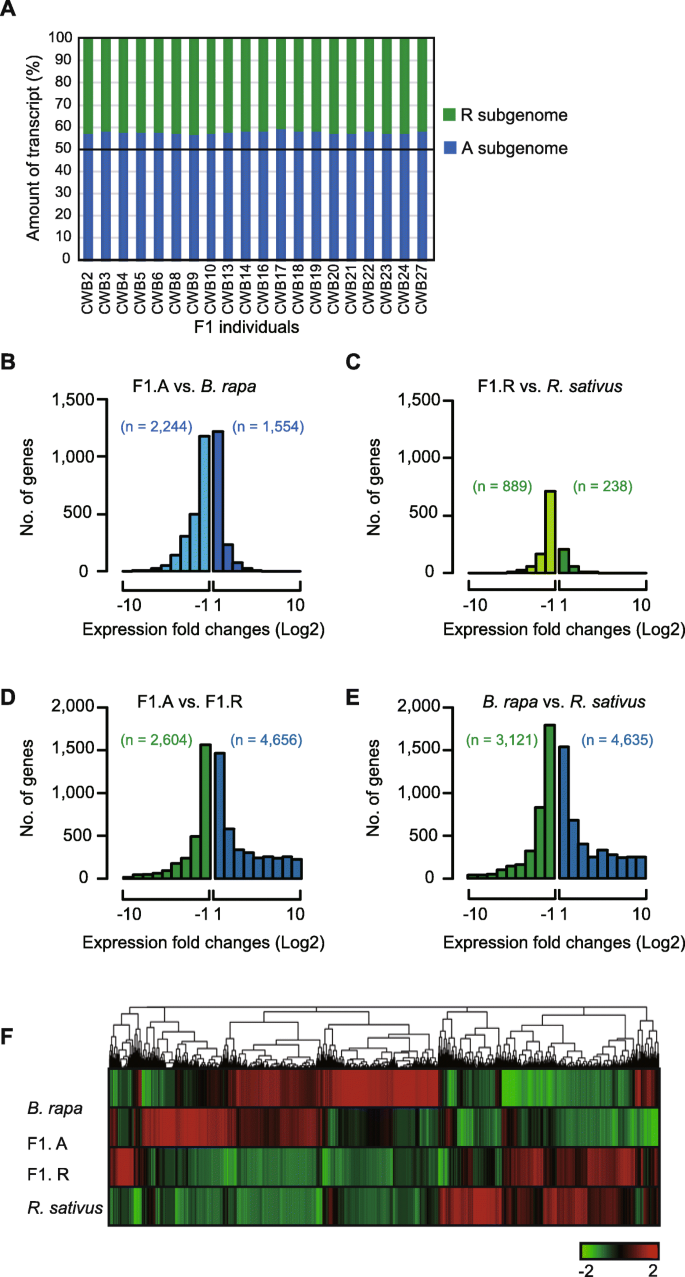
为了探讨杂交后基因表达的变化,我们将来自F1植物的21,538原始基因对的映射读入A和R子胚组中,并比较了来自每个亚基组的基因的表达。在F1杂种中的所有转录物中,从基因组映射到基因的超过一半读取(55%),而剩余的45%被映射到R基因组衍生的基因(图。4.一种)。
为了表征A和R基因组之间的表达差异,我们进行了21,538个正交基因的表达水平的成对比较。在F1杂交物中,上调1554个基因,对亚基组进行下调2244个,而上调238个基因,对于R亚基因,下调889个基因(图。4.b,c)。值得注意的是,源自母体基因组的差异表达基因(〜77%)的显着级分(〜77%),表明父母偏倚保持在F1杂交物中。当比较A和R基因组时,在杂交前检测到父母中的4635 A偏置和3121次偏置基因,而在杂交后,我们检测到F1杂交物中的4656 A偏置和2604个偏置基因,显示该数量在杂交时,具有偏向表达的基因相当保守(图。4.d, e).从F1株中观察到的基因表达变化来看,所有可能的基因表达模式,包括加性、显性、非显性和显性,在F1杂种中都存在(图1)。4.F)。
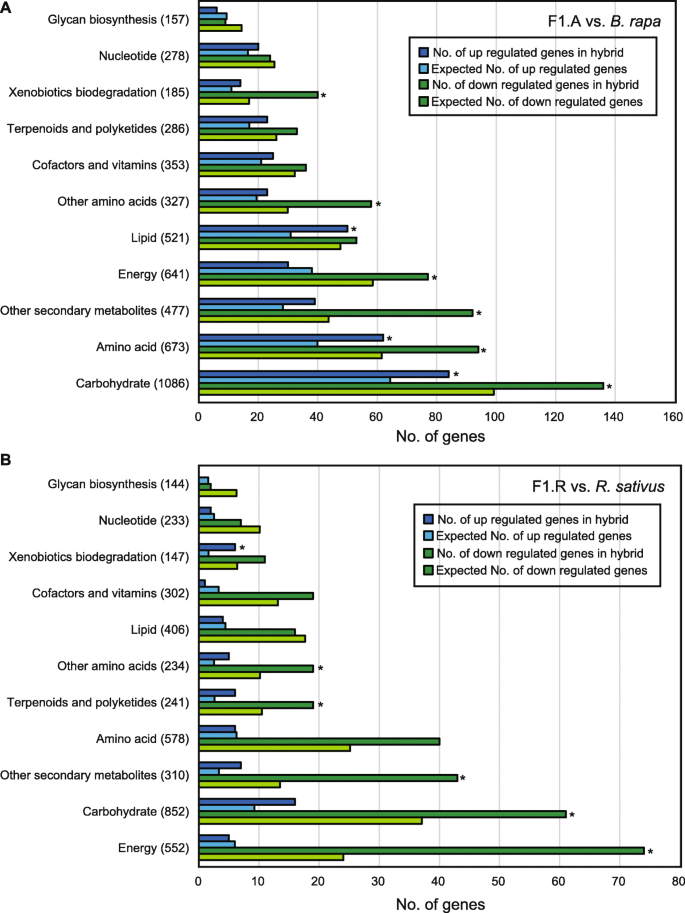
为了评估F1和父母之间的参数,6028和1539的函数与基因本体(GO)术语和GO富集测试进行注释P.< 0.0005的每个生物工艺类别(表2和3.).在F1杂种中上调的基因中,与分解代谢过程相关的GO项在F1中显著富集,通常在A和R基因组中检测到。这些过程包括“细胞碳水化合物分解代谢过程”(GO:0044275)、“葡聚糖分解代谢过程”(GO:00092521)、“细胞多糖分解代谢过程”(GO:0044247)、“葡聚糖代谢过程”(GO:0006073)、“淀粉分解过程”(GO:0005983)和“淀粉代谢过程”(GO:0005977)。因此,杂种F1的旺盛生长可能与两个基因组分解代谢活性的变化有关。对于下调的基因,在x的A和R亚基因组中对胁迫的响应都过高Brassicoraphanus(图。5.),而光合作用相关的氧化石墨烯仅在R基因组的下调基因中占过多的比例(表3.;如图。5.).
代谢物和转录om的组合分析表明淀粉代谢在杂种优势中的重要作用
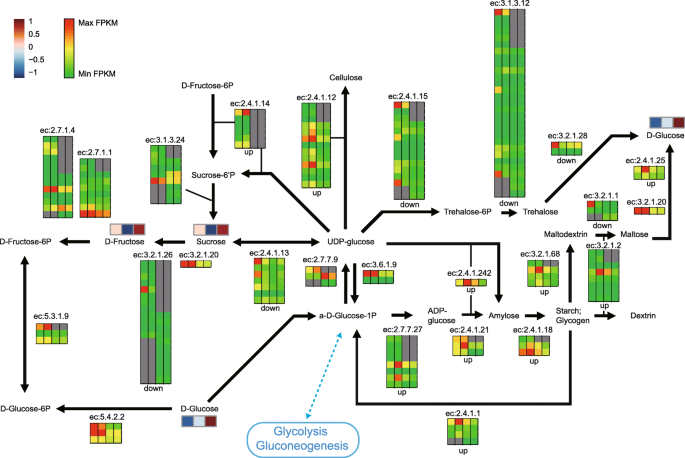
为了确认F1杂种代谢活动的变化,我们进行了KEGG (Kyoto Encyclopedia of Genes and Genomes)富集分析,发现多种代谢途径都被富集,包括“淀粉和蔗糖代谢途径”、“光合生物体碳固定途径”和“糖酵解/糖异生”(fig .)。6.和S7.).的淀粉和蔗糖代谢途径相关的主要差异表达基因在杂交glucose-1-phosphate adenylyltransferase (ec.2.7.7.27) ADP-glucose合成酶(ec.2.4.1.21) NDP-glucose-starch葡糖基转移酶(ec.2.4.1.242), 1, 4-alpha-glucan分支酶(ec.2.4.1.18),淀粉磷酸化酶(ec.2.4.1.1)参与了葡萄糖生物合成淀粉的过程。这些基因的母本拷贝表达上调,而父本拷贝表达水平保持不变(图1)。6.).催化逆代谢的淀粉磷酸化酶(EC.2.4.1.1)也上调,表明在F1杂交体中产生了更多的糖和淀粉,而不是父母。其他酶,包括蔗糖 - 磷酸合酶(EC.2.4.1.14),蔗糖合成酶(EC.2.4.1.13),β-淀粉酶(EC.3.2.1.2)和4-α-葡聚糖转移酶(EC.2.4.1.25),差异调节,表明初级代谢途径的活性基本上在F1杂交物中改变(图。6.).推测受这些途径调控的代谢物在F1杂种中也发生了改变,表明这些转录组和代谢组的变化可能导致F1植株中观察到的导致杂种优势的生理变化。蔗糖量的减少和蔗糖生物合成的下调是一致的,表明杂种F1中可能积累了更多的淀粉,最终表现为生长活力。
将杂种F1的表型、花序茎长、节数和开花时间与代谢物谱和基因表达量进行相关性分析(图S)8.).选择与表型和代谢物含量正相关或负相关的基因(|皮尔逊系数| > 0.6),并对其富集的GO项进行研究(表S3.和S4.).例如,与开花期相关的基因富含与纤维素生物合成相关的氧化石墨烯,而纤维素成分如d -果糖和d -葡萄糖与开花期表型相关性强(Pearson 's系数> 0.5)。此外,d -果糖的含量与初级细胞壁生物发生中富集的基因相关,代谢组和转录组均与表型相关。不同的研究表明细胞壁生物发生和开花时间之间存在相关性[23.那24.].在杂种优势表型方面,花序茎长、d -葡萄糖酸和丁二酸与Pearson系数> 0.5的相关性最高,甘露糖和d -果糖也呈正相关(Pearson系数> 0.4)。对于节点数,只有o -甘油-a-d-半乳糖苷与皮尔逊系数> 0.4相关。基因表达与杂种优势表型相关,代谢产物中脂肪酸、氧化酸、有机酸代谢相关的氧化石墨烯含量较高。
讨论
尽管F1杂种具有异质表型,但其生长活力一致
我们评估了代际杂交种x的杂交表型Brassicoraphanus从一个杂交B. Rapa.和R. Sativus,一个典型的杂种优势极端例子[5.那11.].F1杂种田间生长势(图。1)让人想起巨大的xBrassicoraphanus由之间的杂交产生的R. Sativus和B. Oleracea.[15.].F1植株表现出不同的表型,即开花时间和叶片形状(Figs。2和S1),这可能是由于杂交基因组和转录组的不稳定性,分别称为基因组冲击和转录组冲击[25.那26.].然而,尽管存在这种表型变化,但生物质和植物高度的杂种优势在所有F1个体中始终表达。karpechenko [16.[还观察到F1杂种中的叶片形状和开花时间的表型变化,其中高度或在冠覆面积中的生长活力在从两者之间的交叉中获得的123f1杂种的83株植物中显而易见R. Sativus和B. Oleracea..在这些人口中,据报道,侏儒症虽然本研究未观察到。F1杂种和母植物之间的生长差异的直接比较通常是由不同开花时间妨碍的,特别是在芸苔属中,包括模型植物拟南芥[27.].在本研究中,杂种优势与花期没有直接关系;无论何时开花,F1杂种的花序茎长总是大于任何一个亲本(图1)。2).
杂种优势是指F1杂种相对于亲本的任何优越表现型。在F1杂种中,萝卜根系大小和根系重偶有杂种优势[28.]大白菜中的叶重[29.]和油菜种子产量[30.].然而,对于异源二倍体xBrassicoraphanus(无花果。3.),根比萝卜小,叶比大白菜少。因此,对于不同的属,杂种优势的表现形式是不同的,如之前East所指出的[11.].
在玻璃房子里,植物高度或花序茎长度是x的另一个增长活力的指标Brassicoraphanus.两个都B. Rapa.和R. Sativus有不确定的开花生境;然而,在玻璃屋中,亲本的生长受到限制,花序茎长只能达到1 m左右,而花序茎长超过2 m的杂交种则表现出更多的不确定性。因此,杂种优势的主要表型可能是生长势在所有发育阶段均有表达;然而,如前所述,不同的表型可能发生在不同的环境中[4.那31.].
原发性代谢的改变可能与杂种优势有关
F1杂交种中的富含次数和富集的术语与杂交水稻的观察结果一致[32.]和拟南芥[27.],其中光合作用相关基因是上调的,并对应激响应相关的基因进行下调。这些研究表明,F1杂交厂的杂种优势涉及能源产生的根本变化和对环境刺激的反应。此外,这些液位特异于原产地,即,光合作用基因的母体拷贝在父母拷贝没有。糖含量改变,光合作用基因的差异表达,以及该研究中的增强的生物量与先前在拟南芥,大米和大白菜中制作的观察结果一致[27.那29.那31.那33.].
对生物和非生物胁迫的反应对于改变环境的适应至关重要,这需要新陈代谢的变化和不同无国防相关的代谢物的产生。植物次生新陈代谢涉及许多基因和大量能源的支出。增加的杂合性,特别是在不稳定的代谢中可以提高初级和次生代谢的复杂性,并且需要精细调节的方法,用于产生与对应激的反应有关的次级代谢物。我们对X的F1杂种中的杂种优化的观察Brassicoraphanus使我们假设初级和次生新陈代谢之间的平衡转移有利于初级代谢,其还伴随着转录组和代谢变化,如通过糖和糖酸浓度和相应的基因表达的改变而举例说明。考虑到拟南芥,水稻和其他植物中观察到的类似变化,我们的结果表明糖代谢的转变对于杂交植物中的杂种优势是必不可少的[27.那32.那33.].
现有模型仅部分解释杂种
通过玉米F1杂交种的转录组分析来提出基因表达中的统治性,跨越性和外延的模型[34.].但是,解释这些模型的等位基因相互作用不支持在X中观察到的杂种优势现象Brassicoraphanus因为所有的染色体都以单倍体形态存在。重复的基因相互作用不一定是等位的或在孟德尔遗传学的控制下[11.].因此,可以认为异源二倍体杂种优势主要是由非等位基因的相互作用而不是等位基因的相互作用调节的。因此,强调位点间相互作用的上位性模型更适合于这种情况。
在最近的模型中,能量利用效率用于解释杂种优势,杂交种在基线新陈代谢期间降低能量消耗,并利用节省的能量增加生物量[7.那8.].代谢相关基因表达的改变(图。5.)和代谢物剖面的变化(图。3.)也可能有助于在本研究中观察到的杂种优势表型,尽管改变基因表达和能量利用效率之间的联系需要进一步调查。此外,在这种情况下,从源到水槽的高效糖传输是卓越生物量的另一个问题,因为在杂交中不再存在扩大的根或前叶,并且可能归因于生物质杂种的缺失。我们专注于本研究中的叶片代谢物和转录组,然而,应研究不同的组织,以便将来分析。
杂种优势对新物种的进化具有重要意义
杂种体发生在许多生物体中,杂种优势在其他地方已经讨论了演化中的作用[4.那35.].通常观察到卓越的表型在三种杂种和Allopolyploids中观察到[11.].考虑到杂交和多重化被认为是进化的重要驱动力,我们的观察结果为杂种优势的重要作用提供了进一步的证据,以增加杂交植物的适应性。通过在杂种中表达的杂种优势,通过多倍化可能会显着增加新杂交的生物的可能性,这应该促进导致收购生育和建立新型物种的基因组稳定性。
驯化或自然选择可能导致初级和次生新陈代谢在适应环境的方向上的演变,而不是简单的增长。由于最佳生物量是生态有益的,植物可能产生控制过度生长的机制。然而,随着杂种物,植物可能会恢复到更剧烈的稳定条件,导致在进化期间丢失的能力表达(图。9.).由于生长活力在几代内丧失,杂种明显快速发展适应代谢。
本研究观察到的开花时间和叶片形状等表型变异表明,杂种F1基因组存在不稳定性;然而,我们一致地观察到所有杂种的杂种优势,尽管有这些变异。由此可见,杂种优势并不一定是显性或超显性等等位基因互作的结果。相比之下,我们假设,当来自离散亲本的两套基因组在一个核内与母体细胞质结合时,不亲和性导致了杂种的旺盛生长。当生物体进化时,这种机制也与高度复杂的调节有关。因此,由不亲和性产生的杂种优势释放出高水平的调控,使生物体恢复到相对无限制的生长状态(图S9.).
目前尚不清楚是哪些因素刺激初级代谢,抑制次级代谢,使杂交种恢复到原始状态。我们可以假设代谢的调控基因就是这些因子,这些因子可以称为杂种优势基因。此外,我们认为杂种优势可能是由于不同基因组杂交而导致的任何类型的遗传或表观遗传失调而导致的。
结论
在这项研究中,F1杂交物的生物量杂种从邻近交叉之间的杂种B. Rapa.和R. Sativus通过转录组和代谢物分析研究。尽管F1杂种中的表型变异,但初级和次生代谢相关基因的差异表达以及改变的代谢物谱表明,杂种优势可能涉及初级和次生新陈代谢之间的平衡变化以及相应的转录组变化的变化。x中的观察结果Brassicoraphanus是一种经典的杂种源性优势,可以提供不同的视角,以了解杂种优势的潜在机制。
方法
植物材料
自交系B. Rapa.简历。Chiifu和R. Sativus简历。用于参比基因组测序B. Rapa.和R. Sativus[21.那22.],被博士提供。Jin Kim和Suhyung Park(农村发展管理局,万州,韩国)。CF和WK植物被交叉以产生F1杂交物(图。1那2和s1).未开放的CF芽去雄,用成熟的WK花粉手工授粉。授粉两周后,采集石蕊,在50%漂白溶液中连续转化消毒15分钟,然后用蒸馏水冲洗三次。将未成熟的种子从果荚中取出,放在一个干净的台子上,在MS培养基上培养,直到长成植株。在MS培养基上的植株被转移到土壤(Sunshine Mix #5, SunGro, USA)中,在24°C的室内,每天16小时,连续生长一个月。然后,这些植株被移植到玻璃房子里的一个更大的花盆里或地里。CF和WK种子也被置于MS培养基上,并在类似发育阶段转移到土壤中,大约1周。亲本植株与F1植株一起在步入式室内生长一个月,然后移栽于玻璃房的花盆或田间。对玻璃房栽培的植株进行了花期、茎长和节数的测定。花期由播种后第一次抽薹的天数决定。 Stem length and node number were counted from 3 to 5 fully developed inflorescence stems for each plant and at least three plant of parents and F1 hybrids as indicated in Table1.对于大田种植的植株,测定亲本和F1的3株以上植株鲜重和叶数,见表1.
RNA测序
从试管内未成熟的种子中移植出来,在盆栽中生长一个月,然后采集样本进行RNA测序。为了减少F1和亲本之间的生长差异的影响,每个植株的样品混合了三个不同发育阶段(幼、中、完全发育)的叶片;这些叶子被拍照(图S1)然后在液氮中冷冻和研磨。根据制造商的说明,用植物RNeasy迷你试剂盒(Qiagen,Germany)用植物RNeasy Mini Kit(Qiagen,德国)提取总RNA。如前所述,构建了一个Truseq RNA文库[36.],并在Hiseq 2000平台上测序(USLUMINA,USA)。
定量PCR分析
为了验证RNA测序结果,使用所选的正非对基因进行QPCR分析,CF,WK和F1的三种生物重复。使用总RNA(1μg)与上标III逆转录酶(Invitrogen,USA)和1μl1/20稀释的cDNA的逆转录用于PCR反应。引物列于表s中5..在95℃下在95℃,15秒的60℃下在60℃下的40℃下进行10分钟,在60℃下进行QPCR,在72℃下,用Rotor-Gene Q 2plex HRM平台和Quantifast Sybr Green PCR套件(德国Qiagen)。
转录组数据分析
使用CLC-quality trim工具过滤低质量的原始reads (
代谢物分析
极性代谢物用甲醇提取,如之前的研究所述,但做了一些修改[44.].CF,WK和CWB的冷冻干燥的叶样品用咖啡研磨机粉。将每个50mg粉末的子样物与1.2ml甲醇混合并剧烈涡旋。将1μL甲醇提取物注入GC-MS ISQLT系统(Thermo Fisher Scientific,USA)中注入1μl甲醇的萃取物。样品包括CF和WK的四种生物重复,19b和CWB(表S1).使用MetaboAnalyst 3.0软件(www.metaboanalyst.ca)处理极化和主成分分析(PCA)的正常化和主成分分析(PCA)。
缩写
- CF:
-
B. Rapa.简历。Chiifu.
- 预警:
-
F1杂交物从横梁之间B. Rapa.简历。Chiifu和R. Sativus简历。WK10039.
- 度:
-
差异表达基因
- 罗斯福:
-
错误发现率
- FPKM:
-
每千碱基100万个碎片
- 去:
-
基因本体论
- KEGG:
-
京都基因和基因组百科全书
- 商务:
-
中父母价值
- PCA:
-
主成分分析
- 工作:
-
R. Sativus简历。WK10039.
参考文献
- 1。
琼斯DF。连锁因子的显性作为杂种优势的一种方法。遗传学。1917;2(5):466 - 79。
- 2。
Shull GH。杂种优势是什么。遗传学。1948;33(5):439 - 46。
- 3.
鲍尔斯L.扩大Jone的杂种优势解释理论。我是nat。1944年; 78:275-80。
- 4.
Lippman ZB, Zamir D.杂种优势:重现魔力。趋势麝猫。2007;23(2):60-6。
- 5。
Birchler Ja,Yao H,Chudalayandi S,Vaiman D,Vitia Ra。杂种优势。植物细胞。2010; 22(7):2105-12。
- 6。
陈ZJ。多倍体与杂种优势的分子机制。植物生态学报,2010;
- 7。
高夫SA。一般多基因杂种优势的统一理论:能量效率,蛋白质代谢,和分子育种的含义。新植醇。2011;189(4):923 - 37。
- 8。
巴兰沃尔VK,Mikkilineni v,Zehr Ub,Tyagi Ak,Kapoor S.杂种优势:关于混合活力的新兴思想。J Exp Bot。2012; 63(18):6309-14。
- 9。
陈ZJ。基因组和表观遗传学对杂种优势的分子碱基。NAT Rev Genet。2012; 14(7):471-82。
- 10.
东em,海耶斯香港。杂合子在进化和植物育种中。USDA Bur Plant Ind Bull。1912; 243:7-58。
- 11.
东em。杂种体遗传。1936; 21(4):375-97。
- 12.
Moll RH, lonquist JH, Fortuno JV, Johnson EC。玉米杂种优势与遗传分化的关系。遗传学。1965;52(1):139 - 44。
- 13。
van Hulten Mha,Paulo MJ,Kruijner W,Bankestijn-de Vries H,Kemperman B,Becker FFM,杨杰,罗斯K,STAM Me,Van Eeuwijk Fa,Keurentjes JJB。拟南芥综合绘图群体中杂种优化的评估。Plos一个。2018; 13(10):E0205564。
- 14。
Prakash,S.,S. R.Bhat,C.F.F.Quiros,P. B.Kirti,Chopra V.L. Brassica及其密闭盟友:细胞遗传学和演变。在:Jules Janick(ed)植物品种。Rev.,Wiley。2009; 31:21-187。
- 15.
Gravatt F.萝卜卷曲。j hered。1914; 5:269-72。
- 16。
karpechenko gd。女性的杂种Raphanus SativusL x男性芸苔属植物oleracea李建平。2004;3(3):1 - 7。
- 17。
Lelivelt CLC, Lange W, Dolstra O.属间杂交将甜菜包囊线虫抗性从萝卜转移到甘蓝型油菜。Euphytica。1993;68(1 - 2):111 - 20。
- 18。
陈某,吴杰斯。肥沃肌脂双吡啶之间的表征Raphanus Sativus和Brassica Alboglabra和芸苔属的可与芸苔属。遗传资源庄稼EV。2008; 55(1):143-50。
- 19。
Lee Ss,Lee Sa,杨杰,金J.开发稳定的x后代Brassicoraphanus,之间的代际所有聚倍数Brassica Rapa.和Raphanus Sativus,通过小孢子培养诱导突变。中国生物医学工程学报,2011;
- 20.
易g,金杰,公园je,shin h,yu sh,park s,huh jh。MyB1转录因子是萝卜中红色根皮肤的候选者(Raphanus Sativusl .)。《公共科学图书馆•综合》。2018;13 (9):e0204241。
- 21.
王X,王h,王j,sun r,吴j,刘s,白y,mun jh,bancroft i,cheng f等。中聚蛋白质作物种类的基因组Brassica Rapa..NAT Genet。2011; 43(10):1035-9。
- 22.
Jeong YM, Kim N, Ahn BO, Oh M, Chung WH, Chung H, Jeong S, Lim KB, Hwang YJ, Kim GB,等。通过与芸苔属基因组的染色体水平比较,阐明萝卜的三重祖先基因组结构。中国生物医学工程学报,2016;
- 23。
vermerris w,thompson kj,mcintyre lm,axtell jd。玉米和高粱中细胞壁生物发生与植物发育的进化保守相互作用的证据。BMC EVOL BIOL。2002; 2:2。
- 24。
FKF1对纤维素合成具有负调控作用。植物杂志。2019;180:2240-53。
- 25。
基因组对挑战反应的意义。科学。1984;226(4676):792 - 801。
- 26。
Hegarty MJ,Barker GL,Wilson ID,Abbott RJ,Edwards KJ,Hiscock SJ。通过基因组重复,在enecio中杂交后的转录组休克发生了改善。Curr Biol。2006; 16(16):1652-9。
- 27。
Fujimoto R,Taylor JM,Shirasawa S,孔雀WJ,Dennis Es。C24和COL之间的拟南芥杂种的杂种与光合作用的增加有关。Proc Natl Acad Sci U S A. 2012; 109(18):7109-14。
- 28。
弗罗斯特HB。萝卜大小因子的杂种优势和显性。遗传学。1923;8(2):116 - 53年。
- 29。
Saeki N, Kawanabe T, Ying H, Shimizu M, Kojima M, Abe H, Okazaki K, Kaji M, Taylor JM, Sakakibara H,等。大白菜商业杂交种杂种活力的分子和细胞特性。植物生物学杂志。2016;16:45。
- 30.
关键词:巴苏南达;油菜幼苗和产量性状杂种优势相关数量性状位点的比较定位(芸苔属植物显著l .)。中国生物医学工程学报,2010;
- 31。
拟南芥(Arabidopsis thaliana)田间和温室适应相关数量性状的上位性分析。遗传学。2005;171(4):2013 - 27所示。
- 32.
宋广生,翟海林,彭永刚,张玲,魏刚,陈晓燕,肖永刚,王玲,陈永军,吴斌,等。超级杂交稻转录谱比较及杂种优势机制的初步研究。摩尔。2010;3(6):1012 - 25所示。
- 33.
Korn M,Peterek S,Mock HP,Heyer AG,Hincha DK。冷冻耐受性的杂种优势,以及之间的十字糖和黄酮类化合物含量拟南芥蒂利亚纳广泛改变冰冷耐受性的探讨。植物细胞环境。2008; 31(6):813-27。
- 34.
Swanson-Wagner RA, Jia Y, DeCook R, Borsuk LA, Nettleton D, Schnable PS.在玉米F1杂种及其近交系亲本基因表达的全局比较中,观察了所有可能的基因作用模式。国家自然科学基金资助项目:国家自然科学基金资助项目。
- 35。
Goulet是,Roda F,Hopkins R.植物中的杂交:旧想法。新技术植物理遗。2017; 173(1):65-78。
- 36。
关键词:Illumina小RNA- seq文库,T4 RNA连接酶1,腺苷化适配器工厂方法。2012;8(1):41。
- 37。
徐辉,罗鑫,钱健,庞鑫,宋健,钱刚,等。FastUniq:一个用于配对短读的快速从头复制删除工具。《公共科学图书馆•综合》。2012;7 (12):e52249。
- 38。
Trapnell C,Pachter L,Salzberg SL。Tophat:发现带RNA-SEQ的接头连接点。生物信息学。2009; 25(9):1105-11。
- 39。
Anders S,Pyl Pt,Huber W. htseq - 使用高吞吐量排序数据的Python框架。生物信息学。2015; 31(2):166-9。
- 40.
罗宾逊医学博士,麦卡锡DJ,史密斯GK。edgeR:一个用于数字基因表达数据差异表达分析的生物导体包。生物信息学,2010,26(1):139 - 40。
- 41.
Conesa A,Gotz S,Garcia-Gomez JM,Terol J,Talon M,Robles M.Baster2Go:功能基因组学研究中的注释,可视化和分析的普遍工具。生物信息学。2005; 21(18):3674-6。
- 42。
关键词:基因本体;富集分析;R包。2010.
- 43。
Moriya Y,Itoh M,Okuda S,Yoshizawa Ac,Kanehisa M. Kaas:自动基因组注释和路径重建服务器。核酸RES。2007; 35:W182-5。
- 44.
关键词:植物代谢产物,气相色谱,质谱分析Nat Protoc。2006;1(1):387 - 96。
致谢
作者衷心感谢Soo-Seong Lee博士(韩国安城生物育种研究所)的有益讨论和技术建议。作者们也感谢dr。Jin A Kim(国家农业科学院)和Suhyung Park(韩国万州农村发展管理局国家园艺和草药科学研究所)提供种子B. Rapa.简历。Chiifu和R. Sativus简历。WK10039分别。
数据和材料的可用性
RNA-SEQ原始数据可在NCBI获得,NCBI具有PRJNA524717(https://www.ncbi.nlm.nih.gov/bioproject/PRJNA524717).
资金
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Ministry of Science and ICT (2016R1D1A1B03930431 and 2013R1A1A2058687 to GY) and by ‘Next-Generation BioGreen 21 Program (PJ013262 to HJH)’ Rural Development Administration (RDA), Korea. The funding agencies were not involved in the experimental design, collection and interpretation of data, and in preparation of the manuscript.
作者信息
从属关系
贡献
GY设计并进行了大部分实验。HS和JHA进行了生物信息分析,HRP和JEP进行了表型分析,SL,JGL和EJL进行了代谢物分析。GY写了稿件。JHH监督实验并修订了稿件。所有作者均阅读并批准了手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
F1样品摘要及其分析用法(DOCX 2531 KB)。表S2。RNA-SEQ读取综述。表S3。前5项富集的基因术语具有表达相关性与F1杂种中的表型相关的基因。表S4。基因前5位富集的GO项与F1杂种代谢物含量存在表达相关性。表S5。对基因及其用于QRT-PCR分析的基因。图S1。新合成的allodiploid x的叶形状Brassicoraphanus.图S2。新合成的allodiploid x的花粉形状Brassicoraphanus.图S3。CF,WK和CWB的染色体数字。在AlloDiploid F1杂交(C)中观察到19染色体(单染色剂),而分别在CF(A)和WK(B)中观察到10和9染色体对(二价)。染色体蔓延是从减数分裂的Diakinesis中的花粉母细胞获得。条=10μm。图S4。用于父母(CF和WK)的四个生物学重复的代谢物浓度和19个生物学重复的F1杂交种(F1),如每个图表的顶部所示。图S5。通过QPCR验证RNA-SEQ结果。图S6。用物种特异性和一般引物qPCR验证rna序列结果。图S7。在新陈代谢相关的KEGG途径中分配DEG。图S8。表型与代谢物浓度及代谢物浓度之间的相关性。图S9。图表显示了杂种优势机制。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
易广,申浩,朴仁勋等等。揭示异源二倍体x的生物量杂种优势Brassicoraphanus,杂交之间Brassica Rapa.和Raphanus Sativus,通过集成转录组和代谢物分析。BMC植物BIOL.20.252(2020)。https://doi.org/10.1186/s12870-020-02470-9
已收到:
公认:
发表:
关键词
- Allodiploid.
- 生物量
- 开花时间
- 杂种优势
- 属间杂交
- 糖代谢
- 代谢物
- 转录组