摘要
背景
干旱胁迫会严重影响植物生长和作物产量。干旱诱导启动子的克隆和鉴定将为基于基因的提高作物抗旱性的策略提供价值。
结果
以往的研究表明,编码水通道蛋白的MaPIP1;1基因参与了植物的干旱胁迫响应。本研究从香蕉基因组中分离到位于mapapip1;1转录起始位点上游1362 bp的启动子pMaPIP1;1,转录起始位点(A)位于ATG前47 bp。为了在功能上验证启动子,将不同长度的pMaPIP1;1删除并与GUS融合,生成pMaPIP1;1::GUS融合结构,然后将其转化到拟南芥中,生成M-P1、M-P2、M-P3和M-P4四个转化子。甘露醇处理用于模拟干旱条件。所有四种转化菌对甘露醇处理反应良好。在所有转基因拟南芥组织中,M-P2(−1274 bp ~−1)的转录活性最高,说明M-P2是pMaPIP1的核心区域;启动子的这个区域也给予高水平的基因表达,以响应甘露醇处理。以M-P2为酵母单杂交饵料,筛选出23个与MaPIP1;1互作的不同转录因子或基因。在双荧光素酶互补实验中,当与香蕉启动子结合时,转录因子MADS3正调控MaPIP1;1的转录。qRT-PCR结果显示,干旱胁迫下香蕉叶片和根中MADS3的表达相似。在45%土壤湿度模拟干旱胁迫条件下生长的香蕉植株中,MaPIP1;1表达量最大,这进一步证明MADS3转录因子可以与MaPIP1;1协同作用。
结论
我们的研究结果揭示了MaPIP1;1介导香蕉干旱响应相关的分子机制,并将扩展我们对AQP基因表达调控的理解。这为香蕉抗旱性的遗传改良奠定了基础。
背景
水是植物生长发育所必需的[1].干旱等非生物胁迫会影响植物生长,导致全球植物产量的重大损失[2],在农业上也是一个日益严重的问题[3.,4,5,6].所有形式的水运输,包括干旱调节、单细胞扩张和长距离运输,都需要水通过细胞膜的运动[7].植物水通道蛋白(aquaporins, AQPs)允许水流入和流出,增强液泡膜和质膜的水渗透性[8,9].AQPs在水平衡生理和促进高效用水方面发挥重要作用[10,11,12,13,14].水稳态是细胞生存的基础。水在细胞膜间的运输受aqps -四聚体整体膜通道的控制,该通道在真核生物王国中高度保守[15].在真核生物中,它使水在细胞膜上的流动受到严格的调节,以响应各种外部和内部信号,从而维持生物所需的水平衡[16].快速调节可以通过两种方式实现——要么通过改变通过孔隙本身的水渗透率(门控),要么通过在质膜和细胞内囊泡之间穿梭蛋白质,即所谓的转运,迅速改变质膜中AQP分子的丰度[17].
AQPs是跨膜蛋白,在细胞内膜和质膜上形成通道,促进水向任何方向快速流动[18].为了运输水分,一些主要的内在蛋白(MIP)家族成员也可以运输甘油、CO2、尿素、氨、过氧化氢、硼、硅、亚砷酸盐、锑酸、乳酸[19,20.]和O2[21].
植物AQPs家族庞大且高度多样化,可分为8个亚家族:质膜内禀蛋白(PIPs)、液膜内禀蛋白(TIPs)、结节蛋白26样内禀蛋白(NIPs)、小基性内禀蛋白(SIPs)、glpf样内禀蛋白(GIPs)、杂交内禀蛋白(HIPs)、未分类成员指定的X内禀蛋白(XIPs)和大内禀蛋白(LIPs) [22,23].这些亚家族共同参与植物的生长和发育过程,如种子萌发和果实成熟,以及细胞伸长[24].此外,在植物对环境胁迫的反应中,AQPs在维持水稳态方面发挥着核心作用[18,25].近年来,AQPs在了解植物如何应对非生物胁迫的研究中引起了越来越多的兴趣。许多实验结果表明,植物通过调节AQP活性来应对各种非生物胁迫,如冷胁迫、盐胁迫、机械损伤、干旱胁迫和重金属胁迫。特别是AQP在植物对干旱胁迫的反应中起着至关重要的作用,研究表明,植物中某些AQP家族基因的过表达增加了转基因植物对干旱胁迫的耐受性[24,25,26,27].例如,TaAQP7过表达增加了转基因烟草对干旱胁迫的耐受性[27].小麦TaTIP2;2转基因拟南芥增加了转基因植株对干旱胁迫的耐受性[28].在香蕉中,转基因AQP基因也可以提高抗旱性。过表达MusaPIP1;2的香蕉植株抗旱性较对照植株显著增强[29].在Sreedharan的一项研究中,用MusaPIP1;2转化的转基因香蕉植株在干旱处理后的复水后比野生型植株有更强劲的恢复。对比转基因和野生型植物的生理生化指标,MusaPIP1;2转基因植物的丙二醛含量增加,脯氨酸含量和相对水分含量降低,表明转基因植物的诱导干旱调节能力增强,从而提高了抗旱性。同样,转基因MaPIP1;1的拟南芥也表现出更好的植物抗旱性[30.].
尽管有这些发现,调控抗旱性的分子机制仍然不清楚。干旱等非生物胁迫显著影响植物的生长发育和代谢[31,32].植物有多种途径快速适应多种胁迫,促进干旱胁迫下的生存。一系列功能蛋白如分子伴侣蛋白、渗透调节蛋白、通道蛋白、转运蛋白、保护蛋白和解毒蛋白在这些反应机制中起着重要作用。这些功能蛋白的表达受特定的转录因子控制,这些转录因子与顺式作用元件相互作用,诱导特定基因的表达以应对干旱胁迫。基因表达由特定启动子定量调控,该启动子可包含多个顺式调控元件[33].顺式元件与转录因子(TFs)之间的相互作用通过协同调控转录在激活或抑制靶基因表达中起着关键作用[34,35].目前,能用于作物遗传改良的启动子还很少。植物中最常见的启动子类型是35s启动子CaMV35S,它可以在双子叶中驱动高水平的基因表达,而玉米泛素启动子则驱动单子叶中的基因表达。这些启动子能够在几乎所有组织和发育阶段的标记物或单子房中驱动高水平的转基因表达[36,37,38].诱导启动子或组织特异性启动子在特定条件下或特定组织中调节靶基因的表达。迄今为止,一些组织特异性和胁迫诱导启动子已被报道用于植物。例如,拟南芥中的rd29A和rd29B启动子对高盐度和干旱有反应[39].在小麦中,Dreb2启动子响应干旱胁迫[40].来自芥菜植物的BjSOS2基因启动子在高盐、干旱和非生物胁迫以及其他形式的胁迫中发挥作用[5].硬粒小麦基因TdPIP2;1及其启动子区域响应水稻非生物胁迫[41].
在本研究中,我们克隆了MaPIP1;1基因的启动子,将启动子分为M-P1-M-P4四个部分,并将其转化为拟南芥.GUS染色和GUS失活实验表明,M-P2是启动子的核心区域。采用酵母单杂交方法鉴定直接调控MaPIP1;1启动子的转录因子,以及靶转录因子调控MaPIP1;1表达的分子机制。根据顺式作用元件,使用启动子的5 '缺失突变体来确定核心区域,并作为酵母单杂交试验的诱饵,鉴定出23种不同的转录因子或基因与MaPIP1相互作用;转录因子MADS3是根据其在双荧光素酶实验中的结合结果选择的。在45%土壤湿度诱导干旱胁迫下,MaPIP1;1表达量最大,说明MADS3转录因子与MaPIP1;1协同作用。综上所述,本研究结果揭示了MaPIP1;1介导了香蕉干旱胁迫响应的分子调控机制,将拓展我们对干旱胁迫下香蕉AQP基因表达调控的认识。这一发现为设计提高香蕉抗旱性的基因修饰奠定了基础。
结果
MaPIP1启动子的鉴定及顺式作用元件分析
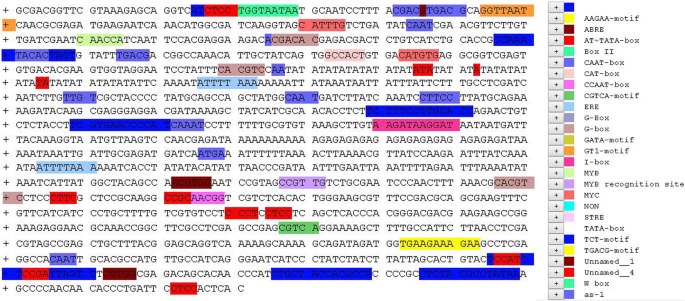
MaPIP1;1启动子序列是从香蕉A基因组网站(http://banana-genome.cirad.fr),设计特异性引物扩增启动子周围的1362 bp片段(表1),位于MaPIP1上游;1个转录起始位点。转录起始位点(A)在ATG前47 bp。利用PlantCARE和PLACE数据库对已知的顺式作用元件启动子序列进行分析,结果表明该片段包含多个TATA-box和CAAT-box核心顺式作用元件、一个脱落酸响应元件(ABRE)、MYB元件(CAACCA)、两种类型的MYC元件(CATGTG和CATTTG)、一个ERE元件(ATTTTAAA)、MYB识别位点(CCGTTG)、一个AAGAA基序(TGAAGAAAGAA)、一个MYBHv1结合位点(CCAAT盒)、两种类型的MeJA(茉莉酸甲酯)响应元件(TGACG-motif和CGTCA-motif),四种类型的光响应元件(Box II,G-box, GT1-motif, I-BOX),一个分生组织响应元件(CAT-box), CCAAT盒(CAACGG), MYB识别位点(CCGTTG)和一个未知元件(CGTGA)(图。1).虽然mapapip1;1是由甘露醇处理诱导的,但pMaPIP1;1序列缺乏已知的干旱胁迫诱导的顺式作用元件。
1362 bp启动子和MaPIP1的顺式作用元件;已知的顺式作用元件如图所示。元素的描述见表1
MaPIP1;1启动子缺失突变体在转基因中的活性拟南芥
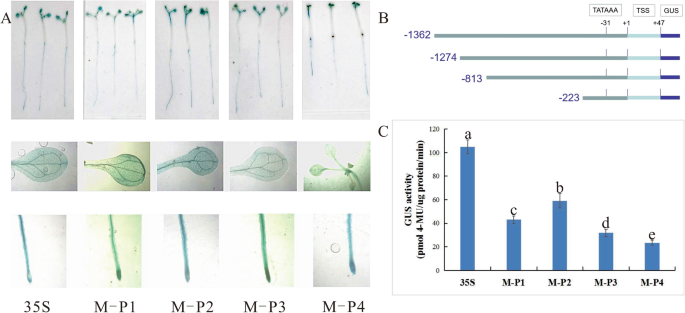
为了表征MaPIP1;1启动子中对干旱胁迫响应至关重要的序列,4个分别为1362 bp、1274 bp、813 bp、223 bp的启动子片段M-P1、M-P2、M-P3、M-P4被替换为pCAMBIA 1304载体的35S启动子拟南芥.对于每个缺失的启动子结构,至少建立三个独立的T3转基因拟南芥系,以确定启动子活性。GUS酶活性测定表明M-P1和M-P2活性高于M-P3和M-P4。M-P2的GUS活性最高可达60 pmol 4MU/μg protein/min,是对照的0.57倍,是M-P3和M-P4片段的1.88倍和2.22倍。2c). GUS染色结果与GUS酶活性一致,说明M-P1-M-P4均能驱动GUS表达,但在转基因中启动子活性不同拟南芥,我们可以清楚地观察到M-P2的根染色最深(图。2a).这些结果表明,M-P2(−1274 ~−1)是MaPIP1;1启动子的核心区域,它包含许多核心区域成分,以及一个CAAT-box和TATA-box。
干旱胁迫响应由MaPIP1;1启动子的四个缺失突变体介导拟南芥
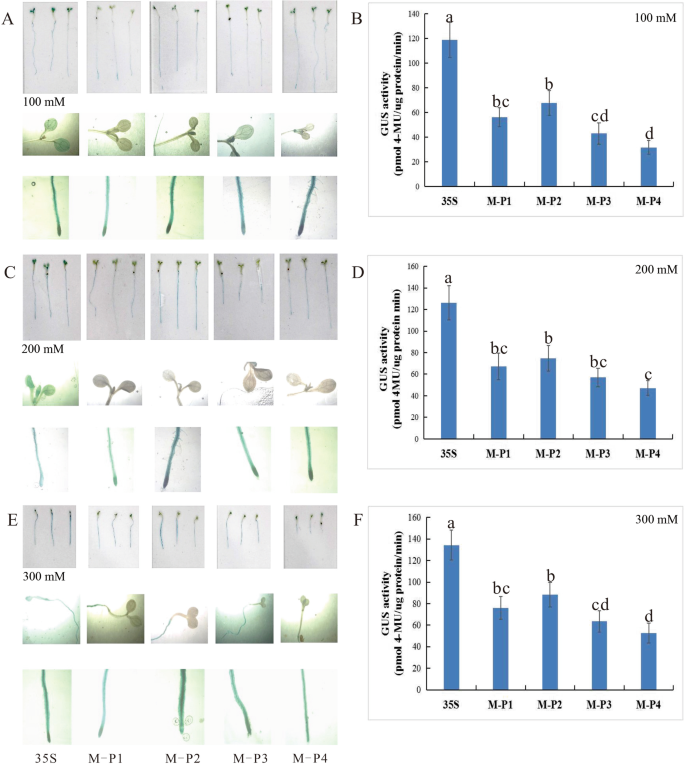
进一步研究转基因15日龄MaPIP1;1介导的干旱胁迫应答的调控机制拟南芥以缺失突变体或CaMV35S启动子转化的种子为对照,分别用100 mM、200 mM或300 mM甘露醇处理。GUS酶活性可以更准确地测定干旱胁迫下GUS表达的差异。与对照相比,M-P1-M-P4各片段GUS酶活性随甘露醇浓度的增加而增加。转M-P2基因的植株(- 1274 ~ - 1)具有更高的酶活性。在300 mM甘露醇处理下,M-P2的GUS酶活性为89 pmol 4MU/μg蛋白/min,是对照的1.48倍。这说明M-P2和M-P3之间可能存在与干旱胁迫相关的功能元件。转基因CaMV35S的酶活性拟南芥在各处理浓度下均稳定。在300 mM甘露醇条件下,M-P2与CaMV35S的比值高于0 mM甘露醇条件下,这表明M-P2(−1274比−1)可以驱动高水平的基因表达和干旱胁迫诱导(图2)。3.b, d, f).启动子引起的GUS染色分别从叶片和根中检测。在不同浓度的甘露醇处理下,M-P1-M-P4转基因植株叶片中的GUS染色不存在或微弱,而CaMV35S对照植株叶片中存在GUS染色。在转基因植物的根中,根尖区域颜色较深。与GUS酶活性结果相似,转基因拟南芥携带M-P2(编码−1274和−1之间的片段)的染色最强,而携带M-P3(编码−813到−1之间的片段)的染色较轻,其他片段的染色强度相似(图2)。3.A, c, e)。
蛋白质结合到干旱反应启动子区域
利用酵母单杂交方法验证M-P2含有MaPIP1;1启动子的核心区域,并研究MaPIP1;1在干旱胁迫中的调控分子机制。以M-P2为诱饵片段构建诱饵载体,在酵母中筛选经干旱处理的香蕉cDNA单杂交文库,鉴定与核心区序列相互作用的蛋白。
在3-氨基-1,2,4-三唑(3AT)筛选板上进一步测试菌落。变换子总数为7.46 × 105.共有29个菌落能不同程度地激活HIS3报告基因,并对其进行DNA测序和BLAST比对分析,得到23个不同的蛋白与MaPIP1;1启动子序列相互作用。23个阳性克隆均激活了HIS3报告基因(图2)。4D),携带β -淀粉酶(BMY)、酸性几丁质酶、果胶酸裂解酶2 (PL2)、中性神经酰胺酶、葡聚糖内-1,3-葡糖苷酶、v型质子atp酶亚基d2、萌发样蛋白、含KH结构域蛋白、热休克同源蛋白70 kDa、3 ' - n-去苯甲酰-2 ' -脱氧紫杉醇n-苯甲酰转移酶、微管蛋白α -3链、α -1,4葡聚糖磷酸化酶L同工酶、吡烷烷酮-羧酸肽酶、adp -核糖化因子、丙酮酸激酶、左旋二酮还原酶和MADS盒蛋白(MADS3)。
干旱胁迫诱导结合蛋白的qRT-PCR检测
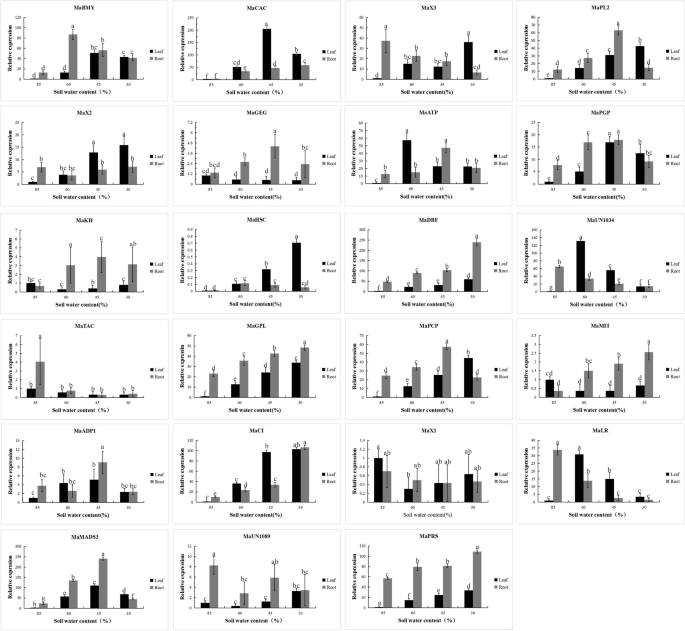
采用qRT-PCR技术,筛选了不同干旱胁迫条件下五叶香蕉苗和一心香蕉苗叶片和根系中23种结合蛋白的表达谱(图1)。5).叶片中MaBMY、macc、MaATP、MaPGP、MaADP1和MaMADS3 6个基因的表达量先升高后降低。MaX3、MaPL2、MaX2、MaHSC、MaDBF、MaGPL、MaPLP、MaCI、MaUN1089、MaPRS等10个基因表达量均呈上升趋势。MaGEG、MaTAC、MaX1 3个基因表达量下降,MaKH和MaMIT表达量无明显变化。在根系中,MaPL2、MaATP、MaPGP、MaPCP、MaADP1、MaMADS3、MaGEG、MaKH的表达先升高后降低。MaBMY、macc、MaDBF、MaGPL、MaCI、MaPRS、MaMI表达增加。其中MaX3、MaLR、MaUN1089、MaTAC表达量呈下降趋势,MaX2、MaHSC、MaX1表达量无明显变化趋势。我们重点研究了其中一种蛋白质,即转录因子MADS3,研究它对干旱胁迫下香蕉植物叶片和根中基因表达模式的影响。香蕉干旱处理下MaMADS3的表达模式与MaPIP1的表达模式一致;1. MADS3 expression was induced by drought stress. In leaves of banana plants exposed to drought stress in the form of 45% soil moisture, the MADS3 gene showed the highest expression, 369, in the leaves. In roots, MADS3 gene expression under the same conditions was similar to that seen for leaves and was 532. This result further demonstrates that the MADS3 transcription factor can cooperate with the MaPIP1;1 gene in response to drought stress in banana plants.
干旱胁迫下香蕉叶片和根系23个阳性无性系的表达分析。详情见表1.数据为均值±标准差n= 3个生物重复。同一字母表示的平均值在点上无显著差异P邓肯多重极差检验< 0.05
MaMADS3激活MaPIP1;1启动子
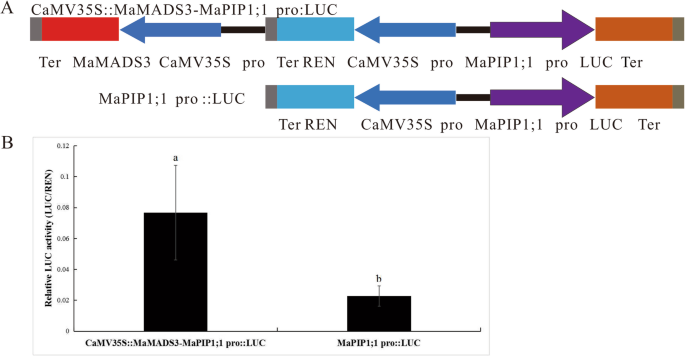
为了进一步证明MADS3与MaPIP1;1启动子区域结合,进行了双荧光素酶测定。将MaPIP1;1启动子M-P2片段克隆到报告载体pGreen II 0800载体pMaPIP1;1::LUC中,将MADS3的全长ORF克隆到效应载体pCAMBIA 1301载体中,生成35S::MADS3(图2)。6).将这两种构建物转化为GV3101农杆菌,在烟叶远侧浸润表达。pMaPIP1;1::LUC相对荧光素酶活性低于35S::MADS3-pMaPIP1;1::LUC,说明MADS3对香蕉MaPIP1;1的转录具有正向调控作用。
讨论
干旱等非生物胁迫已在全球范围内造成植物生产的重大损失[1].水是植物生产所必需的[2]而所有涉及水运输的过程,包括干旱调节、单细胞扩张和长距离运输,都需要水通过细胞膜的运动[3.].AQPs增强植物液泡和质膜的透水性[4],并在水平衡生理学和有效用水方面发挥重要作用[5,6,7,8,9,10].植物有大量的水通道蛋白同源物。质膜中AQPs的丰度和活性受到调控,以控制细胞内和细胞内外的水混合[15].PIP蛋白属于AQP家族,在多种植物跨质膜的水运输中起作用[6,7,8].许多PIP家族蛋白参与非生物应激反应[13].本研究结果表明,MaPIP1;1可以提高转基因拟南芥的植株抗旱性[22].
我们鉴定了MaPIP1;1启动子,以了解其在干旱胁迫响应中的功能。在干旱胁迫条件下对4个缺失突变体M-P1-M-P4的分析表明,在转录起始位点ATG上游携带−1274 -−1序列的M-P2是MaPIP1启动子的关键区域,该启动子介导对干旱胁迫的响应。GUS酶活性的瞬时测量拟南芥M-P2对干旱胁迫有充分的响应能力。PLACE和PlantCARE应用表明,在MaPIP1;1启动子中存在多个tata -box和一个CAAT-box。TATA盒是转录起始位点基因表达的核心启动子元件。CAAT-box是启动子中常见的顺式作用元件,具有增强子活性。而在MaPIP1;1启动子中未发现与干旱胁迫相关的响应元件。我们发现ABRE是脱落酸(ABA)的酸作用元件。有研究报道ABA是一种重要的植物激素,参与许多重要的生物过程和反应,包括非生物胁迫[41,42],因此我们推测MADS3可能通过结合MaPIP1;1启动子上的ABRE元件调控该基因的表达。或者M-P2区域可能包含未知的顺式作用元件,这些元件对于MaPIP1;1介导的干旱胁迫反应至关重要。尽管如此,在该启动子区域中发现的顺式作用元件和相互作用蛋白强调了MaPIP1;1在干旱胁迫响应中的潜在重要作用。
启动子在启动基因转录和调控基因表达方面具有重要的时间和空间意义。靶向基因及其启动子的基因修饰可用于提高作物性能[43].然而,转基因基因的过表达会导致能量代谢效率低下或形态和/或生理功能障碍,从而阻碍植物的生长发育[27,28,29,30.,31,32,33,34,35,36,37,38,39,40,41,42,43].因此,在特定的环境条件下,可诱导启动子可选择性地驱动目标基因的表达,以避免使用本构启动子可能产生的过度表达的负面影响[44,45,46,47].从无花果。2我们可以看到,除了对照的35S启动子,M-P2是四个片段中颜色最深的,GUS酶活性最高。这表明该启动子片段能够更好地应对干旱胁迫。之前的实验表明,MaPIP1;1基因可抵抗干旱胁迫[30.].这进一步验证了该片段可以促进到MaPIP1;1基因,更能抵抗干旱胁迫。一些植物在被胁迫诱导启动子转导后具有较强的抗逆性。例如,在转基因烟草中,玉米启动子ZmGAPP的截断219 bp片段(D8)可以在高盐条件或干旱胁迫下给予高水平的基因表达[48].在这里,我们使用缺失突变体鉴定了1274 bp (M-P2)片段作为MaPIP1的核心片段;1启动子,该启动子在突变体中具有最高的转录活性。在拟南芥在正常和干旱胁迫条件下,转基因M-P1-M-P4启动子的活性分别比对照CaMV35S启动子高57 - 84%。与CaMV35S相比,M-P2在胁迫条件下转基因植物中可能增强MaPIP1;1的表达。从香蕉单子叶中获得MaPIP1;1启动子片段,可用于香蕉抗旱性育种拟南芥(双子叶植物)。不同来源的启动子的转录活性和表达模式在双子叶和单子叶中也可能存在明显差异。在单子叶中,泛素启动子通常比CaMV35S更能驱动转基因表达[49,50,51,52,53,54].一些源自单子叶的泛素启动子不能指导双子叶的转基因表达。CaMV35S启动子在烟草原生质体中显示出超过10%的ubi1转录活性[51].然而,一些启动子通常在双子叶和单子叶中都表现出很强的转录活性。例如,一个0.3 kb的AtTCTP启动子在拟南芥(dicot)和匍匐bentgrass (monocot)中表现出较高的转录活性[55].进一步研究MaPIP1;1启动子在香蕉中的转录活性和表达模式,评价其在单子叶作物遗传改良中的应用前景也具有重要意义。
我们还利用外源香蕉源启动子调控拟南芥中的GUS表达,以证实M-P2在转基因拟南芥中具有高水平的表达。转基因中报告基因GUS的染色拟南芥干旱胁迫处理主要集中在根系(图;4A,C,E),这表明MaPIP1;1启动子可能具有根特异性启动子元件,尽管需要进一步的表征来证实这种可能性。这些结果为该启动子在根组织中指导基因表达奠定了基础。
虽然许多研究表明AQP基因的表达受到非生物胁迫的影响,但在植物中调控AQP表达的转录因子尚未见报道。在这里,我们进行了酵母单杂交(Y1H)筛选,并鉴定出23个蛋白可以作为MaPIP1;1表达的上游调控因子。qRT-PCR结果表明,每个基因的表达模式并不完全相同。虽然从图中可以看出,干旱胁迫下部分基因上调。然而,这些基因并不都在叶片和根中对干旱胁迫作出反应。在我们之前发表的论文中也提到了[30.], MaPIP1;1在叶和根中均有诱导。MaPIP1;1在土壤含水量为45%时表达量最高。因此,我们选择了与其表达模式一致的MADS3基因进行进一步研究。
MADS-BOX与植物对胁迫条件的反应有关。水稻OsMADS31基因在高盐条件下表达下调,并在水稻萌发过程中响应高盐胁迫[56].低温胁迫胁迫下,绵阳草LcMADS1和LcMADS2的表达显著升高,而NaCl胁迫下LcMADS9的表达显著上调[57].油菜中有13个BrMADS基因对低温胁迫有响应。此外,19个BrMADS基因对干旱和盐胁迫有响应[58].在这里,我们发现MaMADS3结合MaPIP1;1启动子来调节基因表达。然而,MaMADS3是否调控MaPIP1;1基因在香蕉体内的表达尚不清楚。因此,有必要进一步研究香蕉中MaMADS3与MaPIP1;1的关系,以充分阐明MaPIP1;1在干旱胁迫下表达的复杂调控机制。
结论
综上所述,从香蕉基因组中分离出MaPIP1;1翻译起始位点上游1362 bp。4个片段M-P1、M-P2、M-P3和M-P4分别转化为拟南芥,对干旱处理反应良好。在所有转基因拟南芥组织中,M-P2(−1274 bp ~−1)的转录活性最高,说明M-P2包含pMaPIP1的核心区域;以M-P2为酵母单杂交饵料,筛选出23个与MaPIP1;1互作的不同转录因子或基因。转录因子MADS3正向调控MaPIP1;1的转录,进一步采用双荧光素酶法进行体外相互作用检测。结果表明,MaPIP1;1介导了香蕉干旱响应相关的分子机制,这将加深我们对AQP基因表达调控模式的理解。
方法
MaPIP1;1启动子序列的分离
MaPIP1;1的ATG起始密码子来源于香蕉A基因组网站(http://banana-genome.cirad.fr/(Nature, 2012, 488: 213-217)。通过筛选pMaPIP1引物,从香蕉基因组DNA中扩增出该序列;1(表1)并经测序证实。最后,利用PZ1引物,通过聚合酶链式反应(PCR)扩增得到MaPIP1;1转录起始位点(TSS)上游1362 bp的片段1),被认为是全长启动子。
启动子序列的生物信息学分析
1362 bp的MaPIP1;1启动子顺式作用元件用PLACE (http://www.dna.affrc.go.jp/PLACE/signalup.html)及PlantCARE (http://bioinformatics.psb.ugent.be/
/ webtools plantcare / html)。给出了活性组分的分析和定位。
启动子的构建:GUS融合质粒
用相应的引物扩增了4个不同大小的5 '端缺失片段(M-P1 - M-P4)(−1362、−1334、−813、−223至−1 bp)(表1)1), PCR产物克隆至BamHI/EcoRI酶切的pCAMBIA 1304载体(Cambia, Australia)。酶切分析和测序验证了该结构。得到的结构被用于稳定的转化拟南芥(哥伦比亚),从CATAS BiyuXu实验室获得。YiXu已经进行了正式的身份认证。使用含有CaMV35S启动子的pCAMBIA1304载体作为阳性对照。
拟南芥培养与遗传转化
将pCAMBIA1304载体和携带M-P1-M-P4启动子的载体转化为农杆菌,在含Kan和Rif抗生素的YEB培养基中28℃摇培养10 h,加入拟南芥转基因浸润液(1/2 MS, 50 g/L)。拟南芥在蔗糖中倒置接种到菌液中,采用花序浸渍法进行转化。干燥的种子在75%乙醇+ 0.02% Triton X-100溶液中浸泡10分钟。去除乙醇,清洗2-3次,吹至无菌滤纸上风干后,铺于选择培养基(1/2MS, 1.5%蔗糖,0.7%阿格拉,25 μg/mL潮霉素B)上,4℃暗箱培养3 d后移至培养室,23℃生长。10天后,正常生长的幼苗被移植。在花蕾中,计算T1代能正常生长的幼苗和致死苗的比例。将T2代种子按3:1的比例移栽到培养基中,驯化一周后,每5天以适量1/2TM拟南芥营养液浇灌。当种子发芽后,收获T2代进行后续实验分析。
干旱处理
对拟南芥幼苗进行了干旱胁迫分析。为了进行干旱胁迫分析,将4日龄的CaMV35S启动子转基因植株和M-P1-M-P4转基因植株移栽到添加100-300 mM甘露醇的MS培养基上15天。分别进行GUS染色、GUS酶活性测定和拍照。
为了确定香蕉植物的干旱胁迫,根据先前描述的程序(tts -1, TOP, Zhejiang, China)测量土壤含水量,并从土壤中生长的香蕉幼苗中除去水分。Hsiao(1973)概述了与不同应力水平相关的土壤水分含量[59].在指定的时间取样。
GUS酶活性的组织化学和荧光测定
新鲜样品(小植物)置于X-Gluc溶液中(GBT, St. Louis, USA) [60]用于组织化学。将组织置于含50 mM磷酸钠(pH 7.0)、0.5 mM铁氰化钾、0.5 mM亚铁氰化钾、10 mM EDTA、0.1% Triton X-100和1 mM X-Gluc的GUS染色液中,然后将D1-D3和D4-D9片段在37℃孵育24 h。用4-甲基伞形基葡萄糖苷荧光法测定GUS酶活性。
总RNA的分离及其定量分析
从干旱处理的五叶香蕉苗和一心香蕉苗中提取总RNA。RNA (1 μg)用Superscript III逆转录酶系统制备cDNA。根据PrimeScript first-strand cDNA synthesis kit (Takara)说明书,将cDNA稀释6倍,每次反应以1.5 μL为模板。采用RT-qPCR方法进行表达分析。结果数据用ACTIN2归一化,并计算相对于各自对照的表达水平的折叠变化。
统计分析
采用SAS 9.2统计软件进行t检验、方差分析和卡方检验,检验均数间是否有显著性差异(P < 0.05)。每个试验设3个重复。
酵母单杂交(Y1H)筛选
Y1H筛选使用Matchmaker Gold One混合文库筛选系统(Clontech, Cat。630304号)。该诱饵序列被克隆到pAbAi pHIS2载体中,赋予了对3AT(一种用作酵母选择标记的环肽抗生素)的耐药性。然后将得到的pHIS2-Bait结构线性化,并通过同源重组整合到Y1HGold酵母的基因组中,生成诱饵特异性报告菌株。测定了诱饵特异性报告菌株对3AT的最低抑制浓度。以含诱饵质粒的Y187酵母转化子为受体制备活性细胞。将文库质粒pGADT7转入其中,在选择介质SD-Trp-Leu和SD-Trp-Leu- his + 50 mM 3AT上进行筛选。用无菌水稀释在选择培养基SD-Trp-Leu上培养的阳性菌落,并将菌落斑点到SD-Trp-Leu、SD-Trp-Leu- his + 100 mM 3AT和SD-Trp-Leu- his + 150 mM 3AT缺失板上,在30℃下培养3-4天。然后筛选阳性克隆进行质粒提取和测序。
双荧光素酶测定
双荧光素酶测定方法由[61].本研究中,LUC和REN均来源于pGreen II 0800-LUC。PCR得到的MaPIP1;1启动子与SpeI酶切的LUC连接,生成MaPIP1;1 pro::LUC。MaMADS3 CDS在SalI消化后与CaMV35启动子融合,并与MaPIP1;1 pro::LUC连接,生成CaMV35S::MaMADS3-MaPIP1;1 pro::LUC。两个构造都被引入农应变BLA4404。当OD600达到0.6 ~ 1.0时,培养物向烟叶远侧浸润。培养3天后从感染区提取总蛋白。根据制造商说明书(Promega,美国),使用双荧光素酶报告分析系统测量LUC和REN的荧光值。LUC值归一化为REN值。考虑到试验的敏感性,每次试验采用16个重复,保留8-10个重复进行分析。
数据和材料的可用性
在这项研究中产生或分析的所有数据都包括在这篇发表的文章及其补充信息文件中。
缩写
- 阿坝:
-
Aureobasidin一
- 惩罚:
-
甲基jasmonate
- AQP:
-
水通道蛋白
- 阿坝:
-
脱落酸
参考文献
- 1.
穆勒,北达科他州,嘉宝,刘昌明,约翰斯顿,M,光线,D.K Ramankutty, N.Foley, j通过营养和水管理缩小产量差距。Nature.2012, 490254 - 257。
- 2.
波伊尔,j.sPlant productivity and environment. Science.1982,218,443–448.
- 3.
P.K Agarwal,舒克拉,防晒,Gupta, K, Jha B。Bioengineering for salinity tolerance in plants: state of the art. Mol Biotechnol2013,54,102–123.
- 4.
Golldack, D。李,C。莫汉,H。,Probst,NTolerance to drought and salt stress in plants: unraveling the signaling networks前沿植物科学2014年,5151年。
- 5.
考尔,C。库马尔,G。,考尔,年代,安萨里,分子量,Pareek, A。,Sopory”栏目,et al. Molecular cloning and characterization of salt overly sensitive gene promoter from Brassica juncea (BjSOS2). Mol Biol Rep2015,42,1139–1148.
- 6.
Pedram,科里,L。R。,Navin R.,Influence of extreme weather disasters on global crop production.自然.2016, 529, 84 - 87。
- 7.
Schulze他,E, E。植物水分在细胞、组织和器官水平的调节:活性过程和隔室的作用,见:E.D.舒尔茨(编),生物系统中的通量控制:从酶到种群和生态系统,学术出版社,圣地亚哥,1994年,第237-299页。
- 8.
赵,C.X邵,宋,楚,L.Y.水通道蛋白structure-function relationships: water flow through plant livingcells, ColloidSurf.B-Biointerfaces。2008年,62163 - 172。
- 9.
Maurel C。水通道蛋白s and water permeability of plant membranes, Annu.Rev植物物理物质植物摩尔生物学1997年,48399 - 429。
- 10.
Siefritz, F。,批,M.T Lovisolo, C,舒伯特,A。,Kaldenhoff, R。PIP1 plasma membrane aquaporins in tobacco:from cellular effects to function in plants. Plant Cell2002,14,869–876.
- 11.
Tyerman,南达科他州Niemietz、C。绿色大苹果,H。Plant aquaporins: multifunctional water and solute channels with expanding roles. Plant Cell Environ2002,25,173–194.
- 12.
莫里隆Martre, P,(保护)监督小组,Barrieu, F。,北,G.B。诺贝尔,防晒,Chrispeels, M.J.Plasma membrane aquaporins play a significant role during recovery from water deficit. Plant Physiol2002,130,2101–2110.
- 13.
Maurel C。Plant aquaporins: novel functions and regulation properties. FEBS Lett2007,581,2227–2236.
- 14.
Shahak Aharon, R, Y。,取胜,年代,Bendov, R, Kapulnik, Y。,Galili G。转基因烟草过表达一种质膜水通道蛋白可以在良好的生长条件下提高植株活力,但在干旱或盐胁迫下则没有效果。植物Cell2003, 15439 - 447。
- 15.
Veronika, N。,而且Susanna T. H .Phosphorylation-Dependent Regulation of Mammalian Aquaporins细胞2019, 8,82。
- 16.
康纳。AC, Bill RM, Conner MT.关于水通道蛋白易位作为调节机制的新共识。生物化学学报。2013;30:101-12。
- 17.
克瑞达S,苏珊娜TH。水通道蛋白选择性和调控的结构洞见。中国生物医学杂志,2015;33:126-34。
- 18.
Maurel C。植物水通道蛋白的新功能与调控特性。中国农业大学学报,2007,581,2227-2236。
- 19.
绿色大苹果,H。,Turner,D.W., Tyerman,S.D., Turner NC. Water fow in the roots of crop species: the infuence of root structure, aquaporin activity, and water logging. Adv Agron 2007,96,133–196.
- 20.
戈麦斯,D。,一个gasse,A., Thiebaud,P., Delrot,S., Geros,H., Chaumon,F Aquaporins are multifunctional water and solute transporters highly divergent in living organisms生物化学生物物理学报2009, 1788, 1213 - 1228。
- 21.
Zwiazek, J.J.棕褐色,X。徐,H。,Navarro-Ródenas,A., Morte,A. Functional signif cance of oxygen transport through aquaporinsSci代表2017年,17日,40411年。
- 22.
Xu.Y胡,W。刘,J.H,歌曲,Sh,侯,X.W,贾,刘昀,Li J.Y,苗族,H.X, Wang Zh型,领带,砂石,徐,B.Y,金,Zh.Q.An水通道蛋白基因MaPIP2-7参与转基因香蕉抗旱、抗寒和耐盐胁迫(穆萨acuminatal .)。植物生理生化.2020, 147, 66 - 76。
- 23.
阿萨,H。Rabbia T, Ghulam,穆斯塔法,穆罕默德,F。,伊姆兰,一个舍希德,M。水通道蛋白的比较系统发育分析提供了植物中基因家族的扩展和进化及其在耐旱和易感鹰嘴豆品种中的作用。基因组学,2020,112,263 - 275。
- 24.
高,Z。,X。,赵,B。,et al. Overexpressing a putative aquaporin gene from wheat, TaNIP,enhances salt tolerance in transgenic Arabidopsis. Plant Cell Physiol.2010,51,767–775.
- 25.
Kapilan, R。Vazir, M。,Zwiazek, J.J.,Regulation of aquaporins in plants under stress. Biol Res 2018,51,4.
- 26.
胡、W。元,问王,Y。等。小麦水通道蛋白基因TaAQP8的过表达增强了转基因烟草的盐胁迫耐受性。中国生物医学工程学报,2012,29(4):344 - 344。
- 27.
周,年代,W,邓,X。小麦水通道蛋白基因TaAQP7的过表达增强了转基因烟草的耐旱性。PLoS One。2012、7、12:e52439。
- 28.
徐,刘昀Wang,周,L。等。小麦水通道蛋白基因TaTIP2;2的异源表达降低了小麦的非生物胁迫耐受力拟南芥.PLoS One。2013、8、11:e79618。
- 29.
Shekhawat Sreedharan,年代,英国Ganapathi,顶替过表达天然质膜水通道蛋白MusaPIP1;2的转基因香蕉植株对不同的非生物胁迫表现出较高的耐受力。中国生物工程学报,2013,29(1):54 - 56。
- 30.
徐,Y。,胡、W。Liu J.H,张,有机,贾,刘昀,苗族,H.X.Xu,金,Zh.Q B.Y。一个b一个n一个n一个一个quaporin gene, MaPIP1;1, is involved in tolerance to drought and salt stresses.BMC植物生物学。2014年,14日,59岁。
- 31.
艾哈迈德,P。普拉萨德,M.N.V.植物的非生物胁迫反应:代谢、生产力和可持续性。施普林格纽约多德雷赫特海德堡伦敦。2012年,473 p。
- 32.
艾哈迈德,P。普拉萨德,M.N.V.气候变化时代植物的环境适应与胁迫耐受性。施普林格纽约多德雷赫特海德堡伦敦。2012 b、715 p。
- 33.
我。,Mitsuhara Ugaki, M, Hirochika, H, Ohshima, M,村上,T。,后藤Y。等。双子叶和单子叶植物中增强外源基因表达的有效启动子盒。植物细胞物理学报,1996,37,49-59。
- 34.
Ptashne, M。转录调控:从lambda到真核生物。生物化学学报,2004,27(3):379 - 379。
- 35.
韦娜,N。Weiste C, andDroge-Laser, W。拟南芥转录因子分子筛选工具研究。Front.PlantSci。2011年,68。
- 36.
Sinha N.R,威廉姆斯,右眼,andHake, S。玉米homeo box基因的过度表达,打结- i,导致从确定到不确定的细胞命运的转换。GeneDev。1993年,7787 - 795。
- 37.
H.J B.Y千,金正日,哦,K.H,铁路,南卡罗来纳州,安,J.H,崔成员j.w.,等等。人促红细胞生成素(EPO)过表达影响植物形态:烟草营养生长迟缓,烟草和拟南芥雄性不育。TransgenicRes。2004年,541 - 549。
- 38.
任,赵,J。W。,智,D, Wang andXia G L。一个rabidopsis DREB1A/CBF3 bestowed transgenic tall fescue increased tolerance to drought stress.PlantCellRep。2007年,26岁,1521 - 1528。
- 39.
andShinozaki Shinozaki, Y。,K。拟南芥干湿反应29基因在转基因植株中的表达及其启动子分析。Mol.Gen。Genet.1993, 236, 331 - 340。
- 40.
Sardaro Tavakol, E,马丁,Shariati,丰富多彩,罗西尼,L, andPorceddu E。启动子一个n一个lysis and expression profile of in response to drought stress in wheat ancestors. Gene.2014,549, 24–32.
- 41.
马里卡,一个戴尔芬,M,丹尼斯,F。,jean - luc, V, Aurore, V,伊曼纽尔,G。,哈立德,M。,Functional analysis of the durum wheat gene TdPIP2;1 and its promoter region in response to abiotic stress in rice植物生理学Biochemistry.2014, 79, 98 - 108。
- 42.
张,H,侯,J。,江,P,气,年代,徐,C。,他问,叮,Z。,Z。李、张、K。K。玉米磷脂酰肌醇合成酶基因(ZmPIS)启动子的鉴定,该启动子在转基因烟草中具有较高的基因表达和盐胁迫或渗透胁迫诱导能力。前沿植物科学2016,7。
- 43.
Cucchiarini Potenza L, L, Piatti, E, Angelini, U,别墅,M。强静磁场暴露对不同dna的影响。Bioelectromagnetics。2004年,25352 - 355。
- 44.
卖艺,P.K.,P一个gès,M.Regulation of abscisic acid-induced transcription. Plant Mol Biol1998,37(3):425–435.
- 45.
谢长廷、T.H。李,j.t., Charng, Y.Y Chan MT。异位表达拟南芥CBF1的番茄植株对水分亏缺胁迫的抗性增强。植物科学学报,2002,26(4):344 - 344。
- 46.
侯,J。,江、P。气,年代,张K。,他问徐,C。et al。从玉米ii型H+−焦磷酸酶基因中分离出盐度和渗透胁迫诱导启动子,并在转基因烟草植株中进行缺失分析。PLoS ONE。2016, 1.1,4: e0154041。
- 47.
Zavallo, D。毕尔巴鄂,马丁,老板霍普,H.E,亨氏,R。向日葵两种新型种子特异性启动子的分离及功能鉴定(向日葵l .)。植物细胞代表2010年,29239 - 248。
- 48.
李,j.t. Prasad, V,杨,p,Wu JF, David Ho TH, Charng YY, et al. Expression of Arabidopsis CBF1 regulated by an ABA/stress inducible promoter in transgenic tomato confers stress tolerance without affecting yield.植物细胞环境。2003年,26日:1181 - 1190。
- 49.
Christensen AH, Sharrock RA, Quail PH.玉米多素基因:结构,表达和转录本剪接的热扰动,以及电穿孔转移到原生质体后的启动子活性。植物化学学报。1992;18:675-89。
- 50.
科内乔MJ,卢思D,布兰肯希普KM,安德森OD,布莱彻AE。转基因水稻中玉米泛素启动子的活性。植物MolBiol。1993; 23:567 - 81。
- 51.
Schledzewski K, Mendel RR。瞬时基因定量表达:玉米多泛素1、水稻动素1、玉米源emu和CaMV 35S启动子在大麦、玉米和烟草细胞中的比较转基因Res. 1994; 3:49 - 55。
- 52.
张志刚,张志刚。剑兰多泛素启动子的表达。植物细胞学报,2006;
- 53.
卡莫K,金艾,朴实,郑永华。剑兰多泛素启动子GUBQ1的5 utr -插入子提高了剑兰和拟南芥的翻译效率。BMC植物生物学。2012;12:79。
- 54.
陶玉斌,何丽丽,牛立军,徐泽峰。麻疯树泛素延伸蛋白基因(JcUEP)启动子的分离与鉴定足底。2015;241:823-36。
- 55.
韩玉杰,金玉敏,黄玉杰,金智。拟南芥翻译控制肿瘤蛋白(AtTCTP)基因中一个用于植物转化的小启动子的研究。植物细胞,2015;34:265-75。
- 56.
赵,Yu J。W。,,W.He,问,尹,M.Y,李,法国专利,崔,B。,Heo,后代e.b., Kim K.W,公园,Y.J.一项全基因组关联研究揭示水稻耐盐相关候选基因(栽培稻)在萌芽阶段。Int J MolSci。2018、12、19(10)。
- 57.
P .贾,赵,Cheng L。元,G。,杨,W,刘,年代,陈,年代,气,D,刘、李,X - G。羊草MADS-box家族基因及其在非生物胁迫响应中的参与。BMC植物生物学。2018年,14日,18(1):42。
- 58.
萨哈,G。,公园,J.I荣格,H.J, Ahmed N.U, Kayum,硕士,钟,M.Y,户珥,Y。,赵,Y.G,渡边,努美阿,安全火花型与植物器官发育和胁迫抵抗相关的MADS-box家族基因的全基因组鉴定和特征芸苔属植物拉伯.BMC基因组学。2015年,14;16:178。
- 59.
植物对水分胁迫的反应。植物学报。2003,24(4):519 - 570。
- 60.
Jefferson RA, Kavanagh TA, Bevan MW。GUS融合:葡糖苷酸酶是高等植物中敏感和多功能性的基因融合标记。Embo j . 1987; 6:3901-7。
- 61.
赫楞R.P,艾伦,A, C, Frie, E.N, Bolitho, K,格拉夫顿,K,邓普顿,医学博士,Karunairetnam, S。Gleave,美国专利,莱恩,西澳功能基因组学的瞬时表达载体,启动子活性定量和植物RNA沉默。植物的方法。2005年,18岁,一13。
确认
不适用。
资金
本文得到了中国热带农业科学院中央公益性科研事业单位基础研究基金(No.1630092020002)、国家自然科学基金(31501371)、中国农业科研系统专项基金(cars -31-02,03)的资助。资助者在实验设计、数据收集和分析或撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
SS和JL构思了这项研究。YX设计了实验并撰写了手稿。ZJ、BX、YL、AW、WH、DH、QW、ZX进行实验并进行分析。所有作者阅读并批准了最终稿。所有作者均已阅读并批准稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1表S1。
本研究采用了启动子的聚合酶链式反应(PCR)引物。
附加文件2表S2。
自激活试验(A)诱饵的自激活试验(a.b.c)对诱饵载体的自激活抑制分别增加0 mM、25 mM、50 mM 3AT。f,Positive control, pGAD53m + p53HIS.(g.h.i) Negative control,pGAD53m + pHIS2.(B) The library screening efficiency.(a.b.c) The dilution of 10,100,1000 multiples respectively
附加文件3表S3。
23蛋白与MaPIP1结合;
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
徐,杨,金,Z,徐,B。et al。鉴定与MaPIP1启动子相互作用的转录因子,该启动子在转基因中具有高水平的基因表达和干旱胁迫诱导能力拟南芥.BMC植物生物学20.278(2020)。https://doi.org/10.1186/s12870-020-02472-7
收到了:
接受:
发表:
关键字
- 水通道蛋白
- 启动子
- Droutht压力
- 5 '删除
- 香蕉
- 转录因子