- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发布:gydF4y2Ba
转录因子TabhlH49积极调节脱氢gydF4y2BaWZY2.gydF4y2Ba基因表达增强小麦抗旱性gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba, 文章编号:gydF4y2Ba259.gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
脱氢酶是一种功能性蛋白质,在许多成熟的种子和逆境条件下的蔬菜组织中都有发现。然而,脱醇蛋白表达的调控机制尚不清楚。gydF4y2Ba
结果gydF4y2Ba
在该研究中,通过使用酵母单杂交系统,从用干旱和冷应力处理的小麦cDNA文库中分离出一种新的干旱胁迫相关的BHLH转录因子突发胁迫相关的BHLH转录因子。TabhlH49蛋白质具有典型的保守的BHLH结构域,是一种Myc型BHLH转录因子。在烟草表皮细胞核中检测到塔布H149,并且C-末端(氨基酸323-362)的氨基酸序列对于其转移活性是必需的。实时PCR分析显示组织特异性表达和干旱胁迫响应性表达gydF4y2BaTabHLH49gydF4y2Ba在小麦。另外,在Y1H和电泳迁移率变动分析的验证说明的是TabHLH49蛋白能够结合并相互作用与小麦的启动子gydF4y2BaWZY2.gydF4y2Badehydrin。双荧光素酶检测结果显示,TabHLH49能正向调节WZY2脱氢酶的表达。TabHLH49的瞬时表达和bsmv介导的基因沉默也表明,TabHLH49正调控WZY2脱氢酶的表达,提高了小麦的抗旱性。gydF4y2Ba
结论gydF4y2Ba
这些结果提供了直接证据表明突布49正常调节脱氢酶的表达水平gydF4y2BaWZY2.gydF4y2Ba基因改良小麦抗旱性。gydF4y2Ba
背景gydF4y2Ba
小麦作为一种重要的粮食作物,在我国北方大部分地区广泛种植。然而,植物在生长发育过程中通常会遭受干旱、冷害或盐害等不同类型的非生物胁迫,这些胁迫直接影响小麦的整体产量。gydF4y2Ba
作为固着生物,植物已经进化到合成了一系列应激反应蛋白,以避免或抵御不利条件的能力。胚胎发育晚期丰富(LEA)蛋白质在帮助保护细胞免受脱水直接作为功能性蛋白。基于他们的保守序列基序中,LEA蛋白已经被划分成七个独特群体[gydF4y2Ba1gydF4y2Ba].第2类LEA蛋白,又称脱水蛋白,具有高度亲水性。它们被认为是亲水性的,包含3个典型的保守基序:K-(EKKGIMDKIKEKLPG), Y-([V/T]D [E/Q]YGNP)和S-(丝氨酸轨道)片段。根据这些保守序列(K-、Y-和s -片段)的存在,将脱醇分为不同的亚类:YnKn、YnSKn、KnS、SKn和Kn [gydF4y2Ba2gydF4y2Ba].小麦脱水gydF4y2BaWZY2.gydF4y2Ba调查在目前的研究是一个YSK2型脱水属于YnSKn亚型[gydF4y2Ba3.gydF4y2Ba].gydF4y2Ba
基本的螺旋 - 环 - 螺旋(bHLH)蛋白质是家族的第二大植物转录因子,可以在激素信号,光形态建成和次生代谢中起重要作用。由于其保守的基本螺旋环 - 螺旋结构域,该系列是众所周知的,其由两个功能区,基本氨基酸区和位于N-末端和C末端的螺旋环 - 螺旋区(HLH)组成分别的BHLH域。碱性氨基酸区含有可以识别和特异性结合靶基因中的DNA基序的基本残基[gydF4y2Ba4gydF4y2Ba].螺旋环螺旋区域由具有可变长度和氨基酸组成的环路连接的两个两亲性α螺旋组成,其可以促进同杂体或异二聚体以控制基因转录[gydF4y2Ba5gydF4y2Ba].gydF4y2Ba
根据前人对bHLH蛋白的研究,这些植物转录因子广泛参与调控植物的生理代谢途径。bHLH在花药发育的调控网络中起着重要的生物学作用gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].此外,bHLHs还参与了植物对干旱、盐度和低温非生物胁迫的响应。AtbHLH112是由盐、干旱和脱落酸(ABA)诱导的核定位蛋白,编码bHLH蛋白。AtbHLH112作为转录激活剂,通过与基因的GCG或e -box结合调节基因的表达,介导生理反应,包括脯氨酸生物合成和ROS清除途径,以增强耐受性[gydF4y2Ba8gydF4y2Ba].此外,来自的BHLH基因THBHLH1gydF4y2Ba甘蒙柽柳hispidagydF4y2Ba可以通过提高渗透势和减少活性氧积累来提高非生物胁迫耐受性[gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
许多以前的研究包括我们的研究,已经表明,小麦在非生物胁迫下合成脱氢。然而,迄今为止脱水的上游调节机制和功能仍然尚不清楚。在这项研究中,我们进一步探索了应力响应机制gydF4y2BaWZY2.gydF4y2Ba(UNIPROT ID:B0LXL4)脱氢基于我们克隆的启动子gydF4y2BaWZY2.gydF4y2Ba来自小麦“gydF4y2Ba郑寅1#gydF4y2Ba“在水的压力。gydF4y2BaTabHLH49gydF4y2Ba(UNIPROT ID:A0A3B6RCI9)被隔离并在通过使用酵母单杂交系统用干旱和冷应力处理的小麦cDNA文库中鉴定。TabhlH49蛋白质编码一个基本的螺旋环 - 螺旋(BHLH)转录因子,其作为正调节器gydF4y2BaWZY2.gydF4y2Badehydrin基因表达。这是第一次详细报道bHLH参与非生物胁迫下的脱水调节机制,并阐明了其在非生物胁迫下的作用gydF4y2BaWZY2.gydF4y2Badehydrin信号通路。gydF4y2Ba
结果gydF4y2Ba
TabhlH49和生物信息学分析的表征gydF4y2Ba
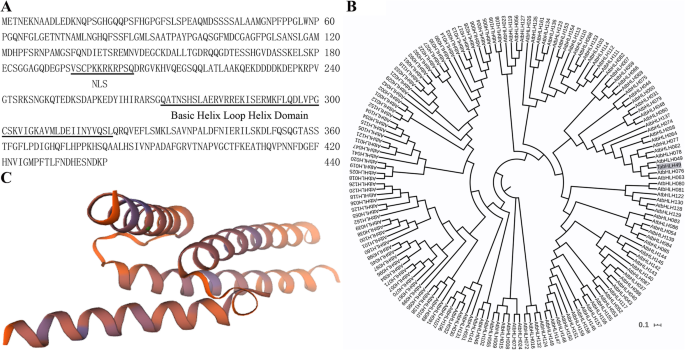
在我们以前的研究中,我们分离bHLH49样蛋白与脱水相互作用的cDNA片段gydF4y2BaWZY2.gydF4y2Ba由酵母单杂交(Y1H)测定进行的启动子[gydF4y2Ba10gydF4y2Ba],通过BLAST搜索小麦基因组数据库获得完整的编码序列,将该基因命名为TabHLH49。TabHLH49编码440个氨基酸,预测蛋白分子量为47.54 kDa,等电点为5.61(图)。gydF4y2Ba1gydF4y2Ba一种)。该基因含有保守的bHLH域,属于bHLH转录因子家族。TabHLH49的三维结构通过SWISS-MODLE软件(图构成。gydF4y2Ba1gydF4y2Bac).利用TabHLH49和162 bHLH基因序列构建系统发育树gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Bab).结果表明,TabHLH49与AtbHLH049高度同源,是myc型bHLH转录因子。gydF4y2Ba
核本地化和TabHLH49的激活能力gydF4y2Ba
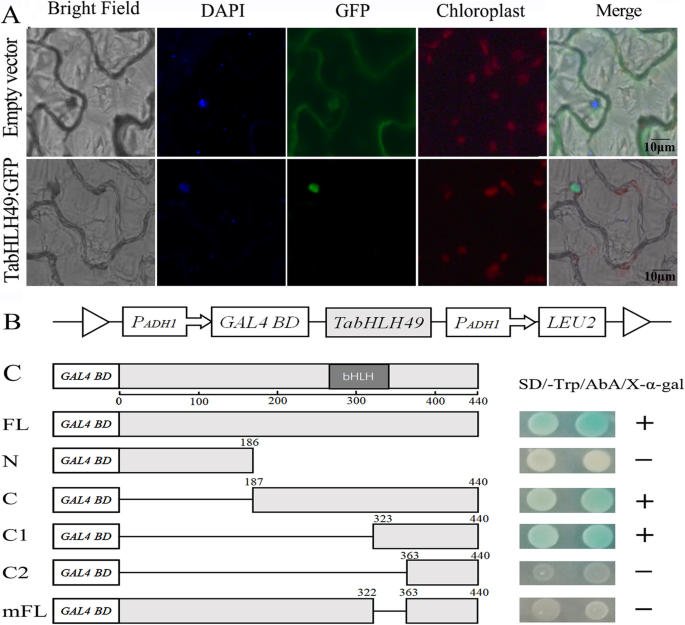
根据ProtComp预测算法,核定位信号'VSCPKKRKRPSQ'存在于塔布49的氨基酸序列中(图。gydF4y2Ba1gydF4y2Baa).因此,TabHLH49可能是一个核定位蛋白。为了验证这一推理,我们通过35S启动子控制下的TabHLH49- gfp共表达来观察TabHLH49的亚细胞定位。重组载体被转化为gydF4y2Ba农杆菌肿瘤术gydF4y2Ba菌株GV3101渗入烟草叶片。用35s转化的GV3101细胞:将GFP载体浸润到烟草叶中作为对照。结果表明,TabhlH49的绿色荧光仅在烟草表皮细胞的核中仅在烟草表皮细胞的核中,而空对照均匀地分布在整个烟草细胞中(图。gydF4y2Ba2gydF4y2Baa).这表明TabHLH49特异性定位于细胞核。gydF4y2Ba
亚细胞定位(gydF4y2Ba一个gydF4y2Ba)及反式活化试验(gydF4y2BabgydF4y2Ba和gydF4y2BacgydF4y2Ba)TabhlH49蛋白质。gydF4y2Ba一个gydF4y2BaTabHLH49在烟草表皮细胞中的亚细胞定位。GFP和TabHLH49:GFP在CaMV35S启动子控制下分别在烟草表皮细胞中瞬时表达。比例尺= 10 μm。gydF4y2BabgydF4y2Ba该pGBKT7中构建,在酵母中表达不同截短TabHLH49蛋白质的示意图。gydF4y2BacgydF4y2Ba完整或截断的TabHLH49的反式激活活性。将GAL4 dna结合域和TabHLH49不同部分的融合蛋白转化到Y2H Gold细胞中,并在SD/−Trp/X-α-gal/AbA板上生长,以评估其反式激活活性gydF4y2Ba
在Y2H金酵母细胞中测定蛋白蛋白的反式激活活性。当不存在C-末端(氨基酸323-362)时,不能激活报告基因的表达,表明C-末端(氨基酸323-362)的氨基酸序列是用于反式激活活性所必需的禁忌49(图。gydF4y2Ba2gydF4y2Bac)。gydF4y2Ba
表达模式分析gydF4y2BaTabHLH49gydF4y2Ba和gydF4y2BaWZY2.gydF4y2Ba在小麦gydF4y2Ba
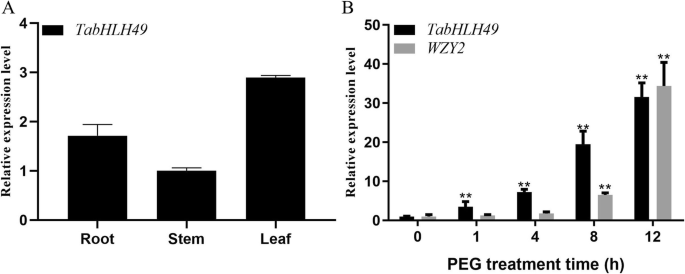
Real-time PCR检测表达gydF4y2BaTabHLH49gydF4y2Ba在小麦的不同组织中(图。gydF4y2Ba3.gydF4y2Ba结果表明gydF4y2BaTabHLH49gydF4y2Ba在2周龄幼苗的根,茎和叶子中表达。表达gydF4y2BaTabHLH49gydF4y2Ba与茎相比,根(1.71倍)和叶(2.89倍)积累较多。gydF4y2Ba
的表达模式gydF4y2BaTabHLH49gydF4y2Ba和gydF4y2BaWZY2.gydF4y2Bareal-time PCR检测。gydF4y2Ba一个gydF4y2Ba实时PCR来分析的表达水平gydF4y2BaTabHLH49gydF4y2Ba在不同的组织中。gydF4y2BabgydF4y2Ba表达式gydF4y2BaTabHLH49gydF4y2Ba和gydF4y2BaWZY2.gydF4y2Ba基因响应于20%PEG 6000治疗。数值为三个样本的均值±SD,显著性差异为gydF4y2BapgydF4y2Ba < 0.05 (*) andpgydF4y2Ba< 0.01 (* *)gydF4y2Ba
我们之前的研究表明gydF4y2BaWZY2.gydF4y2Ba在小麦苗期叶片中含量最高[gydF4y2Ba11gydF4y2Ba].因此,我们选择小麦幼苗叶片来研究其表达水平gydF4y2BaTabHLH49gydF4y2Ba和gydF4y2BaWZY2.gydF4y2Ba在PEG处理后在不同的时间点(0,1,4,8和12h)(图。gydF4y2Ba3.gydF4y2Bab). Real-time PCR结果显示gydF4y2BaTabHLH49gydF4y2Ba在1-12 h明显增加,在12 h达到最高点,约为0 h的31.6倍。有趣的是gydF4y2BaWZY2.gydF4y2Ba显示出类似的趋势gydF4y2BaTabHLH49gydF4y2Ba但落后gydF4y2BaTabHLH49gydF4y2Ba.这些结果表明,TabhlH49可以积极调节表达式gydF4y2BaWZY2.gydF4y2Ba.gydF4y2Ba
TabHLH49是的上游调节剂gydF4y2BaWZY2.gydF4y2Ba
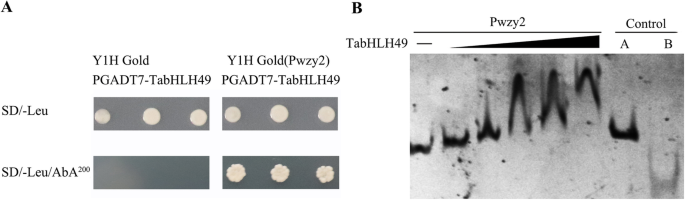
检查TabhlH49之间的交互和gydF4y2BaWZY2.gydF4y2Ba启动子(Pwzy2),酵母单杂交和EMSA分析。酵母单杂交结果表明,含pGADT7-TabHLH49的Y1H Gold酵母细胞不能在SD/−Leu/AbA上生长gydF4y2Ba200.gydF4y2Ba选择性培养基。然而,含有PGADT7-TablH49的Y1H金(PWZY2)诱饵酵母菌株能够在SD / -LEU和SD / -LEU / ABA上生长gydF4y2Ba200.gydF4y2Ba选择性培养基(无花果。gydF4y2Ba4gydF4y2Baa和图SgydF4y2Ba1gydF4y2Ba).EMSA实验表明,与TabHLH49蛋白孵育后,Pwzy2的凝胶流动性发生了变化。gydF4y2Ba4gydF4y2BaB和图.. SgydF4y2Ba2gydF4y2Ba).这些结果表明,TabHLH49是gydF4y2BaWZY2.gydF4y2Ba.gydF4y2Ba
TabHLH49与gydF4y2BaWZY2.gydF4y2Ba(pwzy2)。gydF4y2Ba一个gydF4y2BaTabhlH49与启动子的相互作用gydF4y2BaWZY2.gydF4y2Ba在Y1H测定中。gydF4y2BabgydF4y2Ba采用EMSA分析His6-TabHLH49与大肠杆菌的相互作用gydF4y2BaWZY2.gydF4y2Ba启动子。使用增加量的蛋白质量(0.1,0.2,0.4,0.6和0.8μm)。作为阴性对照,牛血清白蛋白(BSA)代替His6-TabhlH49(对照A)和(GagcgTaactgcccaccaccactCactGCCGCGCGCTGCCC)反复串联DNA片段而不是gydF4y2BaWZY2.gydF4y2Ba结合试验包括启动子(对照B)gydF4y2Ba
TabHLH49正调节的表达gydF4y2BaWZY2.gydF4y2Ba提高小麦的抗旱性gydF4y2Ba
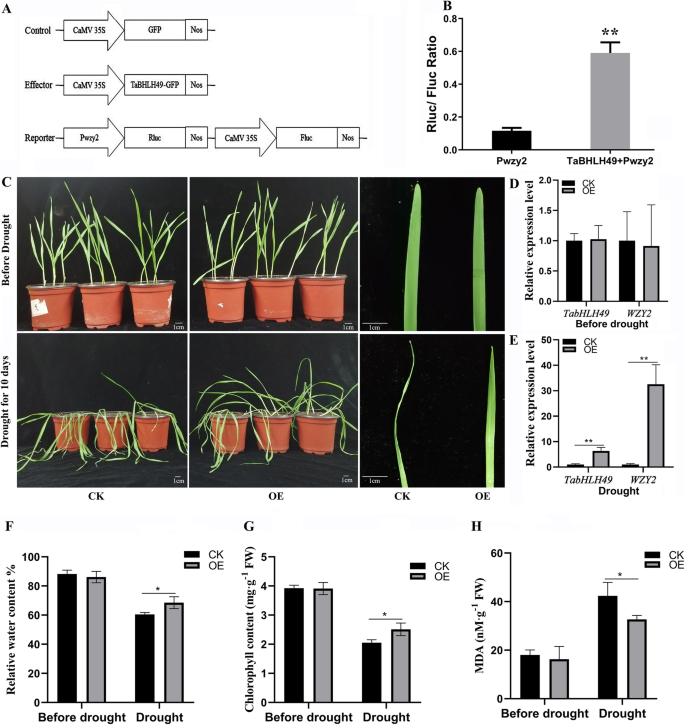
描述…的能力gydF4y2BaTabHLH49gydF4y2Ba激活这一点gydF4y2BaWZY2.gydF4y2Ba基因,烟草叶片共渗透gydF4y2BaA. Tumefaciens.gydF4y2Ba包含35s:tabhlh49:gfp矢量与a一起gydF4y2BaRenilla荧光素酶gydF4y2Ba基因由gydF4y2BaWZY2.gydF4y2Ba启动子。与GFP表达相比,同时过表达TabHLH49:GFP显著增加了Rluc/Fluc比值(图2)。gydF4y2Ba5gydF4y2Bab)。gydF4y2Ba
TablH49的瞬时表达测定。gydF4y2Ba一个gydF4y2Ba瞬时表达系统中使用的pCAMBIA1302空载体(对照)、pCAMBIA1302- tabhlh49:GFP(效应器)和报告基因结构的示意图。“Nos”框表示终止符。gydF4y2BabgydF4y2BaTabHLH49对启动子的反式激活作用gydF4y2BaWZY2.gydF4y2Ba(PWZY2)由烟叶中的双荧光素酶测定结果显示。(a)中描述的构建体转化为gydF4y2Ba农杆菌肿瘤术gydF4y2Ba菌株GV3101渗入烟草叶片。Rluc/Fluc值为6个样品的平均值±SD,显著性差异表示为gydF4y2BapgydF4y2Ba < 0.05 (*) andpgydF4y2Ba< 0.01(* *)。(C-H)表型(gydF4y2BacgydF4y2Ba),gydF4y2BaTabHLH49gydF4y2Ba和gydF4y2BaWZY2.gydF4y2Ba基因表达水平(gydF4y2BadgydF4y2Ba-gydF4y2BaegydF4y2Ba),相对水含量(gydF4y2BafgydF4y2Ba),叶绿素含量(gydF4y2BaggydF4y2Ba)和丙二醛含量(gydF4y2BahgydF4y2Ba)gydF4y2Ba农杆菌属gydF4y2Ba含pCAMBIA1302空载体(CK)和pCAMBIA1302:TabHLH49:GFP (OE)的GV3101在正常生长条件下或干旱胁迫条件下培养10天。数值为三个样本的均值±SD,显著性差异为gydF4y2BapgydF4y2Ba < 0.05 (*) andpgydF4y2Ba< 0.01 (* *)gydF4y2Ba
探索禁忌49在小麦的功能,gydF4y2BaA. Tumefaciens.gydF4y2Ba将含有35S:TabHLH49:GFP (OE)和35S:GFP (CK)的GV3101注射到小麦叶片中进行瞬时基因表达检测,如前所述[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].在天然干旱后10天,小麦叶过表达GFP显示出明显的抗潮和卷曲;然而,过表达禁忌49:GFP的小麦显示出更好的生长(图。gydF4y2Ba5gydF4y2Bac)。实时PCR结果显示,表达gydF4y2BaTabHLH49gydF4y2Ba和gydF4y2BaWZY2.gydF4y2Ba在干旱胁迫后,过表达TabHLH49:GFP的小麦叶片中TabHLH49:GFP的表达显著高于对照(图2)。gydF4y2Ba5gydF4y2BaD-e)。我们还确定了CK和OE线中丙二醛(MDA),相对含水量和叶绿素含量的含量(图。gydF4y2Ba5gydF4y2Baf-h)。干旱胁迫后,OE株系MDA含量显著低于CK株系,相对含水量和叶绿素含量显著高于CK株系。gydF4y2Ba
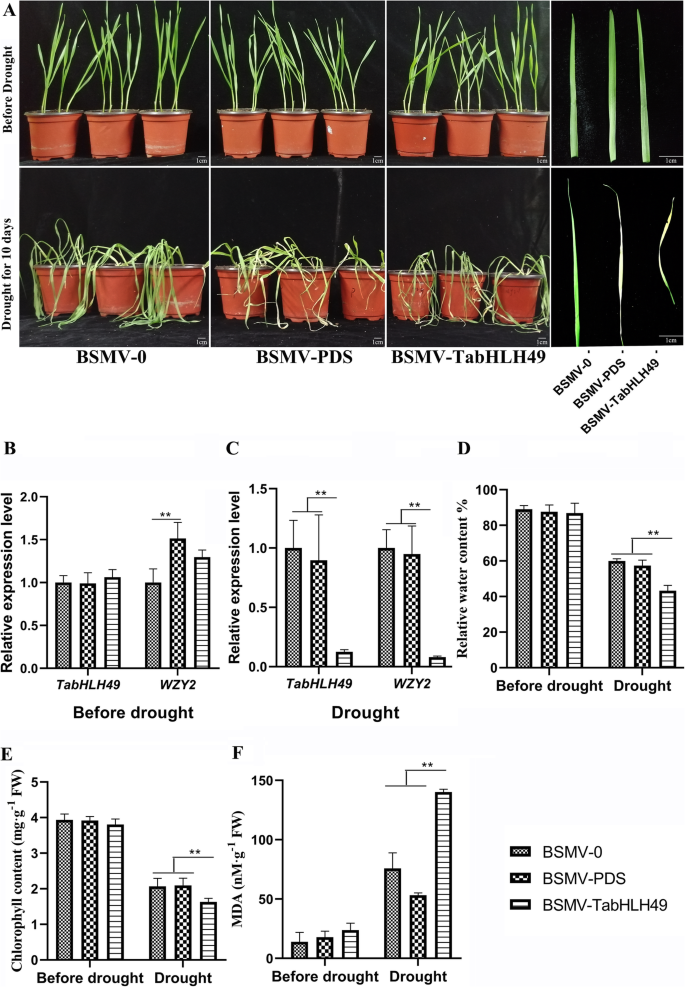
我们还探讨了gydF4y2BaTabHLH49gydF4y2Ba小麦的基因使用大麦条纹马赛克病毒诱导的基因沉默(BSMV-Vigs)技术。BSMV构造BSMV-TabhlH49,携带459个BP片段gydF4y2BaTabHLH49gydF4y2BacDNA序列,用于沉默gydF4y2BaTabHLH49gydF4y2Ba小麦种子的基因(表SgydF4y2Ba1gydF4y2Ba).在接种BSMV-PDS后10天,所有感染BSMV-PDS的植株均观察到叶片光漂白,表明内源PDS基因被沉默(图2)。gydF4y2Ba6gydF4y2Ba一种)。在天然干旱后10天,BSMV-TABHLH49线漂白并比BSMV-0和BSMV-PDS线更严重卷曲(图。gydF4y2Ba6gydF4y2Ba一种)。实时PCR分析表明,转录水平的gydF4y2BaTabHLH49gydF4y2Ba和gydF4y2BaWZY2.gydF4y2Ba与BSMV:0和BSMV- pds株系相比,BSMV- tabhlh49株系在干旱胁迫后表达量减少(图2)。gydF4y2Ba6gydF4y2Bac)。干旱胁迫后,BSMV-TabHLH49株系的MDA含量明显高于BSMV-0和BSMV-PDS株系,叶绿素含量明显低于BSMV-0和BSMV-PDS株系。gydF4y2Ba6gydF4y2BaD-F)。gydF4y2Ba
病毒诱导的基因沉默(Vigs)gydF4y2BaTabHLH49gydF4y2Ba小麦叶子。表型(gydF4y2Ba一个gydF4y2Ba),gydF4y2BaTabHLH49gydF4y2Ba和gydF4y2BaWZY2.gydF4y2Ba基因表达水平(gydF4y2BabgydF4y2Ba-gydF4y2BacgydF4y2Ba),相对水含量(gydF4y2BadgydF4y2Ba),叶绿素含量(gydF4y2BaegydF4y2Ba)和丙二醛含量(gydF4y2BafgydF4y2BaBSMV-0(空载体)、BSMV-PDS和BSMV-TabHLH49在正常生长条件下或干旱胁迫条件下处理10 d后,对小麦叶片的生长发育有显著影响。数值为三个样本的均值±SD,显著性差异为gydF4y2BapgydF4y2Ba < 0.05 (*) andpgydF4y2Ba< 0.01 (* *)gydF4y2Ba
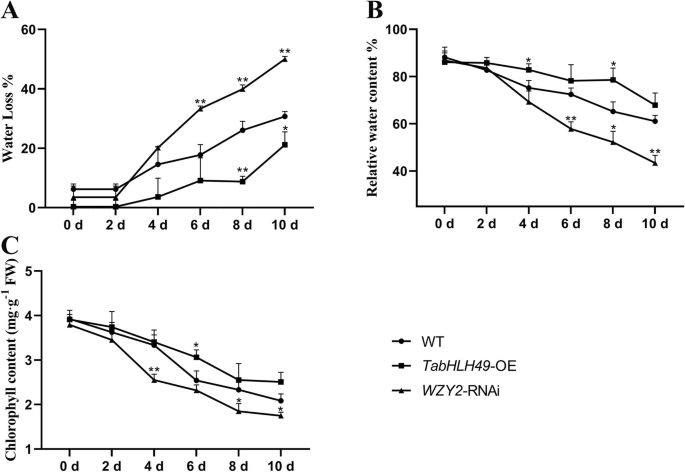
此外,我们还测量了失水率,相对含水量和野生型小麦叶片的叶绿素含量,gydF4y2BaTabHLH49gydF4y2Baoe和gydF4y2BaWZY2.gydF4y2Barnai小麦。gydF4y2BaTabHLH49gydF4y2Ba-OE小麦的相对水分和叶绿素含量最高,失水率最低gydF4y2BaWZY2.gydF4y2Ba-RNAi小麦品系在干旱胁迫下gydF4y2BaWZY2.gydF4y2Ba-RNAi系显示最低的相对水和叶绿素含量和最高失水率(图gydF4y2Ba7gydF4y2BaA-C)。这些结果表明,TabhlH49积极调节脱氢gydF4y2BaWZY2.gydF4y2Ba小麦抗旱性的基因表达研究。gydF4y2Ba
测定土壤失水速率、相对含水量和叶绿素含量gydF4y2BaTabHLH49gydF4y2Baoe和gydF4y2BaWZY2.gydF4y2Barnai小麦。失水率(gydF4y2Ba一个gydF4y2Ba),相对含水量(RWC%)(gydF4y2BabgydF4y2Ba)及叶绿素含量(gydF4y2BacgydF4y2Ba)gydF4y2Ba农杆菌属gydF4y2BaGV3101 containing pCAMBIA1302 empty vector (CK), pCAMBIA1302:TabHLH49:GFP (gydF4y2BaTabHLH49gydF4y2Ba- 电子)或者gydF4y2BaWZY2-gydF4y2BaRNAi小麦。数值为三个样本的均值±SD,显著性差异为gydF4y2BapgydF4y2Ba < 0.05 (*) andpgydF4y2Ba< 0.01 (* *)gydF4y2Ba
讨论gydF4y2Ba
TabHLH49gydF4y2Ba编码应力响应性的BHLH转录因子,并积极调节小麦干旱耐受性gydF4y2Ba
转录因子在调控植物对干旱的响应中起着重要的作用。在gydF4y2Ba拟南芥gydF4y2Ba,许多bHLH转录因子参与了干旱诱导的胁迫反应,如gydF4y2Baatbhlh68gydF4y2Ba[gydF4y2Ba14gydF4y2Ba],gydF4y2Baatbhlh006.gydF4y2Ba[gydF4y2Ba15gydF4y2Ba],gydF4y2Baatbhlh122gydF4y2Ba[gydF4y2Ba16gydF4y2Ba],gydF4y2BaAtbHLH17gydF4y2Ba[gydF4y2Ba17gydF4y2Ba] 和gydF4y2Baatbhlh92.gydF4y2Ba[gydF4y2Ba18gydF4y2Ba].但是,只有少数人在小麦中报道,例如gydF4y2BaTabhlh1.gydF4y2Ba[gydF4y2Ba19gydF4y2Ba] 和gydF4y2BaTabhlh39.gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba],以及监管机制等诸多TabHLH蛋白质的生物学功能尚不清楚。在这里,我们得到了一种新的小麦bHLH转录因子,TabHLH49,通过酵母单杂交(Y1H)测定与脱水蛋白启动子WZY2为诱饵。系统发育分析表明,TabHLH49是高度同源AtbHLH049并且是Myc的型bHLH转录因子(图gydF4y2Ba1gydF4y2Bab)。gydF4y2BaTabHLH49gydF4y2Ba明显受到干旱胁迫的影响(图。gydF4y2Ba3.gydF4y2Bab),增强了对干旱胁迫的耐受性(图。gydF4y2Ba5gydF4y2Bac).与BSMV-0株系相比,BSMV-TabHLH49株系对干旱胁迫的耐受性降低(图1)。gydF4y2Ba6gydF4y2Baa).这些结果表明,TabHLH49编码一种新的bHLH转录因子,正调控小麦的耐旱性。gydF4y2Ba
TabHLH49正调控脱水gydF4y2BaWZY2.gydF4y2Ba基因表达gydF4y2Ba
转录因子通过结合调控下游基因的表达gydF4y2Ba独联体gydF4y2Ba式作用启动子的元件。在我们以前的研究,我们发现G-BOX元素的子gydF4y2BaWZY2.gydF4y2Ba结合BHLH转录因子[gydF4y2Ba21.gydF4y2Ba].EMSA和Y1H分析表明,TabHLH49蛋白可以与启动子结合并相互作用gydF4y2BaWZY2.gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Ba).实时PCR结果表明表达式模式gydF4y2BaWZY2.gydF4y2Ba类似于gydF4y2BaTabHLH49gydF4y2Ba但落后gydF4y2BaTabHLH49gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Bab)。因此,TabhlH49是一个潜在的正稳压器gydF4y2BaWZY2.gydF4y2Ba表达。一种双萤光素酶测定也证实了这一结果(图gydF4y2Ba5gydF4y2Bab).在瞬态表达式分析中gydF4y2BaWZY2.gydF4y2Ba与CK相比,在舌苔49-OE小麦线中的干旱胁迫下表达水平显着增加(图。gydF4y2Ba5gydF4y2Bae)。同样,gydF4y2BaWZY2.gydF4y2BaBSMV-TabHLH49细胞系的表达水平显著降低(图2)。gydF4y2Ba6gydF4y2Bac)。另外,当缺失C末端(氨基酸323-362)时,禁忌49蛋白在酵母中没有在酵母中进行转录活性(图。gydF4y2Ba2gydF4y2Bac).这些结果表明,TabHLH49正调控脱水gydF4y2BaWZY2.gydF4y2Ba基因的表达。gydF4y2Ba
总之,在本研究中提出的结果提供的证据表明,TabHLH49正调节脱水gydF4y2BaWZY2.gydF4y2Ba提高小麦抗旱性的基因表达。我们进一步需要开发稳定过表达的TabHLH49,以确定该转录因子是否参与胁迫,这将有助于研究TabHLH49在脱氢酶信号通路中的显性作用。gydF4y2Ba
结论gydF4y2Ba
这项研究表明,转录因子TabHLH49正调控的表达水平gydF4y2BaWZY2.gydF4y2Ba基因通过与其启动子结合,从而提高小麦的抗旱性。我们的研究提供了更好地了解监管机制gydF4y2BaWZY2.gydF4y2Ba基因响应干旱胁迫,提供进一步作物育种的潜在策略。gydF4y2Ba
方法gydF4y2Ba
酵母单杂交筛选gydF4y2BaT.Aestivum.gydF4y2Ba互补脱氧核糖核酸数据库gydF4y2Ba
619年英国石油公司gydF4y2BaWZY2.gydF4y2Ba将启动子(Pwzy2)克隆到pai载体中,将重组质粒转化到Y1H Gold酵母细胞中作为诱饵[gydF4y2Ba10gydF4y2Ba].Two-week-old wheat seedlings exposed to either 12 h high PEG 6000 (20%) or cold (4 °C) treatments were used to construct the cDNA library. The extraction of mRNA was performed with the MiniBEST Plant RNA Extraction kit (Taraka). First-strand cDNA was synthesized by the SMART cDNA Library Construction Kit (Taraka). All fragments were linked to the vector pGADT7-AD and transformed into yeast bait strain Y1H Gold (Pwzy2) following the Yeast Protocols Handbook (Clontech). The transformed stains were cultured on SD/−Leu/AbA200.gydF4y2Ba中等的。酵母提取质粒,并用T7启动和3'AD测序引物扩增。扩增子转化成gydF4y2Ba大肠杆菌gydF4y2Ba和测序。gydF4y2Ba
禁忌49的生物信息学分析gydF4y2Ba
在Ensembl服务器的小麦基因组数据库中鉴定了TabhlH49的ORF(gydF4y2Bahttp://plants.ensembl.org/Triticum_aestivum/Info/IndexgydF4y2Ba).ProtParam工具预测了物理化学特征[gydF4y2Ba22.gydF4y2Ba].基本的螺旋-环-螺旋保守域和亚细胞定位由NCBI保守域数据库(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/cdd.gydF4y2Ba)及ProtComp (gydF4y2Bahttp://linux1.softberry.com/gydF4y2Ba),分别。Swiss-Model工具(gydF4y2Bahttps://swissmodel.expasy.org/gydF4y2Ba)用于预测蛋白质的三维结构。系统发育树是由邻接的方法构建的,在Mega 7.0软件中具有1000个引导复制[gydF4y2Ba23.gydF4y2Ba].所述wbHLH转录因子的氨基酸序列是从先前的报告获得的[gydF4y2Ba24.gydF4y2Ba].gydF4y2Ba
TabHLH49的亚细胞定位gydF4y2Ba
研究舌蛋白蛋白的亚细胞定位,gydF4y2Ba农杆菌属gydF4y2BaGV3101携带重组质粒pCAMBIA1302:TabHLH49:GFP和pCAMBIA1302空载体(对照)分别注入gydF4y2Ba尼古利亚娜·宾夕法尼亚州gydF4y2Ba树叶。在28℃下在黑暗中培养36小时后,通过荧光显微镜观察烟草表皮细胞中的荧光信号。gydF4y2Ba
TabhlH49转移分析gydF4y2Ba
甲转录激活活性测定法进行如先前报道[gydF4y2Ba8gydF4y2Ba].将TabHLH49全长和截短片段与pGBKT7质粒的GAL4 dna结合域融合,转化酵母Y2H Gold细胞,在SD-Trp/X-α-gal/AbA板上生长,检测其生长情况和α-半乳糖苷酶活性。gydF4y2Ba
植物材料和生长条件gydF4y2Ba
小麦种子“gydF4y2Ba郑寅1#gydF4y2Ba“在本研究中使用。小麦植物的生长条件和20%PEG6000治疗与我们以前的研究中描述的相同[gydF4y2Ba25.gydF4y2Ba].gydF4y2Ba
RNA分离和实时PCR分析gydF4y2Ba
RNA分离和实时PCR的方案是我们之前的研究[gydF4y2Ba25.gydF4y2Ba].所有real-time PCR反应均重复3次,以确保结果的重现性。gydF4y2Ba
融合TabhlH49蛋白和纯化的表达gydF4y2Ba
将TabHLH49克隆到pET-28a载体中,重组质粒转化感受态BL21 (DE3)细胞。用1 mM异丙基β- d -1-硫代半乳糖苷(IPTG)诱导重组蛋白表达6 hgydF4y2Ba大肠杆菌gydF4y2Ba密度达到了ODgydF4y2Ba600gydF4y2Ba在37℃下含有50μg/ ml卡那霉素的LB液体培养基中的0.6。通过离心收获细胞,并在磷酸盐缓冲盐水(PBS)中重新悬浮,然后进行超声波细胞破坏30分钟。使用蛋白质™Ni-NTA树脂(转基因)纯化蛋白质纯化,并通过SDS-PAGE检测。gydF4y2Ba
电泳迁移迁移试验gydF4y2Ba
根据制造商的协议,使用LightShift®Chemiluminescent EMSA Kit (Thermo Fisher Scientific)进行EMSA测试。619 bp的区域gydF4y2BaWZY2.gydF4y2Ba利用基因特异性引物扩增启动子序列(表SgydF4y2Ba1gydF4y2Ba)然后纯化和量化。的gydF4y2BaWZY2.gydF4y2Ba启动子与纯化的TabHLH49蛋白在室温下反应30 min。然后用6%聚丙烯酰胺凝胶电泳对配合物进行分离。gydF4y2Ba
双荧光素酶测定gydF4y2Ba
研究TabHLH49对靶点的反式激活作用gydF4y2BaWZY2.gydF4y2Ba启动子,双荧光素酶分析根据之前的报道[gydF4y2Ba26.gydF4y2Ba].启动子的gydF4y2BaWZY2.gydF4y2Ba被克隆到双荧光素酶报告矢量pc0390-ruc中并转化为gydF4y2Ba农杆菌属gydF4y2BaGV3101然后与PCAMBIA1302:TabHLH49:GFP(效应器)或PCAMBIA1302空向烟叶(控制)一起注射到烟叶。孵育3d后,将叶片研磨在液氮中,然后在室温下与无源裂解缓冲液混合30分钟。离心后,收集上清液并使用双荧光素酶报告系统(Promega)进行荧光素酶活性(Rluc / Fluc)评估。gydF4y2Ba
TabHLH49瞬时表达分析gydF4y2Ba
的gydF4y2Ba杆菌gydF4y2BaGV3101用PCAMBIA1302转换:TabHLH49:GFP和PCAMBIA1302空向量(控制)注入小麦叶片以进行瞬态基因表达测定,如前所述[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].新鲜的gydF4y2Ba杆菌gydF4y2Ba在酵母提取物肉汤(YEB)培养基中生长过夜,含有利福平,氨基丙胺和露身霉素。离心后,将细菌颗粒重悬于含10mM MES的渗透缓冲液中,10mM MgClgydF4y2Ba2gydF4y2Ba,和400 μM acetosyringone at an optical density of OD600gydF4y2Ba = 2.0. For wheat infiltration, the fully expanded secondary leaf of wheat seedlings was infiltrated using a 1 mL syringe without a needle. Plant phenotypes were examined between 5 and 14 d after infiltration.
BSMV-mediatedgydF4y2BaTabHLH49gydF4y2Ba基因沉默gydF4y2Ba
如前所述进行病毒RNA和植物接种的体外转录[gydF4y2Ba27.gydF4y2Ba].将4株小麦接种BSMV- pds(阳性对照)或BSMV- tabhlh49构建体,每次试验均以BSMV:0(阴性对照)作为对照。这个实验重复了三次,并对数据取平均。gydF4y2Ba
丙二醛(MDA)、失水率、相对含水量、叶绿素含量测定gydF4y2Ba
干旱胁迫后小麦叶片丙二醛(MDA)含量、失水率、相对含水量和叶绿素含量的测定方法如前所述[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba28.gydF4y2Ba,gydF4y2Ba29.gydF4y2Ba].gydF4y2Ba
数据和材料的可用性gydF4y2Ba
目前的研究过程中产生和分析的数据集在UniProt的数据库的链接获取gydF4y2Bahttps://www.uniprot.org/gydF4y2Ba,分别在加入号B0LXL4和A0A3B6RCI9下。序列gydF4y2BaWZY2.gydF4y2Ba启动子可以在我们以前的研究的附加文件中找到gydF4y2Bahttps://doi.org/10.1080/15592324.2019.1678370gydF4y2Ba.gydF4y2Ba
缩写gydF4y2Ba
- bHLH:gydF4y2Ba
-
碱性螺旋-环-螺旋转录因子gydF4y2Ba
- pwzy2:gydF4y2Ba
-
脱醇促进剂gydF4y2BaWZY2.gydF4y2Ba基因;gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱盐酸gydF4y2Ba
- EMSA:gydF4y2Ba
-
电泳迁移迁移试验gydF4y2Ba
- Rluc的:gydF4y2Ba
-
Renilla荧光素酶gydF4y2Ba
- 美国人:gydF4y2Ba
-
萤火虫荧光素酶gydF4y2Ba
- 阿坝:gydF4y2Ba
-
Aureobasidin一gydF4y2Ba
- Y1H:gydF4y2Ba
-
酵母一个杂化gydF4y2Ba
- IPTG:gydF4y2Ba
-
异丙基β-D-1-thiogalactopyranosidegydF4y2Ba
- MDA:gydF4y2Ba
-
丙二醛gydF4y2Ba
- 中收取:gydF4y2Ba
-
病毒诱导基因沉默gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Battaglia的男,奥维拉-Carrillo的Y,Garciarrubio A,Campos的楼科瓦鲁比亚斯AA。神秘的LEA蛋白等hydrophilins。植物理性。2008; 148(1):6-24。gydF4y2Ba
- 2。gydF4y2Ba
Garay-Arroyo A,Colmenero-Flores JM,Garciarrubio A,Covarrubias AA。在水赤字条件下,原核生物和真核生物中的高度亲水性蛋白质是常见的。J Biol Chem。2000; 275(8):5668-74。gydF4y2Ba
- 3.gydF4y2Ba
俞Z,王X,张L.结构和脱水蛋白的功能动态:非生物胁迫下的植物保护蛋白。int j mol sci。2018; 19(11):3420。gydF4y2Ba
- 4.gydF4y2Ba
Atchley WR,Terhalle W,衣服A.在BHLH蛋白质结构域中的位置依赖性,群体和预测基序。J Mol Evol。1999; 48(5):501-16。gydF4y2Ba
- 5。gydF4y2Ba
奈尔SK,白肋烟SK。在图书馆认识的DNA。自然。2000; 404(6779):715 717-718。gydF4y2Ba
- 6。gydF4y2Ba
张伟,孙勇,Timofejeva L, Chen C, Grossniklaus U, Ma H.调控gydF4y2Ba拟南芥gydF4y2Ba绒毡层发育和功能的gydF4y2Ba功能障碍Tapetum1(Dyt1)gydF4y2Ba编码推定的BHLH转录因子。发展。2006; 133(16):3085-95。gydF4y2Ba
- 7。gydF4y2Ba
Heisler M,Atkinson A,Bylstra Yh,Walsh R,Smyth Dr。gydF4y2Ba抹刀gydF4y2Ba,一种控制Carpel边缘组织的发展的基因gydF4y2Ba拟南芥gydF4y2Ba,编码BHLH蛋白质。发展。2001; 128(7):1089-98。gydF4y2Ba
- 8。gydF4y2Ba
刘勇,季旭,聂昕,曲敏,郑磊,谭志明,霍林,刘胜,张斌,等。gydF4y2Ba拟南芥gydF4y2BaAtbHLH112通过结合E-box和GCG-box基元调控非生物耐受性相关基因的表达。新植醇。2015;207(3):692 - 709。gydF4y2Ba
- 9。gydF4y2Ba
纪旭,聂旭,刘艳,郑丽,赵辉,张波,霍丽,王永安gydF4y2BabHLHgydF4y2Ba基因gydF4y2Ba甘蒙柽柳hispidagydF4y2Ba通过提高渗透势和降低反应性氧物种积累来提高非生物胁迫耐受性。树生理。2016; 36(2):193-207。gydF4y2Ba
- 10.gydF4y2Ba
刘红梅,刘红梅,杨永强,张丽丽。脱氢酶上游转录因子的鉴定及其相互作用的PP2C蛋白gydF4y2BaWZY2.gydF4y2Ba小麦的基因。植物信号表现。2019; 14(12):1678370。gydF4y2Ba
- 11.gydF4y2Ba
yu z,王x,mu x,张L. rnai介导的脱氢基因的沉默gydF4y2BaWZY2.gydF4y2Ba赋予转基因小麦渗透胁迫不耐症。Funct植物Biol。2019; 46:877-84。gydF4y2Ba
- 12.gydF4y2Ba
Lu X,Kracher B,Saur Iml,Bauer S,Ellwood SR,Wise R,Yaeno T,Maekawa T,Schulze-Lefert P.等位基因大麦MLA免疫受体识别粉末状霉菌病原体的序列无关的无关的流动效果。PROC NATL ACAD SCI。2016; 113(42):E6486-95。gydF4y2Ba
- 13。gydF4y2Ba
高J,Bi W,Li H,Wu J,Yu X,Liu D,Wang X.gydF4y2Ba怀疑gydF4y2Ba与之相关的转录因子gydF4y2BaNPR1.gydF4y2Ba在大麦的抗性抗性是提高小麦抵抗力的潜在资源gydF4y2Ba柄锈菌triticinagydF4y2Ba.植物学报。2018;9:1486。gydF4y2Ba
- 14。gydF4y2Ba
Le Hir R,Castelain M,Chakraborti D,Moritz T,Dinant S,Bellini C.gydF4y2Baatbhlh68gydF4y2Ba转录因子参与调控ABA稳态和抗旱性gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.physiol platararum。2017; 160(3):312-27。gydF4y2Ba
- 15.gydF4y2Ba
拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)在脱落酸信号转导中起转录激活作用。植物细胞。2003;15(1):63 - 78。gydF4y2Ba
- 16。gydF4y2Ba
刘伟,邰华,李胜,高伟,赵敏,谢超,李文祥。gydF4y2BaBHLH122gydF4y2Ba对干旱和渗透胁迫阻力是重要的gydF4y2Ba拟南芥gydF4y2Ba以及ABA分解代谢的抑制。新植醇。2014;201(4):1192 - 204。gydF4y2Ba
- 17。gydF4y2Ba
Babitha KC, Ramu SV, Pruthvi V, Mahesh P, Nataraja KN, Udayakumar M.共表达gydF4y2BaAtbHLH17gydF4y2Ba和gydF4y2BaAtWRKY28gydF4y2Ba提供对非生物压力的抵抗力gydF4y2Ba拟南芥gydF4y2Ba.转基因Res。2013; 22(2):327-41。gydF4y2Ba
- 18。gydF4y2Ba
江Y,杨B,Deyholos MK。在非生物胁迫的拟南芥bHLH92转录因子的功能性特征。Mol Gen Genomics。2009; 282(5):503-16。gydF4y2Ba
- 19。gydF4y2Ba
杨T,姚某,郝升,赵y,卢w,小k.小麦Bhlh型转录因子基因gydF4y2BaTabhlh1.gydF4y2Ba是通过调节aba相关通路介导渗透胁迫耐受性的关键。植物学报2016;35(11):2309-23。gydF4y2Ba
- 20。gydF4y2Ba
翟y,张l,夏c,富士,赵g,jia j,kong x。小麦转录因子,Tabhlh39,改善转基因植物中多种非生物胁迫源的耐受性。Biochem Biophys Res Communce。2016; 473(4):1321-7。gydF4y2Ba
- 21.gydF4y2Ba
朱武,张l,lv h,张h,张d,王x,陈j.脱氢素gydF4y2Bawzy2gydF4y2Ba来自小麦的启动子定义了其对应力耐受性的贡献。Funct综合基因组。2014; 14(1):111-25。gydF4y2Ba
- 22.gydF4y2Ba
Garg VK, Avashthi H, Tiwari A, Jain PA, Ramkete PW, Kayastha AM, Singh VK。MFPPI -多FASTA ProtParam接口。信息学手段。2016;12(2):74 - 7。gydF4y2Ba
- 23.gydF4y2Ba
Kumar S,SteCher G,Tamura K. Mega7:用于更大数据集的分子进化遗传学分析版本7.0。mol Biol Evol。2016; 33(7):1870-4。gydF4y2Ba
- 24。gydF4y2Ba
郭X,王J.小麦BHLH转录因子的全局鉴定,结构分析及表达表达。BMC植物BIOL。2017; 17(1):90。gydF4y2Ba
- 25。gydF4y2Ba
Liu H ., Xing M ., Yang W ., Mu X ., Wang X ., Lu F ., Wang Y ., Zhang L. study of late embrgenesis abundant (LEA) gene family in bread wheat(面包小麦)gydF4y2Ba小麦gydF4y2Ba).Sci代表英国。2019; 9(1):13375。gydF4y2Ba
- 26。gydF4y2Ba
Chen K,Du L,Liu H,Liu Y.来自Mamyba葡萄风信子的新型R2R3-MyB,与Maan2不同,令人生畏的烟草激烈和品红色的花青素色素沉着。BMC植物BIOL。2019; 19(1):390。gydF4y2Ba
- 27。gydF4y2Ba
Holzberg S, Brosio P, Gross C, Pogue GP。大麦条纹花叶病毒在单子叶植物中的基因沉默。植物j . 2002; 30(3): 315 - 27所示。gydF4y2Ba
- 28。gydF4y2Ba
康H,张明,周S,郭Q,陈楼吴Ĵ,小麦泛素基因的王W.表达,gydF4y2Bata-Ub2gydF4y2Ba,提高了非生物应力耐受性gydF4y2BaBroachypodium distachyon.gydF4y2Ba.植物SCI。2016; 248:102-15。gydF4y2Ba
- 29。gydF4y2Ba
张刚,张敏,赵智,任勇,李强,王伟。小麦TaPUB1通过提高抗氧化能力调控植物抗旱性。Sci代表英国。2017; 7(1): 7549。gydF4y2Ba
致谢gydF4y2Ba
我们承认来自西北A&F大学的天勇赵博士,为西北A&F大学提供了双路荧光素酶报告矢量,Zhensheng Kang博士提供了BSMv-Vigs矢量。我们还承认中国国家自然科学基金(第31671608号)。gydF4y2Ba
资金gydF4y2Ba
我们的研究由中国国家自然科学基金(授予31671608)资助。资金代理商在实验设计,数据收集和分析或准备中没有作用。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
设计实验:HL和LZ。进行实验并分析数据:HL和YY。提供试剂/材料/分析工具:LZ。撰写稿件:HL, YY, XW, DL。所有作者阅读并批准了手稿。gydF4y2Ba
通讯作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
研究中使用的特异性引物。gydF4y2Ba
附加文件2:图S1。gydF4y2Ba
图的原始图像。gydF4y2Ba4gydF4y2Ba一个。gydF4y2Ba
附加文件3:图S2。gydF4y2Ba
图的原始图像。gydF4y2Ba4gydF4y2Bab。gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
刘华,杨永强,刘东。gydF4y2Baet al。gydF4y2Ba转录因子TabhlH49积极调节脱氢gydF4y2BaWZY2.gydF4y2Ba基因表达增强小麦抗旱性。gydF4y2BaBMC植物BIOL.gydF4y2Ba20,gydF4y2Ba259(2020)。https://doi.org/10.1186/s12870-020-02474-5gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02474-5gydF4y2Ba
关键字gydF4y2Ba
- 小麦gydF4y2Ba
- DehydringydF4y2Ba
- 干旱胁迫gydF4y2Ba
- BHLH转录因子gydF4y2Ba
- 监管机制gydF4y2Ba