摘要
背景
DNAJ蛋白在植物开发和压力反应中起着关键作用。最近,通过辣椒基因组中的综合生物信息学分析来确定七十六个DNAJ基因。然而,目前迄今为止,没有关于辣椒DNAJ基因的系统发育关系和不同表达谱的报道。在此,我们对不同组织中的辣椒DNAJ基因的系统发育关系和表达谱进行了全身分析,并响应非生物应激和植物激素。
结果
系统发育分析表明,根据序列同源性,将所有辣椒DNAj基因分成7个子家族(亚家族I,II,III,IV,V,VI和VII)。辣椒DNAJS在不同组织中的表达显示,在至少一种组织中表达了约38%(29/76)的胡椒DNAJ。结果表明DNAJS在辣椒生长和发展中的潜在关键作用。此外,为了深入了解尖牙和非刺激性之间胎盘在胎盘中辣椒DNAJ基因的表达差异,还使用RNA-SEQ数据和QRT-PCR分析它们的表达模式。比较分析表明,八种基因在刺鼻和非刺激性辣椒中呈现了不同的表达曲线。的CaDnaJs用参与胎盘发育过程中含有辣椒素合成的基因。更重要的是,我们的研究暴露了这一八种DNAJ基因可能受到压力(热,干旱和盐)调节的事实,并且也受植物激素(ABA,GA3,MEJA和SA)调节。
结论
综上所述,这些结果表明,胎盘中表达的一些DnaJ基因可能参与了植物在辛辣相关化合物生物合成过程中对非生物胁迫的响应。该研究为辣椒DanJ基因的表达谱研究提供了新的思路,并有助于进一步了解DnaJ基因在辣椒中的功能。
背景
DNAJ蛋白最初确定大肠杆菌作为41 kda热休克蛋白[1].一般由4个结构域组成,分别是j结构域、G/ f结构域、锌指结构域(CxxCxGxG)和c端序列[2,3.,4,5].以前的研究试图根据结构的特征将DNAJ蛋白分为三组(I / II / III)[6].组I由J-Domain,G / F域和锌指域组成。第II组由J-Domain和G / F-或锌指域组成。第三组只有J-Domain [7].
植物生长和发展是由各种机制网络调节的复杂生物学过程。据报道,许多DNAJ蛋白在这一过程中参与并发挥重要作用。众所周知,发生在叶绿体中的光合作用是植物生长和发展的重要生理过程[8].此前,研究人员已经发现DnaJ蛋白对叶绿体发育具有重要意义。例如,位于拟南芥叶绿体膜上的DnaJ蛋白ARC6通过组装或稳定FtsZ环,作为叶绿体分化的关键因子[9].随后,陈等人。[10发现叶绿体靶向的3个小DnaJ蛋白AtJ8、AtJ11和AtJ20同时具有特异和串扰功能。这些小蛋白参与多种生理生化过程,包括CO的优化2PSII配合物的稳定和电子转移反应的平衡[10].最近,DNAJ的成员样锌指域蛋白蛋白拟南芥蒂利亚纳已被报道参与质体的生物发生和/或维持。PSA2蛋白家族成员之一被发现定位于类囊体管腔,调控光系统i的积累。结果表明PSA2影响叶绿体发育[11].更重要的是,关于DNAJ蛋白在水稻中的功能的相当大的研究与此前的报道一致。朱等。[12]清楚地照亮了大米中叶绿体发育所需的OSDJA7 / 8,它可能直接或间接地与其他蛋白质相关起作用。
植物DnaJ功能不仅与植物的生长发育有关,还与植物对非生物胁迫的抗性有关。的BIL2基因定位于线粒体被归类为DnaJ家族成员[13].过表达bil2的植株对盐胁迫和强光胁迫均表现出抗性Arabidopisis芥[14].叶绿体靶向DNA.J蛋白质 (LECDJ1.)从番茄(Solanum lycopersicum).在低温胁迫下表达上调。此外,研究人员进一步报道了LECDJ1.改善PSII对低温应力的耐受性,而抑制LECDJ1.提高了PSII对低温的敏感性。结果表明LECDJ1.在维持低温胁迫下的PSII方面发挥了重要作用[15].2015年,第二个番茄叶绿体靶向DnaJ蛋白,SlCDJ2,在转基因西红柿中鉴定出来。研究人员报告说,在热应激之下,过度表达SlCDJ2表现出较高的Rubisco活性、Rubisco大亚基含量和CO2反义植物的同化能力较野生型植物低。结果表明SlCDJ2通过减轻热应激对Rubisco的损伤,促进了其耐热性,而抑制则增强了Rubisco的损伤,减轻了热应激对Rubisco的损伤。
胡椒(辣椒年l.),是一种重要的蔬菜作物,已在世界各地广泛种植[16].辣椒果实是最重要的成分之一的血症是由于一组称为辣椒素的化学类似物[17].虽然已经报道了辣椒蛋白的生物合成途径(苯丙醇型途径和支链脂肪酸途径)[18],调节这些途径的因素尚不清楚。
近年来,植物全基因组测序为识别不同的基因家族提供了机会[19,20.,21,22].在先前的研究中,我们在辣椒基因组中使用生物信息学方法鉴定了总共76个推定的辣椒DNAJ基因(CADNAJ01至CADNAJ76)[23].对CaDnaJ基因家族进行全基因组分析,揭示基因结构、保守基序、染色体定位、独联体在不同组织(根、茎、叶和果皮)和热胁迫条件下的表达谱。很多都与压力有关独联体-元素存在于大多数的启动子区CaDnaJ基因,这表明CaDnaJs可能涉及复杂应力条件的响应过程[23].
本研究选取2个辣椒品系(007ea -刺鼻型和p2 -非刺鼻型),分析辣椒素合成相关因子与CaDnaJ基因的共表达模式。此外,利用qRT-PCR检测了这些CaDnaJ基因对多种胁迫的响应。这些结果将为辣椒DnaJs的功能研究提供一定的参考。
结果
辣椒CaDnaJ基因的系统发育分析
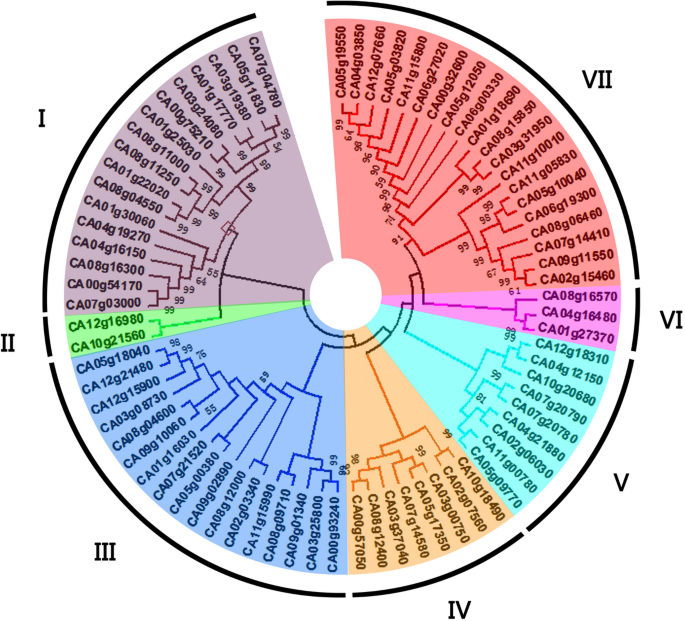
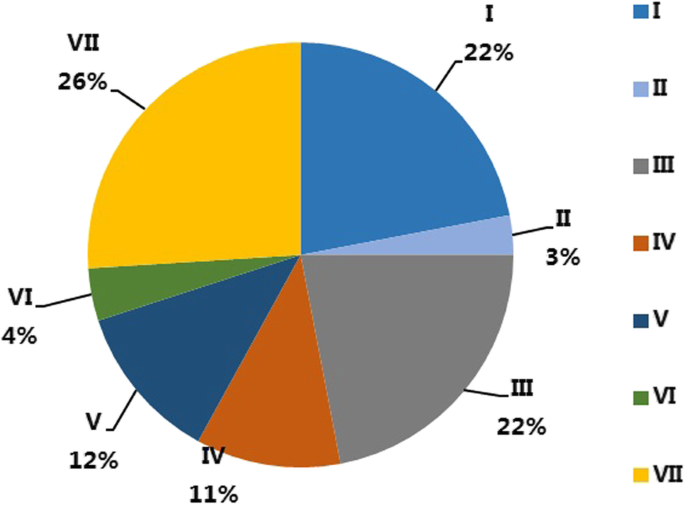
根据76条DnaJ蛋白序列的同源性,将辣椒DnaJ基因家族分为7个亚家族(亚家族I、II、III、IV、V、VI和VII),如图所示。1其中亚科VII(20人)是最大的群体,其次是亚科I(17人)、亚科III(17人)、亚科V(9人)、亚科IV(8人)和亚科VI(3人)。亚科II最小,只有2人CaDnaJ基因构件(图。2).
辣椒CaDnaJ基因表达谱
基于RAN-SEQ和QRT-PCR技术的植物组织/器官特异性表达分析可以提供关于不同组织/器官中基因的功能分化的重要线索[24,25,26,27].为了更详细地比较CaDnaJ在CM334中的表达情况,我们选取CaDnaJ基因的RNA-seq数据进行进一步分析。本研究选取CM334的不同组织,包括根、茎、叶、果皮和胎盘的7个阶段(分别为6 DPA、16 DPA、25 DPA、MG、B、B5、B10)进行表达分析。
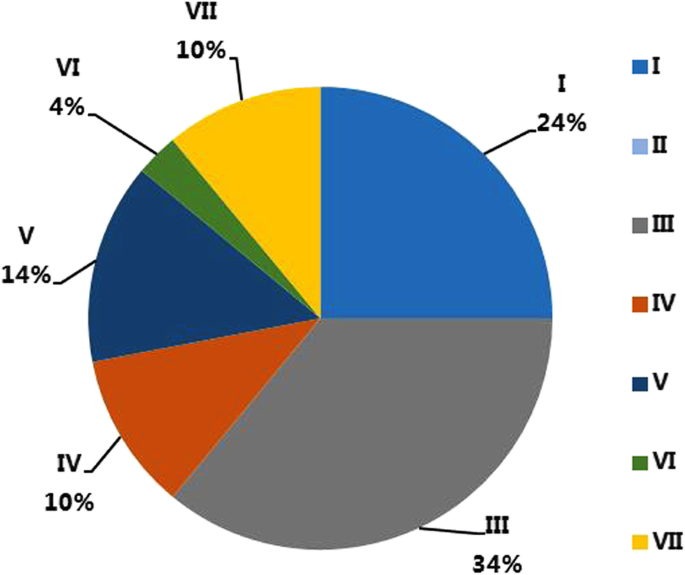
我们发现76个CaDnaJ基因中有29个在至少一个组织中表达([RPKM]≥5.0定义为表达)(补充表2).各亚家族构成分析显示CaDnaJ亚家族在被测组织中的差异表达(表)1).在测试的组织中,亚家族III成员拥有超过34%的表达CaDnaJ(图。3.),虽然它只具有总检测到的CADNAJ的22%(图。2),表明其表达水平较高,并可能在辣椒发育过程中发挥重要作用。相比之下,26%的检测到的CaDnaJs属于VII亚家族(图7)。2),而测试组织中表达的亚家族VII基因在所有分析的组织中仅具有10%(图。3.).有趣的是,在亚家族II成员中发现了一种特殊情况,这两个成员在测试的组织中没有表达(图)。3.,补充表S2).
CaDnaJ基因在不同组织中的表达模式
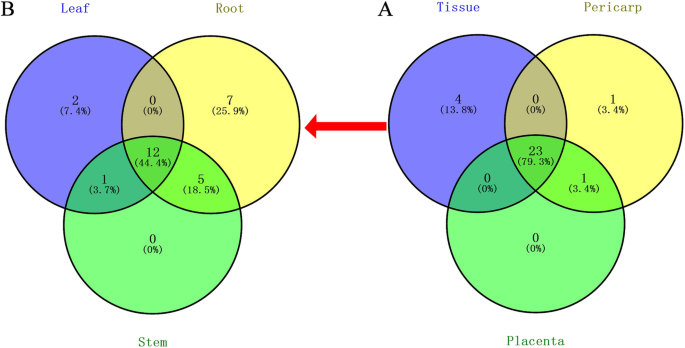
29CaDnaJ选择不同组织中RPKM值大于5.0的基因进行进一步分析(补充表S2).如图1所示4,少量CaDnaJs在被测组织中特异表达,而大多数CaDnaJs在被测组织中特异表达CaDnaJs在两个或多个组织中表达。数据分析表明,具体表达的数量CaDnaJs营养组织(叶、根、茎)的含量高于生殖组织(果皮、胎盘)的含量2).此外,与其他组织相比,更多的CaDnaJ基因在果皮中优先表达。叶片和胎盘具有相同数量的优先表达基因(见表)2).
胎盘中Cadnaj基因的表达模式
对于水果的转录组分析,从开花后6天(DPA),16dPa,25dPa,成熟的绿色(Mg),断路器(B),5天柱,从CM334(刺鼻)植物中收获PericaRP和胎盘。- 破坏(B5)和B10。在ECW30R(非刺激性)植物中,在6dPA,13dPa,20dPa,Mg,B,B5和B10阶段收获胎盘[16].揭示DNAJ的表达是否参与辣椒素的合成,CM334和ECW30R用于研究表达模式CaDnaJ在胎盘基因。RNA-seq数据的比较分析显示,在表达的29个CaDnaJs中,有8个基因(来自III亚家族的CaDnaJ25、47和56,来自IV亚家族的CaDnaJ10、40和74,来自V亚家族的CaDnaJ70和来自VII亚家族的CaDnaJ46)在CM334和ECW中表达谱不同(补充图S)1).
在CM334中,CaDnaJ10、25和40的表达在MG期前逐渐升高,随后保持高表达,而CaDnaJ47和70在胎盘发育过程中保持稳定。特别是CaDnaJ46在B期之前几乎没有表达,在B期后期急剧增加。CaDnaJ56的表达在早期显著下调并保持稳定(补充图S)1).
在ECW中,CaDnaJ25、47和74的表达在胎盘发育早期逐渐升高,随后保持低表达。CaDnaJ40、46和74在ECW中的表达随着胎盘的发育而逐渐增加。相反,CaDnaJ70的表达随着胎盘的发育而下调,在B10中几乎不表达。此外,CaDnaJ10和56在全胎盘发育阶段的表达基本保持稳定(补充图S)1).
CADNAJ47,56和70的CM334中的表达高于胎盘的整体发育过程中ECW的表达,而CADNAJ10和25仅在MG的阶段显示出较高的表达。相反,CADNAJ40和46的表达在CM334中低于胎盘整体发育过程中的ECW中的表达。
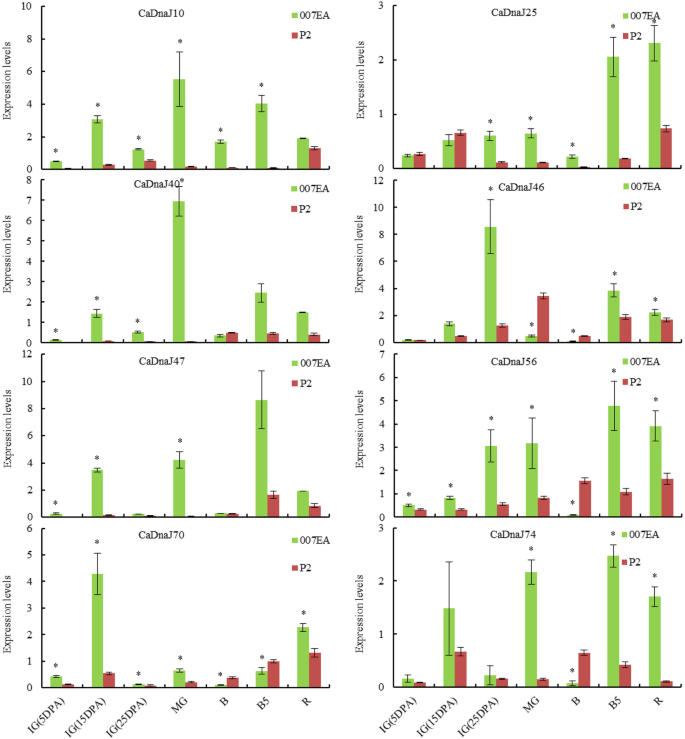
为了进一步验证8个CaDnaJ基因在非刺鼻辣椒品种中的表达情况,本研究以不同胎盘发育阶段的辣椒P2(非刺鼻辣椒)和007EA(刺鼻辣椒)为材料,通过qRT-PCR检测其表达情况。如图所示。5, 8个CaDnaJ基因均表现出不同的表达谱。在P2和007EA中,8个CaDnaJs中的6个基因(CaDnaJ10、25、56、70、47和74)的表达与CM334和ECW的RNA-seq数据基本一致。详细分析发现CaDnaJ10、25、40和47在胎盘不同发育阶段表达上调。CaDnaJ56、CaDnaJ70、CaDnaJ74在B期表达下调,其余6期表达上调。相反,在P2和007EA中,CaDnaJ40表达与CM334和ECW表达结果相反。
8 . The relative expressions ofCaDnaJ胎盘中的基因在007EA(刺鼻)和P2(非刺激)上的7种不同的发育阶段。这些表达水平CaDnaJ使用QRT-PCR测试S。Ig(5DPA),未成熟的绿色水果(后5天后);Ig(15dpa),未成熟的绿色果汁(3后15天);IG (25DPA),未成熟的青果(花期后25天);MG:成熟的青果;B,断路器的水果;B5:断路器+ 5个水果;R,成熟的红色水果。QRT-QPCR在水果样品的不同发展阶段进行三个生物学复制。条形图表示三个生物重复计算的标准差(±SD)。 Statistically significant differences are indicated p < 0.05 by star (*) (Student’s t-test)
CADNAJS与胎盘发育过程中含有辣椒素合成的基因共表达
具体规定CaDnaJs在胎盘发展阶段促使我们检查是否CaDnaJs与辣椒素合成相关的基因共同表达。此前,已经确定了9个辣椒素生物合成基因(CBGs) [16].在本研究中,基于RNA-seq分析了这9个基因在胎盘发育过程中的表达模式(补充图S)2).结果表明,在未成熟的绿色果实(5dpa,15dpa和25dpa)中与辣椒素合成相关的所有基因的表达水平高于成熟的红色果实(破裂,断裂+ 5和红色果实)。在这九个基因中,007EA(高刺激性)的三种基因(PAL1,BCAT和C4H)的表达低于P2(非刺激性)的表达,其与胎盘发育阶段的辣椒素积累无关。为了卡斯和法达结果发现,在15DPA, P2中这两个基因的表达量高于007EA;而在果实中则低于25DPA。这两个基因(KAS和FatA)可能与CaDnaJs(25 DPA)(补充图S1).其余4个基因(ACL、COMT、AMT和CS)在007EA中的表达均高于P2,这与P2的表达水平一致CaDnaJs(补充图年代1).总的来说,通过检查辣椒基因组中的这9个基因的组织特异性表达谱,表明6个基因似乎与辣椒基因共同表达CaDnaJs在胎盘发育。
CADNAJ基因的表达模式响应不同种类的压力条件
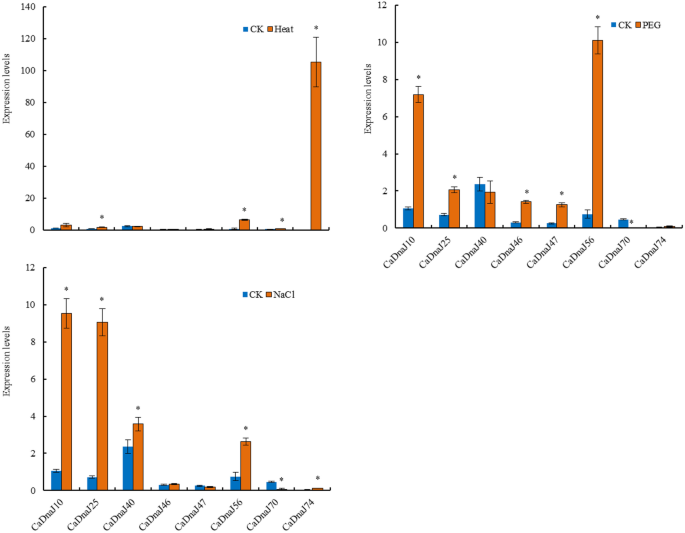
盐、热和聚乙二醇(PEG)等非生物胁迫对植物的生长和生理过程产生不利影响[28,29,30.,31,32,33,34,35,36,37,38,39].本研究进一步研究了8个与刺鼻相关化合物生物合成相关的CaDnaJ基因在不同非生物胁迫下的表达模式,探讨它们在胁迫耐受性中的潜在作用。利用qPCR分析了8个CaDnaJs对热、聚乙二醇和盐胁迫条件的响应。结果表明,这8个基因分别受热、聚乙二醇和盐的调控(图。6).CaDnaJ74在高温胁迫下表达量大幅上调,提示CaDnaJ74可能参与了植物对高温胁迫的响应过程。在干旱胁迫下,8个CaDnaJ基因的表达发生了明显的变化。结果表明,8个基因中有5个基因(CaDnaJ10、25、46、47和56)表达CaDnaJs显着上调。相比之下,CADNAJ70被下调。结果意味着这些CADNAJS可能会参与干旱应激反应。与干旱胁迫下的表达水平相比,在盐胁迫期间仅对CADNAJ70和74进行了下调。
激素处理下CaDnaJ基因的表达模式
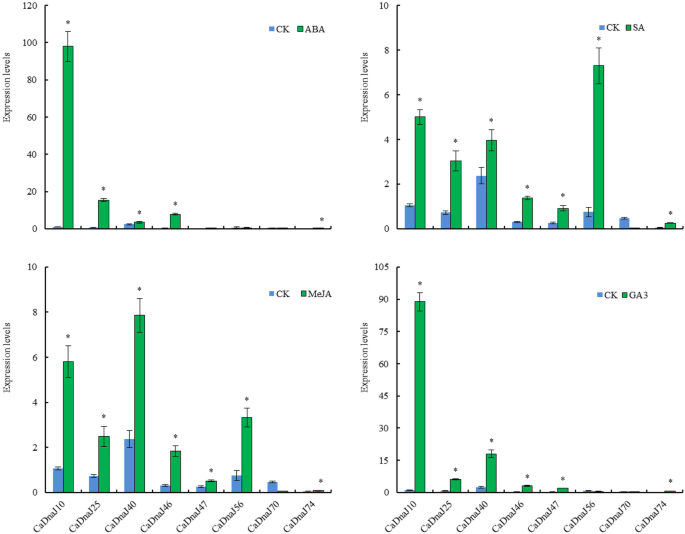
植物激素调节植物生长和发育的多个方面,并调节环境反应,以确保一个成功的生命周期[27,40,41,42,43,44,45,46,47].在这项研究中,为了探讨CADNAJ基因的作用,响应激素治疗,幼苗在6-8岁时的真实叶子的幼苗受到脱盐酸(ABA),GA3.,茉莉酸甲酯(MeJA)和水杨酸(SA)处理(图。7).对于ABA处理,显着上调四个基因(CADNAJ10,25,40和46)(图。7).对遗传算法3.处理后,除CaDnaJ56和70基因外,CaDnaJ10、25、40、46、47和74基因均上调。MeJA和SA处理均诱导了7个基因(CaDnaJ10、25、40、46、47、56和74)的上调。相反,CaDnaJ70在所有激素处理中均下调(图2)。7).我们的结果表明这8个CaDnaJ基因是由这些激素处理诱导的。
讨论
由于其富含辣椒素,养分和水果中的颜料,辣椒已成为番茄后世界上最受欢迎的蔬菜[48,49].最近,在Pepper中鉴定了DNAJ蛋白,普遍存在地参与各种植物生长和发育过程[23].本研究对76个辣椒DnaJ基因的表达谱进行了详细分析。我们的结果显示,大约38%(29)的CaDnaJs在至少一个组织中表达(补充表S2),表明CADNAJS在辣椒植物生长和发育中的潜在关键作用。对这29个CADNAJ的进一步分析显示,5,6和3个CADNAJ分别在叶,根和茎中高度表达,表明辣椒植物生长阶段的基本功能(补充表S2;表格2).此外,我们还发现,10和5 Cadnajs分别在果皮和胎盘中高度表达,表明这些基因在胡椒生殖生长阶段的保护作用(补充表S.2;表格2).部分CaDnaJ基因的表达具有组织特异性。CaDnaJ27和66在叶片中特异表达。CaDnaJ 07、10、13、44、45、46和74 7个基因在根中特异表达。cadnaj04在果皮中特异表达。这些结果表明,这些基因可能与这些特定组织的生长发育调控有关。
辣椒的刺激性归因于一组称为辣椒素的化合物,仅在胡椒果上积累的独特生物碱。这些化合物在食品,化妆品和制药行业方面变得越来越重要。辣椒素通常在辣椒内部的白色部件中发现,称为胎盘。目前,辣椒化合物生物合成途径,包括关键CBG和相关转录因子(TFS),如ERF.,Jerf和CaMYB31,在很大程度上阐明了[50,51].为了分析DnaJ基因表达谱与辣椒素合成的关系,我们将9个参与辣椒素合成的基因(Pal1, BCAT, C4H, KAS, ACL, COMT, FatA, AMT和CS)在刺鼻辣椒(007EA)和非刺鼻辣椒(P2)中选择[16].其中,我们发现六个基因(KAS,FATA,ACL,COMT,AMT和CS)基因在P2中的表达量高于007EA (5DPA、15DPA和25DPA),这与8个基因的表达量一致CaDnaJs在胎盘发育。Co-expression模式之间CaDnaJs发现与辣椒素合成相关的基因,这意味着这些CaDnaJs基因可能参与辣椒中辣椒素合成的调节。
通常,了解每个基因的功能方式和位置需要详细的时空基因表达模式知识[43,52,53]以及对各种非生物压力的反应[54,55,56,57].辣椒水果中辣椒素的生物合成和积累受各种内部和环境因素的影响[58],包括吲哚乙酸(IAA)、茉莉酸(JA)、水杨酸(SA)、赤霉素(GA)等植物激素,以及温度、光照、伤害和干旱等胁迫条件。此外,环境对辣椒产量和辣椒素产量的影响可能因辣椒基因型的不同而不同。此前对7个杂交辣椒品种和2个商品辣椒品种的研究证实,辣椒素产量的大部分变异(67.7%)来自环境条件,而基因型的变异仅占42.4% [50,59].相反,Tripodi等人[60.]的报告指出,在两个不同的土壤气候条件下栽培的14种辣椒品种中,环境对辣椒素含量的贡献率不到0.5%。
在我们的研究中,八CaDnaJ选择具有与CM334(刺鼻)和ECW(非刺激性)的胎盘相似的表达模式的基因(CADNAJ10,25,40,46,47,56,70和74),以研究辣椒反应中的潜在作用各种非生物胁迫和激素。这八个的表达水平CaDnaJ通过QRT-PCR测定热量,干旱和盐下的基因(图。6).一些研究人员表明,在低和中等血型品种的有限供水下,辣椒素产量得到改善[61.].与此相反,在干旱条件下辣椒素产量减少或没有变化[59,62.].我们的数据表明,干旱条件对这8个基因表达的影响大于其他两种非生物胁迫。8个基因中的6个基因的表达CaDnaJs响应干旱胁迫显着增加。仅两种基因(CADNAJ40和CADNAJ70)的表达水平略微降低。结果支持以前的研究,即辣椒素的合成对水胁迫敏感。
在以往的研究中,有SA, IAA和GA的报道3.处理促进了三个辣椒素结构基因的表达,CaMYB31,卡斯, 和PAMT.,而JA治疗引起其表达的显着降低,除了曝光3小时外[50].在我们的研究中,QRT-PCR分析表明,在包括ABA,GA包括ABA的4种不同的激素治疗后,将这八种Cadanj基因的表达占调高或下调3.,meja和sa(图。7).然而,与ABA、GA相比,我们没有观察到MeJA对这8个CaDanJ基因表达的拮抗作用3.和SA。这一现象支持了辣椒的辛辣程度是由不同的植物激素正或负调节的事实。植物激素的浓度和暴露时间对其刺激性程度有很大影响。
结论
在我们的研究中,76个基因组的鉴定和表达分析CaDnaJS在全基因组水平上进行。八DnaJ参与胶囊素体的调节的基因通过这些Cadnaj基因和CBG的共表达模式证实了。此外,通过各种非生物胁迫(热,干旱和盐)和植物激素(ABA,GA3,Meja和SA)诱导这八种基因,这揭示了环境因素在与血症相关的化合物的生物合成中的影响。这些结果提供了可以促进胡椒进一步功能分析的新信息CaDnaJ年代。
方法
数据源
从辣椒基因组数据库下载的胡椒基因组序列(PGD,http://peppergenome.snu.ac.kr/)[16].
系统发育分析
来自76个Cadnaj成员的全氨基酸序列Capsicum Annuum.CM334通过ClustalX程序进行对齐。系统发育树使用MEGA5.10软件构建[63.].邻居加入方法,一对明智删除和泊松模型与动力发育的自举(1000重复)试验使用。基于多序列对准和其他四种物种中DNAJ基因的分类,将胡椒菌CADNAJ基因分配给不同的组。
辣椒DnaJ在不同组织中的表达分析
RNA-SEQ数据已被以前的研究人员透露[16的表达模式CaDnaJ6周大的CM334植物的根、茎和叶中的基因。
的RPKM(每千碱基读取每百万映射读取)值CaDnaJ基因是标志2-转化的[64.].基于表达水平和图案,基因定义为表达,特别表达并根据Cheng等人的分类标准表达。[65.].
植物生长和胁迫处理
实验室提供的2个自交系P2(无刺激性)和007EA(有刺激性)在浙江省农业科学院温室栽培。从P2和007EA植物中采集胎盘,研究其表达模式CaDnaJ不同发育阶段的基因,包括未成熟的绿色水果(5dpa,15dpa和25dpa),成熟的绿色水果,破碎器水果,破碎机+ 5个水果和成熟的红色水果。
对于激素处理,使用10%次氯酸溶液对辣椒007ea进行灭菌5分钟的种子。在生长室中,在生长室中的塑料盆中播种发芽的种子,在26℃/ 19°C下在16-H光周期下播出16-H光周期,直至达到6-8岁的叶子。随后,用100μm甲基己酸酯(Meja),100μmGibberellin喷洒幼苗(Ga3.),在以后4小时收集100μM脱落酸(ABA),1000μM水杨酸(SA)溶液。
辣椒掉的幼苗。将007ea为每种植物灌溉200ml 50ml 50mM NaCl溶液,用于盐应激,200ml 18%PEG用于干旱胁迫处理。对于热应激处理,通过放置在光培养箱中用42℃处理植物,并使用在25℃下生长的植物作为对照组。所有治疗的叶子以后被取样进行4小时。
荷尔蒙治疗样本的三种生物学复制(Meja,Ga3.以浙江农业科学院(Hangzhou, China)温室栽培的辣椒007EA为材料,采集了辣椒007EA (ABA和SA)和非生物胁迫处理(42°C和Nacl)。每个生物复制包含5个个体。我们从每个个体中收集了五片叶子,并将它们混合在一起作为一个生物复制。采集标本后立即用液氮冷冻,提取总RNA。
总RNA提取,逆转录和QRT-PCR分析
使用Total RNA kit和FastQuant RT kit(天根生物技术,北京,中国),按照生产商的方案进行总RNA提取和反转录。
采用ABI StepOne Plus Real-time PCR系统进行定量RT-PCR分析。按照SYBR qPCR Master Mix (Vazyme Biotech co., Ltd., Nanjing, China)说明书操作。循环条件为94°C 5 min,然后94°C 30s, 55°C 30s, 72°C延伸30s 33个循环。的无论在哪里基因被用作内部控制[66.].用于扩增的基因特异性引物列于附录表S1.计算CaDnaJ基因的表达量-△ct方法。
统计分析
所有实验都进行了3次生物重复,每个处理收集5株植物进行分析。所有数据采用SPSS软件进行统计分析(https://www.ibm.com/analytics/spss-statistics-software),采用0.05显著性水平的学生t检验。
数据和材料的可用性
目前研究中使用的所有数据都包含在本发布的文章中,或者可从合理的请求上获得相应的作者。
缩写
- 阿坝:
-
脱盐酸
- B:
-
断路器
- B5:
-
5天post-breaker
- cbre:
-
Capsaicinoid-biosynthetic基因
- DPA:
-
黄色假期
- 遗传算法3.:
-
赤霉素
- 国际宇航科学院:
-
吲哚乙酸
- JA:
-
茉莉酸
- Meja:
-
茉莉酸甲酯
- MG:
-
成熟的绿色
- RPKM:
-
每千碱基读取每百万映射读取
- SA:
-
水杨酸
- TFs:
-
转录因子
参考文献
- 1.
王志强,王志强,王志强,等大肠杆菌DnaJ基因产品。Mol Gen Genet。1980年; 178:583-8。
- 2.
Bukau B, Horwich AL. Hsp70和Hsp60伴侣机。细胞。1998;92:351 - 66。
- 3.
Caplan AJ, Cyr DM, Douglas MG。真核的同系物大肠杆菌DnaJ:与Hsp70应激蛋白共同作用的多种蛋白家族。生物医学杂志1993;4:555-63。
- 4.
Craig Ea,Huang P,Aron R,Andrew A. J-Proteins的不同角色,迫使HSP70共伴侣。Rev Physiol Biochem pharmacol。2006; 156:1-21。
- 5.
银色PA,Way JC。真核DNAJ同源物和HSP70活性的特异性。细胞。1993; 74:5-6。
- 6。
Cheetham Me,Caplan AJ。DNAJ的结构,功能和演化:伴随伴侣功能的保护与调整。细胞应激伴侣。1998年; 3(1):28-36。
- 7。
Ohtsuka K,Hata M.哺乳动物HSP40 / DNAJ同源物:新型CDNA的克隆以及他们分类和命名的提案。细胞应激伴侣。2000; 5:98-112。
- 8。
邢颖,张强。水稻产量的遗传和分子基础研究。植物学报2010;61:421-42。
- 9.
ARC6是一个j域质体分裂蛋白,是蓝藻细胞分裂蛋白Ftn2的进化后代。植物细胞。2003;15:1918-33。
- 10.
Chen KM, Holmström M, Raksajit W, Suorsa M, piipo M, Aro EM.小叶绿体靶向DnaJ蛋白参与光合作用的优化拟南芥蒂利亚纳.BMC植物BIOL。2010; 10(1):43。
- 11.
王永文,陈思明,王文军,黄晓强,周长发,庄志,等。dnaj样锌指结构域蛋白PSA2影响植物的光适应和叶绿体发育拟南芥蒂利亚纳.植物科学学报2016;
- 12.
朱旭,梁松,尹建,袁超,王军,李伟,等。DnaJ OsDjA7/8在水稻叶绿体发育中起重要作用(奥雅萨苜蓿).基因。2015;574(1):11-9。
- 13.
Rajan VB,D'Silva P.拟南芥蒂利亚纳J级热休克蛋白:细胞应激传感器。Funct综合基因组学。2009; 9:433-46。
- 14.
王志强,王志强,王志强,等。一种新的线粒体DnaJ/Hsp40家族蛋白BIL2通过油菜素内酯信号转导促进植物生长和抵抗环境胁迫。足底。2013;237(6):1509 - 25所示。
- 15.
孔F,邓Y,周B,王G,王Y,萌Q.叶绿体靶向DNAJ蛋白有助于在寒冷胁迫下的照相型II的维护。J Exp Bot。2014; 65(1):143-58。
- 16.
Kim S, Park M, Yeom SI, Kim YM, Lee JM, Lee HA,等。辣椒的基因组序列为辣椒的辛辣性进化提供了深刻的见解辣椒物种。Nat麝猫。2014;46:270-8。
- 17。
贝内特DJ,柯比GW。辣椒素的构成和生物合成。J Chem SoC C. 1968:442-6。
- 18。
Aza-gonzálezc,núñez-palenius hg,Ochoa-alejo n。辣椒(Capsicum spp)的辣椒生物合成的分子生物学。植物细胞代表2011; 30(5):695-706。
- 19。
陈美美,李凯,李丕平,宋翠萍,苗永昌。谷胱甘肽过氧化物酶基因家族gossypium hirsutum:全基因组鉴定,分类,基因表达和功能分析。SCI REP。2017; 7:44743。
- 20。
郭玉文,郭海林,李旭,黄丽丽,张邦宁,庞晓波,等。虎杖的两种III型聚酮合成酶:基因结构、进化途径和代谢产物。生物技术学报2013;7(3):371-81。
- 21。
Lu T,张G,Sun L,Wang J,Hao F. CBL系列的基因组鉴定CBLS响应棉花缺乏钾的缺乏率。Peer J. 2017; 5:E3653。
- 22.
孙Q,王GH,张X,张XR,乔P,Long L等。三种栽培华氏蛋白质物种中的趋势基因家族的基因组鉴定及jaz基因的表达。SCI REP。2017; 7:42418。
- 23.
粉丝F,杨x,程y,kang y,柴x.辣椒(辣椒annum l.)中的Dnaj基因家族:综合识别,表征和表达概况。正面。植物SCI。2017; 8:689。
- 24.
韩宇军,王小华,陈伟伟,董明明,袁文军,刘旭,等。类胡萝卜素相关基因的差异表达决定了植物花瓣中类胡萝卜素颜色的多样性桂花雀族,树遗传学.基因组。2014; 10(2):329-38。
- 25.
韩义,吴米,曹升,元W,东M,王X等。OFWRKY3的表征,一种对CCD4中的类胡萝卜素裂解二恶英酶基因的转录因子桂花雀族.植物mol biol。2016; 91(4-5):485-96。
- 26.
梁建勇,夏建勇,刘丽丽,万树强。陆生植物叶片水平光合作用和呼吸对实验变暖的响应的全球模式植物生态学报,2013;6(6):437-47。
- 27.
赵X,王友,乔克,王家,王立,徐cs等。通过改变细胞溶质钙的拟南芥高强度蓝光诱导的高强度蓝光诱导的低诱导的低强度诱导的备用光学素。植物理性。2013; 162(3):1539-51。
- 28.
高伟,徐福成,郭丹东,赵建荣,刘杰,郭玉伟,等。棉花中钙依赖蛋白激酶:植物对盐胁迫早期反应的洞察。BMC Plant biology . 2018;18(1):15。
- 29。
李伟,赵芳,方伟,席东东,侯军,杨旭,等。陆地棉幼苗根系早期盐胁迫响应蛋白的鉴定(gossypium hirsutum采用基于itraq的蛋白质组学技术。植物学报。2015;11(6):732。
- 30。
Lü D, Wang W, Miao C. ATHK1通过调节拟南芥保卫细胞钙通道活性介导ABA信号通路。科学通报。2013;58(3):336-43。
- 31。
马晓宁,张晓荣,杨玲,唐明敏,王凯,王玲,等。过氧化氢在perk4介导的脱落酸调控拟南芥根系生长中发挥重要作用。植物生态学报。2018;46(2):165-74。
- 32。
齐军,宋长平,王斌,周军,Kangasjärvi J,朱建军,等。活性氧的信号转导和气孔运动对干旱胁迫和病原菌攻击的响应。植物学报,2018;60(9):805-26。
- 33。
王pt,刘h,华hj,王l,歌曲cp。液泡局部β-葡糖苷酶有助于拟南芥的耐旱性。Chin Sci Bull。2011; 2011(56):3538-46。
- 34.
徐立,王怀,郭继杰,秦吉,史迪克,李英等。锌通过增加反应性氧物种清除并降低小麦幼苗的积累来提高耐盐性。Biol platarum。2014; 58(4):751-7。
- 35.
张军,王飞,张超,张杰,陈勇,刘刚,等。棉花种子农业接种的新型VIGS方法及其在阐明GhBI-1在盐胁迫反应中的应用。植物学报2018;37(8):1091-100。
- 36.
赵强,陈伟,边建,谢辉,李勇,徐超,等。菠菜热应激反应机制的蛋白质组学和磷蛋白质组学。植物学报。2018;9:800。
- 37.
马丽,张浩,孙丽,张刚,苗超,等。NADPH氧化酶AtrbohD和AtrbohF在ros依赖的Na调控中的作用+/ K+盐胁迫下拟南芥的稳态。中国生物医学工程学报。2012;63(1):305-17。
- 38.
赵旭,王玉杰,王玉玲,王小林,张欣2+通过H2O2-blocked na.+韦西亚防护细胞中的流入。J植物理性。2011; 168(9):903-10。
- 39.
赵旭,李媛媛,肖海林,徐春生,张旭。一氧化氮阻断蓝光诱导的K(+)通过提高胞质钙2+浓度蚕豆根尖L保卫细胞。acta botanica yunnanica(云南植物研究). 2013;55(6):527-36。
- 40。
Hao F,Zhao S,Dong H,张H,Sun L,Miao C.nia1和NIA2参与了外源水杨酸诱导的一氧化氮产生和拟南芥气孔闭合。J Intent Plant Biol。2010; 52(3):298-307。
- 41。
Li K, Yang FB, Miao YC, Song CP. aba信号通路参与调控丝裂原活化蛋白激酶级联模块AIK1-MKK5-MPK6。BMC Plant Biol. 2017;12:5。
- 42。
李磊,侯明杰,曹磊,夏勇,沈志刚,华志斌。谷胱甘肽s -转移酶调节铜耐受性奥雅萨苜蓿.Environ Exp Bot。2018A; 155:313-20。
- 43。
acta opica sinica, 2011, 31 (3): 361 - 364 . acta opica sinica, 2011, 31(3): 361 - 364。植物学报,2018b;60(1): 16-33。
- 44。
刘丽,李恩,姚明,萌SS,歌曲cp。ABA响应蛋白家庭在ABA和应激信号转导的功能分析。Chin Sci Bull。2013; 58:3721-30。
- 45。
宋y,xiang f,张g,miao y,miao c,歌曲cp。作为多种生理过程的内部积分器的脱落酸调节叶片衰老发作拟南芥蒂利亚纳.前植物SCI。2016; 19(7):181。
- 46.
小王K,他约,赵Y,吴T,周XF,丁YL、et al。EAR1通过增强2C蛋白磷酸酶活性负调控ABA信号。植物细胞。2018;30:815-34。
- 47.
张刚,卢涛,苗伟,孙磊,田敏,王军,等。棉ABA受体PYL家族全基因组鉴定及在ABA和渗透胁迫下PYL的表达分析同行j . 2017; 5: e4126。
- 48.
Benson Gas,Obadofin AA,Adesina JM。植物提取物控制辣椒虫害的植物提取物(caspicum.spp。)在尼日利亚湿雨林。纽约SCI J. 2014; 7(1):39-43。
- 49.
天股,卢,锣··苏,穆罕默德 - 莎娜。干旱胁迫对果实发育过程中辣椒素的影响,辣椒成熟(Capsicum Annuum.l .)。农业水资源管理。2014;137:46-51。
- 50.
Arce-Rodríguez ML, Ochoa-Alejo N.一种R2R3-MYB转录因子调节辣椒素生物合成。植物杂志。2017;174:1359 - 70。
- 51.
朱血,太阳别,蔡武,周X,毛耶,陈CJ等。MYB转录因子的自然变化MYB31确定极端辛辣的辣椒的进化过程。新植醇。2019;223(2):922 - 38。
- 52。
Pang YQ,李杰特,齐BS,天M,Sun LR,Wang XC等。Aquaporin attip5; 1作为赤霉素的必要目标促进下胚轴细胞伸长率拟南芥蒂利亚纳在过量硼应力下。植物生态学报。2017;45(3):305-14。
- 53。
关键词:拟南芥,ROP2, AtrbohD,水淹反应植物信号行为。2018;13(9):1-5。
- 54。
郭胜,戴胜,辛格PK,王辉,王勇,谭建华,等。膜结合的nna样转录因子OsNTL5抑制植物的开花奥雅萨苜蓿.植物学报。2018;9:555。
- 55。
吕顺福,于大勇,孙qq,蒋军。nacl胁迫下拟南芥幼苗生长对生长素依赖性根和根毛生长的影响。植物生长规律。2018;84:225-36。
- 56。
尚博生,臧艳华,赵旭,朱东东,范超,郭新宁,等。GhPHOT2在叶绿体避毒中的功能特性gossypium hirsutum.植物生理生化。2019;135:51-60。
- 57。
徐春春,刘海林,徐永元,赵旭升,郭永文,龙龙,等。棉花R2R3-MYB转录因子GbMYB60的异质性表达增加了转基因拟南芥的盐敏感性。Plant Cell Tiss Org Cult. 2018; 133:15-25。
- 58.
陈志强,陈志强,陈志强,等。环境对辣椒素积累的影响辣椒spp。HortSci。2011; 46:1576 - 81。
- 59.
Jeeatid N, Suriharn B, Techawongstien S, Chanthai S, Bosland PW, Techawongstien S.辣椒杂交种基因型与环境互作对辣椒素生产的影响(辣椒JACQ。)在受控环境下。SCI Hortic。2018; 235:334-9。
- 60.
Tripodi P,Cardi T,Bianchi G,Migliori Ca,Schiavi M,Rotino GL,等。辣椒品种产量性能和生物活性化合物含量的遗传和环境因素(Capsicum Annuum.)种植于意大利两个截然不同的地方。Eur Food Res Technol. 2018; 244:1555-67。
- 61.
关键词:辣椒,苯丙氨酸,氨解酶,肉桂-4-羟化酶,辣椒素合成酶,过氧化物酶辣椒干旱胁迫下。中国农业科学(英文版)。
- 62.
黄志强,王志强,王志强,等。油菜素内酯及其合成油菜素内酯对辣椒生长的影响。植物学报。2018;40:106。
- 63.
田ura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然、进化距离和最大简约法的分子进化遗传学分析。生物化学学报2011;28:2731-9。
- 64。
魏开峰,陈杰,陈玉峰,吴丽娟,谢小东。玉米WRKY转录因子家族的分子系统发育及表达分析DNA研究》2012;19:153 - 64。
- 65。
程勇,Ahammed GJ,于建华,姚志平,阮美美,叶启杰,等。通过对辣椒WRKY基因家族的详细表达分析,推测WRKY与调控果实成熟有关。Sci众议员2016;6:39000。
- 66。
万华军,袁伟,阮明明,叶启军,王仁强,李志明,等。辣椒反转录实时荧光定量PCR内参基因的鉴定(Capsicum Annuum.l .)。Biochem Biophys Res Communce。2011; 416:24-30。
确认
不适用。
资金
本研究由广东省现代农业产业技术创新团队专项基金(No. 2019KJ122)、浙江省自然科学基金项目(No. LY18C150008)、国家自然科学基金项目(No. 31872090)、国家重点研发计划项目(No. 2017YFD0101902)资助。广东省现代农业产业技术体系建设,浙江省有害生物防控国家重点实验室培育基地(No. 2010DS700124-ZZ1807),中国农业科研体系专项资金(CARS-23-G44),浙江省农业科技重大专项新品种选育项目(2016C02051)资助方不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
隶属关系
贡献
FF,FL在本研究中进行并分析了大部分实验,XY提供了援助,提供了本研究设计中的所有财务支持和批判性智力投入和稿件的准备。HW和YK设计了这项研究并写了稿件。所有作者讨论了结果并对稿件评论。作者阅读并批准了最终手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1
本研究用于qRT-PCR的引物。表S2每百万百万次映射(FPKM)的每千次映射的片段(FPKM)的不同辣椒组织中的所有Cadnajs的值。补充图S18 . The relative expressions ofCaDnaJ基于RNA-seq数据的胎盘CM334(刺激性)和ECW(非刺激性)基因。6DPA,花期后6天;16 DPA,花期后16天;25 DPA,花期后25天;毫克,成熟的绿色;B5, 5天后断路器;B10,后10天。补充图S2辣椒素生物合成基因CM334(刺激性)和ECW(非刺激性)在胎盘不同阶段的RNA-Seq数据。IG (6DPA),未成熟的青果(花期后5天);IG (16DPA),未成熟的青果(花期后16天);IG (25DPA),未成熟的青果(花期后25天);MG:成熟的青果;B,断路器的水果;B5:断路器+ 5个水果;R,成熟的红色水果。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
风扇,f.f.,liu,f.,yang,x。et al。成员表达概况的全局分析DnaJ辣椒合成的基因家庭参与辣椒素合成(Capsicum Annuum.L)。BMC植物杂志20,326(2020)。https://doi.org/10.1186/s12870-020-02476-3
已收到:
接受:
发表:
关键字
- DnaJ蛋白质
- 胡椒
- 表达分析
- 系统发生学
- 非生物压力