- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
花期和灌浆期高温胁迫对小麦光合作用、脂质和产量的影响gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba268gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
在繁殖发育阶段,短期的高温胁迫会造成小麦产量的显著损失(gydF4y2Ba小麦gydF4y2Bal .)。在小麦开花期和灌浆期进行了两个独立的试验,定量研究了HT对小麦光合作用、叶片脂质组和产量性状的影响。在实验一中,将基因型Seri82的小麦暴露于最适温度(OT;22/14°C;白天/夜晚)或高温(32/22℃)处理14 d。试验二在籽粒灌浆期分别处理OT和HT 14 d。在高温胁迫下,测定了叶绿素指数、类囊体膜损伤、气孔导度、光合速率和叶片脂质组成。在成熟时,量化了籽粒产量及其构成因素。gydF4y2Ba
结果gydF4y2Ba
花期和灌浆期的HT胁迫降低植株光合速率(分别为17%和25%)和籽粒产量gydF4y2Ba−1gydF4y2Ba(分别为29%和44%),类囊体膜损伤(分别为61%和68%)与各自的对照组(OT)相比。开花或籽粒灌浆期的HT胁迫增加了较少不饱和脂类的摩尔百分比[36:5-单乳糖基二酰基甘油(MGDG)和双乳糖基二酰基甘油(DGDG)]。然而,在灌浆期,HT胁迫降低了更多不饱和脂类的摩尔百分比(36:6- MGDG和DGDG)。光合速率与籽粒产量呈显著正相关gydF4y2Ba−1gydF4y2Ba类囊体膜损伤与光合速率呈负相关。gydF4y2Ba
结论gydF4y2Ba
研究表明,在高温胁迫下,保持类囊体膜的稳定性、结实率和单粒重分别能提高光合速率和产量。gydF4y2Ba
背景gydF4y2Ba
小麦(gydF4y2Ba小麦gydF4y2BaL.)是世界上重要的主食作物之一。研究表明,世界上大多数小麦种植区正经历着温度高于最佳温度的时期,导致粮食产量显著下降[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].此外,警监会[gydF4y2Ba5gydF4y2Ba]预测未来作物将面临短暂的极端温度,这将加剧温度对粮食产量的负面影响[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].与营养期相比,小麦在生殖期对高温敏感[gydF4y2Ba6gydF4y2Ba].小麦繁殖期的最佳温度在15至20℃之间[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].然而,在世界小麦种植区,预计白天高温(> 34°C)的频率将增加[gydF4y2Ba3.gydF4y2Ba].如果HT的发生与小麦的敏感期重合,则会对籽粒产量造成显著的负面影响。对于大田作物,在关键生长阶段温度升高可导致产量减少2.5%至10% [gydF4y2Ba9gydF4y2Ba].在小麦方面,种植季节最低或最高温度升高1°C可使全球小麦产量减少约5.6% [gydF4y2Ba1gydF4y2Ba].在另一项研究中,巴克利等人。gydF4y2Ba2gydF4y2Ba]的研究表明,在生殖阶段,预计温度升高1°C将使粮食产量减少21%。Asseng等人。[gydF4y2Ba3.gydF4y2Ba]的研究结果表明,当前平均温度每升高1°C,全球小麦产量将减少6%,并将随着时间和空间的变化而变得更加多变。因此,选育耐高温小麦基因型对维持小麦产量具有重要意义。gydF4y2Ba
HT胁迫严重影响叶片光合作用,影响植物生长发育[gydF4y2Ba10gydF4y2Ba].在叶绿体内,存在于类囊体膜中的光系统II对HT高度敏感,类囊体膜的损伤会减少光合电子转移、三磷酸腺苷的合成以及光化学反应的改变[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].此外,HT增加活性氧(ROS)的产生,包括超氧自由基(OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba)、过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba),以及脂质过氧化,导致膜损伤加重[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].高温胁迫也可引起类囊体膜肿胀和渗漏[gydF4y2Ba11gydF4y2Ba],导致叶绿素捕光复合体II与光系统II核心复合体的物理分离[gydF4y2Ba13gydF4y2Ba].Ristic等人[gydF4y2Ba14gydF4y2Ba]发现了很强的负相关(gydF4y2BargydF4y2Ba2gydF4y2Ba叶绿素含量与冬小麦类囊体膜损伤的相关性为0.78)。小麦在高温胁迫下光合速率降低是类囊体膜损伤、膜脂组成和细胞器氧化损伤相互作用的结果[gydF4y2Ba11gydF4y2Ba].gydF4y2Ba
膜脂组成和不饱和水平的变化是小麦耐热性的重要机制。改变膜脂不饱和水平是防止膜向非双分子层相转变和维持膜功能和稳定性所必需的[gydF4y2Ba15gydF4y2Ba].对小麦叶片的研究表明,在花期,HT胁迫显著降低了单乳糖酰甘油(MGDG)、磷脂酰甘油(PG)、磷脂酰胆碱(PC)和磷脂酰酸(PA)的总量[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].除此之外,在热敏感和耐热基因型中,高温胁迫降低了较多的不饱和脂质水平,增加了较少的不饱和脂质和饱和脂质水平[gydF4y2Ba12gydF4y2Ba].HT胁迫增加了敏感基因型PC的氧化物种和磷脂酰乙醇胺(PE) [gydF4y2Ba12gydF4y2Ba].在高温胁迫下,多种脂类同时发生变化可能与去饱和酶、氧化酶、糖基化酶和酰化酶活性的增加有关[gydF4y2Ba16gydF4y2Ba].小麦花粉的脂质分析表明,在最佳和高温条件下,34:3和36:6的质体外磷脂[PC, PE,磷脂酰肌醇(PI), PA和磷脂酰丝氨酸(PS)]在脂质组成中占主导地位[gydF4y2Ba17gydF4y2Ba].在高温胁迫下,这些脂质的不饱和水平通过降低18:3酰基链水平和增加16:0、18:0、18:1和18:2酰基链水平而降低[gydF4y2Ba17gydF4y2Ba].HT对叶片脂质的影响是在开花期量化的,而不是在籽粒灌浆期量化的,相对影响没有量化。在本研究中,我们利用电喷雾电离串联质谱(ESI-MS/MS)方法定量分析了高温胁迫下叶片脂质分子在开花和籽粒灌浆阶段的广泛分布。gydF4y2Ba
一般来说,植物产量是植物结构、光合效率、繁殖成功率和碳水化合物向籽粒分配的函数,这些组成部分都以不同的方式易受HT的影响[gydF4y2Ba18gydF4y2Ba].在小麦中,花期HT通过影响花粉和雌蕊的形态和功能而降低小花育性[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].花粉形态异常包括萎缩干燥、深孔、外壁粗糙、柱头脱落等。同样,花柱、柱头和子房干燥松弛,附着在柱头上的花粉粒较少[gydF4y2Ba20.gydF4y2Ba].在小麦中,HT会损害活力,导致施肥不良[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].同样,HT降低了水稻等主要谷物的繁殖成功率(结实率)(gydF4y2Ba栽培稻gydF4y2Bal .) [gydF4y2Ba23gydF4y2Ba],高粱[gydF4y2Ba高粱二色的gydF4y2Ba(l)Moench] [gydF4y2Ba24gydF4y2Ba]、珍珠小米[gydF4y2Ba狼尾草glaucumgydF4y2Ba(l)r . Br。] [gydF4y2Ba25gydF4y2Ba].小麦灌浆期施HT可通过单粒重降低籽粒产量[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba],与叶片衰老和籽粒灌浆时间缩短有关[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].gydF4y2Ba
本研究旨在量化HT在小麦开花期和灌浆期对光合作用、叶片脂质组和产量相关性状的影响。我们推测,在花期和灌浆期光合作用的减少与脂质和类囊体膜损伤的变化、种子数量和大小的减少导致籽粒产量下降有关。gydF4y2Ba
结果gydF4y2Ba
温度制度对生理性状和产量性状的影响gydF4y2Ba
从实验一(花期高温处理)和实验二(灌浆期高温处理)开始温度处理后0、2、4、6、8和12日记录的各项生理性状的平均数据及其重复(gydF4y2BangydF4y2Ba= 36),得到温度处理的总体效果。同样,在实验一和实验二中记录的产量及其组分的平均值及其各自的重复(gydF4y2BangydF4y2Ba= 20)。gydF4y2Ba
实验一:花期HTgydF4y2Ba
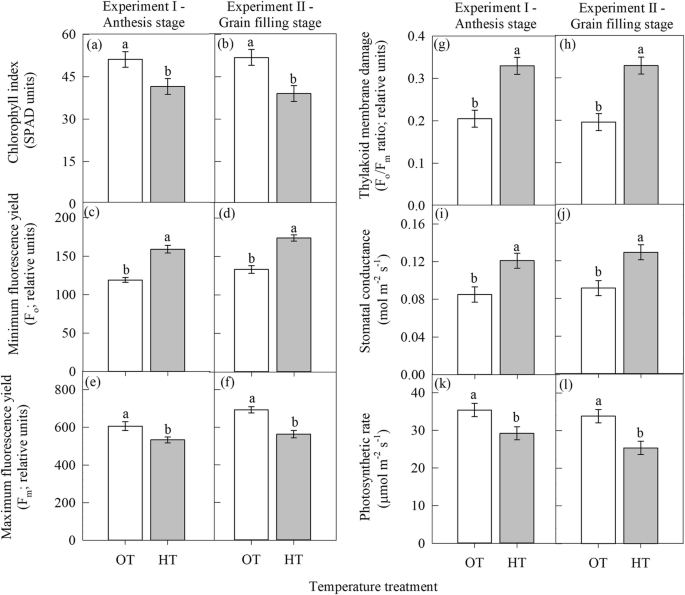
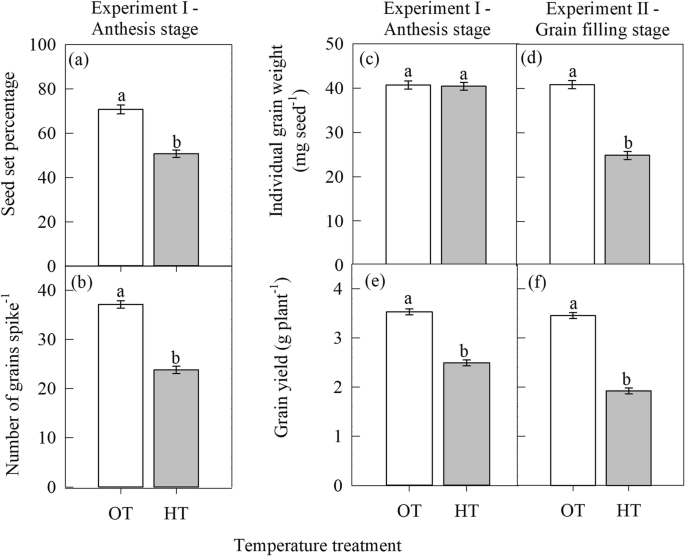
开花期高温胁迫(实验一)显著(gydF4y2BaPgydF4y2Ba≤0.05)使叶绿素指数(SPAD单位)比OT降低19%(图;gydF4y2Ba1gydF4y2Baa).与叶绿素指数一样,最大荧光产率(FgydF4y2Ba米gydF4y2Ba;相对单位)和光合速率(μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)也分别降低了12%和17%,因为与OT相比,HT应力。gydF4y2Ba1gydF4y2Bae和k)。相反,花期HT显著(gydF4y2BaPgydF4y2Ba≤0.05)增加了最小荧光产率(FgydF4y2BaogydF4y2Ba;相对单位)降低34%(图;gydF4y2Ba1gydF4y2Bac),类囊体膜损伤(FgydF4y2BaogydF4y2Ba/ FgydF4y2Ba米gydF4y2Ba比;相对单位)减少61%(图;gydF4y2Ba1gydF4y2Bag),气孔导度降低42%(图;gydF4y2Ba1gydF4y2Bai)比OT。花期温度明显升高(gydF4y2BaPgydF4y2Ba≤0.001)结实率降低28%,粒数出现尖刺gydF4y2Ba−1gydF4y2Ba籽粒产量(g)较OT提高29%(图;gydF4y2Ba2gydF4y2BaA, b, e)。gydF4y2Ba
温度制度[最佳温度(OT: 24/14℃)和高温(HT: 32/22℃)]对叶片生理性状的影响gydF4y2Ba一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba叶绿素指数(SPAD单位)gydF4y2BacgydF4y2Ba而且gydF4y2BadgydF4y2Ba最小荧光产率(FgydF4y2BaogydF4y2Ba;相对单位),gydF4y2BaegydF4y2Ba而且gydF4y2BafgydF4y2Ba最大荧光产率(FgydF4y2Ba米gydF4y2Ba;相对单位),gydF4y2BaggydF4y2Ba而且gydF4y2BahgydF4y2Ba类囊体膜损伤(FgydF4y2BaogydF4y2Ba/ FgydF4y2Ba米gydF4y2Ba比;相对单位),gydF4y2Ba我gydF4y2Ba而且gydF4y2BajgydF4y2Ba气孔导度(mol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba),gydF4y2BakgydF4y2Ba而且gydF4y2BalgydF4y2Ba光合速率(μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)分别在花期(试验一)和灌浆期(试验二)。所示值为LSMEAN±LSMEAN的标准误差[gydF4y2BangydF4y2Ba= 36;3次重复× 6天的测量(治疗拼版后0、2、4、6、8和12天)×重复实验I和II(2)]。相同字母的lsmean估计值在gydF4y2BaPgydF4y2Ba≤0.05gydF4y2Ba
温度制度[最佳温度(OT: 24/14℃)和高温(HT: 32/22℃)]对籽粒产量及其构成因素的影响。gydF4y2Ba一个gydF4y2Ba结实率,gydF4y2BabgydF4y2Ba穗粒数gydF4y2Ba−1gydF4y2Ba,gydF4y2BacgydF4y2Ba而且gydF4y2BadgydF4y2Ba单粒重(毫克种子gydF4y2Ba−1gydF4y2Ba),gydF4y2BaegydF4y2Ba而且gydF4y2BafgydF4y2Ba籽粒产量(株gydF4y2Ba−1gydF4y2Ba)分别在花期(试验一)和灌浆期(试验二)。所示值为LSMEAN±LSMEAN标准误差(gydF4y2BangydF4y2Ba= 20;实验I和实验II(2)重复10次。相同字母的lsmean估计值在gydF4y2BaPgydF4y2Ba≤0.05gydF4y2Ba
实验二:灌浆期高温处理gydF4y2Ba
与实验一类似,灌浆阶段(实验二)的HT应力显著(gydF4y2BaPgydF4y2Ba≤0.05)降低叶绿素指数(25%),最大荧光产率(FgydF4y2Ba米gydF4y2Ba;相对单位)(12%)和光合速率(25%)(图。gydF4y2Ba1gydF4y2Bab, f和l)。然而,HT显著(gydF4y2BaPgydF4y2Ba≤0.05)增加了最小荧光产率(FgydF4y2BaogydF4y2Ba;相对单位)、类囊体膜损伤和气孔导度分别比OT增加了31、68和42%(图2)。gydF4y2Ba1gydF4y2Bad, h, j)。灌浆期高温胁迫显著(gydF4y2BaPgydF4y2Ba≤0.001)降低单粒重(mg种子gydF4y2Ba−1gydF4y2Ba),植株籽粒产量比OT提高了44%(图;gydF4y2Ba2gydF4y2BaD和f)。gydF4y2Ba
温度对脂质组成的影响gydF4y2Ba
实验一:花期HTgydF4y2Ba
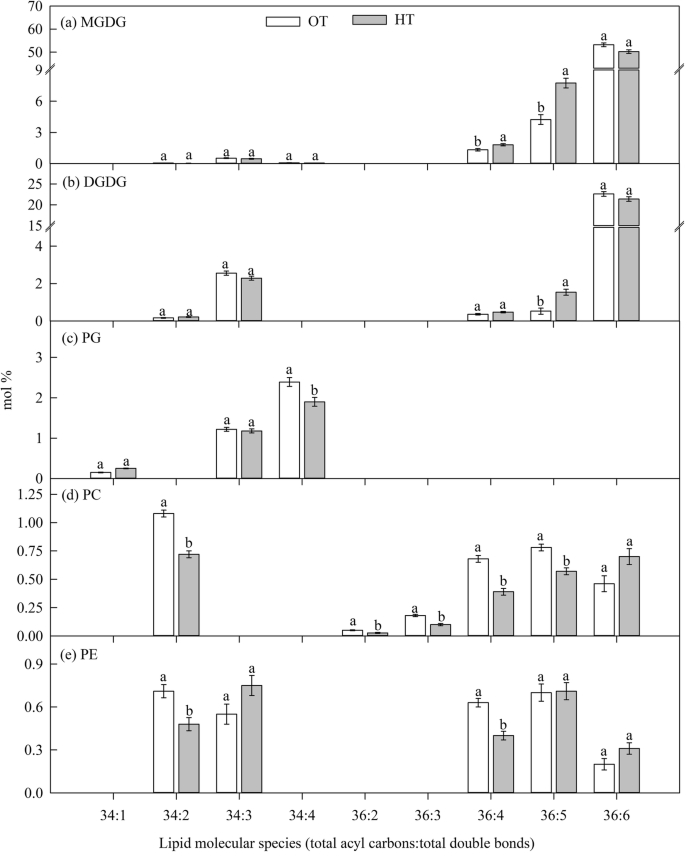
重要的(gydF4y2BaPgydF4y2Ba在花期(实验一),观察HT对总PI摩尔百分比的影响(表1)gydF4y2Ba1gydF4y2Ba).高温应力使总PI的摩尔百分比比OT提高了23%。重要的(gydF4y2BaPgydF4y2Ba≤0.05)由于HT胁迫与OT相比,含有两个多不饱和酰基链的较少不饱和脂类的摩尔百分比增加,如36:5-(18:2/18:3组合)MGDG和双半乳糖二酰基甘油(DGDG)物种。gydF4y2Ba3.gydF4y2Baa, b).相反,34:2-、36:2-、36:3-、36:4-和36:5- PC的摩尔百分比显著降低(gydF4y2BaPgydF4y2Ba与OT相比,HT条件下≤0.05)(图;gydF4y2Ba3.gydF4y2Bad).更多不饱和脂类的比例,即36:6- (di18:3组合)MGDG, DGDG, PC和PE在OT和HT之间没有变化(图6)。gydF4y2Ba3.gydF4y2Baa、b)。gydF4y2Ba
实验二:灌浆期高温处理gydF4y2Ba
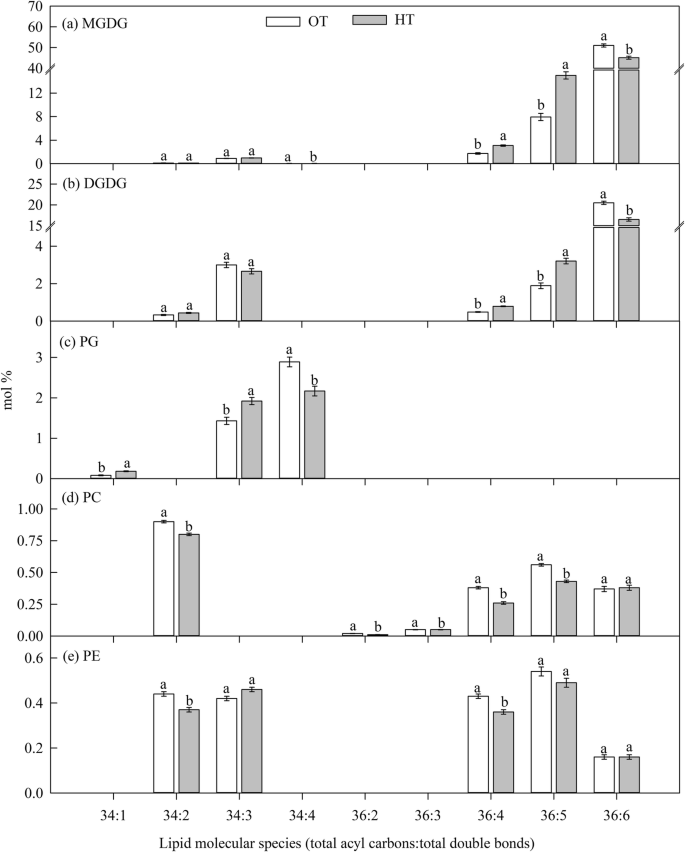
重要的(gydF4y2BaPgydF4y2Ba在灌浆阶段(实验二),观察HT对总MGDG、DGDG和PS的摩尔百分比(表2)的影响gydF4y2Ba1gydF4y2Ba).与OT相比,高温胁迫增加了总- MGDG的摩尔百分比(4%)和PS(57%),并降低了总DGDG的摩尔百分比(10%)(表)gydF4y2Ba1gydF4y2Ba).高温应力显著(gydF4y2BaPgydF4y2Ba≤0.05)降低了含有两个多不饱和酰基链的更多不饱和脂类的摩尔百分比,如36:6- (di18:3组合)MGDG和DGDG物种。gydF4y2Ba4gydF4y2Ba相比之下,与OT相比,HT增加了含有两个多不饱和酰基链的较少不饱和脂类物种的摩尔百分比,如36:5-(18:2/18:3组合)MGDG和DGDG物种或更多饱和脂类物种[含有一个饱和酰基链,即34:1-(18:1/16:0或18:0/16:1组合)PG物种],以及36:4-(18:3/18:1或18:2/18:2组合)MGDG和DGDG物种和34:3 PG(18:3/16:0或18:2/16:1组合)的数量(图2)。gydF4y2Ba4gydF4y2Baa, b, c),但34:4- (18:3/16:1)PG的摩尔百分比显著(gydF4y2BaPgydF4y2Ba≤0.05),HT比OT降低。这些变化表明多不饱和酰基链的摩尔百分比降低(18:3)或饱和酰基链的摩尔百分比增加(16:0)。gydF4y2Ba
温度对脂质不饱和水平的影响gydF4y2Ba
实验一:花期HTgydF4y2Ba
重要的(gydF4y2BaPgydF4y2Ba≤0.05),观察花期温度对塑型脂质和塑外脂质不饱和指数的影响gydF4y2Ba2gydF4y2Ba).高温显著(gydF4y2BaPgydF4y2Ba≤0.05)降低了MGDG和PG的不饱和水平。然而,PE的不饱和水平显著(gydF4y2BaPgydF4y2Ba≤0.05)gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
实验二:灌浆期高温处理gydF4y2Ba
重要的(gydF4y2BaPgydF4y2Ba观察灌浆期不同温度对MGDG、DGDG、PG和PS不饱和指数的影响(表1)gydF4y2Ba2gydF4y2Ba).与OT相比,HT胁迫降低了MGDG、DGDG和PG的不饱和水平。然而,与OT相比,HT下PS的不饱和水平有所增加(表2)gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
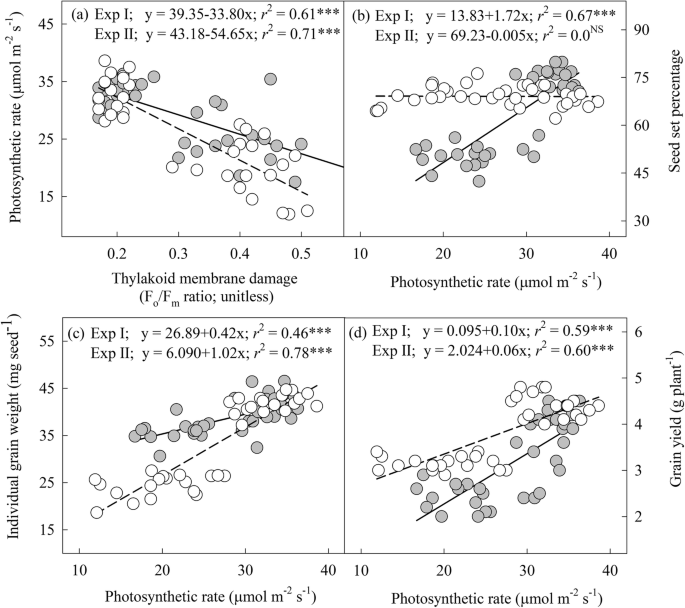
光合速率、类囊体膜损伤与籽粒产量及其组分的关系gydF4y2Ba
花期类囊体膜损伤与光合速率呈负线性关系(gydF4y2BargydF4y2Ba2gydF4y2Ba= 0.61;gydF4y2BaPgydF4y2Ba≤0.001;无花果。gydF4y2Ba5gydF4y2BaA)和灌浆阶段(gydF4y2BargydF4y2Ba2gydF4y2Ba= 0.71;gydF4y2BaPgydF4y2Ba≤0.001;无花果。gydF4y2Ba5gydF4y2Baa).光合速率与结实率呈线性正相关(gydF4y2BargydF4y2Ba2gydF4y2Ba= 0.67;gydF4y2BaPgydF4y2Ba≤0.001;无花果。gydF4y2Ba5gydF4y2BaB)、单粒重(gydF4y2BargydF4y2Ba2gydF4y2Ba= 0.46;gydF4y2BaPgydF4y2Ba≤0.001;无花果。gydF4y2Ba5gydF4y2BaC)、粮食产量(gydF4y2BargydF4y2Ba2gydF4y2Ba= 0.59;gydF4y2BaPgydF4y2Ba≤0.001;无花果。gydF4y2Ba5gydF4y2BaD)在开花阶段。同样,光合速率与单粒重呈线性正相关(gydF4y2BargydF4y2Ba2gydF4y2Ba= 0.78;gydF4y2BaPgydF4y2Ba≤0.001;无花果。gydF4y2Ba5gydF4y2BaC)、粮食产量(gydF4y2BargydF4y2Ba2gydF4y2Ba= 0.60;gydF4y2BaPgydF4y2Ba≤0.001;无花果。gydF4y2Ba5gydF4y2BaD)灌浆期。gydF4y2Ba
关系分析。gydF4y2Ba一个gydF4y2Ba光合速率(μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)作为类囊体膜损伤的功能(FgydF4y2BaogydF4y2Ba/ FgydF4y2Ba米gydF4y2Ba比;相对单位),gydF4y2BabgydF4y2Ba结实率与光合速率(μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba),gydF4y2BacgydF4y2Ba单粒重(毫克种子gydF4y2Ba−1gydF4y2Ba)是光合速率(μmol m .)的函数gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba),gydF4y2BadgydF4y2Ba籽粒产量(株gydF4y2Ba−1gydF4y2Ba)是光合速率(μmol m .)的函数gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba).灰色圆点回归线表示开花期(试验一),白色圆点回归线表示灌浆期(试验二)。* * *表示gydF4y2BaPgydF4y2Ba≤0.001gydF4y2Ba
讨论gydF4y2Ba
花期或灌浆期的高温通过降低类囊体膜的完整性而降低光合速率。在花期和灌浆期,高温处理分别降低了产量相关性状结实率和单粒重。此外,花期和灌浆期的HT胁迫增加了不饱和脂类较少的摩尔百分比(36:5- MGDG和DGDG)。然而,在灌浆期,HT胁迫降低了更多不饱和脂类的摩尔百分比(36:6- MGDG和DGDG)。在两个生育期,光合速率与籽粒产量呈显著正相关gydF4y2Ba−1gydF4y2Ba类囊体膜损伤与光合速率呈负相关。gydF4y2Ba
高温增加类囊体膜损伤(图。gydF4y2Ba1gydF4y2Bag h;FgydF4y2BaogydF4y2Ba/ FgydF4y2Ba米gydF4y2Ba),因为它比其他细胞器对HT更敏感[gydF4y2Ba11gydF4y2Ba].增加的FgydF4y2BaogydF4y2BaHT下的值(1c, d)表示PS II反应中心受损[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba],从而降低天线向反应中心传递的激发能量,从而增加活性氧的生成[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba],并减少NADPH的产生gydF4y2Ba2gydF4y2Ba[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba这会潜在地影响碳固定过程。gydF4y2Ba
叶绿素分子主要位于类囊体膜上,是与PS II和PS I蛋白的复合物,在高温胁迫下类囊体膜的损伤可导致叶绿素的损失[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].在花期和灌浆期,类囊体膜损伤与光合速率呈很强的负相关。gydF4y2Ba5gydF4y2Baa),表明在高温胁迫下类囊体膜的损伤速率超过了修复速率,导致光合速率的净抑制[gydF4y2Ba38gydF4y2Ba].生长温度的升高降低了花期和籽粒灌浆期的光合速率。gydF4y2Ba1gydF4y2Bak, l);但前者随治疗时间的延长而降低的幅度小于治疗后。这可能与小麦灌浆期叶片衰老现象有关[gydF4y2Ba39gydF4y2Ba].gydF4y2Ba
脂质如MGDG倾向于包装成六方相或非双分子层相;相反,DGDG形成双分子层[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].灌浆期的高温降低了总DGDG的摩尔百分比(表2)gydF4y2Ba1gydF4y2Ba),这可能导致薄膜从液晶相转变为六方相或立方相,从而失去膜的完整性。这说明在籽粒灌浆期,膜比花期更容易崩解。两个生长阶段类囊体膜损伤程度相似,灌浆期总DGDG的摩尔百分比较灌浆期低,说明在灌浆期类囊体膜的修复速率可能高于灌浆期,因为在灌浆期,OT和HT的总塑性脂质没有变化(表2)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
综上所述,高温胁迫在脂质变化方面造成了混合效应。主要影响是去饱和酶活性的降低,这从较多不饱和脂质的低摩尔百分比和较少不饱和脂质的高摩尔百分比可以明显看出(图2)。gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba),这可能是高温胁迫下叶片维持细胞膜流动性的一种适应性机制[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].在小麦中,糖脂类(MGDG和DGDG)是主要的脂类,36:6- MGDG和DGDG (di18:3)是主要的脂类。在灌浆阶段,这些脂质在高温处理下下降。gydF4y2Ba4gydF4y2Ba),因为这些物种极易受到高温下产生的ROS的过氧化作用[gydF4y2Ba11gydF4y2Ba].不饱和水平的降低主要是由于多不饱和脂肪酸(18:3)的减少和较少不饱和脂肪酸(18:2和18:1)和饱和脂肪酸(16:0和18:0)的增加(图。gydF4y2Ba4gydF4y2Ba).这与Narayanan等人的发现一致。[gydF4y2Ba12gydF4y2Ba]和Djanaguiraman等人[gydF4y2Ba11gydF4y2Ba].这些变化可能与灌浆期末叶衰老过程有关[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba],以及籽粒灌浆(21.3℃)和花期(23℃)的最佳温度[gydF4y2Ba6gydF4y2Ba].小麦叶片和花粉脂质组各不相同,但在高温胁迫下脂质组分的变化相似,且与耐高温有关[gydF4y2Ba17gydF4y2Ba].gydF4y2Ba
小麦繁殖阶段的高温与籽粒产量下降有关[gydF4y2Ba22gydF4y2Ba].在小麦中,开花前8 ~ 6 d和开花阶段被认为是对HT胁迫最敏感的阶段[gydF4y2Ba20.gydF4y2Ba].阿里清等。[gydF4y2Ba45gydF4y2Ba]观察到,与对照(最佳温度)相比,在高温胁迫下,晚开花分蘖的穗粒重减少幅度更大,这是因为晚开花分蘖在配子体发生阶段经历了高温,而早开花分蘖在开花期经历了高温。在本研究中,花期施HT降低了结实率和粒数,从而降低了籽粒产量。gydF4y2Ba2gydF4y2Baa, b).开花过程中发生的主要生理过程包括花药开裂、柱头感知花粉、花粉萌发、花柱花粉管生长、受精和胚形成。研究表明,花粉和/或雌蕊的功能下降和结构异常可能是高温胁迫下种子数量减少的原因[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].由于灌浆期植株未经历高温处理,因此在花期高温处理不影响单粒重。研究表明,光合作用速率也可能影响小麦花粉管的生长[gydF4y2Ba49gydF4y2Ba],这意味着开花期间的光合速率对维持繁殖成功至关重要。在本研究中,光合速率和结实率之间的显著线性关系证实了这一点(图2)。gydF4y2Ba5gydF4y2Bab)灌浆期高温降低植株产量gydF4y2Ba−1gydF4y2Ba通过影响单个粒重(图;gydF4y2Ba2gydF4y2Bad, f).在小麦中,籽粒灌浆(重量)与当前通过光合作用产生的同化物有关[gydF4y2Ba50gydF4y2Ba]和/或储存的同化物从营养组织转移到发育中的生殖组织(谷物)[gydF4y2Ba51gydF4y2Ba].作物粮食产量下降gydF4y2Ba−1gydF4y2Ba灌浆期高温处理可使籽粒发育加快[gydF4y2Ba52gydF4y2Ba],和/或与光合速率降低相关的叶片衰老[gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
在高温胁迫下,花期和灌浆期旗叶膜脂不饱和水平均发生变化。在花期和灌浆期,高温胁迫下籽粒产量的下降分别与粒数和单粒重有关。植物光合速率与籽粒产量呈正相关gydF4y2Ba−1gydF4y2Ba说明在花期和灌浆期,保持较高的光合速率对获得较高的种子数和籽粒大小至关重要,最终影响籽粒产量。随着基因组研究的发展,靶向高不饱和脂类合成的关键基因可以提高小麦的抗高温胁迫能力。对类囊体或花粉内质/膜脂生物合成、降解和重塑相关基因的综合表达研究将有助于理解耐受机制。了解高温胁迫下脂质分子种类、光合速率和籽粒产量之间的关系,有助于提高抗逆性的分子育种和生理育种。gydF4y2Ba
方法gydF4y2Ba
采用Seri82基因型春小麦(种子来自堪萨斯州立大学小麦遗传资源中心;原始种子来源为墨西哥国际玉米和小麦改良中心)在美国堪萨斯州曼哈顿的堪萨斯州立大学农学系的受控环境设施中进行。gydF4y2Ba
种植业及生长条件gydF4y2Ba
小麦基因型Seri82按照Djanaguiraman等人的解释生长[gydF4y2Ba11gydF4y2Ba]在1.8升的花盆中,放入商业Sun Grow Metro Mix 200盆栽土(Hummert International, Topeka, Kansas, USA)和10克控释肥料(Osmocote Plus, N:PgydF4y2Ba2gydF4y2BaOgydF4y2Ba5gydF4y2Ba: KgydF4y2Ba2gydF4y2Bao = 15:9:12;40株植物在一个大型室内生长室(Conviron Model PGW40, Winnipeg, Manitoba, Canada)中生长,保持24/14°C(白天最高/夜间最低温度),14小时光周期,相对湿度~ 70%。昼夜温度分别保持8 h,过渡时间为4 h。使用冷白色荧光灯产生光合活性辐射(~ 900 mol m)gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba;飞利浦照明有限公司,萨默塞特,美国新泽西州)。出苗21 d后,每罐保留3株植物。为了避免吸虫病,使用系统杀虫剂[马拉松1%颗粒,a.i.a:吡虫啉,1-(6-氯-3-吡啶基)甲基)- n -硝基-2-咪唑烷亚胺,Hummert国际公司,托皮卡,堪萨斯州,美国](4克罐gydF4y2Ba−1gydF4y2Ba) [gydF4y2Ba11gydF4y2Ba].从播种到生理成熟期间,保持2厘米深的水盘,充分浇水(达到100%的罐容量)。Miracle-Gro是一种水溶性肥料(N:PgydF4y2Ba2gydF4y2BaOgydF4y2Ba5gydF4y2Ba: KgydF4y2Ba2gydF4y2Bao = 24:8:16;Scotts Miracle-Gro Products, Inc., Marysville, Ohio, USA)从拔节(Feekes生长期6.0)到生理成熟期(Feekes生长期11.4),每7天添加一次灌溉水(根据制造商的说明)。盆栽在生长室内随机布置,并在隔天随机移动,以避免位置影响。从播种到生理成熟,每隔20min监测一次空气温度和相对湿度。在孕穗期(Feekes生长10.0期),对各株主茎进行生理、脂质和产量性状标记。gydF4y2Ba
温度处理版gydF4y2Ba
实验一:花期HTgydF4y2Ba
在开花阶段(Feekes生长阶段10.5.1),在两个生长室(Conviron Model PGR15, Winnipeg, Manitoba, Canada)随机建立两种温度体系[最佳温度(OT, 24/14°C)和高温(32/22°C)]。10个花盆被移动到每个生长室。将植株在各自的温度条件下保存14 d。在开花阶段,将植株暴露在OT或HT中14 d后,将花盆移回原始生长室,保持24/14℃,直到生理成熟。gydF4y2Ba
实验二:灌浆期高温处理gydF4y2Ba
灌浆期(菲克斯生育期10.5.4;开花后14 d),将10个花盆移至OT(24/14℃)或HT(32/22℃)的生长箱中,进行14 d的温度处理。将植物暴露于OT或HT后,将花盆移回原24/14℃的生长箱中,直至生理成熟。gydF4y2Ba
生理、脂质和产量性状gydF4y2Ba
在开花期和灌浆期各10个温度条件下,4个用于测定叶绿素指数、类囊体膜损伤、气孔导度和光合速率,2个用于采集叶片样品进行脂质分析,其余4个用于测定籽粒产量及其相关成分。gydF4y2Ba
叶绿素指数,类囊体膜损伤,气体交换测量gydF4y2Ba
叶绿素指数,叶绿素gydF4y2Ba一个gydF4y2Ba在实验一(开花期高温处理)和灌浆期高温处理后第0、2、4、6、8和12天的OT和高温处理的10:00 - 14:00 h,对标记植株附着的旗叶进行了荧光和气体交换测量。在4个花盆中,随机选择3个花盆,每个花盆中有1株植物标记,每天观察使用,测量生理性状。根据Djanaguiraman等人的解释,使用叶绿素仪(SPAD-502, Spectrum Technologies, Plainfield, IL, USA)测量标记旗叶中间部分的叶绿素指数。[gydF4y2Ba11gydF4y2Ba].叶绿素gydF4y2Ba一个gydF4y2Ba荧光参数[最小荧光收率(FgydF4y2BaogydF4y2Ba)和最大荧光产率(FgydF4y2Ba米gydF4y2Ba)]使用调制荧光计(OS-30p, optical - science Inc., Hudson, New Hamshire, USA)对30分钟的暗适应标记旗叶进行测量。类囊体膜损伤以FgydF4y2BaogydF4y2Ba/ FgydF4y2Ba米gydF4y2Ba(相对单位)。根据Djanaguiraman等人的描述,使用LICOR 6400便携式光合作用系统(LICOR, Lincoln, Nebraska, USA)测量光合作用和气孔导度[gydF4y2Ba11gydF4y2Ba].gydF4y2Ba
叶片中的脂质提取和脂质分析gydF4y2Ba
在实验一和实验二中,分别测定了四个标记的旗叶的脂质组成。10日采集标记后的旗叶进行脂质提取gydF4y2BathgydF4y2Ba从每个温度制度的温度处理日。将中间三分之一的叶片切开并立即切成碎片,转移到一个带有特氟龙衬里螺旋盖的50ml玻璃管中(赛默飞世尔科学公司,沃尔瑟姆,马萨诸塞州,美国),含有6 mL异丙醇(75°C)和0.01%丁基羟基甲苯。脂质提取如Narayanan等人所述。[gydF4y2Ba12gydF4y2Ba].自动电喷雾电离串联质谱法用于脂质分析。根据Narayanan等人的描述计算脂质不饱和指数[gydF4y2Ba12gydF4y2Ba].gydF4y2Ba
产量和产量组成gydF4y2Ba
在实验一和实验二中,对10个标记植株的产量和产量组成进行了量化。生理成熟时,利用OT和HT处理各株主分蘖上的标记穗计算结实率、穗粒数gydF4y2Ba−1gydF4y2Ba单粒重(mg种子gydF4y2Ba−1gydF4y2Ba),正如Prasad和Djanaguiraman所描述的[gydF4y2Ba20.gydF4y2Ba].同样,收获标记的穗和剩余的穗,在40°C的培养箱中干燥,直到达到恒定的重量。穗被手工脱粒,并称重以确定籽粒产量(g plantgydF4y2Ba−1gydF4y2Ba).gydF4y2Ba
统计分析gydF4y2Ba
试验I(花期高温处理)和试验II(灌浆期高温处理)均有OT和HT两个处理。实验一和实验二重复,处理和生长条件与前文相同。两种试验均记录了生理性状和产量性状;然而,脂质分析是在重复实验中进行的。数据在SAS 9.4 (SAS Institute Inc., Cary, North Carolina, USA)中使用PROC MIXED程序进行分析。生理性状以处理为类变量,以观察天数和试验天数为随机变量,得出温度处理的整体效果。采用Tukey-Kramer校正法分离治疗手段。但对于籽粒产量及其相关性状,处理作为类变量处理,试验作为随机变量处理。处理被认为是类脂分析的变量。利用SAS的PROC REG程序,对第一次和第二次处理的数据进行了生理性状与籽粒产量的回归分析。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究的所有数据已包含在本手稿的表格和/或图表中;本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- DBI:gydF4y2Ba
-
双键(不饱和)指数gydF4y2Ba
- DGDG:gydF4y2Ba
-
Digalactosyldiacylgylcerol;gydF4y2Ba
- 质/女士:gydF4y2Ba
-
电喷雾电离串联质谱法gydF4y2Ba
- HT:gydF4y2Ba
-
高温gydF4y2Ba
- MGDG:gydF4y2Ba
-
MonogalactosyldiacylglycerolgydF4y2Ba
- 不:gydF4y2Ba
-
最适温度gydF4y2Ba
- PA:gydF4y2Ba
-
磷脂酸gydF4y2Ba
- PC:gydF4y2Ba
-
磷脂酰胆碱gydF4y2Ba
- 体育:gydF4y2Ba
-
磷脂酰乙醇胺gydF4y2Ba
- 答:gydF4y2Ba
-
PhosphatidylglycerolgydF4y2Ba
- PI:gydF4y2Ba
-
磷脂酰肌醇gydF4y2Ba
- PS:gydF4y2Ba
-
磷脂酰丝氨酸gydF4y2Ba
- PS:gydF4y2Ba
-
光系统。gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
罗贝尔DB,外勤CB。全球尺度气候-作物产量关系和近期变暖的影响。环境科学学报,2007;2:01 - 1002。gydF4y2Ba
- 2.gydF4y2Ba
Barkley A, Tack J, Nalley L, Bergtold J, Bowden R, Fritz A.小麦育种对堪萨斯州小麦品种产量的影响,1985-2011。Agron J. 2014:227-35。gydF4y2Ba
- 3.gydF4y2Ba
阿森S,福斯特IAN,特纳NC。温度变化对小麦产量的影响。张国栋,2011;17(4):377 - 382。gydF4y2Ba
- 4.gydF4y2Ba
Coffel ED, Horton RM, Sherbinin a .基于21世纪全球热应激暴露快速上升的温度和湿度预测gydF4y2Ba圣gydF4y2Ba世纪。环境科学,2018;13:014001。gydF4y2Ba
- 5.gydF4y2Ba
联合国政府间气候变化专门委员会。给政策制定者的总结。在:Field CB, Barros VR, Dokken DJ, Mach KJ, Mastrandrea MD, Bilir TE, Chatterjee M, Ebi KL, Estrada YO, Genova RC, Girma B, Kissel ES, Levy AN, MacCracken S, Mastrandrea PR, White LL,编辑。2014年气候变化:影响、适应和脆弱性。a部分:全球和部门方面。第二工作组对政府间气候变化专门委员会第五次评估报告的贡献。英国剑桥和纽约:美国:剑桥大学出版社;2014.p .学会年会。gydF4y2Ba
- 6.gydF4y2Ba
Farooq M, Bramley H, Palta JA, Siddique KHM。小麦繁殖期和灌浆期的热胁迫。植物科学进展,2011;30:491-507。gydF4y2Ba
- 7.gydF4y2Ba
王文杰,王文杰,王文杰,等。小麦生殖生长过程中高温耐受性的研究。一、调查程序和一般反应模式。德国农业决议1989;40:965-80。gydF4y2Ba
- 8.gydF4y2Ba
Shewry PR.小麦。中国科学(d辑),2009;gydF4y2Ba
- 9.gydF4y2Ba
Hatfield JL, Boote KJ, Kimball BA, Ziska LH, Izaurralde RC, Ort D, Thomson AM, Wolfe DW。气候对农业的影响:对作物生产的影响。艾力龙。2011;103:351-70。gydF4y2Ba
- 10.gydF4y2Ba
王志刚,王志刚,王志刚。植物耐热性研究进展。环境科学学报,2007;gydF4y2Ba
- 11.gydF4y2Ba
Djanaguiraman M, Boyle DL, Welti R, Jagadish SVK, Prasad PVV。小麦在高温下光合速率下降是由于脂质饱和、氧化、酰基化和细胞器损伤造成的。BMC植物生物学,2018;18:55。gydF4y2Ba
- 12.gydF4y2Ba
Narayanan S, Tamura PJ, Roth MR, Prasad PVV, Welti R.高温胁迫下小麦叶片脂质的变化:I.高昼夜温度导致小麦叶片脂质发生重大变化。植物细胞环境,2016;39:787-803。gydF4y2Ba
- 13.gydF4y2Ba
pasenes C, Horton P.两个大豆品种的耐高温光合作用(gydF4y2Ba菜豆gydF4y2Bal .)。Photosynth res 1999; 62:197-203。gydF4y2Ba
- 14.gydF4y2Ba
Ristic Z, Bukovnik U, Prasad PVV。热胁迫下冬小麦类囊体膜热稳定性与叶绿素损失的相关性。作物科学,2007;47:2067-73。gydF4y2Ba
- 15.gydF4y2Ba
de Kroon AIPM, Rijken PJ, de Smet CH.膜磷脂类和酰基链稳态的制衡,酵母的观点。Prog fatty res 2013; 52:374-94。gydF4y2Ba
- 16.gydF4y2Ba
王晓明,王志强,王晓明,等。高温胁迫下小麦叶片脂质研究进展:ⅱ。通过脂质共存分析检测协调代谢的脂质。植物细胞环境,2016;39:608-17。gydF4y2Ba
- 17.gydF4y2Ba
王志强,王志强,王志强,等。高温胁迫对小麦花粉脂质组的影响。植物细胞环境学报,2018;41:1749-61。gydF4y2Ba
- 18.gydF4y2Ba
德里东克斯N, Rieu I, Vriezen WH。植物在营养和生殖阶段耐热性的选育。植物再生,2016;29:67-79。gydF4y2Ba
- 19.gydF4y2Ba
Tashiro T, Wardlaw IF。在小麦籽粒发育前和发育早期,高温冲击和湿度的响应发生了变化。植物学报。1990;17:551-61。gydF4y2Ba
- 20.gydF4y2Ba
王晓明,王晓明,王晓明,等。小麦籽粒重和小花育性对高温胁迫的响应:温度和持续时间的敏感期和阈值。植物学报。2014;41:1261-9。gydF4y2Ba
- 21.gydF4y2Ba
王志刚,王志刚,王志刚,等。小麦孢子发生异常的研究(gydF4y2Ba小麦gydF4y2BaL.)由短期高温引起的。安·博特,1982;49:835-46。gydF4y2Ba
- 22.gydF4y2Ba
李文杰,李志强,李志强,等。小麦花期高温胁迫对小麦产量和生物量的影响。安博。1998;82:631-9。gydF4y2Ba
- 23.gydF4y2Ba
Prasad PVV, Boote KJ, Allen LH Jr, Sheehy JE, Thomas JMG。高温胁迫下水稻小穗肥力和收获指数的物种、生态型和品种差异农田作物决议2006;95:398-411。gydF4y2Ba
- 24.gydF4y2Ba
Djanaguiraman M, Perumal R, Jagadish SVK, Ciampitti IA, Welti R, Prasad PVV。高粱花粉和雌蕊对高温胁迫的敏感性。植物细胞环境,2018;41:1065-82。gydF4y2Ba
- 25.gydF4y2Ba
Djanaguiraman M, Perumal R, Ciampitti IA, Gupta SK, Prasad PVV。珍珠谷子对高温胁迫反应的量化:阈值、敏感期、遗传变异和花粉和雌蕊的相对敏感性。植物生态学报,2018;gydF4y2Ba
- 26.gydF4y2Ba
杨娟,王志刚,王志刚,杨建军。小麦异种双倍体耐高温的生长和衰老特征。Euphytica。2002;126:185 - 93。gydF4y2Ba
- 27.gydF4y2Ba
Castro M, Peterson CJ, Rizza MD, Dellavalle PD, Vazquez D, Ibanez V. Ross a.热胁迫对小麦籽粒特性和蛋白质分子量分布的影响。入:Buck HT, Nisi JE, Salomon N,编辑。gydF4y2Ba逆境下小麦生产gydF4y2Ba.多德雷赫特:施普林格;2007.p . 365 - 71。gydF4y2Ba
- 28.gydF4y2Ba
赵华,戴涛,景强,姜东,曹伟。花后高温对小麦叶片衰老和籽粒灌浆的影响。植物生长学报。2007;51:149-58。gydF4y2Ba
- 29.gydF4y2Ba
罗贝尔DB,西布里A, ortizo - monasterio JI。极端高温对印度小麦衰老的影响。张国昌。2012;2:186-9。gydF4y2Ba
- 30.gydF4y2Ba
王志强,王志强,王志强,等。叶绿素荧光猝灭与光合电子传递量子产率的关系。生物化学学报,1989;39(4):389 - 397。gydF4y2Ba
- 31.gydF4y2Ba
宋勇,陈强,慈东,邵旭,张东。高温对杨树光合作用及相关基因表达的影响。BMC植物生物学。2014;14:111。gydF4y2Ba
- 32.gydF4y2Ba
布雷斯蒂克M,兹夫恰克M,卡拉吉HM,卡彭蒂埃R,阿拉赫弗迪耶夫SI。光系统II原位热稳定性:环境诱导的驯化和基因型特异性反应gydF4y2Ba小麦gydF4y2Ba中国植物学报,2012;29(3):344 - 344。gydF4y2Ba
- 33.gydF4y2Ba
孙勇,刘霞,翟红,高红,姚勇,杜勇。葡萄叶片光系统II光化学及氧化酶途径对热胁迫的响应。植物学报。2016;38:232。gydF4y2Ba
- 34.gydF4y2Ba
Bolhar-Nordenkampf HR, Long SP, Baker NR, Oquist G, Schreiber U, Lechner EG。叶绿素荧光作为田间叶片光合能力的探针:当前仪器的综述。生态学报,1989;3:497-514。gydF4y2Ba
- 35.gydF4y2Ba
鲁班AV,约翰逊议员,达菲CDP。光系统II天线中的光保护分子开关。生物化学学报(英文版);gydF4y2Ba
- 36.gydF4y2Ba
杨晓明,王晓明,张晓明,等。光合作用对高温胁迫的响应。中国生物医学工程学报。2014;37(2):344 - 344。gydF4y2Ba
- 37.gydF4y2Ba
植物学报。2017;37:347-59。gydF4y2Ba
- 38.gydF4y2Ba
高光胁迫诱导植物叶绿体类囊体膜网络的结构变化。中国生物医学工程学报(英文版);2014;gydF4y2Ba
- 39.gydF4y2Ba
张佳杰,陈广旭,高XX,褚佳杰。两种不同衰老特性的大田春小麦品种旗叶光合作用的下降。中国生物医学工程学报(英文版);2006;gydF4y2Ba
- 40.gydF4y2Ba
李AG)。膜脂:这只是一个阶段。生物学报。2000;10:R377-80。gydF4y2Ba
- 41.gydF4y2Ba
张志刚,张志刚,张志刚,等。植物光合作用热耐受性和叶绿体超微结构的改变gydF4y2Ba拟南芥gydF4y2Ba缺乏脂质去饱和。植物科学进展。1989;30(4):344 - 344。gydF4y2Ba
- 42.gydF4y2Ba
村上Y, Tsuyama M, Kobayashi Y, Kodama H, Iba K.三烯脂肪酸与植物耐高温的关系。科学。2000;287:476-9。gydF4y2Ba
- 43.gydF4y2Ba
王晓明,王晓明,王晓明,等。大鼠脂质脂肪b基因突变对棕榈酸盐含量降低的影响gydF4y2Ba拟南芥gydF4y2Ba.植物物理学报。2004;135:1269-79。gydF4y2Ba
- 44.gydF4y2Ba
马特隆科索-庞塞,曹旭,杨泽,JB。衰老过程中的脂质转换。植物科学进展(英文版);gydF4y2Ba
- 45.gydF4y2Ba
Aliqing S, Somayanda I, Sebastian SV, Singh K, Gill K, Prasad PVV, Jagadish SVK。开花期热胁迫影响春小麦的开花时间、结实率和籽粒品质。作物科学,2018;gydF4y2Ba
- 46.gydF4y2Ba
王晓明,王晓明,王晓明,等。热胁迫对小麦花粉管生长和子房解剖结构的影响(gydF4y2Ba小麦gydF4y2Bal .)。植物学报。1983;10:137-44。gydF4y2Ba
- 47.gydF4y2Ba
刘志刚,刘志刚,张志刚。烟草花粉对高湿高热胁迫的响应:活力和萌发性gydF4y2Ba在体外gydF4y2Ba而且gydF4y2Ba在活的有机体内gydF4y2Ba.植物科学学报。1991;4:104-9。gydF4y2Ba
- 48.gydF4y2Ba
Fabian A, Safran E, szbo - eitel G, Barnabas B, Jager K.高温和干旱共同胁迫降低小麦柱头功能和育性。植物科学学报2019;10:244。gydF4y2Bahttps://doi.org/10.3389/fpls.2019.00244gydF4y2Ba.gydF4y2Ba
- 49.gydF4y2Ba
坎贝尔AW,格里芬WB, Burritt DJ,康纳AJ。光强对小麦-玉米组合花粉管生长和胚存活的重要性。Ann Bot. 2001; 87:517-22。gydF4y2Ba
- 50.gydF4y2Ba
Blum A, Sinmen B, Mayer J, Golan G, Shpiler L.热胁迫下茎秆储备动员支持小麦籽粒灌浆。植物学报1994;21:771-81。gydF4y2Ba
- 51.gydF4y2Ba
Plaut Z, Butow B, Blumenthal C, Wrigley C.花后水分亏缺和温度升高对小麦籽粒干物质输送及其对产量的贡献。农田作物决议2004;86:185-98。gydF4y2Ba
- 52.gydF4y2Ba
Barlow KM, Christy BP, O 'Leary GJ, Riffkin PA, Nuttall JG。极端高温和霜冻事件对小麦生产影响的模拟研究进展。农田作物,2015;171:109-19。gydF4y2Ba
- 53.gydF4y2Ba
热胁迫对小麦叶片和穗光合作用的影响。中国科学(d辑),1986;gydF4y2Ba
- 54.gydF4y2Ba
王志强,王志强,王志强,等。小麦籽粒发育过程中高温损伤模式的研究。植物科学。1984;61:363-8。gydF4y2Ba
- 55.gydF4y2Ba
Prasad PVV, Pisipati SR, Momcilovic I, Ristic Z.灌浆期高温和干旱胁迫对小麦产量和叶绿体EF-Tu表达的独立和联合影响。中国农业科学(英文版);2011;gydF4y2Ba
确认gydF4y2Ba
作者非常感谢堪萨斯州立大学生物系杰出教授R. Welti博士对脂质分析的科学和技术支持,这些分析是在堪萨斯州脂质组学研究中心分析实验室进行的;仪器的获取和脂组学方法的开发得到国家的支持gydF4y2Ba
科学基金会(EPS 0236913, MCB 0920663, MCB 1413036, DBI 0521587, DBI 1228622),堪萨斯科技企业公司,国立卫生研究院的K-IDeA生物医学研究卓越网络(INBRE) (P20GM103418)进行脂质分析。资深作者(医学博士)感谢印度哥印拜陀泰米尔纳德邦农业大学允许他在堪萨斯州立大学进行博士后研究。提及商标或专有产品并不构成堪萨斯州立大学对产品的保证或担保,也不意味着它批准排除其他可能也是合适的产品。本出版物的投稿号是。我是堪萨斯农业实验站的19-065-J。gydF4y2Ba
资金gydF4y2Ba
我们非常感谢美国农业部通过Norman Borlaug奖学金向E. Erdayani博士和堪萨斯州立大学农学系提供的财政支持。我们感谢麦菜科协调农业项目(麦菜科- cap,批准号)。2011-68002-30029(美国农业部NIFA)和美国国际开发署(USAID)资助未来气候适应性小麦创新实验室(批准号:2011-68002-30029;援助- 0 - aa - - 13 - 00008);资助未来创新实验室开展可持续集约化合作研究(批准号:;援助- oaa - l - 14 - 00006)。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
PVVP构想并设计了实验。MD进行实验,收集和分析数据并撰写手稿。EE帮助并处理了脂质分析的样品。SN收集资料,编辑稿件。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Djanaguiraman, M, Narayanan, S, Erdayani, E。gydF4y2Baet al。gydF4y2Ba花期和灌浆期高温胁迫对小麦光合作用、脂质和产量的影响gydF4y2BaBMC植物生物学gydF4y2Ba20.gydF4y2Ba268(2020)。https://doi.org/10.1186/s12870-020-02479-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02479-0gydF4y2Ba
关键字gydF4y2Ba
- 粒数gydF4y2Ba
- 高温gydF4y2Ba
- 单粒重gydF4y2Ba
- 脂质gydF4y2Ba
- 光合作用gydF4y2Ba
- 小麦gydF4y2Ba