抽象的
背景
拟南芥致病相关基因5 (CPR5)的组成表达体最近被证明作为核孔复合体(NPC)的一部分在门控中发挥作用。突变CPR5.导致多种缺陷,包括异常毛状体,降低倍性水平,减少生长和增强对细菌和真菌病原体的抗性。亲爱的性质CPR5.突变意味着CPR5蛋白影响多种途径。然而,关于允许CPR5影响不同途径的结构特征很少。
结果
我们的硅研究表明,除了三个假定的核定位信号簇和四个或五个跨膜结构域外,CPR5还包含两个假定的替代翻译起始位点。为了测试这些位点中涉及的蛋氨酸编码核苷酸的作用,METCPR5.其中相关核苷酸被改变以编码谷氨酰胺的cdna被融合到CPR5.原生启动子和改变的构建体cpr5-2植物补充cPR5妥协的表型。控制和METCPR5.构造能够补充所有人CPR5.表型,虽然互补的程度取决于具体的互补株系。值得注意的是,植物通过METCPR5.构造显示较大的叶子并在挑战时显示出降低的阻力假单胞菌含油PV.太平洋标准时间与对照植物相比,DC3000。因此,编码甲硫氨酸编码核苷酸调节生长和抗性。我们提出CPR5 N-末端的结构特征涉及有助于调节生长和抗性之间的平衡的蛋白质的选择性等级。
结论
植物需要仔细平衡用于生长和抵抗的资源量。拟南芥CPR5蛋白调节植物生长和免疫力。在这里,我们表明CPR5的N末端特征参与了生长和抗性之间平衡的调节。这些发现可能会有利于提高植物产量的努力,同时保持最佳的抗病抗性水平。
背景
植物识别大多数病原体的攻击,并通过生产抗微生物蛋白和防御反应的激活来响应[1].在试图确定导致植物抗病和易感性的信号传递过程中,许多表现出抗性反应缺陷的突变体被分离出来。例如,具有高易感性表型的突变体,NPR1.为了病因相关基因的非患者[2那3.那4.] 和eds5为了加强疾病susceptibility5[5.那6.]和突变体显示与国防相关基因的组成型激活和增强的防御反应(例如,ACD6.(加速细胞死亡6.),CPR1(病因相关基因的组成型表达者1)[7.],CPR2.和CPR6.[8.)被孤立。1997年,Bowling和他的同事报告了cpr5-2突变体,显示了本构型表达的病因相关基因PR1那PR5和PDF1.2在没有任何病原体攻击的情况下,在它们的叶子上的异常胎儿和过敏反应(HR)的病变[9.].后来,Jing等人[10.]描述了old1(O.nsetL.电弧炉D.eath1)突变体显示HR样病变,早期叶片衰老和早期叶死亡。在同年,尤达等人。[11.)报道HYS1.(超脑病1)作为加速叶片衰老的突变体和对糖的过敏。Borghi等。[12.] 孤立cpr5-3,这显示出叶k减少+水平和cpr5-2表型。CPR5.那OLD1和HYS1.都被发现是同一个位点,随后的研究表明CPR5.植物对外源脱落酸(ABA)、茉莉酸(JA)和乙烯(ET)也表现出超敏反应[13.那14.那15.].亲爱的性质CPR5.突变体表明CPR5是不同细胞途径的主调节因子[16.].
CPR5蛋白的功能分析很困难,因为这种蛋白质仅在植物和苔藓中发现,Physcomitrella patens.[13.].然而,计算研究表明,CPR5预计包含一个n端二部核定位信号(NLS)和多个跨膜(TM)域在羧基端[11.],这与CPR5是核膜蛋白的模型一致[14.].最近,CPR5已成为核锁素之一,并显示为核孔隙络合物(NPC)的一部分起作用[14.那15.那17.].表明CPR5通过形成CPR5-CPR5同源体和解毒的核细胞质转运作为突变的突变来参与NPC术语。CPR5.基因被提出导致免疫力损害CPR5.突变体。然而,目前尚不清楚CPR5蛋白的结构特征如何调解选择性。
在硅研究表明,CPR5包含三个nls编码残基簇,两个酪蛋白激酶(CK)磷酸化位点簇和一些可选的翻译起始位点。在这里,我们对假定的备选翻译起始位点编码残基进行突变,以测试它们在CPR5功能中的作用。突变基因被用来补充cpr5-2突变体。我们发现补充线条改变了生长和疾病抵抗太平洋标准时间DC3000表明CPR5 N-末端参与了植物生长和抗病性的调节。
结果
CPR5预计包含多个翻译起始位点
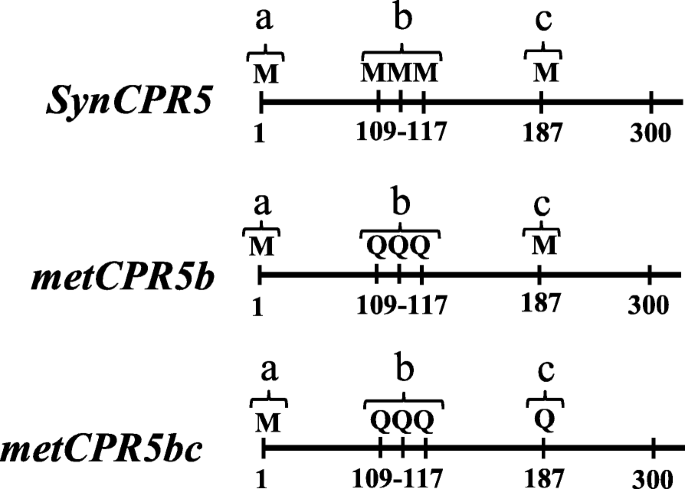
这CPR5.转录物在位置A,B和C处具有多个内框架起始密码子,如图2所示。1.如果这些是功能替代翻译启动网站,则预期这些站点包含有利于诸如茎环结构的翻译启动的特征。因此,这是CPR5.进一步计算分析mRNA序列。数字1显示CPR5.mRNA序列和内框架起始密码子的位置。仔细观点是第二推定站点(站点B)的视图表明它由三个串联起始密码子组成,第一个起始密码子下游109 NT。第三个站点发生在第一个站点下游的187 nt。此外,这是CPR5.预测编码序列在前190个核苷酸中包含四个茎环结构(图S1)。在这些茎环中,第一和第二推定的起始位点之间存在第一个。该茎环似乎强,载于调用茎形成的50%相关的Nuceleotides是鸟嘌呤和胞嘧啶。值得注意的是,预测第二推定的起始站点是茎环的一部分。每个推定的翻译开始站点后面是茎环结构(图S1)。另外,用于翻译或鸟嘌呤如腺嘌呤或鸟嘌呤的推定良好的残基也存在于每个推定启动位点的预期位置( - 3,+ 3和+ 4)(图S)1)。这些结果与模型同意CPR5.转录物含有多个翻译启动位点。
合成物的构造CPR5.具有突变起始密码子的基因
互补CPR5.野生型突变体CPR5.基因拯救与突变相关的受损表型[18.].因此,我们旨在通过补充来检验假定的替代起始位点在CPR5功能中的作用cpr5-2合成植物CPR5.构建推定位点的突变。为了区分补充转基因转录物cpr5-2转录物中,在合成中引入了许多核苷酸变化CPR5.密码子优化编码序列。密码子优化的合成版本CPR5.基因被称为SynCPR5(无花果。1和S2)和假定的起始位点单独或集体突变的结构被称为metCPR5b和metcpr5bc..这metCPR5bRNA转化为CPR5蛋白,第二个假定起始位点的三个蛋氨酸转化为谷氨酰胺残基。选择谷氨酰胺作为替代,因为它在大小上与蛋氨酸相似,并被认为对蛋白质三级结构的影响有限[19.].这metcpr5bc.除了第二个起始位点外,RNA的第三个假定起始位点也发生了突变(图。1)。因此,这些合成构建体将允许单独检测内源性cpr5-2来自MRNA的mRNA来自合成构建体的mRNAcpr5-2线与合成物相关的CPR5.基因。
CPR5.母语推动者能够开车SynCPR5表达
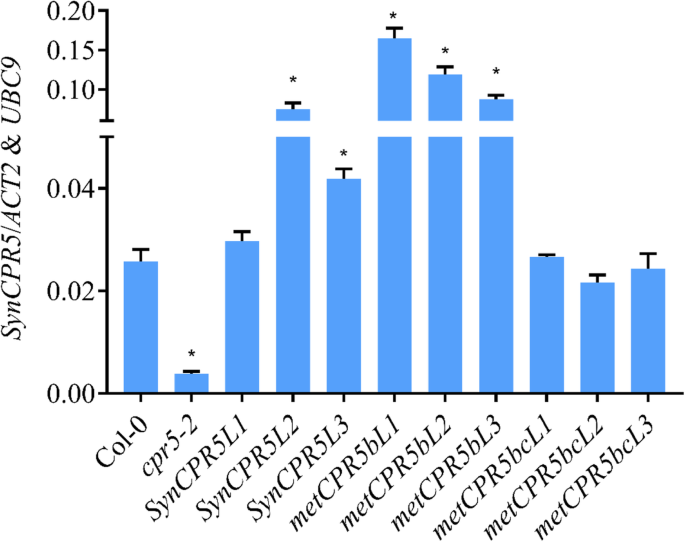
许多研究使用了花椰菜花叶病毒35S推动者推动表达的CPR5.基因[13.那20.那21.].在这里,我们表达了SynCPR5来自本地的CPR5.促进剂以模仿野生型的表达CPR5.基因。实际水平SynCPR5然而,预期转基因系的转录物的转录物在野生型,野生型或高于野生型中的野生型,因此由于位置效应而低于野生型[22.那23.].1.5 kB上游片段CPR5.基因(AT5G64930)与...融合SynCPR5编码序列,整个盒子被转移到cpr5-2植物。成功后SynCPR5转型,SynCPR5将三种独立的纯合额度的表达进行了比较CPR5.在野生型Col-0和突变体中的表达cpr5-2行。相对转录本丰度SynCPR5那CPR5.和cpr5-2使用SynCPR5那CPR5.和cpr5-2基因特异性底漆套(图S2和表S.1),如方法所述。如图1所示。2,相对SynCPR5在独立之间变化的转录物丰富SynCPR5行。syncpr5l1.显示出野生类型的表达式,而syncpr5l2.和syncpr5l3.展示SynCPR5转录本丰度高于野生型。总而言之,这些结果证实了1.5 kb的原生基因CPR5.推动者能够开车SynCPR5转基因拟南芥植物中的表达。
转基因METCPR5.线条的叶子比SynCPR5和野生型线
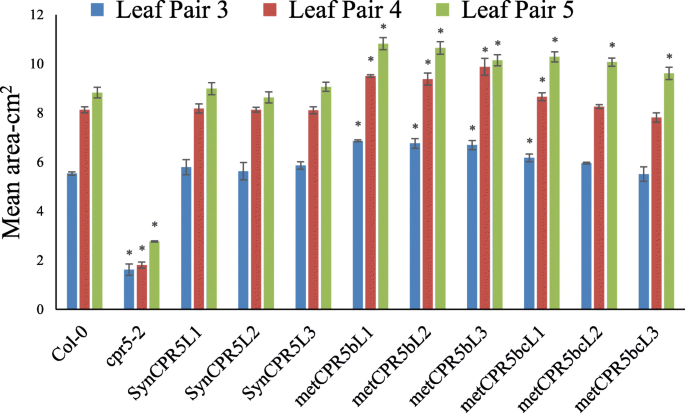
接下来,这是metCPR5b和metcpr5bc.构念被转移到cpr5-2植物确定突变推定翻译启动位点的效果CPR5.活动。选择每个构建体的三条独立的纯合线进行分析和相对METCPR5.测量的水平。如图1所示。2, 全部metCPR5b线显示比野生类型更高的mRNA水平metcpr5bc.株系显示野生型(Col-0)转录本丰度。在不同的转基因和对照野生型的生长过程中cpr5-2在相同条件下种植的植物线,我们指出了叶子METCPR5.植物似乎比野生型更大(图。3.)。这促使我们量化不同植物线的叶片尺寸。在标准生长条件下生长植物31天,并如方法所述测量第三至第五叶对的叶片尺寸。如图1和图2所示。3.和4.,叶的面积SynCPR5线从野生类型的那些漠不关心。相比之下,第三(第五和第六个玫瑰花叶),第四(第七和第八个玫瑰花叶)和第五(第九和第十莲甜叶)叶对metCPR5b植株明显大于野生型SynCPR5线条(图。4.)。此外,第五叶对的叶子区域metcpr5bc.植物大于野生类型的植物SynCPR5植物。除了叶面积外,我们还测定了表皮铺装细胞的大小。的细胞metcpr5bc.植株明显比野生型大(P.< 0.05;学生的T.- 最低)(图S3.)。因此,这些结果表明第二推定替代翻译开始站点限制了叶子尺寸。
metCPR5b和metcpr5bc.叶子具有比野生类型更高的倍率水平
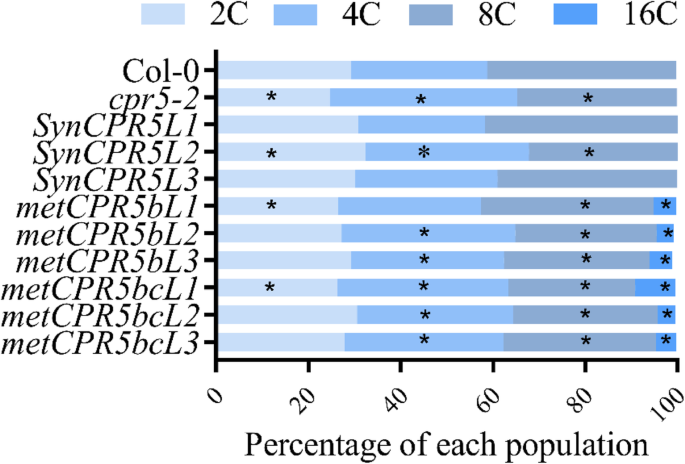
叶子尺寸与倍增性水平正相关[24.].在A. Thaliana.,叶片通常经历三次到四轮的宿主,因此含有高达16或32℃的DNA含量的核群[24.].我们假设METCPR5.具有更大的叶子的线,具有比野生类型更高的倍率水平。测试这个假设,第三个和第四个叶子从24天(24 das)METCPR5.那SynCPR5收获野生型植物,并提取核以进行倍频分析(图。5.)。孤立核的流式细胞术显示出两种SynCPR5品系的倍性水平与野生型不同,2C和4C水平较高,8C水平较低。大多数METCPR5.线条具有相似的2C,但高4C水平比野生型。有趣的是,所有METCPR5.线显示较低的8C水平,另外,找到16C种群(图。5.),而在其他线条中未检测到16C核。这些结果支持的假设是扩大的叶子是由增加的倍率水平增加引起的METCPR5.行。
METCPR5.植物赋予了增强的易感性P. inringae.
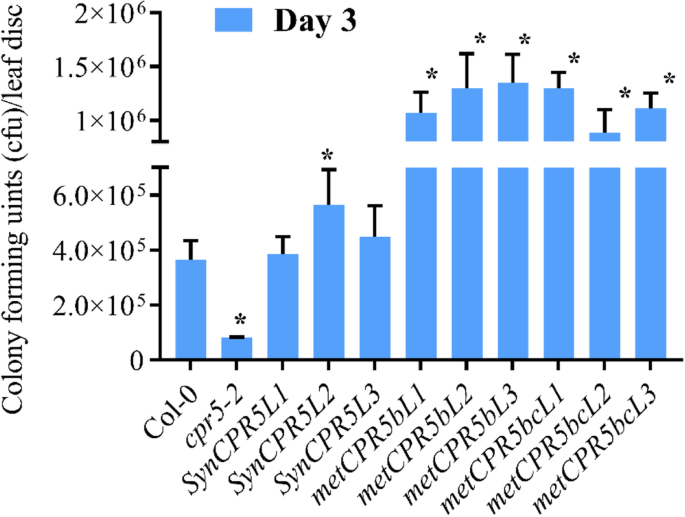
自从cpr5-2突变体显示出降低的叶子尺寸与增强的感染抗性相结合假单胞菌含油PV。番茄DC3000 (太平洋标准时间DC3000),我们假设较大的叶子METCPR5.植物可能与对太平洋标准时间DC3000。因此,METCPR5.植物生长在中性昼(12:12光:暗)条件下。4 ~ 5周龄植株的叶片被浸透太平洋标准时间DC3000,敏感性通过测量菌落形成单位(cfu)的数量进行评分,如(52)所述。如图1所示。6., 这metCPR5b和metcpr5bc.线条显示出明显更高的易感性太平洋标准时间DC3000与野生型比较。相比之下,SynCPR5线条显示易感性太平洋标准时间除了野生型方式之外的DC3000syncpr5l2.,它显示比野生类型更高的易感性。综上所述,METCPR5.植株的叶片比野生型大,对植物的抗性降低太平洋标准时间DC3000感染。
太平洋标准时间DC3000感染生长测定。从随机选择的三种植物接种的叶片切割了三个叶片圆盘太平洋标准时间如[60中所述,提取DC3000和细菌。25.].太平洋标准时间从叶片中提取DC3000细菌(1厘米2)并镀到琼脂平板上。在生长3天后测量菌落形成单元(CFU)。误差条表示平均值的标准错误,星号表示与Col-0的显着差异P. < 0.05 (Student’sT.-测试)
METCPR5.行有变量PR1水平
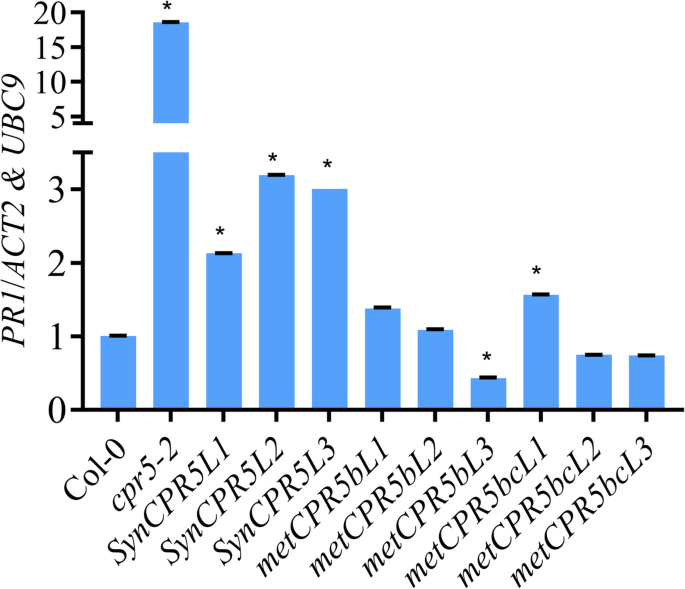
SA介导的抗病性标志物基因的表达发病机制相关GENE1(PR1)增强了cpr5-2突变体和与阻力相关[9.].因此,预计这一点METCPR5.线条减少了PR1的水平。转录丰度PR1从未感染的野生型cpr5-2那SynCPR5和METCPR5.使用实时QRT-PCR线。如图1所示。7.那cpr5-2植物表现出大大增加PR1的水平。但是,最重要的是METCPR5.行显示PR1转录水平与野生型相似。例外的是metCPR5bL3和metcpr5bcl1.线条,较低和更高PR1水平分别。值得注意的是,全部SynCPR5表现出的线条增加PR1水平与野生型相比(图。7.)。
讨论
CPR5在生长和抵抗监管中的作用
植物在抗性和生长之间平衡资源分配,以限制对植物生长的负面影响[26.那27.].为了进一步最大限度地减少成本,植物为不同类型的生物和非生物应激开发了不同,高度策划的防御系统[28.那29.那30.].例如,响应于生物营养病原体而激活水杨酸(SA)介导的电阻,而JA / ET介导的抗性在病症病原体侵袭时诱导抗性[31.].防御系统的组成型激活导致增长和发展缓慢或降低[28.那29.那32.].的表型CPR5.突变体,即受损的生长与抗病原体的抗性增加相结合P. inringae.和Hyaloperonospora parasitica.[9.与这一观点相一致,并表明在CPR5.获得成本的成本。这也同意调查涉及植物蛋白和胃肠杆菌蛋白(GA)生物合成和信号传导的大量基因被压抑CPR5.[17.].也许表型的最简单的解释是CPR5用作电阻的抑制器。一些观察结果表明,这是如此:上调的病因相关基因(PR1和PR5) 和植物防御素1.2(PDF1.2),形成HR样病变和较高的SA水平CPR5.植物 [8.那9.那11.那14.].此外,细胞氧化还原平衡的放松管制CPR5.已经提出植物参与病变和早期叶片衰老的诱导[33.],表明CPR5可以通过调节ROS水平来抑制阻力[16.].同样,过敏反应CPR5.植物到激素sa,ja,aba和et [13.那20.]表明CPR5可以通过抑制这些激素反应的大小来调节SA和JA / ET介导的抗性。CPR5还被证明抑制了一组参与细胞壁的生物合成的基因[21.],其作为针对病原体感染的第一屏障[34.].然而,异常的毛状体,较小的表皮细胞和降低的倍性水平清楚地表明CPR5也参与了生长调节,并且已经提出了抗性的激活CPR5.可能是生长缺陷的结果[35.],包括异常细胞壁合成[36.].
我们在此显示核苷酸的变化METCPR5.导致植物比野生型生长较大,以抵抗抗性太平洋标准时间DC3000。突变的碱基对,而不是mRNA丰度似乎是至关重要的,因为表型与突变的类型和mRNA丰富相关。这也与先前的结果一致,其中野生类型过表达CPR5.基因使用35s启动子导致基因表达增加1000倍,没有相似的较大叶片并报告耐药性降低[13.].这表明观察到的表型是MetCPR5蛋白的结构性质的结果。然而,我们不能排除甲硫氨酸编码核苷酸的可能性,以某种方式限制蛋白翻译METCPR5.突变,导致蛋白质水平更高。结果与CPR5不仅仅是用作抗性抗病症的阻遏物的模型一致,但它调节生长和抗性之间的平衡,由此结构特性 - 在N-终端存在 - 限制CPR5可以利义的程度抗性增长。
CPR5如何控制生长抵抗平衡?
由于其复杂性质和大量生长和抵抗相关基因或激素,植物如何调节生长和抗性之间平衡的机制较差。例如,所有人都被证明涉及植物生长和免疫力的调控,所示的毒素,芸苔类固醇,细胞蛋白,赤霉素,脱落酸,乙烯和茉莉酸盐[26.那37.那38.那39.那40那41.那42.那43.].值得注意的是,许多这些激素的水平或信号通路受到影响CPR5.突变体也是:水杨酸(SA)和茉莉酸(JA)的水平较高CPR5.植物,CPR5.植物在SA,JA,ABA和ET信号通信路径中有扰动[13.], 和CPR5.植物对外源SA,ABA,JA和ET过度敏感[13.那15.].最近,孟等人。(2017)表明,CPR5通过调节SA和展开的蛋白质反应来调节生长和应力响应 - 权衡。另外,抑制了大量的生长促进基因,例如养蛋白和GA响应基因CPR5.突变体[17.].DELLA蛋白的核聚集导致GA信号抑制,而它们的降解释放抑制GA生物合成信号[44.].DELLA靶基因在CPR5.表明赤霉素的含量可能受到影响CPR5.植物也一样[17.].总之,这些结果表明上述激素的改变水平或信号传导可能影响生长和抗性CPR5.突变植物。这符合我们的假设,即CPR5在通过介导生长和抗性激素来调节生长和抗性之间的平衡方面起着核心作用。最近发现CPR5功能如何提供提出CPR5如何控制生长和抗性的方法:CPR5是作为核孔隙络合物(NPC)的一部分起作用的核磁素之一,并抑制NPC和细胞周期蛋白依赖性激酶的活性(CKIS)在无应力条件下[14.那15.那17.].是。的构象变化的结果CPR5.突变体或作为应激的结果,改变CPR5介导的门,允许许多分子进入细胞核,导致抗性基因的激活[17.].此外,CPR5通过形成CPR5-CPR5同源过二聚体参与NPC栅,作为选择性屏障[17.].CPR5的n端区域对于CPR5-CPR5在NPC内的同源性相互作用至关重要,当这种相互作用在NPC中丢失时Old1-L3.等位基因CPR5.(G120D),发现蛋白质如NPR1,JAZ1和ABI5在细胞质中不保留[17.].这些结果均与我们一般一致,表明导致CPR5蛋白的N末端部分变化的突变可以以抗病抗性的代价来改善植物生长,可能通过改变的CPR5-CPR5同源化和CPR5介导的NPC门控.尽管如此,除了METCPR5蛋白的可能结构变化之外,核苷酸也会发生变化METCPR5.转录物可以以其他方式影响CPR5功能:突变去除可能的替代翻译起始位点和不同的可选地翻译的CPR5蛋白可能影响NPC门控。的确,在硅的分析中CPR5.转录物鉴定了附近推定的替代翻译起始网站和类似的二级结构的潜在RNA二级结构对于替代翻译开始站点的活动是重要的[45.那46.那47.那48.那49.].或者,或者另外,诱导的突变可能影响二次结构本身,因此可能具有修改的翻译。
结论
综上所述,这些结果使我们提出,改变的核苷酸METCPR5.可以改变CPR5-CPR5同源化,因此CPR5介导的NPC门控。NPC复合物中的任何结构差异,然后可以通过改变生长和/或抗性调节剂的改变的浇注来影响生长和抗性之间的平衡。
方法
植物材料和生长条件
拟南芥蒂利亚纳哥伦比亚(CPR5和cpr5-2)种子与[50.] 学习。根据[中的方法,洗涤和消毒种子并消毒。51],在4°C黑暗中吸收3-4天。吸收种子生长在高压灭菌道尔顿优质种子饲养混合®,新西兰。除上述情况外,该植株在22°C和65%相对湿度(RH)的长日照条件下(16 h光照,8 h黑暗)生长。为假单胞菌含油细菌渗透,植物在21℃和65%RH下在短日气体条件下(10小时,14小时暗)生长。
毛滴数,叶子和路面细胞面积测量
从生长的植物中除去叶子并安装在玻璃载玻片上。在解剖显微镜下计数每个滴毛体上的阑尾数。在31 das(播种后的天数),从植物中取出叶对,然后送到叶面积机(Li-3050A / 4,Li-Cor,USA)上,用于两种叶子的组合测量。成对收获叶子:叶1和2被认为是叶对1,叶3和4作为叶对2,等等。Leaf 3 from three different plants of the same transgenic line was imaged using a scanning electron microscope (FEI Quanta 200 Environmental Scanning Electron Microscope (SEM) with EDAX module) following manufacturer’s instructions at Manawatu Microscopy Imaging Centre (MMIC), Massey University, Palmerston North. The images were processed and cell areas were measured individually by ImageJ (https://imagej.nih.gov/ij/)。
CPR5.基因合成和转化
修改了CPR5.基因变体,SynCPR5(图1) 和METCPR5.,由GenScript (GenScript®,美国)合成。这CPR5.基因变异,以及1.5 kb的原生基因CPR5.启动子片段通过Genscript克隆到PGREEN0229中。克隆的序列保真度SynCPR5和METCPR5.构建物经Sanger测序和酶切分析证实。质粒转化为农杆菌肿瘤GV3101,然后用来改变cpr5-2如上所述使用花卉浸渍的植物[52].第一代转化植株收获的种子在土壤床上种植,使用BASTA (125 mg/L)筛选阳性转化子。在后代中选择纯合子转化系。通过DNA测序、酶切分析和PCR分析证实了转基因在转化系中存在CPR5.那SynCPR5和METCPR5.特定转基因的底漆(图S1)。
倍增水平测量,QRT-PCR数据分析和致病性测定
对于流式细胞术,如所述分离,染色并分析核[21.].运动学分析(DNA含量测量)CPR5.转基因系,包括Col-0(CPR5)和cpr5-2,使用Sysmec Cyflow cytometer(PareC,Cyflow®,USA)根据制造商的说明进行。使用快速RNA Miniprep试剂盒(Zymo Research)从植物中分离总RNA,并使用转录器第一链CDNA合成试剂盒(Roche)制备cDNA。使用浅循环480实时PCR(Roche)系统量化转录物丰度[25.].如上所述,使用Microsoft Office Excel 2010执行转录性丰富和统计分析53].假单胞菌含油如上所述进行PV DC3000致病性测定[25.].
可用性数据和材料
本研究期间生成和/或分析的所有数据都包含在此已发布的文章及其补充信息文件中。在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。
缩写
- 阿巴:
-
脱盐酸
- Abi5.:
-
ABA IMENSEN 5.
- ACD6.:
-
加速细胞死亡6
- AT3G18780:
-
肌动蛋白2
- AT4G27960:
-
泛素缀合酶9(UBC9.)
- AT5G64930:
-
CPR5.
- cDNA:
-
互补脱氧核糖核酸
- CK:
-
酪蛋白激酶
- ckis:
-
细胞周期蛋白依赖性激酶
- CPR1:
-
病因相关基因的组成型表达者1
- CPR2.和CPR6.:
-
病因相关基因的组成型表达者1和6.
- CPR5.:
-
病因相关基因的组成型表达者5
- DAS:
-
播种后的日子
- eds5:
-
增强疾病易感性
- 等:
-
乙烯
- HYS1.:
-
Hypersenescence 1
- JA:
-
茉莉酸
- Jaz1:
-
jasmonate zim-domain 1
- nls:
-
核定位信号
- 全国人大:
-
核心孔隙
- NPR1.:
-
病因相关基因的非表达者1
- NPR1.:
-
病因相关基因的非表达者1
- old1:
-
在一套叶死1
- PDF1.2:
-
植物防御素1.2
- PR1:
-
发病相关基因1
- RNA / DNA:
-
核糖核酸/脱氧核糖核酸
- SA:
-
水杨酸
- SynCPR5:
-
CPR5的合成版本
- TM域:
-
跨膜域
参考
- 1。
植物-微生物相互作用中的细胞死亡程序。植物细胞。1996;8(10):1793 - 807。
- 2。
Cao H,Bowling Sa,Gordon As,Dong X.拟南芥突变体的表征是无响应者对系统性获得性抗性的诱导者。植物细胞。1994年; 6(11):1583。
- 3.
Delaney TP,Friedrich L,Ryals Ja。拟南芥信号转导突变体在化学和生物学诱导的疾病抗性中缺陷。Proc Natl Acad Sci U S A. 1995; 92(14):6602-6。
- 4.
Shah J, Kachroo P, Klessig DF。拟南芥的SSI1突变恢复病因相关的基因表达NPR1.植物和渲染消除基因表达水杨酸依赖性。植物细胞。1999; 11(2):191-206。
- 5。
rogers ee,ausubel fm。拟南芥增强疾病易感性突变体表现出对几种细菌病原体和改变的增强易感性PR-1基因表达。植物细胞。1997年; 9(3):305-16。
- 6.
nawrath c,métrauxjp。Arabidopsis Express的水杨酸诱导缺陷型突变体PR-2和PR-5并且在接种病原体后积累了大量的camalexin。植物细胞。1999;11(8):1393 - 404。
- 7.
Bowling Sa,Guo A,Cao H,Gordon As,Klessig DF,Dong X.拟南芥的突变导致系统性获得性抗性的组成型表达。植物细胞。1994年; 6(12):1845-57。
- 8.
Clarke JD,Volko SM,Ledford H,Ausubel FM,Dong X.水杨酸,茉莉酸和乙烯的角色心肺复苏-诱导的抗性。植物细胞。2000;12(11):2175 - 90。
- 9.
保龄球sa,克拉克jd,liu y,klessig df,dong x。的CPR5.拟南芥的突变体表达了两者NPR1.- 依赖和NPR1.- 依赖性抗性。植物细胞。1997年; 9(9):1573-84。
- 10。
景赫科,Sturre MJ,Hile J,Dijkwel PP。征叶死亡突变体的拟南芥识别治疗途径控制叶片衰老。工厂J. 2002; 32(1):51-63。
- 11.
陈志强,陈志强,陈志强,等。一种新基因的鉴定HYS1./CPR5.在诱导叶片衰老和病原体防御反应中具有抑制作用拟南芥蒂利亚纳.工厂J. 2002; 29(4):427-37。
- 12.
陈志强,陈志强,陈志强,等。钾离子与钾离子代谢的关系。中国生物医学工程学报拟南芥蒂利亚纳.《公共科学图书馆•综合》。2011;6 (10):e26360。
- 13。
陈建平,陈志强,陈志强,陈志强。拟南芥CPR5.是一种衰老调节基因,具有潮流的函数,如衰老的进化理论所预说。J Exp Bot。2007; 58(14):3885-94。
- 14。
王某,顾y,zebell sg,安德森lk,王w,mohan r等人。植物效应触发免疫中CKI-RB-E2F细胞周期信号通路的非甘露解作用。细胞宿主微生物。2014; 16(6):787-94。
- 15.
王S. CPR5-CKI信号通路在整合植物应激反应方面发挥着核心作用。可以j植物sci。2017; 97(5):767-70。
- 16.
Jing HC, Dijkwel PP. CPR5:一个工厂的多面手。植物学报。2008;3(8):562-3。
- 17.
顾y,Zebell Sophia G,梁Z,王S,康B-H,董X.核孔渗透是效应引发的抗扰度的会聚信号事件。细胞。2016; 166(6):1526-38 E11。
- 18.
刘yg,shirano y,fukaki h,yanai y,tasaka m,tabata s等人。转化态受态染色体矢量与大型基因组DNA片段的植物突变体的互补加速了位置克隆。Proc Natl Acad Sci U S A. 1999; 96(11):6535-40。
- 19.
萧Z,刘X,亨西伊,寄生HF。Smad 3的N末端中的不同的核定位信号决定了其配体诱导的核易位。Proc Natl Acad Sci U S A. 2000; 97(14):7853-8。
- 20.
高G,张某,王C,杨X,王Y,苏X等。Arabidopsis CPR5通过LOX途径和ABA信号传导独立地调节种子萌发和发育的发芽逮捕。Plos一个。2011; 6(4):E19406。
- 21.
Perazza D,Laporte F,Balague C,Chevalier F,Remo S,Bourge M等。GEBP / GPL转录因子调节CPR5依赖过程的子集。植物理性。2011; 157(3):1232-42。
- 22。
桃C,Velten J.转基因表达变异性(位置效应)猫和格斯通过连接的分歧T-DNA启动子驱动的报告基因。植物mol biol。1991; 17(1):49-60。
- 23。
Gelvin SB。农杆菌介导的植物转化:“基因 - 赛道”工具背后的生物学。Microbiol mol Biol Rev.2003; 67(1):16-37。
- 24。
sugimoto-shirasu k,roberts k。“巨大的它”:植物中的结核和细胞尺寸控制。CurrOp植物BIOL。2003; 6(6):544-53。
- 25。
Tahir J,Watanabe M,Jing H-C,Hunter Da,Tohge T,Nunes-Nesi A等。r型介导的先天免疫和疾病易感性的激活受拟南芥中细胞溶质O-乙酰丝氨酸(硫醇)裂解酶的突变的影响。工厂J. 2013; 73(1):118-30。
- 26。
Lozano-duránr,zipfel c.增长和免疫之间的权衡:芸苔类固醇的作用。趋势植物SCI。2015; 20(1):12-9。
- 27。
Meng Z,Ruberti C,Gong Z,Brandizzi F.CPR5调节水杨酸和展开的蛋白质反应,以管理植物生长和压力反应之间的权衡。植物J. 2017; 89(3):486-501。
- 28。
Walters D,Heil M.成本和权衡与诱导抗性相关。physiol mol植物疗法。2007; 71(1):3-17。
- 29。
HUOT B,Yao J,Montgomery BL,他SY。植物的生长防御权衡:优化健身的平衡行为。莫尔工厂(牛津大学出版社/美国)。2014; 7(8):1。
- 30.
王志强,王志强,王志强,等。FTSH4蛋白酶的缺乏影响拟南芥线粒体中的蛋白质羰基化、线粒体形态和磷脂含量:对复杂相互作用的新见解。植物杂志。2016;171(4):2516。
- 31。
Caarls L,Pieterse Cmj,van Wees Scm。水杨酸如何对茉莉酸信号传导进行转录控制。前植物SCI。2015; 6:170。
- 32。
Kempel A,SchädlerM,Chrobock T,Fischer M,Van Kleunen M.与本构和诱导植物抵抗草食病的兴奋相关的权衡。PROC NATL ACAD SCI。2011; 108(14):5685。
- 33。
景慧聪,赫贝尔·r,oeljeklaus s,sitek b,stühlerk,meyer he,等。早期叶片衰老与拟南芥中的改变的细胞氧化还原平衡有关CPR5./old1突变体。植物BIOL。2008; 10(S1):85-98。
- 34。
Engelsdorf T, Gigli-Bisceglia N, Veerabagu M, McKenna JF, Augstein F, van der Does D,等。模式触发免疫和细胞壁完整性维护共同调节植物应激反应。bioRxiv。2017:130013。
- 35。
Kirik V,Bouyer D,Schobinger U,Bechtold N,Herzog M,Bonneville JM等。CPR5.参与细胞增殖和细胞死亡控制并编码一种新的跨膜蛋白。咕咕叫医学杂志。2001;11(23):1891 - 5。
- 36。
Brininstool G,Kasili R,Simmons La,Kirik V,Hulskamp M,Larkin JC。病因相关基因5的组成型表达影响细胞壁生物发生和培养体发育。BMC植物BIOL。2008; 8:58。
- 37。
Llorente F,Muskett P,Sanchez-Vallet A,Lopez G,Ramos B,Sanchez-Rodriguez C,等。抑制促进症响应途径增加了对病症真菌的拟南芥易感性。莫尔植物。2008; 1(3):496-509。
- 38。
Kazan K, Manners JM。将发育与防御联系起来:植物-病原互作中的生长素。植物科学进展。2009;14(7):373-82。
- 39。
Choi J,Huh Su,Kojima M,Sakakibara H,Paek K-H,Hwang I.细胞分离激素激活的转录因子ARR2.通过促进植物免疫TGA3 / NPR1.- 在拟南芥中依赖性水杨酸信号传导。DEV细胞。2010; 19(2):284-95。
- 40.
Choi J,Choi D,Lee S,Ryu C-M,Hwang I. cytokinins和植物免疫:老敌人或新朋友?趋势植物SCI。2011; 16(7):388-94。
- 41.
Denancén,sánchez-vallet a,Goffner D,Molina A.疾病抵抗或生长:植物激素在平衡免疫应答和健身成本方面的作用。前植物SCI。2013; 4:155。
- 42.
Claeys H,De Bodt S,InzéD.Gibberellins和Dellas:增长监管网络中的中央节点。趋势植物SCI。2014; 19(4):231-9。
- 43.
宋某,黄鹤,高清,王j,wu d,liu x等。互动MYC2和乙烯不敏感3调节拟南芥中茉莉酸酯和乙烯信号之间的拮抗作用。植物细胞。2014; 26(1):263-79。
- 44.
王F,朱D,黄X,Li S,龚Y,Yao Q等。从无细胞测定系统中获得的拟南芥Della蛋白的生化见解。植物细胞。2009; 21(8):2378-90。
- 45.
Chabregas SM, Luche DD, Van Sluys MA, Menck CF, Silva-Filho MC.两个框架内翻译启动密码子的差异使用调节亚细胞定位拟南芥蒂利亚纳THI1。中华细胞杂志2003;116(p2): 285-91。
- 46。
Sunderland Pa,West Ce,Waterworth Wm,Bray Cm。在单个转录物中选择起始密码子决定DNA连接酶1同种型生产和细胞内靶向拟南芥蒂利亚纳.Biochem Soc Trans。2004; 32(PT 4):614-6。
- 47。
Christensen AC,Lyznik A,Mohammed S,Elowsky Cg,Elo A,Yule R等人。双域,双靶向细胞膜蛋白质在拟南芥中可能使用非八乌乌开始密码子。植物细胞。2005; 17(10):2805-16。
- 48。
Wamboldt Y,穆罕默德S,Elowsky C,Wittgren C,De Paula WB,Mackenzie SA。雷达核糖体扫描在高等植物中替代翻译起始蛋白质双重靶向的参与。植物细胞。2009; 21(1):157-67。
- 49。
asano k。为什么开始密码子选择如此精确的真核生物?翻译。2014; 2(1):E28387。
- 50。
Boch J,Verbsky ML,Robertson TL,Larkin JC,Kunkel BN。抗性基因介导的防御反应分析拟南芥蒂利亚纳携带突变的植物CPR5..植物与微生物的相互作用。1998;11(12):1196-206。
- 51。
张志强,张志强,张志强,等。拟南芥分子生物学研究进展[j]。冷泉港:实验室出版社;2002.
- 52。
张x,亨罗基r,林ss,niu qw,chua nh。农杆菌介导的转化拟南芥蒂利亚纳使用花卉DIP方法。NAT PROTOC。2006; 1(2):641-6。
- 53。
Pfaffl MW,Tichopad A,PrGomet C,Neuvians TP。使用配对相关性测定稳定监管靶基因,差异调控的靶基因和样品完整性:基于BeyKeeper - 基于Excel的工具。Biotechnol Lett。2004; 26(6):509-15。
致谢
我们要感谢Gill Norris博士,SFS,Massey University,Palmerston North为她的帮助选择氨基酸METCPR5.Massey University, Palmerston North, SFS, Tina Sehrish博士,获得技术支持和有帮助的讨论,Niki Minards, Manawatu Microscopy Imaging Centre (MMIC), Massey University,获得扫描电子显微镜工作。
资金
MBF是高等教育委员会(HEC),巴基斯坦,奖学金的收件人。欧盟FP7-IRSES / RSNZ Grant#612630到PPD。欧盟Horizo n 2020研究和创新计划,Plantasyststorstors to tsg和BMR(FPA号664620下的SGA-CSA No.739582)。TSG承认BG05M2OP001-1.003-001-C01项目,由欧洲区域发展基金通过保加利亚语“科学和智能增长”运营计划提供资金。资金机构没有参与实验设计,数据收集和分析或准备稿件。
作者信息
从属关系
贡献
MBF和PPD设计了该项目。MBF进行了所有的实验工作。MBF,PPD,TSG和BMR分析了数据并写了稿件。所有作者均阅读并批准了手稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1:
推定转换起始网站和RNA阀门环结构的位置。图S2:用于实时QRT-PCR量化的引物的序列比较和位置。图S3:下轴表皮铺装细胞面积。表S1:名称名单。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
费萨尔,m.b.,盖切夫,t.s.,穆勒-罗伯,B。等等。假定的替代翻译起始位点编码的核苷酸CPR5.调节生长和抗性。BMC植物BIOL.20.295(2020)。https://doi.org/10.1186/s12870-020-02485.2.
已收到:
公认:
发表:
关键词
- CPR5.
- 植物生长
- 抗病性
- 细胞死亡
- 拟南芥蒂利亚纳
- exodoreduplication