摘要
背景
如果植物第一次面对压力,大多数对压力敏感的基因会对相同方向的冷光和强光做出反应。正如最近所显示的,对于一小部分核心环境应激反应簇的基因,预处理拟南芥在24小时的4°C冷刺激下,基因表达的冷调节在20°C下持续了一周,尽管主要的冷效应在前24小时内恢复。这种基于记忆的调节被称为启动效应。在这里,我们分析了24小时冷启动对转录组范围内基因表达的冷调控的影响,并研究了冷启动是否以及如何影响光对基因表达的调控。
结果
冷启动影响了一小部分基因的冷和超光调节。与未启动植物在冷光胁迫下观察到的强基因共调控相反,在冷启动植物中,大多数启动敏感基因以胁迫特异性的方式进行调控。此外,在4°C 24 h的低温处理和800 μmol量子m的热滤强光下,基因的反向调控和共调控几乎一样多−2年代−1).基因本体富集分析表明,冷启动优先支持植物在冷触发下防御病原体相关基因的表达。这种调控是以参与生长调控和运输的基因的表达为代价的。相反,在强光触发下,冷启动导致调节代谢和发育的基因表达增强,防御基因表达减弱。独立培养和处理重复的qPCR证实了RNASeq引导实验中观察到的趋势。
结论
24小时的启动冷刺激激活了持续数天的应激记忆,该记忆控制基因表达的冷和光调节,并以应激源特异性的方式调节生长和防御调节。
背景
植物对各种环境信号作出动态反应,并能适应许多不利条件[1,2,3.]。对持续轮班的性能优化称为适应或适应。这一过程需要花费数天时间,涉及代谢、基因表达、有时甚至是解剖和形态方面的成本高昂的变化[4,5]。特异性信号传导,如冷诱导的ICE (CBF表达诱导剂)-CBF (C-repeat binding factor, C-repeat binding factor)通路[6],例如ROS(活性氧)和脱落酸信号共同配置植物,使其激活并表现出更高的抗逆性[1,7]。一旦条件改善,大多数支持适应的反应几乎立即停止,恢复调节开始[8,9,10]。
如果连续应激事件之间的滞后阶段本身太短,不足以建立保护,但足够短,足以维持部分适应反应,几个短的刺激可以导致与连续应激经历相似或更高的应激耐受性[11]。这种现象被称为夹带。
相比之下,启动与压力的持续或原始压力反应的积累无关[12]。应激记忆(由启动刺激引起)使用以低代谢成本设置的信息载体,并修改对后续应激(触发应激)的反应[12,13]。启动已被描述为广泛的生物和非生物应激刺激[12,13,14]。然而,在大多数情况下,特定记忆机制的(精确)性质仍然是未知的。根据最初的记录,它可以从亚稳定的代谢印记到跨代稳定的表观遗传标记[13,15,16]。
在我们早期关于冷启动的研究中,我们发现拟南芥在4°C下处理24 h,差异调节核心环境应激反应簇的基因,这些基因是在应对各种应激源时诱导的,包括寒冷[17,18]。冷启动减弱了锌指转录因子的诱导作用ZAT10(锌指转录因子10;STZ;(在较小程度上)BAP1(bon1相关蛋白;At3g61190))在5天后的冷刺激和支持冷激活CHS(查耳酮合酶;TT4;At5g13930)和PAL1(苯丙氨酸铵裂解酶;At2g37040)表达[17]。相同的启动刺激不影响冷诱导COR15A(At2g42540) [17],受主要冷驯化调控ice - cbf通路的调控[1]。
在这个小的基因选择中,ZAT10表现出最强的引物性[17]。ZAT10表达响应广泛的非生物胁迫,包括高光强和寒冷[17,18,19]。转录因子介导次级基因表达调控,如诱导非质体抗坏血酸过氧化物酶APX2(At1g07890)和叶绿体铁超氧化物歧化酶FSD1(At4g25100)并抵消渗透和耐盐性的充分激活[20.]。
ZAT10在非应力条件下几乎不表达[17,21]。在突然寒冷或过度光照下发生的光氧化应激反应[22,23,24],它是由活性氧(ROS)诱导的,可能是由H2O2[25]。在高光下,ZAT10诱导是由PAP(3′-磷酸腺苷5′-磷酸)支持的,PAP(3′-磷酸腺苷5′-磷酸)在光氧化抑制PAP-去磷酸化叶绿体基质定位磷酸酶SAL1 (At5g63980)时积累[26]。在寒冷条件下,cbf依赖性转录因子CZF1 (At2g40140)的诱导被激活ZAT10表达式[27,28]。各种各样的ZAT10调控途径受到叶绿体抗氧化保护的不同控制。然而,例如,ROS对SAL1的调节更多地依赖于基质抗坏血酸过氧化物酶(sAPX)的功能,而不是类囊体抗坏血酸过氧化物酶(tAPX)的活性[26,冷调节CBF基因被tAPX拮抗[29和冷启动ZAT10仅由瞬时冷后积累的tAPX介导,可以拮抗tAPXRNA沉默[17,30.]。
低温主要减缓酶促反应,而过量光照增加光合光反应的激发压力,对能量消耗影响不大[2]。22,23,24尽管这两种扰动的性质不同,但冷光和过量光都会导致光合电子传递和消耗氧化还原能量的叶绿体代谢之间的失衡。与对光合作用影响的高度相似性相一致的是,在naïve植物中,这两种胁迫类型对87%的应答基因的调控方向相同[31]。许多冷反应基因,例如:BAP1和ZAT (拟南芥锌指属转录因子ZAT6(At5g04340),ZAT10和ZAT12(At5g59820) [20.,32,33,34]属于“核心环境应激反应基因”,在各种应激条件下被诱导,介导应激反应调节和适应过程[18]。低温和光照胁迫下转录组调控的高度重叠[j]31]表示强烈的反式-冷启动对光调控基因表达的影响。相反,主要应激反应基因调控的复杂性,比如ZAT10,让我们假设独联体- - -反式特殊效果。在本研究中,我们比较了24 h冷启动对5 d后4°C或温控强光(800 μmol光子m)响应的影响−2年代−1)触发刺激,首先,对频繁与ZAT10最后,在转录组的大范围内研究冷启动对未来基因表达调控的特异性。
结果
冷启动导致特定ZAT基因的冷激活减少
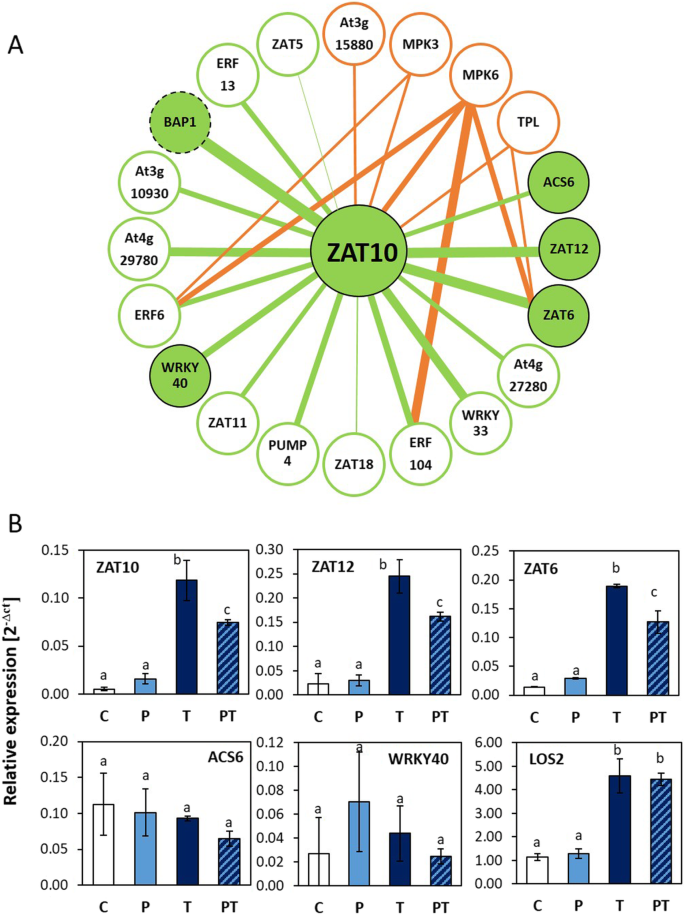
ZAT10先前的研究表明,所选择的冷反应基因具有最强的引物性[17]。来识别类似的调控基因拟南芥使用GENEMANIA对转录本丰度调控的公开可用数据资源进行扫描ZAT10类似调控基因[35]。15个突出显示的基因(图2)1一)包括BAP1,就像ZAT10,在4℃条件下冷激24 h后5天冷激敏感性降低,如前所示[17]。此外,GENEMANIA还命名了锌指转录因子的基因ZAT6锌指蛋白6;At5g04340),ZAT11(At2g37430),ZAT12(At5g59820),ZAT5(At2g28200),ZAT18(At3g53600), WRKY转录因子WRKY33(At2g38470)和WRKY40(At1g80840), ap2型转录因子ERF6乙烯响应因子6;At4g17490),ERF13(At2g44840)和ERF104(At5g61600),线粒体解偶联蛋白PUMP4(At4g24570)和Ca2 +-结合蛋白编码基因At4g272800。STRING v.11平台上的类似分析[36也显示ACS61-氨基环丙烷-1-羧酸合成酶6;At4g11280),参与乙烯的生物合成,作为一种ZAT10共表达基因(图2)1).所有这些基因都有反应,比如ZAT10,广泛的非生物应激刺激和氧化应激[20.,37,38,39,40,41,42,43]。
STRING v.11进一步表明了蛋白与蛋白之间的相互作用。1;橙色线)。通过反馈效应,它们可以影响转录物丰度调控。ZAT10转录因子与MAP激酶MPK3 (At3g45640)和MPK6 (At2g43790)相互作用,这两个激酶是响应生物和非生物信号的核心植物胁迫信号转导通路的元件[44,45]。MPK6和MPK3也磷酸化ZAT6 [46], erf6, erf104 [41,43], wrky33 [47], wky40 [41]及ACS6 [48]。此外,ZAT10与转录共阻遏子toppless (TPL, At1g15750)和toppless - related -4 (At3g15880)相互作用[44,49,50,51]。TPL也结合ZAT6 [50]。测试ZAT10我们选择了与MPK6 / MPK3和/或TPL具有不同亲和力的基因,即ZAT10,ZAT6,ACS6和WRKY40用于qPCR(定量聚合酶链反应)的引物分析。我们进一步纳入了双功能烯醇化酶基因LOS2(At2g36530),这是一个负的上游转录调控因子ZAT10[52]。通过qPCR分析了这些基因在触发后立即在未处理植株(T)和在冷触发前5天冷启动植株(PT)中的转录水平。作为对照,分析了未处理的植物(C)和在启动冷处理前5天感知到冷处理但未被冷触发的植物(P)。
就像ZAT10的转录水平ZAT12和ZAT6与t型植物相比,pt植物显著减少,显示了启动敏感性(图2)。1b)。ACS6和WRKY40对触发刺激不敏感,与植物是否冷启动无关。的监管LOS2,它将ZAT10启动子和控制ZAT10介导的寒冷和干旱标记基因的冷诱导RD29[52],是强冷诱导的(C-和T-植物中转录物水平的比较),但不受启动调节(T-和pt -植物中转录物水平的比较)。分析没有表明与已知的zat10相互作用蛋白的相互作用控制启动,但表明冷启动影响特定基因,即使是在一组基因中,这些基因在其他情况下被广泛地共同调节ZAT10[17,18,19(图。1).
冷启动对ZAT基因在强光触发下调控的影响
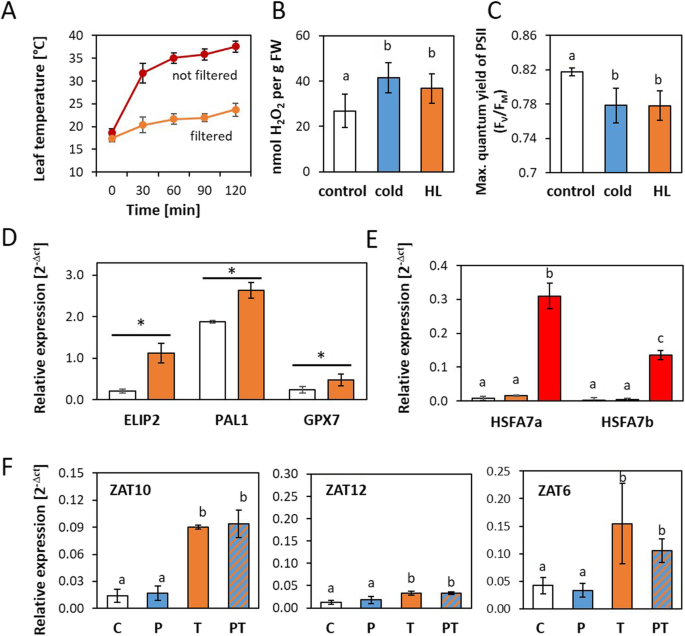
为了比较冷启动对冷光和强光触发的影响,我们建立了800 μmol量子m的热过滤强光触发装置−2年代−1)(图。2a,这增加了H2O2水平和对光系统II(由光系统II的最大量子产率所示)的损害程度与用于冷启动和冷触发的4°C处理相似(图2)。2B和c)。
冷启动对光触发的影响。一个热过滤(橙色)和非热过滤照明(红色)下的叶片表面温度。bH2O2对照植物(白色)和冷植物(蓝色)或强光触发植物(橙色)的含量。从两个独立栽培和处理的植株组中获得的9株植株数据中,不同字母表示差异具有统计学意义(学生t检验;p< 0.05)。c光系统II的最大量子产率(FV/ F米)在对照植物(白色)和冷(蓝色)或强光触发植物(橙色)。暗驯化20分钟后,用饱和白光闪光测定该参数。从两个独立栽培和处理的植株组中获得的10株植株数据中,不同字母表示差异具有统计学意义(学生t检验;p< 0.05)。d对照植物(白色)和热控光照2 h后(橙色)光响应基因的相对转录丰度。成绩单水平是标准化的成绩单水平YLS8;相对转录本丰度的统计显著差异用星号标记(n= 3 - 5;Tukeys事后检验;p< 0.05)。e对照植物(白色)、热控光照2 h(橙色)和非热控光照(红色)后热响应基因的相对转录丰度。成绩单水平是标准化的成绩单水平YLS8;在统计上有显著差异的相对转录本丰度用不同的字母标记(n= 3 - 5;Tukeys事后检验;p< 0.05)。f4°C低温诱导24 h对光刺激转录物丰度调控的影响。对照植物(C)、仅冷启动植物(P)、仅光触发植物(T)和光触发后立即冷启动+光触发植物(PT)相对转录本丰度的调控。根据3-5个独立培养和处理的生物重复获得的数据,不同字母表示相对转录物水平的差异具有统计学意义(Tukeys事后检验;p< 0.05)。所有子图均显示平均值±标准差
通过qPCR进一步评估其对表征良好的光和热调控基因调控的影响。在强光照射2 h后,光诱导基因的转录水平下降ELIP2(早光诱导蛋白2, At4g14690 [53),),GPX7(谷胱甘肽过氧化物酶, At4g31870 [54),),PAL1(苯丙氨酸铵裂解酶, At2g37040)升高(图2)。2d).热过滤器足以抵消热敏基因的显著激活HSFA7a(At3g51910)和HSFA7b(At3g63350) [55,56(图。2e)。
除了归纳ZAT10,光处理增加了ZAT6转录水平几乎与24 h冷处理的t植株一样强。1b和2f)。ZAT12对光处理的反应非常微弱(但也很明显)(图2)。2f).在冷源植物中,ZAT6在pt植株中比在t植株中更低,表明了引物性,但由于基因诱导水平的差异较大,影响不显著。相反,转录水平ZAT10和ZAT12在启动和未启动的植物中,受光触发的调节更为相似(图2)。2f).因此,冷启动对这些基因的光触发反应没有任何影响或只有很小的影响。
触发后的光合性能
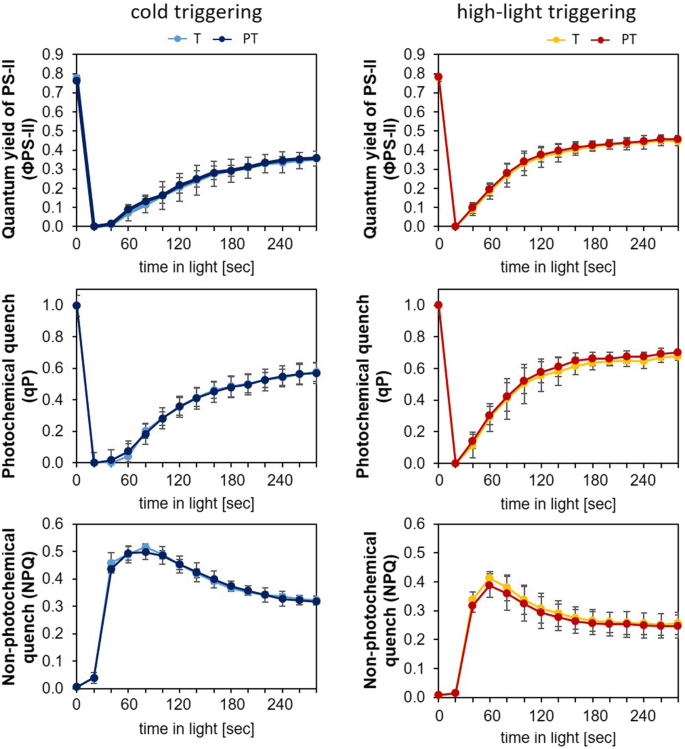
冷光触发反应的不同之处扎-冷源植物中的基因(图;1b和2f),尤其是ZAT10这可能是由于启动对光合电子传递效率的影响。为了验证这一假设,我们通过叶绿素-a荧光分析比较了冷源植物在冷触发和光触发后光系统ii的光合性能。触发型(T)和启动+触发型(PT)植物在中年叶片中通过二维叶绿素-a荧光成像并排分析,在4周的植物中显示出最强的启动敏感性。30.(图。3.).
冷触发和光触发后,光系统ii的最大量子产率(FV/ F米;图中0分钟。3.上图)在黑暗驯化的T-和pt -植物中相似,表明触发反应不受冷启动的影响。光通量密度(PPFD)为185 μmol量子m−2年代−1,光系统II的量子产率(Φ)PS-II)、光化学和非光化学猝灭(qP和NPQ)在启动和未启动植物之间也没有差异,无论是冷触发还是光触发(T-和PT)。结果表明,虽然冷和光对Φ的影响不同,但启动处理并没有降低对触发应激的响应PS-II淬火参数(图1)3.).T-植物和pt -植物响应的相似性不支持基因表达调控的启动依赖差异是由启动引起的应激诱导损伤或光系统ii活性调节的差异引起的假设。
冷启动对冷调控和高光调控基因表达的影响
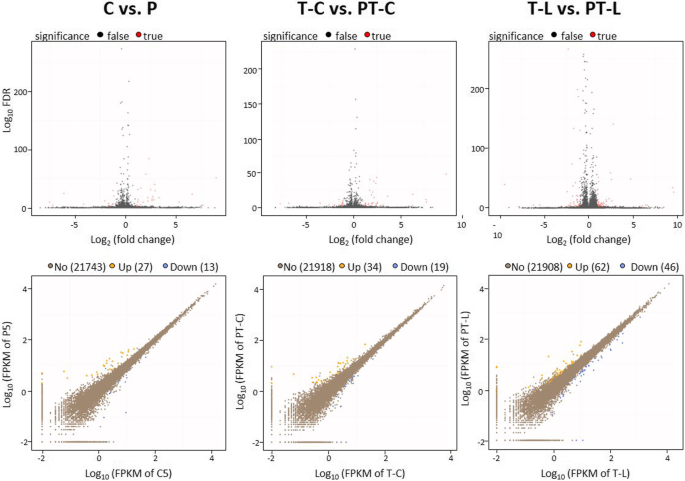
为了更深入地了解冷启动对胁迫反应的影响,我们在低温(4°C)和光触发(800 μmol量子m) 2 h后,最大限度地拓宽了靶基因谱,并进行了全基因组rna测序(RNASeq)分析−2年代−1) 5天前冷处理和未处理植株。RNA测序结果为每个样本2376 - 2414万reads。选项卡。1).至少,98.49%的reads可以被定位到TAIR10基因组。选项卡。1).记录了24,085个不同基因的序列。许多众所周知的,高度冷和光响应转录因子的转录水平,例如。CBF1(At4g25490)和CBF3(At4g25480) [57],ANAC078(At5g04410) [58),ZAT10[17,21),ZAT6[59],在冷或光触发2小时后已经强烈减少。选项卡。2).与此同时,次级冷调控基因的转录水平,如cbf3调控基因COR15A(At2g42540)和ANAC078靶基因At1g56650, At3g01600和At5g58610 [60仍然被诱导(补充)。选项卡。2).以热诱导性为特征的基因,如HSFA2(At2g26150),HSFA7a(At3g51910),HSA32(At4g21320),在所有样品中仅极弱表达。选项卡。2).衰老调控因子NAC的转录水平ORE1(ANAC092;At5g39610) [61]在任何样品中均未增加。选项卡。2).表达模式证实了应激源特异性靶基因的高响应性,并表明处理不会诱导热信号或激活衰老。
在未处理的植株中,61.7%在光照下上调2倍以上的基因和32.8%在光照下下调2倍以上的基因在冷处理下也有至少2倍的调控。相反,在至少2倍调控的基因中,只有0.3%和5.5%受到冷和光的负调控。因此,我们的冷光处理在未引物的植物中广泛地向同一方向调节基因,这与之前其他人的研究结果相似[31]。
火山图(描绘了基于错误发现率(FDR)的启动依赖调节的强度)(图2)。4上),并对引物植株(y轴)与相应未引物植株(x轴)的基因表达水平进行印迹分析(图2)。4底部),表明冷启动仅影响特定基因的冷和光调节。与光触发相比,冷触发导致的基因表达变异性要小得多。4底部)。一般来说,在中等强表达基因中观察到最显著的启动依赖性调控(图2)。4底部)。
主成分分析(PCA)(图1)5a)和聚类(图2)。5b) T型和pt型植株中相对转录本水平的变化表明,对非触发型、冷触发型和光触发型植株的启动效应在方向和强度上存在差异。在第一个比较中,我们已经假设触发后观察到的启动效应不是由于基因对启动刺激反应的长期失调,而是启动影响了对触发刺激的反应。
通过RNASeq观察到转录物丰度调控。一个主成分分析分离非触发(C, P)、冷触发(T-C和PT-C)和光触发样本(T- l和PT- l)的数据集,根据触发刺激的类型比启动效应(P或PT与C或T相比)更强。b低温或光照触发、引物或未引物样品相对于对照植物转录物水平的转录物丰度调控聚类分析。热图只列出了在启动和/或触发植株中表达强度至少为c植株2倍或低于c植株的基因(FDR值< 0.001)。10倍上调转录本以暗红色表示,10倍下调转录本以蓝色表示。cvenn图描绘了在强阈值设置为log时,在冷触发(PT-C)或光触发(PT-L)之前(P)和之后以启动依赖方式上调或下调的基因数量2(启动/未启动)≥I 1 I和FPKM≥10 (前)或日志的弱阈值设置2(启动/未启动)≥I 0.5 I和FPKM≥5 (底)
冷启动的长期、非触发依赖性基因表达效应
为了进行更严格的基因调控分析,我们选择了在所有样本中检测到的13775个基因,并在至少一个数据集中以FPKM(每千碱基外显子每百万读取的片段数)值5或更高的值进行记录。通过将滞后期(P / C)末、冷触发植物(PT-C / T-C)和光触发植物(PT-L / T-L)的fpkm值除以,计算了引物对转录本水平的影响。
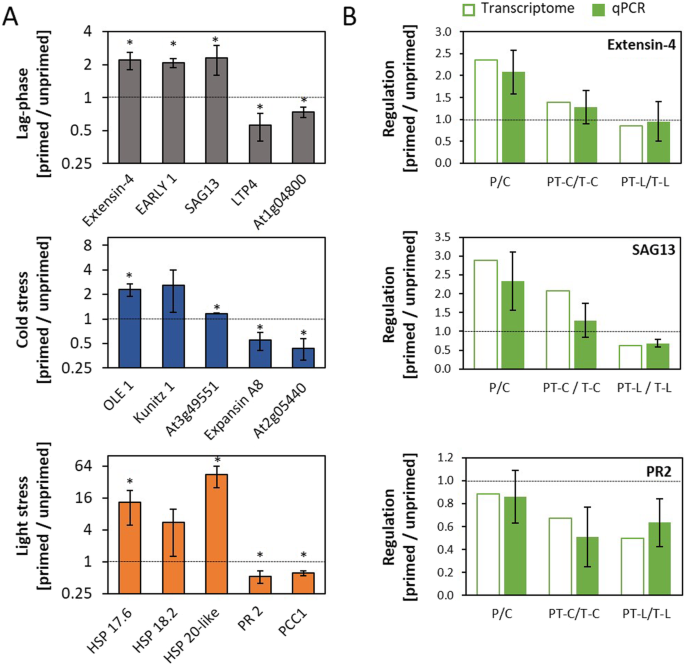
在5天的滞后期结束时,C和P植株的转录组比较表明,在施加触发刺激之前,转录组已经广泛恢复。与对照植物相比,只有12个基因的转录水平高2倍以上,只有4个基因的转录水平低2倍以上(图2)。5好了,补给。选项卡。3.).At1g53870编码一个LURP(延迟/持续上调)响应Hyaloperonospora parasitica)类蛋白At1g73260(推测的胰蛋白酶抑制剂)、At4g12490和At4g12480(两种双功能抑制剂AZI3和ealie1)、阳离子交换剂At3g51860和卤酸脱卤酶样水解酶(HAD)超家族蛋白At5g36790)的上调最为明显。这些基因在对照条件下表达较弱。因此,转录水平的绝对调控是低的。相反,一个跨膜蛋白(At4g12495)的转录水平,衰老和胁迫诱导基因SAG13(At2g29350,编码短链醇脱氢酶)和extensin-4(At1g76930)的FPKM值大于10。在冷启动后5天,它们的转录物水平增加了2倍以上,反映出强烈的绝对效应(补充表)。3.).
与C相比,P中下调的四个基因编码脂质转移蛋白4 (At5g59310)、富含甘氨酸的蛋白(At1g04800)、另一个lurp1样蛋白(At1g53890)和胚胎发育控制基因(At4g29660)。选项卡。3.).
在至少一个处理和日志中分析低阈值(FPKM≥5)的转录物丰度模式2(启动/未启动)≥I0.5I)(图5c底部)显示,365个潜在的长期调控基因中只有两个,即假设基因(At5g23411)和At1g53870(编码lurp1相关蛋白),在未触发和冷或光触发的植物中共同上调。在所有三个处理组中,只有一个假设基因(At1g13470)在冷启动植物中共同下调。选项卡。4).协同调节基因的数量非常少,表明启动记忆以应激源特异性的方式影响基因调节。
冷启动对冷触发和光触发的常见触发依赖效应
因为寒冷和过量的光线会将大多数基因调控在同一个方向上[31],共同信号转导元件的调控将导致冷触发和光触发对启动敏感基因的影响高度相似。已经分析了一小部分的选择ZAT10相关基因存在差异(图2)。1b和2e).在转录组水平上,RNASeq分析鉴定在更严格的条件下进行分析(FPKM≥10和log)2(PT/T)≥I1I)只有一个未进一步表征的跨膜蛋白(At4g22510)的基因可能(至少2倍)在冷和光触发的植物中共调控(图2)。5c)。
降低阈值至FPKM≥5和log2(PT/T)≥I0.5I显示29个基因在光和冷触发后以启动依赖的方式共调控(supply . 1)。选项卡。4).17个共同上调的转录本中有8个位于同一染色体区域,几个短基因在正义和反义方向上重叠。因此,FPKM值(为这些基因计算的)可能夸大了实际的转录物丰度和单个基因的调节幅度。其余共同上调的基因(除了假设的蛋白质和功能未知的蛋白质)编码erd6样1 (早期脱水反应-6 like-1;At1g08920)、cc - nps - lrr类免疫受体(At1g59218)、延伸蛋白OLE1 (At2g16630)、激酶抑制剂样蛋白(At2g28870)、质体编码光受体蛋白M (Atcg00220)和质体核糖体亚基L32 (Atcg01020)等多种蛋白。
在12个基因组中,这12个基因在启动植物的光和冷触发后表达较少(补品)。选项卡。4),三个编码疾病相关基因,即两个β-葡聚糖酶(PR2 (BGL2;At3g57260)和BLG3 (At3g57240))和一个几丁质酶(At2g43570)。
冷启动对冷触发和光触发的特殊影响
大多数启动反应基因受到冷触发或光触发的调节(图2)。5c).在高选择性条件下(FPKM≥10,log2(PT/T)≥I1I)时,只有膨胀素a8 (At2g40610)和甘氨酸富蛋白9 (At2g05440)两个基因在冷触发后由于冷启动而转录水平降低。与此同时,13个基因在冷触发后在冷启动植物中比在未启动植物中表达更强烈。其中三个,库尼茨胰蛋白酶抑制剂(At1g73260),NIT2(At3g44300)和SAG13(At2g29350),在应用触发刺激之前已经诱导。其余10个基因中有9个编码(假设的)脂质转移蛋白或不确定其功能(补充)。选项卡。3.).剩下的触发特异性调控基因是OLE1(At2g16630)编码扩展蛋白。
相反,光触发导致冷引植物特异性积累了9个基因的转录本,其中3个基因编码热休克蛋白。各种防御相关基因,如PR2(病原体应答基因2,At3g57260),PR4(At3g04720),一种病原体和昼夜节律控制基因PCC1(At3g22231)、一种几丁质酶(At3g12500)和五种防御素在引物植物中受强光诱导的强度低于naïve(供品)。选项卡。3.).编码胰蛋白酶抑制剂和跨膜蛋白的两个基因At2g73260和At4g12495在被引植物光照前后表现出反向调控。触发反应对启动效应的反转表明,启动通过触发光胁迫事件积极影响基因调控。
当基于较弱的标准(FPKM≥5和log)筛选基因时,证实了启动对冷触发和光触发的影响在数量上的差异2(PT/T)≥I0.5I)。5C):冷启动后,130个基因被特异性诱导,121个基因被下调。与光触发的未启动植物相比,冷启动植物的光触发对613个基因的诱导作用更强,对334个基因的下调作用更强。
qPCR分析调控模式
通过至少3个独立培养和处理的生物重复,通过qPCR评估了在RNASeq实验中观察到的在滞后期结束时显示启动效应的5个基因,在冷触发后以启动依赖方式调节的5个基因,以及在光照下调节的5个启动敏感基因的调控(图4)。6a).优先选择FPKM值高的基因。在qPCR分析中,转录水平与组成表达基因的表达强度归一化YLS8(At5g08290) [62]。在所有三个基因集中,选择了三个基因,其中三个基因在启动植物中与未启动植物相比表达上调,两个基因表达下调。13、在所选的15个基因中,qPCR分析显示显著调控(Student t-Test,p< 0.05),与RNASeq数据一致。另外两个基因At5g59720(编码热休克蛋白HSP18.2)和At1g73260(编码Kunitz因子蛋白)的转录水平与RNASeq实验的方向相同,平均(尽管不显著)被调节2倍以上。
在冷引后5天,qPCR检测的5个基因中有较高的转录水平(图2)。6a顶),RNASeq分析仅显示为SAG13冷触发后的转录水平也更高。qPCR在独立培养和处理的生物重复中证实了这种效应(图2)。6b).此外,与RNASeq分析一致,在光触发后,被引植物也出现了下调。选项卡。3.;无花果。6b). qPCR进一步证实了RNASeq对extensin-4 (At1g76930)的调控PR2(At3g57260)触发前后(图2)6b).由启动和各自未启动植物的FPKM值计算得出的比率(P/C;所有处理的PT-C/T-C和PT-L/T-L值均在各种生物重复的qPCR值范围内(图2)。6b)。
冷启动效应对触发反应的功能分类
基于基因本体富集分析的启动调控基因功能分类[j]63,64],使用更广泛的数据集(log2(PT/T) > l0.5l FPKM≥5)http://systemsbiology.cau.edu.cn/agriGOv2/).采用Fischer检验(f检验)和Yekutieli法对数据处理进行评价,p水平为0.05 [65]。统计检验和多重检验调整的最小阈值设定为每个GO-term 5个基因[66]。从原始数据中,提取了分层GO结构中最具体的GO子集(图2)。7和8).完整的列表包括关于p值和FDR(错误发现率)的信息,以及按层次顺序描绘所有go术语的图形图像,均在补编中提供。选项卡。5).
冷触发后以启动依赖方式调控的基因的功能表征。以TAIR10为背景,用AgriGO鉴定富集的功能基因本体。原始数据包括统计信息和go术语参考代码在附录中进行了总结。选项卡。5
光触发后以依赖启动方式调控的基因的功能表征。以TAIR10为背景,用AgriGO鉴定富集的功能基因本体。原始数据包括统计信息和go术语参考代码在附录中进行了总结。选项卡。5
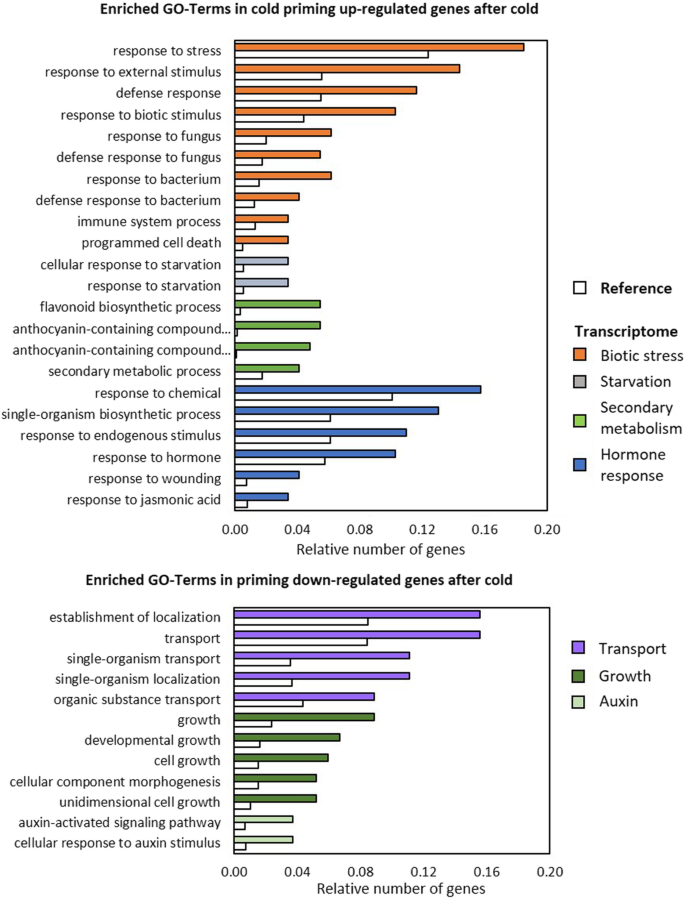
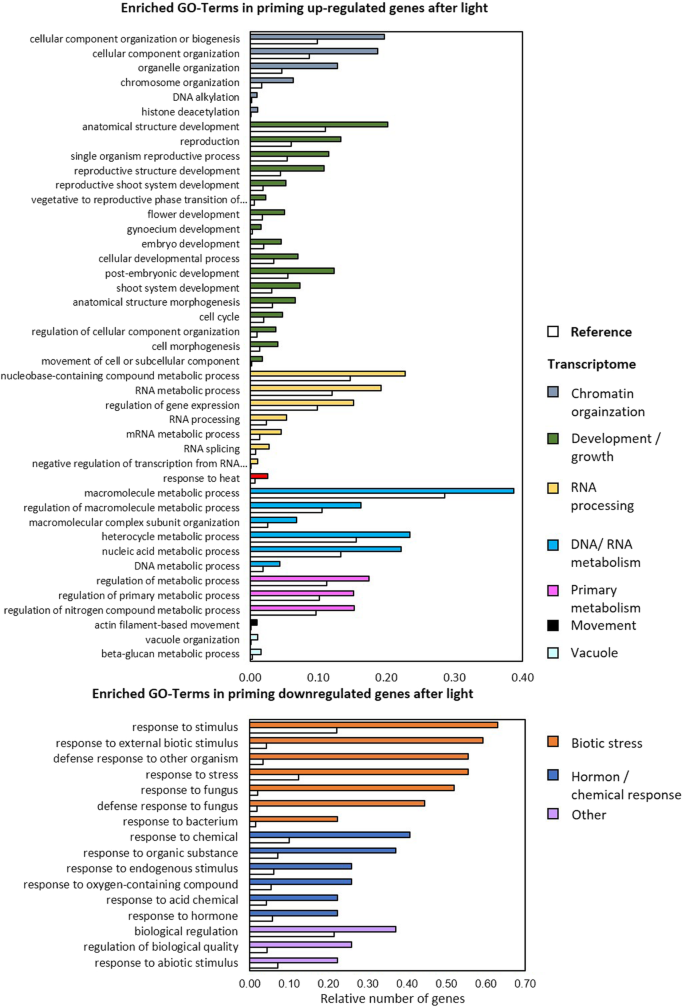
在冷触发后冷启动植物中上调的转录本组中,与未启动的冷胁迫植物相比,胁迫调节基因显著富集(图2)。7).特别是反应损伤、免疫和程序性细胞死亡调控的基因和/或受茉莉酸信号控制的基因被过度代表。此外,启动优先影响了参与饥饿调控和类黄酮和花青素生物合成的基因(At4g22880、At4g09820、At2g02990、At3g29590、At5g17220、At5g42800、At4g14090、At5g54060)的冷触发反应。后一组的所有8个基因也受到过量光的诱导,但与冷触发后的启动植物相比,光触发后的启动植物的诱导程度较低,甚至出现了反向调控。选项卡。5).CHS和PAL1,它调节苯丙素代谢的早期步骤,先前的研究表明,在寒冷的植物中,在寒冷的触发下,它被更强烈地激活[17],在新数据集中,它们也在冷启动植物中被更强烈地诱导,以响应冷触发,尽管它们没有通过用于生物信息学分析的阈值标准。与此同时,冷触发导致冷启动植物中与运输组织、生长和形态发生相关的基因表达较弱(图2)。7).各种较少表达的基因响应生长素激活的信号和反应途径。
光照触发后,冷引植物细胞器组织、形态发生和核酸代谢等相关基因的诱导作用强于非冷引植物。响应生物刺激、酸和含氧有机化合物(At5g44420、At3g15356、At3g22231、At2g14560、At1g73260、At4g10500、At3g16530)的基因和参与代谢调节过程的基因在引物植物中较少表达(图5)。8).总的来说,氧化石墨烯分析表明,冷启动导致在冷和光触发下的生长和生物应激反应的反向支持(图2)。7和8,橙色和深绿色条)。
冷光和强光反向调控启动响应基因的亚分析
159个基因在PT-C(冷启动和冷触发)植物中转录水平高于T-C(仅冷触发)植物,379个基因在PT-L(冷启动和光触发)植物中转录水平低于T-L(仅光触发)植物(FPKM值> 5和log)2(PT/T) > l0.5l) 17个基因呈负调控(见表1)。6).此外,在145个基因中,有12个基因在PT-C植物中被下调(与T-C相比),而在PT-L植物中有633个基因被上调(与T-L相比)。6).
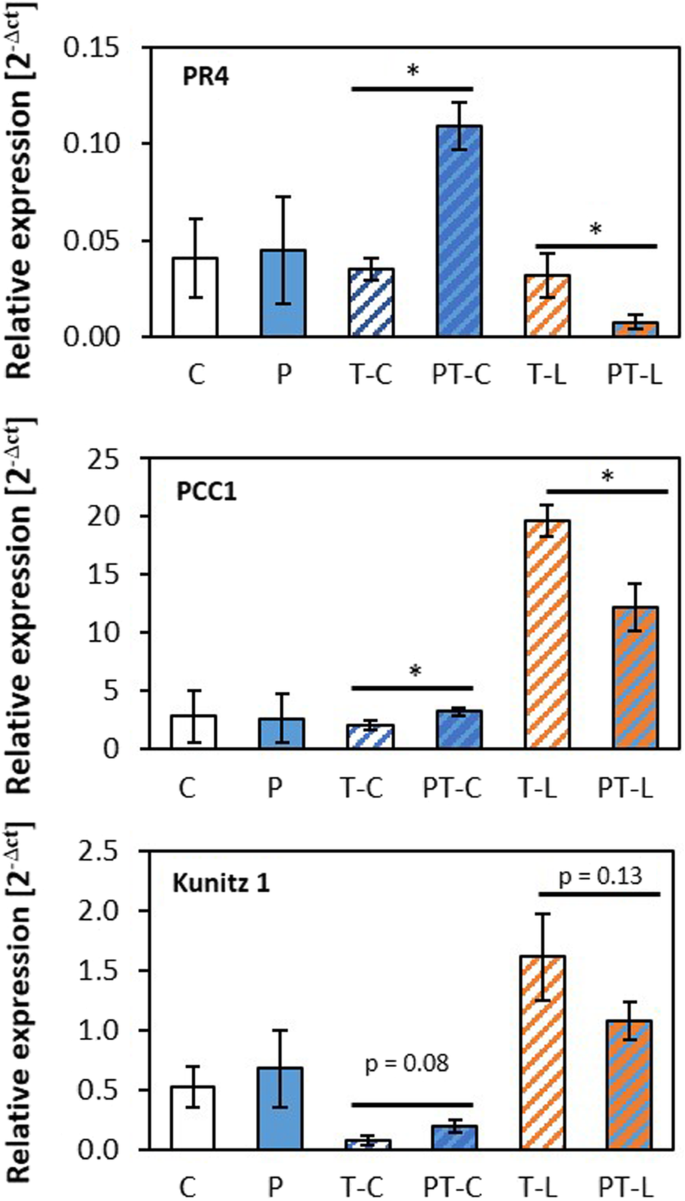
这29个反向调控基因中有6个在TAIR10中未被注释,这是使用AgriGO v2进行功能分类的数据背景。在剩余的23个基因组中,只有一个生物学功能被显著过度代表(supl。选项卡。7).23个基因中的7个,即At2g29350、At4g37990、At1g73260、At2g43510、At3g22231、At3g04720和At3g12500,对生物刺激有反应。如果植物在冷启动之前,它们在冷触发后都表现出较高的转录本水平,而在光触发后则表现出较低的转录本水平。选项卡。6).即使考虑到触发之前的轻微调节,所有这些基因都对光触发表现出特定的反应。选项卡。6).其中3个基因(At3g22231、At3g04720和At3g12500)在冷触发后也表现出转录水平的上调和对光的下调。这三个双向调控基因编码质膜蛋白病原体和昼夜节律控制(PCC1;At3g22231),发病机制4(PR4;At3g04720)和一种碱性几丁质酶(CHI-B;At3g12500)。这三个基因都与病原体防御有关。也CHS (At5g13930),而不是其他核心反应基因PAL1 (At2g37040),在冷启动的植物中表现出较强的表达,而在超光触发后表现出较低的转录水平PCC1,PR4和CHI-B(增刊。选项卡。2).
在GENEMANIA平台上的表达网络分析显示,两者之间只有非常微弱的共表达PR4和CHI-B没有两个基因的共同调控PCC1.利用eFP浏览器的compare模式对转录物丰度调控进行比较,证实了这些基因在naïve植物中几乎不受共调控的印象[67]在公开可获得的转录物丰度调控数据的发育调控拟南芥以及对生物和非生物压力的反应。qPCR分析证实了病原菌相关基因的反向调控PCC1,PR4和Kunitz 1冷激植物在冷光触发后的反应(图2)。9).CHI-B的转录本水平低于qPCR检测水平。
其他16个基因以启动依赖的方式对冷和光触发作出反向反应,具有不同的功能。5个编码跨膜蛋白(At4g12495, At1g79170, At1g16916, At5g65580和At1g53035), 2个蛋白酶抑制剂(At1g73260和At2g43510)和2个蛋白磷酸酶2C (At5g02760和At3g16800)。选项卡。6).
讨论
应激触发一系列事件,这些事件在几秒到几分钟内开始,转录活性的第一次可测量的变化[68,69]。经过一段时间的大规模调节,转录组被调整为适应调节。主应力调节和次应力调节的失活主导了应力后阶段[70]。在我们的实验中,植物在感受到启动冷刺激5天后,初级和次级基因表达调控几乎完全重置(Supp. Tab.)。2;无花果。5).在这个阶段,我们将植物暴露在寒冷或过度光照下。如果将这两种胁迫作用于naïve植物,它们对大多数基因的调控方向相同[18,31(增刊。选项卡。2).然而,在冷启动后5天,同样的刺激主要引起特异性效应,部分甚至是反向转录丰度调节(图2)。1,2,5和6;增刊。选项卡。2,3.和4).由于低温和光照调控基因之间的低重叠依赖于启动的方式(图2)。1,2和5+ 5。选项卡。3.,4,5和6),我们得出结论,冷启动解除了特定基因的冷和光调节。
冷启动建立记忆的机制以及启动诱导的信息如何在启动植物中被记录的机制仍在研究中。13,15,16]。各种研究表明,表观遗传记忆,如组蛋白和DNA(去)乙酰化或(去)甲基化,用于存储热应激事件的信息[15,71,72,73]。例如,COR15A(At2g42540)和COR47(At1g20440)的表达更强烈,如果第二个冷刺激紧随第一个冷刺激之后[74]。然而,大多数冷诱导组蛋白标记是亚稳态的。因此,对基因表达调控的影响很快就消失了。例如,冷启动效应COR15A如果在短时间冷刺激下启动,在24 h内可以完全恢复[72]。相反,长时间的低温,如在4°C下2周,会导致更高的转录本积累COR15A5天后施加24小时4°C触发刺激[17]。将亚稳态的冷记忆转变为稳定的冷记忆,如调节开花地点c(方法;(5g10140),需要几天甚至几周的低温暴露[75]。与之前基于qpcr的分析一致COR15A规定(17], 24 h冷启动后5 d无表观遗传冷记忆内参基因,即COR15A,COR47或方法(增刊。选项卡。2) [74,75],在本研究中显示了启动依赖性调节。
尽管光照和寒冷对naïve植物转录组的影响广泛重叠[31(增刊。选项卡。2),仅在32个基因中观察到启动依赖的共调控(其中几个重叠,可能反映了双重注释)(图2)。5B). 29个启动敏感基因甚至被反向调控。后一组包括核心环境应激反应簇的特征良好的基因[18],如ZAT转录因子,CHS以及致病的相关基因PCC1,PR4和CHI-B(增刊。选项卡。2;无花果。9).冷启动支持应激(激素)响应基因在冷触发时的表达,并导致与生长和代谢物运输相关的基因表达降低(图2)。7).在冷激植物中,光触发后,参与胁迫反应调控的基因下调,而参与生长、代谢和发育的基因上调(图2)。8).冷启动对基因表达调控的这种反向作用表明,启动以应激源特异性的方式影响冷和光的敏感性和反应性。在生物学功能方面,我们的分析强调了两种冷启动效应:
- (1)
冷启动支持参与花青素和类黄酮代谢的基因的冷调节。
8个参与黄酮类化合物和花青素生物合成的基因在低温触发下表现出启动依赖性调控(图2)。7;增刊。选项卡。2和5).花青素和类黄酮是广谱保护剂,不仅能过滤紫外线和/或蓝光和红光,而且还具有抗氧化能力[76,77]。它们的合成受到各种胁迫的激活,包括寒冷、紫外线、干旱、盐和强光[78,79]。CHS和PAL1,先前通过qPCR显示,在冷触发下,这些基因在冷引植物中被诱导得更强烈[17],编码催化苯丙素代谢初始步骤和控制查尔酮代谢通量的酶。尽管对CHS和PAL1转录物水平没有通过本研究中应用的严格阈值标准,它们的转录物丰度在冷启动的植物中也较高(在强光触发下较低或不变)。选项卡。2).8个冷调控基因中的5个,即At5g42800, At5g17220, At4g22880, At4g14090和At4g09820,加上CHS和PAL1由MYB75 (At1g56650) [80]。MYB75表达受ZAT10 [20.]。MYB75转录水平在冷触发时显示出轻微的正冷启动效应,而在强光触发时则没有。选项卡。2),与选择性启动依赖性调控一致ZAT10在寒冷时,但不是光触发(图2)。1和2).它可以将启动调控联系起来CHS/PAL1和ZAT10,我们之前假设它是由平行诱导的,反向作用的途径控制的[17]。
- (2)
逆冷启动依赖于冷和光触发的调节。
我们的研究中最引人注目的观察是在冷触发和冷启动后的光触发之间的反向权衡。众所周知,冷预处理可以降低植物对病原体的敏感性[81]。最近的转录组分析显示,冷预处理的拟南芥对致病菌的敏感性较低两(太平洋标准时间)菌株DC 3000,解释了水杨酸生物合成和信号传导的冷调节效应[82]。水杨酸水平在寒冷中增加83],可以激活局部和全身的抵抗力[84]。10 h冷激处理后仅2 h,防御信号的冷修饰导致PAL1和PR2的诱导较弱PR4渗入后丁香假单胞菌DC3000[82]。在我们的研究中,24 h冷启动后5天,PAL1在冷源植物中受寒冷和强光的诱导更强烈。然而,更特异的水杨酸调控基因的转录水平PR2较低(图2)。6增刊。选项卡。2)。相反,甲壳素结合蛋白的基因PR4和PCC1在冷源植物中,不下调,但在寒冷条件下强烈上调,而在光照条件下下调(图2)。9).在我们看来,这种防御相关基因在冷光和强光触发下的特异性调控可以像差异调控一样ZAT10(无花果。1和2),只能通过基因对特定触发因素反应的特定调节来解释。换句话说,我们得出结论,冷启动记忆解除了核心应激信号的耦合,并在应激源特异性基因调控中发挥其调节潜力。
结论
在不断变化的环境中,控制防御和生长之间的平衡对植物来说至关重要,以优化它们的适应性[85]。我们的研究表明,冷启动对特定基因的调控有差异,甚至对核心环境反应集群的基因的调控不偶联。对冷启动后果的转录组分析表明,冷触发以运输和生长相关基因的表达为代价,支持各种参与防御和保护的基因的表达。相反,光触发优先激活参与代谢和发育的基因,但下调参与防御反应的基因。整体模式表现为29个基因的逆调控。由此,我们得出结论,冷启动通过区分冷和光诱导调节来改变应激信号。
方法
植物生长与胁迫处理
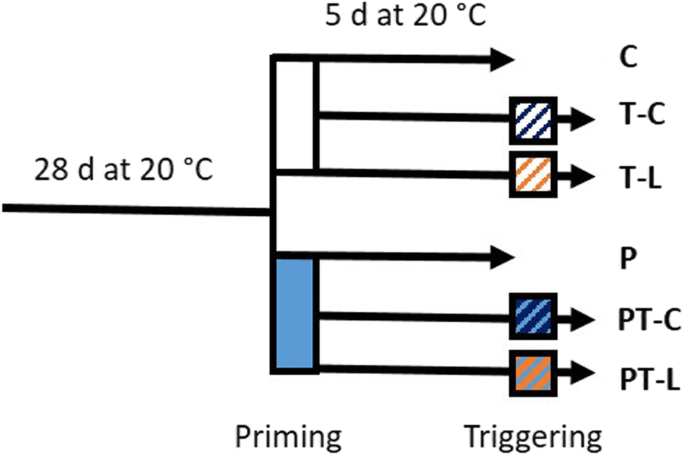
拟南芥(col0)植株在直径6 cm的圆形盆栽中,在20±2℃条件下,光照10 h /黑暗14 h,光照率100-110 μmol量子*m,培养28 d−2年代−1(Lumilux冷白色荧光条纹;德国欧司朗)。在启动过程中,对一半4周龄植株进行24 h的冷刺激,在光照开始2.5 h后将它们转移到4±2°C的冷室中,与20°C的冷室具有相同的通气、照明和空气湿度设置(图2)。10).之后,将处理过的植株放回20°C,与未处理过的植株按随机模式并排培养。一般设置与先前研究中使用的相同[17],只是将冷室温度传感器换成了冷却节奏中缩短相位长度的传感器,从而更好地稳定了昼夜温度。1/3的启动植株和naïve植株在启动刺激结束后的第5天、光照开始后的2.5 h收获。对照植株(C植株)一直保持在20°C。
在20°C的滞后期5天后,将1/3的启动植株和1/3的对照植株转移到4°C(冷触发),开始冷触发(图2)。10).在强光触发条件下,将1/3的引物植株和1/3的naïve植株暴露在800 μmol量子m的光通量下2 h−2年代−1用卤素灯(R7-s 500 W, Emil Lux GmbH Wermelskirchen,德国)照射30分钟后。卤素灯的热辐射通过水层过滤,并通过适度通风加以控制。利用红外测温仪在叶片上表面监测叶片温度。
对于RNASeq样品,在5天的滞后期结束时,在低温和超光触发处理后2小时,每次处理收获10个植株的完整莲座,并立即在液氮中冷冻2稳定RNA,防止降解。用于qPCR分析的至少3个独立实验重复中,每个处理和样品的5-7个单株的完整莲座被收获,汇集并立即在液氮中冷冻2.
RNA分离及RNA文库构建
为了分离RNA,将植物材料在液态氮中磨成细粉2.使用Gene Matrix通用RNA纯化试剂盒(EURx,格但斯克,波兰)从100 mg植物材料中提取RNA,包括供应商推荐的DNase处理。在- 20℃下,通过加入0.1体积的3m醋酸钠(pH 5.2)和2.5体积的无水乙醇,将RNA从溶液中沉淀下来。将RNA溶解于50 μl无rnase的H中2在2% (w/v)琼脂糖凝胶中添加1% (v/v)甲醛,通过电泳评估RNA的完整性。
对于RNA文库的构建,按照北京基因组研究所(北京,中国)的标准程序,使用寡核苷酸(dT)磁珠富集mRNA,并通过DNA/rRNA杂交从rRNA中剥离。然后,将mRNA转录成cDNA,生成随机N的第二DNA链6底漆。然后对双链cDNA进行5 '端修复,3 '端poly- a -tail,并用oligo-dT-adapter连接。用特定的引物PCR扩增结扎产物。在北京基因组研究所Illumina High-Seq4000平台上进行单端测序,平均获得2400万(±160.000)个reads,每个处理的reads长度为50个碱基对。选项卡。1).
生物信息学分析
RNASeq获得的reads不含接子序列污染且不明确碱基少于10% (= clean reads),使用Bowtie (version 2.1.0 [86];)及HISAT (2.1.0 [87];)。使用RSEM软件包将每个基因的对齐reads数归一化为转录本长度和每次处理的总reads数。对于2000个表达最高的基因,使用edgeR进行主成分分析[88]及limma图书馆[89]在R 3.5.1中。利用R函数pheatmap (https://CRAN.R-project.org/package=pheatmap).用InteractiVenn分析基因共调控[90]。另外用GENEMANIA进行表达分析[35], STRING v.11 [36]和eFP浏览器平台[67]。通过基因本体对显著表达和差异调控基因的功能进行表征2-change > 1, FPKM值> 5)在AgriGO 2.0平台上进行[66]根据基因本体条款的TAIR10的释放。
反转录和实时定量PCR
为了进行实时PCR分析,使用高容量反转录试剂盒(Applied Biosystems, Carlsbad, CA, usa)将mRNA转录成cDNA。低聚糖dT16在25°C条件下,将V引物退火至mRNA的多a尾部,孵育10分钟。37℃条件下2 h, 85℃条件下5 min热失活酶停止反应。在CFX96实时系统(Biorad, Hercules, CA, usa)上进行实时qPCR分析,模板cDNA为50 ng,模板cDNA为0.2 μl, 10xSYBR Green (Sigma-Aldrich, Germany)为20 μl,如前面所述[17],但成绩单水平只是标准化的YLS8(黄叶特异性蛋白8;At5g08290),因为其他典型的qPCR分析使用内参基因对冷或光处理有反应。如果适用的话,所有引物都是通过QUANTPRIME软件设计的,以跨越外显子-内含子边界[91]。引物序列在附录中列出。选项卡。8).
H的量化2O2水平
中等老叶,激发敏感性最强[30.]和最低背景H2O2水平(92],立即被冷冻在液氮中以固定新陈代谢。取50 mg冷冻植物材料在200 μl 5 mM KCN中按[93]。不溶性物质在13.000 g、4℃条件下沉淀5 min后,取100 μl上清液与1 ml预冷染料溶液(100体积125 μM二甲酚橙与100 mM山梨醇新鲜混合,1体积25 mM (NH))混合4)2铁(所以4)22.5 M H2所以4).室温培养10min后,分光光度法测定560nm处的吸光度,并根据H2O2标准。
叶绿素a荧光分析
暗驯化20 min后,叶绿素-a荧光(FV/ F米)在饱和光闪(> 1000 μmol量子m)下测定−2年代−1)在Imaging PAM image - k4b (Walz, Effeltrich, Germany)中启动(P)和启动+触发(PT)植物中。光系统II的有效量子产率(Φ)PS-II= (FM´/ F - F)M´)),光化学淬火(qP = (FM´- F) / (FM´-F0´))和非光化学淬火(NPQ = (F米/ FM´(1)在光照前后各间隔20 s的饱和闪光下进行分析,光通量密度为185 μmol量子m−2年代−1在阳光下露出上面三分之一的叶子。
统计分析
差异的显著性采用学生t检验(p< 0.05)。更大的数据集用Tukey事后测试(p< 0.05)。
数据和材料的可用性
在当前研究中生成和分析的所有数据集都作为附加文件与手稿一起上传。原始数据和处理过的数据见附录。选项卡。2,上载于PrimeDB (https://primedb.mpimp-golm.mpg.de/index.html?sid=reviewer&pid=bf0fa52fb0b4e9641017a9d0b6528261)和NCBI-GEO (GSE151749;Gsm4589752 - gsm4589757)。
缩写
- C:
-
控制植物
- C5:
-
控制滞后期末期的植物
- CBF:
-
c -重复结合因子
- Col-0:
-
拟南芥var。Columbia-0
- FPKM:
-
每百万读取的外显子每千碱基的片段
- FV/ F米:
-
暗驯化植物光系统II的量子产率
- HSF:
-
热休克因子
- 冰:
-
CBF表达诱导剂
- 地图:
-
有丝分裂原活化蛋白
- MPK:
-
MAP蛋白激酶
- 病人:
-
启动植物
- P5:
-
滞后期末期的植物
- PPFD:
-
光合光子通量密度
- PT:
-
启动和触发植物
- PT-C:
-
冷激发和冷触发植物
- PT-L:
-
冷启动和光触发植物
- RNASeq:
-
RNA-Sequencing
- ROS:
-
活性氧
- sAPX:
-
基质抗坏血酸过氧化物酶
- 师:
-
只面对触发刺激的植物
- 温度系数:
-
Cold-triggered植物
- T-L:
-
光触发植物
- tAPX:
-
类囊体结合抗坏血酸过氧化物酶
- 表示为:
-
光合淬火
- qPCR:
-
实时定量聚合酶链反应
- 走:
-
基因本体论
- NPQ:
-
非光化学猝灭
- 紫外线:
-
紫外线
- ΦPS-II:
-
光系统II在光下的量子产率
参考文献
- 1.
托马斯休曼氏金融。植物冷驯化:抗冻基因及其调控机制。植物生理学报。1999;50:571 - 599。
- 2.
Selote DS, Bharti S, Khanna-Chopra r2*-在小麦幼苗中的积累和脂质过氧化。生物化学学报,2004;32(4):724 - 724。
- 3.
张建军,张建军,张建军,等。干旱、盐胁迫和温度胁迫诱导植物代谢重排及其调控网络。[J] .中国生物医学工程学报,2012;33(3):593 - 598。
- 4.
王志强,王志强。热驯化的研究进展拟南芥lyrata基因型成本和转录变化。中国生物医学工程学报,2018;31(3):393 - 398。
- 5.
家伙CL。低温驯化与抗冻性:蛋白质代谢的作用。植物生理学报。1990;41(1):187 - 223。
- 6.
李国宝,韩德胜,朱建军。拟南芥冷响应转录组及其ICE1调控。植物学报。2005;17(3):355 - 75。
- 7.
Fowler S, Thomashow MF。拟南芥转录组分析表明,在冷驯化过程中,除了CBF冷响应途径外,还激活了多种调节途径。植物学报。2002;14:16 - 16。
- 8.
Lichtenthaler港元。植物胁迫:植物胁迫概念的介绍。植物生理学报。1996;28(4):444 - 444。
- 9.
Jackson MW, Stinchcombe JR, Korves TM, Schmitt J.转基因抗寒性的成本和效益拟南芥.中国生物医学工程学报,2004;13(3):396 - 398。
- 10.
李平,李平,张建军,李建军。冷驯化后的时间依赖性脱驯化拟南芥登记入册。科学代表2015。https://doi.org/10.1038/srep12199.
- 11.
吴成,南汉,朴永祥。植物的胁迫记忆:在脱落酸携带的拟南芥植物中,气孔响应的负调控和rd22基因对光的瞬时诱导。植物学报,2003;36(6):344 - 344。
- 12.
Hilker M, Schwachtje J, Baier M, Balazadeh S, Baurle I, Geiselhardt S, Hincha DK, Kunze R, Mueller-Roeber B, Rillig MC,等。缺乏神经系统的生物体对应激反应的启动和记忆。中国生物医学工程学报,2016;31(1):444 - 444。
- 13.
王晓明,王晓明,王晓明,等。低温胁迫对植物抗寒性的影响。植物学报,2019;42(2):782 - 782。
- 14.
贝克斯GJ,康拉斯U.启动抗逆性:从实验室到现场。植物学报,2007;10(4):426 - 431。
- 15.
Friedrich T, Faivre L, Bäurle I, Schubert D.植物温度记忆的染色质机制。植物学报,2019;42(2):762 - 762。
- 16.
Zuther E, Schaarschmidt S, Fischer A, Erban A, Pagter M, Mubeen U, Giavalisco P, Kopka J, Sprenger H, Hincha DK。拟南芥低温记忆与抗冻能力增强相关的分子特征。植物学报,2019;42(2):854 - 856。
- 17.
范布尔,张建军,张建军,等。抗坏血酸过氧化物酶的低温调控及其在抗坏血酸过氧化物酶表达中的作用拟南芥.植物学报,2016。https://doi.org/10.1186/s12870-016-0856-7.
- 18.
Hahn A, Kilian J, Mohrholz A, Ladwig F, Peschke F, Dautel R, Harter K, Berendzen KW, Wanke D.植物核心环境胁迫响应基因的系统协调。中国生物医学工程学报,2013;14(4):771 - 771。
- 19.
Kilian J, Whitehead D, Horak J, Wanke D, Weinl S, Batistic O, D'Angelo C, Bornberg-Bauer E, Kudla J, Harter K. AtGenExpress全球胁迫表达数据集:UV-B光,干旱和冷胁迫响应的协议,评估和模型数据分析。植物科学学报,2007;35(2):347 - 356。
- 20.
米特勒R,金勇,宋海龙,库图J,库图A, cifcii - yilmaz S,李海,史蒂文森B,朱建军。Zat10的功能获得和功能丧失突变增强了植物对绝代胁迫的耐受性。生物医学工程学报,2006;38(5):537 - 542。
- 21.
Rossel JB, Wilson PB, Hussain D, Woo NS, Gordon MJ, Mewett OP, Howell KA, Whelan J, Kazan K, Pogson BJ。拟南芥对光氧化胁迫的系统和细胞内反应。植物学报。2007;19(4):491 - 491。
- 22.
Ensminger I, Busch F, Huner NPA。光滞和冷驯化:通过光合作用感应低温。植物物理学报。2006;26:28 - 44。
- 23.
Huner NPA, Oquist G, Hurry VM, Krol M, Falk S, Griffith M.耐冷植物光合作用、光抑制和低温驯化。光合作用学报。1993;37:19-39。
- 24.
李建军,李建军,李建军,等。光合作用对植物光合特性的影响。植物学报,2002;5(3):481 - 481。
- 25.
苏威蓝N, Jaspert N, Van der Kelen K, Tognetti VB, Schmitz J, Frerigmann H, Stahl E, Zeier J, Van Breusegem F, Maurino VG。空间H2O2信号特异性:H2O2叶绿体和过氧化物酶体对植物转录组的调节是不同的。植物化学学报,2014;7(1):391 - 391。
- 26.
陈建新,Mabbitt PD, Phua SY, Mueller JW, Nisar N, Gigolashvili T, Stroeher E, Grassl J, Arlt W, Estavillo GM,等。SAL1磷酸腺苷磷酸酶失活对叶绿体氧化应激的感知和信号转导。中国科学:自然科学版,2016;33(4):591 - 591。
- 27.
周明明,沈超,吴丽莲,唐克新,林健。植物低温胁迫的一个关键信号通路:cbf依赖性信号通路。中国生物医学工程学报,2011;31(1):186 - 92。
- 28.
赵朝昭,张志军,谢世杰,司涛,李云云,朱建军。CBF转录因子在拟南芥冷驯化中的关键作用的突变证据。植物生理学报,2016;17(1):544 - 559。
- 29.
Maruta, Noshi M, Tanouchi A, Tamoi M, Yabuta, Yoshimura K, Ishikawa T, Shigeoka S. H2O2-触发的叶绿体向细胞核的逆行信号在应激反应中起着特殊的作用。中国生物医学工程学报,2012;37(1):444 - 444。
- 30.
范布尔,陈建军,陈建军,等。叶绿体ROS信号的低温启动及其在类囊体膜上的局部调控。科学代表2019。https://doi.org/10.1038/s41598-019-39838-3.
- 31.
Rasmussen S, Barah P, Suarez-Rodriguez MC, Bressendorff S, Friis P, Costantino P, Bones AM, Nielsen HB, Mundy J.拟南芥转录组对组合胁迫的响应。植物生理学报,2013;31(1):393 - 394。
- 32.
朱莹,杨华,孟海虹,华娟。拟南芥中低温诱导BAP1的ICE1介导。植物生理学报,2011;15(5):558 - 558。
- 33.
沃格尔JT,扎尔卡DG,范布斯柯克HA,福勒SG,托马斯MF。CBF2和ZAT12转录因子在拟南芥低温转录组配置中的作用植物学报,2005;41(1):1 - 6。
- 34.
史海涛,陈志林。拟南芥半胱氨酸2/组氨酸2型转录因子锌指激活的c -重复结合因子途径在褪黑激素介导的拟南芥抗冻性中起重要作用。[J] .中国林业科学,2014;37(5):391 - 391。
- 35.
ward - farley D, Donaldson SL, Comes O, Zuberi K, Badrawi R, Chao P, Franz M, Grouios C, Kazi F, Lopes CT等。GeneMANIA预测服务器:用于基因优先排序和预测基因功能的生物网络集成。核酸学报,2010。https://doi.org/10.1093/nar/gkq537.
- 36.
Szklarczyk D, Gable AL, Lyon D, Junge A, Wyder S, Huerta-Cepas J, Simonovic M, Doncheva NT, Morris JH, Bork P,等。STRING v11:覆盖范围增加的蛋白质关联网络,支持全基因组实验数据集的功能发现。核酸学报,2019;47:D607-13。
- 37.
陈健,杨玲,严欣,刘毅,王锐,范涛,任毅,唐旭,肖峰,刘毅,等。锌指转录因子ZAT6通过谷胱甘肽依赖途径正向调节拟南芥的镉耐受性。植物生理学报,2016;17(1):557 - 557。
- 38.
李建军,李建军,李建军,等。锌指蛋白Zat12对拟南芥抗坏血酸过氧化物酶1表达的影响。中国生物医学工程学报,2004;39(1):1 - 7。
- 39.
Fujimoto SY, Ohta M, Usui A, Shinshi H, ohme takagi M.拟南芥乙烯响应元件结合因子在GCC盒子介导基因表达中的转录激活或抑制作用。植物学报。2000;12:393-404。
- 40.
König K, Vaseghi MJ, Dreyer A, Dietz KJ。谷胱甘肽和抗坏血酸在调节逆行强光反应中的意义拟南芥叶子。植物物理学报,2018;32(2):662 - 663。
- 41.
王长平,杜云云,赵晓玲,苗玉春,宋春平。mpk6 - erf6 - ros响应的顺式作用元件7/GCC盒子复合物调控拟南芥氧化基因转录和氧化反应。植物生理学报,2013;31(1):393 - 398。
- 42.
徐鑫,陈超,范斌,陈铮。拟南芥WRKY18、WRKY40和WRKY60转录因子的生理和功能相互作用。植物学报。2006;18(6):1310 - 1326。
- 43.
王晓明,王晓明,王晓明,王晓明,等。fg22基因在磷酸腺苷激酶(mapk)中表达的调控作用拟南芥通过乙烯信号。科学通报,2009;26(6):867 - 872。
- 44.
张晓明,张晓明,张晓明,张晓明,张晓明,张晓明。拟南芥免疫系统中MAP激酶信号转导的研究进展。大自然。2002;415:977 - 83。
- 45.
毛李G,孟X,王R, G,汉族L,刘Y,张s ACC合酶活性的双级监管MPK3 / MPK6级联及其下游WRKY转录因子在乙烯诱导拟南芥。公共科学图书馆。2012。https://doi.org/10.1371/journal.pgen.1002767.
- 46.
刘晓明,阮小春,金可,韩海军,刘杰,李凯,金麦,尹杰,钟卫生。锌指转录调控因子ZAT6被MPK6磷酸化,调控盐胁迫和渗透胁迫下拟南芥种子萌发。中国生物医学工程学报,2013;30(3):559 - 559。
- 47.
毛光华,孟晓忠,刘永远,郑志勇,陈志祥,张庆生。WRKY转录因子被两个病原体响应的MAPKs磷酸化驱动拟南芥植物抗毒素的生物合成。植物学报,2011;23(3):1639 - 53。
- 48.
拟南芥1-氨基环丙烷-1-羧酸合成酶磷酸化诱导乙烯生物合成植物学报。2004;16:3386-99。
- 49.
阮小春,金山,李凯,金珂,刘小明,韩海军,黄明辉,李文生,洪建军,文玉辉,等。拟南芥c2h2型锌指转录因子(ZAT10)作为MAP激酶底物的鉴定植物学报,2012;31(3):737 - 745。
- 50.
郭文杰,李建平,李建平,等。拟南芥基因调控的研究进展。植物生理学报,2012;38(2):432 - 438。
- 51.
张建军,张建军,李建军,等。植物MAPK基因的快速信号通路研究进展植物信号行为。2015。https://doi.org/10.1080/15592324.2015.1062197.
- 52.
李海,郭勇,吴塔明,熊立明,史蒂文森B,朱建军。低温反应基因转录所需的基因位点LOS2编码一种双功能烯醇化酶。[j] .中华医学会杂志。2002;21(2):92 - 702。
- 53.
王晓明,王晓明,王晓明,等。光诱导蛋白对拟南芥光氧化胁迫的保护作用。科学通报,2003;30(1):1 - 6。
- 54.
Chang CC, Slesak I, Jorda L, Sotnikov A, Melzer M, Miszalski Z, Mullineaux PM, Parker JE, Karpinska B, Karpinski S.拟南芥叶绿体谷胱甘肽过氧化物酶在光氧化应激与免疫应答中的交互作用。植物物理学报。2009;15(5):693 - 693。
- 55.
李建军,李建军,李建军,等。高温胁迫下植物基因组的变化。植物生理学报。2008;46(6):748 - 761。
- 56.
Swindell WR, Huebner M, Weber AP.拟南芥热休克蛋白和转录因子的转录谱分析揭示了热应激和非热应激反应途径之间的广泛重叠。BMC Genomics. 2007。https://doi.org/10.1186/1471-2164-8-125.
- 57.
赵国强,赵国强,赵国强。拟南芥CBF基因的冷诱导涉及多个ICE (CBF表达诱导剂)启动子元件和低温脱敏的冷调控回路。植物生理学报。2003;33(3):990 - 998。
- 58.
Morishita T, Kojima Y, Maruta T, Nishizawa-Yokoi A, Yabuta Y, Shigeoka S.拟南芥NAC转录因子ANAC078调控黄酮类化合物的生物合成。植物生理学报,2009;50(5):1010 - 1022。
- 59.
马绍文,波纳特·汉杰。集成的拟南芥应激相关转录谱、启动子结构和细胞特异性表达。基因组生物学。2007。https://doi.org/10.1186/gb-2007-8-4-r49.
- 60.
Yabuta, Morishita T, Kojima Y, Maruta T, nishiawa - yokoi A, Shigeoka S. ANAC078蛋白识别序列的循环扩增和目标选择技术鉴定。植物信号行为。2010;5:695-7。
- 61.
吴惠明,金玉杰,李永武。留绿突变体的叶片衰老拟南芥:暗育过程中光系统I和II的分解过程。中国生物医学工程学报,2000;33(2):391 - 391。
- 62.
蔡可夫斯基T, Stitt M, Altmann T, Udvardi MK, Scheible WR。拟南芥转录正常化的优质内参基因的全基因组鉴定和检测。植物生理学报。2005;39(1):5 - 17。
- 63.
Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM, Davis AP, Dolinski K, Dwight SS, Eppig JT,等。基因本体论:生物学统一的工具。医学学报。2000;25:25-9。
- 64.
Gaudet P, Livstone MS, Lewis SE, Thomas PD。基因本体联盟中基于系统发育的功能注释传播。生物通报,2011;12:449-62。
- 65.
benjamin Y, Yekutieli D.依赖关系下多重测试中错误发现率的控制。科学通报。2001;29:1165-88。
- 66.
田涛,刘宇,严宏,游强,易鑫,杜志,徐伟,苏忠。agriGO v2.0:面向农业社区的GO分析工具包,2017更新。中国生物医学工程学报,2017;45(5):522 - 522。
- 67.
陈建军,陈建军,陈建军,陈建军。用于探索和分析大规模生物数据集的“电子荧光象形文字”浏览器。科学通报,2007;2:718。
- 68.
郭晓燕,刘方芳,钟凯。植物冷信号转导及其调控机制。植物学报,2018;36(2):745 - 756。
- 69.
汤耀明,刘建军,刘建军,刘建军,刘建军。拟南芥CBF转录激活因子在冷驯化中的作用。植物生理学报。2001;12(1):1 - 5。
- 70.
张建军,张建军,张建军,张建军,张建军。冷驯化过程的快速转录和代谢调控拟南芥.生物医学工程学报,2017;18:731。
- 71.
To TK, Nakaminami K, Kim JM, Morosawa T, Ishida J, Tanaka M, Yokoyama S, Shinozaki K, Seki M.拟南芥HDA6的耐寒性。中国生物医学工程学报,2011;6(6):414 - 414。
- 72.
权思聪,李迪,崔刚,郑伟。拟南芥冷反应基因中H3K27三甲基化的组蛋白占用依赖性和非依赖性去除。植物科学学报,2009;30(2):1145 - 1145。
- 73.
卞玉杰,具美,朱海杰,李海明,李德华。拟南芥冷驯化、脱驯化和再驯化下基因表达的比较分析。植物物理学报,2014;32(2):556 - 564。
- 74.
Park J, Lim CJ,沈明志,Park hji, Cha JY, Iniesto E, Rubio V, Mengiste T, Zhu JK, Bressan RA,等。表观遗传转换从压抑到允许染色质对冷应激的反应。科学通报,2018;33(5):544 - 544。
- 75.
杨H,浆果,奥尔森次数,哈特利M,院长霍华德•M c Polycomb沉默的不同阶段进行表观遗传记忆在拟南芥的冷。科学。2017;357:1142-5。
- 76.
Nakabayashi R, yoneura -Sakakibara K, Urano K, Suzuki M, Yamada Y, Nishizawa T, Matsuda F, Kojima M, Sakakibara H, Shinozaki K,等。抗氧化类黄酮的过度积累增强拟南芥的抗氧化和抗旱性。植物科学学报,2014;37(1):367 - 379。
- 77.
陈建军,陈建军,陈建军,等。植物抗氧化机制的研究进展。植物信号学报,2011;6:709-11。
- 78.
李建军,李建军,李建军。低温诱导苯丙氨酸解氨酶和查尔酮合成酶信使rna的积累拟南芥以依赖光的方式植物生理学报。1995;08:39 - 46。
- 79.
Rabino IMAL。光、温度和花青素的生产。植物生理学报。1986;81:922-4。
- 80.
张国强,张国强,张国强,张国强。通过对协同调控基因的瞬时分析鉴定一个顺式调控元件。植物方法。2008。https://doi.org/10.1186/1746-4811-4-17.
- 81.
李春华,李春华。低温诱导植物对坏死性致病菌的抗性及抗氧化酶活性与细胞膜通透性的关系。植物科学。2003;16(4):1019 - 1028。
- 82.
吴忠,韩生,周辉,黄志康,王勇,金燕,石辉,杨伟拟南芥通过水杨酸依赖途径。植物学报。2019。https://doi.org/10.1111/pce.13579.
- 83.
Scott IM, Clarke SM, Wood JE, Mur LA。水杨酸积累抑制拟南芥在低温下的生长。植物生理学报。2004;35(5):1040 - 109。
- 84.
水杨酸在植物防御中的作用——参与者和主角。植物学报,2007;10:466 - 472。
- 85.
郝波,姚军,孟宝林,何世文。植物生长与防御的权衡:优化适应性的平衡行为。植物学报,2014;7:1267-87。
- 86.
张建军,张建军,张建军,等。一种新型的快速定位方法[j]。Nat Methods. 2012。https://doi.org/10.1038/nmeth.1923.
- 87.
李建军,李建军,李建军,等。一种低内存要求的快速拼接对准器。Nat Methods. 2015。https://doi.org/10.1038/nmeth.3317.
- 88.
麦卡锡DJ,陈Y,史密斯GK。关于生物变异的多因子RNA-Seq实验差异表达分析。中国生物医学工程学报,2012;41(4):488 - 498。
- 89.
Ritchie ME, Phipson B, Wu D,胡勇,Law CW, Shi W. Smyth GK: rna测序和微阵列研究的极限幂差分表达分析。中国生物医学工程学报,2015;43(4):447。
- 90.
Heberle H, Meirelles GV, da Silva FR, Telles GP, Minghim R. interactive Venn:基于web的维恩图集分析工具。生物信息学。2015。https://doi.org/10.1186/s12859-015-0611-3.
- 91.
王晓东,王晓东,王晓东,等。qantprime技术在定量PCR中的应用。生物信息学。2008。https://doi.org/10.1186/1471-2105-9-465.
- 92.
王晓明,王晓明,王晓明,等。低温胁迫下植物叶片活性氧和抗氧化能力的测定。编辑:Hincha D, Zuther E。分子生物学方法(Clifton, N.J.)。植物冷驯化:方法和方案。第2版。纽约:斯普林格;2020.(印刷中)。
- 93.
刘建军,刘建军,刘建军。铁-二甲酚橙络合物过氧化氢测定。生物化学学报。1999;23(3):349 - 355。
资金
这项工作由德国研究基金会(CRC973/C4)和柏林大学资助。资助者在研究设计、数据收集和分析、发表决定或手稿准备方面没有任何作用。
作者信息
从属关系
贡献
JB和AB设计并完成了RNASeq分析的实验,AB完成了所有后续的实验,并起草了部分手稿和图表。MB监督项目并定稿。所有作者已阅读并同意稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:
增刊。表1。关于RNA测序和RNA序列比对质量的一般信息。
附加文件2:
5.表2。对照植物(C5)和启动植物(P5)在5 d滞后期结束时的FPKM值,仅冷(T-C)或仅光触发(T-L)植物,以及冷启动和冷(PT-C)或光触发(PT-L)植物根据对照植物的FPKM值排列。对于每个基因,列出了用于对齐RNASeq读数的转录本变体。
附加文件3:
5.表3。在阈值为log时显示启动依赖性调控的基因的身份2(启动/未启动)≥I 1 I和FPKM≥10至少一个处理。日志2(带底色/未带底色)值≥1以橙色突出显示2(带质数/无质数)值≤−1(蓝色表示)。qPCR检测的调控基因以亮黄色突出显示。
附加文件4:
5.表4。在阈值为log时显示启动依赖性调控的基因的身份2(启动/未启动)≥I 0.5 I和FPKM≥5至少一个处理。日志2(底漆/未底漆)≥0.5的值以橙色突出显示2(带底数/未带底数)值≤- 0.5(蓝色)。qPCR检测的调控基因以亮黄色突出显示。
附加文件5:
5.表5所示。在log阈值下调控的基因功能富集分析中,基因本体(go术语)的原始数据2(启动/未启动)≥I 0.5 I,启动后FPKM≥5。表列表(从左到右)的基因数量与查询中一步一步,相关的基因数量的查询,相关的基因数量参考背景中一步一步(TAIR10)基因作为背景,总数的比例与各自相关的基因相对于基因总数一步一步分析查询(转录组)和背景(参考),浓缩在查询相对引用,富集显著性的p值和错误发现率(FDR)。
附加文件6:
5.表6所示。冷光触发后显示反向启动依赖调控的基因特性。与防御反应相关的七个基因被标记为深橙色。日志2(底质/未底质)≥0.5的值以橙色突出显示2(带底数/未带底数)值≤- 0.5(蓝色)。
附加文件7:
5.表7所示。基因本体(go术语)通过功能富集分析获得的基因,这些基因以启动依赖的方式被冷和光反向调控(supl。表6)。对文中提到的七个基因进行分组的GOs用橙色标记。
附加文件8:
5.表8所示。用于qPCR分析的寡核苷酸引物列表。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
bitner, A, van Buer, J. & Baier, M.冷启动解耦光和冷调控基因表达拟南芥.BMC Plant Biol20.281(2020)。https://doi.org/10.1186/s12870-020-02487-0
收到了:
接受:
发表:
关键字
- 冷
- 光
- 启动
- 触发
- 内存
- 拟南芥
- 增长
- 国防
- 基因表达