摘要
背景
淀粉在白天合成,暂时储存在叶片中,然后在随后的夜间降解,以支持植物的生长和发育。淀粉降解障碍会导致生长迟缓,甚至衰老和死亡。核孔复合体参与了许多细胞过程,但其与淀粉降解的关系至今尚不清楚。我们之前确定了这两个Nucleoporin98基因(Nup98a和Nup98b)通过冗余调节开花君士坦斯(有限公司) - 独立途径拟南芥.该双突变体还表现出严重的衰老表型。
结果
我们发现Nucleoporin 98参与叶片中糖代谢的调节,也参与衰老调节拟南芥.我们表明,Nup98a和Nup98b在淀粉降解的不同阶段有冗余功能。的nup98a-1 nup98b-1与野生型植物相比,双突变体积累更多的淀粉,表现出严重的早期衰老表型。与淀粉降解相关的标记基因表达受损nup98a-1 nup98b-1双突变体,碳饥饿和衰老标记基因的表达比野生型更早,表达量更高,表明能量代谢异常是双突变体衰老的主要原因。在生长培养基中添加蔗糖可以挽救早熟禾的衰老表型nup98a-1 nup98b-1突变体。
结论
我们的研究结果为核孔复合体在与生长发育相关的能量代谢中的新作用提供了证据NUP98淀粉降解功能,以控制生长调节拟南芥.
背景
核孔复合体(NPC)是细胞核和细胞质之间大分子通讯的关键桥梁,调节基因表达[1].NPC由至少30种独特的核孔蛋白(Nups)组成,在真核细胞中高度保守[2,3.].Nup98是一个移动的外周含Phe-Gly结构域(FG)的核孔蛋白,它跨越了NPC中央通道的细胞核和细胞质部分[4,5].拟南芥Nup98a(也被称为DRACULA2, DRA2)也存在于不同的亚细胞位置[6].Nup98参与动物和酵母中货物进出口、基因表达、转录记忆和多种发育过程的调控[4,5,6,7,8,9].在拟南芥,DRA2控制避光综合症[6].在水稻中,Nup98同源物APIP12 (avrpi - t interaction PROTEIN12)参与了对该病原体的基础抗性稻瘟病菌目标是Magnaporthe效应AvrPiz-t [10].在最近的一份报告中拟南芥,蛋白质Nup98和Nup88/MOS7(SNC1,7的修饰物)之间的相互作用是植物抵抗坏死营养型真菌病原体所必需的Botrytis cinerea和丝裂原活化蛋白激酶信号[11].我们发现Nup98参与了植物的开花调控拟南芥[12].
衰老是一个重要的细胞过程,与各种发育和环境线索相关[13].在死亡之前,植物将衰老器官中的资源重新动员,并将其转移到下沉器官以支持其生长和发育[14,15,16].迄今为止,已经确定至少200个基因调节或参与植物中的衰老过程。淀粉是在叶子中合成的主要光合产物,在夜间降解以支持植物开发。在淀粉降解中不同步骤中基因功能的损害阻碍了植物生长到不同的延伸率[17,18].糖直接或间接调节衰老:糖积累不仅触发和加速,而且也可能延迟衰老[19,20,21].事实上,在糖的作用下,植物的衰老过程是由年龄或条件决定的[20,22,23].在糖通路中,已经确定了三个关键基因:葡萄糖传感器己糖激酶1(HXK.1)、能源传感器蛋白质KINASE10(KIN10),KIN11,TOR(雷帕霉素的靶点)[21,24,25,26,27].
目前,NPC调控植物淀粉降解和衰老的机制尚不清楚。然而,在动物中,有几项研究报道鼻咽癌通过修改染色体结构、DNA修复和复制或细胞分裂来控制细胞衰老[28,29,30,31,32].NPCs的损伤导致核细胞质运输功能障碍[30].这两个Nup107[33),TPR.(进行启动子区域)[34,35与癌细胞增殖和衰老细胞的细胞衰老有关。
在这项研究中,我们关注两个NUP98同源基因,Nup98a和Nup98b,在拟南芥.突变体这些基因中的单个突变体拟南芥无明显的开花和衰老表型。然而,双突变体,nup98a-1和nup98b-1,表现出明显的早衰表型。基因表达分析表明Nup98a和Nup98b参与淀粉降解,调节生长。进一步的分析表明,双突变体的早期衰老可能是由于淀粉降解初始步骤的缺陷,并导致能量供应功能障碍。有趣的是,这种双突变体的早期衰老表型可以通过在生长培养基中添加糖来挽救。我们的数据表明Nup98a和Nup98b可能冗余地运作淀粉退化的调节,并有助于正常增长和发展拟南芥.
结果
NUP98突变导致早期衰老拟南芥
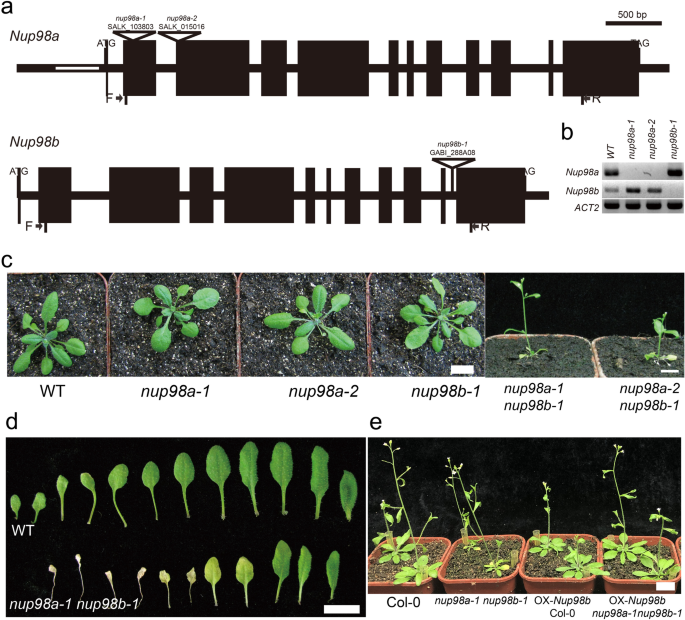
Nup98是真核生物中高度保守的核孔蛋白。在拟南芥,哺乳动物有两种同源物Nucleoporin98-Nup98a(At1g10390)和Nup98b(At1g59660),在pheg - gly (FG)-repeats和autoproteolytic domain中具有高度保守的氨基酸序列(APD, Supplementary Figure)1)[3.,6].Nup98a以前报告为DRACULA2(DRA2),是遮阴回避综合征(SAS)的调节因子拟南芥[6和对一种水稻真菌病原体的免疫反应[11].调查NUP98植物开发中的功能,我们筛查了突变体nup98a(SALK_080083, SALK_090744, SALK_023493, SALK_103803, SALK_015016从ABRC订购)nup98b(CS803848和从GABI T-DNA突变中心订购的GABI_288A08)。分离出Salk_103803,Salk_015016,GABI_288A08的以下插入突变体的纯合线,其中Salk_103803和GABI_288A08是帕里报道的突变体[9].这些纯合子突变体中的T-DNA插入蛋白质编码区(图。1a) RT-PCR证明这些突变体为空等位基因(图。1b,补充图2),与Parry的结果一致[9].与之前的研究一样[9,在开花和衰老过程中均未观察到明显的表型nup98a或nup98b单突变体与野生型植物在长日照条件下的比较(图。1c). Nup98a和Nup98b具有高度保守的氨基酸序列(补充图)1),我们检验了假设Nup98a和Nup98b功能冗余。引人注目的是,两个双突变体,nup98a-1 nup98b-1和nup98a-2, nup98b-1与野生型相比,野生型植株表现出相似的早期衰老表型。1c和d).衰老表型不仅出现在叶片中,也出现在整株中。此外,与野生型植物相比,双突变植株有额外的表型,包括花序更小,花和角果更小,身材更矮,严重的不育性(补充图)3.和4).我们最近报道nup98a-1 nup98b-1双突变体具有早期开花表型[12].表达了Nup98b基因在双突变体中,挽救了衰老表型(图。1这些结果证实了这一点Nup98a和Nup98b多余地行动。
突变的NUP98导致早期衰老表型。一个: T-DNA插入等位基因Nup98a和Nup98b.黑色条表示外显子,黑色细线表示内含子或UTR, 5 ' -UTR中的开放线表示内含子,三角形表示T-DNA插入,突变体名称和符号上方的T-DNA标识符。b:RT-PCR确认单个突变体nup98a-1,nup98a-2,nup98b-1.正向(F)和反向(R)引物的位置在一个(黑色箭头)。ACT2被用作控制。b指的是图SI中提供的全长图像。c:单个突变体nup98a-1,nup98a-2,nup98b-1表现出与野生型植物相似的表型。然而,双突变体nup98a-1 nup98b-1和nup98a-2,nup98b-1表现出严重的早期衰老。种子萌发后第20天拍照。d:叶片衰老表型nup98a-1 nup98b-1双突变体莲座叶在花序出现时收获。e:异位表达Nup98b挽救了水稻叶片衰老表型nup98a-1 nup98b-1双突变体。所有的植物都是在土壤中发芽生长的。种子萌发后30天拍照。*表示测量值显著(*P< 0.05或**P< 0.01)与对照组不同。误差柱表示平均值的±SD。所有的图像都是我们自己的数据
研究衰老表型是否针对nup98a-1 nup98b-1突变体,我们选择另外三个核孔蛋白突变体,nup96-1,nup160-1,nup107-1,在我们之前的报告中显示了开花表型[36]分析其他核孔组分对衰老的影响。令我们惊讶的是,在这些突变体中没有观察到早期衰老表型(补充图5),提示部分核孔蛋白可能不参与衰老的调控NUP98可能具有特定的衰老调节功能。
的Nup98基因参与了衰老启动的多种途径
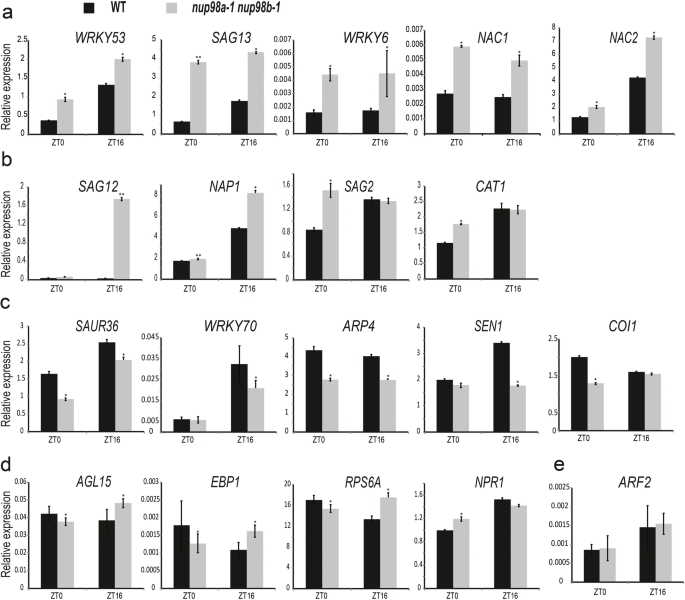
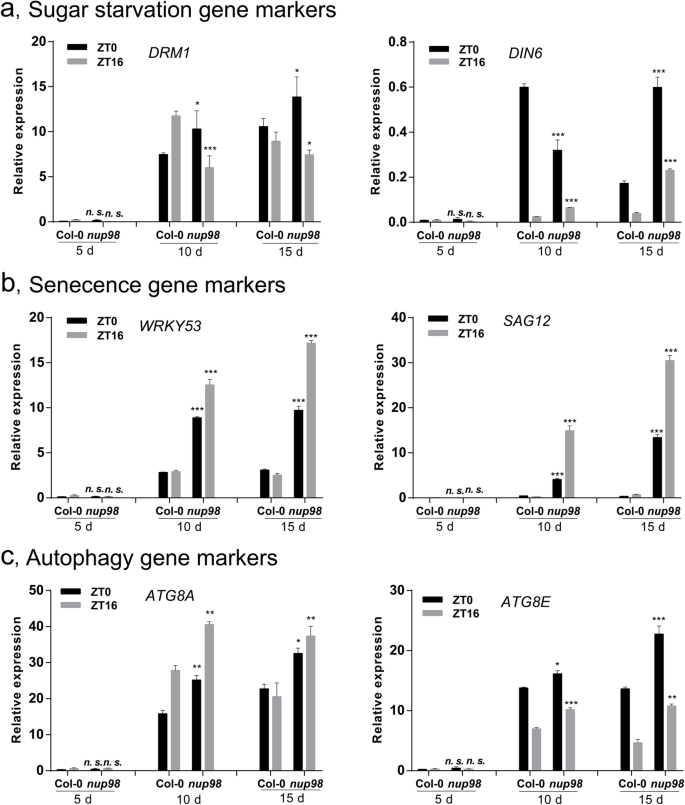
因为观察到的早期衰老nup98a-1 nup98b-1双突变体可能是发育改变的次要效应,我们进一步探讨了其作用Nup98a和Nup98b在衰老的监管。到目前为止,至少有200个基因被确认参与了植物的衰老调节[37].我们对主要文献进行了总结,如图所示6研究表明,植物衰老是由激素、糖、光和光周期和光胁迫等多种内源和环境信号共同作用的结果。为了确定与早期衰老的潜在联系,我们测量了重要的衰老相关基因的mRNA丰度nup98a-1 nup98b-1双突变体植株(补充图6通过实时荧光定量PCR (RT-qPCR)检测了长日照条件下植物的ZT0 (Zeitgeber 0,即光照时间)和ZT16(光照时间)。如图所示。2,基因表达nup98a-1 nup98b-1双突变体与野生型有显著差异。在第一类中,WRKY53(编码Wrky DNA结合蛋白53),SAG13(编码SENESCENCE-ASSOCIATED GENE13),WRKY6,NAC1.(编码NAM、ATAF和CUC)和NAC2.ZT0和ZT16的转录本丰度均较高。2A),表明应激途径中的基因(WRKY53,WRKY6,NAC1.)和SA途径(WRKY53,WRKY6,NAC2.的衰老表型相关nup98a-1 nup98b-1双突变体。在第二类中,SAG12,午睡(编码含Nac结构域的蛋白质),SAG2和CAT1(编码过氧化氢酶1),在ZT0或ZT16处仅在ZT0或ZT16处的丰度增加(图。2b)相比之下,在第三类中,SAUR36(编码小型助流素上调36.),WRKY70,ARP4(编码肌动蛋白相关的蛋白质4),SEN1(编码拼接ENDONUCLEASE1), 和薏苡仁(编码CORONATINE INSENSITIVE1)在ZT0和/或ZT16处的丰度降低(图。2C),表明生长素(SAUR36)及茉莉酸酯(薏苡仁)的信号可能与nup98衰老表型。丰富的AGL15(编码AGAMOUS-LIKE15),EBP1(编码ERBB-3绑定PROTEIN1),RPS6a(编码核糖体PROTEIN6a), 和NPR1(编码PR-GENES1的非表达子)在ZT0和ZT16有相反的变化(图。2D,表明这些基因的功能NUP98衰老的调节可能依赖于生物钟。
与衰老相关的基因表达发生改变nup98a-1 nup98b-1双突变体。在黎明(ZT0)和黄昏(ZT16)基因均上调(一个)或在黎明(ZT0)或黄昏(ZT16) (b).c:黎明(ZT0)和/或黄昏(ZT16)的黎明调控基因。d:在黎明(ZT0)和黄昏(ZT16)分别上调或调控的基因。e:组成表达基因。14日龄的幼苗nup98a-1 nup98b-1长日照条件下的双突变体和野生型植株分别在ZT0和ZT16收获。所有RT-PCR检测至少重复3次,每次重复3个重复。所有RT-PCR基因转录本测量均归一化至对照TIP41(At4g34270),并显示为相对值。学生的t采用检验进行统计分析。*表示测量值显著(*P< 0.05或**P< 0.01)与对照组不同。误差柱表示平均值的±SD
这一表达谱表明,在细胞中至少有三个衰老过程受到影响nup98双突变体。首先,几种途径,主要是压力和SA途径,涉及调节衰老nup98a-1 nup98b-1双突变体。其次,不同的基因在不同的阶段(上午阶段或下午阶段)受到正调控或负调控,以其独特的模式发挥作用。第三,一些基因,如WRKY53,WRKY6,NAP1,SAG2,可能在多种途径中发挥作用。结果表明,黄颡鱼的衰老表型nup98双突变涉及多条途径。许多基因表现出昼夜节律的表达模式,与我们之前的报道一致NUP98基因受涉及昼夜钟的过程调节[12].
淀粉的代谢在体内受损nup98a-1 nup98b-1双突变体
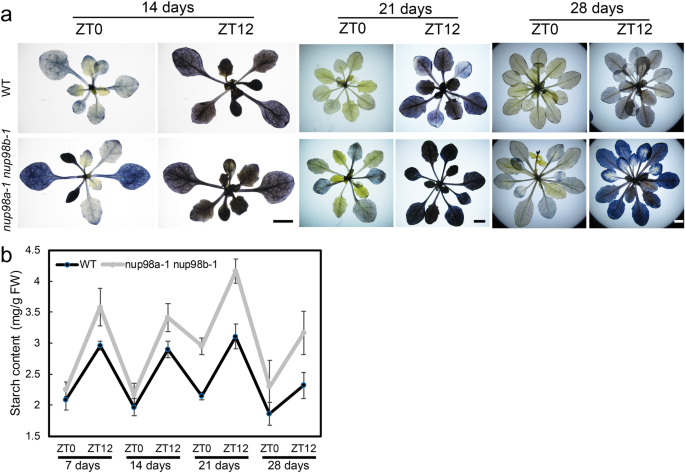
在光合作用中,淀粉被合成并储存在叶绿体中,然后在夜间降解。许多基因参与了植物中淀粉的降解(补充图)7)[17,18].首先,我们检测了玉米叶片的淀粉稳态nup98a-1 nup98b-1双突变体植株在12 h光照/12 h黑暗条件下(ZT0,黎明和ZT12,黄昏)生长(图2)。3.).所有植株的叶片在黄昏时都积累了淀粉,但通过碘染色法测定,双突变体植株的淀粉含量远高于野生型植株。3.a)和淀粉定量测定(图。3.b).在更老的(21天和28天)叶片中,双突变体的信号更强烈,可能是随着时间积累淀粉的结果。因此,无论是在黎明还是黄昏,双突变体都比野生型积累了更多的淀粉,并且在14和21日龄的幼苗中这一表型更加明显(图2)。3.综上所述,这些结果表明淀粉代谢在nup98a-1 nup98b-1双突变体。
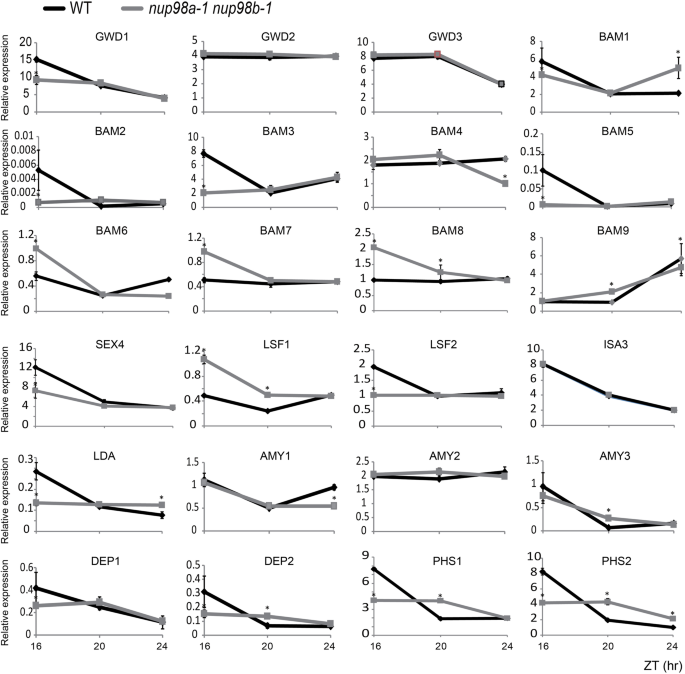
我们测量了淀粉代谢相关基因的转录本丰度[17)(图。4),并发现与野生型植物相比,双突变体中许多基因的RNA积累至少在一个时间点显著降低。这些基因为淀粉的降解过程编码酶,而不仅仅是在叶绿体的早期阶段[17),如GWD1(编码α-葡聚糖水,DIKINASE1;或淀粉过量1,SEX1),β-BAM1(编码β-AMYLASE1),BAM3,BAM5,BAM6,BAM7,BAM8,SEX4,LSF1(编码LIKE SEX FOUR1),但也在后面的步骤,如乔治。(1)右旋糖苷酶),AMY1(编码α淀粉酶)和AMY2,DPE1(编码失衡酶)和DPE2,PHS1(编码α-葡聚糖磷酸化酶)PHS2.这些基因的时间依赖性低表达表明它们受到昼夜节律的控制NUP98它本身就参与了昼夜节律调节拟南芥[12].这些基因在淀粉降解的不同阶段发挥作用[17].GWD1是α-葡聚糖水二激酶,它使支链淀粉的糖基残基在C-6位置磷酸化β-淀粉酶分解α1, 4-linked葡萄糖链。LSF1和SEX4释放葡萄糖基残基C-6和C-3处结合的磷酸盐。ISA (ISOAMYLASE 3)和LDA (LIMIT-DEXTRINASE)都能水解α-1,6个支点,但有不同的底物。艾米行动α1,四连杆释放线性的α-1,4-联寡糖和分枝α1, 4,α1, 6-linked低聚糖。歧化酶(DPEs)将葡萄糖/α-1,4连接的葡聚糖基从供体葡聚糖转移到受体,释放葡萄糖/葡聚糖基的非还原端。α-葡聚糖磷酸化酶(PHSs)作用于细胞的非还原端α-1,4-连接葡萄糖。降低丰富这些基因导致淀粉多余的表型nup98a-1 nup98b-1双突变体(图。3.),性别4突变体(17].参与淀粉代谢的其他一些基因的mRNA丰度,包括GWD2,GWD3,ISA3(ISOAMYLASE3),AMY3,未受显著影响,提示Nup98a / b淀粉的代谢受到某些特定酶的限制。
我们还通过RT-qPCR检测了光合作用和糖代谢相关基因的mRNA丰度nup98a-1 nup98b-1双突变体和野生型植株(补充图8).在光合作用相关基因方面,mRNA丰度降低LHCA(光系统I捕光复合物基因A),奇迹(光系统I捕光复合物基因B)被观察到nup98a-1 nup98b-1不同时间点的双突变体,例如:LHCA1/2和LHCB1.1在ZT0和LHCA1和LHCB1.4在ZT16基因。我们也观察到mRNA丰度的降低KIN10和KIN11与野生型植物相比,这是预料中的,因为这两个基因都是糖信号基因。这两个基因都与延缓植物衰老有关[21,26,27,因此它们的转录丰度降低可能与早期衰老有关(补充图)6).我们也观察到mRNA丰度略有增加HXK1(ZT16),可能通过细胞分裂素信号通路促进早期衰老[24].出乎意料的是,mRNA丰度TPS1,衰老激活剂[20,在nup98a-1 nup98b-1这表明T6P(海藻糖-6-磷酸)与观察到的衰老无关。结果表明,双突变体的淀粉合成和糖信号传导受到损害。
外源性糖挽救早期衰老表型nup98a-1 nup98b-1双突变体
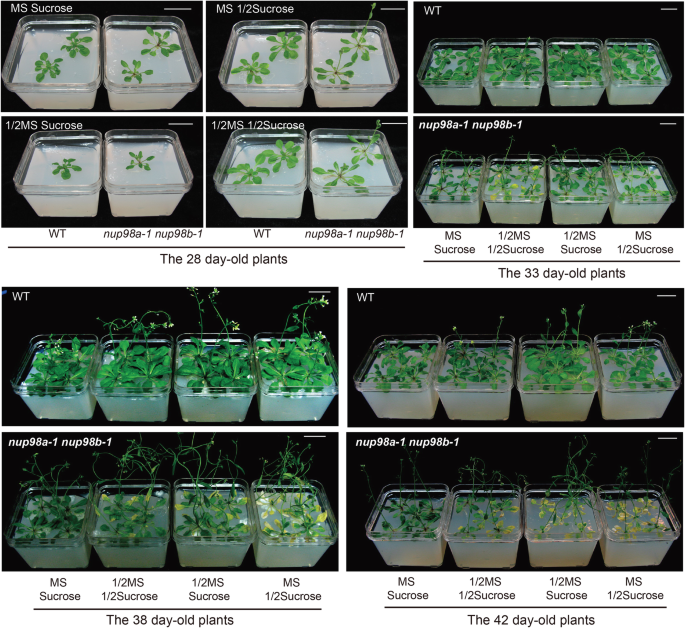
我们的结果表明,碳或能源供应受到损害nup98a-1 nup98b-1双突变体植物。我们通过在生长培养基中以蔗糖的形式提供外源碳来验证这一想法,看看是否可以挽救早期的衰老表型。我们的结果表明,尽管蔗糖和MS基础营养物质比野生型植物弱,但它们支持植株良好的生长(图。5)。两种植物都在添加蔗糖和基本营养素的培养基上完成其生命周期。接下来,我们让双突变体和对照植物在MS培养基中生长,直到花序出现,然后将它们转移到土壤中。正如预期的那样,双突变体在移植前在MS培养基上与野生型植物一样生长(补充数字)9).但转入土壤后,突变植株叶片在第6天迅速出现衰老症状,第30天出现萎蔫(补充图)9).野生型植物和nup98随着在没有任何补充的琼脂糖培养基上生长的植物,双突变体不会存活(补充图10).
增加的营养和蔗糖延缓衰老nup98a-1 nup98b-1双突变体。幼苗生长条件与无花果相同。3..1/2MS表示ms强度为1/2。1/2蔗糖表示1.5%的蔗糖。分层后,植物在长日照条件下生长。增加基础营养和蔗糖都能延缓衰老nup98a-1 nup98b-1双突变株。条 = 5. 所有的图像都是我们自己的数据
为了排除土壤对上述衰老表型的可能影响,我们通过在蔗糖和宏、微营养素浓度不同的培养基上连续生长植物,测试外源宏、微营养素是否能够补充双突变体中观察到的表型(补充图10).令我们惊讶的是,蔗糖不仅抑制了双突变体的早期衰老表型,而且在蔗糖存在的情况下还抑制了宏、微量营养素的衰老。较低强度的基础营养(½MS)增强了较低的蔗糖(1.5%)抑制衰老的作用,表明能量供应和基础营养代谢都受到了损害nup98a-1 nup98b-1双突变体。
饥饿和衰老标记基因在nup98a-1 nup98b-1双突变体
以上结果表明nup98a-1 nup98b-1双突变体可能遭受糖饥饿和衰老。因此,我们想知道饥饿或衰老标记基因是否在双突变体中高度表达。DORMANCY-ASSOCIATED蛋白质像1(DRM1 / DYL1At1g28330)和黑暗诱导6(DIN6At3g47340) (38,39是两个被充分研究的糖饥饿标记基因,而SAG12(At5g45890)和WRKY53(At4g23810)是特征明确的衰老标志物[40,41,42].自噬是糖饥饿和衰老过程中发生的重要事件[38,43,44),而自噬8a(ATG8aAt4g21980)和ATG8e(At2g45170)是植物自噬的两个典型分子指标[45].因此,我们研究了这些基因在大肠杆菌中的表达变化nup98a-1 nup98b-1结果表明,与野生型相比,双突变体在时间和发育依赖模式下发生了不同的变化。6).在双突变体中,DRM1在极早期(萌发后第5天),ZT0开始表达量显著升高,而ZT12开始表达量显著降低(图2)。6一种)。喧嚣是由光抑制和暗诱导的基因[46],其在双突变体ZT0上的高表达量在第15天开始明显,而在ZT12上的高表达量在第10天开始出现。6a).与野生型植物相比,衰老标记WARKY53在双突变体早期表达较高时DRM1表达紊乱(第5天)(图。6b)。SAG12是一种发育控制的指示衰老后期的指标[47,48].2 .我们发现SAG12在早期(第5天)双突变体和野生型植株之间的表达。然而,SAG12从第10天开始,双突变体ZT0和ZT12的转录水平都较高(图2)。6b).自噬的两种标志物,ATG8a和ATG8e从第10天开始,在大多数双突变体样本中,也有较高的mRNA丰度nup98a-1 nup98b-1双突变体表现出能量饥饿的迹象,至少在分子水平上,在植物没有显示可见的衰老表型的早期发育阶段。这些表达变化具有昼夜节律和发育特征。先前的一份报告显示,不同的糖(如蔗糖、葡萄糖和果糖)对衰老的调节有不同的影响[39].因此,观察标记基因的早表达和高表达符合黄萎病的衰老特征nup98a-1 nup98b-1双突变体。
Nup98蛋白主要定位于核膜和核质
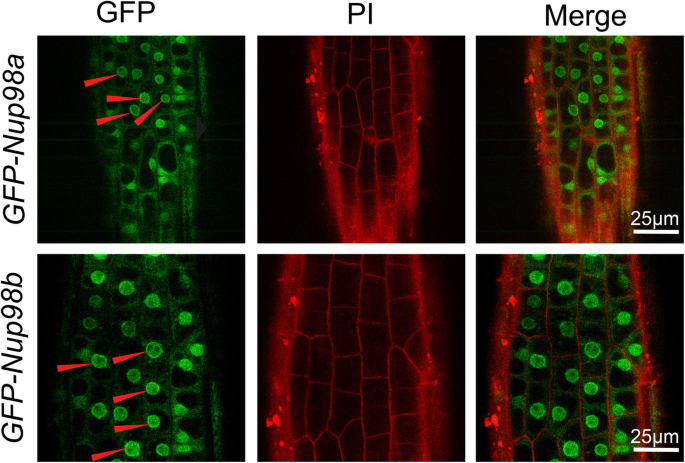
Nup98是一种可移动的外周FG (phegly结构域)核孔蛋白,位于NPC中央通道的核侧和胞质侧[4,5].拟南芥Nup98a(也称为DRA2)也存在于不同的亚细胞室[6].我们构建的转基因拟南芥植物表达35 s:: GFP: Nup98a和35 s:: GFP: Nup98b并分析了两种融合蛋白的亚细胞定位。不足为奇的是,这两种蛋白质都分布在细胞质、核质和核外周。7).我们观察到这两种蛋白质的亚细胞分布没有显著差异,这与我们观察到的它们的遗传冗余一致。综上所述,我们的联合研究结果表明Nup98b蛋白和Nup98a蛋白同时定位于细胞核和细胞质[6他们在其他生物中的同源物[4,5].
讨论
衰老是植物生命周期中生长发育不可或缺的一个过程,最终导致细胞和组织的解体和死亡。在这样的生理过程中,各种基础营养物质从衰老的器官,如叶子,重新分配到生殖器官和种子[13].然而,过早衰老可能会导致器官衰竭,甚至整个植物死亡[49].微调衰老过程可以避免非生物胁迫的有害影响,从而使植物获得最佳的生殖结果。许多因素,包括激素、发育年龄、非生物胁迫和光照条件,都参与了植物衰老的调节[21,22,50,51,52,53,54,55,56,57,58,59].虽然这些因素在植物衰老中发挥着重要而明确的作用,但糖的作用尚不清楚,因为不同的研究小组发表了相互矛盾的结果[19,20,21,60].NPC是细胞核与细胞质之间的大分子运输和基因转录的重要守门人,因此,它在植物许多不同的发育过程中发挥着重要作用[28,29,30,31,32].我们的研究为植物衰老研究提供了新的思路,因为我们发现NPC参与了衰老的调控。我们的调查证实NUP98基因参与淀粉降解,赋予衰老的起始拟南芥.
Nup98a和Nup98b在衰老调节中有冗余作用拟南芥,因为nup98单个突变体没有明显的衰老表型(图。1),即使之前的一份报告显示下胚轴较长nup98a突变体(6].相似的蛋白质序列(图S1)和Nup98a和Nup98b蛋白之间的亚细胞定位(图。7)支持这一假设。这种衰老表型可能是特定的突变NUP98基因,因为检测到的其他核孔蛋白突变体没有类似的表型(图S4).然而,检查更多的其他核孔蛋白突变体来阐明其特异性是很重要的NUP98衰老调节功能。分子数据支持NUP98基因通过多种途径调节衰老,包括乙烯,水杨酸,ABA,细胞蛋白和胁迫,因为这些途径中的标记基因,例如SAG12,NAP1,WRAY53,WRKY6,WRKY70,NAC1.,NAC2.和HXK1,基因表达发生显著变化(图。2).此外,这些基因可能以时间(昼夜)的方式发挥作用,因为它们的显著表达变化只发生在特定的时间,黎明或黄昏(图)。2).我们最近报道了ELF3基因和其他时钟基因在nup98a-1 nup98b-1与野生型植物相比的双突变体[12].因此,昼夜节律模式可能与nup98编码基因调控的衰老网络有关。
糖被确认为控制植物生长和发展中的重要信号[61].糖信号通路中的许多重要基因(TOR,KIN10,KIN11,TPS1,SnRK1) (数字S7)碳饥饿(DRM1和DIN6)(图。6)所有人都被监管nup98a-1 nup98b-1双突变体植物。基于所提出的数据,双突变体可能阻碍了糖可用性,这表明这可能是发酵衰老的主要原因(图。5).
在植物中,糖来源于光合作用,并首先以淀粉的形式储存。白天在叶绿体中积累的淀粉在夜间分解成单糖[17,18].我们的证据显示nup98a-1 nup98b-1双突变体积累了更多的淀粉,这是不可能的,因为更高的光合效率(图S7),但淀粉降解受损(图。3.).这一假设得到了以下支持:1)与光合作用相关的基因转录水平较低(LHCA1,LHCA2,LHCB1.1和LHCB1.4),这将导致双突变体中淀粉合成的减少(图S7);2)淀粉降解基因的低转录本积累(图。4)控制淀粉降解的许多步骤(图S6)[17会导致淀粉在nup98a-1,nup98b-1双突变体。双突变体的淀粉降解障碍首先会导致糖饥饿,然后导致叶片衰老,最后导致整个植株死亡。
除此之外,Nup98a和Nup98b也可以具有营养代谢的功能,因为生长培养基中基底营养物的浓度对生长和衰老产生了重大影响nup98a-1,nup98b-1双突变体(无花果。5).在这种情况下,应考虑生长培养基中的成分(糖或MS),特别是在未来的衰老研究中。
以前的实验表明,生物钟调节植物中的淀粉代谢[62,63].ELF3正调节淀粉积累,淀粉降解显著减慢elf3突变植物比在相应的野生型植物中[64].因此,ELF3和其他时钟晚间基因,如ELF4和勒克斯ARRHYTHMO,亦会影响叶片衰老[65,66].本文研究的许多基因表现出时间依赖性的基因表达差异(图。2,4和6).我们以前表明,许多时钟基因的表达明显变化nup98a-1,nup98b-1双突变体(12].综上所述,时钟基因可能参与了Nup98a / Nup98b-调节淀粉降解和衰老拟南芥.
我们最近报道nup98a-1,nup98b-1,英尺10英寸三倍突变体表现出相同的晚花期特征英尺10英寸突变体,但它也维持早期衰老表型nup98a-1,nup98b-1双突变体(12],表示Nup98a和Nup98b蛋白质以不相关或独立的途径参与调控开花和衰老过程。
很明显,功能NUP98在衰老调节中是间接的。突变的NUP98基因可能导致昼夜节律途径功能紊乱、淀粉降解障碍、糖饥饿、叶片衰老和植物死亡。确定是怎么回事会很有趣NUP98调控生物钟机制介导的淀粉降解相关基因的功能。
应该指出,即使是Nup98a和Nup98b它们在调控开花和衰老过程中是冗余的,但在其他发育过程中可能发挥独立而特异的作用nup98a单突变体(dra2)显示避免阴影[6].
结论
NPC在植物发育过程中具有多种作用。据我们所知,我们的研究首次报道了鼻咽癌在调节植物衰老中的作用。这一结果很有前景,并暗示了鼻咽癌在弥补淀粉代谢和衰老控制之间的差距方面的新功能。也就是说,Nup98a和Nup98b蛋白质重叠在他们的控制淀粉降解赋予衰老的调节拟南芥.
方法
植物材料和生长条件
水稻T-DNA插入突变体的种子nup98a(SALK_080083, SALK_090744, SALK_023493, SALK_103803, SALK_015016)和nup98b(CS803848和GABI_288A08)分别来自ABRC和GABI T-DNA突变中心。纯合子筛选按SALK (http://signal.salk.edu/).所有突变体都由肖龙博士鉴定。除正文中指出外,拟南芥短句来源哥伦比亚野生型植株及其衍生突变体在光照条件下(16 h/8 h,光照条件为100 μmol m)长日照条件下生长− 2.年代− 1.荧光照明。植物在10厘米的盆栽土壤中生长,或在含有不同强度的蔗糖和MS (Murashige & Skoog)基础培养基(Sigma, #M5524)的培养液中生长,其中含有原始经典配方(NH4没有3., 1650.0毫克·L− 1.;先3., 1900.0毫克·L− 1.;CACL.2, 332.2毫克·L− 1.;MgSO4h·72啊,180.7毫克·L− 1.;KH2阿宝4, 170.0毫克·L− 1.;FeSO4h·72啊,27.8毫克·L− 1.;H3.薄3., 6.2 mg·L− 1.;MnSO4·H2啊,16.9毫克·L− 1.;CoCl2h·62啊,0.025毫克·L− 1.;ZnSO4h·72O、 8.6 mg·L− 1.;Na2哞4h·22o,0.25 mg·l− 1.;KI、0.83 mg·L− 1.;CuSO4h·62啊,0.025毫克·L− 1.;Na2EDTA·2 h2啊,37.26毫克·L− 1.;甘氨酸(游离碱),2mg·L− 1.肌醇,100 mg·L− 1.;烟酸(游离酸),0.5 mg·L− 1.;盐酸吡哆醇·,0.5毫克·L− 1.;盐酸硫胺素·,0.1毫克·L− 1.)[67].
基因和启动子的克隆及质粒的构建
采用标准GATEWAY (Invitrogen)方法进行基因克隆和质粒构建。大多数病媒生物是由我们实验室开发的[68].全长Nup98a和Nup98b用特异性引物对开放阅读框进行pcr扩增S1),然后克隆到FU30 [68含有n端GFP标记的。基因导入载体(Fu30-GFP: Nup98a或Fu30-GFP: Nup98b),35秒启动子进入载体(Fu76-35秒)和二进制矢量(Fu39-2) [68]应用于LR反应(Invitrogen)。Fu39-2 -35S:GFP:Nup98a和Fu39-2 -35S:GFP:Nup98b采用二值向量进行变换拟南芥用花浸渍法[69].采用纯合子转基因株系进行分子表征和表型分析。
半定量PCR,实时定量RT-PCR,亚细胞定位
在萌发后第14天的ZT0(光照时间点)和ZT16(光照时间点)采收整株幼苗。RNA制备、cDNA合成以及实时定量和半定量rt - pcr均参照Xiao et al. [70,除了使用At4g34270作为三倍的参照基因[71,72].所有基因登录号及相关引物序列列于表中S1.共聚焦显微镜观察并捕捉GFP荧光信号,碘化丙啶(PI)染色细胞壁[68].
淀粉染色及定量分析
14-21日龄和28日龄野生型植株及突变体叶片淀粉含量拟南芥植物被碘染色[73].样品在ZT0(光照时间点)和ZT12(光照时间点)采集,光照时间为12 h /黑暗时间为12 h。用有代表性的工厂来积累数据。淀粉定量分析依据淀粉测定试剂盒(Solarbio,北京,Cat#BC0700)使用说明书,在分光光度计(RAYLEIGH, VIS-7220 N;采用不同浓度葡萄糖(0.2、0.1、0.05、0.025、0.0125、0.00625、0.003125、0.00156 mg/mL)生成的标准曲线。
统计分析
每个实验至少有3个生物学重复,每个重复得到相似的结果。为了获得数据,我们选择了一株具有代表性的植物并拍摄了照片。采用SPSS软件包确定显著差异概率(P)水平的所有数据(*P< 0.05,* *P< 0.01, ***P < 0.001, compared to controls). Error bars represent ± SD of the mean.
数据和材料的可用性
本研究过程中产生或分析的所有数据均包含在本发表的文章及其补充信息文件中。
缩写
- 全国人大:
-
核孔复合体
- 国家联盟:
-
Nucleoporin
- 有限公司:
-
君士坦斯
- 阿坝:
-
脱落酸
- ABI:
-
阿坝不敏感
- ACS:
-
Aminocyclopropane-1-carboxylate (ACC)合成酶
- AGL15:
-
AGAMOUS-LIKE 15
- 向来关注:
-
拟南芥组氨酸激酶
- 层次分析法:
-
拟南芥组氨酸phosphotransfer蛋白质
- AMY3:
-
Alpha-amylase-like 3
- APD:
-
Autoproteolytic域
- APIP12:
-
AVRPIZ-T PROTEIN12互动
- ARP4:
-
肌动蛋白相关的蛋白质4
- ARF:
-
生长素响应因子
- 加勒比海盗:
-
拟南芥响应监管机构
- C2H4:
-
乙烯
- ATG8:
-
自噬8
- BAM:
-
Beta-amylase
- 猫:
-
过氧化氢酶
- CK:
-
细胞分裂素
- COI1:
-
Coronatine insensitive1
- CWINV:
-
细胞壁转化酶
- DIN6:
-
黑暗inducible6
- DRM1 / DYL1:
-
Dormancy-associated protein-like1
- DPE:
-
不成比例的酶
- DRA2:
-
DRACULA2
- EBP1:
-
Erbb-3结合蛋白
- 鳗鱼:
-
增强他们水平
- EIN:
-
乙烯不敏感
- 精灵:
-
早期开花
- ETR:
-
乙烯反应
- FG:
-
Phe-Gly域
- G6P:
-
6-phosphoric酸葡萄糖
- 绿色荧光蛋白:
-
绿色荧光蛋白
- GLK:
-
Golden 2-like转录因子
- GWD1:
-
α-葡聚糖水:双激酶
- HXK1:
-
己糖激酶1
- ISA3:
-
异淀粉酶3
- 亲人:
-
蛋白激酶
- LDA:
-
Limit-dextrinase
- LHCA:
-
光系统I捕光复合物基因A
- 奇迹:
-
光系统I捕光复合物基因B
- LSF1:
-
像性four1
- 护士:
-
氮
- NAC:
-
Nam, ataf和cuc
- 小睡:
-
NAC-LIKE蛋白质
- NPR1:
-
pr基因非表达体1
- 纽约:
-
NONYELLOW着色
- MOS7:
-
修饰符的SNC1 7
- 铁矿石:
-
ORESARA
- 小灵通:
-
α葡聚糖磷酸化酶
- 、:
-
光敏色素B
- 论坛:
-
光敏色素相互作用的因素
- PYR /所有/ RCAR:
-
Pyrabactin抗性/ pyr1样或aba受体的调控成分
- RPS6A:
-
核糖体蛋白S6A
- RT-qPCR:
-
实时定量PCR
- 凹陷:
-
衰老相关基因
- SAS:
-
荫蔽躲避综合征
- 阿富汗二月:
-
小生长素调节
- SAUR36:
-
小生长素调节
- SEX4:
-
淀粉多余4
- SGR:
-
STAYGREEN
- T6P:
-
海藻糖-6-磷酸盐
- TOR:
-
雷帕霉素靶点
- Tpr:
-
RANSLOCATED启动子区域
- TPS1:
-
Trehalose-6-phosphate synthase1
- WRKY:
-
WRKY dna结合蛋白质
- ZT型:
-
Zeitgeber.
参考文献
- 1.
基因组的调节途径:细胞周期内的核质运输。细胞。2003;112(4):441 - 51。
- 2.
Strambio De Castillia C,Niepel M,Rout MP.《核孔复合物:桥接核运输和基因调控》.国家自然科学杂志《摩尔细胞生物学》2010年版;11(7):490-501。
- 3.
田村,田志强。拟南芥核孔复合组分的鉴定与鉴定。植物细胞。2010;22(12):4084 - 97。
- 4.
Capitanio JS, Montpetit B, Wozniak RW。核质Nup98通过调节DExH/D-box蛋白来控制基因表达。核。2018;9(1):1 - 8。
- 5.
Franks TM, McCloskey A, Shokirev MN, Benner C, Rathore A, Hetzer MW。Nup98招募Wdr82-Set1A/COMPASS复合物为启动子,调节造血祖细胞中的H3K4三甲基化。基因Dev。2017;31(22):2222 - 34。
- 6.
Wang X, Micol JL, Ponce MR ., et al. .DRACULA2是一种动态核孔蛋白,在拟南芥中调控遮荫回避综合征。发展。2016;143(9):1623 - 31所示。
- 7.
Light WH, Brickner JH。核孔蛋白通过保守机制调控染色质结构和转录记忆。核。2013;4(5):357 - 60。
- 8.
克罗斯MK,鲍尔斯硕士。Nup98通过与微管的关联和MCAK的对抗性调节双极纺锤体组装。中国生物医学工程学报。2011;22(5):661-72。
- 9.
拟南芥核孔复合体的组成在植物生长控制中发挥多种多样的作用。中国生物医学工程学报。2014;65(20):6057-67。
- 10.
关键词:稻瘟病菌,avrpizt, Nup98, APIP12,基础抗性大米。2017;5。
- 11.
1 .在一种坏死营养真菌病原体的免疫反应中,核孔蛋白调控MAP激酶信号通路的研究。植物杂志。2016;172(2):1293 - 305。
- 12
姜松,肖林,黄鹏,程智,陈芳,苗艳,付艳芳,陈强,张小明。核孔蛋白Nup98以constans独立模式参与开花调控。植物学报2019;38(10):1263-71。
- 13
甘S, Amasino RM。理解衰老(叶片衰老的分子遗传调控和操纵)。植物杂志。1997;113(2):313 - 9。
- 14
叶衰老的分子生物学研究。acta botanica sinica(云南植物研究)1997;48(307):181-99。
- 15
Kroger R,荷兰MM, Moore MT, Cooper CM。植物衰老:温带农业湿地养分释放的机制。环境Pollut。2007;146(1):114 - 9。
- 16
Himelblau E, Amasino RM。拟南芥叶片衰老过程中营养物质的流动。acta botanica sinica(植物科学学报),2001;
- 17
Streb S,Zeeman SC.《拟南芥中的淀粉代谢》,第10卷。Rockville:拟南芥书/美国植物生物学家学会;2012年,第e0160页。
- 18.
阮林。蔗糖代谢:通向不同碳利用和糖信号的途径。Annu Rev Plant Biol.2014;65:33–67。
- 19.
范·多尔恩工作组。完整植物叶片细胞的衰老是由低糖或高糖引起的吗?中国农业科学。2008;59(8):1963-72。
- 20.
海藻糖- 6-磷酸是导致叶片衰老的关键因素,与高碳利用率有关。植物杂志。2012;158(3):1241 - 51。
- 21.
Sheen J.植物葡萄糖信号网络中的主调节器.植物生物学杂志.2014;57(2):67-79。
- 22.
衰老,衰老和整个植物的死亡。新植醇。2013;197(3):696 - 711。
- 23.
黄志强,王志强,王志强,等。糖在调节叶片衰老过程中环境信号整合中的作用。中国农业科学。2006;57(2):391-9。
- 24.
Cho Ji,Ryoo N,EOM JS,Lee DW,Kim HB,Jeong SW,Lee Yh,Kwon Yk,Cho MH,Bhoo Sh,等。水稻六酮酶OSHXK5和OSHXK6作为葡萄糖传感器的作用。植物理性。2009; 149(2):745-59。
- 25.
Baena-Gonzalez E,Rolland F,Thevelein JM,Sheen J.在植物应力和能量信号中的转录网络中央积分器。自然。2007; 448(7156):938-42。
- 26.
熊艳艳,陈志强。植物中雷帕霉素(TOR)信号通路的研究进展。中国生物化学杂志。2012;287(4):2836-42。
- 27.
陈志强,陈志强。葡萄糖- tor信号通路在细胞周期转录调控中的作用。细胞周期。2013;12(13):1989 - 90。
- 28.
D’angelo MA, Raices M, Panowski SH, Hetzer MW。核孔复合物的年龄依赖性恶化导致有丝分裂后细胞的核完整性丧失。细胞。2009;136(2):284 - 95。
- 29.
韦伯斯特BM, Colombi P, Jager J, Lusk CP.核孔复合体组装的ESCRT-III/Vps4监测。细胞。2014;159(2):388 - 401。
- 30.
费希特曼B,哈雷尔a,核入口的压力和老化。Mech Ageing Dev. 2014; 135:24-32。
- 31.
费尔南德斯-马丁内斯J,劳特议员核孔复合生物发生。细胞生物学杂志。2009;21(4):603-12。
- 32.
追猎者兆瓦。核孔复合体在有丝分裂后细胞衰老中的作用。老化(奥尔巴尼纽约)。2010; 2(2): 74 - 5。
- 33.
Kim SY, Kang HT, Choi HR, Park SC. Nup107的减少减弱了衰老细胞中的生长因子信号。生物化学学报。2010;41(1):131-6。
- 34.
Snow CJ,Paschal BM.核孔蛋白Tpr在癌症和衰老中的作用.医学生物学杂志,2014;773:309-22。
- 35.
David Watine B.沉默核孔蛋白Tpr在癌细胞中引发衰老样表型。PLoS One.2011;6(7):e22423。
- 36
肖林,刘伟,陈飞,张旭,陈强,付云飞。拟南芥NUP107-160亚复杂突变体的表型分析农业科技学报,2016;18(5):54-61。https://doi.org/10.13304/j.nykjdb.2016.065.
- 37
王志强,王志强,王志强,等。拟南芥叶片衰老相关转录因子的研究进展。植物生物(Stuttg)。16 2008; 10(5): 63 - 75。
- 38
Contento AL,Kim SJ,Bassham DC.拟南芥悬浮培养细胞对Suc饥饿反应的转录组分析.植物生理学.2004;135(4):2330-47。
- 39
李志刚,李志刚,李志刚,等。拟南芥糖调控基因的鉴定及体内糖敏感机制的研究进展。植物学报2006;119(2):115-23。
- 40。
王志强,王志强,王志强,等。WRKY53基因在拟南芥叶片衰老过程中的表达及其调控机制。植物学报,2014,36(5):591 - 598。植物生物(Stuttg)。16 2008; 10(5): 110 - 20。
- 41。
陈志强,陈志强。拟南芥光合组织寿命和衰老的发育和年龄相关过程。植物细胞。1993;5(5):553 - 64。https://doi.org/10.1105/tpc.5.5.553.
- 42。
Lohman KN, Gan S, John MC, Amasino RM。拟南芥叶片自然衰老的分子分析。杂志。1994;92(2):322 - 8。
- 43.
Usadel B, Nagel A, Thimm O, Redestig H, Blaesing OE, Palacios-Rojas N, Selbig J, Hannemann J, Piques MC, Steinhauser D,等。可视化工具MapMan的扩展,允许对数组进行统计分析,显示相应的基因,并与已知响应进行比较。植物杂志。2005;138(3):1195 - 204。
- 44.
自噬在植物生长和胁迫反应中的作用。自噬。2006;2(1):2 - 11。
- 45.
Bassham直流。植物自噬分析方法。方法。2015;75:181-8。
- 46.
藤木Y,吉川Y,佐藤T,Inada N,伊藤M,西田I,渡边A.拟南芥的暗诱导基因与叶片衰老相关,并受到糖的抑制.生理植物.2001;111(3):345-52。
- 47.
卢三世,Amasino RM。拟南芥和甘蓝型油菜对发育衰老的调控是保守的。植物学报。1999;41(2):195-206。
- 48.
Weaver LM, Gan S, Quirino B, Amasino RM。应激和激素处理下几个衰老相关基因表达模式的比较。植物学报。1998;37(3):455-69。
- 49.
黄志强,王志强,王志强,等。植物衰老、衰老和死亡的形态学条件及其对植物长生不老的影响。新植醇。2015;206(1):。是每天奋斗
- 50.
林波,金海杰,南赫。叶片衰老。植物学报2007;58:115-36。
- 51.
Khan M, Rozhon W, Poppenberger B.激素在植物衰老中的作用-一个小型综述。老年医学。2014;60(1):49-55。
- 52.
郭Y.迈向叶片衰老的系统生物理解。植物mol biol。2013; 82(6):519-28。
- 53.
陈志强,陈志强,陈志强,等。植物器官衰老和死亡的营养循环与发育调控。中国生物医学工程学报。2010;33(4):491 - 497。
- 54.
张洪,周超。叶片衰老的信号转导。植物学报。2013;82(6):539-45。
- 55.
陈志强,陈志强,陈志强,等。植物叶片发育和胁迫信号的激素调控。acta botanica yunnanica(云南植物研究). 2013;
- 56.
WRKY转录因子:植物中多种转录因子的统称。植物信号学报。2014;9(2):e27700。
- 57.
陈志强,陈志强,陈志强,等。乙烯和转录因子在植物叶片衰老过程中的作用。植物科学学报。2014;5:650。
- 58.
在叶片衰老开始时特异性表达的转录因子的鉴定。足底。2001;213(3):469 - 73。
- 59.
王志强,王志强,王志强,等。WRKY53转录因子在拟南芥叶片衰老过程中的作用。植物学报,2012,37(6):659 - 663。植物学报。2004;55(6):853-67。
- 60。
Wingler A, masclax - daubresse C, Fischer AM。植物和异养生物中的糖、衰老和衰老。中国生物医学工程学报。2009;60(4):1063 - 66。
- 61。
糖信号与植物生长发育的调控。[J] .机器人。2014;65(3):799-807。
- 62。
Kim Ja,Kim Hs,Choi Sh,Jang Jy,Jeong MJ,Lee Si。昼夜时钟在调节植物新陈代谢的重要性。int j mol sci。2017; 18(12):2680。
- 63。
在黑暗中跳舞:黑暗是植物的信号。植物学报。2017;40(11):2487-501。
- 64。
Flis A, Mengin V, Ivakov AA, Mugford ST, Hubberten HM, Encke B, Krohn N, Hohne M, Feil R, Hoefgen R, et al.;多个昼夜时钟输出调节碳和氮储备的日更替。植物学报。2019;42(2):549-73。
- 65。
金正日H, Kim HJ Vu QT,荣格年代,麦克朗CR、香港年代,南HG。生理控制的ORE1 PRR9积极调节拟南芥叶片衰老。中国科学(d辑:地球科学)2018;
- 66。
ELF4是一个涉及中央振荡器CCA1和LHY的负反馈回路的光敏色素调控元件。植物j . 2005; 44(2): 300 - 13所示。
- 67.
陈志强,陈志强,陈志强,等。一种烟草组织培养快速生长和生物测定的新方法。杂志。1962;15:473 - 97。
- 68.
王旭,范超,张旭,朱杰,付宇飞。生物载体,一种灵活的植物基因特异性表达系统。植物学报。2013;13(1):198。
- 69.
农杆菌介导的拟南芥转化的一种简化方法。植物j . 1998; 16(6): 735 - 43。
- 70.
萧c,陈f,yu x,林c,fu yf。钩基因的过表达,AHL22,延迟开花并抑制拟南芥中备率的伸长率。植物mol biol。2009; 71(1-2):39-50。
- 71.
Gutierrez L, Mauriat M, Guenin S, Pelloux J, Lefebvre JF, Louvet R, Rusterucci C, Moritz T, Guerineau F, Bellini C, et al.;缺乏对内参基因的系统验证:在植物的逆转录聚合酶链反应(RT-PCR)分析中,一个被低估的严重缺陷。生物技术学报;2008;6(6):609-18。
- 72.
chechowski T, Stitt M, Altmann T, Udvardi MK, Scheible WR。拟南芥转录因子标准化相关内参基因的全基因组鉴定与检测。植物杂志。2005;139(1):5。
- 73.
拟南芥中淀粉降解调控的突变体。植物杂志。1991;95(4):1181 - 8。
致谢
我们感谢所有帮助过我们的朋友和同事。感谢阿德莱德大学的Jeremy Timmis教授提高了硕士英语水平。
资金
本研究由国家自然科学基金项目(No. 31571411, No. 31370324),中国科学院创新团队项目,澳大利亚研究委员会未来奖学金项目(FT130100525)和中国科学院基础研究基金项目(No. Y2017CG25)资助。资助方没有参与研究的实验设计、数据收集、分析和解释,也没有参与手稿的撰写。
作者信息
从属关系
贡献
概念化,Y-FF和X-MZ;方法,LX和Y-FF;调查,LX, SJ, PH, FC, ZC, YM, X-X W, CL, LL;形式分析,LX, FC, XW和QC;可视化、LX和Y-FF;写作-初稿,Y-FF, QC资金获取,Y-FF和X-MZ;项目管理,Y-FF和X-MZ;资源,X-M Z, YM, X-XW, QC;监督Y-FF。 All Authors read and approved the manuscript.
相应的作者
道德宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1:
补充表1。本研究使用的引物。
额外的文件2:
图S1。Nup98a和Nup98b蛋白结构域拟南芥.
额外的文件4:
图S3。的nup98a1,nup98b1双突变体在各器官表现多效性表型。
额外的文件5:
图S4。的nup98a1,nup98b1双突变体表现为衰老和不育表型。
额外的文件6:
图S5。衰老表型是特异性的nup98a1,nup98b1与其他核孔蛋白的突变体相比是双突变体。
额外的文件7:
图S6。植物衰老起始的分子网络。
额外的文件8:
图S7。淀粉在叶绿体中的简化降解途径。
额外的文件9:
图S8。光合作用和糖代谢相关基因的表达分析nup98a1,nup98b1双突变体。
附加文件10:
图S9。外源蔗糖降低了玉米的早期衰老nup98a1,nup98b1双突变体植物。
额外的文件11:
图S10。表型分析nup98a1,nup98b1在不同培养基上培养的双突变体与野生型相比。
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
肖磊,姜松,黄鹏。等等。两个Nucleoporin98同源基因共同参与调节淀粉降解以抑制衰老拟南芥.植物生物学20.292(2020)。https://doi.org/10.1186/s12870-020-02494-1
收到了:
接受:
发表:
关键词
- NUP98
- 淀粉
- 糖
- 衰老
- 核孔复合体
- Nucleoporin