摘要
背景
亚麻(亚麻属植物usitatissimumL.)在许多国家种植以获取纤维和种子。亚麻品种的油成分不同,根据脂肪酸的比例,用于制药、食品或油漆行业。众所周知,基因悲伤的(stearoyl-ACP desaturase)和时尚(脂肪酸去饱和酶)家族在脂肪酸的合成中起着关键作用,这些基因的一些等位基因与亚麻油的某种成分有关。然而,对这些基因的遗传多态性的研究资料仍然不足。
结果
在俄罗斯托尔若克亚麻研究所收集的基础上,形成了一套具有代表性的84个品种和株系,反映了亚麻油脂肪酸组成的多样性。的全长度序列的一种确定方法SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B利用Illumina平台开发基因,对84份亚麻样品中的6个基因进行MiSeq深度测序。所获得的高覆盖率(平均约400倍)使在的多态性的准确评估成为可能SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B品种/品系异质性基因及评价。遗传多样性水平最高的是冬小麦FAD3A而且FAD3B基因- 91和62多态性分别。相关分析显示,特定变异之间存在关联悲伤的而且时尚基因以及主要由它们催化转化的脂肪酸:悲伤的-硬脂酸和油酸FAD2-油酸和亚油酸FAD3-亚油酸和亚麻酸。除1个低亚麻品种/株系外,其他品种/株系均含有色氨酸替代终止密码子FAD3A基因和组氨酸以酪氨酸取代FAD3B而只有其中一个多态性的样品亚麻酸含量中等,没有这些多态性的品种/系亚麻酸含量高。
结论
遗传多态性的悲伤的而且时尚对不同油分组成的亚麻品种和品系的基因进行了评价,揭示了特定多态性与脂肪酸比例之间的关联。研究结果为开展亚麻品种的分子标记辅助选择和dna鉴定奠定了基础。
背景
亚麻(亚麻属植物usitatissimumL.)在许多国家种植以获取纤维和种子。在植物中,亚麻籽是健康ω-3脂肪酸(亚麻酸、LIN、C18:3)的主要来源之一,普通亚麻中ω-3脂肪酸的含量约为50-60%。种子还含有亚油酸(ω-6, LIO, C18:2)、油酸(ω-9, OLE, C18:1)、硬脂酸(STE, C18:0)和棕榈酸(PAL, C16:0) [1,2].亚麻籽用于油漆、清漆、生物柴油、树脂和动物饲料的生产,亚麻籽用于功能性食品和医药产品。不同的亚麻品种在油脂脂肪酸组成上存在差异:solin亚麻与传统亚麻不同,其LIN含量极低(小于5%),富含LIO,且具有长期储存的特点,对食品工业具有重要意义[1,2,3.,4].LIN和LIO是不能在哺乳动物组织中合成的多不饱和脂肪酸[5].为了达到最佳的健康和疾病预防效果,膳食中ω-6/ω-3的比例要求为1-3/1;氧化稳定的单不饱和OLE的含量对于生产稳定健康的油和其他产品也很重要[3.,6,7,8].
脂肪酸去饱和酶在烃类链上形成双键,在脂肪酸的合成中起着关键作用,决定着亚麻油的组成和用油方向[9].硬脂酰- acp去饱和酶(SAD)催化STE转化为OLE;脂肪酸去饱和酶2和3 (FAD2和FAD3)分别负责将OLE去饱和为LIO和LIO去饱和为LIN。FAD2和FAD3与细胞膜结合,而SAD是质体定位的可溶性去饱和酶[10,11].两个paralogous基因,SAD1而且SAD2,有3个外显子和2个内含子,总长度分别为2665 bp和2592 bp,编码396个残基蛋白;paralogousFAD2A而且FAD2B无内含子,长度为1137 bp (FAD2A)及1149 bp (FAD2B),分别编码378和382个氨基酸残基的蛋白质;FAD3A而且FAD3B也有6个外显子和5个内含子,总长度为3280 bp (FAD3A)及3002 bp (FAD3B),分别编码392和391个氨基酸残基的蛋白质[10,12].SAD1而且SAD2基因在亚麻中有差异表达:mRNA水平SAD1在种子发育阶段和基因型之间的差异比SAD2[12,13,14].人们认为FAD2B在LIO积累中起作用,而FAD2A是将OLE完全转换为LIO的重要因素[12].FAD3A而且FAD3B表达与亚麻酸积累和mRNA水平相关FAD3B比FAD3A[12,15,16].然而,在Thambugala和Cloutier的工作中,亚麻基因型具有相同的异构体SAD1、SAD2 FAD2A,FAD2B,FAD3A,FAD3B但脂肪酸含量不同(OLE - 11.4-21.8%, LIO - 9.9-14.9%, LIN - 53.7-71.9%),去饱和酶基因表达与油脂组成无相关性[14].多态性在悲伤的而且时尚基因被证明与脂肪酸组成有关[10,17].然而,关于这些基因的遗传多样性及其对亚麻油组成的影响的数据仍然不足,这给标记辅助选择的开展带来了复杂性。
本文分析了一组具有代表性的亚麻品种和株系l . usitatissimum脂肪酸组成多样性,采用深度靶向测序SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B基因。这种方法能够准确识别多态性,评估样品异质性,并随后寻找DNA变异和亚麻油组成之间的关联。
结果
SAD和FAD基因的多态性
序列SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B对84例标本进行深度测序l . usitatissimumPAL(5 ~ 7.6%)、STE(2.7 ~ 6.4%)、OLE(12.9 ~ 24%)、LIO(11.9 ~ 72.4%)和LIN(2.7 ~ 65.3%)含量不同的品种和品系(附加文件1).文库制备完成后,84个品种和品系分别获得40个长约600 bp的扩增子,这些扩增子包含目标序列、Illumina平台处理所需序列和双索引条形码,并在MiSeq (Illumina, USA)上进行600个周期的测序。每个品系和品种研究的每个基因平均复盖率为400倍。原始测序数据保存在Sequence Read Archive (SRA)中,登录号为PRJNA625974。
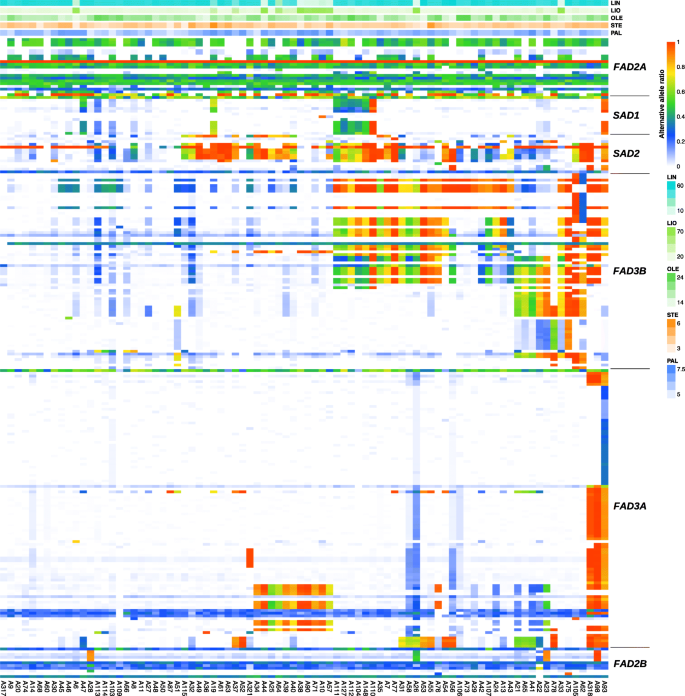
读取被修剪并映射到l . usitatissimum基因组(GCA_000224295.2/ASM22429v2)使用BWA-MEM显示了大约80%的平均总体读映射率,而bowtie2显示只有50%。使用VarScan和freeBayes进行多态性搜索。在分析的所有样本中,超过一半的发现多态性具有非常低的变异等位基因频率(VAF), 2-20%。VAF过低,这些多态性可能代表测序错误、PCR错误引物、不包括在基因组装配中的脱靶等位基因的扩增或其他人为因素。因此,我们根据VAF分布分析过滤掉了这些变量。VarScan可识别232个多态性:SAD1- 14,SAD2- 14,FAD2A- 21日FAD2B- 11,FAD3A- 101,FAD3B71个,而freeBayes揭示了239个多态性:SAD1- 15日SAD2- 15日FAD2A- 31日FAD2B- 15日FAD3A- 90,FAD3B- 73。大多数由VarScan和freeBayes变体识别的是常见的:SAD1- 12,SAD2- 12,FAD2A- 20,FAD2B- 11,FAD3A- 91,FAD3B- 62(根据VarScan对多态性的解释)。因此,FAD3A而且FAD3B基因具有最高的遗传多样性。详细的结果在附加文件中表示2,3.,4,而且5以变异表的形式(每个研究品种和品系的每个已鉴定多态性的等位基因频率反映在“备选等位基因覆盖率”、“参考等位基因覆盖率”和“备选等位基因比例”列)和热图(所有研究品种和品系的PAL、STE、OLE、LIO和LIN含量以及每个已鉴定多态性的备选等位基因比例反映在色标上)。
样本的异质性
我们的方法基于植物库的排序(每个品种和品系约50个),可以评估品种/品系的异质性。我们发现,大多数样本显示至少一个基因的异质性。多态性的FAD3B基因是异质性最能说明问题的例子:对于特定的变异,在某些样本中,参考等位基因占主导地位,在其他样本中,替代等位基因占主导地位,同时也发现了具有相近比例的参考等位基因和替代等位基因的样本(图2)。1额外的文件4而且5).
相关分析
鉴定的多态基因PAL、STE、OLE、LIO含量与LIN和VAF含量的相关性分析SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B基因揭示了特定DNA变异与亚麻油脂肪酸组成之间的关联。在表1, Spearman相关系数大于或小于−0.25 (假定值< 0.05)表示VarScan和freeBayes的结果,并在附加文件中表示由VarScan和freeBayes多态性识别的所有相关分析的结果6而且7.我们总共发现了31个与一种或几种脂肪酸含量相关的变异(脂肪酸相关多态性,FAA多态性):29个SNPs(单核苷酸多态性)和2个indels(插入/缺失)。为SAD1基因中,5个snp与油成分相关,为SAD2 -2个SNPs和1个indel, forFAD2A- 3个snp,为FAD3A -9个snp,FAD3B- 10个snp和1个indel。
这些相关性揭示了去饱和酶基因变异和主要是这些脂肪酸之间的相关性,在它们参与的生物合成:5个多态性在SAD1基因与OLE含量相关,其中2个在SAD2基因-含STE和OLE, 9 inFAD3A和10FAD3B-以LIO和LIN的含量为准。然而,5个多态性在FAD3A和2FAD3B与PAL、STE含量相关。中的变体FAD2A而与OLE和LIO含量的相关性不强,而与OLE和LIO含量的相关性不强FAD2A(见表1).
为SAD1在所有5种FAA多态性中,VAFs要么以相近比例存在,要么在每个基因型中不存在,而对于SAD2,我们没有观察到这样的模式。为FAD2A大部分样品中FAA多态性的VAFs范围在0.2 ~ 0.5之间,且在个别样品中存在差异。为FAD3A在大多数样品中,与LIN含量多态性相关的9个位点的VAFs都很接近,但在一些样品中,16092294、16092348、16093029和16093040位点的VAFs与其他位点相比存在显著差异:样本A58、A26、A56、A318、A98和A93的VAFs均存在显著差异,样本A76、A22和A23的VAFs仅为16092348位点(见附加文件)8).应该指出的是,这些站点也与LIO内容相关。FAA多态性在单个样本中VAFs的多样性最大FAD3B.
氨基酸替换
在SAD1在一个内含子(2)中,在该基因之前,即上游(2),在该基因之后,即下游(1)中,发现了FAA snpSAD2在CP027621.1:17365164基因中,FAA多态性位于一个外显子(GGT被AGT取代,甘氨酸被丝氨酸取代)、一个内含子以及该基因之后。在FAD2A基因中,在一个外显子中发现了两个snp,但它们都不会导致氨基酸的替代,而在该基因之后又发现了一个。在FAD3A在该基因中,两个FAA单核苷酸多态性导致氨基酸取代:丙氨酸取代苏氨酸(CP027631.1:16092575)和色氨酸取代停止密码子(CP027631.1:16092348)。在FAD3BTAT替代CAT导致组氨酸取代酪氨酸(CP027622.1:1035655), AGC替代ATC导致丝氨酸取代异亮氨酸(CP027622.1:1035674)。其他的FAA多态在FAD3A而且FAD3B基因不会导致氨基酸序列的变化。
研究品种和品系的聚类
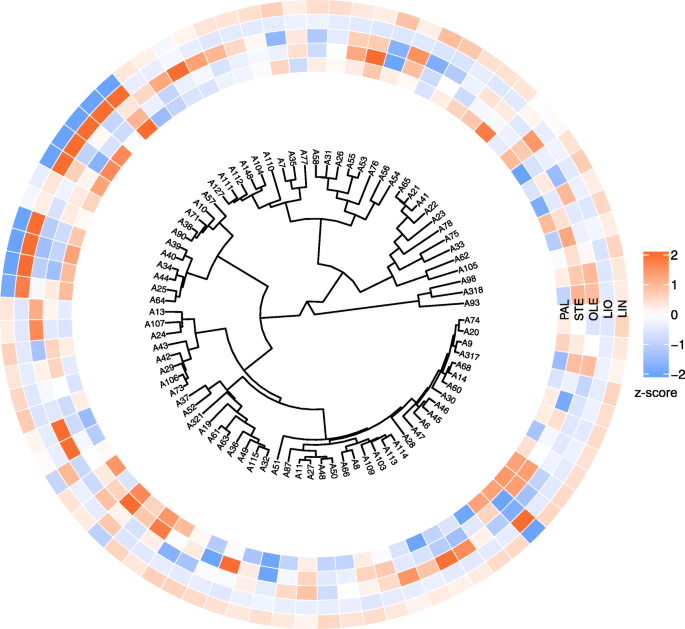
对研究的亚麻品种和株系进行聚类分析SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B使用VarScan和freeBayes进行鉴定。2和额外的文件9).基于VarScan和freeBayes数据的聚类结果非常相似。10个低LIN高LIO品种和品系中有9个(A57、A10、A71、A38、A90、A34、A44、A25和A64)的聚类如图。2)了。然而,有一个低lin的样本(A6)不在这个集群中。对于其他簇,没有明确的与脂肪酸组成的关联,可能是由于多态性的优势FAD3A而且FAD3B这些基因参与了LIO向LIN的去饱和过程。
中变量的分析FAD3A而且FAD3B对A6低lin样品进行了分析,该样品处于其他低lin品种和株系集群之外。我们发现SNP在FAD3A该基因(位点CP027631.1:16090340)导致精氨酸被一个可以解释LIN含量低的终止密码子取代。在A22、A42和A64样品中也发现了这种SNP,但VAF较低,约为5-10%,而仅在A6中,约80%的植物具有这种SNP (Additional files2而且3.).
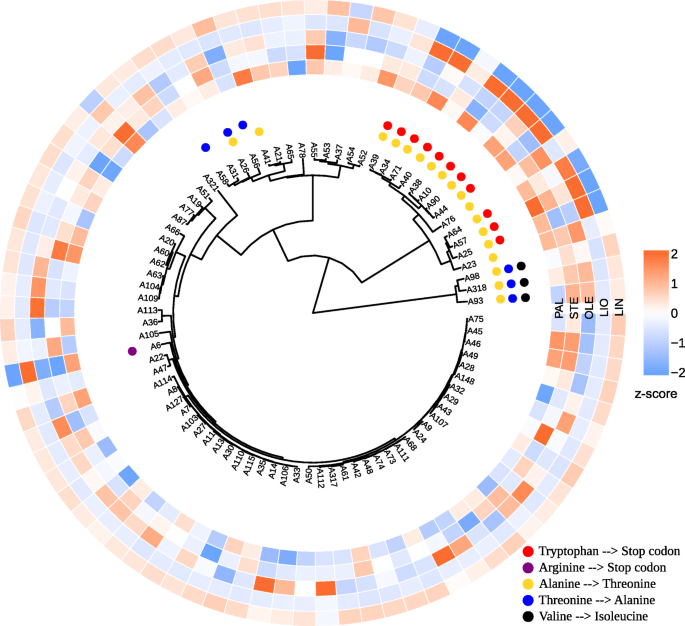
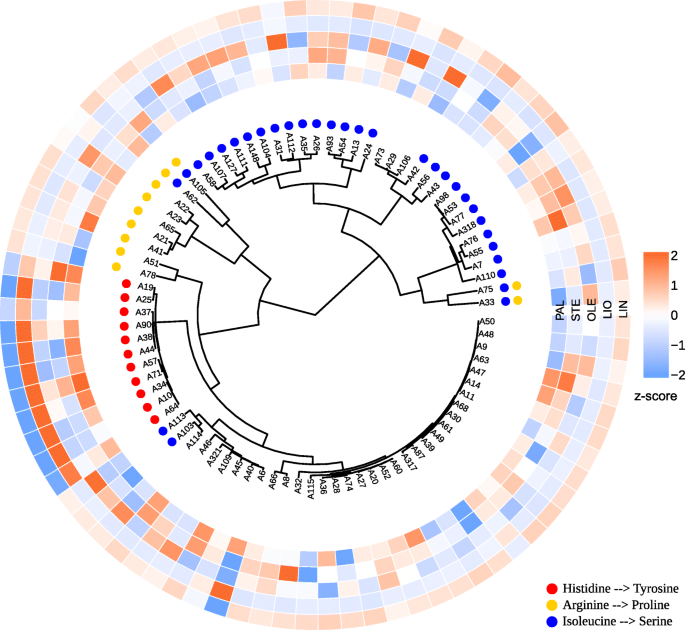
我们还根据个体基因的多态性对亚麻样品进行了聚类:SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B.结果在附加文件中表示10(VarScan)和附加文件11(freeBayes)。两个不同的呼叫者鉴定出的多态性为研究基因提供了相似的树状图。聚类结果显示FAD3A而且FAD3B这一群体中包含了大部分低lin亚麻品种和株系(图3)。3.而且4).
从图中可以看出。3.而且4, low-LIN簇中所有low-LIN样本均包含两个终止密码子(CP027631.1:16092348)FAD3A酪氨酸替代基因(CP027622.1:1035655)FAD3B基因。其中只有1个多态性的样品位于lin中段(32.6 ~ 46.8%),A39和A40样品只包含终止密码子inFAD3A(无花果。3.),而A19和A37的样品-只以组氨酸取代酪氨酸FAD3B(无花果。4).所有没有这些多态性的样品都是高lin的,除了低lin A6,有精氨酸来阻止密码子的替代FAD3A.
进一步分析了氨基酸的FAA多态性FAD3A在所有low-LIN和中lin样品中,SNP位于导致色氨酸停止密码子替换的cp027631:16092348位点,也包含其余8个FAD3AFAA snp(附加文件8).而A76和A23两个样品仅携带这8个FAA多态性,且具有较高的LIN含量。这说明色氨酸在亚麻品种和品系形成低LIN含量的过程中起着阻止密码子替代的关键作用。大多数的FAD3BFAA多态性与LIO含量呈负相关,表明它们出现在高lin样品中,但可以从附加文件中看到8在美国,超过三分之一的高lin样本不包含任何这些变异。唯一的FAA多态性FAD3B与LIN含量负相关的基因是CP027622.1:1035655位点的SNP,导致组氨酸向酪氨酸的取代。因此,这个SNP在low-LIN和mid-LIN样本中出现,而其他10个SNP都没有出现FAD3BFAA的变种,在提供亚麻油中亚麻酸含量低的关键作用。
讨论
本研究采用深度测序的方法对其进行遗传多样性评估SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B在84个不同脂肪酸组成的亚麻品种和株系中,发现了与脂肪酸生物合成有关的基因。每个品种的DNA提取量约为50株,其高覆盖度可以在品种/品系异质性的情况下进行DNA多态性的准确鉴定。2012年获得亚麻基因组草图序列[18],并于2018年使用BioNano基因组光学作图技术接收染色体规模的假分子,并改进基因组装配[19].这些结果使我们能够绘制出Illumina的读取图悲伤的而且时尚基因的l . usitatissimum基因组(GCA_000224295.2/ASM22429v2),从而减少由于在DNA水平上具有高同源性的其他脂肪酸相关基因或假基因的错误引物和测序而导致研究基因多态性错误识别的概率[20.].
采用VarScan和freeBayes两种常用的变量调用方法进行多态识别SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B所研究亚麻品种和系的基因。其遗传多样性最高FAD3A而且FAD3B基因- 91和62多态性分别。这一结果与其他研究的数据一致[10,21].FAD3A而且FAD3B将LIO去饱和成LIN [15,16],亚麻具有广泛的LIO和LIN含量遗传多样性[10].在研究的集合中l . usitatissimum与OLE、STE和PAL含量差异在1.5 ~ 2.4倍之间的差异相比,LIN和LIO含量差异最大(分别为24倍和6倍),这可能是在水稻中鉴定出众多多态性的原因FAD3A而且FAD3B基因。
相关性分析允许确定与亚麻油组成相关的变异(表1额外的文件6,7而且8).大多数相关被确定在多态性之间悲伤的而且时尚与生物合成有关的脂肪酸的基因和含量:悲伤的变异主要与STE和OLE内容相关,FAD2- OLE和LIO,FAD3- LIO和LIN。然而,也发现了一些与其他脂肪酸的关联。Thambugala等人的研究也得到了类似的结果SAD2OLE含量显著;FAD2A-适用于OLE和LIO;FAD3A-表示LIN、LIO和PAL;FAD3B-表示LIN、LIO、OLE和PAL [10].在一项亚麻全基因组关联研究中,发现了亚麻与亚麻之间的相关性FAD3A,FAD3BLIN、LIO和betweenSAD1和STE17].在本研究中,Spearman的相关系数在−0.43到0.39之间变化,在进一步分析中,大于或小于−0.25的系数被认为是显著的。大多数这样的多态性是在FAD3A而且FAD3B基因。值得注意的是,对于所有与油成分多态性相关的亚麻样品,至少有一个甚至更多的研究亚麻样品是异质性的。这表明,在一个亚麻品种或品系中,可以存在不同脂肪酸组成的基因型,并利用分子标记进行悲伤的而且时尚基因可能有助于提高品种纯度。
发现的FAA多态性位于基因启动子、外显子和内含子的不同区域。寻找由这些多态引起的氨基酸取代悲伤的而且时尚基因显示错义突变SAD2,FAD3A,FAD3B基因和无意义的突变FAD3A.然而,大多数发现的多态性是沉默的。我们的数据与之前的研究结果相似,在之前的研究中发现了沉默和错义突变悲伤的,FAD2,而且FAD3基因,而停止密码子显示在FAD3[10,12,15,16,22].在本研究中,大多数LIN含量低、LIO含量高的样品都发生了CP027631.1:16092348的突变,导致了一个终止密码子InFAD3ACP027622.1:1035655突变导致组氨酸被酪氨酸取代FAD3B而所有高林分品种和品系均未发生这些突变。A39和A40样品的LIN分别为43.5和46.8%,终止密码子在FAD3A而林氨酸含量为32.6和35.0%的A19和A37仅以组氨酸替代酪氨酸FAD3B.因此,所有4个样本只具有两种突变中的一种,都是中lin。A6样品被排除在大趋势之外:该品种亚麻酸含量低(9.4% LIN),没有上述突变FAD3A而且FAD3B基因。在A6中,另一个突变FAD3A在CP027631.1:16090340位点发现了一个终止密码子,该突变可能是该品种LIN含量较低的原因,但在该品种中未发现至少40% VAF的多态性FAD3B.
尽管我们揭示了大量的多态性FAD3A而且FAD3B并在其中发现了大量与脂肪酸组成相关的基因(9个为FAD3A和11FAD3B),进一步分析得到的数据表明,只有3个变体在确定样品中亚油酸和亚麻酸的比例中起关键作用,它们分别位于CP027631.1:16092348、CP027631.1:16090340和CP027622.1:1035655位点FAD3A基因和组氨酸对酪氨酸的替代FAD3B.这些多态性的存在或缺失可能导致亚麻酸的高、中或低含量,而亚麻酸的含量决定了亚麻油的使用。剩下的8个联邦航空局snpFAD3A该基因与关键基因(CP027631.1:16092348)或无关键基因同时存在,表明这些品种和品系具有共同的起源。相反,FAA多态性在FAD3B在样本中是通过关键的一个(CP027622.1:1035655)或其他10个不同的组合呈现的。这些发现对具有特定林氨酸含量的品种的育种是有用的:如果育种程序中一个亲本的林氨酸含量低,而另一个亲本的林氨酸含量高,就可以选择纯合的家系FAD3A而且FAD3B基因和等位变异对应的高,低,或中等的LIN含量已经在F2或F3.利用分子标记的后代将提高育种过程的效率。
结论
我们对其遗传多态性进行了评估SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B在亚麻种子脂肪酸去饱和过程中起关键作用的基因。考虑到品种和品系的异质性,Deep Illumina测序能够获得高覆盖率,并准确识别所研究基因的SNPs和indel。其遗传多样性最高FAD3A而且FAD3B基因。相关性分析显示DNA变异SAD1,SAD2,FAD2A,FAD3A,FAD3B与PAL、STE、OLE、LIO、LIN含量相关。大多数低lin的样本都用色氨酸来阻止密码子的替换FAD3A用酪氨酸代替组氨酸FAD3B,而这些多态性中只有一个与中等的LIN含量相关。其余的低lin样本含有精氨酸,以阻止密码子的替换FAD3A那是这个品种从分析的集合中所固有的。研究发现的基因多态性可用于开发分子标记,筛选亚麻育种中有价值的基因型,获得纯改良品种,显著提高育种效率,并有助于基于dna的亚麻品种认证。此外,在的多态数据悲伤的而且时尚这些基因及其与亚麻油组成的相关性,有助于开发基于crispr技术的亚麻油脂肪酸组成定向变化方法。
方法
植物材料
本研究利用了俄罗斯托尔乔克亚麻研究所收集的84个PAL、STE、OLE、LIO、LIN等不同含量的亚麻品种和株系(补充文件)1).根据Bjelková等人的描述对油分和成分进行了评估。[23根据捷克标准、计量和测试办公室的数据。
种子用70%乙醇消毒1 min, 1%次氯酸钠消毒10 min,然后在培养皿滤纸上培养5 d。每个品种和品系取约50株幼苗,用CTAB法进行DNA提取[24].使用量子比特2.0荧光计(Life Technologies, USA)评估DNA浓度。
扩增子文库的制备和测序
的测序SAD1,SAD2, FAD2A,FAD2B FAD3A,而且FAD3B基因,我们使用改良的Illumina协议制备文库(https://support.illumina.com/documents/documentation/chemistry_documentation/16s/16s-metagenomic-library-prep-guide-15044223-b.pdf).利用启动子将被研究的基因分为大约450-500 bp的区域,以这样的方式设计的引物可变位点较少,如果可能,一对引物可以放大的区域SAD1而且SAD2, FAD2A而且FAD2B,或FAD3A而且FAD3B同时进行。大型软件(25的分析悲伤的而且时尚来自GenBank的序列和我们关于亚麻基因组和转录组的数据(未发表)。NCBI Primer-BLAST [26和MethyMer [27]用于底漆设计。因此,有12对引物悲伤的10基因,FAD2基因,18 forFAD3基因被开发(附加文件12).按照我们之前的描述,对文库制备进行了两阶段PCR [28].总之,第一阶段允许扩增目标序列并附加悬挑适配器,第二阶段使用包含测序适配器和双索引条形码的Nextera XT v2索引引物。为了增加特异性,第一阶段采用了触达PCR。对于每个研究基因,在第二阶段PCR前,将每个亚麻品种和品系的扩增子组合在一起,每个样品取4 μl。利用Agilent 2100生物分析仪(Agilent, USA)和Qubit 2.0 (Life Technologies)对制备的扩增子文库的质量和浓度进行评价。然后,对文库进行标准化、池化,并在MiSeq (Illumina, USA)上以600个周期的格式进行测序(配对300bp reads, v3试剂)。
深度排序数据处理和变体调用
Illumina读取的数据用trimmomatic[修剪和过滤]29].然后读取被映射到l . usitatissimum参考基因组(组装GCA_000224295.2/ASM22429v2)。我们决定将reads映射到全长基因组组装,而不是一组PCR靶区。其主要原因可能是PCR误引和扩增了脱靶同源基因,从而产生与靶基因显著不同的reads,而这些差异可能被变异调用者认为是SNPs/indels。
我们使用BWA-MEM [30.与bowtie2相比,它允许更多的不匹配和索引。这对我们来说尤其重要,因为我们研究的是亚麻品种和株系,它们的基因组可能与参考汇编有显著差异。
使用Picard工具对映射读取进行重新排序和分组。由于不适用于PCR扩增子测序,我们没有标记重复序列。最后,我们通过两个不同的工具执行了变量调用:VarScan [31和freeBayes [32].滤除所有样本中VAF低于20%的变异。
接下来,我们分析了PAL、STE、OLE、LIO、LIN含量与基因多态性之间的关系Sad1, sad2, fad2a, fad2b, fad3a, fad3b通过计算斯皮尔曼和肯德尔的等级相关系数和假定值.我们特别注意VAF值的相对标准差(rStD)的值。rStD越大,关联越可靠。
寻找由FAA多态性引起的氨基酸取代悲伤的而且时尚利用我们的亚麻基因组和转录组测序数据(未发表)进行基因分析,以估计外显子-内含子的边界。
最后,我们根据他们的基因型(即VAF剖面;每个基因或所有基因)。在此之前,我们将所有VAF < 20%归零,以减少剩余脱靶的影响,并计算样本间欧氏距离。聚类采用Ward D2方法。所有计算都是在R环境中进行的。使用pheatmap、d3heatmap、ggtree和ghheatmap包进行聚类树图和热图的可视化。
数据和材料的可用性
在当前研究中生成和分析的数据集可以在序列读取存档(Sequence Read Archive, SRA)中获得,PRJNA625974。
改变历史
2021年1月15日
本文的一项修正案已经发表,可以通过原文访问。
缩写
- 悲伤:
-
Stearoyl-ACP desaturase
- 时尚:
-
脂肪酸desaturase
- 朋友:
-
棕榈酸
- STE:
-
硬脂酸
- 奥立:
-
油酸
- 利奥:
-
亚油酸
- 林:
-
亚麻酸
- VAF:
-
不同的等位基因频率
- SNP:
-
单核苷酸多态性
- 联邦航空总局:
-
脂肪酸相关
参考文献
- 1.
穆尔AD,韦斯科特ND。亚麻:亚麻属。伦敦:CRC出版社;2003.
- 2.
芸苔属遗传与基因组学研究。可汗:施普林格;2019.
- 3.
Goyal A、Sharma V、Upadhyay N、Gill S、Sihag M.亚麻及亚麻籽油:一种古老的药物和现代的功能食品。食品科技学报,2014;51(9):1633-53。
- 4.
张国平,张国强,张国强,等。马来酸酐化亚麻籽油制备亚麻副产物复合材料的环氧树脂固化剂。聚合物。2019;11(2):301。
- 5.
Dar AA、Choudhury AR、Kancharla PK、Arumugam N.植物FAD2基因的发生、调控及其作用。植物学报。2017;8:1789。
- 6.
Simopoulos AP, DiNicolantonio JJ报道。平衡欧米茄-6和欧米茄-3的比例对预防和控制肥胖很重要。开放的心。2016;3 (2):e000385。
- 7.
-6/ -3脂肪酸比例的增加会增加肥胖的风险。营养。2016;8(3):128。
- 8.
DiNicolantonio JJ, O’keefe JH。保持低欧米茄-6/欧米茄-3的比例对于减少炎症很重要。开放的心。5 (2): e000946。2018;
- 9.
Shanklin J, Cahoon EB。脂肪酸的去饱和及相关修饰1。植物生理化学学报1998;49:611 - 614。
- 10.
张志强,张志强,张志强,张志强,等。亚麻6个去饱和酶基因的遗传变异及其对脂肪酸组成的影响。中国科学:地球科学。2013;26(10):327 - 327。
- 11.
张颖,马西莫娃,马吉提南。巧克力树硬脂酰酰基载体蛋白去饱和酶基因家族的特征Theobroma可可L.前沿植物科学。2015;6:239。
- 12.
Rajwade AV、Kadoo NY、Borikar SP、Harsulkar AM、Ghorpade PB、Gupta VS.亚麻仁种子发育过程中SAD、FAD2和FAD3去饱和酶基因转录活性的差异导致α -亚麻酸含量的变异。植物化学。2014;98:41-53。
- 13.
Jain RK, Thompson RG, Taylor DC, MacKenzie SL, McHughen A, Rowland GG,等。两种亚麻仁基因工程启动子的分离与鉴定。作物科学。1999;(6):1696 - 701。
- 14.
亚麻(Linum usitatissimum L.)脂肪酸组成及去饱和酶基因的表达。应用学报,2014;55(4):423-32。
- 15.
亚麻(Linum usitatissimum L.)高、中、低亚麻酸基因型3个脂肪酸去饱和酶基因的转录谱分析和基因特征及其在亚麻酸积累中的作用。基因组。2011年,54(6):471 - 83。
- 16.
张海燕,张志强,王晓燕,等。FAD3去饱和酶基因对亚麻籽中亚麻酸含量的影响。植物杂志。2005;139(1):79 - 87。
- 17.
游FM,肖军,李鹏,姚智,贾刚,何磊,等。全基因组关联研究和选择标记检测亚麻种子产量和油质相关的基因组区域。化学进展。2018;19(8):2303。
- 18.
王铮,N Hobson, L Galindo,朱松,史丹,J McDill,等。亚麻(Linum usitatissimum)基因组由短散弹枪序列重新组装而成。植物j . 2012; 72(3): 461 - 73。
- 19.
游FM,肖军,李鹏,姚智,贾刚,何磊,等。亚麻染色体尺度伪分子的光学、物理和遗传图谱提炼。植物j . 2018; 95(2): 371 - 84。
- 20.
李鹏,李志勇,傅莹等。亚麻脂肪酸合成基因家族的全基因组鉴定与鉴定。蛋白质组学与生物信息学,2014,7(10):310-26。
- 21.
王志强,刘志强,刘志强,等。不同脂肪酸组成亚麻仁品种脂肪酸去饱和酶的序列表征及硅结构预测。食品农业学报,2016;96(15):4896-906。
- 22.
Porokhovinova EA, Shelenga TV, Matveeva TV, Pavlov AV, Grigorieva EA, Brutch NB。VIR亚麻低水平亚麻酸基因多态性研究生态麝猫。2019;17(2):5-19。
- 23.
刘志强,王志强,王志强,等。亚麻仁(Linum usitatissimum L.)基因型对多不饱和脂肪酸含量的影响。化学Pap。2012;66(10):972 - 6。
- 24.
克拉克JD。植物DNA分离的十六烷基三甲基溴化铵(CTAB) DNA微型准备。冷泉港方案。2009;2009(3):pdb.prot5177。
- 25.
Kumar S, Stecher G, Li M, Knyaz C, Tamura K. MEGA X:跨计算平台的分子进化遗传学分析。生物医学进展。2018;35(6):1547-9。
- 26.
Ye J, Coulouris G, Zaretskaya I, Cutcutache I, Rozen S, Madden TL. Primer-BLAST:一种用于聚合酶链反应的目标特异性引物设计工具。BMC生物信息学。2012; 13:134。
- 27.
克拉斯诺夫、涅尔尼科娃、拉库尼娜、斯涅日金娜、库德里亚夫采娃、德米特里耶夫。MethyMer:设计用于亚硫酸氢盐测序完整CpG岛的特定引物组合。生物信息学学报,2018;16(1):1840004。
- 28.
Melnikova NV, Kudryavtseva AV, Borkhert EV, Pushkova EN, Fedorova MS, Snezhkina AV等。西伯利亚杨梅特1和ARR17基因的性别特异性多态性。Biochimie。2019;162:26-32。
- 29.
Bolger AM, Lohse M, Usadel B. Trimmomatic:用于Illumina序列数据的灵活修剪器。生物信息学。2014;30(15):2114 - 20。
- 30.
与BWA-MEM比对序列读取、克隆序列和装配contigs。arXiv: 13033997 v2 [q-bioGN]。2013.
- 31.
张强,张志强,德拉尔森,沈丹,McLellan MD,林林,等。VarScan 2:通过外显子组测序发现癌症中的体细胞突变和拷贝数改变。基因组研究》2012;22(3):568 - 76。
- 32.
基于单倍型的短读序列变异检测。arXiv: 12073907 v2 [q-bioGN]。2012.
确认
我们感谢EIMB RAS生物医学精确基因组编辑和基因技术中心为数据分析提供的计算能力和技术。这项工作是利用EIMB RAS基因组中心(http://www.eimb.ru/ru1/ckp/ccu_genome_ce.php).
关于这个补充
本文已作为BMC植物生物学第20卷增刊1,2020:第5届国际科学会议“植物遗传学、基因组学、生物信息学和生物技术”(PlantGen2019)的一部分发表。附录的完整内容可以在网上找到//www.cinefiend.com/articles/supplements/volume-20-supplement-1.
资金
部分工作(亚麻遗传多样性分析)悲伤的而且时尚研究项目17-29-08036由RFBR资助。这项工作的一部分(亚麻基因组和用于引物设计和外显子-内含子边界估计的转录组测序)和出版费用由俄罗斯科学基金会资助,赠款16-16-00114。资助者在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有任何作用。
作者信息
从属关系
贡献
AD、TR、NM构思并设计了作品;PK、TR、LP、EP、RN、MP、OK、YK、VC、AS、NM进行实验;AD、PK、TR、AZ、LP、GV、EN、ER、AK、GK、NM分析数据;AD、PK、GK、NM撰写稿件。所有作者阅读并批准最终稿。
相应的作者
道德声明
伦理认可和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格《自然》对出版的地图和机构附属关系中的管辖权要求保持中立。
本文已更新。原始出版物包含错误的历史日期。
补充信息
额外的文件1。
84个亚麻品种和品系的特征分析。
额外的文件2。
多态性的SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B利用VarScan技术对84个亚麻品种和株系进行了鉴定。
额外的文件3。
多态性的SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B利用freeBayes在84个亚麻品种和株系中鉴定出的基因。
额外的文件4。
热图反映的多态性SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B利用VarScan技术对84个亚麻品种和株系进行了鉴定。亚麻品种和株系沿水平轴排列,多态分布在SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B基因沿着纵轴排列。每种多态性的PAL(棕榈酸)、STE(硬脂酸)、OLE(油酸)、LIO(亚油酸)和LIN(亚麻酸)含量及其替代等位基因比率(Alt. ratio)均反映在所有研究品种和品系的色标上。
额外的文件5。
热图反映的多态性SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B利用freeBayes在84个亚麻品种和株系中鉴定出的基因。亚麻品种和株系沿水平轴排列,多态分布在SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B基因沿着纵轴排列。每种多态性的PAL(棕榈酸)、STE(硬脂酸)、OLE(油酸)、LIO(亚油酸)和LIN(亚麻酸)含量及其替代等位基因比率(Alt. ratio)均反映在所有研究品种和品系的色标上。
额外的文件6。
中多态性之间的相关性SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B亚麻油的脂肪酸组成和基因分析。
额外的文件7。
中多态性之间的相关性SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B亚麻油脂肪酸组成和自由贝叶斯基因揭示。
额外的文件8。
脂肪酸相关多态性SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B利用VarScan和freeBayes对84个亚麻品种和株系进行基因分析。
额外的文件9。
基于多态性的84个亚麻品种和株系聚类分析SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3BfreeBayes揭示的基因。
额外的文件10。
基于个体基因多态性的84份亚麻样品聚类分析(SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B)由VarScan揭示。
额外的文件11。
基于个体基因多态性的84份亚麻样品聚类分析(SAD1,SAD2,FAD2A,FAD2B,FAD3A,FAD3B)由freeBayes揭示。
额外的文件12。
DNA文库制备第一阶段引物。
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议授权,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和源代码,提供知识共享许可协议的链接,并说明是否进行了修改。本文中的图像或其他第三方材料均包含在本文的知识共享许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的知识共享许可中,并且您的预期使用不被法定法规允许或超过允许的使用,您将需要直接从版权所有者获得许可。如欲查阅本牌照副本,请浏览http://creativecommons.org/licenses/by/4.0/.知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在对数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
德米特里耶夫,助理律师,凯兹马纳,P,罗日米娜,助教et al。遗传多样性的悲伤的而且时尚亚麻品种和株系脂肪酸组成的相关基因。BMC植物杂志20.301(2020)。https://doi.org/10.1186/s12870-020-02499-w
收到了:
接受:
发表:
关键字
- 亚麻
- 亚麻属植物usitatissimuml
- 悲伤的
- 时尚
- Desaturases
- 脂肪酸
- 遗传多样性
- 多态性
- 深度测序