摘要
背景
豆科植物通过改变基因表达模式来响应同源根瘤菌的共生定植和侵染,但转录组反应的程度很少在物种水平以下进行研究。本文描述了12个根瘤菌生物型的鉴定Ensifer meliloti,在苜蓿根系中形成氮气固定结节(紫花苜蓿L.),其次是对比较RNA-SEQ分析,每种苜蓿品种均接种两种大肠meliloti在共生性能和系统发育相关性中变化的菌株。
结果
基于它们的共生性能,特别是芽干重的基础上鉴定了根瘤菌生物型。通过将RNA-SEQ数据与未诱导的对照植物的数据进行比较来确定差异表达的基因(DEGS)和代谢途径。每种品种在每种品种中产生的次数之间发现显着差异,同时接种两种根瘤菌菌株(P< 0.01)。A total of 8111 genes was differentially expressed, representing ~ 17.1% of the紫花苜蓿基因组.各紫花苜蓿品种中deg的含量在0.5 ~ 12.2%之间。有趣的是,在类黄酮生物合成和植物与病原体相互作用(NBS-LRR)中具有预测作用的基因被鉴定为最显著的基因差异表达基因。其他的差异基因包括Medsa002106和编码结节蛋白和NCR多肽的基因,它们的表达是在固氮结节发育过程中特异性诱导的。更重要的是,两种根瘤菌接种剂之间的植物转录组(DEGs和KEGG途径)与系统发育距离之间存在显著正相关。
结论
苜蓿对不同根瘤菌菌株(即生物型或品系)的侵染反应表现出明显不同的基因集。候选基因包括Medsa002106和NBS-LRR家族中编码结节蛋白和NCR多肽和蛋白的基因。
背景
豆类流离虫共生的启动和发展需要宿主植物和微生物共生之间的许多信号交换和调节方法。植物衍生的类黄酮诱导Lysr型调节剂Nodd的表达,其激活结构染色的转录(点头,nol,诺伊的)基因在根瘤菌[1].这些结瘤基因负责结瘤因子(NFs)的生物合成和输出。其次,植物中lysin Motif receptor -样Kinase (LysM-RLK)检测到细菌来源的NFs,引起根瘤器官发生,根瘤菌通过侵染线侵染植物根系[1].从感染的线程被释放后,根瘤菌细胞包含在植物衍生的膜的结构和经历分化成类菌体。这最终导致symbiosomes的形成,其中大气中的氮转化成铵[2,3.].终端菌菌分化过程由结核特异性肽(例如小Nodulin酸性RNA结合蛋白(粪便),结节特异性富含半胱氨酸的肽(NCRS)和富含甘氨酸富含蛋白质(GRPS)的肽(GRPS)管辖[4,5].因此,它们是建立高效固氮共生系统所必需的。
豆科植物和根瘤菌之间的共生相互作用是高度特异性的,可以发生在物种水平或以下[6].一个富裕的例子是在属的豆科植物Medicago和他们的共生体Ensifer meliloti.m .呈锯齿状的和m . rigiduloides形成具有高效固氮根瘤大肠melilotiBV。medicaginis和大肠melilotiSV。rigiduloides分别[7].如前所述,宿主特异性很大程度上取决于植物产生的类黄酮和根瘤菌产生的NFs [8,9].NF的化学结构对于特定宿主植物的特异性识别至关重要。所有NFS都具有保守的核心结构,但在特定的根瘤菌瘤蛋白介导的化学修饰中变化[7,10].然而,一种细菌菌株可以产生多种形式的NFs [11].另一方面,Medicago基因组编码超过700个NCR基因,其在结节中特别表达。多样化的NCR肽曲目对宿主植物赋予识别和操纵根瘤菌感染以应变特异性的潜力[12,13].此外,植物先天免疫参与控制细菌感染的早期阶段,并在共生过程的后期决定植物细胞分化[14].因此,推测豆科植物对低于物种水平的不同根瘤菌菌株(如生物变种(或共生变种)、生态型或品系)的感染表现出不同的基因表达模式是很有可能的。
新一代测序方法已经提供了真知灼见细菌感染在某些型号的类群植物细胞的全球应对[15,16.].更具体地说,RNA-seq转录谱允许检测在共生过程中差异表达的所有基因。最近的研究确定了共生特性,如氧气反应[17.],植物免疫力[18.和植物激素的产生[16.,19.,20.,21.和次级代谢物[22.,23.,24.].大豆的转录组反应明显(大豆)接种两种不同属的根瘤菌,慢生根瘤菌和Sinorhizobium fredii (Ensifer)[25.].此外,转录组概况Lotus对虾在接种根瘤菌兼容比较,未适应的根瘤菌和致病细菌菌株,数据显示没有一般早期防御类的兼容根瘤菌诱发反应[26.].
根瘤菌通常在种水平上进行分类,但为了更好地了解根瘤菌与豆科植物之间的具体相互作用,需要进一步在种水平以下进行分类[27.].Symbiovar先前提出它们所属以反映根瘤菌菌株形成根瘤豆类的能力无论物种[27.,28.,29.,30.,31.].由于几乎每一种豆科作物都涉及多个品种,因此特定根瘤菌菌株的生物型归属在农业中也很有用。虽然生物型分类的概念已被广泛采用,但寄主植物如何在种以下水平上对根瘤菌感染作出遗传反应仍是一个谜。
在这里,我们报告了一个比较RNA-seq分析的四个苜蓿品种,每个受两种不同的根瘤菌感染加上一个未接种的对照。我们的工作始于32个根瘤菌分离物的共生特性,这导致了12个独特的生物类型的鉴定。然后利用这些知识设计了一个大规模的植物转录组实验,涉及4个苜蓿品种和6个根瘤菌生物型。转录组分析结果一致表明,在生物型水平上,豆科植物对根瘤菌感染的反应表达了显著不同的基因组。本文还将讨论豆科植物与根瘤菌相互作用的分子机制,并预测差异表达基因的功能和代谢途径。
结果
评估苜蓿相关根瘤菌的共生效率
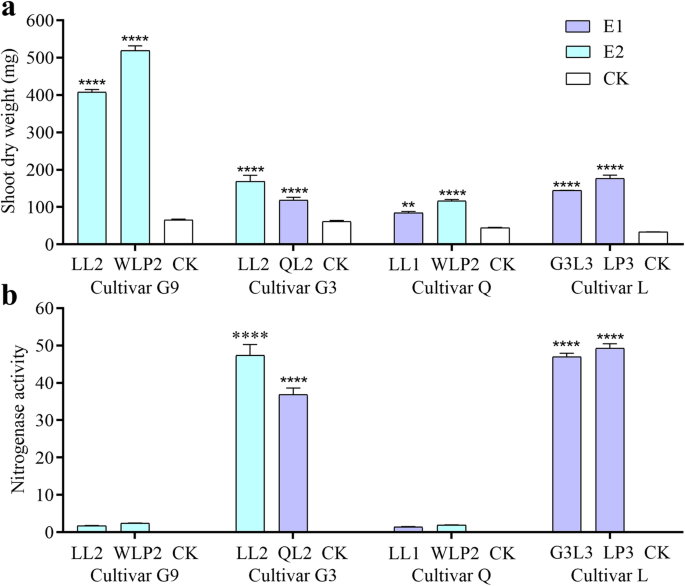
32株根瘤菌的系统发育关系(列于附加文件中)1),根据16S rRNA基因序列分析。结果表明,它们均与菌株类型密切相关大肠meliloti(附加文件2).其次,确定共生性能在五个紫花苜蓿在附加文件中提供了5个植物品种的14个参数的数据3.,4,5,6和7分别。地上部干重(SDW)和固氮酶活性的结果见图。1对于选择用于植物转录组分析的菌株(见下文)。符合我们的期望,在不同的根瘤菌菌株中观察到大的变化以及不同的苜蓿品种,暗示特异性植物细菌相互作用。使用SDW数据作为一个例子,苜蓿品种G9与未征收的对照相比产生了最高的分数(图。1).3株根瘤菌LL11 (639.67 mg)、WLP2 (519.33 mg)和LL2 (407.53 mg)的SDWs平均值显著高于对照3.).有趣的是,9个根瘤菌菌株产生显著下SDWS,提示感染根瘤菌可以是有害的不相容植物栽培种。另一方面,for a single rhizobial strain WLP2 significantly higher SDWs were detected with plant cultivars G9 (519.33 mg) and Q (116.23 mg), but not with cultivars L (42.97 mg), WL (124.37 mg), and G3 (44.4 mg) when compared with the uninoculated control (61.4 mg). Similar phenomenon was found with the nitrogenase activities (Fig.1额外的文件3.,4,5,6和7).综上所述,共生数据一致表明,苜蓿-根瘤菌相互作用在物种水平以下具有高度特异性。
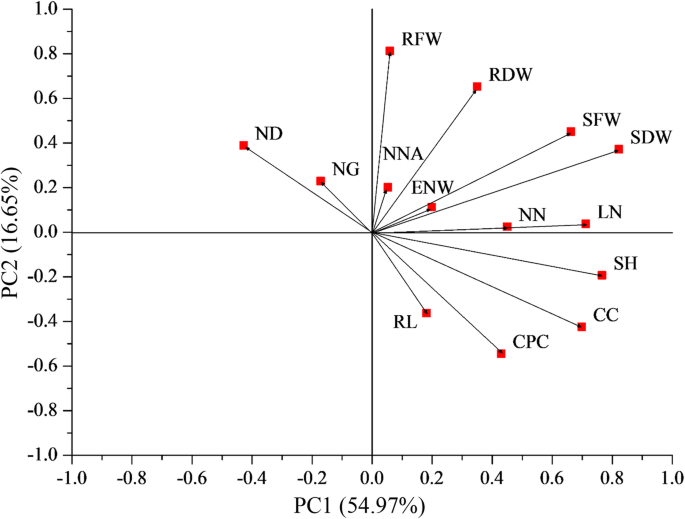
然后,对14个参数的共生数据进行主成分分析(PCA),评估各参数的相对重要性。结果表明,植物SDW对共生多样性的影响最大,而固氮酶活性对共生多样性的影响最小。2).此外,SDW值与氮酶活性之间存在弱的正相关性(R = 0.1653,P = 0.0338). SDW was thus selected as the representative parameter for estimating rhizobial symbiotic efficiency.
生物型分类大肠meliloti分离
将32株分离菌株随机分为3个共生类别(有效、E;抑制,我;无效,O),表示显著高、低或无差异(P< 0.05),与未接种对照相比(附加文件8).将各根瘤菌的共生种类与按G3、G9、L、Q、WL顺序排列的苜蓿品种进行组合。这导致了32个物种共12种共生模式(即生物型)大肠meliloti菌株对5个紫花苜蓿品种(见表)1).每个生物型具有与测试苜蓿品种独特的共生特异性。例如,生物型I,II,III和IV与苜蓿品种G3,G9,L和Q分别显示的有效单品种特异性。然而,生物型IX,X和XI分别显示了与苜蓿品种G9,Q和WL,抑制一品种特异性。观察到生物型V(苜蓿品种G3和G9)和VI(苜蓿品种G9和Q)有效两品种特异性,而观察到生物型XII抑制两品种特异性(品种Q和WL)。此外,生物型八没有形成任何的苜蓿品种的有效共生。
RNA-seq的实验设计
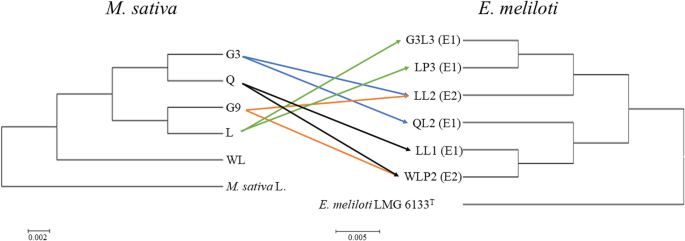
上述共生试验的结果使我们假设(i)苜蓿品种的转录组在以下物种水平上对根瘤菌感染的反应存在显著差异;(ii)有效单品种特异性生物型(E1)和有效双品种特异性生物型(E2)在同一寄主植物上的整体基因表达模式不同。为了验证这些假设,对6个根瘤菌菌株和4个紫花苜蓿品种进行转录组分析,显示出12种独特的共生相互作用(图。3.).此外,对4个植物品种分别设置未接种对照。G3-QL2、L-LP3、L-G3L3和Q-LL1是E1菌株与其特异品种之间的互作,而G3-LL2、G9-LL2、G9-WLP2和Q-WLP2是E2菌株与其特异品种之间的互作(图2)。3.、表1).在生物型而言,一个苜蓿品种(L)用相同的生物型两种根瘤菌(G3L3和LP3)接种,而所有其他三个苜蓿品种用不同生物型根瘤菌接种。
数字3.显示了5个紫花苜蓿品种间的系统发育关系,并分别将6个根瘤菌菌株与参考种结合。利用4个管家基因的串联序列构建植物系统发育树(matK1,matK2,matK3,rbcl.)具有97%或以上的序列相似性。利用16S rRNA基因序列与该菌株进行遗传相关性分析大肠meliloti液化沼气6133T作为外类群。值得注意的是,苜蓿品种WL被排除在RNA-seq的分析,因为它不支持与任何32种根瘤菌的共生效率在显著增加SDW值方面。
RNA-seq读取统计和功能注释
生成共有95,120个未成熟,并用于对常用数据库的相似性搜索和功能注释(附加文件9).组合文本的长度分布和基本局部比对搜索工具(BLAST)的分类来源匹配紫花苜蓿unigenes呈现在附加文件中10.利用Blast2GO软件v2.3.5,根据生物过程、细胞组分和分子功能的本体论,将67,815个unigenes分为特定的GO (gene ontology)功能类别(Additional file)11a)。共有20,444个组装的unigenes与127 kegg(基因和基因组的京都百科全书)途径和19路等级2(附加文件11b).基于GO和KEGG的功能注释和通路分配显示了在细胞中功能蛋白和代谢通路的高度多样性紫花苜蓿转录组。
差异表达基因(DEGs)的变异分析
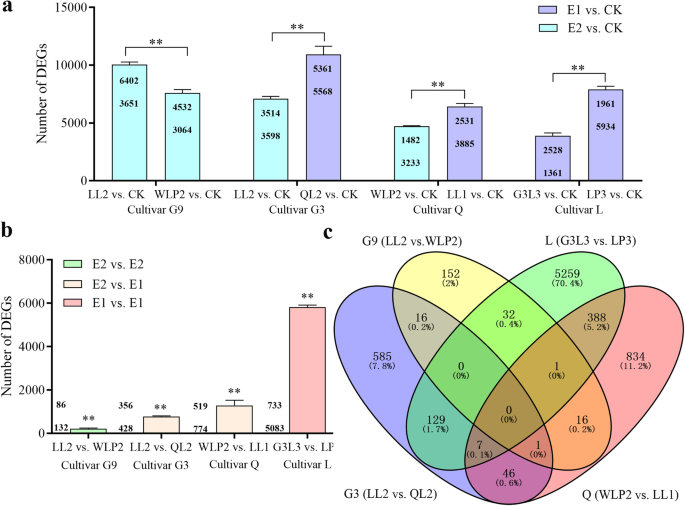
基因|日志2(fold change, FC) |≥1和错误发现率(FDR, corrected-p值)<0.05被指定为DEG。首先为相对于未征收对照的八种根瘤菌接种植物生成DEG。结果显示使用两个E2根瘤菌菌株的G9时DEGS数量的显着差异(问< 0.01)。用两株E1菌株(问< 0.01)。对于G3和Q品种,它似乎与E1菌株接种引起比E2应变显著更高DEGS(问< 0.01)。当将E2菌株(LL2或WLP2)接种到两种不同的植物品种时,G9中的含量明显高于G3(图。4a).数据表明,品种G9对E2根瘤菌感染表现出比G3和Q品种更大的转录组反应。不同治疗中常见基因的数量见附加文件12.数据显示,0.23%的基因Medicago基因组涉及高效固氮根瘤的形成。
两种不同根瘤菌接种苜蓿品种的DEGs变化。一个生物型与CK比较中检测到DEGs。每一列中显示了上调(上)和下调(下)基因的数量。数据是三个生物重复的平均值和标准误差。b在生物型比较检测DEGS;c生物型比较中二基因的维恩图Arunachal Pradesh,P < 0.01; E2, Effective two-cultivars specific biotype; E1, Effective one-cultivar specific biotype; CK, uninoculated control; G9,紫花苜蓿简历。甘农9号;G3,紫花苜蓿简历。甘松第3号;问,紫花苜蓿简历。清水;我,紫花苜蓿简历。隆中
此外,两种根瘤菌接种的每个品种在变异水平上也产生了DEGs问 < 0.01 (Fig.4a).共8111个基因表达差异,占全组基因的17.1%蒺藜苜蓿基因组。结果表明,4个紫花苜蓿品种均具有生物型特异性的转录组反应(图。4b)。为栽培品种L检测到含有两种E1菌株的味道最大的效果,5816℃(12.2%)。当用E1-与E2型菌株接种它们时,对于品种Q(1293)和G3(784)观察到较少的℃。检测218°的栽培品种G9接种两种E2菌株(图。4b). 4个品种间差异显著(问< 0.01)。4种品种没有发现常见的含量(图。4c).然而,3个品种(G9、Q和G3)共享一个DEG (Medsa002106),表明该基因可能在生物型水平上对根瘤菌的特异性识别中发挥作用。
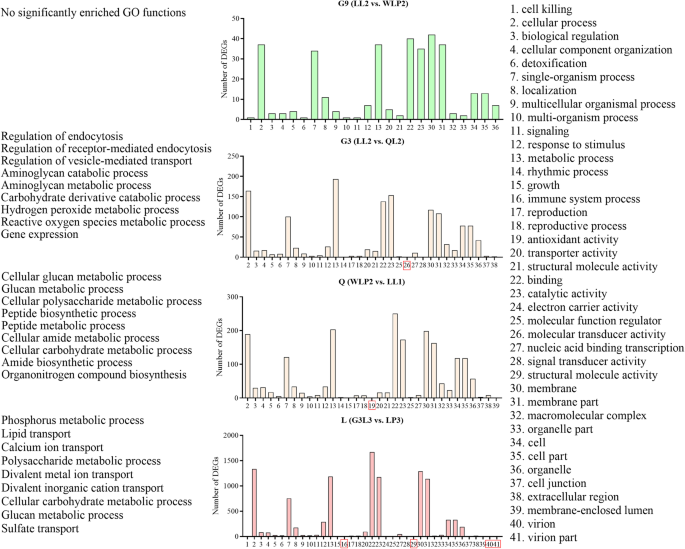
两株根瘤菌接种苜蓿后,每个苜蓿品种的GO条件和由DEGs富集的KEGG途径
去浓缩分析确定了四种品种共同富集的21条术语(图。5).与栽培品种G3和栽培品种Q相比,栽培品种L的2株E1型菌株具有更多的GO功能,栽培品种G9 (问-Value <0.05)。对于E1与E2菌株的特异性,参与内吞炎,过氧化氢和反应性氧物质的代谢基因在G3(LL2与QL2)中显着富集,而细胞多糖,葡聚糖,肽,酰胺和碳水化合物的代谢过程富集在Q中(WLP2与LL1)。
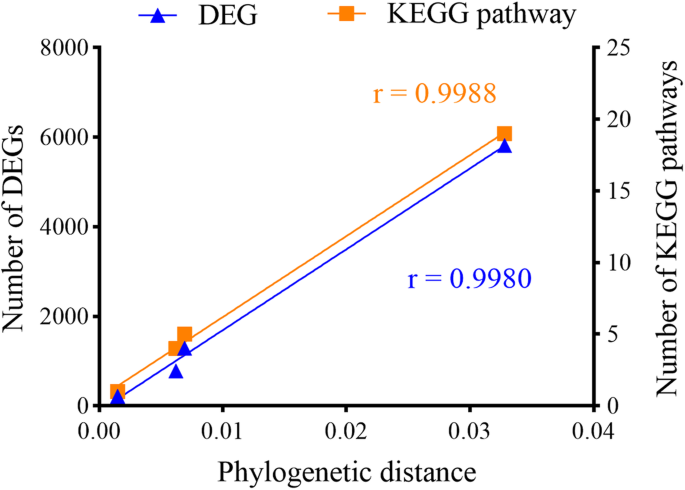
Begg途径从生物型比较中显着富集(问-value < 0.05),见表2.G3 (LL2 vs. QL2)和Q (WLP2 vs. LL1)中的DEGs与核糖体、缬氨酸、亮氨酸和异亮氨酸的生物合成和萜类生物合成有关。然而,类黄酮的生物合成和植物与病原菌的相互作用是植物品种L (G3L3 vs. LP3)的主要途径。比较两株根瘤菌的系统发育距离与DEGs的数量呈显著正相关(图2)。6).
结节成立以来,豆血红蛋白和谷氨酰胺合成酶基因的表达
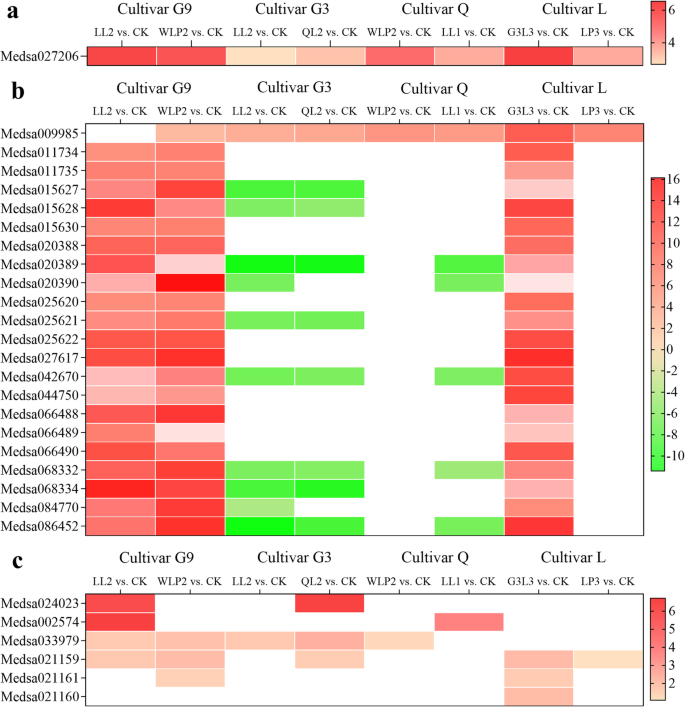
接下来,我们比较了已知功能基因的表达根瘤菌豆科植物共生关系。如图所示。7A,在用六种根瘤菌菌株接种时上调结节初始(nin)基因(Medsa027206)。在G9(LL2与CK,WLP2对CK)和L(G3L3与CK)中,共鉴定了22种leghemoglobin基因的21种。有趣的是,除了与根瘤菌菌株LL2接种的G9外,基因Medsa009985在所有治疗中上调(图。7b).令人惊讶的是,品种G3 (LL2 vs. CK, QL2 vs. CK)和Q (LL1 vs. CK)中除Medsa009985外,所有的legem血红蛋白基因都被下调并高水平表达。此外,还观察到编码谷氨酰胺合成酶的DEGs的品种特异性表达模式(图)。7c)。
与类黄酮生物合成和植物与病原体相互作用相关的DEGs
鉴于黄酮类化合物的豆科植物 - 根瘤菌共生既定角色,在类黄酮生物合成途径的基因进行进一步分析和结果汇总表3..其中包括CHS(查尔酮合成酶)、HCT (shikimate o -羟基肉桂酰转移酶)、DFR(二氢黄酮醇4-还原酶)、F3H(柚皮素3-双加氧酶)和E5.5.1.6(查尔酮异构酶)。41个deg在4个紫花苜蓿品种间的表达水平差异显著(表1)3.).这表明,根瘤菌共生能的过程中,有可能改变类黄酮的分泌模式。
为了探索不同细胞防御反应的潜力,我们进一步分析了植物与病原体的相互作用途径(表1)4).结果表明,4个品种间的DEG值差异较大。G9中仅鉴定出10个DEGs, G3中鉴定出53个DEGs, q中鉴定出64个DEGs,而品种L中鉴定出722个DEGs。与未接种的对照相比,这些deg大部分下调。在这一类别中最丰富的deg包括RPM1(抗性假单胞菌含油pv。maculicola.1)和LRR-RLK(富亮氨酸重复受体激酶),通常确认为所有四个品种。与此相反,CERK1(几丁质激发子受体激酶1)、CNGCs(环核苷酸门控通道)、FLS2 (LRR类受体丝氨酸/苏氨酸蛋白激酶)、HSP90B(热休克蛋白90kda beta)、LysM-RLK和PTI1 (Pto-interacting protein 1)仅在一个品种中检测到。总之,这些结果表明,细胞防御机制在物种水平以下的特定相互作用中的潜在作用。
编码结节蛋白、多肽和转座子的基因
从品种G3、Q和L中共鉴定出35个编码结节蛋白的基因序列(见表2)5),其中没有被G3之间共享(LL2与QL2)和Q(WLP2对LL1)。有趣的是,在G9品种(LL2与WLP2)识别度的视角不包含参与根瘤生产任何基因。因此,该数据有力地表明,根瘤素是低于物种相互作用的特定的部分原因。如表所示4共鉴定出673个多肽DEGs,占总DEGs的8.3%。在528个DEGs中发现4种类型的多肽(G3L3 vs. LP3)。Q的137个DEGs (WLP2 vs. LL1)属于3种类型的肽(NCR, GRP和SNARP)。然而,在G3 (LL2 vs. QL2)中发现了三个不同的肽,即CLE (CLAVATA3/胚胎周围区域),PSK(植物硫激酶)和RALF(快速碱化因子)。只有NCR多肽在G9中有差异调控(LL2 vs. WLP2)。
转座元件是植物基因组中的普遍特征,和苜蓿也不例外[32.].有趣的是,当品种G3和Q分别被E1和E2生物型(LL2对QL2和WLP2对LL1)感染时,一个DEG编码转座子(Medsa090988, Ty3-I Gag-polyprotein)被下调(表2)6).编码在所有四种品种中通常鉴定的15种蛋白质的DEG的分布是在附加文件中提供的13.
通过问rt - pcr
引物设计用于验证9度的视角问rt - pcr(附加文件14).七个基因(MedSa004474,Medsa025205,Medsa053760,Medsa057934,Medsa062433,Medsa067873和Medsa084795)常见于G3(LL2与QL2),Q(WLP2与LL1)和L(G3L3与LP3),而鉴定了Medsa002736在G9(LL2与WLP2)中,Q(WLP2对LL1)和L(G3L3对LP3)。MedSA002106通常以G9(LL2与WLP2),G3(LL2与QL2)和Q(WLP2与LL1)表示。结果问RT-PCR与RNA-seq数据的预期一致(附加文件)15).
讨论
本研究的目的是扩大我们具体的了解根瘤菌-豆科植物的相互作用降低到物种以下的水平。为此,我们首先确定了12个E. melilti的五个苜蓿品种与其共生的性能的基础上生物型。生物型分类是一个深入鉴定种内根瘤菌在宿主植物的种内水平[28.,33.].接下来,我们使用了最先进的RNA-seq的技术剖析,以根瘤菌感染植物转录反应。该试验被设计以测试单个植物品种是否显著由两个紧密相关的根瘤菌显示在感染基因表达的不同的图案。首先,我们的RNA-seq的结果揭示了植物转录四个苜蓿品种各有相比2种根瘤菌接种的显著差异。DEGS数量达到最多整个组基因的12.2%编码的基因组中紫花苜蓿.更重要的是,deg的数量和功能途径与两株根瘤菌的系统发育距离呈正相关。我们的工作还确定了与特定种内相互作用相关的候选基因。这些信息为进一步分析了解种内特异性的分子机制奠定了基础。此外,生物型归属对生物固氮在农业中的实际应用具有直接意义。
基于共生性能的生物型鉴定
共生效率的宿主生长促进的估计,并且通常具有增强的植物SDW [相关联34.,35.].在这里,我们证明了基于sdw的共生效率大肠meliloti5种苜蓿品种,菌株很大。该数据强烈致力于土壤中根瘤菌种群的主机驱动的适应性演变。有趣的是,一些菌株对某些植物品种表现出抑制作用。因此,潜在的有益细菌可以以寄生(或致病)方式起作用[36.,37.].在某些条件下,限制植物生长的因素是碳而不是氮。因此,观察到的非有效(O)、抑制(I)和有效(E)种内相互作用可以用N的能量成本之间的平衡来解释2-fixation和矿物氮采集[38.].此外,我们基于sdw的生物分型结果与以往关于利用植物干物质生物量评估共生效率的报告基本一致[35.,39.,40.].当一个特定的苜蓿品种在农业种植因此,它是接种兼容根瘤菌至关重要。
本研究的另一个有趣发现是,一些根瘤菌生物型与新引进的苜蓿品种形成了有效的共生关系,而不是与它们最初分离的植物品种。虽然这可能是由于实验室植物生长条件和自然环境之间的差异造成的,但在相同的生境中,无需长期的共同进化,高效的菌株特异性豆科植物-根瘤菌相互作用也可以发生[7].因此,大量的不同的根瘤菌菌株将有助于为特定的苜蓿品种选择兼容生物型[28.].
植物转录组的变异对低于物种水平的根瘤菌感染的反应
这项工作涉及五种属于同一种类的苜蓿品种紫花苜蓿.品种WL是从用于RNA-SEQ(图1中的4个品种不同系统发育。3.),并没有与32个物种中的任何一个形成有效的共生关系大肠meliloti菌株。说明WL作为该地区新引种的紫花苜蓿品种,与当地根瘤菌资源的适应性、亲和性和亲缘关系较弱。相反,国内杂交品种G3和G9以及本地品种L和Q对当地环境的适应性较好,它们能够与本地根瘤菌形成特异性和有效的共生关系。目前的转录组分析排除了品种白光,但观察到的白光抑制/无效共生与所有本地根瘤菌的机制需要进一步的单独研究。
对于特异性的DEGs,我们的结果与之前关于菌株特异性共生相互作用的报道基本一致Azospirillum和米饭之间也根瘤菌和大豆[25.,41.].大多数DEG与淀粉和蔗糖新陈代谢相关,核糖体,植物激素信号转导,植物 - 病原体相互作用和黄酮类化合物和其他次生代谢物的生物合成[25.,41.].在该研究中,在两个E2根瘤菌菌株(LL2与WLP2)之间针对G9品种检测到相对较少的DEG(0.5%),但与G3和Q品种相比,它们含有更多的leghemoglobin和谷氨酰胺合成酶的含量:G3(LL2与CK)和Q(WLP2与CK)。Leghemoglobin和谷氨酰胺合成酶在调节氧可用性和氮代谢中分别发挥关键作用[42.,43.].显著的是,在G9中检测到的所有血红蛋白基因均上调,而在G3中检测到的除Medsa009985外的其他基因均下调。这可能解释了e2诱导的G9根瘤比e2诱导的G3根瘤具有更高的茎干质量和更强的固氮能力[44.].
根据我们之前的结论,苜蓿品种对不同根瘤菌菌株侵染的敏感性不同[45.,46.].然而,转录组变异的程度是否与根瘤菌共生体之间的系统发育距离相关尚不清楚。在本研究中,我们比较了一个植物品种(L)与属于同一生物型的两株根瘤菌(生物型III的G3L3和LP3)接种后的转录组,发现了数量惊人的DEGs(5816),占12.2%蒺藜苜蓿基因组。第二十二条豆血红蛋白基因被G3L3相对应的感染上调对LP3。其他DEGS包括与植物免疫和用于结瘤和固氮,如多糖,磷,钙,离子,碳水化合物和硫酸盐关键底物代谢相关的那些。一起,该数据提供经验证据支持菌株特异性分子相互作用的假说中根瘤菌豆科植物共生关系。
在确定的特异性植物先天性免疫的潜在作用根瘤菌豆科植物共生
植物固有免疫在根瘤菌感染的初始阶段被触发,但根瘤菌细胞可以主动抑制或逃避植物固有免疫系统,以避免被与其兼容的宿主作为入侵病原体[47.].以往的研究表明LRR-RLKs在结核中积累Symcrk.突变体的蒺藜苜蓿[48.].大豆NBS-LRR抗性(R)基因通过识别根瘤菌III型分泌系统传递的效应蛋白来确定宿主-根瘤菌的特异性[49.].当R基因可能是导致紫花苜蓿排除无效根瘤菌菌株的原因[50.,51.].然而,在成熟结节防御反应可以潜在地杀死细菌和阻断菌体及其豆科植物宿主[之间的营养交流14,52.].本研究检测到几个防御相关基因,主要在G9和L品种的有效结节中下调(见表)4).这些包括LRR-RLK,NBS-LRR和NB-ARC,这是主要的R-效应触发免疫的基因[41.,53.].这一发现强烈介绍了植物先天免疫的作用在根瘤菌菌株的具体感知中。
结论
本文提供的数据揭示了苜蓿品种间特定的共生相互作用大肠meliloti该被分为12个共生生物型菌株。更显著,我们表明,在响应于在以下物种水平感染由根瘤菌菌株苜蓿品种显示不同转录概况(即生物型,应变)。差异表达的基因包括Medsa002106和那些编码根瘤素和NCR肽和NBS-LRR蛋白。所识别的DEGS的进一步分析将提供深入了解下述的物种特异性共生的基本机制。
方法
植物取样和遗传鉴定
2014年5月和8月在甘肃农业大学3个牧草试验站采集苜蓿种子和根际土壤植物(补充文件)1),使用上述标准方法[45.,46.].在系统发育分析中,从叶片样品中提取基因组dna,然后用于4个管家基因的PCR扩增垫K1,垫K2,垫K3,加拿大皇家银行l如先前所述[54.].使用清音生物科技公司(陕西省县县)的服务进行DNA测序。使用Mega 6.0软件构建邻居的树木[46.,55.].5个紫花苜蓿品种的代用标本保存在甘肃农业大学认知馆植物标本馆,植物的登录号为ms-20140421-01 ~ ms-20140421-05,种子的登录号为ms-20140813-04 ~ ms-20140813-08。
共生绩效分析大肠meliloti分离
根瘤菌从各种类型的样品,如结节,叶,茎,花,根表皮,根碑,根际土壤,田地土壤和种子[孤立45.].所有的32个分离物的16S rRNA基因测序和随后的系统进化分析使用标准方法[经受识别46.].
采用完全随机设计模型测定5个紫花苜蓿品种的共生性能[56.].用含2500 mg·mL碘伏消毒剂对种子进行表面消毒- 1可用碘酒)浸泡2分钟,然后用无菌蒸馏水冲洗5次,彻底干燥。种子在0.8% (m·v)的培养基上萌发- 1)water agar at 28 °C for 24 h, and then transplanted into a plastic pot (diameter: 13.2 cm, height: 10 cm) at a depth of 2 cm. Each pot contained 450 g of sterilized sand. The sand was screened with a 2-mm sieve, soaked in 1 mol·L- 1HCl达到pH7,用蒸馏水冲洗七次,在105℃下在烘箱中干燥,并在高压釜中在121℃下灭菌6小时[56.].盆子置于塑料盆(29 cm × 20 cm × 9.5 cm)中,500 mL无菌蒸馏水,第7天用500 mL豪格兰氮溶液灌洗[57.].然后将盆置于生长室中,昼夜循环16 h: 8 h,日间温度为22℃,夜间温度为18.5℃。相对湿度45±5%,光照150 μmol·m- 2·S.- 1.
Plants were inoculated 2 weeks after germination with the emergence of first leaf for > 90% seedlings. Inoculants were prepared by first growing大肠meliloti菌株保存在−80°C冰箱中50 mL TY肉汤培养基[58.在28°C(180转/分)的旋转振动筛上24 ~ 48小时,以达到完全生长(OD600海里= 1)。每株培养物在10000 rpm, 25℃离心10 min (Xiangyi离心机,H1650,长沙,中国),无菌蒸馏水重悬至OD值600海里的0.5 [56.].用30 mL根瘤菌悬液同时接种一盆紫花苜蓿幼苗(~ 30株)。每个处理设置4个独立的生物重复(盆)。接种后,每周灌灌500 mL霍格兰无氮营养液1次。每天用无菌蒸馏水补充水池中的水。接种后45 d,每个钵苗随机抽取10株,用标准方法测定其共生特性[45.]:根瘤数,有效根瘤重(粉红结节的重量),结节直径,化合物叶片数,苗高,根长,根瘤固氮酶活性,叶绿素含量和粗蛋白质含量。鲜重和干重分别为植物的枝条和根分开测量。结节如前所述分级[59.].简而言之,所强化的死亡结节被定义为1级;具有白色横截面的结节被定义为2级;粉红色结节直径<0.5 mm定义为3级;直径为0.5〜1mm的粉红色结节定义为4级;直径> 1mm的粉红色结节被定义为5级。菌株的共生效率被标记为有效(e),非排污性(O)或抑制性(I),其代表显着更高,无或更低的共生价值(P< 0.05)。
RNA-seq分析
如图所示。3.12个处理,3个独立的重复进行rna测序。研究对象为4个紫花苜蓿品种,每个品种接种2个根瘤菌菌株和1个未接种的对照。所有根瘤菌菌株都能在相关品种上形成有效根瘤。接种根瘤后45天采收根瘤,立即用液氮冷冻。使用EASYspin Plus植物RNA分离试剂盒(Aidlab,北京,中国)根据制造商的协议提取总RNA。用分光光度法定量RNA浓度(NanoDrop Technologies, Inc.),使用安捷伦2100生物分析仪(Agilent Technologies, Inc.)测定其完整性。
根据制造商的说明,使用Illumina®(NEB, Ipswich, MA, USA)的NEBNext®Ultra™RNA Library Prep Kit生成库。简单地说,用oligo (dT)连接的磁珠富集mRNA,并用随机六聚体引物和M-MuLV逆转录酶合成cDNA第一链。随后用缓冲液、dNTPs、RNase H和DNA聚合酶i合成第二链cDNA,经QiaQuick PCR试剂盒(Borunlaite, Beijing, China)纯化,EB缓冲液洗脱,剩余cDNA片段悬垂修复至钝端。DNA片段的3 '端在与发夹环结构连接之前被腺苷化。琼脂糖凝胶电泳,筛选150 ~ 200 bp的cDNA片段。最后用Phusion high fidelity DNA聚合酶、通用PCR引物和index (X)引物进行PCR。在Illumina NovaSeq 6000平台上,利用赛健生物技术有限公司(中国广州)提供的服务,对36个cDNA文库(12个处理× 3个重复)的两端进行测序。
差异表达基因的测定
fastq格式的原始RNA-seq数据首先使用FastQC (v0.11.5)处理,以删除低质量的适配器和序列。由于缺乏参考基因组序列,如前所述,使用Trinity (v2.2.0)软件组装高质量的干净reads [60.].Sequences with similarity > 95% were grouped into one class, and the longest sequence of each class was treated as the unigene in subsequent processing. Taxonomic and functional annotation of the transcripts were performed using Blast+ (v2.4.0) for the annotation with Nr (non-redundant protein sequences from NCBI), Swiss-Prot (a manually annotated and non-redundant protein sequence database) and COG/KOG (cluster of orthologous groups of proteins), KAAS for annotation with KEGG, Blast2GO (v2.3.5) for GO annotation and HMMER3 for Pfam (protein families database of alignments and hidden Markov models). Genes were identified with an E-value 10- 5对存放在数据库中的序列。
使用RSEM软件包v1.2.31直接将全长reads映射到参考unigenes [61.].FDR < 0.05和log的基因2(FC)≥1为指定的DEGs [62.],其使用磨边机v3.14.0 [确定63.].使用Blast2GO (v2.3.5)对所有deg进行GO富集分析,使用KEGG对所有deg进行KEGG通路富集分析(http://www.expasy.org).采用超几何检验确定显著富集的氧化石墨烯功能和KEGG通路。计算p-value受到Bonferroni修正,采取修正p-value < 0.05作为阈值。当问- 值被定义为自然PFDR(正FDR)类似物的p-Value [64.],选择显著水平0.05进行富集分析。
实时荧光定量PCR (问rt - pcr)
使用上述方法制备总RNA的总RNA问以β-肌动蛋白作为内源对照,采用标准程序进行RT-PCR。寡核苷酸引物的序列在附加文件中提供14.当问通过基于熔化曲线分析来分析RT-PCR数据△△CT和2-△△CT方法[65.].当△每个基因的CT值由目的基因的CT值减去内源性对照的CT值计算。Prism 8.0版(GraphPad Software Inc., San Diego, California, USA)进行统计学分析。
数据和材料的可用性
RNA-seq数据已存入GenBank,登录号为SRR8224042 ~ SRR8224077。这四个管家基因的序列可在GenBank的存储库中找到,登录号为MN159019至MN159037。
缩写
- 协助:
-
结核特异性半胱氨酸富含肽
- 毛评点:
-
Nodule-specific glycine-rich蛋白质
- SNARPs:
-
小结瘤素酸性RNA结合蛋白
- NFs:
-
点头的因素
- SDW:
-
射干重
- E1:
-
有效的单品种特异性生物型
- E2:
-
有效的两品种的具体生物型
- NBS-LRR:
-
核苷酸结合域富含亮氨酸重复
参考资料
- 1.
Jiménez-Guerrero I, Acosta-Jurado S, Cerro PD, Navarro-Gómez P, López-Baena FJ, olero FJ, Vinardell JM, Pérez-Montaño F.根瘤菌中nod基因诱导分子效应的转录组学研究:不同的武器,一个目的。基因。2018;9(1):1。
- 2。
Catalano CM, Lane WS, Sherrier DJ。共生体膜蛋白的生化特性Medicago truncatula根结节。电泳。2004; 25(3):519-31。
- 3.
Roth Le,Stacey G.细菌释放成氮固定大豆结节的宿主细胞:酶促膜来自三种来源。EUR JBelt Biol。1989; 49(1):13-23。
- 4。
丹尼斯·罗奥·罗克·雷。比较肿胀与非纺无毒杆状菌之间的共生效率。植物理性。2010; 154(3):1541-8。
- 5。
Kereszt A, Mergaert P, Montiel J, Endre G, Kondorosi É。植物多肽对共生瘤发育和功能的影响。植物科学学报2018;
- 6。
张xx, Turner SL,郭晓伟,杨慧杰,Debellé F,杨桂平,Dénarié J,杨建文,李fd。常见结瘤基因黄芪西科斯尽管染色体多样性,根瘤菌仍然是保守的。应用环境微生物学。2000;66(7):2988-95。
- 7。
安德鲁斯M,Andrews Me。豆类根瘤菌中的特异性。int j mol sci。2017; 18(4):705。
- 8。
马森博伊文C,吉罗E,佩雷X,Batut J.建立固氮共生豆类:根瘤菌多少食谱?杂志征稿2009; 17(10):458-66。
- 9。
刘cw,默里jd。黄酮类化合物在结论宿主范围特异性中的作用:更新。植物。2016; 5(3):33。
- 10.
Radutoiu S,Madsen的LH,Madsen的EB,Jurkiewicz A,深井E,Quistgaard EMH,Albrektsen AS,詹姆斯EK,Thirup S,Stougaard J. LysM结构域居间lipochitin寡糖识别和非功能性需求基因扩大了共生寄主的范围。EMBO j . 2007; 26(17): 3923 - 35。
- 11.
库珀我。豆科植物和根瘤菌之间的早期相互作用:在分子对话中揭示复杂性。应用微生物学杂志。2007;103(5):1355-65。
- 12.
Wang Q, Yang S, Liu J, Terecskei K, Ábrahám E, Gombár A, Domonkos Á, Szücs A, Körmöczi P, Wang T, Fodor L, Mao L, Fei Z, Kondorosi É, Kaló P, Kereszt A, Zhu hMedicago truncatula.中国科学(d辑:地球科学)2017;
- 13。
Yang S, Wang Q, Fedorova E, Liu J, Qin Q, Zheng Q, Price PA, Pan H, Wang D, Griffitts JS, Bisseling T, Zhu HMedicago truncatula.中国科学(d辑:地球科学)2017;
- 14。
Berrabah楼Ratet P,Gourion B.豆类结节:在没有防御诱导的大规模感染。分子植物微生物相互作用。2018; 32(1):35-44。
- 15.
Pérez-MontañoF,Jiménez-Guerrero I,Acosta-Jurado S,Navarro-GómezP,Ollero FJ,Ruiz-Sainz Je,López-baena FJ,Vinardell JM。结核病对杂志的转录组分分析Sinorhizobium frediiHH103揭示了借助于共生的新型根瘤菌基因。SCI批准。2016; 6(1):31592。
- 16。
Larrainzar E, Riely BK, Kim SC, Carrasquilla-Garcia N, Yu HJ, Hwang HJ, Oh M, Kim GB, Surendrarao AK, Chasman D, Siahpirani AF, Penmetsa RV, Lee GS, Kim N, Roy S, Mun JH, Cook DR.深度测序Medicago truncatula根转录组揭示了点头因子和乙烯信号之间的大量和早期相互作用。植物杂志。2015;169(1):233 - 65。
- 17。
Pessi G, Ahrens CH, Rehrauer H, Lindemann A, Hauser F, Fischer HM, Hennecke H.全基因组转录组分析慢生根瘤菌菌体在大豆根瘤。分子植物微生物相互作用。2007; 20(11):1353至1363年。
- 18。
Nobori T,Velásquezac,吴j,kvitko bh,克雷梅勒jm,wang y,he sy,Tsuda K.植物免疫下的细菌病原体的转录om景观。Proc Natl Acad Sci U S A. 2018; 115(13):E3055-64。
- 19。
Breakspear A,Liu C,Roy S,Stacey N,Rogers C,Trick M,Morieri G,Mysore Ks,Wen J,Oldroyd Ged,Downie Ja,Murray JD。根发“感染物”Medicago truncatula揭示细胞周期基因的变化,并揭示了在根瘤菌感染中的养肝信号传导的要求。植物细胞。2014; 26(12):4680-701。
- 20.
van Zeijl A, den Camp RHMO, Deinum EE, Charnikhova T, Franssen H, den Camp HJMO, Bouwmeeter H, Kohlen W, Bisseling T, Geurts R.根瘤菌脂-壳寡糖信号触发细胞分裂素的积累Medicago truncatula的根源。摩尔。2015;8(8):1213 - 26所示。
- 21.
Jardinaud MF, Boivin S, Rodde N, Catrice O, Kisiala A, Lepage A, Moreau S, Roux B, Cottret L, Sallet E, Brault M, Emery RJN, Gouzy J, Frugier F, Gamas pMedicago truncatula根表皮。植物杂志。2016;171(3):2256 - 76。
- 22.
paungfu -Lonhienne C, Lonhienne TGA, Yeoh YK, Donose BC, Webb RI, Parsons J, Liao W, Sagulenko E, Lakshmanan P, Hugenholtz P, Schmidt S, Ragan MA。甘蔗和植物之间的相声促进生长伯克德利亚物种。SCI批准。2016; 6:37389。
- 23.
于热A,Bakkou N,佩雷X.仿形共生的响应Sinorhizobium frediiNGR234菌株的RNA-Seq生物固氮;2015.
- 24.
鲍威尔AF,多伊尔JJ。接种根瘤菌非添加剂转录反应在年轻异源多倍体与二倍体其祖先相比。基因。2017; 8(12):357。
- 25.
元S,戎L,陈S,陈H,章C,陈L,郝Q,单Z,羊Z,邱d,张X,差异基因表达的周X. RNA测序分析响应于在不同根瘤菌株大豆(大豆)根。前植物SCI。2016; 7:721。
- 26.
Kelly S, Mun T, Stougaard J, Ben C, Andersen SU. DistinctLotus对虾对从共生到致病的一系列细菌的转录组反应。植物学报。2018;9:1218。
- 27.
Ribeiro RA, Rogel MA, López-lópez A, Ormeño-orrillo E, Barcellos FG, Martínez J, Thompson FL, Martínez-Romero E, hungriia M.热带根瘤菌A型菌株的再分类根瘤菌leucaenaesp. 11 Int J Syst Evol Microbiol. 2012; 62:1179-84。
- 28.
Rogel Ma,Ormeno-Orrillo E,Romero Me。根瘤菌中的Symbiovars反映了对豆类的细菌适应。SYST APPL MICROBIOL。2011; 34(2):96-104。
- 29.
陈志强,陈志强,陈志强,等。一种新型共生体的定义与进化。rigiduloides等Ensifer meliloti高效结瘤Medicago物种。acta Microbiol sinica . 2013;36(7): 490-6。
- 30.
Ramírez-Bahena MH, Chahboune R, Velazquez E, Gómez-Moriano A, Mora E, Peix A, Toro M. Centrosema是一种由几个新的推测种和共生变种结瘤的杂交种Bradyrhizobium在不同的美国国家微生物学报。2013;36(6):392-400。
- 31.
Rogel MA,Bustos的P,安圣玛丽亚RI,冈萨雷斯V,Romero的d,CEVALLOS MA,洛萨诺L,卡斯特罗-蒙德拉贡Ĵ,马丁内斯-Romero的Ĵ,Ormeño-Orrillo E,在symbiovar mimosae的马丁内斯-Romero的E.基因组基础根瘤菌etli.BMC基因组学,2014;15(1):575 - 85。
- 32.
Pecrix Y,Staton Se,Sallet E,Lelandais-Briere C,Moreau S,Carrere S,Blein T,Jardinaud MF,Latrasse D,Zouine M,Zahm M,Kreplak J,Mayjonade B,Satgéc,Perez M,Cauet S,Marande W,Chantry-Darmon C,Lopez-Roques C,Bouchez O,BérardA,Debelléf,Muos S,Bendahmane A,BergèsH,Niebel A,Buitink J,Frugier F,Benhamed M,Crespi M,Gouzy J,GamasP.全基因组景观Medicago truncatula共生基因。Nat植物。2018;4(12):1017 - 25所示。
- 33.
Bourion V, Heulin-Gotty K,《V, Tisseyre P, Chabert-Martinello M, Pervent M, Delaitre C, D卑鄙,Siol M, Duc G,布鲁内尔B, Burstin J, Lepetit M . Co-inoculation豌豆核心的多样化rhizobial菌株显示了有节竞争力和固氮效率是不同的特征交互。植物学报2018;8:2249。
- 34.
Fox SL, O’hara GM, Bräu L.增强结核分枝和共生效应Medicago truncatula接种时荧光假单胞菌WSM3457和Ensifer(中华根瘤菌)论文WSM419。土壤植物。2011;348(1 - 2):245 - 54。
- 35.
马立克-科扎扎祖克,Wdowiak-Wróbel S, Kalita M, chernetsky M, Deryło K, Tchórzewski M, Skorupska A.寄主依赖共生效率根瘤菌BV。三叶草结核分离株三叶草鲁本斯.Antonie Van Leeuwenhoek。2017; 110(12):1729-44。
- 36。
价格PA,坦纳HR,狄龙BA,巴卜男,沃克GC,Griffitts JS。根瘤菌肽酶裂解HRRP宿主编码的信号肽类和介导共生兼容性。国家科学院院刊美A. 2015; 112(49):15244-9。
- 37。
尼尔森MS,萨多斯基MJ。固氮根瘤菌与豆科植物的分泌系统和信号交换。植物科学学报2015;6:491。
- 38。
拉盖尔G,德普雷特G,布里翁V,杜克G。根瘤菌BV。蚜豌豆根瘤、根和芽的发育反应与基因型互作。新植醇。2007;176(3):680 - 90。
- 39。
Calheiros AS,初中MDAL,桑托斯MVF,天琴座MDCCP。共生效益和calopo根瘤菌菌株竞争力的Argissolo vermelho-amarelo在伯南布哥干燥林区的三个植被覆盖下。白质生物学杂志。2015;39(2):367-76。
- 40。
da Silva VSG, de Rosália e Siva Santos CE, de Freitas ADS, Stamford NP, da Silva AF, de Lyra MDCCP, Santos LRC, Ferreira JDS。豆科植物原生根瘤菌的共生效率银合欢leucocephala从巴西东北地区的几个土类派生。奥斯特Ĵ作物科学2018; 12(3):478-85。
- 41。
Drogue B, Sanguin H, Chamam A, Mozar M, Llauro C, Panaud O, prigente - combaret C, Picault N, Wisniewski-Dyé F.植物的根转录组分析揭示了菌株依赖的反应Azospirillum赖斯合作。植物科学学报2014;5:607。
- 42。
刘建军,刘建军,刘建军,杨建军。豆科植物-根瘤菌共生的基因组变异及其转录组基础研究。摩尔生态。2017;26(21):6122 - 35。
- 43.
詹姆斯D,Borphukan B,Fartyal D,Achary VMM,Reddy Mk。谷氨酰胺合成酶的转基因操纵:在农作物改善的各个方面的未开发潜力的目标。在:GOSAL SS,WANI SH(EDS),作物改善的生物技术,第2卷,第14章,第367-416章。Cham:Springer International Publishing AG;2018年。
- 44.
López SMY, Sánchez MDM, Pastorino GN, Franco MEE, Balatti PA。结节和延迟结节衰老:两种策略慢生根瘤菌具有高容量固氮分离物。CURR微生物。2018; 75(2):1-9。
- 45.
康伟,石胜,徐磊。植物内生根瘤菌与非内生根瘤菌的多样性与共生分化紫花苜蓿.安微生物。2018; 68(5):247-60。
- 46.
康伟,徐磊,姜志,石松。植物内生根瘤菌遗传多样性与共生效率差异紫花苜蓿.可以j microbiol。2019; 65(1):68-83。
- 47.
于H,宝H,张Z,在结节终端菌体分化期间曹Y.免疫信号转导途径。趋势植物科学。2019; 24(4):299-302。
- 48.
Berraabah F,Balliau T,Elhosseyn As,George J,Zivy M,Ratet P,Gourion B.乙烯信号通路的控制阻止了在根瘤菌的细胞内容纳过程中的植物防御。新植物。2018; 219(1):310-23。
- 49.
刘军,杨松,郑强,朱红。水稻显性基因的鉴定Medicago truncatula这限制了结节的形成Sinorhizobium Meliloti.应变Rm41。中国生物医学工程学报。2014;14(1):167。
- 50.
王栋,杨树华,唐飞,朱洪波。豆科植物-根瘤菌共生的特异性。细胞Microbiol。2012;14(3):334 - 42。
- 51.
生活在植物内部:细菌内生菌。植物学报。2011;14(4):435-43。
- 52.
王志强,王志强,王志强,等。豆科植物与根瘤菌的共生关系及其与植物免疫的关系。植物科学进展。2015;20(3):186-94。
- 53.
张Y,夏R,旷H,迈尔斯BC。植物NBS-LRR防御基因的多样化指示将针对他们的microRNA的进化。mol Biol Evol。2016; 33(10):2692-705。
- 54.
李YQ。常见牧草通用DNA条形码的筛选及数据库的建立。硕士论文。兰州:甘肃农业大学;2017.
- 55.
Tamura K,SteCher G,Peterson D,Filipski A,Kumar S. Mega6:分子进化遗传学分析6.0版。mol Biol Evol。2013; 30(12):2725-9。
- 56.
苗yy,shi sl,张jg,mohamad oa。苜蓿中苦参碱治疗具有relizia的迁移,定植和幼苗生长(紫花苜蓿L.)。Acta Agr Scand B-S P. 2018; 68(1):26-38。https://doi.org/10.1080/09064710.2017.1353131.
- 57.
霍格兰DR,嫩DI。对于没有土壤生长的植物水培方法。伯克利:加州农业大学药学院,农业试验站;1950年。
- 58.
贝灵哲酒庄我。R因子转移根瘤菌.Ĵ创微生物。1974; 84(1):188-98。
- 59.
李建峰,张树清,石少林,霍ph .紫花苜蓿内生根瘤菌的位置和数量。中国J Eco-Agr。2009; 17(6): 1200 - 5。
- 60。
Grabherr MG,哈斯BJ, Yassour M,莱文生理改变,汤普森哒,阿米特我,Adiconis X,风扇L, Raychowdhury R,曾问,陈Z, Mauceli E, Hacohen N, Gnike, Rhind N,迪帕尔马F, Birren BW, Nusbaum C, Lindblad-Toh K,弗里德曼N, Regev三位一体:重建一个完整的从RNA-Seq没有基因组转录组数据。生物科技Nat》。2011;29(7):644 - 52。
- 61。
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12(1):323。
- 62。
Wu Td,NACU S.快速和SNP耐受性的复杂变体和短读拼接。生物信息学。2010; 26(7):873-81。
- 63。
罗宾逊MD,麦卡锡DJ,SMYTH GK。编辑:用于数字基因表达数据的差异表达分析的生物导体包。生物信息学。2010; 26(1):139-40。
- 64。
层JD。正误发现率:贝叶斯解释和q值。安Stat。2003;31(6):2013 - 35。
- 65。
Livak KJ, Schmittgen TD。利用实时荧光定量PCR和2- PCR方法对相关基因表达数据进行分析△△Ct方法。方法。2001;25(4):402 - 8。
致谢
康文娟感谢国家留学基金委对赴新西兰留学的资助。我们感谢两位匿名评论员的建设性意见。
资金
本研究部分由甘肃农业大学资助。基金资助:国家自然科学基金资助项目(No. 31560666),甘肃省科技计划项目(No. 19ZD2NA002-3),国家现代农业产业技术体系资助项目(No. 19ZD2NA002-3);CARS-34)。Zhang的实验室研究得到了新西兰MBIE Catalyst Fund的资助(项目编号:027529544)。92846082)。这些资助机构支持细菌菌株和植物样本的测序,但在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有作用。
作者信息
从属关系
贡献
SLS和WJK设计了这项研究。WJK,ZHJ,FW,YGC和CL进行了实验并分析了数据。HFW执行了统计分析。WJK写了稿件。XXZ促进了稿件的监督,数据分析和修订。所有作者均阅读并批准最终手稿。
相应的作者
伦理宣言
伦理批准和同意参与
已获甘肃农业大学批准采集植物样品。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1。
的列表Ensifer meliloti菌株。
额外的文件2。
32个代表性系统发育树Ensifer meliloti基于16S rRNA基因的序列的菌株。加入日内的数字(www.ncbi.nlm.nih.gov/)列于括号内。
额外的文件3。
共生性能32Ensifer meliloti菌株紫花苜蓿简历。甘农9号。大肠meliloti菌株1〜32按照以下顺序编码:G3L2,G3L3,G3L4,G3L5,G3L6,G3L7,G3L8,G3L9,G3L10,G3L12,G3L13,G3T2,G9L3,G9L4,G9L5,G9L6,G9L7,G9L8,LL1,LL2,LL5,LL6,LL7,LL8,LL10,LL11,LP3,QL 2,QL 4,QL5,WLG1和WLP2。红色和绿色的框表示比未接种的对照显著较高和较低的值,分别为(P< 0.05)。接受转录组分析的菌株用蓝线和紫色方框标记(****,显著性在P< 0.0001;n,没有意义P< 0.05)。数据是平均值,有四种生物重复实验的标准误差。
额外的文件4。
共生性能32Ensifer meliloti菌株紫花苜蓿简历。甘农3号。大肠meliloti菌株1〜32按照以下顺序编码:G3L2,G3L3,G3L4,G3L5,G3L6,G3L7,G3L8,G3L9,G3L10,G3L12,G3L13,G3T2,G9L3,G9L4,G9L5,G9L6,G9L7,G9L8,LL1,LL2,LL5,LL6,LL7,LL8,LL10,LL11,LP3,QL 2,QL 4,QL5,WLG1和WLP2。红色和绿色的框表示比未接种的对照显著较高和较低的值,分别为(P< 0.05)。接受转录组分析的菌株用蓝线和紫色方框标记(****,显著性在P< 0.0001;n,没有意义P< 0.05)。数据是平均值,有四种生物重复实验的标准误差。
额外的文件5。
共生性能32Ensifer meliloti菌株紫花苜蓿简历。清水。大肠meliloti菌株1〜32按照以下顺序编码:G3L2,G3L3,G3L4,G3L5,G3L6,G3L7,G3L8,G3L9,G3L10,G3L12,G3L13,G3T2,G9L3,G9L4,G9L5,G9L6,G9L7,G9L8,LL1,LL2,LL5,LL6,LL7,LL8,LL10,LL11,LP3,QL 2,QL 4,QL5,WLG1和WLP2。红色和绿色的框表示比未接种的对照显著较高和较低的值,分别为(P< 0.05)。接受转录组分析的菌株用蓝线和紫色方框标记(****,显著性在P< 0.0001;n,没有意义P< 0.05)。数据是平均值,有四种生物重复实验的标准误差。
额外的文件6。
共生性能32Ensifer meliloti菌株紫花苜蓿简历。隆中。大肠meliloti菌株1〜32按照以下顺序编码:G3L2,G3L3,G3L4,G3L5,G3L6,G3L7,G3L8,G3L9,G3L10,G3L12,G3L13,G3T2,G9L3,G9L4,G9L5,G9L6,G9L7,G9L8,LL1,LL2,LL5,LL6,LL7,LL8,LL10,LL11,LP3,QL 2,QL 4,QL5,WLG1和WLP2。红色和绿色的框表示比未接种的对照显著较高和较低的值,分别为(P< 0.05)。接受转录组分析的菌株用蓝线和紫色方框标记(****,显著性在P< 0.0001;n,没有意义P< 0.05)。数据是平均值,有四种生物重复实验的标准误差。
额外的文件7。
共生性能32Ensifer meliloti菌株紫花苜蓿简历。WL168HQ。大肠meliloti菌株1〜32按照以下顺序编码:G3L2,G3L3,G3L4,G3L5,G3L6,G3L7,G3L8,G3L9,G3L10,G3L12,G3L13,G3T2,G9L3,G9L4,G9L5,G9L6,G9L7,G9L8,LL1,LL2,LL5,LL6,LL7,LL8,LL10,LL11,LP3,QL 2,QL 4,QL5,WLG1和WLP2。红色和绿色的框表示比未接种的对照显著较高和较低的值,分别为(P< 0.05)。接受转录组分析的菌株用蓝线和紫色方框标记(****,显著性在P< 0.0001;n,没有意义P< 0.05)。数据是平均值,有四种生物重复实验的标准误差。
额外的文件8。
32Ensifer meliloti五个紫花苜蓿品种品系。菌株置于以下三类:有效(E),非有效(O)和抑制(I)与地上部分干重的值显著更高,无显著差和比未接种的对照植物,分别的显著降低(P< 0.05)。
额外的文件9。
的组装和转录功能注释的总结紫花苜蓿.
附加文件10。
从头组装的长度分布和BLAST的分类来源相匹配紫花苜蓿unigenes。一个从头组装的长度分布;b分类爆炸源的爆炸源。
额外的文件11。
基因本体(GO)的分布和KEGG分类紫花苜蓿转录组。a生物过程中的主要功能类别,转录组中发现的细胞成分和分子功能类别。纵坐标表示unigenes的数量。条形图表示分配的数量紫花苜蓿与Blastx的蛋白质与每个GO术语匹配。一个Unigene可以与多个GO术语匹配。b左y轴表示kegg路线。CEGGG分类所涉及代谢途径的未成年人分为五组,如右y轴上所示。X轴表示分配给特定途径的未成熟的百分比。
附加文件12。
两株根瘤菌接种苜蓿品种后表达的共同基因。
附加文件13。
4个品种中常见的上调和下调基因的数量。除植物多肽和植物与病原体相互作用的蛋白外,15个蛋白中有上调和下调的deg。
附加文件14。
实时荧光定量PCR引物序列(问rt - pcr)。
附加文件15。
通过定量实时PCR验证九次DEGS(问rt - pcr)。当问RT-PCR数据为平均值±日志的SEM2(折叠变化)使用2计算-△△CT方法。g7个基因在G3, Q和L中共同表达。h在G9,Q和L中共同表达的一种基因。我一个基因在G9、G3和L中共同表达。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
康,W.,江,Z.,陈,Y。等等。植物转录组分析揭示了苜蓿与其根瘤菌共生体在物种水平下的特定分子相互作用。BMC植物BIOL.20.293(2020)。https://doi.org/10.1186/s12870-020-02503-3
收到了:
接受:
发表:
关键词
- 转录组
- 根瘤菌豆科植物共生
- 苜蓿品种
- 根瘤菌
- 生物型