摘要
背景
NAC (NAM, ATAF1-2和CUC2)家族是已知的最大的植物特异性转录因子家族之一,在植物发育过程和逆境响应中发挥重要作用。
结果
在本研究中,共鉴定出112个NACs在叶与茎、叶与根、根与茎的比较中存在差异表达杨树simonii×P。黑质通过RNA-Seq鉴定289个成员。在150 mM NaCl胁迫下,根、茎和叶中分别检测到148、144和134个nac对盐有响应。其中,三种组织共有53个盐反应性NACs。在盐胁迫下,鉴定出41/37个NACs上调/下调黑杨树RT-qPCR检测170个非冗余NACs,与RNA-Seq结果相似。6个NACs的表达谱分析,包括4个随机上调基因(NAC86,NAC105,NAC139和NAC163)和两个下调基因(NAC15和NAC149)表明,少数NACs在三种组织中表现出特定的时空表达模式杨树simonii×P.nigra.通过对盐胁迫下不同组织中差异表达的NACs进行转录组筛选和系统发育分析,鉴定出18个与木材形成相关的潜在NACs和20个参与胁迫反应的潜在NACs杨树simonii×P.nigra.
结论
本研究进一步了解了杨树组织特异性与基因功能之间的联系,为杨树NACs在逆境响应中的功能分析奠定了基础。
背景
NAC最初来源于三个蛋白质的名称:NAM、ATAF1-2和CUC2 [1]。NAC家族可能是最大的植物特异性转录因子(TF)家族,大约有20,000个成员[2]。该家族所有成员共有一个高度保守的n端NAC结构域,包含150-160个氨基酸。该域可划分为5个子域(A-E)。子结构域A、C和D是高度保守的,而B和E是可变的。A子结构域与功能二聚体的形成有关。带正电荷的C和D亚结构域是重要的dna结合区。B和E亚结构域可能与NAC蛋白的功能多样性有关[3.]。NAC家族具有多种多样的c端转录调控区域,具有几种特定的基序,这些基序富含丝氨酸-苏氨酸、脯氨酸-谷氨酰胺或酸性残基的重复序列,可作为转录激活剂或抑制剂[3.,4]。少数NAC TFs作为植物发育过程和各种胁迫反应的中心调控因子,可以通过特异性结合靶基因启动子区域的顺式作用元件与下游基因相互作用。一些重要的元素有ABREs、DREs、LTREs、MYB、MYC等[4,5]。此外,一些研究指出了几个上游要素和microrna在植物发育和环境胁迫反应中调控NAC蛋白的表达发挥重要作用[6,7]。例如,证明了在的启动子中插入了MITE元件ZmNAC111并且与玉米抗旱性的自然变异显著相关[6];几microrna如miRNA164,miRNA159,miRNA166,miRNA319等,通过调控与植物生长和胁迫反应相关的NAC蛋白的表达,在重叠的遗传网络中发挥关键作用[7]。
NACs可以调节多种生物过程,包括植物发育过程、激素生物合成、代谢过程、胁迫反应等。[8]。NACs参与多种植物发育过程,如侧根发育、器官形成、细胞分裂和分化、植物衰老、次生细胞壁形成等[9,10,11,12]。具体来说,某些NACs在木材形成过程中充当主基因调控因子,例如与维管相关的NACs结构域(盾)基因,次级壁相关NAC结构域(SND)基因,NAC继发性壁增厚(望远镜)基因[13,14,15,16]。例如,VND7通过直接调节木质部导管形成相关基因的表达参与木材的形成[14];SND1能调节纤维的二次壁合成吗拟南芥[15];NST1和NST2能调节二次壁增厚吗拟南芥[16]。此外,少数NACs在植物激素的生物合成、接受和信号调控中发挥重要作用[17]。此外,几种NACs与活性氧积累和细胞死亡有关[18]。最后但并非最不重要的是,许多NACs已被确定参与生物/非生物应激反应[4,5]。
在揭示NACs在应激反应中的调节功能方面已经做了大量的工作[19]。NACs在多种信号通路和调控网络中通过自调节或交叉调节应激相关基因参与多种应激反应[j]。20.]。采取ANAC096如与bzip型ABRE结合因子和ABRE结合蛋白协同作用,提高植物在脱水和渗透胁迫条件下的抗逆性[21]。大多数NACs在植物的逆境反应中起正向调节作用。例如,TaNAC2转基因作物对干旱、盐和冰冻胁迫的耐受性增强拟南芥[22]。SlNAC4作为胁迫响应型TF在番茄耐盐性和耐旱性正向调节中的作用[23]。此外,还有几种NACs在抗逆性中起相反的作用。例如,一个新的NAC基因来自拟南芥,ATAF1干旱诱导,负向调控应激反应基因的表达[24]。ONAC095被确定为转基因水稻干旱和冷胁迫反应的负调控因子[25]。此外,少数NACs参与了非生物和生物胁迫信号之间的串扰。例如,OsNAC6转基因水稻对脱水、高盐和稻瘟病的耐受性提高[j]。26]。转基因拟南芥overexpressingATAF1耐旱性增强,但对坏死性真菌高度敏感[27]。此外,某些NACs可能在植物对环境胁迫的响应和植物发育过程的调节中发挥作用。GmNAC20转基因大豆不仅增强了耐盐性和抗冻性,而且促进了侧根的形成拟南芥[28]。拟南芥AtNAP被鉴定为渗透胁迫反应的负调节因子和衰老的正调节因子[29]。
随着新一代测序(NGS)的普及,近年来对荞麦、高粱、小米、水稻、大豆、马铃薯等作物NAC家族全基因组分析的研究越来越多[qh]30.,31,32,33,34,35,36]。例如,共80个FtNACs在全基因组基础上从荞麦中获得[30.];多达145名非冗余人员SbNACs通过全基因组调查从高粱中鉴定[31];通过全基因组综述,研究了水稻151个非冗余NAC基因的基因结构、系统发育、基因组定位和表达谱[32];通过综合全基因组分析和基因组构成分析,从谷子中鉴定出147个推定的NACs [33]。此外,NACs的下游基因也可以通过全基因组关联研究进行鉴定。例如,利用转基因水稻的RCc3:6MYC-OsNAC表达根,通过ChIP-Seq和RNA-Seq鉴定OsNAC蛋白的直接靶基因[34]。然而,树木NAC家族的全基因组分析远远少于作物NAC家族的全基因组分析。
杨树是生物学研究的模范树种[37]。Di-haploid杨树simonii×P。黑质是一种特殊的杂交杨树在东北、西北和西南地区的经济和防护林建设中发挥着重要作用[38]。了解NACs在木材形成和应力响应中的调节作用将有助于提高木材质量和木材的应力耐受性杨树simonii×P。黑质.因此,我们专注于分析和筛选盐反应性和木材相关的NACs杨树simonii×P。黑质本研究通过转录组分析。首先,分析并筛选了黄花苜蓿叶片、茎和根的差异表达基因(DEGs)和289个NAC成员杨树simonii×P。黑质RNA-Seq。然后分别在三种组织中鉴定出盐反应性deg和NACs。特别定量了170个非冗余nac在黄花苜蓿叶片中的相对表达量杨树simonii×P。黑质通过RT-qPCR检测盐胁迫下的基因表达。通过RT-qPCR验证盐胁迫下不同时间点6种NACs在3种组织中的表达规律。此外,利用转录组分析和系统发育分析相结合,鉴定了杨树与木材形成和盐胁迫反应相关的潜在NACs。本研究结果揭示了杨树NACs的功能特征。
结果
三种组织间的deg比较杨树simonii×P。黑质
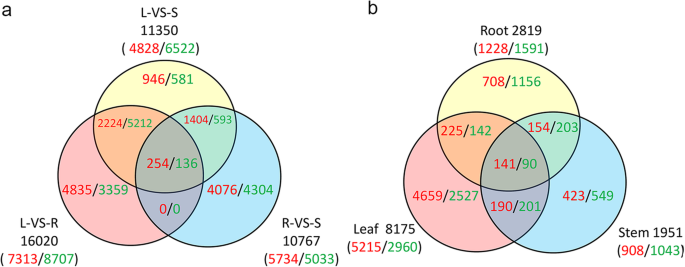
从叶片与茎、叶片与根、根与茎的73,013个对照组中,共鉴定出11,350个(高表达4828个/低表达6522个)、16,020个(7313/8707)和10,767个(5734/5033)极性基因。与茎和叶相比,根中有更多高表达的deg。在这些基因中,三个对照组共有390个(254/136)个基因。1a、补充Excel1).这390个基因主要参与植物发育、胁迫响应、代谢过程、激素信号等不同的生物过程。在254个上调的deg中,转录因子23个,转录抑制因子3个,转运基因14个,以及a /B桶状结构域(Dabb)基因。其中转录因子12个,转运基因7个,还有早反应性脱水应激等少数应激反应基因ERD3136个下调基因中的基因(补充Excel)1).
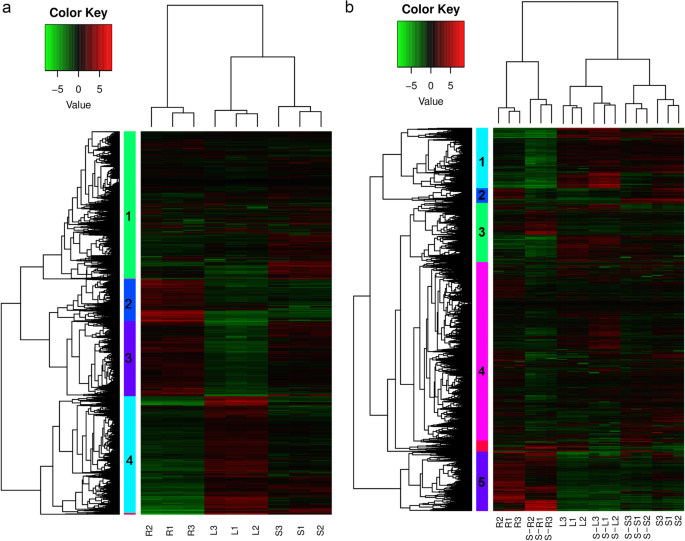
采用聚类分析确定三种组织中deg的表达模式(图2)。2a).根据组织的不同,deg在垂直方向上可分为3组,在水平方向上根据mRNA丰度可分为4组。簇2在根中的表达量高于叶和茎;簇3在叶片中的表达量低于茎和根;簇4在叶片中表达量高,在根中表达量低;与叶和根相比,簇1似乎在茎中高度表达。此外,茎和叶中的deg聚集在一起,表明deg在两种组织中具有相似的表达模式(图2)。2一个)。
三种组织中的盐反应性deg杨树simonii×P。黑质
盐胁迫下,根、茎、叶共鉴定出2819个、1951个、8175个上调基因(URGs) 1228个、908个、5215个,下调基因(DRGs) 1591个、1043个、2960个(图2)。1b、补充Excel2).其中,三个组织共有231个基因(141个URGs和90个DRGs)。这231个基因主要与胁迫反应有关,如生长素反应GH3基因,乙烯反应转录因子15,干燥反应基因29个b,Dabb(应激反应A/B桶结构域)基因等。在141个URGs中,转录因子9个,调控基因4个,应激响应基因较少。90个DRGs中有8个转运基因,3个相互作用基因,少量合酶或酶基因(补充Excel)2).
deg垂直聚为3组,共6个亚群,茎叶基因在盐处理下聚在一起。横向上,deg主要分为5类。在叶片中检测到的URGs多于DRGs,而在根和茎中则相反。集群1在根中的表达量低于在叶和茎中的表达量。簇5在根中的表达量高于叶和茎。与对照相比,盐胁迫下根系中簇2和4的表达下调。其他簇与盐处理的URGs和DRGs混合(图2)。2b)。
三种组织间NACs表达差异的比较杨树simonii×P。黑质
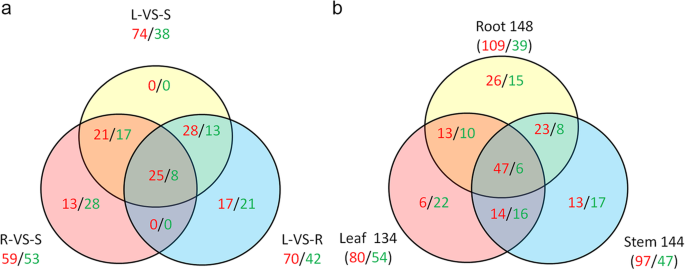
为了评估NAC家族在不同组织中的表达模式,对所有289个NAC成员的mRNA丰度(补充Excel3.)的转录组数据来源于杨树simonii×P.nigra.基于FPKM,检测到227个NACs,其中112个在至少一个FPKM≥4的组织中表达(补充Excel)3.).与根和叶相比,茎中检测到更多高表达的NACs,表明更多的NACs倾向于在茎中特异性表达。在叶对茎、叶对根、根对茎的比较分析中,分别鉴定出74/38、70/42、59/53高/低表达NACs(图2)。3.a).在叶片和根的比较中,特异表达的NACs多达38个(17个高表达/21个低表达)。在根vs茎比较中有41个NACs特异性表达,其中高表达基因13个,低表达基因28个。在叶片和茎的比较中没有特异性表达的基因,说明NACs在两种组织中的表达模式相似。三个比较共有33个NACs,包括25个高表达基因和8个低表达基因(图2)。3.a)。叶与茎、叶与根、根与茎的FC分别高出2倍的NACs有47个(31/16)、43个(31/12)、35个(20/15)(supplementary Excel)4).
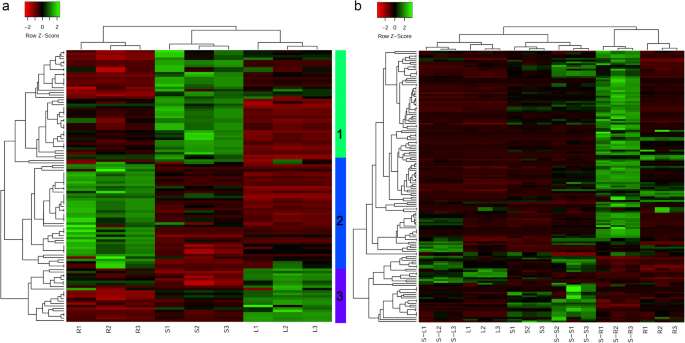
采用分层聚类方法鉴定了112种NACs在根、茎和叶中的表达模式。NACs可以垂直聚集成3组。将叶和茎中的基因归为同一组,说明NACs在两个组织中的表达模式相似,这与DEGs的表达模式相同。横向上,这些基因可分为三类。簇1、簇2和簇3分别在茎、根和叶中高表达(图2)。4a).茎中高表达的NACs多于根和叶,这与DEGs在三种组织中的表达模式不同。
三种组织中的盐反应性NACs杨树simonii×P。黑质
为了更好地理解盐胁迫下NAC家族的表达模式,我们从NAC的转录组数据中得到了NAC家族全部289个成员的mRNA丰度杨树simonii×P.nigra在控制和盐胁迫条件下。基于FPKM,检测到258个NACs,其中151个NACs在至少一个组织中表达,FPKM≥4(补充Excel)3.,无花果。3.b)。在151个NACs中,分别有109/39、97/47、80/54个基因在根、茎和叶中被上调/下调(图2)。3.b). 3种组织中NACs上调与下调的比例分别为2.79、2.06和1.48。分别有41个(26个上/15个下)、30个(13/17)、28个(6/22)NACs在三种组织中特异表达。两种组织共有31个(23/8)、30个(14/16)、23个(13/10)盐反应性NACs。共发现53个NACs,其中上调基因47个,下调基因6个(图2)。3.b).根、茎、叶中对盐有响应的nac数量分别为75个(66/9)、32个(26/6)、39个(25/14)4).
对151份NACs进行聚类分析,探讨盐胁迫下NACs在不同组织中的表达规律。基因在纵向上可分为3个类群,包括6个亚类群,在横向上可分为许多簇(图2)。4b).盐胁迫下,根中NACs表达量的上调高于茎和叶。叶片和茎中的基因被归为同一组,这与三个组织中的deg相同。结果表明,盐胁迫条件下,NACs和deg在叶片和茎中具有相似的表达模式。
170个非冗余nac在植物叶片中的表达分析杨树simonii×P。黑质盐胁迫下
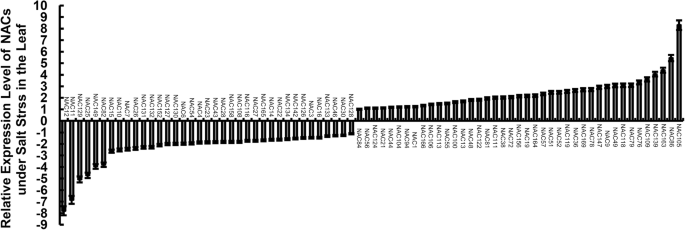
基于PlantTFDB (http://planttfdb.cbi.pku.edu.cn/index.php),有170个NACs编码不同的氨基酸序列,转录物不同。定量分析了170个非冗余nac在紫花苜蓿叶片中的相对表达量杨树simonii×P.nigraRT-qPCR。共有78个NACs响应盐刺激,包括41个上调基因和37个下调基因(图2)。5).共有86个耐盐NACs,其中上调基因50个,下调基因36个(supplementary Excel)3.),基于170个NACs的RNA-Seq数据。RNA-Seq和RT-qPCR分析结果表明,大多数NACs的表达具有一致性。
6种NACs的时空表达分析杨树simonii×P。黑质
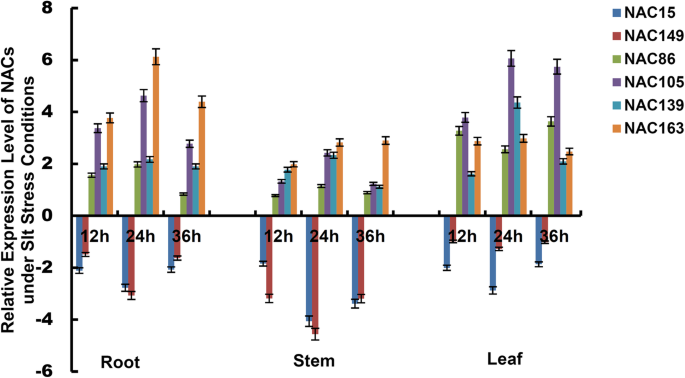
为了进一步研究NACs的时空表达模式,我们量化了4个随机上调基因(NAC86,NAC105,NAC139和NAC163)和两个下调基因(NAC15和NAC149),分别处理0、12、24、36 h。结果表明,四种上调的NACs在不同组织中的表达模式在整个时间过程中表现出相似的表达模式。表达量在12 ~ 24 h呈上升趋势,24 h达到峰值,24 ~ 36 h呈下降趋势,2个下调基因的表达量则相反。NACs上调基因在根和叶中的相对表达量普遍高于茎,而下调基因在茎中的表达变化高于根和叶(图2)。6).结果证实了少数NACs在不同的时间和空间表达模式杨树simonii×P.nigra.
植物NACs的系统发育分析杨树和拟南芥
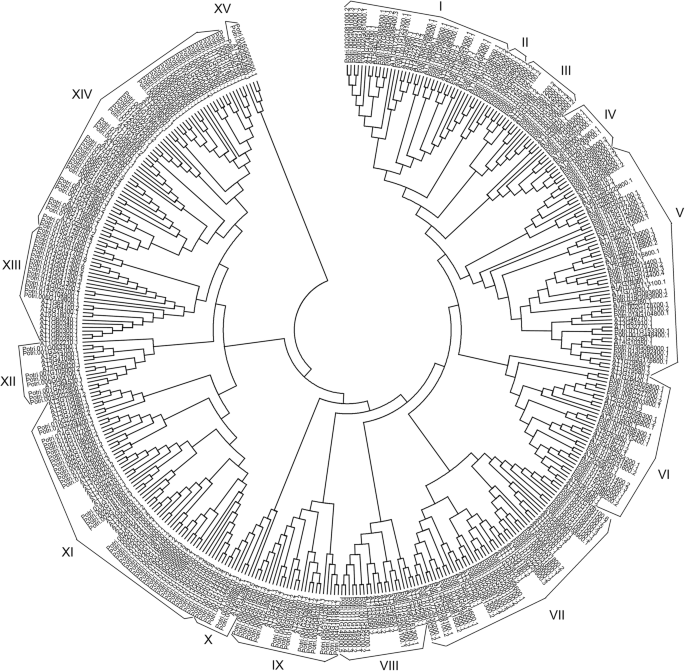
目的:鉴定NACs的同源关系杨树和拟南芥,一个包含289个NACs的系统发育树杨树trichocarpa138页拟南芥用他们推导出的蛋白质序列(图2)构建。7).杨树18岁拟南芥,最小的亚群是XV,有4个成员(图2)。7).值得注意的是,所有其他子组都包含来自两者的NACs杨树和拟南芥除亚群II只含有5个杨树NACs外,表明该亚群可能是与共同祖先分化而获得的。
在本研究中,我们共鉴定出112个NACs在叶与茎、叶与根、根与茎的比较中差异表达杨树simonii×P。黑质基于同源性分析拟南芥和杨树2,无花果。7).根据基因注释,57个NACs中有18个参与木质部形成或次生壁合成3.).另一方面,共有53个盐反应性NACs被鉴定为在三种组织中共享杨树simonii×P。黑质同时,从53个NACs中有20个与胁迫反应有关拟南芥和杨树, 20个NACs多聚为I、VII亚组(supplementary Excel3.,无花果。7).
讨论
鉴于近年来的研究成果,NACs在杨树木材形成和逆境响应方面的生物学功能得到了重视。NACs在次生细胞壁生物合成转录调控中起着总开关的作用,通过调控一系列下游TFs和木材生物合成基因杨树trichocarpa[39]。共有12个NACs来自杨树trichocarpa被鉴定为在木质部组织和韧皮部纤维中表达,过表达的基因诱导了杨树叶片异位次生壁增厚[40]。此外,许多杨树NACs被鉴定为具有应激响应性,并且这些基因的过表达有助于转基因植物的抗逆性。例如,共有76个nac被筛选为对盐敏感杨树alba×Populus腺体通过RNA-Seq和过表达NAC57转基因作物耐盐性增强拟南芥[41]。三个NAC转录因子胡杨被证明对转基因玉米的耐盐性和耐旱性有差异调控拟南芥[42]。本研究探讨了NAC家族的潜在功能,特别是在木材形成和应力响应方面的功能杨树simonii×P。黑质,为杨树NACs的功能分析提供了有益的参考。
随着NGS和生物信息学技术的进步,结合系统发育分析的RNA-Seq方法已被开发为一种有前景的技术,用于初步鉴定许多植物物种的组织特异性和应激反应性NACs。例如,在大豆基因组中检测到152个全长NACs,并新预测了38个与胁迫相关的NACsGmNACs通过转录组分析和系统发育分析鉴定[35];通过综合全基因组分析,共鉴定出136个NACsStNACs通过RNA-seq和比较系统发育分析与拟南芥[36]。在本研究中,分析了杨树根、茎和叶中289种NACs的mRNA丰度杨树simonii×P。黑质RNA-Seq。在三种组织的比较中,共筛选出112个NACs存在差异表达。在这三种组织中分别检测到148,144,134个NACs对盐有反应。更重要的是,通过对比系统发育分析,从RNA-Seq数据中鉴定出18个与木材形成相关的潜在NACs和20个参与胁迫反应的潜在NACs拟南芥.特别是,其中一些NACs已被证实在木材形成和应力响应中发挥关键作用。本研究通过不同组织中转录组筛选与系统发育分析的相关性,为NAC家族的功能鉴定提供了更为全面、高效的途径杨树.
片段重复对NAC家族的扩展起着重要的作用杨树[8]。总共有289个假定的NACs杨树trichocarpa其中119个保留了与其他基因的片段复制2]。然而,NACs在片段重复后表现出较高的表达模式分化率,大多数NACs在时间和空间上表现出特定的表达模式杨树trichocarpa[8]。在本研究中,随机选择6个NACs,包括4个上调基因和2个下调基因,在3个组织中表现出特定的时空模式杨树simonii×P.nigra在盐胁迫下。此外,在三种组织中鉴定出57种NACs差异表达杨树simonii×P。黑质并可能与植物发育过程有关拟南芥和杨树(补充表2,无花果。7).在57个NACs中,有18个基因可能参与了木材的形成(补充Excel)3.).其中有8个NACs是同源的VNI2,负向调节木质部导管的形成拟南芥[43];4个NACs是同源基因拟南芥SND2,它调节与次级细胞壁发育有关的基因的表达[44];3个NACs与XND1,负调节木材纤维素的合成拟南芥[45];3个NACs是同源的NST1/3和VND1,分别。VND1有助于子叶木质部导管的形成和NST1/3是次生壁形成的关键调控因素[46,47]。另外39种NACs与叶片衰老、根冠发育、胚胎发生、细胞增殖、茎尖分生组织形成、开花时间等其他植物发育过程有关。特别是,我们之前的研究表明,杨树的NAC基因,NAC15通过调节转基因烟草中的木质素和纤维素相关基因来促进木材的形成[48]。
通过植物功能与系统发育的相关性分析NAC家族基因的功能是一种众所周知的方法。在根、茎和叶中共鉴定出53个盐响应性NACs杨树simonii×P。黑质在书房里。结果表明,53个NACs中有20个可能参与了胁迫反应拟南芥和杨树(补充表2,无花果。7).20个nac中(Excel补充3.), 9个基因与ATAF1基因拟南芥,在非生物和生物应激反应中具有双重功能[27];4个NACs是同源的AtNTL7,对内质网抗逆性有贡献拟南芥[49];2个NACs是同源基因JUB1,提高了转基因植株的抗旱、耐热、耐盐能力拟南芥[50];2个NACs是同源基因NTL9从拟南芥,参与叶片衰老与渗透胁迫应答之间的串扰[51];NAC是同源的ANAC078,在强光胁迫下调控类黄酮生物合成[52];2北亚,NAC13和NAC105,是同源的拟南芥RD26,在非生物胁迫下发挥转录激活因子的作用[53]。特别是,我们之前的研究已经证实过表达NAC13转基因植株耐盐性显著增强杨树alba×Populus腺体.和NAC13与野生杨树相比,反义mRNA转基因品系的耐盐性显著降低[54]。我们也证明了NAC105是本研究中盐处理叶片NAC家族中上调幅度最大的基因,在转基因植物耐盐胁迫中表现出调控功能(未发表数据)。
结论
在本研究中,共鉴定出112个NACs(38.8%)在叶与茎、叶与根、根与茎的比较中存在差异表达杨树simonii×P。黑质RNA-Seq。盐胁迫下,根、茎、叶中分别有109/39、97/47、80/54个NACs上调/下调。其中,共鉴定出53个盐反应性NACs在三种组织中共享。RT-qPCR结果显示,在170个非冗余NACs中,共鉴定出78个NACs对盐敏感,其中上调41个,下调37个,与RNA-Seq结果相似。6种NACs的表达模式表明,少数NACs在3种组织中表现出特定的时空表达模式杨树simonii×P.nigra在盐胁迫下。通过转录组筛选和系统发育分析,鉴定了盐胁迫下不同组织中差异表达的NACs,共鉴定出18个与木材形成相关的潜在NACs和20个与胁迫应答相关的潜在NACs。该研究为杨树NACs的功能鉴定提供了有益的参考。
方法
植物材料
生长的小枝杨树simonii×P。黑质在室温、光照/暗循环16/8 h、相对湿度70%条件下,水培能萌发新根和新叶[38,48,55]。一个野生型无性系共42个小枝苗杨树simonii×P。黑质在东北林业大学实验林中获得的植物材料[48]。其中,21株1月龄左右长有新根新叶的小枝苗用150 mM NaCl处理,其余21株在水中培养作为对照。在对照和盐胁迫条件下,分别于0、12、24、36 h进行3个生物重复(1苗为1个生物重复)收获24株幼苗的根、茎和叶,并在液氮中冷冻,进行RT-qPCR。采用3个生物重复(3个幼苗为1个生物重复)分别采集对照和盐胁迫条件下24 h的18株幼苗的根、茎和叶,进行RNA-Seq测序。每个处理在每个时间点制备3个生物重复。
RNA-Seq基因表达分析
以上18份样品送交GENEWIZ公司,使用Illumina Hi-seq2000平台进行RNA-Seq分析。原始RNA-Seq数据按照我们之前研究中的描述进行处理[38,55]。基因的mRNA丰度被量化为FPKM(每千碱基片段数/百万reads) [48]。
根据错误发现率(FDR)≤0.05和Log进行鉴定2(折叠变化,FC)≥2。deg的分层聚类采用Gene Cluster 3.0, Java Treeview进行可视化[56]。在控制或应激条件下,至少一个组织中FPKM≥4的NACs被用于计数FC上调或下调的表达[55]。deg和nac的维恩图采用venny2.1软件(http://bioinfogp.cnb.csic.es/tools/venny/index.html).
RT-qPCR基因表达分析
170个非冗余NACs引物对和肌动蛋白基因作为内控(补充表)1)基于Phytozome12数据库(https://phytozome.jgi.doe.gov/pz/portal.html).RT-qPCR实验操作系统参照我们前期研究[38,48]。
植物NACs的系统发育分析杨树和拟南芥
NAC家族成员的信息来自杨树trichocarpa和拟南芥源自PlantTFDB (http://planttfdb.cbi.pku.edu.cn/)(补充表2)。系统发育树包括来自杨树trichocarpa138名NACs来自拟南芥由MEGA X用Neighbor-Joining法构造[57]。
数据和材料的可用性
本研究过程中产生的数据包含在这篇发表的文章及其补充信息文件中。研究中使用的原始测序数据已存入NCBI SRA,登录号为SRP267437。
缩写
- 特遣部队:
-
转录因子
- 总会在:
-
下一代测序
- 度:
-
差异表达基因
- 北亚:
-
NAC基因
- 开始:
-
差异基因
- 按:
-
抑制基因
- 足球俱乐部:
-
褶皱变化
- FPKM:
-
每千克碱基片段数每百万读取
- 罗斯福:
-
错误发现率
- 盾:
-
血管相关的NAC结构域
- SND:
-
从墙关联的NAC域
- 望远镜:
-
NAC二次壁增厚
参考文献
- 1.
方勇,尤杰,谢凯,等。水稻NAC转录因子家族组织特异性或胁迫应答基因的系统序列分析与鉴定。生物医学工程学报。2008;28(2):547 - 563。
- 2.
金杰,田飞,杨德东,等。PlantTFDB 40:成为植物转录因子和调控相互作用的中心枢纽。核酸学报,2017;45:D1040-5。
- 3.
陈建军,陈建军,李建军,等。NAC转录因子的dna结合特异性和分子功能。植物科学,2005;49(1):785 - 97。
- 4.
Puranik S, Sahu PP, Srivastava PS,等。NAC蛋白:在胁迫耐受中的调控和作用。植物科学,2012;17(3):369 - 81。
- 5.
李建军,李建军,李建军,等。NAC转录因子在植物非生物胁迫响应中的作用。生物化学学报(英文版);2012(3):387 - 398。
- 6.
毛慧,王慧,刘生,等。NAC基因中的一个转座元件与玉米幼苗的抗旱性有关。学报。2015;6:8326。
- 7.
Hernandez Y, Sanan-Mishra N。microrna的NAC转录因子在植物发育和环境胁迫反应中的介导调节。植物基因学报,2017;11:190-8。
- 8.
胡锐,齐刚,孔玉柱,等。NAC结构域转录因子基因家族的综合分析杨树trichocarpa.植物生理学报,2010;10(10):1450。
- 9.
Jensen MK, Kjaersgaard T, Petersen K,等。NAC基因:激素信号的时间特异性调节因子拟南芥.植物信号学报,2010;5(7):907。
- 10.
王洪辉,赵强,陈峰,等。次级细胞壁主开关的NAC结构域功能和转录控制。植物学报,2011;38(4):1104 - 1104。
- 11.
Mohammed N, Sharoni AM, Shoshi K. NAC转录因子在植物生物和非生物胁迫反应调控中的作用。微生物学报,2013;4:248。
- 12.
Christiansen MW, Matthewman C, Podzimskasroka D,等。大麦NAC转录因子基因过表达HvNAC005表现出发育迟缓和发育迟缓,并伴有早期衰老。[J] .中国生物医学工程学报,2016;37(2):559 - 559。
- 13.
Grant EH, Fujino T, Beers EP等。调控血管细胞分化的NAC结构域转录因子的研究拟南芥和杨树.足底。2010;232:337-52。
- 14.
Yamaguchi M, Mitsuda N, Ohtani M,等。维管相关的nac结构域7直接调控木质部导管形成的一系列基因的表达。植物学报。2011;33(1):1 - 6。
- 15.
钟锐,Demura T,叶铮。SND1NAC结构域转录因子是棉纤维二次壁合成的关键调控因子拟南芥.植物学报。2006;18(3):358 - 70。
- 16.
李建平,李建平,李建平,等。NAC转录因子NST1和NST2的拟南芥调节次生壁增厚,是花药开裂所必需的。植物学报,2005;17:2993-3006。
- 17.
寇鑫,刘超,韩磊,等。NAC转录因子在番茄果实成熟过程中乙烯生物合成、接收和信号转导等方面发挥着重要作用。中国生物医学工程学报,2016;29(1):444 - 444。
- 18.
牛峰,王波,吴峰,等。油菜(甘蓝型油菜)NAC103转录因子基因是植物中诱导活性氧积累和细胞死亡的新参与者。中国生物医学工程学报,2014;44(4):559 - 564。
- 19.
Marques DN, Dos Reis SP, De Souza CRB。植物NAC转录因子对非生物胁迫的响应。植物学报,2017;11:170-9。
- 20.
王晓明,王晓明,王晓明,等。NAC转录因子在植物逆境胁迫调控中的作用。前面的微生物。2013; 4:248。
- 21.
徐振宇,金世义,玄达日,等。的拟南芥NAC转录因子ANAC096与bzip型转录因子共同参与脱水和渗透胁迫反应。植物学报,2013,25(11):4708-24。
- 22.
毛翔,张宏,钱翔,等。TaNAC2一种nac型小麦转录因子,增强了小麦的多种非生物胁迫耐受性拟南芥.实验学报,2012;63(8):2933-46。
- 23.
朱明,陈刚,张军,等。非生物应激应答型nac型转录因子slnac4调控番茄耐盐、耐旱及胁迫相关基因(茄属植物lycopersicum).植物学报,2014;33:1851-63。
- 24.
卢普乐,陈南志,安瑞,等。一种新的干旱诱导基因,ATAF1该基因编码一种NAC家族蛋白,该蛋白负向调节应激反应基因的表达拟南芥.植物化学学报,2009;32(2):559 - 561。
- 25.
黄磊,洪毅,张宏,等。水稻NAC转录因子ONAC095在抗旱和抗冷胁迫中起相反的作用。植物学报,2016;16(1):203。
- 26.
陈国强,陈国强,陈国强,等。nac型转录因子的功能分析OsNAC6参与水稻非生物和生物胁迫响应基因的表达。植物学报,2007;31(4):617 - 618。
- 27.
吴勇,邓志,赖杰,等。的双重函数拟南芥ATAF1在非生物和生物应激反应。生物医学进展,2009;19(11):1279。
- 28.
郝玉军,魏伟,宋秋霞,等。大豆NAC转录因子促进转基因植株的非生物胁迫抗性和侧根形成。植物科学学报,2011;38(1):1 - 6。
- 29.
石海英,胡德华,阮璐,等。拟南芥AtNAP作为负调节通过抑制AREB1在盐胁迫反应中。足底。2017;245(2):329 - 41。
- 30.
刘敏,马忠,孙伟,等。苦荞NAC转录因子家族的全基因组分析(Fagopyrum tataricum).生物医学工程学报,2019;20:113。
- 31.
Kadier Y,祖勇,戴强,等。高粱NAC家族基因的全基因组鉴定、分类及表达分析[j]。高粱二色的(l)Moench]。植物学报,2017;33(3):391 - 391。
- 32.
Nuruzzaman M, Manimekalai R, Sharoni AM,等。水稻NAC转录因子家族全基因组分析。基因。2010;456:30-44。
- 33.
Swati P, Pankaj SP, Nath MS,等。谷子NAC转录因子家族的全基因组调查、基因组构成及表达谱分析Setaria italical .)。科学通报,2013;8(5):e64594。
- 34.
郑鹏杰,郑辉,崔永远,等。水稻抗旱4个nac结构域转录因子直接靶基因全基因组分析。BMC Genomics. 2018;19:40。
- 35.
田磊,李宁,魏靖子,等。大豆发育和脱水胁迫下植物特异性NAC转录因子家族的全基因组调查及表达分析生物医学进展,2011;18(4):263-76。
- 36.
Kumar SA, Vishal S, Kumar PA,等。马铃薯NAC转录因子家族的全基因组组织及表达谱分析(茄属植物tuberosuml .)。中国生物医学工程学报,2013;4(4):391 - 391。
- 37.
杨森S,道格拉斯CJ。杨树植物生物学的模型系统。植物学报,2007,35(1):444 - 444。
- 38.
姚文军,周炳荣,张晓明,等。多种非生物胁迫下转录因子基因的转录组分析杨树simonii×P黑质.基因。2019;707:189 - 97。
- 39.
钟荣强,李超,叶铮。杨树木材相关NAC结构域转录因子的功能表征。植物生理学报。2010;32(2):1044 - 1055。
- 40.
李建军,李建军,李建军,等。一个参与杨树木材形成调控的NAC结构域蛋白家族。植物科学学报,2011;37(1):491 - 491。
- 41.
姚文杰,赵凯,程志华,等。盐胁迫下杨树转录组分析及转录因子的过表达NAC57基因赋予转基因作物耐盐性拟南芥.植物科学,2018;9:1121。
- 42.
卢鑫,张鑫,段宏,等。三个应激反应性NAC转录因子来自胡杨转基因植物对盐和干旱耐受性的差异调控。植物物理学报,2018;32(1):73-97。
- 43.
山口M,大谷M,三田N,等。VND-INTERACTING2NAC结构域转录因子负向调控木质部导管的形成拟南芥.植物学报,2010;22(4):1249-63。
- 44.
胡赛SG, Mizrachi E, Spokevicius AV等。SND2是一种NAC转录因子基因,可调控参与细胞次级细胞壁发育的基因拟南芥纤维和增加纤维细胞面积的桉树。植物学报,2011;11(1):173。
- 45.
赵超,赵文宇,葛伟东,等。XND1中NAC域族的成员拟南芥负调控木质部木质纤维素合成和程序性细胞死亡。植物学报,2008;33(3):444 - 444。
- 46.
李建平,李建平,李建平,等。NAC转录因子,NST1和NST3,是木本组织次生壁形成的关键调控因子拟南芥.植物学报。2007;19(1):270-80。
- 47.
Tan TT, Endo H, Sano R,等。转录因子VND1-VND3有助于子叶木质部导管的形成。植物生理学报,2018;36(1):773-89。
- 48.
姚文杰,张大伟,周连荣,等。杨树过度表达NAC15基因促进转基因烟草成材。植物学报,2020;20(1):12。
- 49.
迟永华,Melencion SMB, Alinapon CV,等。膜系结NAC转录因子,AtNTL7,有助于内质网抗逆性拟南芥.中国生物医学工程学报,2017;33(4):641 - 647。
- 50.
Ebrahimian-Motlagh S, Ribone PA, Thirumalaikumar VP等。JUNGBRUNNEN1赋予HD-zip I转录因子下游的耐旱性AtHB13.植物科学,2017;8:2118。
- 51.
尹洪,金绍文,金世文,等。叶片衰老的调控NTL9-药物渗透胁迫信号拟南芥.生物医学工程学报,2008;25(5):438 - 445。
- 52.
陈志强,陈志强,陈志强,等。拟南芥NAC转录因子;ANAC078在强光下调节类黄酮的生物合成。植物生理学报,2009;50(12):2210-22。
- 53.
Fujita M, Fujita Y, Maruyama K,等。一种脱水诱导的NAC蛋白RD26,参与了一种新的aba依赖的应激信号通路。植物学报,2004;39(6):863 - 876。
- 54.
张欣,程志,赵凯,等。杨树的功能特性NAC13耐盐基因。植物科学,2019;28(1):1 - 8。
- 55.
姚文杰,张晓明,赵凯,等。多种非生物胁迫下ERF基因家族的表达模式胡杨×黑胡杨.植物科学,2017;8:181。
- 56.
胡华华,黄慧聪。生物信息学:微阵列数据聚类和功能分类。方法:中华生物医学杂志。2007;38:405 - 16。
- 57.
库马尔S, Stecher G, Li M M,等。MEGA X:跨计算平台的分子进化遗传学分析。生物医学进展,2018;35(6):1547-9。
致谢
不适用。
资金
中央高校基本科研业务费专项资金(2572018CL03)、江苏省自然科学基金(BK20190748)和111项目(B16010)资助。资助机构未参与研究设计、数据收集、分析或稿件准备。
作者信息
从属关系
贡献
WY设计研究,进行实验,分析数据,撰写论文。CL分析数据并提供新的分析工具。SL和JW修改了手稿。BZ和TJ构思了这项研究。所有作者都阅读并认可了稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:表S1。
肌动蛋白基因引物对列表及170个非冗余NACs杨树trichocarpa。(docx26kb)
附加文件2:表S2。
NACs的同源信息拟南芥和杨树simonii×P.nigra。(docx27kb)
附加文件3:Excel 1
在根、茎和叶中都有DEGs杨树simonii×P.nigra。(XLSX 2947kb)
附加文件4:Excel 2
根、茎、叶中对盐敏感的DEGs杨树simonii×P.nigra。(XLSX 1212kb)
附加文件5:Excel 3
相关NACs列表,包括所有289个NAC成员,在3个组织中至少有一个FPKM≥4的组织中表达112个NACs,在盐处理中至少有一个FPKM≥4的组织中表达151个NACs, 170个非冗余NACs中有86个盐反应性NACs, 18个与木材形成相关的潜在NACs, 20个参与胁迫反应的潜在NACs。
附加文件6:Excel 4
三种组织或各组织在盐处理下FC > 2的NACs差异表达列表。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
姚伟,李,C,林,S。et al。盐响应性NACs和木材相关NACs的转录组分析胡杨×黑胡杨.BMC Plant Biol20.317(2020)。https://doi.org/10.1186/s12870-020-02507-z
收到了:
接受:
发表:
关键字
- 杨树simonii×P。黑质
- NAC转录因子
- 盐胁迫
- 转录组分析
- 系统发生的分析