- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
黄麻赤霉素代谢基因的全基因组鉴定、鉴定及表达谱分析gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba306gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
赤霉素是调节植物生长发育最重要的植物激素之一。黄麻(gydF4y2BaCorchorusgydF4y2BaSp .)是第二大韧皮纤维来源。本研究结果表明,外源赤霉素对黄麻高度及相关性状具有正向调节作用,增加内源赤霉素产量有利于黄麻品种性状的改善。然而,参与黄麻GA生物合成的基因还没有得到精确的分析。gydF4y2Ba
结果gydF4y2Ba
全基因组分析确定了22个黄麻GA生物合成途径相关的候选基因。其中,有四个基因-gydF4y2Ba科钦,CoCPS CoKOgydF4y2Ba而且gydF4y2BaCoKAOgydF4y2Ba在早期阶段工作。七个gydF4y2BaCoGA20oxgydF4y2Ba年代,三个gydF4y2BaCoGA3oxgydF4y2Ba年代,八gydF4y2BaGA2oxgydF4y2BaS基因在后面的步骤中起作用。这些基因通过系统发育、基序、基因结构和启动子区域分析以及染色体定位进行了特征分析。空间基因表达分析显示11gydF4y2BaGA氧化酶类gydF4y2Ba其中4个表达量与黄麻GA产生有积极关系,并被标记为关键调控因子。所有的生物合成基因在早期和晚期均表现出组织特异性。gydF4y2BaGA氧化酶gydF4y2Ba基因受反馈调控,而早期步骤基因不受反馈调控。gydF4y2Ba
结论gydF4y2Ba
丰富黄麻GA生物合成途径和基因的知识,将有助于通过改变关键调控基因的表达水平来增加黄麻内源GA的产生。gydF4y2BaCoGA20ox7、CoGA3ox2、CoGA2ox3和CoGA2ox5gydF4y2Ba可能是产生GA最重要的基因。gydF4y2Ba
背景gydF4y2Ba
赤霉素(Gibberellin, GA)由黑泽博士(Dr. E. Kurosawa)于1926年发现,是植物生长发育的关键激素之一。这种经典的植物激素参与不同的生理过程,如种子发芽[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,梢伸长[gydF4y2Ba3.gydF4y2Ba,叶展开[gydF4y2Ba4gydF4y2Ba,花的发育[gydF4y2Ba5gydF4y2Ba),和水果gydF4y2Ba衰老gydF4y2Ba[gydF4y2Ba6gydF4y2Ba].它最终诱导细胞伸长和分裂;此外,它还能积累淀粉[gydF4y2Ba7gydF4y2Ba从而有能力影响整个植物的生长。GAs是二萜激素的一个大家族,在植物、真菌和细菌中有130个成员[gydF4y2Ba8gydF4y2Ba].它们都有19或20个碳原子,分别被分类为C19-GAs和C20-GAs。虽然植物中含有数百种GAs,但GA等只有少数几种gydF4y2Ba1gydF4y2Ba和遗传算法gydF4y2Ba4gydF4y2Ba生物活性(gydF4y2Ba8gydF4y2Ba].gydF4y2Ba
从香叶酰香叶酰二磷酸(GGDP,植物中萜烯的常见前体)中产生活性GAs的GA生物合成途径在模型植物中已被明确定义,大多数编码GA生物合成酶的基因已被识别[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].该途径明显分为早期和后期两个步骤[gydF4y2Ba11gydF4y2Ba].早期的步骤包括将GGDP转换为GAgydF4y2Ba12gydF4y2Ba而后面的步骤包括遗传算法的转换gydF4y2Ba12gydF4y2Ba气体。第一步,将GGDP转换为gydF4y2BaentgydF4y2Ba-kaurene由两种酶由萜烯合成酶(TPSs)家族命名gydF4y2BaentgydF4y2Ba-共聚二磷酸合酶(CPS)和gydF4y2BaentgydF4y2Ba-kaurene合成酶(KS)。然后gydF4y2BaentgydF4y2Ba-kaurene被氧化成GAgydF4y2Ba12gydF4y2Ba由另外两种酶的活性命名gydF4y2BaentgydF4y2Ba-kaureneoxidase (KO)和gydF4y2BaentgydF4y2Ba-考雷诺酸氧化酶(KAO),来自细胞色素P450单加氧酶(P450s)。在后续步骤中,GA20氧化酶和GA3氧化酶催化逐级氧化生成各种GA中间体和GA等具有生物活性的GAsgydF4y2Ba1gydF4y2Ba乔治亚州gydF4y2Ba4gydF4y2Ba而GA2氧化酶则将它们转化为不活跃的气体,如GAgydF4y2Ba8gydF4y2Ba乔治亚州gydF4y2Ba34gydF4y2Ba分别为(gydF4y2Ba12gydF4y2Ba].gydF4y2Ba
所有早期步骤基因都由单个或少数基因编码[gydF4y2Ba13gydF4y2Ba].虽然有些植物有多个同源基因,但只有一个基因参与GA代谢。例如,水稻有3个OsCPS副本和11个oscs样基因家族副本。但是只有OsCPS1和OsKS1参与gydF4y2BaentgydF4y2Ba-kaurene生物合成(gydF4y2Ba14gydF4y2Ba].相反,GA氧化酶是由小基因家族编码的[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,在不同器官中表达模式不同[gydF4y2Ba16gydF4y2Ba,并具有不同的功能作用。作为一个例子,gydF4y2BaMaGA3ox4gydF4y2Ba在香蕉幼果中表达量较高,而在成熟果实中表达量较低。的表达水平gydF4y2BaMaGA20ox3gydF4y2Ba叶、苞片和幼果含量高,但根、假茎和成熟果实含量低[gydF4y2Ba17gydF4y2Ba].此外,一些gydF4y2BaGA氧化酶类gydF4y2Ba通过反馈调节维持植物内GA的内稳态[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba]和前馈调节[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].然而,早期的步骤基因,例如。gydF4y2BaCPS, KS KO,gydF4y2Ba而且gydF4y2Ba花王gydF4y2Ba不受反馈控制[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba23gydF4y2Ba在植物。gydF4y2Ba
在内源生物活性GA水平的调控中,后期步长基因比早期步长基因更重要[gydF4y2Ba11gydF4y2Ba].例如-功能的丧失gydF4y2BaGA20氧化酶gydF4y2Ba而且gydF4y2Ba赤霉素氧化酶gydF4y2Ba导致的矮化表型,如绿色革命sd-1 [gydF4y2Ba10gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba24gydF4y2Ba而在过表达的转基因植株中未发现表型改变gydF4y2BaAtCPS, atk公司gydF4y2Ba[gydF4y2Ba25gydF4y2Ba].另一方面,异位表达gydF4y2BaGA20oxgydF4y2Ba导致了更高的植物和更大的器官gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba土豆(gydF4y2Ba28gydF4y2Ba),烟草(gydF4y2Ba29gydF4y2Ba]和玉米通过增加内源GA水平。同样,在转基因植株过表达中也出现了叶片深绿色的矮化表型gydF4y2BaJcGA2ox6gydF4y2Ba[gydF4y2Ba30.gydF4y2Ba].gydF4y2Ba
黄麻,被称为黄金纤维,是一种最长和最便宜的天然纤维,覆盖gydF4y2Ba∼gydF4y2Ba全球80%的韧皮纤维产量[gydF4y2Ba31gydF4y2Ba].它以耐用性和多功能性而闻名。最重要的是,它是可降解的,可再生的和环保的。gydF4y2Ba32gydF4y2Ba].因此,黄麻和黄麻产品在全球越来越受欢迎,预计到2021年将增长200% [gydF4y2Ba33gydF4y2Ba这需要更高的收益。虽然两个gydF4y2BaCorchorus olitoriusgydF4y2Ba而且gydF4y2BaCorchorus capsularisgydF4y2Ba是商业栽培,纤维的主要来源是什么gydF4y2BaCorchorus olitoriusgydF4y2Ba因为这个物种生长在世界上大约80%的黄麻生长地区。已有研究表明,外源GA喷施黄麻后,黄麻纤维细胞拉长,茎和节间变长[gydF4y2Ba34gydF4y2Ba].此外,GA诱导细胞壁增厚和纤维细胞直径增大[gydF4y2Ba35gydF4y2Ba].此外,我们的实验表明,GA喷雾增加了黄麻的节间长度,最终产生了高于对照的植株(未发表数据)。因此,GA在黄麻生长发育中起着至关重要的作用。gydF4y2Ba
GA代谢途径在各种植物中都有解释,如gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba),南瓜gydF4y2Ba36gydF4y2Ba)、大米(gydF4y2Ba10gydF4y2Ba],豌豆[gydF4y2Ba37gydF4y2Ba)、玉米(gydF4y2Ba38gydF4y2Ba],gydF4y2Ba丹参gydF4y2Ba[gydF4y2Ba39gydF4y2Ba和香蕉[gydF4y2Ba17gydF4y2Ba].此外,这一知识已被广泛用于开发具有改变GA水平和所需特性的植物。例如,沉默gydF4y2BaGA2氧化酶gydF4y2Ba导致转基因烟草的高度和木质部细胞数量增加[gydF4y2Ba40gydF4y2Ba].尽管科学家已经公布了两种黄麻的基因组gydF4y2Ba41gydF4y2Ba],黄麻GA代谢基因尚未鉴定。本研究探讨了黄麻GA生物合成基因之间的系统发育关系及其保存区域、基因结构、染色体位置和复制事件。此外,研究了外源赤霉素对黄麻生长的影响,并以赤霉素抑制剂多效唑(PAC)作为对照。此外,我们还检测了它们在黄麻不同组织中的表达,并观察其组织特异性,以确定可能触发GA生物合成的基因。这将为阐明黄麻遗传调控机制和培育具有较好农艺性状的黄麻品种铺平道路。gydF4y2Ba
结果gydF4y2Ba
黄麻赤霉素代谢途径基因的鉴定gydF4y2Ba
为了分离出7类GA代谢基因-gydF4y2BaCPS, KS, KO, KAO, GA20氧化酶,GA3氧化酶,gydF4y2Ba而且gydF4y2BaGA2氧化酶gydF4y2Ba在gydF4y2Bac . olitoriusgydF4y2Ba我们检索了各自的序列gydF4y2Ba拟南芥gydF4y2Ba香蕉和米饭(附加文件gydF4y2Ba1gydF4y2Ba:表S1),并使用这些序列作为对黄麻基因组序列的BLASTP查询。我们发现了22个候选基因,包括一个gydF4y2BaCPSgydF4y2Ba基因(gydF4y2BaCoCPSgydF4y2Ba),一个gydF4y2BaKSgydF4y2Ba基因gydF4y2Ba(科钦)gydF4y2Ba,一个gydF4y2BaKOgydF4y2Ba基因(gydF4y2BaCoKOgydF4y2Ba),一个gydF4y2Ba花王gydF4y2Ba基因(gydF4y2BaCoKAOgydF4y2Ba), 7gydF4y2BaGA20oxgydF4y2Ba基因(gydF4y2BaCoGA20ox1-7gydF4y2Ba),三个gydF4y2BaGA3oxgydF4y2Ba基因(gydF4y2BaCoGA3ox1-3gydF4y2Ba)和八个gydF4y2BaGA2oxgydF4y2Ba基因(gydF4y2BaCoGA2ox1-8gydF4y2Ba).gydF4y2Ba
早期步骤基因gydF4y2Ba
黄麻的基因组中有所有四种酶参与早期步骤的单一基因。通过对Pfam和SMART数据库的检索,我们发现cops和CoKS酶都含有萜烯合酶n端结构域和萜烯合酶家族金属结合结构域。它们分别位于分子量为91.81 kDa和84.15 kDa的叶绿体中。这两个基因的内含子数量相对较高,分别为14和11。gydF4y2Ba1gydF4y2Ba).结果几乎与gydF4y2Ba拟南芥gydF4y2Ba两者都有16个内含子gydF4y2BaAtCPSgydF4y2Ba而且gydF4y2Baatk公司gydF4y2Ba.CoKO和CoKAO是细胞色素P450的成员,具有P450结构域。CoKO和CoKAO分别位于叶绿体和内质网。CoKO的分子量为56.24 kDa, CoKAO的分子量为58.19 kDa。这两个gydF4y2BaCoKOgydF4y2Ba而且gydF4y2BaCoKAOgydF4y2Ba有8个外显子和7个内含子。gydF4y2Ba1gydF4y2Ba).4个基因的预测等电点(pI)在5.55 ~ 9.15之间。关于这些基因的详细信息见表gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
之后的步骤基因gydF4y2Ba
GA20ox、GA3ox和GA2ox三种酶参与了GA生物合成途径的后期步骤。这三组酶都属于铁依赖性氧化还原酶家族,包含两个保守结构域[2g - feii_oxy (PF00847)和DIOX_N (PF14226)]。除CoGA20ox5缺失2OG-FeII_Oxy结构域外,其余序列均存在上述结构域。它们的Mw范围为35.06 ~ 44.56 kDa,平均值为46.00 kDagydF4y2Ba1gydF4y2Ba).CoGA2ox6等电点最低(5.03),CoGA2ox3等电点最高(8.80)。所有的酶都位于细胞质中。gydF4y2Ba
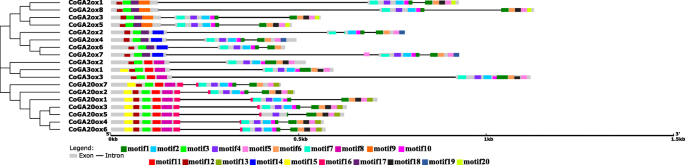
在基因结构分析中,我们发现gydF4y2BaGA20氧化酶类gydF4y2Ba黄麻的基因具有两个内含子和三个外显子gydF4y2BaGA3oxgydF4y2Ba亚族包含一个内含子和两个外显子。C-19 GA2ox和C-20 GA2ox亚群的基因外显子数均在3-4之间。部分成员来自GAox家族gydF4y2BaCoGA3ox3, CoGA2ox1和CoGA2ox8gydF4y2Ba内含子相对较长(图。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
黄麻赤霉素代谢基因的系统发育和保守基序分析gydF4y2Ba
早期GA生物合成基因gydF4y2Ba
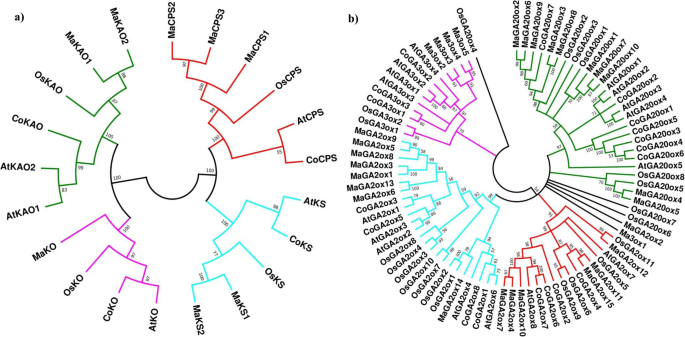
系统发育分析显示,两种不同的蛋白质家族,二萜环化酶(CPS和KS)和Cyt P450单加氧酶(KO, KAO)位于两个不同的分支(图。gydF4y2Ba3.gydF4y2BaA)和四种不同的酶保留在四个不同的分支中。此外,还证明了早期步进酶可以被分离成单子代和双子代。gydF4y2Ba
GA代谢基因的系统发育位置。系统发育树(gydF4y2Ba一个gydF4y2Ba)为早期GA生物合成基因及(gydF4y2BabgydF4y2Ba)为GA氧化酶基因,用MEGA 7.0软件进行测序gydF4y2Ba栽培稻gydF4y2Ba(操作系统),gydF4y2Ba拟南芥gydF4y2Ba(在),gydF4y2Ba穆萨acuminatagydF4y2Ba(Ma)和gydF4y2BaCorchorus olitoriusgydF4y2Ba(有限公司)。蛋白质序列的接入号已在附加文件中提及gydF4y2Ba1gydF4y2BaS1:表gydF4y2Ba
这些蛋白序列的基序分布模式显示,cops和CoKS都含有几乎相似的基序,如1、2、3、4、6、15和16(图4)。gydF4y2Ba1gydF4y2Ba),因为它们来自同一蛋白质家族。因此,我们推测这些基序是二萜环化酶蛋白家族的特异性结构。然而,主题不。13, 17和19是区分cops和CoKS的基序,其中cops包含基序号。13, 17和CoKS拥有motif no。19.另一方面,CoKO和CoKAO蛋白只有一个共同的基序,即基序no。7.这可能是Cyt P450单加氧酶蛋白家族的保守基序。CoKO蛋白的标志性基序是基序no。18和CoKAO这些是母题号。 8, 10, 11, 12 and 14. Motif sequences are given in Additional file1gydF4y2BaS2:表。gydF4y2Ba
GA氧化酶类gydF4y2Ba
用来自植物的55个GA氧化酶(GA20ox, GA3ox, GA2ox)序列构建了邻接系统发育树gydF4y2Ba拟南芥gydF4y2Ba大米,香蕉和黄麻。系统发育树被分为4个不同的亚组——GA20氧化酶,GA3氧化酶,C-19 GA2氧化酶和C-20 GA2氧化酶(图2)。gydF4y2Ba3.gydF4y2Bab). GA20ox和GA2ox的群比GA3ox大。例如,gydF4y2Ba拟南芥gydF4y2Ba水稻、香蕉和黄麻分别有5、8、10和7个GA20ox拷贝,而它们分别有4、2、4和3个GA3ox拷贝。gydF4y2Ba
GA氧化酶属于含铁的异丙青霉素N合成酶家族gydF4y2Ba2 +gydF4y2Ba-结合基序,一个靠近氨基末端的HXD二联体和一个靠近羧基末端的组氨酸[gydF4y2Ba42gydF4y2Ba].多序列比对和三维结构显示黄麻GA20氧化酶中这些氨基酸的位置分别为His-249、Asp-251和His-305。gydF4y2Ba4gydF4y2Ba一个;额外的文件gydF4y2Ba2gydF4y2BaGA3氧化酶分别为His-223、Asp-225和His-280(图1)。gydF4y2Ba4gydF4y2Bab,额外的文件gydF4y2Ba2gydF4y2Ba:图S2)。作为异openicillin N合成酶的成员,GA2氧化酶也携带相同的基序。C-19 GA2ox中两个His和一个Asp残基的位置分别为200、257和202。gydF4y2Ba4gydF4y2Bac,额外的文件gydF4y2Ba2gydF4y2Ba:图S3)。同样,C-20 GA2ox在214和217位含有HXD二联体,在268位含有His二联体。gydF4y2Ba4gydF4y2Bad,额外的文件gydF4y2Ba2gydF4y2Ba:图S4)。此外,GA20氧化酶具有两个结合位点,位于232-240位的NYYPXCXXP序列和位于151-156位的LPWKET序列。然而,黄麻中只有CoGA20ox2和CoGA20ox7这两个序列具有精确的结合位点LPWKET,而其余5个序列则略有不同,例如CoGA20ox1、CoGA20ox4和CoGA20ox6的第一个位置分别是M、F和F,而不是LgydF4y2Ba2gydF4y2Ba:图S1)。gydF4y2Ba
黄麻GA氧化酶具有一些共同的基序,如基序no。1、3、6、12gydF4y2Ba2gydF4y2Ba).主题没有。除CoGA2ox2外,4也很常见。同样,主题不。除CoGA20ox5外,其余17个序列均含有2、7和10。GA20氧化酶的标记基序为基序no。13和16,而GA3氧化酶中未发现这种特殊基序。因为GA20ox和GA3ox都有基序号。8和11,它们可能是这些亚科的功能主导母题。C-19和C-20 GA2ox蛋白的唯一基序为基序no。 9 and 14 respectively. Both C-19 GA2ox and C-20 GA2ox contained motif no. 17, which was absent in GA20 oxidases and GA3 oxidases. So, this exclusive motif may account for the function difference of GA2ox gene family. Motif sequences are given in Additional file1gydF4y2Ba:表S3。虽然基序分布模式在不同亚群中有所不同,但在不同物种的亚群内却非常相似,这说明来自同一亚科的成员具有相似的基因结构。gydF4y2Ba
找到gydF4y2Ba独联体gydF4y2Ba-作用元件在GA生物合成基因的启动子gydF4y2Ba
独联体gydF4y2Ba-作用元件通过促进转录因子的结合在基因转录中起着至关重要的作用。为了阐明GA代谢基因的调控机制,我们搜索了每个转录起始位点上游1000 bp的序列gydF4y2Ba独联体gydF4y2Ba元素。可用gydF4y2Ba独联体gydF4y2Ba-调控因子分为四类——(a)植物激素调控,(b)生物和非生物胁迫,(c)植物生长和发育,(d)启动子功能gydF4y2Ba2gydF4y2Ba:图S5)。应激(生物和非生物)反应gydF4y2Ba独联体gydF4y2Ba-基元在黄麻GA生物合成基因中最多,光响应基元中(ATC基元、G-box、GT-基元、TCT-基元、3-AF1结合位点、Box 4、tcc -基元、atct -基元、AE-box、CAG基元、MRE、I-box、gata -基元、Box ii、cap -基元、GA-基元、lamp -基元、chs-CMA2a)最高。在黄麻GA代谢基因中,参与激素调控的基序数量仅次于胁迫响应基序的第二大群。此外,它们还含有与不同植物激素相关的基序,如水杨酸(TCA-element, SARE)、生长素(TGA element)、脱落酸(ABRE)、赤霉素(TATC-box, p-box, gar -motif)。有趣的是,在18个GA氧化酶中,只有7个基因-gydF4y2BaCoGA20ox2, CoGA20ox7, CoGA3ox2, CoGA2ox3, CoGA2ox5, CoGA2ox6gydF4y2Ba而且gydF4y2BaCoGA2ox7gydF4y2Ba包含主题p-box(附加文件gydF4y2Ba2gydF4y2Ba:图S5)。黄麻GA生物合成基因的数量最少gydF4y2Ba独联体gydF4y2Ba-植物生长发育的作用元件(CAT-box, O2-site, GCN4_motif)。可用gydF4y2Ba独联体gydF4y2Ba- GA启动子区的调控元件及其描述见附加文件gydF4y2Ba1gydF4y2Ba:表S4。gydF4y2Ba
基因本体注释(GO)gydF4y2Ba
GO分析表明,黄麻GA生物合成基因大部分参与氧化还原过程。它们还参与了花的发育和单维细胞的生长。gydF4y2Ba5gydF4y2Baa).这些基因还具有广泛的分子功能,如赤霉素20-氧化酶、赤霉素3- β -双加氧酶、C-19赤霉素2- β -双加氧酶、C-20赤霉素2- β -双加氧酶活性。此外,它们还具有镁、铁和血红素结合能力。gydF4y2Ba5gydF4y2Bab)。gydF4y2Ba
染色体定位与复制分析gydF4y2Ba
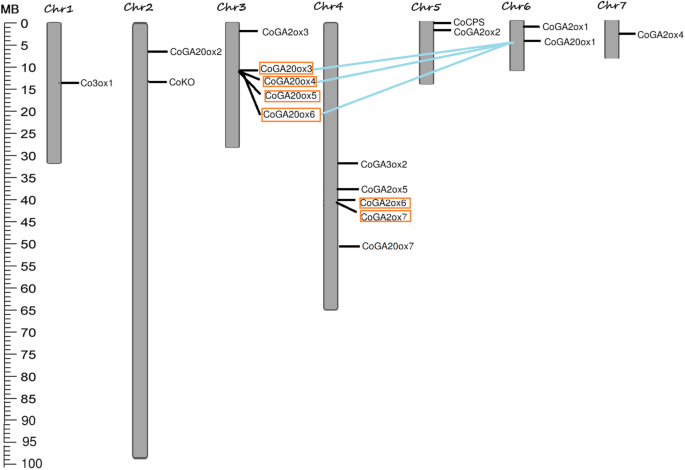
为了了解GA生物合成基因在不同染色体上的分布规律,我们在黄麻的7条染色体上进行了基因定位,发现大部分基因位于染色体3和染色体4上(图4)。gydF4y2Ba6gydF4y2Ba).四个基因包括gydF4y2Ba科钦,CoKAO CoGA3ox3gydF4y2Ba,gydF4y2BaCoGA2ox8gydF4y2Ba没有被映射到黄麻的任何染色体上,因为黄麻的草稿组装只固定了总基因组的约60%。gydF4y2Ba
复制是生物进化过程中的一种重要机制。在黄麻GA生物合成基因中发现了2个串联复制基因簇和3个片段复制基因对(图4)。gydF4y2Ba6gydF4y2Ba).计算Ka/Ks比值,探讨复制后的基因发散趋势。黄麻GA生物合成基因90%经过了纯化选择,这意味着在复制事件发生之前可能会发生功能分化(表2)gydF4y2Ba2gydF4y2Ba).使用同义替换率计算重复事件发生的时间。结果表明,片段复制的分化时间为8.85 ~ 1025万年前(MYA),串联复制的分化时间为1.32 ~ 9.16 MYA(表2)gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
空间表达分析gydF4y2Ba
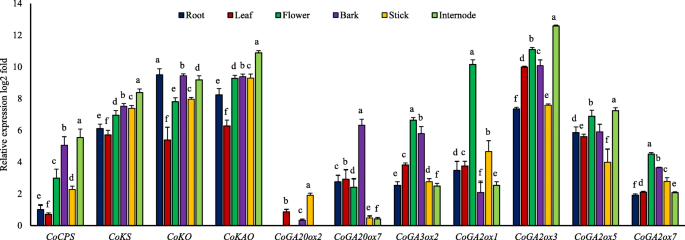
在确定黄麻GA生物合成途径的不同基因后,我们检测了它们在根、叶、花、枝、树皮和顶节间的表达,以了解它们是否具有器官特异性表达模式。总的来说,早期步骤基因在所有被分析的器官中普遍表达。gydF4y2BaCoKAOgydF4y2Ba与其他三个基因相比有更高的表达。gydF4y2BaCoCPS,科钦gydF4y2Ba而且gydF4y2BaCoKAOgydF4y2Ba表达模式相似,在节间顶部表达量最高,在叶片中表达量最低。的表达gydF4y2BaCoKOgydF4y2Ba基因在根、树皮和节间中表达量较高,而在叶片中表达量较低(图5)。gydF4y2Ba7gydF4y2Ba).值得注意的是,大多数基因(gydF4y2BaCoCPS、CoKO CoKAOgydF4y2Ba)与其他组织相比,在上节间表达量最高。gydF4y2Ba
有趣的是,在我们考虑的样本中,大多数后步基因(11个基因)是不活跃的。只有七个人gydF4y2BaCoGA20ox2, CoGA20ox7, CoGA3ox2, CoGA2ox1, CoGA2ox3, CoGA2ox5gydF4y2Ba,gydF4y2BaCoGA2ox7gydF4y2Ba在不同组织中有表达。为了证明我们的结果,我们利用Islam等人发表的RNA-seq数据研究了GA生物合成基因的表达。[gydF4y2Ba41gydF4y2Ba].这与我们的qRT-PCR数据非常相似(附加文件gydF4y2Ba2gydF4y2Ba:图S6)。此外,我们还使用qRT-PCR引物对这些未表达基因的cDNA进行了PCR分析gydF4y2Ba1gydF4y2Ba:表S5),凝胶中未观察到条带(数据未显示)。gydF4y2Ba
GA20ox家庭,gydF4y2BaCoGA20ox7gydF4y2Ba在所有被检查的组织中广泛表达gydF4y2BaCoGA20ox2gydF4y2Ba显示组织特异性,仅在叶、树皮和木棍中表达。的表达gydF4y2BaCoGA20ox7gydF4y2Ba以树皮为主,其次为叶和根。总的来说,gydF4y2BaCoGA20ox2gydF4y2Ba表达低于gydF4y2BaCoGA20ox7gydF4y2Ba在几乎所有的测试部分。gydF4y2BaCoGA3ox2gydF4y2BaGA3氧化酶家族中唯一活性基因,花中表达量最高,节间顶部表达量最低(图5)。gydF4y2Ba7gydF4y2Ba).在四种GA2氧化酶中,gydF4y2BaCoGA2ox3gydF4y2Ba表达量最高,且多在节间顶部表达。总的来说,gydF4y2BaCoGA2ox5gydF4y2Ba在节间和花中表达量较高,枝中表达量较低。虽然表达水平gydF4y2BaCoGA2ox1gydF4y2Ba花的数量很高,它实际上是一个每周表达的基因。的gydF4y2BaCoGA2ox7gydF4y2Ba与其他组织相比,在所有被考虑的组织中表达最少gydF4y2BaGA2氧化酶类gydF4y2Ba(无花果。gydF4y2Ba7gydF4y2Ba).根据表达模式,我们可以假设gydF4y2BaCoGA20ox7, CoGA3ox2gydF4y2Ba,gydF4y2BaCoGA2ox3gydF4y2Ba而且gydF4y2BaCoGA2ox5gydF4y2Ba是黄麻和gydF4y2BaCoGA20ox2、CoGA2ox1 CoGA2ox7gydF4y2Ba都是最不重要的。gydF4y2Ba
外源处理的形态效应gydF4y2Ba
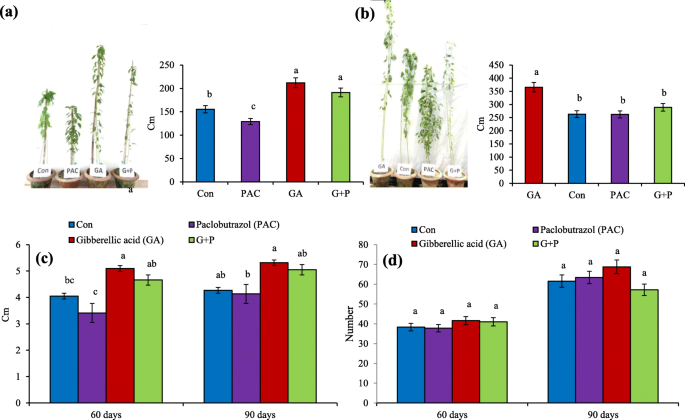
采用外源GA、PAC和G + P溶液对黄麻植株进行处理,研究GA对黄麻植株的影响。结果表明,GA处理显著提高了植株株高(图5)。gydF4y2Ba8gydF4y2BaA和b)与对照组相比。另一方面,在PAC处理的情况下发现了相反的情况。G + P处理植株高度中等,低于GA处理,高于PAC处理。在节间长度和节数的变化中也发现了类似的趋势(图1)。gydF4y2Ba8gydF4y2Bac和d)。与对照相比,GA增加了节点数和节点间长度,而PAC减少了节点数和节点间长度。这些结果表明GA在植物发育中具有重要作用。gydF4y2Ba
GA生物合成基因对外源处理的响应gydF4y2Ba
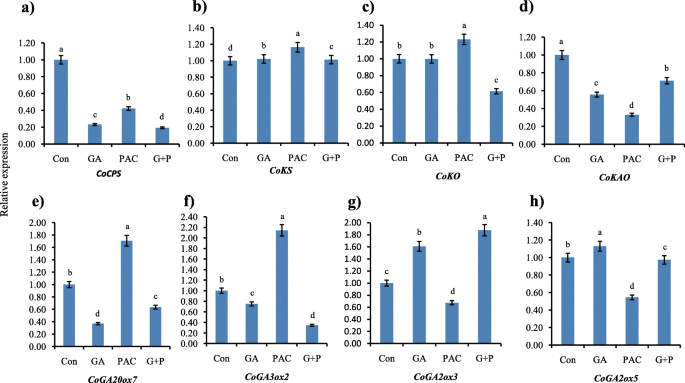
采用蒸馏水(con)、GA、PAC和G + P处理30日龄黄麻植株,研究GA代谢途径基因对外源喷雾的反应。本实验仅采集顶部节间作为RNA样本进行qRT-PCR分析。gydF4y2BaCoCPSgydF4y2Ba而且gydF4y2BaCoKAOgydF4y2Ba被抑制,gydF4y2Ba科钦gydF4y2Ba与对照组相比,在所有处理中都略有上调。gydF4y2BaCoKOgydF4y2Ba在GA处理的样品中保持不变,而在PAC处理中上调,在G + P处理中下调(图1)。gydF4y2Ba9gydF4y2Ba模拟)。gydF4y2Ba
GA、PAC和G + P对GA生物合成相关基因表达的影响。早期步骤基因的折叠变化(gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba),gydF4y2BaCoGA20ox7gydF4y2Ba(gydF4y2BaegydF4y2Ba),gydF4y2BaCoGA3ox2gydF4y2Ba(gydF4y2BafgydF4y2Ba),gydF4y2BaCoGA2氧化酶类gydF4y2Ba(gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2Ba).采用定量RT-PCR法进行表达分析,相对表达量用2gydF4y2Ba——ΔΔCgydF4y2BaT方法。正常化是针对gydF4y2BaGAPDHgydF4y2Ba基因。水处理组织的表达水平作为对照。每个基因的CT值是三个生物重复和三个技术重复的平均值。根据LSD测试,在每个观察的列后面跟着不同的字母是显著不同的gydF4y2BaPgydF4y2Ba≤0.05。竖线表示标准误差gydF4y2Ba
基于空间表达分析,gydF4y2BaCoGA20ox7、CoGA3ox2 CoGA2ox3gydF4y2Ba,gydF4y2BaCoGA2ox5gydF4y2Ba检测它们对GA、PAC和G + P处理的反应。gydF4y2BaCoGA20ox7gydF4y2BaGA和G + P分别下调0.63倍和1.07倍,而PAC处理显著上调1.3倍。的表达水平gydF4y2BaCoGA3ox2gydF4y2Ba与对照相比,GA、G + P和PAC处理的表达量分别下调0.25和1.7倍,上调1.3倍(图1)。gydF4y2Ba9gydF4y2Bae-f)。与此相反,GA和G + P喷施能提高gydF4y2BaCoGA2ox3, CoGA2ox5gydF4y2Ba而PAC喷雾则降低了其表达水平(图。gydF4y2Ba9gydF4y2Bag-h)。总的来说,GA处理的表达变化低于PAC和G + P。gydF4y2Ba
讨论gydF4y2Ba
基因鉴定,系统发育关系,基序分析,基因结构gydF4y2Ba
早期步骤酶gydF4y2Ba
黄麻GA代谢途径早期参与的酶由单基因编码。这一发现与之前的研究完全一致,之前的研究认为GA代谢途径基因的早期步骤由单个或少数基因编码[gydF4y2Ba13gydF4y2Ba].例如,gydF4y2Ba拟南芥gydF4y2Ba有一份gydF4y2BaCPS, KSgydF4y2Ba,gydF4y2BaKOgydF4y2Ba还有两份gydF4y2Ba花王gydF4y2Ba基因(gydF4y2Ba43gydF4y2Ba].从系统发育关系和基因结构分析发现黄麻与黄麻的关系更为密切gydF4y2Ba拟南芥gydF4y2Ba而不是米饭和香蕉。gydF4y2Ba3.gydF4y2BaA)证明早期的步进酶可以分为单子代酶和双子代酶[gydF4y2Ba17gydF4y2Ba].Plant-mPLoc亚细胞定位显示,cops、CoKS和CoKO位于叶绿体中,CoKAO位于内质网中。这一结果与以往的研究非常一致。例如:AtCPS和AtKS1在叶绿体中定位,而AtKO留在叶绿体的外包膜中,AtKAO1和AtKAO2在内质网中定位[gydF4y2Ba44gydF4y2Ba].gydF4y2Ba
之后的步骤酶gydF4y2Ba
我们在黄麻中鉴定了3种GA氧化酶的18个候选基因。其中,黄麻含有7种GA20氧化酶,3种GA3氧化酶,8种GA2氧化酶gydF4y2Ba拟南芥gydF4y2Ba含有5种GA20氧化酶,4种GA3氧化酶和7种GA2氧化酶。水稻基因组中GA20ox、GA30x和GA2ox分别有8、2和11个拷贝。因此,GA20ox和GA2ox的基因数量更多,这证明了这两个类群的进化路线更加动态。这也导致了进化过程中选择压力的放松或约束的放松。另一方面,GA3ox的基因数量较少,这意味着该家族比GA20ox和GA2ox更加保守[gydF4y2Ba17gydF4y2Ba].gydF4y2Ba
GA氧化酶的系统发育分析表明,它们被分为4个不同的亚群(GA20ox, GA3ox, C-19 GA2ox和C-20 GA2ox)。这个结果与gydF4y2Ba拟南芥gydF4y2Ba、水稻、玉米和大豆[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].对所有子组的独特主题的识别进一步证明了分类的合理性。在每个亚组中,我们观察到来自同一物种的GA氧化酶的亲缘关系比来自其他物种的GA氧化酶的亲缘关系更密切,这最终意味着GA氧化酶的扩展发生在该蛋白质家族的进化早期。gydF4y2Ba
虽然GAox家族蛋白的催化结构域很保守,但黄麻内部不同亚家族的基因结构存在差异。与亚家族中亲缘关系更密切的成员在基因结构上更相似,这表明GAox家族具有选择性多样化。黄麻的GAox亚科大多含有3个外显子。这也强调了选择性多样化。黄麻GAox家族的一些成员具有相对较长的内含子。这些内含子可能是从不平等的交叉进化而来的[gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
外源处理的形态效应gydF4y2Ba
GA处理的黄麻植株较高,而PAC处理的黄麻植株较矮。这一发现与其他纤维作物类似,如大麻[gydF4y2Ba46gydF4y2Ba和亚麻[gydF4y2Ba47gydF4y2Ba].同样,GA也会增加节点数和节点间长度。这些观察结果证明GA通过增加节间的数量和长度来影响营养茎的生长。GA通过诱导参与这些过程的基因的转录引起细胞伸长和分裂的增加。举个例子,在水稻和gydF4y2Ba拟南芥gydF4y2Ba,一些编码木糖葡聚糖内转糖基化酶(XETs)和扩展蛋白的基因被GA上调[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].XET负责细胞壁的可塑性,而扩展蛋白则参与植物细胞壁的松动。一些编码周期蛋白依赖性蛋白激酶的基因在GA处理后也在水稻的茎间分生组织中异位表达[gydF4y2Ba51gydF4y2Ba].而在G + P处理下,株高适中,说明PAC主要通过减少GA的生物合成抑制植株生长,部分受GA的拯救。gydF4y2Ba
GA代谢基因的组织特异性及其对外源处理的响应gydF4y2Ba
黄麻GA生物合成基因表现出明显的组织特异性,与许多其他植物相似[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].然而,大多数的gydF4y2BaGA氧化酶类gydF4y2Ba黄麻基因不参与GA的生物合成。例如,在五个人之间gydF4y2BaGA20氧化酶类gydF4y2Ba黄麻只有两种(gydF4y2BaCoGA20ox2gydF4y2Ba而且gydF4y2BaCoGA20ox7gydF4y2Ba)表示。这一结果最终证明了GA氧化酶的冗余功能[gydF4y2Ba16gydF4y2Ba].有趣的是,对这些基因的启动子分析显示,大多数表达的基因包含一个特定的gydF4y2Ba独联体gydF4y2Bap-box(附加文件gydF4y2Ba2gydF4y2Ba:图S5)。因此,p-box可能在调控gydF4y2BaGA氧化酶类gydF4y2Ba.顶端节间是最活跃的组织,GA代谢途径的大部分基因在此表达量最高。这些结果表明了GA生物合成在组织和器官水平上的调控作用,也揭示了GA的定位gydF4y2BaCoGA2ox3gydF4y2Ba而且gydF4y2BaCoGA2ox5gydF4y2Ba在器官内的表达影响GA的内稳态和水平,从而影响生长。一般来说,生长中的器官,如发育中的叶子,膨大的节间,含有最多的生物活性GA [gydF4y2Ba52gydF4y2Ba,这些器官有高水平的ga生物合成基因表达[gydF4y2Ba53gydF4y2Ba].因此,为了检验外源GA、PAC和G + P处理的效果,仅从顶节间采集样品。在这个实验中,gydF4y2BaCoGA20ox7gydF4y2Ba,gydF4y2BaCoGA3ox2gydF4y2Ba在GA处理中表达下调,而在PAC处理样品中表达相反。植物有自己的内稳态系统,通过一种反馈调节机制,保持最佳的GA水平,以继续其自然生长和发育[gydF4y2Ba54gydF4y2Ba].外源赤霉素处理植株后,内源赤霉素的数量增加gydF4y2BaCoGA20ox7gydF4y2Ba,gydF4y2BaCoGA3ox2gydF4y2Ba降低它们的表达来降低GA的合成。同样,PAC处理的植物内源GA含量较低,因为PAC抑制GA合成。作为一个结果,gydF4y2BaCoGA20ox7, CoGA3ox2gydF4y2Ba增加了它们的表达以减少PAC的影响。另一方面,gydF4y2BaCoGA2ox3, CoGA2ox5gydF4y2Ba对活性GA失活负责的基因,则表现出相反的表达模式。这是由于另一种名为GA2ox基因前馈调节的内稳态机制[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].总的来说,上调和下调GA对基因表达的影响均弱于PAC,这最终说明在对照条件下黄麻的顶节间GA水平最优。根据Acheampong等人。[gydF4y2Ba55gydF4y2Ba当特定器官生长所需的GA含量最低时,它对PAC的反应高,对GA的变化最小。在G + P处理中,植物先用PAC处理,即GA含量较低。而在GA治疗2 d后,PAC的影响最小。因此,在这些样品中,基因表达变化与GA处理样品相似,但高于GA处理样品。对于早期步骤基因,我们没有得到任何反馈调控。事实上,这已经被证明,早期步骤基因不受反馈调节[gydF4y2Ba23gydF4y2Ba].而这些基因在GA、PAC和G + P处理后转录水平发生变化。这一现象很难解释,因为其中的两种cops和CoKS与(E,E)-4,8,12-三甲基三甲-1,3,7,11-四烯(TMTT)生物合成途径相互作用[gydF4y2Ba56gydF4y2Ba].此外,PAC与KO竞争抑制GA的生物合成[gydF4y2Ba57gydF4y2Ba].因此,产生这种现象的原因还需要实验证明。gydF4y2Ba
尽管黄麻gydF4y2BaGA氧化酶类gydF4y2Ba基因改变表达以维持黄麻体内GA的平衡,但在持续喷洒GA后,我们仍然得到不同的形态,如植株高度和节间长度增加,这也是胡萝卜的常见现象[gydF4y2Ba58gydF4y2Ba和苹果[gydF4y2Ba59gydF4y2Ba].实际上,每10天用GA和PAC处理黄麻会改变黄麻内源GA水平,改变激素稳态,从而影响植株生长。gydF4y2Ba
结论gydF4y2Ba
在本研究中,我们确定了黄麻中7种参与GA代谢的酶的22个候选基因,并将其分为cops、CoKS、CoKO、CoKAO、CoGA20ox、CoGA3ox和CoGA2ox 7个基因家族。系统发育分析、基序分布模式和基因结构研究表明黄麻GA代谢基因具有保守性和发散性。此外,通过空间表达分析,我们证实了它们的组织特异性,发现顶部节间是GA代谢基因最活跃的区域,大多数GA代谢基因在该区域有较高的表达。我们还发现,只有后面的步骤基因是反馈调节的。结合这些结果,我们最终确定了四个关键的调控基因。对遗传因子生物合成基因的综合分析将为黄麻和其他具有重要农业意义的近缘植物的遗传改良奠定基础。gydF4y2Ba
方法gydF4y2Ba
序列获取,对齐,和系统发生树的构建gydF4y2Ba
所有参与GA生物合成的序列都是从TAIR (thegydF4y2Ba拟南芥gydF4y2Ba信息资源,gydF4y2Bahttp://www.Arabidopsis.orggydF4y2Ba)、水稻基因组注释计划数据库(gydF4y2Bahttp://www.rice.plantbiology.msu.edu/gydF4y2Ba)、香蕉基因组中心(gydF4y2Bahttp://banana-genome.cirad.fr/blastgydF4y2Ba)及NCBI (gydF4y2Bahttp://www.ncbi.nlm.nih.gov/gydF4y2Ba).为了鉴定这些基因在黄麻中的同源性,对黄麻进行了BLAST search (BLASTP)gydF4y2BaCorchorus olitoriusgydF4y2Ba品种:O-4基因组(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/bioproject/215141gydF4y2Ba).从期望阈值低于1e-30的BLAST中接受序列。所有的序列都列在附加文件中gydF4y2Ba1gydF4y2BaS1:表。Expasy ProtParam工具(gydF4y2Bahttp://web.expasy.org/protparam/gydF4y2Ba)用于测定分子量、理论pI等理化性质。通过Plant-mPLoc (gydF4y2Bahttp://www.csbio.sjtu.edu.cn/bioinf/plant-multi/gydF4y2Ba).的多序列对齐gydF4y2Ba拟南芥gydF4y2Ba、水稻、香蕉和黄麻的研究采用Clustal Omega工具(gydF4y2Bahttp://www.ebi.ac.uk/Tools/msa/clustalo/gydF4y2Ba).使用带有泊松校正、成对删除和1000个自举复制参数的邻域连接(NJ)方法生成无根系统发生树,使用MEGA version 7 [gydF4y2Ba60gydF4y2Ba].gydF4y2Ba
域、基序、基因结构和三维结构的确定gydF4y2Ba
预测黄麻GA代谢基因的蛋白序列经Pfam (gydF4y2Bahttp://pfam.sanger.ac.uk/searchgydF4y2Ba)和SMART (gydF4y2Bahttp://smart.emblheidelberg.de/gydF4y2Ba)数据库,以识别它们的保守域。为了获得它们的特征基序,采用了多期望最大化基序诱导(multiexpectation Maximization for motif Elicitation, http://meme-suite.org/),参数为:最大基序个数设置为20,最优基序宽度设置为6-50个氨基酸,模型每个序列中有0或1个单个基序。系统发育树连同通用特征格式版本3 (GFF3)的注释文件被制备,用于基因结构显示服务器(GSDS) 2.0 (gydF4y2Bahttp://gsds.cbi.pku.edu.cn/gydF4y2Ba)来确定内含子-外显子结构。系统发生树、保守基序和基因结构通过可缩放向量图形编辑器Inkscape 0.92.4 (gydF4y2Bahttps://inkscape.org/gydF4y2Ba).含铁的三维结构gydF4y2Ba+ 2gydF4y2Ba通过名为I-TASSER(迭代线程装配优化)的在线工具预测绑定位点(gydF4y2Bahttp://zhanglab.ccmb.med.umich.edu/I-TASSER/gydF4y2Ba).gydF4y2Ba
启动子分析与基因本体注释gydF4y2Ba
对于启动子分析,从转录起始位点上游1000 bp处提取gydF4y2BaCorchorus olitoriusgydF4y2Ba使用自定义Perl脚本。这些假定的gydF4y2Ba独联体gydF4y2Ba-作用元素通过名为PlantCare (gydF4y2Bahttp://bioinformatics.psb.ugent.be/webtools/plantcare/html/gydF4y2Ba).基因本体分析采用Blast2GO (gydF4y2Bahttps://www.blast2go.com/gydF4y2Ba).根据与默认参数的序列相似性,分别得到生物过程和分子功能这两个主要类别的GO术语。gydF4y2Ba
染色体定位与复制分析gydF4y2Ba
用示意图表示了赤霉素生物合成基因在黄麻不同染色体上的分布。一般来说,在100 kb区域内具有70%以上同一性且被其他不超过5个基因分离的蛋白质被认为是串联复制[gydF4y2Ba61gydF4y2Ba].同样地,由5个以上基因分离的基因被认为是分段复制。gydF4y2Ba
ka/ks比值的测定gydF4y2Ba
利用Clustal Omega程序对重复基因对的氨基酸序列进行比对。Ka(每个非同义替换点的非同义替换次数)和Ks(每个同义替换点的同义替换次数)比值由PAL2NAL (gydF4y2Bahttp://www.bork.embl.de/pal2nal/gydF4y2Ba)通过PAML的codeml程序。一般Ka/Ks = 1表示中性选择;Ka/Ks < 1为净化选择;Ka/Ks > 1表示加速进化与正选择[gydF4y2Ba62gydF4y2Ba].散度时间t的估计公式为“t = Ks/2r”,其中r = 1.5 × 10gydF4y2Ba−8gydF4y2Ba根据伊斯兰等人的说法。gydF4y2Ba41gydF4y2Ba].gydF4y2Ba
植物材料gydF4y2Ba
Tossa黄麻(gydF4y2Bac . olitoriusgydF4y2Ba简历。O-4)用于本实验的形态和分子分析。种子采自孟加拉国黄麻研究所基因库,收录号为1808。在BARJ温室中,光照16 h,光照8 h,温度32°C, 36个(30 × 30 cm)陶罐,每罐4粒种子。用蛭石和有机土(1:1)混合制备的陶罐。其中12罐用于形态数据采集,12罐用于空间表达分析,其余用于GA、PAC和G + P喷雾效果检验。盆栽在温室对照环境中保存至试验结束。gydF4y2Ba
GA、PAC、G + P处理gydF4y2Ba
GA (LOBA Chemie)和多效唑(PAC)- GA (Sigma-Aldrich,德国)溶液的抑制剂在100ppm蒸馏水和0.1%间20(润湿剂)中制备。在G + P喷施的情况下,在GA喷施2 d前先喷施PAC,采用G + P联合处理验证GA与PAC的效应关系。gydF4y2Ba
形态数据收集gydF4y2Ba
在30日龄时,用低压手棒喷雾器分别向植株喷洒浓度为100 ppm的20种配制GA、PAC和G + P溶液。喷雾过程中湿度保持在60%,温度保持在25-27℃。对照植株用含0.1%吐温20的蒸馏水处理。从株龄30天到90天,每隔10天进行一次喷施。在60 d龄(第4次喷施)和90 d龄(第7次喷施),用米尺测量所有处理和对照的株高。用植株总长度除以总节点数来确定节间长度。gydF4y2Ba
RNA样本集合gydF4y2Ba
为了进行空间基因表达分析,收集了40日龄植物的根、叶(第5叶)、树皮和枝条(距顶部9 cm)、顶部节间(莲座丛至第5叶-约5.5 cm)样本。为检验外源喷施效果,以100 ppm的GA、PAC和G + P喷施12 h后,采集叶顶节间(莲座丛至第5叶)作为RNA样品。所有取样的器官立即在温室液氮中冷冻,保存在−80°C。gydF4y2Ba
RNA分离和cDNA制备gydF4y2Ba
为了分离RNA,每个样品在液氮中用研钵和杵碾碎成细粉。最后,采用Ahmed等人提到的改进的CTAB方法提取RNA。[gydF4y2Ba63gydF4y2Ba].RNA质量检测采用1%凝胶电泳,然后用NanoDrop 2000分光光度计定量(NanoDrop, ThermoFisher Scientific, USA)。所有RNA样本均用扩增级DNase I (Sigma-Aldrich, Germany)处理,以避免DNA污染。之后,根据制造商的说明,使用RevertAid第一链cDNA合成试剂盒(Thermo Fisher Scientific, USA)制备第一链互补DNA (cDNA)。随后,样品与RNase H (Thermo Fisher Scientific, USA)孵育,根据制造商的说明降解任何RNA - dna杂交体的RNA链,并在−20°C保存直到使用。gydF4y2Ba
引物设计与反转录实时定量PCR (qRT-PCR)gydF4y2Ba
特异性qRT-PCR引物通过在线工具IDT (gydF4y2Bahttps://sg.idtdna.com/pages/tools/primerquestgydF4y2Ba)和Genscript (gydF4y2Bawww.genscript.comgydF4y2Ba)为除CoGA20ox3、CoGA20ox4、CoGA20ox5和CoGA20ox6外所有参与GA生物合成途径的基因。由于这四个序列的CDS区几乎有80-85%的相似性,因此只设计了一个引物。所有引物见附加文件gydF4y2Ba1gydF4y2Ba:表S5。之后,使用PowerUp™SYBER™Green Master Mix(美国赛默飞世尔科学公司)进行qRT-PCR,并保持制造商协议。总反应液为20 μl,每个反应含cDNA 40 ng。实验在Quantstudio 5(应用生物系统)的96孔板中进行,条件为50℃2分钟,95℃2分钟,95℃15秒,60℃1分钟,45个循环。所有的qRT-PCR反应有3个生物复制和3个技术复制,阴性对照(无模板)。熔解曲线也被生成来检查引物的特异性。gydF4y2Ba
qRT-PCR数据用2-进行分析gydF4y2BaΔΔCgydF4y2BaT方法(gydF4y2Ba64gydF4y2Ba].用内参基因归一化后的结果表示为倍变。虽然管家基因通常被用作归一化的内参基因,但根据组织、环境条件和物种的不同,管家基因也可能发生显著变化。根据侯赛因等人。[gydF4y2Ba32gydF4y2Ba蛋白磷酸酶2A催化亚基(gydF4y2BaPP2AcgydF4y2Ba)基因作为内参基因在不同组织中的表达分析。但观察GA、PAC和G + P处理对GA生物合成基因表达的影响,黄麻未见此研究。因此,我们进行了一项实验,以寻找不受GA调控(数据未显示)且在不同处理样品中更稳定的管家基因,并发现甘油醛3-磷酸脱氢酶(gydF4y2BaGAPDHgydF4y2Ba)作为你想要的。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持完整协议的结论和描述的数据集可以在手稿及其附加文件中找到。在当前研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- 遗传算法:gydF4y2Ba
-
赤霉素gydF4y2Ba
- CPS:gydF4y2Ba
-
entgydF4y2Ba-copalyl二磷酸合酶gydF4y2Ba
- 花王:gydF4y2Ba
-
entgydF4y2Ba-kaurenoic酸氧化酶gydF4y2Ba
- 柯:gydF4y2Ba
-
entgydF4y2Ba-kaurene氧化酶gydF4y2Ba
- KS:gydF4y2Ba
-
entgydF4y2Ba-kaurene合酶gydF4y2Ba
- GA20ox:gydF4y2Ba
-
GA20oxidasegydF4y2Ba
- GA2ox:gydF4y2Ba
-
GA2-oxidasegydF4y2Ba
- GA3ox:gydF4y2Ba
-
GA3-oxidasegydF4y2Ba
- GGDP:gydF4y2Ba
-
Geranylgeranyl二磷酸gydF4y2Ba
- 支持:gydF4y2Ba
-
萜烯synthasesegydF4y2Ba
- XET:gydF4y2Ba
-
Xyloglucan endotransglycosylasesgydF4y2Ba
- NCBI:gydF4y2Ba
-
国家生物技术信息中心gydF4y2Ba
- 存在:gydF4y2Ba
-
定量实时聚合酶链反应gydF4y2Ba
- PAC:gydF4y2Ba
-
摘要gydF4y2Ba
- CTAB:gydF4y2Ba
-
Cetyltrimethylammonium溴化gydF4y2Ba
- 2奇怪:gydF4y2Ba
-
2-oxoglutarate-dependent加双氧酶gydF4y2Ba
- PP2Ac:gydF4y2Ba
-
蛋白磷酸酶2A的催化亚基gydF4y2Ba
- GAPDH:gydF4y2Ba
-
甘油醛3磷酸脱氢酶gydF4y2Ba
- TMTT:gydF4y2Ba
-
(E, E) 4 8 12-trimethyltrideca-1, 3、7 11-tetraenegydF4y2Ba
参考文献gydF4y2Ba
Tyler L, Thomas SG, Hu J, Dill A, Alonso JM, Ecker JR等。DELLA蛋白和赤霉素调控拟南芥种子萌发和花发育。植物杂志。2004;135(2):1008。gydF4y2Ba
Ayele BT, Ozga JA, Kurepin LV, Reinecke DM.发育轴和胚轴对豌豆萌发和幼苗生长过程中赤霉素生物合成的调控。植物杂志。2006;142(3):1267 - 81。gydF4y2Ba
朱提拉O, Jensen E, Pearce D, Pharis R.赤霉素GA3对柳芽伸长的刺激作用活性似乎依赖于通过GA3羟基化到GA1。杂志。2006;84:113-20。gydF4y2Ba
Hedden P, Proebsting WM。赤霉素生物合成的遗传分析。植物杂志。1999;119(2):365。gydF4y2Ba
Blázquez MA, Green R, Nilsson O, Sussman MR, Weigel D.赤霉素通过激活叶子启动子促进拟南芥开花。植物细胞。1998;10(5):791。gydF4y2Ba
赛拉尼,Sanjuán R,欧瑞兹-里弗罗,富M, García-Martínez JL。赤霉素对番茄坐果和生长的调控作用。植物杂志。2007;145(1):246。gydF4y2Ba
2014年统计公报。罗马:联合国粮食及农业组织;2014.gydF4y2Ba
赤霉素在维管植物、真菌和细菌中的发生。植物生长学报,2001;20(4):387-442。gydF4y2Ba
杨建平,孙建平,郭伯乐,等。赤霉素信号转导:生物合成、分解代谢及其反应途径。植物细胞。2002;14(增刊):s61 - 80。gydF4y2Ba
坂本T,三浦K,伊藤H, Tatsumi T,上口-田中M,石山K,等。水稻赤霉素代谢酶基因及其相关突变体的研究进展。植物杂志。2004;134(4):1642。gydF4y2Ba
黄燕,王旭,葛松,饶国勇。植物赤霉素氧化酶基因的分化与适应性进化。中国生物医学杂志2015;15:207。gydF4y2Ba
拟南芥赤霉素的生物合成。Phytochem启2006;5:39-47。gydF4y2Ba
赤霉素生物合成。威利:奇切斯特;2012.gydF4y2Bahttps://doi.org/10.1002/9780470015902.a0023720gydF4y2Ba.gydF4y2Ba
Grennan正义与发展党。水稻赤霉素代谢酶。植物杂志。2006;141(2):524 - 6。gydF4y2Ba
Phillips AL, Ward DA, Uknes S, Appleford NEJ, Lange T, Huttly AK,等。拟南芥中3个赤霉素20-氧化酶cDNA克隆的分离与表达。植物杂志。1995;108(3):1049。gydF4y2Ba
张志强,张志强,张志强,等。两种赤霉素3-氧化酶在拟南芥发育中的作用不同且重叠。植物j . 2006; 45(5): 804 - 18。gydF4y2Ba
陈娟,谢娟,段勇,胡红,胡勇,李伟。通过全基因组鉴定和表达谱分析,揭示了在威廉姆斯香蕉及其矮化突变体中参与赤霉素代谢的组织特异性表达和差异调控基因。植物生物学杂志,2016;16(1):123。gydF4y2Ba
Xu YL, Li L, Gage DA, Zeevaart JA。拟南芥GA5表达反馈调控与赤霉素水平代谢工程植物细胞。1999;11(5):927 - 36。gydF4y2Ba
马铃薯赤霉素20-氧化酶转录水平的反馈控制与日调节。植物杂志。1999;119(2):765。gydF4y2Ba
赤霉素2-氧化酶(参与赤霉素失活的多功能酶)的分子克隆及功能表达。中国科学(d辑:自然科学版)1999;32(4):369 - 369。gydF4y2Ba
艾略特RC。豌豆赤霉素失活的前馈调控。植物生长学报,2001;20(1):87-94。gydF4y2Ba
Rieu I, Eriksson S, Powers SJ, Gong F, Griffiths J, Woolley L,等。遗传分析表明,C19-GA 2氧化是拟南芥赤霉素失活的主要途径。植物细胞。2008;20(9):2420 - 36。gydF4y2Ba
Helliwell CA, Sheldon CC, Olive MR, Walker AR, Zeevaart JA, Peacock WJ等。拟南芥-kaurene氧化酶基因GA3的克隆。中国科学(d辑:自然科学版)1998;gydF4y2Ba
Oikawa T, Koshioka M, Kojima K, Yoshida H, Kawata M.编码赤霉素20-氧化酶亚型的OsGA20ox1在水稻植株身高调控中的作用。植物分子生物学,2004;55(5):687-700。gydF4y2Ba
Fleet CM,山口S,花田A, Kawaide H, David CJ,神谷Y,等。AtCPS和AtKS在拟南芥中过表达可增加t-kaurene的产量,但没有增加生物活性赤霉素。植物杂志。2003;132(2):830 - 9。gydF4y2Ba
Coles JP, Phillips AL, Croker SJ, Garcia-Lepe R, Lewis MJ, Hedden P.赤霉素20氧化酶基因义和反义表达对拟南芥赤霉素产生和植株发育的影响。植物j . 1999; 17(5): 547 - 56。gydF4y2Ba
黄s, Raman AS, Ream JE,藤原H, Cerny RE, Brown SM。20-氧化酶的过表达在拟南芥中产生了赤霉素生产过剩的表型。植物杂志。1998;118(3):773 - 81。gydF4y2Ba
g20 -氧化酶基因表达变化对马铃薯茎长、块茎诱导和块茎产量有显著影响。植物j . 2000; 22(3): 247 - 56。gydF4y2Ba
黄晓明,张晓明,张晓明,等。转基因烟草中赤霉素代谢变化对生物量积累、木质素生物合成和光合作用的影响。植物杂志。2004;135(1):254 - 65。gydF4y2Ba
胡亚烨,陶亚波,徐泽发。过表达麻疯树赤霉素2-氧化酶6 (JcGA2ox6)可导致拟南芥和麻疯树的矮化和叶片、花和果实变小。植物科学进展2017;8:2103。gydF4y2Ba
Basra A.农业和园艺中的植物生长调节剂:它们的作用和商业用途。纽约:食品出版社;2000.gydF4y2Ba
Hossain MS, Ahmed R, Haque MS, Alam MM, Islam MS.黄麻实时定量RT-PCR分析内参基因的鉴定与验证。分子生物学杂志2019;20(1):13。gydF4y2Ba
珠宝MRJ。金色的梦换金色的纤维。在:每日太阳报;2016.gydF4y2Ba
恒我。赤霉素对部分韧皮部纤维细胞宽度和细胞壁的影响。安机器人。1963;27(1):185 - 96。gydF4y2Ba
恒我。赤霉素对纤维细胞长度的影响。安机器人。1961;25(4):453 - 62。gydF4y2Ba
Lange T, Kappler J, Fischer A, Frisse A, Padeffke T, Schmidtke S,等。南瓜幼苗发育过程中赤霉素的生物合成。植物杂志。2005;139(1):213。gydF4y2Ba
Davidson SE, Swain SM, Reid JB。豌豆早期GA生物合成途径的调控。足底。2005;222(6):1010 - 9。gydF4y2Ba
宋军,郭斌,宋峰,彭辉,姚勇,张勇,等。玉米种子萌发过程中赤霉素代谢酶基因的全基因组鉴定及表达谱分析。基因。2011;482(1 - 2):34-42。gydF4y2Ba
杜强,李晨,李东,陆森。通过对丹参中赤霉素代谢相关基因的全基因组分析、分子克隆和表达谱分析,发现了组织特异性表达、反馈调节、胁迫响应和交替拼接的新基因。BMC基因组学。2015;16:1087。gydF4y2Ba
杨晓燕,王晓燕,王晓燕,等。沉默ga2氧化酶对植物生长和纤维生成的影响。植物生态学报。2010;8(4):425-35。gydF4y2Ba
Islam MS, Saito JA, Emdad EM, Ahmed B, Islam MM, Halim A,等。两种黄麻的比较基因组学和纤维生物发生的洞察。Nat植物。2017;3(2):16223。gydF4y2Ba
罗奇PL, Clifton IJ, Fulop V, Harlos K, Barton GJ, Hajdu J,等。异戊西林N合酶的晶体结构是一个新的酶结构家族中的第一个。大自然。1995;375(6533):700 - 4。gydF4y2Ba
小川M,花田A,山内Y, Kuwahara A,神谷Y,山口S.拟南芥种子萌发过程中赤霉素的生物合成及其响应。植物细胞。2003;15(7):1591。gydF4y2Ba
海利韦尔CA,沙利文JA,模具RM,格雷JC,孔雀WJ,丹尼斯ES。拟南芥-kaurene氧化酶的质体包膜定位连接了赤霉素生物合成途径的质体和内质网步骤。植物j . 2001; 28(2): 201 - 8。gydF4y2Ba
韩飞,朱斌。水稻、拟南芥和大豆三个赤霉素氧化酶基因的进化分析。基因。2011;473(1):23-35。gydF4y2Ba
阿塔尔•CK。赤霉素对大麻纤维的影响。经济学机器人。1961;15(2):133 - 9。gydF4y2Ba
Rastogi DA, Siddiqui A, Mishra B, Srivastava M, Pandey R, Misra P,等。生长素和赤霉素对亚麻籽生长和产量组成的影响(gydF4y2Ba亚麻属植物usitatissimumgydF4y2Bal .)。作物育种应用学报2013;13:136-43。gydF4y2Ba
膨胀蛋白基因的表达与深水水稻的生长有关。植物细胞。1997;9:1661 - 71。gydF4y2Ba
Uozu S, Tanaka-Ueguchi M, Kitano H, Hattori K, Matsuoka M.水稻xet相关基因的鉴定。植物杂志。2000;122:853-9。gydF4y2Ba
徐伟,王晓燕,王晓燕。拟南芥xet相关基因家族:环境和激素对表达的调控。植物j . 1996; 9:879 - 89。gydF4y2Ba
植物细胞周期基因cycA1;1和cdc2s -3受赤霉素协同调控。足底。2000;211:376 - 83。gydF4y2Ba
王晓燕,王晓燕,王晓燕,等。赤霉素在大豆营养组织中的分布。大豆叶片突变的生物学和生物化学效应。植物杂志。1992;99:368 - 71。gydF4y2Ba
Silverstone AL, Chang C, Krol E,孙TP。赤霉素生物合成基因GA1的发育调控gydF4y2Ba拟南芥gydF4y2Ba.植物j . 1997; 12(1): 9-19。gydF4y2Ba
Thomas SG, Rieu I, Steber CM。赤霉素代谢与信号转导。Vitam霍恩。2005;72:289 - 338。gydF4y2Ba
akacheampong AK, Hu J, Rotman A,郑C, Halaly T, Takebayashi Y,等。葡萄中赤霉素信号元件的功能表征和发育表达谱分析。中国科学(d辑:自然科学版)2015;gydF4y2Ba
马艳,袁亮,吴斌,李旭,陈松,陆松。丹参萜类生物合成新基因的全基因组鉴定与鉴定。J Exp Bot 2012; 63:2809-23。gydF4y2Ba
赤霉素生物合成抑制剂:在农业和园艺中的应用。:赤霉素。纽约:施普林格纽约;1991.p . 296 - 310。gydF4y2Ba
王桂林,阙峰,徐志生,王峰,熊爱斯。外源赤霉素改变了胡萝卜根和茎的形态、解剖和转录调控网络。BMC Plant Biol. 2015;15:290。gydF4y2Ba
张松,张丹,范松,杜磊,沈勇,邢磊,等。外源GA3及其抑制剂多效唑对富士苹果花形成、内源激素和开花相关基因的影响(gydF4y2Ba马吕斯有明显gydF4y2BaBorkh)。植物生理生物化学,2016;107:178-86。gydF4y2Ba
Kumar S, Stecher G, Tamura K. MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。Mol Biol evl 2016;33(7): 1870-4。gydF4y2Ba
舒燕,刘颖,张娟,宋玲,郭晨。植物AP2/ERF超家族基因的全基因组分析及其对非生物胁迫的响应gydF4y2BaMedicago truncatulagydF4y2Ba.植物科学进展2015;6:1247。gydF4y2Ba
Ka/Ks比值:诊断序列演化的形式。趋势麝猫。2002;18(9):486。gydF4y2Ba
Ahmed R, Hossain MS, Haque M, Alam M, Islam MS.适合NGS数据生成和实时定量RT-PCR的田间黄麻不同部位RNA分离改进方案。生物技术学报2019;18:647-58。gydF4y2Ba
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C (T))方法分析相关基因表达数据。方法。2001;25(4):402 - 8。gydF4y2Ba
确认gydF4y2Ba
作者感谢黄麻基础与应用研究项目所有研究人员的合作,特别感谢Rasel Ahmed和Md. Sabbir Hossain的热情支持。gydF4y2Ba
资金gydF4y2Ba
这项研究没有得到任何正式的资助。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
UH和MSI设计了这项研究。MSH, RJ和SJ监督了实验并修改了手稿。UH和SMTK进行了生物信息学分析。UH和MRA进行实验、RNA提取、qRT-PCR并对结果进行分析。KKB进行了统计分析并审查了论文。UH、MRA和MM收集形态学数据和RNA样本进行分子分析;MSI, UH和MRA撰写并严格审查了手稿。所有作者均已阅读并认可该手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
本文所使用的GA代谢基因的加入数。gydF4y2Ba表S2。gydF4y2Ba在水稻早期步骤GA生物合成基因中观察到的模因定义基序的多层一致序列,gydF4y2Ba拟南芥gydF4y2Ba香蕉和黄麻。gydF4y2Ba表S3。gydF4y2Ba从水稻GA氧化酶中观察到的模因定义基序的多层一致序列,gydF4y2Ba拟南芥gydF4y2Ba香蕉和黄麻。gydF4y2Ba表S4。gydF4y2Ba的活动gydF4y2Ba独联体gydF4y2Ba- GA生物合成基因启动子区的作用元件。gydF4y2Ba表S5。gydF4y2Ba本研究用于qRT-PCR的内参基因和GA代谢基因引物序列。gydF4y2Ba
附加文件2:图S1。gydF4y2Ba
黄麻中GA20氧化酶的多重比对。(绿色框为GA衬底结合位点,棕色框为2-氧戊二酸盐结合基序(LPWKET),黑色框为FegydF4y2Ba2 +gydF4y2Ba结合主题)。gydF4y2Ba图S2。gydF4y2Ba黄麻中GA3氧化酶的多重比对。(黑色的盒子表示FegydF4y2Ba2 +gydF4y2Ba结合主题)。gydF4y2Ba图S3。gydF4y2Ba黄麻C-19 GA2氧化酶的多重比对。(黑色的盒子表示FegydF4y2Ba2 +gydF4y2Ba结合主题)。gydF4y2Ba图S4。gydF4y2Ba黄麻C-20 GA2氧化酶的多重比对。(黑色的盒子表示FegydF4y2Ba2 +gydF4y2Ba结合主题)。gydF4y2Ba图S5。gydF4y2Ba独联体gydF4y2Ba-作用元件存在于GA生物合成基因的启动子区。gydF4y2Ba独联体gydF4y2Ba-作用元件负责植物激素调节(a)植物生长和发育(b)生物和非生物胁迫响应(c)启动子功能(d)。从起始点开始的1000 bp上游序列被考虑。gydF4y2Ba图S6。gydF4y2Ba热图显示参与GA生物合成的基因的相对表达。样品取自4天大的幼苗、纤维细胞、抽苔前的幼苗和纤维细胞。标准化RNA-seq数据的热图是由三个生物重复从纤维细胞和整个幼苗gydF4y2Bac . olitoriusgydF4y2Ba而且gydF4y2Bac . capsularisgydF4y2Ba.通过RNA-seq分析得出的量化转录水平(每千碱基外显子模型的片段每百万映射读数,FPKM)来测定基因表达。热刻度,log2 (FPKM)。为了计算单个基因的log2 (FPKM)值,将所有原FPKM值相加,伪计数为1。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献放弃书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Honi, U., Amin, m.r., Kabir, S.M.T.gydF4y2Baet al。gydF4y2Ba黄麻赤霉素代谢基因的全基因组鉴定、鉴定及表达谱分析。gydF4y2BaBMC植物杂志gydF4y2Ba20.gydF4y2Ba306(2020)。https://doi.org/10.1186/s12870-020-02512-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02512-2gydF4y2Ba
关键字gydF4y2Ba
- 黄麻gydF4y2Ba
- 赤霉素gydF4y2Ba
- 天然纤维gydF4y2Ba
- 可生物降解的gydF4y2Ba
- 组织特异性gydF4y2Ba
- 反馈调节gydF4y2Ba